- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发布:GydF4y2Ba
促进生长和诱导抗病GydF4y2Ba花烛属植物GydF4y2Ba受益根内心细胞殖民GydF4y2BaPiriformospora籼GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba19GydF4y2Ba文章编号:GydF4y2Ba40GydF4y2Ba(GydF4y2Ba2019GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
花烛属植物andraeanumGydF4y2Ba作为一种重要的观赏花卉,从组织培养转入土壤后需要经过一段生长延迟期,这需要时间和额外的成本。此外,在这一时期,植株对细菌感染高度敏感,导致发育受损和严重损失。在这里,我们旨在解决内生真菌的应用,GydF4y2BaPiriformospora籼GydF4y2Ba保护GydF4y2BaA. Andraeanum.GydF4y2Ba在关键传播期间的根系系统,是否GydF4y2Bap .籼GydF4y2Ba通过刺激宿主对疾病的抵抗力来降低死亡率。GydF4y2Ba
结果GydF4y2Ba
我们证明GydF4y2Bap .籼GydF4y2Ba缩短恢复期GydF4y2Ba花烛属植物GydF4y2Ba,促进生长和赋予抗病性。有益效果GydF4y2Bap .籼GydF4y2Ba导致更快的延伸GydF4y2Ba花烛属植物GydF4y2Ba扎根于互动的早期。GydF4y2Bap .籼GydF4y2Ba-定殖植物吸收更多的磷,比未定殖的对照植物表现出更高的光合速率。此外,较高的胁迫相关酶活性、茉莉酸水平和茉莉酸响应基因mRNA水平表明,该真菌为植物更有效地应对潜在的威胁,包括青枯病做好准备。GydF4y2Ba
结论GydF4y2Ba
这些结果表明GydF4y2Bap .籼GydF4y2Ba这是一个有助于促进的共生关系吗GydF4y2Ba花烛属植物GydF4y2Ba生根和发展。我们所有的证据都足以支持赋予疾病的抗病GydF4y2Bap .籼GydF4y2Ba通过植物-真菌共生。此外,它还暗示GydF4y2Bap .籼GydF4y2Ba作为生物肥料在观赏植物栽培中有较强的应用潜力。GydF4y2Ba
背景GydF4y2Ba
花烛属植物andraeanumGydF4y2Ba是世界上最受欢迎的观赏花,也是销量第二的观赏花。由于它多彩的花冠和吸引人的持久的花序,它成为一种流行的切花和盆栽植物从热带到温带地区[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba].为了克服传统传播的缺点,GydF4y2Ba花烛属植物GydF4y2Ba组织培养是一个强大的工具,补充育种策略和加速GydF4y2Ba花烛属植物GydF4y2Ba发展 [GydF4y2Ba1GydF4y2Ba].然而,将幼苗移栽到土壤中往往伴随着高死亡率[GydF4y2Ba3.GydF4y2Ba,因为根系在非生物和生物胁迫下都很脆弱。因此,传播GydF4y2BaA. Andraeanum.GydF4y2Ba组培苗移栽土壤速度慢、成本高、损失大,阻碍了其商业化应用。GydF4y2BaPiriformospora籼GydF4y2Ba的GydF4y2BaSebacinalesGydF4y2Ba是一种众所周知的内生真菌,在广泛的植物物种的根皮层和表皮层定殖,包括农艺、园艺、药用作物和观赏植物[GydF4y2Ba4.GydF4y2Ba].菌丝体可以以细胞内且大多数在细胞间空间中活和繁殖。内生殖的殖民促进营养素吸收到宿主[GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba,促进增长[GydF4y2Ba7.GydF4y2Ba]及各工厂的整体表现[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].在此背景下,有人提出,殖民和增长促进由GydF4y2Bap .籼GydF4y2Ba独立于植物常见的共生基因,依赖于不同的宿主途径[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba].此外,它还刺激了对生物和非生物胁迫的抵抗力[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba11GydF4y2Ba].GydF4y2Bap .籼GydF4y2Ba提高存活率GydF4y2Ba吊兰GydF4y2Ba促进人体对磷、铜、铁和锌等基本营养物质的吸收[GydF4y2Ba12GydF4y2Ba].由于有益的根殖民机基于工作模型具有高潜力的农业应用GydF4y2Ba拟南芥GydF4y2Ba和GydF4y2BaBrasssicaGydF4y2Ba[GydF4y2Ba13GydF4y2Ba].我们建议是否GydF4y2Bap .籼GydF4y2Ba保护GydF4y2BaA. Andraeanum.GydF4y2Ba在关键繁殖时期,是否可以利用内生菌刺激寄主对疾病和其他威胁的抵抗力来降低死亡率。测定了接种后的生长性能、形态和适合度GydF4y2BaA. Andraeanum.GydF4y2Ba并将这些参数与未定殖对照进行比较。采用RT-PCR检测植物激素刺激及发病相关基因的表达。我们证明GydF4y2Bap .籼GydF4y2Ba加强幼苗在土壤中早期繁殖阶段。植株越大、越强,茉莉酸(JA)含量越高,对病原菌的抗性越强。GydF4y2Ba
方法GydF4y2Ba
植物材料和真菌培养GydF4y2Ba
花烛属植物andraeanumGydF4y2Ba简历GydF4y2Ba.GydF4y2Ba本实验使用福建省三明市农业科学院花卉研究所提供的“甜冠军”。Murashige和Skoog将约3厘米高、2 ~ 3根不定根的幼苗放入装有1/ 2ms培养基的无菌瓶中[GydF4y2Ba14GydF4y2Ba].1个月后,每个实验从瓶中取出5株幼苗,平放于含1/ 2ms培养基的培养皿中。一种直径2厘米的琼脂盘GydF4y2Bap .籼GydF4y2Ba将菌丝或不含真菌的琼脂盘(对照)放置在距离1 cm处GydF4y2Ba花烛属植物GydF4y2BaLee等人所描述的根源[GydF4y2Ba15GydF4y2Ba].接种14 d后,移栽到温室土壤盆栽中。进一步的培养遵循标准化的常规条件。的文化GydF4y2BaPiriformospora籼GydF4y2Ba本研究使用的菌株DSM11827来源于德国Braunschweig的Deutsche Sammlung für mikro有机体und Zellkulturen,注册号DSM11827。该真菌首先被Varma等鉴定为根内生真菌[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba].工作培养基在4°C条件下培养,每两个月传代至新培养基进行更新。GydF4y2Bap .籼GydF4y2Ba将菌丝(20~30 g/l)接种到幼苗根部。真菌在新鲜的固体琼脂培养基上培养,在液体卡弗培养基中培养后过滤获得用于接种的菌丝[GydF4y2Ba16GydF4y2Ba].GydF4y2Ba
根系和分子检测的显微镜观察GydF4y2Ba
确认是否GydF4y2Bap .籼GydF4y2Ba成功地与GydF4y2Ba花烛属植物GydF4y2Ba,采用显微观察和RT-PCR分析。共生后7、14、21天GydF4y2Bap .籼GydF4y2Ba那GydF4y2Ba花烛属植物GydF4y2Ba将根固定或直接用乳酚/棉蓝乙醇染色。图像采用OLYMPUS DP72(日本)显微镜拍摄。分子检测:从根中分离总RNAGydF4y2Bap .籼GydF4y2Ba使用RNeasy植物迷你试剂盒(Qiagen)控制根。反转录后,用Omniscript RT (Qiagen)和Oligo (dT) 20从1 μg总RNA中合成cDNA,反应体积为20 μl。采用PRIMER BLAST工具从NCBI (GydF4y2Bahttp://www.ncbi.nlm.nih.gov/tools/primer.GydF4y2Ba-爆炸)放大碎片GydF4y2Bap .籼稻微软GydF4y2Ba延伸因子1a的基因(登录号AJ249911.2;Pi-forward: 5 ' -TCCGTCGCGCACCATT-3 '和Pi-reverse: 5 ' -AAATCGCCCTCTTTCCACAA-3 ', 84 bp) (Bütehorn et al. 2000)。反应过程为94°C 3 min, 94°C 30 s, 58°C 30 s, 72°C 90,循环30次,72°C 7 min。PCR产物经1%琼脂糖凝胶电泳检测。GydF4y2Ba
生物量参数的测定GydF4y2Ba
定殖和未定殖的株高、根长、根、茎、叶鲜重GydF4y2Ba花烛属植物GydF4y2Ba接种后测定植物30,45和60天。叶面积GydF4y2Ba花烛属植物GydF4y2Ba采用叶面积测量仪(YMJ-B,浙江托普,中国)和SPAD-502Plus(柯尼卡美能达Sensing, INC.)测定叶绿素含量。日本)。每次实验分析10个样本。植物的形态变化对GydF4y2BaRalstonia solanacearumGydF4y2Ba和GydF4y2Bap .籼GydF4y2Ba在生长期间,殖民被仔细记录。通过显微镜观察覆盖根区域的染色菌丝网来估计定殖率。GydF4y2Ba
根生长测定GydF4y2Ba
根系活力测定采用TTC(2,3,5-三苯基四唑氯)法[GydF4y2Ba17GydF4y2Ba].用蒸馏水清洗根部,然后在滤纸上拍干。根材料(0.5 g)完全浸入含有0.4% TTC和75 mM磷酸盐缓冲液(pH 7.0)的10ml溶液中,在37℃暗隔热至1-3小时,然后加入2ml 1 M硫酸盐缓冲液停止反应。去根,表面干燥,用3-4 ml乙酸乙酯匀浆,然后用研钵和杵磨碎。将红色提取液转移到试管中,用少量乙酸乙酯洗涤残渣2~3次。将合成的乙酸乙酯相加入至10 ml,在485 nm处进行分光光度测定。用标准曲线进行标定,以定量反应中减少的四唑的量。对于每个生长阶段,进行3个重复。GydF4y2Ba
植物器官养分含量的测定GydF4y2Ba
以前发表的方法被用来测定氮,磷和钾的含量GydF4y2Ba花烛属植物GydF4y2Ba根,茎和叶子[GydF4y2Ba18GydF4y2Ba].对于养分含量的评估,共有10个独立的GydF4y2Bap .籼GydF4y2Ba-Colonized和-uncolonized.GydF4y2Ba花烛属植物GydF4y2Ba幼苗用于分别在30,45和60天内确定各种植物零件。GydF4y2Ba
抗氧化酶活性测定GydF4y2Ba
没有米子(0.1g)的叶片在2ml 50mM PBS缓冲液中均化(137mM NaCl,2.7mm Kcl,10mM磷酸钠二元酸,2mM磷酸钾,pH 7.8),含有0.2mM乙二胺四乙酸(EDTA)和1%聚乙烯吡咯烷酮(PVP)。匀浆以24,000-×离心 GGydF4y2Ba静置20 min,上清液用于酶的测定。测定超氧化物歧化酶(SOD)活性[GydF4y2Ba19GydF4y2Ba通过测量560nm处的硝基辛胂氯化物的减少。如上所述,将过氧化氢酶(CAT)活性分析[GydF4y2Ba20.GydF4y2Ba通过测量hGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba在240nm处的消耗,并通过如前所述的470nm的吸收变化测定过氧化物酶(POD)活性[GydF4y2Ba21GydF4y2Ba].GydF4y2Ba
叶片JA水平分析GydF4y2Ba
十个独立GydF4y2Ba花烛属植物GydF4y2Ba幼苗。称取2 g叶片,立即用液氮冷冻,然后用100 mM pH 7.4的PBS缓冲液2℃研磨,3000rpm离心20分钟。用植物茉莉酸(JA)酶联免疫吸附测定试剂盒(My BioSource, San Diego, CA, USA)检测茉莉酸含量。为测定病原菌对中茉莉酸含量的影响GydF4y2Ba花烛属植物GydF4y2Ba分别在接种12、24和48 h后测定植株的JA含量GydF4y2Bar . solanacearumGydF4y2Ba004.植物表面用70%的酒精消毒,然后风干。的细菌悬液GydF4y2Bar . solanacearumGydF4y2Ba004 (100 CFU/ml)注射到晚熟叶片中脉。无菌除盐水作为阴性对照。GydF4y2Ba
RT-qPCR分析基因表达GydF4y2Ba
从根组织中提取的总RNA采用了先前描述的松树幼苗的方法[GydF4y2Ba15GydF4y2Ba].互补DNA(cDNA)合成,RT-QPCR条件和基因特异性引物在表中给出GydF4y2Ba1GydF4y2Ba.表达值使用管家基因标准化GydF4y2BaGAPDHGydF4y2Ba.GydF4y2Ba
统计分析GydF4y2Ba
数据显示手段与标准误差的三个独立的生物样品。采用双向方差分析(ANOVA)评估定殖根和非定殖根之间基因表达的差异GydF4y2Ba.GydF4y2Ba采用GraphPad Prism 5.01版软件(2007)进行统计分析。在所有的图表中,误差柱表示标准差。GydF4y2Ba
结果GydF4y2Ba
植物根的殖民化GydF4y2Bap .籼GydF4y2Ba
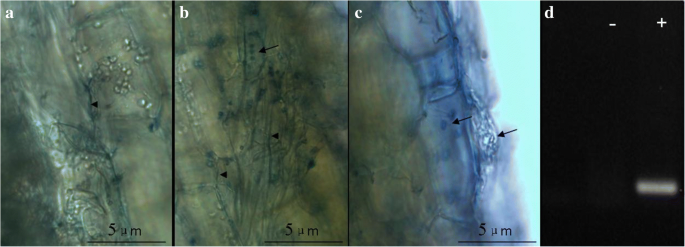
健康的GydF4y2Ba花烛属植物GydF4y2Ba接种不定根生长旺盛的幼苗GydF4y2Bap .籼GydF4y2Ba按照前面描述的方法[GydF4y2Ba15GydF4y2Ba].显微镜检查根定殖成功。接种后14天,根被广泛定植GydF4y2Bap .籼GydF4y2Ba(无花果。GydF4y2Ba1GydF4y2Ba).真菌菌丝通过根表皮细胞层并乘以皮质层;孢子在皮质层中大大存在(图。GydF4y2Ba1GydF4y2Ba).PCR分析GydF4y2BaPitefGydF4y2Ba标记基因进一步证实了根组织定殖(图。GydF4y2Ba1GydF4y2Ba).随后,殖民和控制GydF4y2Ba花烛属植物GydF4y2Ba植物从琼脂盘移到温室的花盆中。GydF4y2Ba
染色GydF4y2Bap .籼GydF4y2Ba根的菌丝和孢子GydF4y2Ba花烛属植物GydF4y2Ba幼苗接种2周。GydF4y2Ba一种GydF4y2Ba那GydF4y2BaB.GydF4y2Ba和GydF4y2BaCGydF4y2Ba:菌丝和孢子的显微观察GydF4y2Bap .籼GydF4y2Ba殖民统治的根基。GydF4y2BaD.GydF4y2Ba:显示检测到Pitef mRNAGydF4y2Bap .籼GydF4y2Ba殖民(+)但不在GydF4y2Bap .籼GydF4y2Ba-uncolonized(−)的根源。三幅图的比例尺均为5 μm。箭头表示厚垣孢子;箭头指示菌丝;Pitef:翻译延伸因子基因GydF4y2Bap .籼GydF4y2Ba
p .籼GydF4y2Ba刺激生物质生产GydF4y2Ba花烛属植物GydF4y2Ba
根和芽的大小,以及鲜重和叶面积GydF4y2Bap .籼GydF4y2Ba殖民GydF4y2Ba花烛属植物GydF4y2Ba在移栽后30、45和60 d对植株进行调查。如图所示。GydF4y2Ba2GydF4y2Ba那GydF4y2Bap .籼GydF4y2Ba促进了幼苗的生长,与未定殖的幼苗相比,分枝的数量、叶的高度和表面积以及根的长度都增加了(表2)GydF4y2Ba2GydF4y2Ba).在真菌存在的情况下,根、茎和叶的新鲜重量也增加了。真菌格外引人注目的有益作用在早期阶段(30天),即在关键的恢复阶段转让苗盆后,同时,uncolonized幼苗迎头赶上的参数在以后的成长阶段,尽管经济增长促进作用的真菌仍可检测。叶绿素和总蛋白质含量GydF4y2Bap .籼GydF4y2Ba殖民GydF4y2Ba花烛属植物GydF4y2Ba叶数也高于未定殖对照(见表)GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba).与叶子相比,根的鲜重增加得更厉害。总之,刺激作用GydF4y2Bap .籼GydF4y2Ba在幼苗移栽到花盆后的关键早期阶段可检测到。GydF4y2Ba
p .籼GydF4y2Ba促进磷的吸收,而不是氮和钾的吸收GydF4y2Ba
为了确定真菌对生长的影响是否反映在养分吸收的增加上,我们测定了定殖和非定殖植物的根、茎和叶中的P和N含量,并将结果与钾吸收进行了比较(表)GydF4y2Ba4.GydF4y2Ba).有趣的是,在3个调查时间点,根、茎和叶中都没有真菌促进N和K的吸收,而在3个时间点真菌存在时,3个器官中P的含量都较高(表)GydF4y2Ba4.GydF4y2Ba).效果最强的是树叶。与生物量的结果一致,我们还观察到真菌对磷含量的刺激作用在移栽到盆内30天后达到最大值。因此,似乎GydF4y2Bap .籼GydF4y2Ba特别促进磷的吸收GydF4y2Ba
p .籼GydF4y2Ba促进抗氧化酶活性和抗辩相关基因的表达GydF4y2Ba
数字GydF4y2Ba3.GydF4y2Ba显示,GydF4y2Ba花烛属植物GydF4y2Ba温室土壤上的植物在第一个时期对细菌感染相当敏感。这对育种家来说是一个严重的问题,因为这些感染是造成植物大量损失的原因。GydF4y2BaP. indica-GydF4y2Ba殖民GydF4y2Ba花烛属植物GydF4y2Ba植物明显更能抵抗生物胁迫(图。GydF4y2Ba3.GydF4y2Ba).殖民化植物的更好性能与抗氧化酶的更高活性有关。总的来说,我们观察到三个时间点的SOD,猫和植物荚的活性增加约20%(表GydF4y2Ba3.GydF4y2Ba).GydF4y2Ba
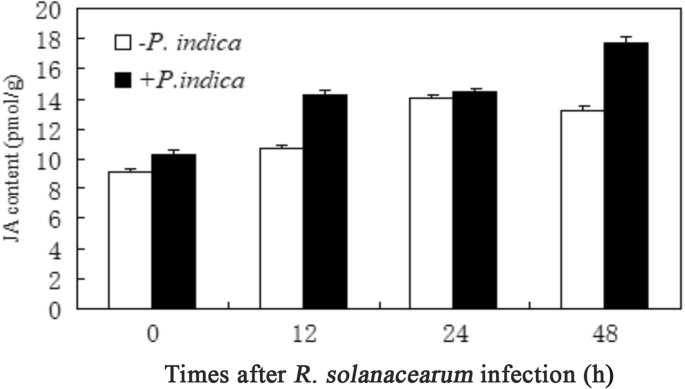
p .籼GydF4y2Ba刺激JA积累和激素响应基因GydF4y2Bar . solanacearumGydF4y2Ba感染GydF4y2Ba
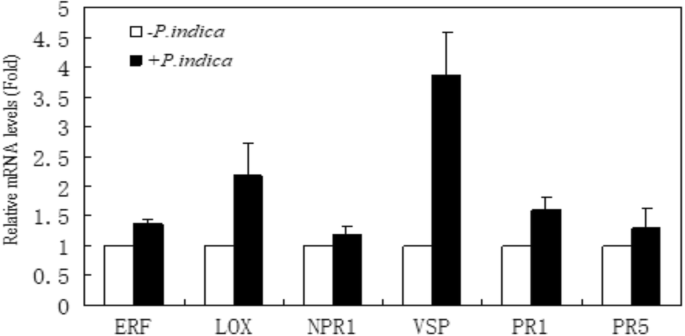
侵染前,叶片中的JA含量已略高于未接触真菌的植株(Fig。GydF4y2Ba4.GydF4y2Ba).这可能支持了防御反应的激活在共生相互作用GydF4y2Bap .籼GydF4y2Ba.此外,JA水平与细菌感染平行增强。在12小时内感染根部,1,2天GydF4y2Bar . solanacearumGydF4y2Ba,对ja反应的基因,例如GydF4y2Ba垂直地震剖面(GydF4y2Ba营养储存蛋白)GydF4y2Ba美国国家公共电台1GydF4y2Ba(非致病相关表达)和GydF4y2Ba液态氧GydF4y2Ba(脂肪加氧酶)的增加,并且与未定殖的对照相比,定殖植物的这种增加更强(图。GydF4y2Ba5.GydF4y2Ba).PR1 (Pathogenesis-Related 1)和PR5 (Pathogenesis-Related 5)也增加GydF4y2Bap .籼GydF4y2Ba- 浅植物(图。GydF4y2Ba5.GydF4y2Ba).GydF4y2Ba
叶片中激素响应基因的表达GydF4y2Bap .籼GydF4y2Ba-uncolonized( - )和殖民(GydF4y2Ba+GydF4y2Ba)GydF4y2Ba花烛属植物GydF4y2Ba植物在挑战后2天GydF4y2Bar . solanacearumGydF4y2Ba.et反应的相对mRNA水平GydF4y2Ba小块土地GydF4y2Ba, JA-responsiveGydF4y2Ba垂直地震剖面GydF4y2Ba那GydF4y2Ba液态氧GydF4y2Ba,和sa响应GydF4y2BaPR1GydF4y2Ba那GydF4y2BaPR5GydF4y2Ba和GydF4y2BaNPR1GydF4y2Ba,采用定量RT-PCR分析。计算相对于组织的表达水平GydF4y2BaGAPDHGydF4y2Ba信使rna水平。条形代表平均值±平均值的标准误差GydF4y2Ba
讨论GydF4y2Ba
p .籼GydF4y2Ba殖民广泛的植物物种,包括农业上重要的单子叶植物到双子叶植物[GydF4y2Ba22GydF4y2Ba那GydF4y2Ba23GydF4y2Ba].本研究建立了一种新的共生系统GydF4y2Ba花烛属植物GydF4y2Ba和GydF4y2Bap .籼GydF4y2Ba.与GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba[GydF4y2Ba24GydF4y2Ba],GydF4y2Ba芸苔属植物显著GydF4y2Ba[GydF4y2Ba25GydF4y2Ba],GydF4y2Ba栽培稻GydF4y2Ba[GydF4y2Ba26GydF4y2Ba],GydF4y2Ba小麦GydF4y2Ba[GydF4y2Ba27GydF4y2Ba]或GydF4y2BaMedicago Truncatula.GydF4y2Ba[GydF4y2Ba28GydF4y2Ba,真菌刺激生物量积累,特别是根的生长和长度GydF4y2Ba花烛属植物GydF4y2Ba.自从根源GydF4y2Ba花烛属植物GydF4y2Ba部分生长在土壤表面,内生菌对这些部分的根系的影响很难量化,但是如果整个根系被认为是明显的生长促进是可以检测到的。的影响GydF4y2Bap .籼GydF4y2Ba关于形态学的GydF4y2Ba花烛属植物GydF4y2Ba根系与观察到的快速根系伸长以及叶和茎尺寸增大的生长刺激相关,这在转入土壤后的前30天优先发生。在后期阶段,有利的效果下降,这在大麦中也观察到[GydF4y2Ba29GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba他将这种现象描述为“寄主植物的初始优势”。这对GydF4y2Ba花烛属植物GydF4y2Ba从组织培养到盆栽后,幼苗对逆境和疾病非常敏感。引入GydF4y2Bap .籼GydF4y2Ba因此,进入商业施加的传播过程可以是克服育种者问题的有用工具。虽然这项调查在早期侧重统一GydF4y2Ba花烛属植物GydF4y2Ba增长,这是合理的假设GydF4y2Bap .籼GydF4y2Ba还支持后面的观赏植物开发的步骤。早期的殖民地开花GydF4y2Ba答:芥GydF4y2Ba植物表明,植物的基本新陈代谢是由真菌在植物的整个生命周期中刺激的[GydF4y2Ba31GydF4y2Ba].GydF4y2Ba
菌丝通过真菌的PTP转运体从土壤中吸收磷(P),并将养分转移到宿主的根部,如玉米[GydF4y2Ba6.GydF4y2Ba].真菌还改善了土壤中酸和碱性磷酸酶的活性[GydF4y2Ba26GydF4y2Ba那GydF4y2Ba32GydF4y2Ba这样可以更好地从土壤中获取磷。考虑到GydF4y2Bap .籼GydF4y2Ba在营养方面,尤其是寄主对磷的吸收和各种植物的生长反应方面,很难预测假定的相关性。内生菌不促进植物对磷的吸收GydF4y2Ba仙客来GydF4y2Ba在低磷条件下,提高植株的磷含量[GydF4y2Ba33GydF4y2Ba].另一方面,内生菌增加了烟草的生物量和产量,但没有促进磷的积累[GydF4y2Ba34GydF4y2Ba].绿豆亦有类似结果[GydF4y2Ba35GydF4y2Ba]和大麦[GydF4y2Ba29GydF4y2Ba].因此,有促进生长的作用GydF4y2Bap .籼GydF4y2Ba在一些宿主植物上与P吸收速率没有相关。我们的研究表明GydF4y2Bap .籼GydF4y2Ba促进磷的积累GydF4y2Ba花烛属植物GydF4y2Ba,叶片中的P堆积高于根和茎。有趣的是,植物中的N和K内容物不会被真菌刺激,证明P的特异性。植物P供应提高了CO的敏感性GydF4y2Ba2GydF4y2Ba同化作用和氮含量,进而提高光合效率和生长速度[GydF4y2Ba36GydF4y2Ba].然而,在GydF4y2Ba花烛属植物GydF4y2Ba,真菌增加了叶绿素水平,但不是N采光率。也是Achatz等人。[GydF4y2Ba29GydF4y2Ba)表明,GydF4y2Bap .籼GydF4y2Ba在低光强度条件下增加光合效率,而N累积不受影响。GydF4y2Bap .籼GydF4y2Ba也提高了玉米的光合效率[GydF4y2Ba37GydF4y2Ba],但没有在相同条件下的养分吸收数据。较高的叶绿素水平和光合速率可能会加速碳水化合物的合成,从而促进植物的生长GydF4y2BaA. Andraeanum.GydF4y2Ba.GydF4y2Ba
许多研究也表明GydF4y2Bap .籼GydF4y2Ba弗兰肯审查了宿主系统抗氧化能力[GydF4y2Ba38GydF4y2Ba,但从文献数据中也没有清晰的描述。在大麦中,根中抗坏血酸含量增加,而叶中抗坏血酸含量不受影响GydF4y2Bap .籼GydF4y2Ba[GydF4y2Ba8.GydF4y2Ba].Vadassery等。[GydF4y2Ba39GydF4y2Ba也显示出抗坏血酸和谷胱甘肽水平升高GydF4y2Ba拟南芥GydF4y2Ba殖民GydF4y2BaP. indica。GydF4y2Ba在我们的研究中,SOD、CAT和POD活性是植物细胞抗氧化的中心[GydF4y2Ba40GydF4y2Ba受到真菌的刺激。具有较好的抗氧化活性的植株表现表明,从组培苗移栽到盆栽后的关键期,真菌增强了植株的先天免疫和非生物胁迫反应。Baltruschat等人[GydF4y2Ba30.GydF4y2Ba]在盐胁迫下,定殖大麦根中5种抗氧化酶含量均增加。保护酶不仅参与植物的防御反应,而且在植物的一般代谢中起重要作用[GydF4y2Ba41GydF4y2Ba].这也许可以解释为什么会被殖民GydF4y2BaA. Andraeanum.GydF4y2Ba植物表现的更好。因为强壮的植株(参见[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba42GydF4y2Ba那GydF4y2Ba43GydF4y2Ba[发病率降低(图。GydF4y2Ba3.GydF4y2Ba),GydF4y2Bap .籼GydF4y2Ba可能是未来应用的强大工具,用于传播GydF4y2Ba花烛属植物GydF4y2Ba.GydF4y2Ba
抗病途径在水稻、大麦和GydF4y2Ba答:芥GydF4y2Ba[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba31GydF4y2Ba那GydF4y2Ba44GydF4y2Ba].大麦叶片中的JA和SA信号通路对定殖大麦的白粉病抗性无响应,而热激蛋白HSP70基因和致病相关基因HvPr17对大麦的白粉病抗性有响应[GydF4y2Ba45GydF4y2Ba].然而,在GydF4y2Ba答:芥,GydF4y2Ba系统抗性反应与水杨酸盐信号无关,但需要一个有效的茉莉酸盐防御途径[GydF4y2Ba46GydF4y2Ba].Vahabi等人[GydF4y2Ba47GydF4y2Ba],也证实菌丝分泌物诱导了高JA/ABA/SA/JA- ile水平的根和茎GydF4y2Ba答:芥GydF4y2Ba通过转录组和HPLC-MS技术。据报道GydF4y2Bap .籼GydF4y2Ba能诱导抗性吗GydF4y2Ba拟南芥GydF4y2Ba响应叶片病原体的感染GydF4y2BaGonovilomyces orontiiGydF4y2Ba.在这项研究中,测试是否GydF4y2Bap .籼GydF4y2Ba殖民GydF4y2Ba花烛属植物GydF4y2Ba植物更容易受到感染,因为我们利用了细菌GydF4y2Bar . solanacearumGydF4y2Ba(经常通过在农业繁殖程序期间通过根腐腐烂导致严重的植物损失。病原细菌导致枯萎,其与主体的JA依赖性防御响应相关。这些报告表明,不同植物的机制对殖民化反应是不同的。在我们的研究中,殖民中PR基因的相对水平GydF4y2Ba花烛属植物GydF4y2Ba表明参与植物激素反应的SA/ETH(乙烯)/VSP主要集中在叶片中GydF4y2Ba花烛属植物GydF4y2Ba对细菌性疾病感染敏感。GydF4y2Ba
病因相关(PR)蛋白(SA响应相关基因)在抗病反应中起重要作用[GydF4y2Ba48GydF4y2Ba].我们的研究表明GydF4y2Bap .籼GydF4y2Ba促进PR1和PR5显着上调GydF4y2Ba花烛属植物GydF4y2Ba叶约0.5倍水平。这表明内生菌在植物中发挥诱导系统抗性机制(ISR)的作用,在细菌感染时激活ja依赖的防御过程[GydF4y2Ba46GydF4y2Ba].由于不同信号通路的协同或拮抗,当植物遭遇生物和非生物胁迫时,PR基因可被多种植物激素信号分子调控[GydF4y2Ba49GydF4y2Ba那GydF4y2Ba50GydF4y2Ba].研究了JA/SA和其他与系统获得性抗性(SAR)相关的信号分子水平,诱导了PR基因的相对mRNA水平。Rout等[GydF4y2Ba51GydF4y2Ba结果表明,当植物遭受外源激素SA/ABA/MeJA(茉莉酸甲酯)/ETH以及干旱、盐害和创伤条件时,大蒜PR5水平升高,说明外源激素积累与植物获得抗性有关。李等人[GydF4y2Ba44GydF4y2Ba结果表明,喷施ABA后,水稻叶片PR5水平升高。VSP是ja调控的防御基因的一个子集,在对抗病原体挑战时表达更强烈。VSP表达增强GydF4y2Bap .籼GydF4y2Ba-介导的对白粉病的抗性GydF4y2Ba答:芥GydF4y2Ba[GydF4y2Ba46GydF4y2Ba].GydF4y2Ba
不同的是以上基因水平上调后GydF4y2Bap .籼GydF4y2Ba感染的JA相关基因脂氧合酶(LOX)没有显着变化,而JA-Imcucess植物储存蛋白(VSP)水平显着提高。JA是植物对应激感知的鉴定信号分子,通过感觉血管束通过长距离传输响应各种植物应力响应[GydF4y2Ba52GydF4y2Ba].此外,系统抗性反应与水杨酸盐信号无关,但需要一个有效的茉莉酸盐防御途径[GydF4y2Ba46GydF4y2Ba].此外,JA的生物合成效率受到各种因素的影响:在转基因中的JA合成键酶基因AOX(替代氧化酶)的表达GydF4y2Ba拟南芥GydF4y2Ba与野生型相比,番茄植物并未增加,野生型与底物浓度相关。同样,JA在受伤植物中的表达也没有明显与JA相关关键酶OPDA的表达,JA的生物合成GydF4y2Ba拟南芥GydF4y2Ba番茄植株受底物浓度或OPDA以外的其他因素的限制[GydF4y2Ba53GydF4y2Ba].因此,GydF4y2Bap .籼GydF4y2Ba未诱导大麦中JA合成相关基因的表达量[GydF4y2Ba8.GydF4y2Ba],也不会反映植物中的JA内容。在我们的研究中,JA内容GydF4y2Bap .籼GydF4y2Ba- 浅植物显着增加,但LOX的表达没有显着增加,这也表明JA合成在感染细菌疾病后除了LOX基因之外的其他因素的影响GydF4y2Ba花烛属植物GydF4y2Ba.中JA含量GydF4y2Bap .籼GydF4y2Ba殖民GydF4y2Ba花烛属植物GydF4y2Ba叶片在48 h内呈现单峰变化,表明JA是两者相互作用的早期分子信号GydF4y2Ba花烛属植物GydF4y2Ba及其致病菌。Vahabi等人[GydF4y2Ba47GydF4y2Ba]显示JA的调节受到植物和微生物互相辨别的限制。叶中的JA含量持续增加,增强了根腐抗病抗性,这表明了这一点GydF4y2Bap .籼GydF4y2Ba可以作为益生菌来提高耐药性吗GydF4y2Ba花烛属植物GydF4y2Ba.此外,在我们的研究中GydF4y2Ba小块土地GydF4y2Ba(乙烯响应因子)基因的乙烯响应转录因子增强,JA通过调控ERF1作用于乙烯信号[GydF4y2Ba54GydF4y2Ba].这是一致的,结果是Ja的根,茎和叶子的含量GydF4y2BaP. indica-GydF4y2Ba殖民GydF4y2Ba花烛属植物GydF4y2Ba组织分别高于对照植物的组织。GydF4y2Ba
结论GydF4y2Ba
总之,我们的结果表明GydF4y2Bap .籼GydF4y2Ba能诱发多种信号通路参与防御功能GydF4y2BaA. Andraeanum.GydF4y2Ba.然而,信号通路、基因表达调控以及激素水平的影响之间的相互作用机制仍需进一步研究。此外,我们的结果表明,它是有希望的发展GydF4y2Bap .籼GydF4y2Ba作为一种用于观赏植物的生物肥料。GydF4y2Ba
缩写GydF4y2Ba
- 阿坝:GydF4y2Ba
-
脱落酸GydF4y2Ba
- AOX:GydF4y2Ba
-
替代氧化酶GydF4y2Ba
- AOX:GydF4y2Ba
-
替代氧化酶GydF4y2Ba
- 猫:GydF4y2Ba
-
过氧化氢酶GydF4y2Ba
- 乙:GydF4y2Ba
-
乙烯GydF4y2Ba
- ISR:GydF4y2Ba
-
诱导系统抗性GydF4y2Ba
- 是:GydF4y2Ba
-
茉莉酸GydF4y2Ba
- 液态氧:GydF4y2Ba
-
脂氧合酶GydF4y2Ba
- NPR1:GydF4y2Ba
-
Non-expresser公关GydF4y2Ba
- opda:GydF4y2Ba
-
Oxo-Phytodienoic酸GydF4y2Ba
- 圆荚体:GydF4y2Ba
-
过氧化物酶GydF4y2Ba
- 公关:GydF4y2Ba
-
Pathogenesis-relatedGydF4y2Ba
- rt - pcr:GydF4y2Ba
-
逆转录聚合酶链反应GydF4y2Ba
- 山:GydF4y2Ba
-
水杨酸GydF4y2Ba
- SOD:GydF4y2Ba
-
超氧化物歧化酶GydF4y2Ba
- VSP:GydF4y2Ba
-
营养贮藏蛋白质GydF4y2Ba
参考文献GydF4y2Ba
- 1.GydF4y2Ba
Teixeira da Silva JA, Dobránszki J, Winarto B, Zeng S。GydF4y2Ba花烛属植物GydF4y2Ba体外:综述。Sci Hortic。2015;186:266 - 98。GydF4y2Ba
- 2.GydF4y2Ba
关键词:花,切花,花瓶寿命,品种差异GydF4y2Ba花烛属植物andraeanumGydF4y2Ba是由调节水分吸收的机制决定的。Sci Hortic。2010;124(1):102 - 8。GydF4y2Ba
- 3.GydF4y2Ba
Varma A, Savita V, Sudha, Sahay N, Butehorn B, Franken P。GydF4y2BaPiriformospora籼GydF4y2Ba,一种可培养的促进植物生长的根内生菌。应用环境微生物学报1999;65(6):2741-4。GydF4y2Ba
- 4.GydF4y2Ba
YE W,Shen Ch,Lin Y,Chen PJ,Xu X,Oelmuller R,Yeh Kw,Lai Z.生长促进相关的miRNA在内胞内真菌殖民殖民殖民GydF4y2BaPiriformospora籼GydF4y2Ba.《公共科学图书馆•综合》。2014;9 (1):e84920。GydF4y2Ba
- 5.GydF4y2Ba
植物内生真菌的研究GydF4y2BaPiriformospora籼GydF4y2Ba通过在其启动子中与保守的基序结合的同源域转录因子刺激硝酸还原酶和淀粉降解酶葡聚糖水直立通酶的表达。J Biol Chem。2005; 280(28):26241-7。GydF4y2Ba
- 6.GydF4y2Ba
Yadav V, Kumar M, Deep DK, Kumar H, Sharma R, Tripathi T, Tuteja N, Saxena AK, Johri AK。来自根内生真菌的磷酸盐转运体GydF4y2BaPiriformospora籼GydF4y2Ba在磷酸盐运输到寄主植物中起作用。[J] .中国生物医学工程学报,2010;GydF4y2Ba
- 7.GydF4y2Ba
陈志强,王志强,陈志强,等GydF4y2BaPiriformospora籼GydF4y2Ba对一年生向日葵生长和籽油产量的影响。共生关系。2011;53(2):83。GydF4y2Ba
- 8.GydF4y2Ba
Waller F, Achatz B, Baltruschat H, Fodor J, Becker K, Fischer M, Heier T, Huckelhoven R, Neumann C, von Wettstein D,等。植物内生真菌的GydF4y2BaPiriformospora籼GydF4y2Ba将大麦重新编程为盐胁迫耐受性,抗病性和更高的产量。Proc Natl Acad SCI U S A. 2005; 102(38):13386-91。GydF4y2Ba
- 9.GydF4y2Ba
陈志强,陈志强,陈志强,等。新型共生真菌的功能研究进展GydF4y2BaPiriformospora籼GydF4y2Ba,卷。80;2014.GydF4y2Ba
- 10.GydF4y2Ba
Banhara A,Ding Y,KühnerR,Zuccaro A,Parniske M.根细胞的定植和植物生长促进GydF4y2BaPiriformospora籼GydF4y2Ba独立于植物共同共生基因发生。植物科学学报2015;6:667。GydF4y2Ba
- 11.GydF4y2Ba
Harrach BD, Baltruschat H, Barna B, Fodor J, Kogel KH。共生的真菌GydF4y2BaPiriformospora籼GydF4y2Ba保护大麦根免受由坏死性病原菌镰刀菌引起的抗氧化能力丧失。植物与微生物学报。2013;26(5):599-605。GydF4y2Ba
- 12.GydF4y2Ba
Gill SS, Gill R, Trivedi DK, Anjum NA, Sharma KK, Ansari MW, Ansari AA, Johri AK, Prasad R, Pereira E,等。GydF4y2BaPiriformospora籼GydF4y2Ba:植物抗逆性研究的潜力和意义。Microbiol前面。2016;7:332。GydF4y2Ba
- 13.GydF4y2Ba
Varma A, Sherameti I, Tripathi S, Prasad R, Das A, Sharma M, Bakshi M, Johnson JM, Bhardwaj S, Arora M, et al. 13共生真菌梨状菌(Piriformospora indica):综述。In: Hock B, editor。真菌协会。柏林,海德堡:施普林格柏林海德堡;2012.231 - 54页。GydF4y2Ba
- 14.GydF4y2Ba
陈志强,陈志强,陈志强,等。一种烟草组织培养快速生长和生物测定的新方法。杂志。2006;15(3):473 - 97。GydF4y2Ba
- 15.GydF4y2Ba
李永昌,庄士敏,钱正昌,孙晨,蔡东,娄斌,欧缪勒,叶伟明。大白菜和大白菜的生长促进作用GydF4y2Ba拟南芥GydF4y2Ba经过GydF4y2BaPiriformospora籼GydF4y2Ba不受菌丝合成生长素的刺激。植物-微生物相互作用学报。2011;24(4):421-31。GydF4y2Ba
- 16.GydF4y2Ba
Hill T,Käfere.改进的曲霉血清介质方案:痕量元素和最小中盐储存液,Vol。48;2001年。GydF4y2Ba
- 17.GydF4y2Ba
洛佩兹·德尔·埃吉多·L,纳瓦罗-米罗·D,马丁内斯·埃雷迪亚五世,托罗普·PE,伊内塔·PPM。用2,3,5-三苯基四唑氯盐分光光度法测定种子批次的活力:以普通大麦为模型。植物学报。2017;8:747。GydF4y2Ba
- 18.GydF4y2Ba
使用单一硫酸-过氧化氢分解物分析放射性松针叶。土壤通报,1980;11(2):175-88。GydF4y2Ba
- 19.GydF4y2Ba
超氧化物歧化酶:II。幼苗水溶性蛋白的纯化及定量关系。植物杂志。1977;59(2):315 - 8。GydF4y2Ba
- 20.GydF4y2Ba
恩诺沙星对赤子爱胜蚓生长速率和过氧化氢酶活性的影响。环境毒理学杂志。2008;26(2):177-80。GydF4y2Ba
- 21.GydF4y2Ba
镁缺乏和强光增强了豆叶中超氧化物歧化酶、抗坏血酸过氧化物酶和谷胱甘肽还原酶的活性。植物杂志。1992;98(4):1222 - 7。GydF4y2Ba
- 22.GydF4y2Ba
Sun C, Johnson JM, Cai D, Sherameti I, Oelmuller R, Lou B。GydF4y2BaPiriformospora籼GydF4y2Ba通过刺激抗氧化酶、干旱相关基因的表达和质体定位的CAS蛋白,提高了大白菜叶片的抗旱性。植物生理学报。2010;167(12):1009-17。GydF4y2Ba
- 23.GydF4y2Ba
张志强,张志强,张志强。GydF4y2BaPiriformospora籼GydF4y2Ba-具有异常大的植物宿主范围的互惠担子菌。植物病理学杂志。2012;13(5):508-18。GydF4y2Ba
- 24.GydF4y2Ba
Peškan-Berghöfer T, Shahollari B, Giong Pham H, Hehl S, Markert C, Blanke V, Kost G, Varma A, Oelmüller rGydF4y2BaPiriformospora籼GydF4y2Ba与GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba根是研究有益植物-微生物相互作用的一个新系统,涉及植物内质网和质膜上的早期蛋白质修饰。杂志。2004;(4)122:465 - 77。GydF4y2Ba
- 25.GydF4y2Ba
苏泽忠,王涛,Shrivastava N,陈媛媛,刘旭,孙超,尹勇,高庆坤,娄保国。GydF4y2BaPiriformospora籼GydF4y2Ba促进生长,种子产量和芸苔Nimobiol res的质量。2017; 199:29-39。GydF4y2Ba
- 26.GydF4y2Ba
Das J, Ramesh KV, Maithri U, Mutangana D, Suresh CK。好氧水稻对GydF4y2BaPiriformospora籼GydF4y2Ba.中华医学杂志。2014;52(3):237-51。GydF4y2Ba
- 27.GydF4y2Ba
(4)真菌的影响GydF4y2BaPiriformospora籼GydF4y2Ba干旱和机械综合胁迫下小麦的生理特性和根系形态。植物生理生化。2017;118:107-20。GydF4y2Ba
- 28.GydF4y2Ba
李丽,李丽,王旭,朱平,吴华,齐胜。植物促生内生菌GydF4y2BaPiriformospora籼GydF4y2Ba在Medicago Truncatula缓解盐度压力。植物理性生物化学。2017; 119:211-23。GydF4y2Ba
- 29.GydF4y2Ba
阿查兹B,科格尔KH,弗兰肯P,沃勒F。GydF4y2BaPiriformospora籼GydF4y2Ba菌根化通过加速大麦植株的早期发育来提高籽粒产量。植物信号学报。2010;5(12):1685-7。GydF4y2Ba
- 30。GydF4y2Ba
Baltruschat H, Fodor J, Harrach BD, Niemczyk E, Barna B, Gullner G, Janeczko A, Kogel KH, Schafer P, schwarcinger I, et al.;根内生菌对大麦耐盐性的影响GydF4y2BaPiriformospora籼GydF4y2Ba与抗氧化剂的大量增加有关。新植物学家。180(2): 501 - 2008; 10。GydF4y2Ba
- 31。GydF4y2Ba
拟南芥内生真菌梨状孢子菌(Piriformospora indica)的定殖可能通过触发赤霉素的生物合成而导致拟南芥早开花。生物化学学报。2017;490(4):1162-7。GydF4y2Ba
- 32.GydF4y2Ba
王志强,王志强,王志强,等。植物根内生真菌对磷的利用研究进展GydF4y2BaPiriformospora籼GydF4y2Ba.土壤植物。2016;405(1):231 - 41。GydF4y2Ba
- 33.GydF4y2Ba
Ghanem G,Ewald A,Zerche S,Hennig F.根殖民化与Piriformospora的作用和磷酸盐可用性对仙客仁果肉的生长和生殖生物学。SCI Hortic。2014; 172:233-41。GydF4y2Ba
- 34.GydF4y2Ba
Barazani O, Benderoth M, Groten K, Kuhlemeier C, Baldwin IT。GydF4y2BaPiriformospora籼GydF4y2Ba和GydF4y2BaSebacina vermiferaGydF4y2Ba以降低烟草对草食动物的抗性为代价,提高烟草生长性能。环境科学。2005;146(2):234 - 43。GydF4y2Ba
- 35.GydF4y2Ba
丛枝菌根真菌与丛枝菌根真菌GydF4y2BaPiriformospora籼GydF4y2Ba单独或结合GydF4y2Ba根瘤菌GydF4y2Ba在绿色的谷物。植物营养学报,2010;33(2):285-98。GydF4y2Ba
- 36.GydF4y2Ba
Walker Anthony P, Beckerman Andrew P, Gu L, Kattge J, Cernusak Lucas A, Domingues Tomas F, Scales Joanna C, Wohlfahrt G, Wullschleger Stan D, Woodward FI。叶片光合特性(Vcmax和Jmax)与叶片氮、磷和比叶面积的关系:meta分析和建模研究生态学报。2014;4(16):3218-35。GydF4y2Ba
- 37.GydF4y2Ba
Rai MK, Shende S, Strasser RJ。快速荧光瞬态JIP试验是一种快速、灵敏的评价丛枝菌根真菌有效性的技术GydF4y2BaZea Mays.GydF4y2Ba:叶绿素a荧光分析。acta botanica botanica(云南植物研究). 2008;42(2):191-8。GydF4y2Ba
- 38.GydF4y2Ba
植物强化根内生菌GydF4y2BaPiriformospora籼GydF4y2Ba:潜在的应用和生物学背后。苹果microbiol biotechnol。2012; 96(6):1455-64。GydF4y2Ba
- 39.GydF4y2Ba
Vadassery J, Tripathi S, Prasad R, Varma A, Oelmuller R.单脱氢抗坏血酸还原酶2和脱氢抗坏血酸还原酶5是相互作用的关键GydF4y2BaPiriformospora籼GydF4y2Ba和GydF4y2Ba拟南芥GydF4y2Ba.J植物理性。2009; 166(12):1263-74。GydF4y2Ba
- 40.GydF4y2Ba
了解氧化应激和抗氧化功能对光合作用的影响。植物杂志。2011;155(1):93 - 100。GydF4y2Ba
- 41。GydF4y2Ba
Mittler R.氧化应激,抗氧化剂和应力耐受性。趋势植物SCI。2002; 7(9):405-10。GydF4y2Ba
- 42。GydF4y2Ba
Kumar M, Yadav V, Tuteja N, Johri AK。玉米抗氧化酶活性的研究GydF4y2BaPiriformospora籼GydF4y2Ba.微生物学。2009;155 (Pt 3): 780 - 90。GydF4y2Ba
- 43。GydF4y2Ba
胡c,赵w,风扇j,李z,阳r,zhao f,王j,王s.与Ja途径相关的保护酶和基因涉及到西红柿高土壤温度下的根结线路响应MI-1。Hortic Environ Biotechnol。2015; 56(4):546-54。GydF4y2Ba
- 44.GydF4y2Ba
李X-y,gao l,张w-h,liu j-k,张y-j,王h-y,刘d-q。小麦PR5基因对叶锈病感染响应的特征表达,GydF4y2Ba柄锈菌triticinaGydF4y2Ba.植物学报。2015;10(1):132-41。GydF4y2Ba
- 45.GydF4y2Ba
Waller F, Mukherjee K, Deshmukh SD, Achatz B, Sharma M, Schafer P, Kogel KH。植物的系统和局部性反应GydF4y2BaPiriformospora籼GydF4y2Ba和相关的Sebacinales物种。J植物理性。2008; 165(1):60-70。GydF4y2Ba
- 46.GydF4y2Ba
斯坦E,莫立特A,科格尔KH,沃勒fGydF4y2Ba拟南芥GydF4y2Ba菌根真菌梨形孢霉(Piriformospora indica)赋予的茉莉酸信号和NPR1的细胞质功能。植物生理学报。2008;49(11):1747-51。GydF4y2Ba
- 47.GydF4y2Ba
关键词:拟南芥,拟南芥,拟南芥GydF4y2BaPiriformospora籼GydF4y2Ba从最初由真菌释放的化学介质引起的短暂应力转变为两个共生体物理接触后的相互作用。BMC Plant Biol. 2015;15:58。GydF4y2Ba
- 48.GydF4y2Ba
侯明,徐伟,白华,刘艳,李玲,刘玲,刘波,刘刚。水稻叶片与水稻互作过程中致病相关蛋白的特征表达GydF4y2Ba黄oryzaeGydF4y2Bapv。Oryzae。植物学报2012;31(5):895-904。GydF4y2Ba
- 49.GydF4y2Ba
Bari R, Jones JD。植物激素在植物防御反应中的作用。acta botanica sinica(云南植物学报),2009;GydF4y2Ba
- 50.GydF4y2Ba
Antico CJ, Colon C, Banks T, Ramonell KM。茉莉酸介导的对坏死营养和生物营养真菌病原体的防御作用的见解。医学杂志。2012;7(1):48-56。GydF4y2Ba
- 51.GydF4y2Ba
Rout E, Nanda S, Joshi RK。大蒜PR5基因的分子特性及异种表达GydF4y2Ba大蒜GydF4y2BaL.)增强了对坏死营养真菌的抗性。acta botanica yunica(云南植物研究). 2016;144(2):145 - 60。GydF4y2Ba
- 52.GydF4y2Ba
李msyxf。茉莉酸信号在植物中及其与环境相关的生物学功能。盛泰Xuebao / Acta Ecologica Sinica。2014; 34(23):6779。GydF4y2Ba
- 53。GydF4y2Ba
Laudert D,Schaller F,Weiler EW。转基因尼古罗尼亚塔哈特和GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba植物过表达氧化烯合成酶。足底。2000;211(1):163 - 5。GydF4y2Ba
- 54。GydF4y2Ba
在植物防御中,乙烯响应因子1整合了来自乙烯和茉莉酸途径的信号。植物细胞。2003;15(1):165 - 78。GydF4y2Ba
确认GydF4y2Ba
我们承认中国农业科学院的整个研究团队,中国福建省三明治学院以及与国立台湾大学,台北,中华民国的研究团队的真诚合作以及Friedrish-Schiller University,Jena,Jena,德国的研究团队。GydF4y2Ba
资金GydF4y2Ba
国家自然科学基金项目(31761130073和31422047),科技部(KXGH17005),台湾资助。资助机构没有参与研究的设计、分析和手稿中数据的解释。GydF4y2Ba
数据和材料的可用性GydF4y2Ba
本研究过程中产生或分析的所有数据均可向通讯作者免费索取GydF4y2Ba:GydF4y2Bakaiwun Yeh [E-mail:ykwbppp@ntu.edu.tw]仅供合理使用。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
KWY构思了原创的想法,设计了HMZ,CMC和XMX的实验。由JX种植的植物。HFL和FZL执行了实验。WFX监控了实验并检查了数据。Ro和Kwy写道并纠正了手稿。所有作者都阅读,编辑并批准了最终手稿。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
本研究不包含任何需要伦理同意或批准的研究。GydF4y2Ba
同意出版GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
出版商的注意事项GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文遵循知识共享署名4.0国际许可协议(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
林,高频。那Xiong, J., Zhou, HM.et al。GydF4y2Ba促进生长和诱导抗病GydF4y2Ba花烛属植物GydF4y2Ba受益根内心细胞殖民GydF4y2BaPiriformospora籼GydF4y2Ba.GydF4y2BaBMC植物杂志GydF4y2Ba19,GydF4y2Ba40(2019)。https://doi.org/10.1186/s12870-019-1649-6GydF4y2Ba
已收到GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-019-1649-6GydF4y2Ba
关键字GydF4y2Ba
- 花烛属植物andraeanumGydF4y2Ba
- Piriformospora籼GydF4y2Ba
- 共生者GydF4y2Ba
- 增长促进GydF4y2Ba
- 抗病性GydF4y2Ba