摘要
背景
寄主植物与寄主选择性毒素(HST)产生相互作用的机制主产在感染期间对可持续的作物生产特别重要。苹果斑病(马吕斯×家庭Borkh)引起的答:alternata苹果病型是一种主要病害,特别是在全球最大的苹果生产国东亚。一个显性基因,alt.,控制苹果品种“美味”对交替斑点的敏感性。在这项研究中,我们很好地映射了alt.基因座和特征三个潜在的候选基因。
结果
我们使用了797 f1来自15个苹果品种之间的杂交个体易感(alt./alt)和抵抗(alt/alt)到链格孢菌斑点,构建其物理和遗传图谱alt.位于11号染色体顶端的位点。易受影响的基因来自《美味》(Delicious)。为了精细地绘制alt.轨迹,我们建造了一个“缺乏美味”的BAC库,这是一次“美味”的运动,并使用图形基因分型来分隔alt.位点到一个43 kb的区域。三个基因预测了候选人alt.其中,编码螺旋-核苷酸结合-富亮氨酸重复序列(CC-NB-LRR)型抗病蛋白的基因是最有希望的。此外,在5 '非翻译区还发现了一个12 bp的插入alt.- 这种基因的等位基因,其存在或不存在,其与易感性或耐受性共同分离答:alternata对43个供试品种(包括老苹果和现代苹果育种创始者)进行了苹果致病型分析。
结论
抗病蛋白被认为是产生hst的易感性/抗性的决定因素答:alternata第一次。我们的发现为hst介导的疾病控制机制提供了新的见解答:alternata对宿主植物。
背景
植物与病原体的相互作用是在最小限度使用化学品的情况下实现可持续作物生产的主要利益。虽然大多数alternaria.菌种是存在于土壤或腐烂组织中的腐生真菌[1,2],主持人选择性毒素(HST)生产主产在各种宿主植物中获得了致病性状并引起疾病。生产HST答:alternata有七种致病变体(病理型),每种产生不同HST的不同HST,属于蔷薇科(马吕斯,Pyrus,草莓属)和芸香科(柑橘类)以及茄科植物(番茄[茄属植物lycopersicum]和烟草[尼古利亚娜烟草)) (3.,4].hst是低分子量的次级代谢物,只对产生毒素的真菌的宿主有毒,而不影响其他植物。
虽然已经广泛研究了真菌致病性,但宿主对真菌感染的易感性仍然很差。化学结构已被阐明七HST中的六个,并且HST生物合成基因已被克隆,除烟草型病理型外[3.,4].而且,使用互补实验答:alternata在其生产HST的能力中变化的突变体揭示了其致病性源于宿主植物的机制[5,6,7].而卫生服务中心的主要目标地点已确定[3.,4]确定宿主敏感性的基因仅在粗柠檬中鉴定(柑橘jambhiri郁郁葱葱的。)和番茄[8,9].因此,需要阐明宿主敏感性/抵抗的机制,以综合了解植物主持人与HST生产之间的关系答:alternata.
答:alternata苹果型(以前称为答:马里)产生am毒素[10,11,12),并在苹果(马吕斯×家庭borkh。)。AM-毒素有三种相关的分子物种,AM-毒素I,II和III,其中AM-毒素I是最丰富的。am-toxin生物合成基因,AMT1,AMT2,AMT3,AMT4,已经被克隆,并聚集在一个有许多转座子样序列的小的条件可有可无的染色体中[6].alternaria斑点影响东亚的苹果园,这些果园超越了北美,欧洲作为苹果生产最高的地区[13,14].它的特点是在晚春至初夏,叶片上出现圆形的棕色或黑色斑点,导致落叶。这导致了光合作用的减少和果实品质的恶化,导致苹果产量的重大损失。
虽然苹果品种对斑点病的敏感性水平不同,品种'美味','印度'和他们的运动和后代是特别易受影响[15].对链格孢斑点病的易感性由显性基因控制alt.,被映射到“美味”运动“Starking Delicious”(SD)的11号染色体上[16,17].抗性品种为基因型alt/alt,易感品种是alt./alt或alt./alt.虽然品种纯合alt.尚未确定[16].一些简单序列重复(SSR)标记已被鉴定为侧翼alt.位点,为定位克隆提供良好的起点alt..在本研究中,我们对alt.使用F.1抗性和易感苹果品种间的杂交所衍生的后代。本研究中使用的所有易感材料都是“美味”的衍生品。构建了‘SD’的细菌人工染色体(BAC)库,用于精细定位alt.轨迹。此外,设计了基于PCR的基因分型标记,用于评分苹果品种的抗性/敏感表型。
结果
细的映射alt.
为了精细映射alt.位点797 F1植物(表格1,附加文件1(图S1),我们首先应用标记富集方法对chr 11的遗传图谱进行了分析,该图谱由‘SD’和‘Jonathan’两个对等的全亲本构建。前面描述的45个SSR标记[17测试了,其中25个标记物在“SD”中是多态的,并进行联系分析(附加文件2:表S1)。
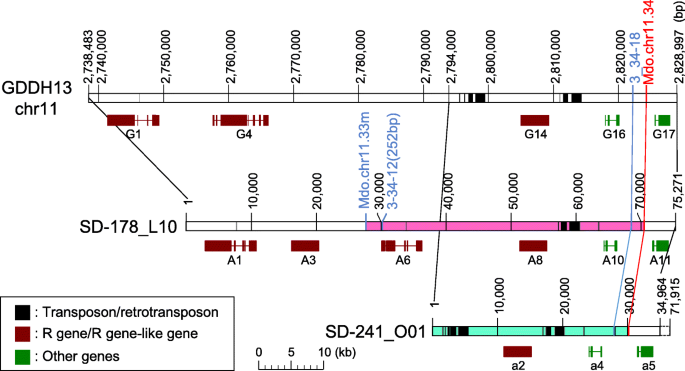
在25个SSR标记中,21个标记定位于chr11。在这21个ssr中,有9个与alt.基因座(图。1a). SSR标记Mdo.chr11.28和Mdo.chr11.44位于alt.轨迹在两边。然而,由于Mdo.chr11.28的多态性较差,因此将Mdo.chr11.27与Mdo.chr11.44一起使用,以进行进一步的精细映射alt.轨迹。在683 f中间1共鉴定出20株Mdo.chr11.27和Mdo.chr11.44重组植株1和额外的文件3.:表S2)。在这20个重组体中,加上来自‘SD’和‘Jonathan’互惠全亲本的另外3个重组体,分别鉴定出9个和14个植株对Alternaria blo斑点病敏感和抗性(见表)1).没有植物表现出中度抗性。利用表型和遗传联系数据,alt.区域表示为图形基因型(图。1b和附加文件3.:表S2)。的候选区域alt.在MDO.CHR11.3和MDO.CHR11.34之间识别,根据“金色美味”基因组1.0主要组装,跨越102 kB的物理距离。三种植物显示重组之间alt.鉴定了MDO.CHR11.3或MDO.CHR11.34。
精细映射alt.轨迹。一个从“SD”和“乔纳森之间的114个互惠交叉口构建的”缺乏美味“(SD)的标记富集的初始地图。本研究中开发的简单序列重复(SSR)标记以粗体表示。Chr:染色体。b详细的物理地图alt.遗传信息使用797 F1来自15个杂交的个体。每个标记的物理位置都是基于‘Golden Delicious’基因组版本1.0初级组装。基因型的图形表示也显示在附加文件中3.S2:表。c最后的图形基因型的序列侧翼alt.轨迹。只显示了三个关键的重组体。的候选区域alt.用双头箭头表示。绿色和粉红色段表明alt.- - -alt相关地区,分别。d‘SD’细菌人工染色体(BAC)克隆的筛选
进一步缩小候选区域,我们通过重新设计了从MDO.CHR11.3和MDO.CONCO.CONCO.CHR11.34之间设计的MDO.CHR11.33的底漆序列设计了新的SSR标记MDO.CHR11.33M。在标记富集方法中没有放大,甚至在MDO.CHR11.3和MDO.CHR11.34之间开发了两个额外的SSR标记(3_34-12和3_34-18)(表2).识别alt.-相关等位基因,我们最初将这些标记映射到‘SD’地图(数据未显示)。Mdo.chr11.33 m和3_34-18标记的PCR扩增片段分别为267-bp和299-bp,均代表Mdo.chr11.33 m和3_34-18alt.相关的等位基因。标记3_34-12有2个片段(288 bp和252 bp)代表alt.-相关等位基因的PCR扩增结果显示,3_34-12引物对扩增了两个紧密连接的位点(3_34-12 [288 bp]和3_34-12 [252 bp])。对23个重组体进行SSR标记检测,发现3_34-12 (252 bp)和3_34-18与重组体共分离alt.(图。1c). Mdo.chr11.33 m位于alt.和Mdo.chr11.3。3_34-12 (288 bp)位点定位于候选基因外的Mdo.chr11.3和Mdo.chr11.28之间的基因组位置alt.区域(附加文件3.:表S2)。总的来说,精细映射定界alt.到Mdo.chr11.33 m和Mdo.chr11.34之间的9 kb区域。
BAC克隆的鉴定alt.地区
识别候选区域的基因alt.,我们建立了一个“SD”的BAC库,平均插入尺寸为180 kB,并且在第一次试验中共有49,920个BAC克隆。因此,BAC文库的尺寸约为8985MB,其约为苹果基因组大小的11倍。但是,无法识别含有四个SSR标记中的每一个的克隆(MDO.CHR11.3,MDO.CHR11.34,3_34-12和MDO.CHR11.33M)。因此,我们使用比第一次试验更短的碎片进行第二次试验,然后开发了另外的61,056个BAC克隆,尽管它们的平均插入尺寸未被验证。最终,鉴定了含有至少一个SSR标记物的四种BAC克隆(SD-178_L15,SD-279_H07,SD-242_L21和SD-241_O01)(图。1d)。BAC克隆,SD-178_L15,SD-279_H07,SD-242_L21被确定为alt.-关联克隆,SD-241_O01被鉴定为alt有关克隆。只有一个alt.-相关克隆覆盖了完整的候选区域(SD-178_L15),而alt- 未经证实的克隆(SD-241_O01)。SD-178_L15和SD-241_O01都被霰弹枪测序并确定分别为75,271和71,915bp的长度(图。2).的alt.候选区域约43 kb,位于SD-178_L15的5′端27-70 kb范围内。BAC克隆SD-241_O01在离5′端30,344 bp和28,015 bp处分别含有Mdo.chr11.34和3_34-18的正向引物,其余两个标记3_34-12和Mdo.chr11.33 m均未含有。
在硅基因鉴定和表征中
BAC克隆SD-178_L15和SD-241_O01的序列和GDDH13的部分序列,GDDH13是一个新的基因组序列,来自一个' Golden Delicious '双单倍体系[18,以检测是否存在基因、转座因子和其他特征。SD-178_L15、SD-241_O01和GDDH13之间的转座元件的结构和位置明显不同。2).我们在SD-178_L15、SD-241_O01和GDDH13中鉴定了11个(A1-11)、12个(a1-12)和17个(G1-17)预测ORFs3.和图。2).多个预测orf的蛋白序列与植物防御反应相关基因的蛋白序列高度相似3.).InterProScan在SD-178_L15、SD-241_O01和GDDH13的4个、3个和3个orf中分别鉴定了一个富含亮氨酸重复序列(LRR)的结构域,这是抗病(R)基因的主要组成部分4和图。2).在A10、a4和G16 orf中也发现了致病性III型效应因子Avr裂解位点RIN4。的alt.SD-178_L15的候选区域包含5个预测的orf (A6-10),其中3个具有R基因的特征,2个代表反转录转座子样序列,被丢弃。
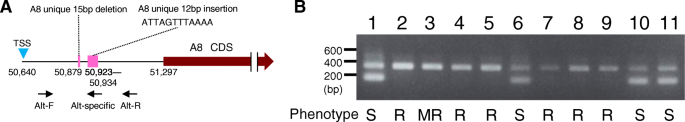
在这内alt.候选区域,A6 ORF唯一存在于SD-178_L15上,并且不存在于SD-241_O01和GDDH13中。A6 ORF显示与盘绕线圈核苷酸结合-LRR(CC-NB-LRR)型蛋白质的高相似性;但是,它缺少NB域(表4和额外的文件4:图S2)。与GDDH13基因组chr 11 2.656 Mb上预测的ORF MD11G1030400相似度最高(62%)。A8、a2和G14的orf与CC-NB-LRR类R蛋白具有高度的相似性,明确表明它们属于这一类蛋白。它们代表了高度保守的1405个氨基酸(>相似性99%),编码CC、NB和LRR域(见表)4)通过口语预测为细胞外蛋白(数据未显示)。A8 ORF患有几种独特的序列变化,包括CC和NB域中的几个氨基酸取代(附加文件5:图S3)和12bp插入和5'未转换区域(UTR)中的15-BP删除(图。3.).A10,A4和G16 ORF患有RIN4,一种致病型III效应分配因子AVR切割位点域(表4).A10和G16的氨基酸序列相同,其转录起始位点上游2 kb的启动子序列也相同,只是有1-bp的错配。然而,a4预测的氨基酸序列,特别是在c端,与A10和G16有显著差异(附加文件)6:图S4)。
DNA标记用于检测的alt.-相关等位基因A8 ORF。一个A8 ORF独特的12-bp插入结构及其检测引物的示意图。b凝胶图像显示了用“Alt-F”、“Alt-R”和“Alt-specific”引物从苹果品种基因组DNA中扩增出的PCR产物。不同的凝胶道代表不同的苹果品种:1,“Starking Delicious”;2、“乔纳森”;3、“金冠苹果”;4、“罗尔斯珍妮特”;5,“伍斯特红苹果”;6,“印度”;《考克斯的橙色皮平》(Cox ' s Orange Pippin);8、“麦金托什”;9, p13_7 - 3693; 10, P13_7–3743; and 11, P3_01. S = susceptible, R = resistant, MR = moderately resistant. TSS: transcription start site, CDS: coding sequences
DNA的标志alt.
A8 ORF的5'UTR中的独特插入用于开发基于PCR的基因分型标记alt.地区(图。3.).携带该插入物的材料对AKI-3分离物感染易感(> 2.5)答:alternata苹果病理类型(附加文件7:表S3与图3.).
讨论
在本研究中,我们精细地绘制了alt.利用BAC克隆扩增到chr 11顶端43 kb区域(fig .;1和2),并预测三种orf作为潜在的候选基因,潜在的敏感性或耐药反应答:alternata苹果致病型。这些预测的ORF中的一个编码典型的R蛋白。
控制alertaria斑点易感性的基因
SSR标记(CH05G07)与赋予易感性易感性的主要基因相关联答:alternataapple pathotype在5.6 cM的距离上已经被报道过[19].然而,由于CH05g07位于两个不同的chr(12和14)上[20., Li等人确定的该基因的基因组位置[19]可能与之不同alt.在本研究中映射的基因座(图。1).这种不一致可能是由于对病原菌分离物攻击的反应或所使用的实验条件的基因差异造成的。它的毒性可能是答:alternata同一品种在中国和日本不同[15,21].例如,在中国的研究中,“金鲜”被定义为易患链格孢病[19但同样抵抗[15,22,23或中等抗性[24在日本研究中。高浓度HST应用于抗病品种诱导敏感性的发现[25[那些研究中使用的病原体在其生产HST的能力方面不同;中国人可能会大量生产am-toxin,而不是日本人。因此,表征研究病原体的毒力是重要的。此外,李等人的基因型表型评估的长孵育时间(7天)。[19与Abe等人使用的相比[15[可能提高其他由基因控制的耐药/易感系统,这些基因与本研究中发现的不同。这些不一致性背后的机制需要在未来的研究中进行研究。
候选基因的识别
没有alt-相关BAC克隆完全跨越alt.区域,表明该区域的序列或染色体结构的性质抑制了其克隆。一种可能性可能是围绕的区域alt.候选地区包含许多欣dIII识别位点,这阻碍了我们在第一次试验中获得的长馏分的形成。在BAC克隆和GDDH13部分基因组序列中发现了几个R基因。这一结果与之前对chr 11顶部CC-NB-LRR基因簇的观察结果一致[26].虽然RT-PCR尚未验证预测的orf,但我们在候选区域预测了两个编码R蛋白(A6和A8)的orf和一个编码防御反应相关蛋白(A10)的orf(见表)3.和图。2).A6和A8的氨基酸序列与CC-NB-LRR类R蛋白高度相似;然而,由于A6缺乏NB-ARC结构域,而NB-ARC结构域是这类基因中R蛋白功能的典型和关键[27, A6可能是一个伪基因。SD-241_O01和GDDH13中A6等位基因的缺失可能与NB-LRR基因的重复有关。在A6附近,SD-178_L10的非编码核苷酸序列与GDDH13和SD-241_O01有很大差异(数据未显示);SD-178_L10与其他两种基因几乎没有相似之处,表明异位重组和/或基因易位是植物基因组中抗基因类似(RGA)家族(包括NB-LRR)扩增的驱动因素。A6与位于A6约100 kb处的MD11G1030400相似性最高,这一事实与之前的研究结果一致[28];Nb-LRR伪原通常存在于100KB的Bonafide NB-LRR基因范围内。因此,可以通过基因重复产生A6并处于偏差化的过程中。
由于预测的ORFs A8、a2和G14被认为是CC-NB-LRR类R基因,编码的蛋白可以直接或间接识别效应体,从而诱导超敏反应(hypersensitive response, HR)。提示CC和NB结构域的一些氨基酸替换可能与它们的功能改变有关。这些orf的氨基酸序列高度保守(> 99%的相似性)表明A8是一个功能性R基因,其5 ' UTR的独特多态性表明其独特的表达谱alt.尽管未来的研究需要收集支持这一理论的证据。
预计ORF,A10,A4和G16编码RIN4,一种致病型III效应分配因子AVR切割位点(表4).在拟南芥蒂利亚纳,RIN4介导人力资源反对两它与被称为“保护模型”的被广泛研究的植物-病原体关系有关[29,30.,31].R蛋白RPM1和RPS2(即守卫蛋白)监测RIN4(即守卫蛋白)的不变性。由分泌的致病性效应物攻击p .两修饰RIN4,从而激活RPM1和RPS2,诱导HR。类似的机制可能存在于苹果公司,A10,一个候选alt.,将作为监护蛋白.然而,由于A10和G16预测的蛋白和启动子序列高度保守,这表明它们之间没有功能和表达水平的差异,因此似乎不是可信的候选者alt.轨迹。
因此,在SD-178_L15 BAC克隆预测的三个中,A8似乎是最有希望的候选者alt.轨迹。这些发现还提出了am-toxin的Elicitor活性。虽然am-toxin的抑制效果良好记录了[32,在本研究中首次描述了am毒素的激发子活性。
敏感性控制的预测机制
尽管有相反的证据,HR被认为是一种植物对抗入侵病原体的防御机制,病原体通过诱导感染部位周围区域的程序性细胞死亡而包含在死亡组织中[33].在R基因介导的植物与真菌病原体之间的典型关系中,由于基因对基因相互作用的结果,抗性通常是显着的。相比之下,苹果与苹果关系答:alternataApple Pathotype展示了相反的趋势,其中alertaria斑点易感性是占主导地位的[16].这类似于A. Thaliana.和Cochliobolus Victoriae.[34].c . victoriae是一种产生HST victorin的坏死营养真菌吗A. Thaliana..的敏感性A. Thaliana.来c . victoriae是占主导地位的继承[35],可以在保护模型的基础上解释[36,37].Lorang等人。[38]确定了易感基因,LOV1编码CC-NB-LRR R类蛋白。LOV1守护victorin的目标TRXh5。victorin对TRXh5的攻击增加了游离LOV1,导致了LOV1介导的HR。因此,c . victoriae利用植物对自身发病机制的防御反应[34].因为本研究也提示R基因参与了hst的产生答:alternata,苹果和苹果公司之间的关系有可能答:alternata和中间观察到的相似吗A. Thaliana.和c . victoriae.
Tabira等人。[39]表明,细胞死亡不是必需的苹果感染答:alternata苹果型,说明HR诱导的某一步骤是足够的答:alternata感染。值得注意的是答:alternata一种腐生植物,模仿生物营养病原体,引发抗性反应,利用宿主的防御系统进行入侵。然而,详细的分子机制背后的苹果侵染答:alternata苹果的病理类型需要阐明。
全面了解与之间的关系答:alternata和它的主人
hst产生之间的关系答:alternata蔷薇科的寄主植物与蔷薇科相似。例如,日本梨黑斑病和草莓黑斑病(F.×ananassa.杜赫)是由日本梨和草莓引起的致病型答:alternata分别为(3.,4].已经表明,宿主植物对疾病的敏感性是占主导地遗传的,类似于苹果中的alterararia斑点[16,40,41.].这些病原体产生的hst以宿主细胞的质膜为靶点[4].在日本梨中,易感基因一个已被映射到梨chr11之间的标记Mdo.chr11.28和Mdo.chr11.34 [17,因此完全对应于alt.苹果候选区域;草莓中易感基因的染色体位置尚不清楚。的答:alternata苹果病型最近被证明在欧洲梨(p .普通的l .) [42.].虽然还没有对遗传模式进行研究,但am毒素可诱导特定欧洲梨品种(如Le lecectier和General Leclerc)叶片的静脉坏死,但在“Bartlett”中没有[42.,表明存在类似的hst产生答:alternata-东道主关系在欧洲梨。基于这些发现,我们假设答:alternata利用植物防御系统表达对蔷薇科植物的致病性,并且蔷薇科宿主的基因参与了对蔷薇科植物的易感答:alternata可以在功能上保守。
抗斑点病苹果的标记辅助育种
利用三种引物(Alt-F、Alt-R和Alt-specific)对其进行评分alt.通过对现代育种先驱和老品种的基因型分析,表明该标记在抗黑斑苹果育种中的应用价值。结果表明,12 bp的引物与易感表型的共分离表明对链格孢斑点病的易感性来源单一,且引物与链格孢斑点病的因果多态性之间存在足够的连锁不平衡alt..然而,它并没有从抗性品种中区分出“金鲜”等中等抗性品种,这需要在未来的研究中进行研究。
结论
CC-NB-LRR类R蛋白被鉴定为有希望的候选基因alt..这是第一个发现HR诱导控制hst产生敏感性/耐药的候选基因的研究答:alternata疾病。这一发现提供了新的洞察力融入了HST生产之间的关系答:alternata和宿主植物。这些信息将有助于开发更好的疾病控制策略,也将提高我们对植物防御机制和真菌致病性共同进化的理解。最重要的是,本研究开发的DNA标记可作为标记辅助育种抗斑点病苹果的工具。
方法
植物材料和DNA提取
总共797华氏度1由15个易感链格孢菌(alt./alt)和 - 售伴(alt/alt)为本研究的主要材料(表1).其中包括114华氏度1由' SD '和' Jonathan '之间的互交衍生而来的植物,此前已评估它们对Alternaria blotch的抗性[43.].这项研究中使用的易感材料来自于共同的创始人“Delicious”(易感,alt./alt;附加文件1:图S1)。此外,上述8个现代世界苹果品种和35个旧世界苹果品种的创始者[15]也包括在本研究中(附加文件7:表S3)。所有的苹果基因型都是在日本盛冈NARO果树和茶叶科学研究所的苹果研究站种植和维护的。
基因组DNA从所有F中分离1后代和他们的父母。简单地说,将100 mg嫩叶在液氮中磨碎,并与1 ml分离缓冲液(10% PEG 6000, 100 mM Tris-HCl [pH 8.0], 350 mM山梨糖醇,50 mM EDTA [pH 8.0])在50°C下培养30分钟。按照制造商说明使用DNA提取设备PI-50α (Kurabo,大阪,日本)提取基因组DNA。
alterararia斑块抗性评估
的单孢子分离物答:alternata应用AKI-3对苹果的斑点病抗性进行了评价。接种是使用如前所述的离叶法进行的[15].简而言之,五个,第二或第三个最小的叶子被从每个植物的生长芽中除去并涂有2×10的悬浮液5用喷雾机测定AKI-3分离株的分生孢子。接种后的叶片在20℃塑料室黑暗中培养48 h。每片叶子的抗性水平按0(无明显症状)到5(几乎整个叶子完全坏死)的等级进行评分,如前所述[15].为确定某一基因型的抗性水平,取同一基因型的所有叶片的抗性评分平均值。基因型抗性水平的评分略有修改,来自Abe等[15];基因型分为耐药型(平均评分≤0.5分)、中耐型(平均评分0.5 ~ 2.5分)和易感型(平均评分> 2.5分)。
SSR标记和联系分析
SSR标记(Mdo.chr11.1-11.44)以前开发用于精细测绘一个基因,负责日本梨(Pyrus pyrifolianakai)到黑点疾病[17],用于初始标记富集和精细映射alt.轨迹(附加文件2:表S1)。这些标记由跨越苹果基因组1.0初级组装的苹果基因组1.0版本的Cher 11的Contig开发[44.]对应alt.的位置。此外,在同一组装体上还开发出了新的SSR标记。批Primer3 [45.]用于识别SSRs(表2)和底漆设计。这些标记物的PCR扩增和检测如前所述[46.].使用JOINMAP 4.1版进行联动分析和遗传地图结构[47.].利用伪测交作图策略计算标记间的遗传距离[48.利用回归映射算法和Kosambi的地图功能。最低LOD评分为10.0,用于建立连锁组。
BAC图书馆建设和霰弹枪测序
如前所述构建了“SD”的BAC库[49.].简而言之,消化了从'SD'叶中分离的核DNA欣dIII限制性内切核酸酶。将第一次试验时大小为100-180 kb且稍短于第二次试验时的DNA片段连接到BAC载体pindigobac5 (Epicentre, Illumina)上,转化为大肠杆菌, ElectroMAX DH10B细胞(Invitrogen, Life Technologies)。取菌落,转移到384孔板上的LB培养基上,在−80℃下保存。
识别跨越的克隆alt.利用4个SSR标记(Mdo.chr11.3、Mdo.chr11.34、3_34-12和Mdo.chr11.33 m)筛选BAC克隆。采用pcr扩增片段长度进行鉴定alt.- 要么alt- 分配的克隆。因为这alt-相关等位基因3_34-12和Mdo.chr11.33 m未被鉴定,这些标记只能检测到alt.- 分配的克隆。选择的BAC克隆的DNA随机剪切和使用ABI 3730XL测序仪(Applied Biosystems,Life Technologies)与普通前向和反向引物和染料终止剂方法进行测序。使用PHRED和PHRAP软件包组装霰弹枪序列[50.,51.].为了填补组装的BAC contigs之间的任何缝隙,使用其他方法进行额外的散弹测序,如染料引物和转座子标签测序[52.].
在硅基因的预测和表征
两个BAC无性系(SD-178_L15和SD-241_O01)和一个双单倍体系‘Golden Delicious’(GDDH13)的部分序列[18],按照SD-178_L15裁剪,进行硅分析。使用重复掩码识别转座元件的核苷酸序列(http://repeatmasker.org.)被替换为预测开放阅读帧(orf)之前的Ns。使用FGENESH进行ORF预测[53.]用Dicot植物的算法。预测的ORFS针对国家生物技术信息中心的非还原(NR)蛋白质数据库(NCBI;https://blast.ncbi.nlm.nih.gov/),使用InterProScan查找保守域[54.].使用欧洲分子生物学实验室(Embl;http://www.ebi.ac.uk/Tools/psa/)和日本DNA数据库(DDBJ;http://clustalw.ddbj.nig.ac.jp/index.php?lang=en.),分别。
DNA的标志alt.
根据BAC克隆SD-178_L15的序列设计了3条引物:Alt-F (5 ' -ATGTGTTTTATCCATCCAATTACG-3 ')、Alt-R (5 ' - aagttcaaatctgactccgcta -3 ')和Alt-specific (5 ' -GCCAGGGAGACTAAATTTTAAACTAAT-3 ')。使用GoTaq Hot Start Master Mix (Promega, Madison, WI, USA)对所有三种引物进行pcr。PCR条件包括94°C初始变性2 min, 94°C变性30 s, 55°C退火30 s, 72°C延伸30 s, 72°C延伸10 min, 35个循环。
参考文献
- 1.
链孢属的生物学、流行病学和致病性。圣保罗:APS出版社;1994.
- 2.
Thomma BPHJ。alternaria.SPP ::从一般嗜血物质到特定的寄生虫。莫尔植物途径。2003; 4:225-36。
- 3.
Akimitsu K, Tsuge T, Kodama M, Yamamoto M, Otani H。alternaria.寄主选择毒素:植物病害的决定因素。植物病理学杂志。2014;80:109-22。
- 4.
等。植物病原真菌产生的宿主选择性毒素主产.FEMS Microbiol Rev. 2013; 37:44-66。
- 5。
Johnson Lj,Johnson Rd,Akamatsu H,Salamiah A,Otani H,Kohmoto K,等。来自条件可分配的染色体的自发丧失主产苹果病型导致毒素产量和致病性的丧失。咕咕叫麝猫。2001;40:65 - 72。
- 6。
Harimoto Y, hata R, Kodama M, Yamamoto M, Otani H, tge T.在苹果病型中控制am毒素生物合成和致病性的多余染色体编码基因的表达谱主产.Mol植物微生物相互作用。2007; 20:1463-76。
- 7。
Harimoto Y,Tanaka T,Kodama M,Yamamoto M,Otani H,Tsuge T.MAMT2的多个副本是Apple Pathotype的先决条件主产产生足够的AM-毒素以表达致病性。J Gen Plant Pathol。2008; 74:222-9。
- 8.
Ohtani K,Yamamoto M,Akimitsu K.敏感性主产柑橘中的毒素,因为改变了线粒体RNA处理过程。美国国立科学研究院2002;99:2439-44。
- 9.
Brandwagt BF,Mesbah La,Takken Flw,Laurent PL,Knppers Tja,Hiles J等人。番茄的长寿保证基因同源物介导抗性主产f。SpLycopersici.毒素和伏马毒素B1.美国国家科学学院2000;97:4961-6。
- 10.
田志刚,田志刚,田志刚,等。互隔链孢霉毒素的研究进展alternaria mali.罗伯茨。Chem Lett。1974年; 3:635-8。
- 11.
am -毒素I和II的结构,寄主特异性植物毒性代谢产物alternaria mali..农业生物化学。1975;39:1115-22。
- 12.
Ueno T, Nakashima T, Umemoto M, Fukami H, Lee SN, Izumiya N.质谱分析alternaria mali.毒素和相关环糊精肽。BIOL质谱。1977; 4:134-42。
- 13.
Sawamura K.苹果和梨疾病的纲要。在:琼斯al,aldwinkle hs,编辑。alternaria斑点。圣保罗:APS媒体;1990. p。24-5。
- 14.
filajdic n,sutton tb。识别和分配alternaria mali.不同品种苹果对黑链格孢病的敏感性。工厂说。1991;75:1045-8。
- 15.
Abe K,Iwanami H,Kotoda N,Moriya S,Takahashi S.苹果基因型的评估和马吕斯种对Alternaria斑点病的抗性主产苹果病型的分离叶法研究。植物品种。2010;129:208-18。
- 16。
Saito K,Takeda K.苹果中患者抗性抗性的遗传分析。日本J品种。1984; 34:197-209。
- 17。
Terakami S, Moriya S, Adachi Y, Kunihisa M, Nishitani C, Saito T, et al.日本梨黑斑病易感基因的精细定位Pyrus pyrifolia纳街)。Sci繁殖。2016;66:271 - 80。
- 18.
Daccord M,Celton JM,Linsmith G,Becker C,Choisne N等人。高品质的德诺族组装苹果基因组和早期水果发育的甲虫动态。NAT Genet。2017; 48:1099-106。
- 19.
李啊,张丽,张Z,孔博,程泽。一种简单的序列重复标记,与Apple的易感性相关联,引起的alertaria斑点主产苹果致病型。中国科学(d辑:地球科学)2011;
- 20.
范德维格WE,范考文MPW, Walser M, kode LP,等。横跨苹果的微卫星标记(马吕斯x家庭borkh。)基因组。树遗传学基因组织。2006; 2:202-24。
- 21.
李勇,Hirst PM,万勇,刘勇,周强,高华叶良性和主产中国主要苹果品种和砧木的苹果病型。HortScience。2012; 47:1241-4。
- 22.
谷谷,吉田。苹果抗病性的研究ⅰ。苹果品种和杂交种对斑点病的抗性研究。Bull Hort Res Sta Ser C. 1967; 5:9-19。
- 23.
王志强,王志强,王志强,等。不同品种对苹果赤星病反应的组织学研究alternaria mali.抢。公牛FAC AGRIC IWATE大学。1971; 10:217-31。
- 24.
苹果斑点病的研究2。在alternaria.sp。,alertaria斑点的因果生物和日本疾病的名称。公牛座位res stn系列。1963; 1:77-94。
- 25.
Kohmoto K,Taniguchi T,Nishimura S.苹果品种易感性之间的相关性alternaria mali.和对am毒素的敏感性。
- 26.
王志强,王志强,王志强,等。苹果(马吕斯x家庭以及蔷薇科的进化史。《公共科学图书馆•综合》。2014;9:e83844。
- 27。
Gururani MA, Venkatesh J, Upadhyaya CP, Nookaraju A, Pandey SK, Park SW。植物抗病基因研究现状及发展方向。植物病理学杂志。2012;78:51-65。
- 28。
Marone D, Russo MA, Laido G, De Leonardis AM, Mastrangelo AM。植物核苷酸结合位点-富亮氨酸重复序列(NBS-LRR)基因:宿主防御反应的主动守卫者。中华医学杂志。2013;14:7302-26。
- 29。
Axtell MJ, Staskawicz BJ。rps2特异性抗病性的起始拟南芥耦合到AVRRPT2定向消除RIN4。细胞。2003; 112:369-77。
- 30。
Mackey D,Belkhadir Y,Alonso JM,Ocker Jr,Dangl JL。拟南芥RIN4是III型毒力效应因子AvrRpt2的靶点,可调节rps2介导的耐药性。细胞。2003;112:379 - 89。
- 31。
麦凯,霍尔特BF III,韦格A, Dangl JL。RIN4与两III型效应分子,需要rpm1介导的耐药拟南芥.细胞。2003;108:743-54。
- 32.
朱利民,倪维文,刘爽,蔡炳辉,邢辉,王胜。苹果叶片响应的转录组学分析主产苹果致病型感染。植物学报2017;8:22。
- 33.
作者简介:王志强,男,博士,博士生导师。植物免疫系统中的细胞程序性死亡。Cell Death Differ. 2011; 18:1247-56。
- 34.
Wolpert TJ, Lorang JM。维多利亚枯萎病,防御完全颠倒了。植物病理学杂志。2016;95:8-13。
- 35.
Lorang JM, carkaci - sali N, Wolpert TJ。victorin敏感性的鉴定与表征拟南芥蒂利亚纳.植物微生物学报2004;17:577-82。
- 36.
Sweat TA, Wolpert TJ。硫氧还蛋白h5是由CC-NBS-LRR基因介导的victorin敏感性所必需的拟南芥蒂利亚纳.植物细胞。2007;19:673 - 87。
- 37.
loang J, Kidarsa T, Bradford CS, Gilbert B, Curtis M, Tzeng SC.《欺骗守卫:利用植物的防御机制研究疾病易感性》。科学。2012;338:659 - 62。
- 38.
Lorang JM, Sweat TA, Wolpert TJ。通过“抗性”基因赋予植物抗病能力。中国科学院院刊2007;104:14861-6。
- 39。
光诱导苹果和梨叶片对am毒素敏感性的研究主产苹果致病型。植物病理学杂志1989;55:567-78。
- 40。
日本梨黑斑病抗性研究。一、抗病遗传。Bull Hort Res Stn Japan A. 1973; 12:17-27。
- 41。
Yamamoto M,Namiki F,Nishimura S,Kohmoto K.培养的宿主特异性自杀毒素研究主产草莓派型造成的alertaria草莓品种morioka-16黑点。Ann Phytopath Soc Japan。1985; 51:530-35。
- 42。
Tanahashi M, Nakano T, Akamatsu H, Kodama M, Otani H, Osaki-Oka K。主产Apple Pathotype(一个.马里)导致欧洲梨黑斑。植物病理学杂志。2016;145:747 - 95。
- 43。
Moriya S, Terakami S, Iwanami H, Haji T, Okada K, Yamamoto T, et al.;遗传定位和标记辅助选择致链格孢斑点病易感基因主产苹果的病理类型。Acta长的矮。2013;976:555-60。
- 44.
Velasco r,zharkikh a,comuourtit j,dhingra a,cestaro a,kalyanaraman a等。驯化苹果的基因组(马吕斯×家庭borkh。)。NAT Genet。2010年。https://doi.org/10.1038/ng.654.
- 45.
尤FM,霍宁,强洋,罗明杰,马勇,韩东,等。BatchPrimer3:一个高通量的web应用于PCR和测序引物设计。BMC生物信息学。2008;9:253。
- 46.
Moriya S, Okada K, Haji T, Yamamoto T, Abe K有限公司,一个控制苹果柱状生长习性的基因(马吕斯×家庭Borkh。)联动组10.植物品种。2012; 131:641-7。
- 47.
van Ooijen JW (2006) JoinMap 4软件用于计算实验群体的遗传连锁图。瓦赫宁根Kyazma B.V
- 48.
Gratepaglia D,Sederoff R.遗传联系地图桉树茅和桉树urophylla使用伪testcross:映射策略和RAPD标记。遗传学。1994年; 137(4):1121-37。
- 49.
田中俊,田中俊,田志勇,等。水稻基因组文库的构建与鉴定粳稻品种,日本晴和BAC图书馆籼稻品种、Kasalath。澳大利亚农业生物资源研究所。2000;14:41-52。
- 50。
Ewing B, Green P.使用phred自动测序器追踪的碱基呼叫。2错误概率。基因组研究》1998;8:186 - 94。
- 51。
EWING B,Hillier L,Wendl MC,Green P.使用PHRED的自动定序器痕迹的基础呼叫。I.准确评估。Genome Res。1998年; 8:175-85。
- 52。
佐佐木,松本,山本K,坂田k, Baba T, Katayose Y,等。水稻1号染色体的基因组序列和结构。大自然。2002;420:312-6。
- 53。
Salamov AA, Solovyev VV。自始基因的发现果蝇基因组DNA。Genome Res。2000; 10:516-22。
- 54。
interproscan是InterPro签名识别方法的集成平台。生物信息学。2001;17:847-8。
致谢
不适用。
资金
这项工作得到了日本农林水产省的资助(基于基因组学的农业创新技术,HOR-2001)。资助机构在研究的设计、数据的收集、分析和解释以及手稿的撰写中没有作用。
数据和材料的可用性
BAC克隆的核苷酸序列分别用于DDBJ作为LC360748和LC360749,分别用于SD-178_L10和SD-241_O01。
作者信息
从属关系
贡献
SM,St,Ty和Ka构思和设计了实验。SM,KO,YA,TS和KA对植物材料进行了抗病性评估。SM和St进行分子标记的发育和检测。SM,ST,YK,HF,JW,HK和TY涉及BAC库的实验。SM和St分析了数据。SM起草了稿件。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
图S1。本研究使用的苹果易感材料系谱。(PDF 50 kb)
附加文件2:
表S1。标记富集分析中SSR标记的定位。(PDF 30 kb)
附加文件3:
表S2。显示基因型重组的图解alt.和侧翼标记。(PDF 38 KB)
附加文件4:
图S2。A6的两两对齐,预测ORF在alt.区域和XP_009379454.1,最类似于A6的基因,如数据库搜索所透露。(PDF 49 KB)
附加文件5:
图S3。预测候选基因的氨基酸序列比对alt.、A8、a2和G14。(PDF 37 kb)
附加文件6:
图S4。预测候选基因的氨基酸序列比对alt.、A10、a4和G16。(PDF 36 kb)
附加文件7:
表S3。创始者和老品种之间存在12 bp插入。(PDF 50 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Moriya, S., Terakami, S., Okada, K.等等。苹果(马吕斯×家庭到Alternaria blotch。BMC植物BIOL.19,132(2019)。https://doi.org/10.1186/s12870-019-1737-7
收到了:
接受:
发表:
关键词
- 主产
- 细菌人工染色体图书馆
- 抗病性
- Host-selective毒素
- 保护模式