摘要
背景
植物育种已被认为是控制真菌感染和减少伏马菌素积累最有效和环境安全的方法之一。然而,由于伏马菌素抗性遗传结构复杂,阻碍了传统育种的顺利进行,标记辅助选择是一种有效的选择方法。在本研究中,首次利用GWAS检测玉米籽粒对伏甲菌素积累抗性的高分辨率QTL,以补充已发表的镰刀菌穗腐病GWAS结果。
结果
共发现39个与玉米籽粒伏马菌素抗性显著相关的snp位点,并聚为17个QTL。新的伏马菌素含量qtl分别位于3.02、5.02、7.05和8.07。基于之前的研究,已注释的功能可能涉及对病原体的抗性的基因已经被强调。
结论
通过育种方法确定与玉米免疫应答信号有关的基因的有利功能变异,在减少伏马菌素对玉米籽粒污染的同时,不显著干扰菌丝的发育和生长,从而有利于玉米的内生行为镰刀菌素verticillioides.
背景
玉米核可以被不同的真菌物种产生的许多霉菌毒素污染,大多数属于属的物种曲霉属真菌,青霉菌要么镰刀菌素.关于核心毒素的核污染的担忧是全世界的传播,因为这些毒素是通过物种生物合成的赤恶苗病复杂的,如Fusarium proLiferatum.(松),F. subglutinans(Wollenw。&赖因金)和F. Verticillioides.(孢)尼伦伯格,其传染的玉米核在世界各地[1].伏马毒素已被证明毒性动物,并已通过国际研究机构列为可能对人类致癌癌症[2].在伏马菌素被发现的短短几年之后,寻找减少玉米籽粒受伏马菌素污染的策略就成为世界上许多地方的优先事项[3.],和植物育种已被提议作为最有效和对环境安全的方法来控制真菌感染,并减少烟曲霉毒素积累一个[4,5].然而,耐伏马菌素积累的复杂遗传结构可能会阻碍常规育种,这种遗传结构似乎由许多小效应的数量性状位点(QTL)控制[1].为了避免这一问题,作者试图找到与抗镰刀菌穗腐病(FER)和/或伏马菌素污染相关的基因相关的标记,并将其用于标记辅助选择程序[6,7,8,9,10.,11.,12.].许多研究专注于检测QTL以抵抗FER;除了染色体9中,QTL被鉴定为染色体9.然而,只有两项研究,其中QTL对玉米内核污染的抗肺部污染与FER的QTL一起定位;作者指出,检测到许多QTL与疾病特征有关[8,13.].如,此外,基因型相关系数伏马毒素的积累和FER之间报道均较高,范围从0.87至0.99,选择用于向FER电阻已经被提出作为一种更简单的方法来与伏马毒素[间接内核污染减少14.,15.,16.,17.].然而,埃勒和合作者[18.]进行选择用于向FER阻力并得出结论,选择用于减小FER可能具有有限的有效性,以提高对烟曲霉毒素积累的阻力。鉴于这些结果,更QTL研究,以检测涉及电阻随需要伏马毒素玉米污染特定的基因组区域。
利用双亲本后代的QTL定位是揭示特定性状遗传相关基因组区域的有力工具,但QTL分辨率较低。因此,由于标记与QTL之间缺乏紧密的连锁关系,可能会影响标记辅助选择(MAS)的有效性,因此通常在进行MAS之前对已检测到的QTL进行精细定位。精细定位使育种家可以显著降低QTL定位的置信区间,最终定位QTL背后的一个或多个基因;但这既昂贵又耗时。在这种情况下,使用自交系面板进行全基因组关联研究(GWAS)似乎是一种有效的替代方法,用于检测与伏马菌素污染玉米籽粒有关的抗性基因。GWAS已被广泛用于检测分子标记与抗FER或幼苗感染之间的关联[19.,20.,21.,22.,23.,24.,25.,26.].鉴定了与改善对FER抗性有显着相关的新型玉米基因座,每个基因座解释了少量的表型变异性。由于赋予抗病性更大的等位基因稀有并且存在于热带玉米的较高频率中,因此提出了Gwas作为鉴定热带玉米种质中的特异性FER抗性等位基因变体的有用工具,以使它们变得温带凹陷种质[19.,20.].在目前的研究,GWAS已首次在玉米籽粒中检测高分辨率QTL为抗伏马菌素累积执行。
玉米对FER抗性的候选基因已经在转录组、蛋白质组和代谢组研究中被提出,用于研究玉米对感染的反应镰刀菌素verticillioides对FER抗性水平对比的基因型[27,28,29,30.,31,32,33,34,35].抗病和感病自交系在对照条件下有差异转录积累的基因,以及接种后特异性诱导或下调抗病基因型的基因,可以作为揭示玉米对FER抗性机制的宝贵资源。特别是当它们位于包含qtl的基因组区域时。在本研究中,我们考虑了这些完整的信息,为检测伏马菌素污染的高分辨率QTL提出候选基因。
结果
籽粒中伏马菌素含量的遗传遗传力(0.42±0.08)较低,但与零有显著差异。基因型与环境交互作用对该性状也非常重要(见表)1),但跨环境的表型平均值将与基因型表现很好地对应,因为基因型x环境的显著影响更多地归因于基因型差异的异质性,而不是在不同环境中缺乏基因型表现的相关性[14.,36].2011年的数据离散度高于2010年1:在图之间S1),但Spearman相关系数平均化伏马菌素内容和那些在2010年和2011实验确定分别为0.834和0.830。近交系的蓝色值CML158Q,Pa875,CML218,CML228,Mo18W,GT112和HP301(属于不同种质组[37])在10年之下。
Fumonisin含量和FER之间的表型相关性不显着(0.40±0.32),同时两个特征之间的基因型相关性较高,显着(0.88±0.11)。然而,观察到QTL的QTL的共同定位,并观察到FER的QTL(数据未显示)。表型( - 0.18±0.05)和基因型( - 0.41±0.11)Fumonisin含量和丝天天之间的相关系数是阴性和显着的。
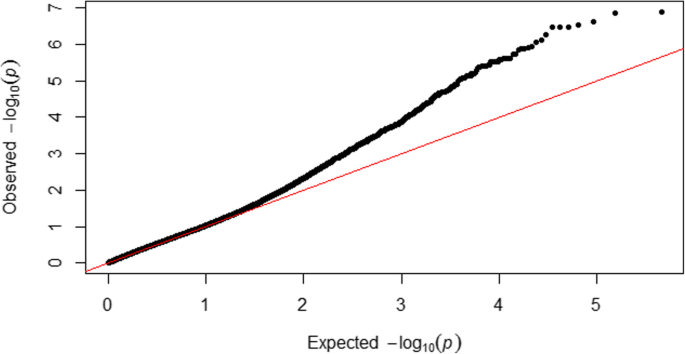
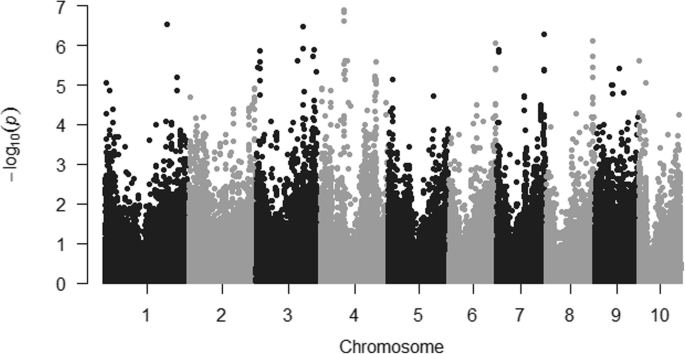
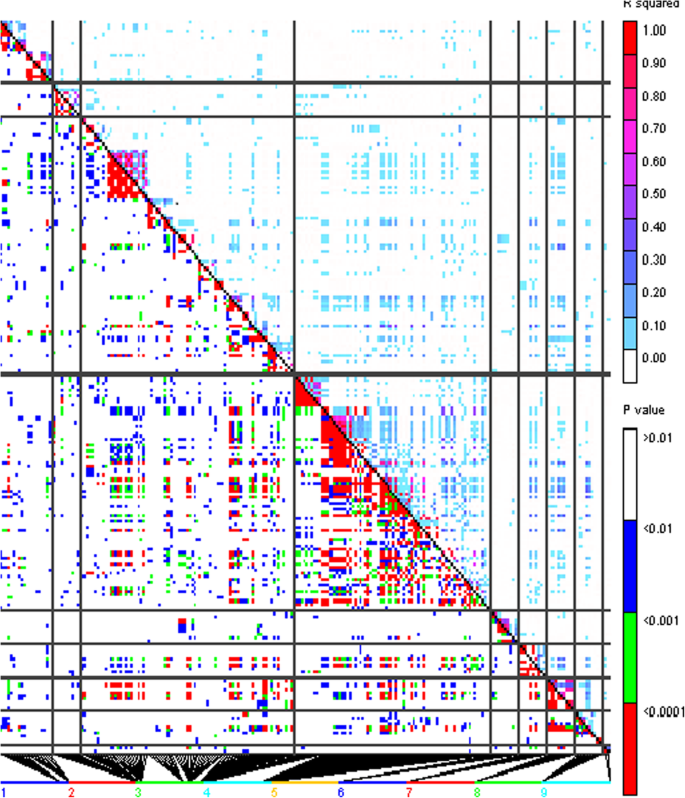
256个自交系聚为使用TASSEL最佳压缩选项11组,并且背景的遗传效应,由亲属关系矩阵模型化,占为伏马菌素含量表型变异的29%。所使用的MLM的“拟合度”被示出在图1;如预期的那样,离群值位于Q-Q图的上部,并分散在所有染色体上(图5)。1和2).然而,只有三十九个异常值超过了0.5的rmip阈值,并且可以被认为可与内核中的富马激酶积累可靠相关(表2).在连锁不平衡状态下,当显著的snp位于基因组区域时,它们被归类为一个独特的QTL (r2> 0.4),共产生17个与伏马菌素积累相关的qtl(表1)2).对于要在玉米籽粒烟曲霉毒素积累性显著的SNPs箱1.07,1.09,2.08,3.02,3.04,3.05,3.06,3.08,3.09,4.02,4.05,5.02,6.07,7.05,8.07,9.03被发现。在一般情况下,没有LD(R2 > 0.4) was found among SNPs associated with different QTLs, except between SNPs in QTLs at chromosomes 3 and 4 (Fig.3.).
QTL支持区间为数千~数百万bp,定位于B73基因组v2 (RefGen_v2) (ftp://ftp.ensemblgenomes.org/pub/plants/release-7/fasta/zea_mays/dna/),以及在B73基因组V4(RefGen_v4)38] (桌子2和附加文件2:表S1)。位于每个QTL的支撑间隔内(基于Refgen_v4)内的所有基因被认为是该QTL的候选基因(附加文件2表S1),并将讨论根据以往研究注释的功能可能涉及对病原体的抗性的基因。QTL定位于连锁不平衡高且置信区间超过2 Mbp的基因组区域,如bins 4.05和9.03,除了含有snp的基因外,没有候选基因。
讨论
自交系在内核烟曲霉毒素含量之间差异显著和在内核伏马菌素含量遗传遗传力低,但从零显著不同表示有自交系用于向烟曲霉毒素积累电阻之间加性遗传变异性。对伏马菌素含量的遗传相似,那些由红和荷兰报道[39,但比在基因较少的人群中观察到的小[14.,15.,16.].低富隆污染的低遗传性强调了基于稳定的QTL实现标记辅助选择方法的重要性,以增加玉米抗核污染的玉米抗性。在这种情况下,基于表型,标记辅助选择将比艰苦的和昂贵的选择程序更有效。
Fumonisin含量和FER之间缺乏显着的表型相关性可能是由于由于在同一实验中不利的分离物或/和气候条件的低致病性,因此在同一实验中,报告的同一近铬的FER值为中度[19.,而这些条件更有利于伏马菌素的积累,因为籽粒污染的平均值为58.4 ppm(三分之一的自交系的平均值在50 ppm以上,同时约10%的自交系的平均值在10 ppm以下)。那么,有利于伏马菌素积累而不是疾病发展的条件可以解释这两个性状之间缺乏表型相关性,与报道的结果相反[1],以及用于FER [没有检测QTL的19.使用同样的实验试验。
在以前的研究中,发现抽丝和烟曲霉毒素积累天之间的正相关系数[13.,14.];同时,在本研究中,伏马菌素含量与吐丝天数呈负相关。然而,对伏马菌素含量的qtl进行了共定位2)和吐丝天数(数据未显示)发生在4号染色体的5,405,928-5,466,378间,而伏马菌素含量增加和吐丝天数的等位基因似乎在偶联期相连。我们假设群体结构可能是目前研究中观察到的两个性状之间显著且正的基因型相关系数的原因,因为热带玉米自交系较晚,对FER的抗性等位基因频率较高[20.].因此,在去除随机遗传变异(用加性关系矩阵解释的变异)后,可以发现增加伏马菌素积累和延迟成熟的连锁遗传变异。
玉米籽粒中与伏马菌素积累显著相关的39个SNPs被归为17个高分辨率QTL,其中至少有4个位于之前研究未报道的新QTL后面[8,13.].这些新qtl分别位于3.02、5.02、7.05和8.07。除3.08,4.05,7.05和9.03箱中的特定区域外,以往GWAS中与FER显著相关的基因组区域没有重叠,一般与支持伏马菌素污染籽粒的QTL区间[19.,20.,21.,22.,23.,24.,25.].因此,这些QTL对于减少伏马菌素对籽粒的污染尤其有用,同时不显著干扰菌丝的发育和生长,因此,在已知有益的内生菌行为镰刀菌素verticillioides。镰刀菌素verticillioides已经被证明是通过促进生长和诱导防御相关的变化(如苗期细胞壁木质素沉积和成熟植物生长增加)来促进宿主健康的贡献者[40,41,42,43].然而,由于玉米伏马菌素污染的遗传特性是多基因的,育种应该基于基因组选择(GS)模型,而不是专注于确定所检测的QTL的有利遗传变异的标记辅助方法。然而,利用逐步线性回归混合模型将GWAS和GS统一在一个单一的统计模型中,精确定位QTL可以提高基因组预测的准确性[44].
候选基因
QTL支持间隔包括LD中的QTL周围区域(r2> 0.4)。支持区间内的所有基因作为候选基因,利用MaizeGDB基因组浏览器对其进行鉴定和表征。然而,讨论将主要集中在可能涉及抗病原体的注释功能的基因。
毒素的生物合成似乎被连接到主机的殖民统治和一些镰刀菌素verticillioides在这两个过程中起重要作用的基因已被描述[40,45,46].例如,基因FUG1起着减轻与主机环境相关联的应力的作用,作为基因调控网络底层玉米谷粒发病机制和伏马菌素生物合成的关键组成部分。因此,预计参与了对真菌病害防御某些宿主基因也将被牵连毒素调制。
植物有一种天生的免疫系统来防御病原体[47].模式触发的免疫(PTI)或基底防御反应是由识别病原体相关分子模式(PAMP)的植物模式识别受体(PRR)介导的,但植物病原体可以通过有助于病原体毒力的效应抑制这种基础防御反应。然而,二次免疫应答,抗性蛋白质(RPS)介导的抗性蛋白质(RPS)介导的脑靶诱导的宿主靶标的扰动,允许植物来止止病原体生长。另外,在诱导局部免疫应答期间,可以激活全身获得的抗性(SAR)。PTI似乎在玉米的抵抗力中发挥着主要作用镰刀菌镰刀菌,玉米抗性将以某种方式通过pti诱导获得性系统免疫实现,其中ABA、SA和JA激素信号通路可能参与[33].因此,直接参与植物免疫应答的基因值得特别关注,因为它们是发现显著关联的首选候选基因。
Zm00001d042659(在RefGenB73_v4的3号染色体上≈175 Mbp)被注释为a蛋白质src2样蛋白质基因,因此,可以在识别的PAMP的牵连,因为在胡椒粉,SRC2蛋白充当免疫应答的真菌诱导的所需相互作用配偶[48].含有l型凝集素结构域的受体激酶被认为是病原菌入侵的植物传感器,因此,Zm00001d043781基因被注释为anl型凝集素结构域包含受体激酶IV.1QTL 3.08 [49].
参与ETI应答的最大一类耐药蛋白包括核苷酸结合亮氨酸丰富重复(NB-LRR)蛋白。在拟南芥,基因LOV1编码一种典型的NB-LRR蛋白,但这种蛋白是独特的,因为它对真菌毒素victorin和真菌敏感Cochliobolus victoriae.在目前的研究中,一个推定的非活性疾病易感蛋白LOV1(Zm00001d032376)基因位于QTL的置信区间内为1.07,并提出作为可能的候选基因对于QTL。
同样,参与植物免疫应答信号传导的基因也可能参与植物抗性。水杨酸是植物局部和系统获得性抗性所必需的一种防御激素。水杨酸是由胆草酸途径的最终产物chorismate合成的,尽管完整的生物合成路线尚未确定。然后,基因参与合唱的生物合成和对病原体效应蛋白的反应,如磷酸-2-脱氢-3-脱氧庚酸族醛糖酶基因是检测到QTL的良好候选基因[50,51].基因Zm00001d013611已被提议作为磷酸-2-脱氢-3-脱氧庚酯醛糖酶2,叶片状QTL为5.02。除了chorismate通路的结构基因外,已证实具有调控作用的基因可以作为候选基因突出显示。Zm00001d032368编码的蛋白质SAR缺陷1 (SARD1)是1.07中发现的QTL的一个很好的候选,因为SARD1已被报道为水杨酸积累所需的正调控因子[52].Zm00001d033389被提议为1.09的优选候选基因QTL基因(包含在QTL的置信区间跨越从261226685到261380422 RefGen_v4),因为用于VQ基序家族蛋白编纂。在SA-的VQ家族成员发挥积极或消极的角色和/或JA介导的植物免疫反应[53].
由于植物素可以通过与SA信号传递的对抗反射来干扰植物防御电路[54[未来验证的另一组有趣的基因包括在恶化信号传导中具有经过验证的或可能功能的基因[ZM00001D039513(辅助/ IAA-transcription因子7在bin 3.02), Zm00001d044172 (srph1 - SGT1抗病同源物1在Bin 3.09)和ZM00001D022400(F-box蛋白SKIP5基因在bin 7.05)] [55[ZM00001D04841(可能的patatin-like磷脂酶基因在bin 4.02)] [56].调控生长素信号转导和转运的基因对玉米幼苗抗赤霉病的可能影响镰刀菌素graminearum已经显示出[57].通常,基于许多病原体 - 宿主相互作用的结果提出了通过养蛋白和/或信号通路的植物疾病抗性的调节[54].最后,还显示了规范细胞周期调节剂,例如细胞周期蛋白依赖性激酶抑制剂,形成直接参与Eti的信号通路的一部分,并且还可以有助于基底阻力[58].因此,Zm00001d048837和Zm00001d013610标注为可能的细胞周期蛋白依赖性激酶抑制剂可分别在4.02和5.02,强调作为候选基因的QTL,而值得特别注意那枚。
除水杨酸外,植物脂质代谢物是局部和系统防御病原体的重要信号分子[59].更具体地说,通过多不饱和脂肪酸氧化产生的真菌和植物oxylipin(包括众所周知的茉莉酸)在植物病原生态系统中具有信号的原始作用[60].真菌oxylipin试图重编程PTI,反过来,宿主通过产生自己的oxylipin来阻止病原体感染:然而,真菌oxylipin也可以通过激活宿主oxylipin通路的基因来诱导效应触发易感性(Effector Triggered Susceptibility, ETS),例如ZmLOX3,抑制玉米oxylipin途径的防御相关分支,有利于镰刀菌素verticillioides毒力和伏马菌素积累[60,61].鞘脂,在微生物和哺乳动物中的宿主之间的细腻手臂上的调节中也发挥着重要作用。鞘脂在免疫植物响应信号中的类似累及可以基于稀缺研究,鉴定鞘脂代谢的基因作为抗真菌感染的重要因素[62,63.].在田间条件下,玉米籽粒中奥昔利平和鞘脂代谢受到干扰镰刀菌素verticillioides生长和伏马菌素生产;植物脂肪氧化酶基因和基因茉莉酸生物合成的早期激活出现重要因素赋予抗性[35,64.,65.].因此,Zm00001d039768(酰基辅酶A氧化酶的过氧化物酶体4基因)在3.04其中包含的SNPs显著S3_15,056,252,S3_15,057,326,S3_15,057,331和S3_15,057,578拟为QTL;和Zm00001d044175(中性/碱性非溶酶体神经酰胺酶基因)在3.09提出了QTL。
最后,植物的另一种脂质成分,角质层,也可以在植物抵御真菌的攻击中发挥重要作用。植物角质层是由植物气生器官的表皮细胞产生的一层保护层,为真菌进入植物组织提供了第一道必须克服的屏障。然而,角质层也提供了化学和物理线索,这对许多真菌病原体的基本感染结构的发展是必要的,真菌对角质层改变的感知可能对促进植物防御是必要的[66.].在水稻中,异常的角质层形成可能会影响植物防御半生物营养真菌的信号,magnaporthe oryzae.[67.].因此,基因myb28(Zm00001d050400),其是同源的ATMYB16参与细胞内角质层生物合成调控的基因拟南芥[68.7.05的QTL可能是一个很好的候选人。
有许多致病性相关的变化,遵循PAMP感知,如富集的cytosolic Ca的助核+2和生产/积累反应性氧(ROS)。参与保护植物组织免受氧化损伤和ROS解毒的基因可能在玉米防御中是重要的镰刀菌素verticillioides;抗性基因型中抗氧化成分的增加似乎对玉米籽粒防备病原体攻击至关重要[34].因此,参与ROS生产和ROS-Scavenging和ROS解毒的基因也是良好的候选者:ZM00001D042061(可能的NADPH:醌氧代酶基因)被提出为3.05的QTL的候选基因;ZM00001D042555(一种推定的醇脱氢酶基因)在≈171mbp的乙二虫373_v4(bin 3.06)中的染色体3中的qtl;ZM00001D043787,ZM00001D043789和ZM00001D043795(谷胱甘肽转移酶基因)和ZM00001D043782 [ZMRAV1.,这可能通过调节参与ROS清除的基因的表达来改善压力耐受性[69.[]为3.08位QTL;QTL的基因Zm00001d046455(预测具有氧化还原酶和转移酶活性的蛋白编码基因)位于9.03。
Lanubille和统一者观察到抗性基因型对核感染的响应镰刀菌素verticillioides其特征是组成性表达,并通过迅速和增强的一些关键基因的诱导[30.].因此,当前GWAS中的候选基因,即在控制条件下,在抗性和易感基因型中转录差异的基因,以及被特异性修饰的基因镰刀菌素verticillioides在Lanubile等人的研究中,耐药基因型的感染[30.](ZM00001D007025,ZM00001D007032和ZM00001D043798)将应得特别关注。基因ZM00001D007025和ZM00001D007032(分别名为GRMZM2G422537和GRMZM2G035356)的功能尚不清楚;虽然ZM00001D043798(以GRMZM2G448710之前命名),a叶锈病10抗病位点受体样蛋白激酶基因,可能参与对真菌的基础防御[70].
结论
已经证实了玉米抗性血清抗核污染的复杂性,因为基因型X环境相互作用对表型变异具有重要贡献,并且许多具有小效果的基因会有助于遗传变异。共发现39个与玉米籽粒伏马菌素抗性显著相关的snp位点,并聚为17个QTL。新的伏马菌素含量qtl分别位于3.02、5.02、7.05和8.07。使用GWAS发现的QTL的高分辨率使我们能够为这些QTL提出候选基因;许多候选人涉及玉米免疫响应信号传导。这些基因的功能变异可能特别有助于减少富马菌素的核污染而不会显着干扰菌丝体的发育和生长,因此,在有益的内生行为中镰刀菌素verticillioides.这些候选基因在玉米籽粒的贡献耐fuminisin积累的验证将是未来工作的重点。
方法
植物材料和田间试验
来自玉米多样性面板的270个近交系的子集(由302种近交线组成),其在世界各地的公共育种部门提供的大部分多样性71.在2010年和2011年进行了评估镰刀菌素verticillioides.北中央区域植物介绍站(NCRPIS)在AME,爱荷华州的北部地区植物介绍站(NCRPIS)提供了种子,并在附加档案中显示了NCRPIS登录名称3.表S2。
评估工作在西班牙Pontevedra(42°24 ' N, 8°38 ' W,海拔20米)进行,采用18 × 15 α-格子设计,有两个重复。试验采用手工种植,每个试验区每行间隔0.8 m, 29座两粒山间隔0.18 m。地块进行了过度种植和疏植,最终密度约为70,000株公顷−1.在每一行中,在丝绸日期七到14天之间,用局部毒性孤立的孢子悬浮液的两个毫升接种了五次初级耳朵镰刀菌素verticillioides使用经过测试的内核接种协议[72.].孢子悬浮液含有106每毫升孢子和注入使用四针疫苗接种耳的中心。在oculated ears from each row were collected 2 months after inoculation, dried at 35 °C for 1 week, and shelled. From each plot, a representative kernel sample of approximately 200 g was ground and stored at 4 °C until performing chemical analyses. Kernels were ground through a 0.75 mm screen in a Pulverisette 14 rotor mill (Fritsch GmbH, Oberstein, Germany).
地面样本被送往西班牙Lleida,大学食品科技系用于测定总伏马菌素(伏马菌素B的1,B.2, B3.)内容使用商品化ELISA试剂盒(R-Biopharm Rhône Ltd., Glasgow, Scotland, UK)。此试剂盒是一个竞争性的酶免疫分析定量伏马菌素残留玉米。该试验的回收率约为60%,平均变异系数约为8%;specifities B1,B.2, B3.分别为100%、40%左右和近100%,检测限为0.025 ppm (mg kg−1).样品的提取和制备,以及测试性能,进行了描述的商业套件。
基因型数据
我们使用了两年中具有表型数据的256个自产品系的基因型,用于一套大约99万个SNP标记(AllZeaGBSv2.7),该SNP标记来自基因分型测序(GBS)策略(Elshire et al. 2011)并提升到AGPv3 (Glaubitz et al. 2014) [73.].排除了0号染色体上的SNPs、单体snp和多等位snp以及插入/缺失多态性(INDELs)。然后,首先对数据集进行过滤,筛选出缺失基因型数据超过20%,次要等位基因频率(MAF)小于5%的snp。在使用Beagle v4.0 (Browning and Browning 2016)进行输入后,在将杂合子基因型设置为分析中缺失后,进行第二次过滤(> 20%和MAF < 5%)。分布在玉米基因组中的226,446个经过过滤的SNPs被用于GWAS分析。在Plink v1.9软件中进行基于连锁不平衡的修剪后,获得了一个约99k的SNPs子集,并用于在Tassel 5中执行亲属矩阵(k)。
统计分析
遗传力(\({\ widehat {H}} ^ 2 \))在不同环境估计了如由Holland等人所描述的家庭均值的基础上伏马菌素污染。[74.].伏马菌素内容和其他数据之间的遗传和表型的相关性以前出版的[75.]荷兰之后计算纯洁和恐惧的天数[76.].采用SAS混合模型程序(PROC mixed)对每个自交系进行最佳线性无偏估计(BLUE),并将自交系视为固定效应,将年内复制、年内复制*年和年复制视为随机效应。Line BLUEs被用来演奏GWAS。
基于混合线性模型(MLM)的基因组关联分析在Tassel v5.2.25中进行[77.].流苏使用的MLM是
在哪里y是表型的载体(蓝调),β是一个固定效应的载体,包括测试的SNP标记,u是随机添加剂效应(自交系)的矢量,X和Z表示矩阵,以及e是随机残差向量。The variance of random line effects was modeled as Var(u) = K\({\σ}_a ^ 2 \), 在哪里K是个n × n成对血缘关系系数的矩阵和\({\σ}_a ^ 2 \)估计的添加剂遗传方差是[78.].在Tassel中使用最优压缩水平(compressed MLM)和先前确定的种群参数(P3D)来获得方差分量的限制性最大似然估计[79.].
为了识别与性状关联最密切的snp, GWAS分析采用了子抽样或子标记程序[80,81.].使用R软件生成的100个分布数据集中的每一个[82.包含来自多样性群体的80%的近交系的随机样品。只有SNP标记只确定在p< 1 × 10−4并在≥50个子样本中检测到,即重样模型包含概率(RMIP)阈值为0.50,认为与所研究性状显著相关。在雄穗中分析了与伏马菌素含量显著相关的snp之间的连锁不平衡(LD)。
候选基因的选择
我们还在每个重要的SNP周围检查了基因组区域中的LD,以使支撑间隔用于重要的关联。支持间隔将包括LD中的周围区域(r2> 0.4)。支持区间内包含的所有基因均视为候选基因,利用MaizeGDB基因组浏览器对其进行了识别和表征[83.].虽然SNP位点参考的是玉米B73 RefGen_v2,但LD中该区域侧翼的基因定位在玉米B73 RefGen_v4中,用于在最新版本的B73序列中搜索候选基因。
缩写
- fer:
-
镰刀菌素耳朵腐烂
- g:
-
基因选择
- GWAS:
-
基因组协会研究
- LD:
-
连锁不平衡
- 马斯:
-
分子标记辅助选择
- QTLS:
-
数量性状位点
- SNP:
-
单核苷酸多态性
参考
- 1。
圣地亚哥R,曹A,玉米粒及玉米的农艺管理和繁殖的影响涉及烟曲霉毒素积累Butron A.遗传因素。毒素。2015; 7(8):3267-96。
- 2。
研究:Fumonisin B1.有时候草药,氧氧膦酸氧胞苷,萘和苯乙烯。载:82国际上关于癌症研究的国际机构,对人类的致癌风险评估。里昂,法国;2002:301-306。
- 3.
Munkvold GP, desjardin AE。玉米中的伏马菌素——我们能减少它们的发生吗?工厂说。1997;81(6):556 - 65。
- 4.
Jouany JP。预防、净化和减少饲料中霉菌毒素毒性的方法。饲料科学技术。2007;137(3-4):342-62。
- 5.
Eller MS, Holland JB, Payne GA。玉米伏马菌素污染抗性改良育种。毒素启2008;27(3 - 4):371 - 89。
- 6.
丁建强,王雪梅,钱德尔,闫建斌,李建生。玉米穗腐病抗性的RIL群体QTL定位摩尔品种。2008;22(3):395 - 403。
- 7。
Pérez-Brito D,Jeffers D,González-de-Leónd,Khairallah M,Cortés-Cruz M,Velázquez-cardelas G,Azpíroz-Rivero S,Srinivasan G. QTL Moniliforme耳朵腐烂在墨西哥高地玉米腐败抗腐蚀性的QTL映射。农业古代。2001; 35:181-96。
- 8。
罗伯逊-霍伊特LA, Jines MP, Balint-Kurti PJ, Kleinschmidt CE, White DG, Payne GA, Maragos CM, Molnar TL, Holland JB。玉米穗腐病和伏马菌素抗性的QTL定位作物科学。2006;46(4):1734 - 43。
- 9。
陈建峰,丁建强,李慧敏,李志明,孙晓东,李建军,王瑞霞,戴晓东,董海峰,宋文斌,等。玉米穗腐镰刀菌抗性数量性状位点的检测与鉴定。摩尔品种。2012;30(4):1649 - 56。
- 10。
Giomi GM, Kreff ED, Iglesias J, faguel CM, Fernandez M, Oviedo MS, Presello DA。阿根廷玉米种质抗镰刀菌和赤霉病的数量性状位点。Euphytica。2016;211(3):287 - 94。
- 11.
张芳,万新强,潘广田。玉米穗腐病抗性的QTL定位。1.利用微卫星和AFLP标记构建图谱。应用遗传学报。2006;47(1):9-15。
- 12.
李泽,丁杰克,王汝克,陈俊,太阳XD,陈德,宋WB,董鹤,戴XD,夏ZL等。一种新的QTL,用于玉米抗镰刀菌腐烂。J Appl Genetics。2011; 52(4):403-6。
- 13.
Maschietto V, Colombi C, Pirona R, Pea G, Strozzi F, Marocco A, Rossini L, Lanubile A.玉米穗腐病和伏马菌素抗性QTL定位及候选基因。BMC Plant Biol. 2017;17:20。
- 14.
罗伯逊洛杉矶,克莱因施密特CE,怀特DG,佩恩GA,马戈斯CM,霍兰德JB。两个玉米群体穗腐病抗性和伏马菌素抗性的遗传力及其相关性。作物科学。2006;46(1):353 - 61。
- 15.
Löfflerm,凯斯尔B,Ouzunova M,Miedaner T.在欧洲玉米中降低乳糜毒素浓度的线和Testcross性能之间的协变性,丝网通道接种两种镰刀菌物种。Al Appl Genet。2011; 122(5):925-34。
- 16.
Bolduan C,Miedaner T,SchipPrack W,Dhillon BS,Melchinger AE。欧洲早期玉米近红细胞抗耳腐蚀和霉菌毒素污染的遗传变异。农作物科学。2009; 49(6):2019-28。
- 17。
Löffler M, Miedaner T, Kessel B, Ouzunova M.对3个成熟组接种2种镰刀菌的欧洲玉米穗腐病的霉菌毒素积累及其评级。Euphytica。2010;174(2):153 - 64。
- 18。
Eller Ms,Payne Ga,荷兰jb。在先进的远程玉米线及其Topcross杂种中减少镰刀虫腐蚀和富马激酶含量的选择。农作物科学。2010; 50(6):2249-60。
- 19。
ZILA CT,费尔南多萨马约亚L,圣地亚哥R,Butron A,荷兰JB。全基因组关联研究揭示了与在玉米芯多样性面板镰刀菌穗腐病抗性相关的基因。G3-基因基因组遗传学。2013; 3(11):2095-104。
- 20。
Zila CT, Ogut F, Romay MC, Gardner CA, Buckler ES, Holland JB。美国玉米自交系穗腐病全基因组关联研究。BMC Plant Biol. 2014;14:372。
- 21。
ju m,周Zj,mu c,张xc,高jy,梁yk,陈俊,吴yb,李xp,wang sw等。通过组合QTL映射和基因组关联分析来解剖玉米镰刀菌的遗传建筑腐蚀性抗腐蚀性。SCI REP。2017; 7:46446。
- 22。
Coan MMD, Senhorinho HJC, Pinto RJB, Scapim CA, Tessmann DJ, Williams WP, Warburton ML镰刀菌素verticillioides在热带场玉米和爆米花核心集合中。农作物科学。2018; 58(2):564-78。
- 23。
陈家,Shrestha R,丁JQ,郑HJ,Mu Ch,Wu Jy,Mahuku G. Genome-Indiual Assocuation研究和QTL映射揭示了热带玉米种质中镰刀虫腐蚀性相关的基因组基因座。G3-基因基因组遗传学。2016; 6(12):3803-15。
- 24。
De Jong G,Pamplona Aka,Von Pinho RG,Balestre M.基因组 - 宽关联分析耳腐蚀性造成的镰刀菌素verticillioides在玉米。基因组学,2018;110(5):291 - 303。
- 25.
Butron A, Santiago R, Cao A, Samayoa LF, Malvar RA。玉米多亲本先进代杂交群体穗腐病抗性qtl分析工厂说》2019。(https://doi.org/10.1094/PDIS-09-18-1669-RE).
- 26.
Stagnati L,Lanubile A,萨马约亚LF,Bragalanti男,GIORNI P,Busconi男,荷兰JB,马罗科答:全基因组关联研究揭示了与tesistance相关联的标记和基因镰刀菌素verticillioides玉米多样性面板中幼苗感染。G3(Bethesda,MD)。2019; 9(2):571-9。
- 27.
元GS,张ZM评选,湘K,沈哟,Du J,林HJ,刘L,赵潘GT MJ。不同的抗性和敏感玉米基因表达内在的反应镰刀菌素verticillioides感染。植物学报2013;31(4):925-35。
- 28.
Campos-Bermudez VA, faguel CM, Tronconi MA, Casati P, Presello DA, Andreo CS。与感染相关的转录和代谢变化镰刀菌素verticillioides玉米穗腐病抗性对比的自交系。《公共科学图书馆•综合》。2013;8(4):10。
- 29。
黄萎病镰刀菌(Fusarium verticillioides)侵染后玉米籽粒和丝粒中抗穗腐性差异基因表达植物生理学杂志。2010;167(16):1398-406。
- 30.
Lanubile A,Ferrarini A,Maschietto V,Delledonne M,Marocco A,Bellin D.具有对比耳腐蚀性的玉米基因型中富血清叶酸诱导性诱导反应的功能基因组分析。BMC基因组学。2014; 15:710。
- 31。
Lanubile A,Bernardi J,Marocco A,Logrieco A,Paciolla C.玉米基因型中的防御基因和酶的差异激活,具有对比的抗性水平镰刀菌素verticillioides.Environ Exp Bot. 2012; 78:39-46。
- 32。
Lanubile A,Bernardi J,Battilani P,Logrieco A,Marocco A.抗性和易感玉米基因型激活不同的转录反应镰刀菌素verticillioides.physiol mol植物疗法。2012; 77(1):52-9。
- 33。
王YP,周ZJ,高JY,吴YB,夏ZL,张兴业,吴JY。玉米耐机制镰刀菌素verticillioides通过RNA-seq数据的综合分析。植物学报2016;7:1654。
- 34。
Maschietto V,Lanubile A,De Leonardis S,Marocco A,Paciolla C.致病性相关蛋白质和抗氧基酶活性的组成型表达触发玉米抗性镰刀菌素verticillioides.acta botanica yunnanica(云南植物研究). 2016;
- 35。
Maschietto V,马罗科A,Malachova A,Lanubile A.耐镰刀菌素verticillioides玉米自交系中的富龙素积累涉及脂氧酶(LOX)基因的较早和增强的表达。J植物理性。2015; 188:9-18。
- 36。
屠杀A,Reid LM,Santiago R,Cao A,Malvar Ra。玉米耐药抗性与脱辛苯酚和富马菌菌腐蚀的抗性。植物病理学。2015年。
- 37.
刘凯杰,刘志刚,刘志刚,刘志刚。玉米自交系遗传多样性的微卫星分析[j]。遗传学。2003;165(4):2117 - 28。
- 38.
焦勇,裴鲁索P,史静,梁涛,Stitzer MC, Wang B, Campbell MS, Stein JC, Wei X, Chin C-S, et al.;利用单分子技术改进玉米参考基因组。大自然。2017;546(7659):524 - +。
- 39.
洪H-Y,荷兰JB。电阻的双列分析,以镰孢属穗腐病和烟曲霉毒素污染玉米。农作物科学。2012; 52(5):2173-81。
- 40.
Blacutt AA,金SE,Voss Ka,Gao M,Glenn Ae。镰刀菌素verticillioides玉米产霉菌毒素模型病原体的毒性、毒力和生态位适应性研究进展。植物病理学。2018;108(3):312 - 26所示。
- 41。
培根CW,格伦AE,耶茨IE。镰刀菌素verticillioides:管理与玉米的内生联系,减少伏马菌素的积累。毒素启2008;27(3 - 4):411 - 46。
- 42。
Yates Ie,Bacon CW,Hinton DM。内生感染的影响镰刀菌素moniliforme论玉米生长和细胞形态学。植物DIS。1997年; 81(7):723-8。
- 43。
Yates Ie,Widstrom NW,Bacon CW,Glenn A,Hinton DM,Sparks D,Jaworski AJ。玉米生长的场效镰刀菌素verticillioides接种过的种子。Mycopathologia。2005;159(1):65 - 73。
- 44。
李高清,苏gs,姜l,宝泽姆。基因组关联研究和基因组选择的高效统一模型。Genet Sel Evol。2017; 49:8。
- 45。
骑我们的JB, blhm BH。真菌特异性新基因FUG1在乌马菌素的致病性和生物合成中起作用镰刀菌素verticillioides.植物学报。2017;18(4):513-28。
- 46。
慕克吉男,金JE,公园YS,Kolomiets MV,沉WB。G蛋白信号传导的调节因子在镰刀菌素verticillioides调解在没有自生能力与可行的玉米籽粒差宿主 - 病原体的反应。莫尔植物途径。2011; 12(5):479-91。
- 47。
德维特P.视野与思考(minireview) - 植物如何识别病原体,保卫自己。细胞mol寿命。2007; 64(21):2726-32。
- 48。
刘志强,邱爱玲,史利平,蔡俊生,黄晓燕,杨松,王波,沈磊,黄明敏,牟少林,等。SRC2-1作为PcINF1的相互作用伙伴,在PcINF1诱导的辣椒免疫中是必需的。中国生物医学工程学报。2015;66(13):3683-98。
- 49.
王永强,王志强,王永强。l -型凝集素受体激酶在植物免疫中的作用。公共科学图书馆Pathog。2017;13(8):1164。
- 50.
Winterberg B,Du Fall La,Song XM,Pascovici D,Care N,Molloy M,OHMS S,Solomon PS。病养效应蛋白SNTOX3重新编程代谢并引发易感麦叶的强大防御反应。BMC植物BIOL。2014; 14:215。
- 51.
登普西DMA,Vlot交流,Wildermuth MC,Klessig DF。水杨酸生物合成和代谢。拟南芥的书。2011; 9:e0156-6。
- 52.
张应祥,徐胜生,丁鹏,王冬梅,程永涛,何静,高明华,徐飞,李勇,朱振华,等。一个植物特异性转录因子家族的两个成员对水杨酸合成的控制和系统性获得抗性。中国科学院院刊2010;107(42):18220-5。
- 53。
林YJ,林RC。含VQ含有植物特异性转录调节剂的蛋白质系列。植物理性。2015; 169(1):371-8。
- 54。
kazan k,礼仪jm。将开发与防御联系起来:植物病原体相互作用中的植物素。趋势植物SCI。2009; 14(7):373-82。
- 55。
植物生长素受体与植物发育:一种新的信号传导范式。见:《细胞与发育生物学年刊》2008;24:55-80。
- 56。
舍雷尔GFE,Labusch C,阿芬Y.磷脂酶并用ABP1和TIR1生长素信号转导网络中两种受体:全面和挑衅性的模型。前植物SCI。2012; 3:10。
- 57。
刘YJ,郭YL,马CY,张东风,王C,杨天问,徐ML。玉米抗性的转录组分析镰刀菌素graminearum.BMC基因组学。2016; 17:13。
- 58。
Wang S ., Gu YN ., Zebell SG ., Anderson LK ., Wang W ., Mohan R ., Dong XN. the non - canonical role of CKI-RB-E2F signaling pathway in plant effect -triggered immunity. acta botanica sinica(云南植物研究中心)。细胞宿主微生物。2014;16(6):787-94。
- 59。
脂质、脂肪酶和脂质修饰酶在植物抗病中的作用。发表于:植物病理学年度回顾,第43卷。帕洛阿尔托:年度评论;2005.229 - 60页。
- 60.
Battilani P,Lanubile A,Scala的V,Reverberi男,格雷戈里R,Falavigna C,Dall'asta C,公园YS,贝内特Ĵ,博雷戈EJ。,等人。从通过在9脂氧合酶途径两者病原体和宿主拮抗茉莉酸介导的防御氧脂素镰刀菌素verticillioides玉米感染。莫尔植物途径。2018; 19(9):2162-76。
- 61.
Scala V, Beccaccioli M, Dall’asta C, Giorni P, Fanelli C.中oxylipin生物合成相关基因的表达分析镰刀菌素verticillioides和玉米粒的相互作用。植物病理学杂志。2015;97(1):193-7。
- 62.
Arias SL, Mary VS, Otaiza SN, Wunderlin DA, Rubinstein HR, Theumer MG。毒素分布和鞘突基底不平衡镰刀菌素verticillioides- 活化和Fumonisin B1浇水玉米幼苗。植物化学。2016; 125:54-64。
- 63.
于晓敏,王新军,黄小龙,布chenauer H,韩启明,郭杰,赵军,曲志平,黄丽丽,康志生。小麦中性神经酰胺酶基因ta-CDase的克隆与鉴定。acta photonica sinica; 2011;38(5): 3447-54。
- 64.
Dall'asta C,Giorni P,Cirlini M,Reverberi M,Gregori R,Ludovici M,Camera e,Fanelli C,Battilani P,Scala V.玉米脂质在富韵素积累中发挥枢轴作用。世界肌科毒素J. 2015; 8(1):87-97。
- 65。
Giorni P,Dall'asta C,Reverberi M,Scala V,Ludovici M,Cirlini M,Galaverna G,Fanelli C,Battilani P.开放的田间研究玉米杂交种、脂类化合物和伏马菌素积累。毒素。2015;7(9):3657 - 70。
- 66。
Raffaele S,Leger A,Roby D.非常长的链脂肪酸和植物对病原体响应的脂质信号传导。植物信号表现。2009; 4(2):94-9。
- 67。
Garroum I,Bidzinski P,DaraspeĴ,Mucciolo A,Humbel BM,莫瑞尔JB,Nawrath C.角质层中的缺陷奥雅萨苜蓿ATP结合盒式磁带转运仪G31突变植物引起侏儒症,防御反应和病原体耐受性。植物细胞生理。2016; 57(6):1179-88。
- 68。
Oshima, Shikata M, Koyama T, Ohtsubo N, Mitsuda N, Ohme-Takagi M. MIXTA-like转录因子和WAX诱导剂1/SHINE1协调调控角质层发育拟南芥和Torenia Fournieri..植物细胞。2013;25(5):1609 - 24。
- 69。
闵宏伟,郑军,王建华。玉米ZmRAV1对转基因拟南芥耐盐和渗透胁迫有重要作用。植物学报,2014;57(1):28-42。
- 70.
烫发S,索厄斯R,Oakeley E,Angliker H,Paszkowski U.组织适应稻瘟病菌侵袭策略magnaporthe oryzae..植物细胞。2010;22(9):3177 - 87。
- 71.
Flint-garcia sa,thuillet ac,yu JM,Pressoir G,Romero Sm,Mitchell Se,Doobley J,Kresovich S,Goodman MM,Buckler ES。玉米协会人口:用于定量特质轨迹解剖的高分辨率平台。工厂J. 2005; 44(6):1054-64。
- 72.
曹亚平,张志强,张志强,等。白玉米对伏马菌素的抗性评价。acta botanica yunica(云南植物研究). 2014;34(1):1 - 4。
- 73.
Romay MC, Millard MJ, Glaubitz JC, Peiffer J, swartz K, Casstevens TM, Elshire RJ, Acharya C, Mitchell S, Flint-Garcia SA,等。美国国家玉米自交系种子库的综合基因分型。基因组医学杂志。2013;(6):14队。
- 74.
荷兰JB,奈奎斯特WE,塞万提斯·马丁内斯CT。估计植物育种的遗传解释:更新。在:雅尼克Ĵ,编辑。植物育种评论,第一卷。22.新泽西州霍博肯市:Jonh Wiley和Sons;2003页。9-112。
- 75.
Samayoa LF, Malvar RA, Olukolu BA, Holland JB, Butron a .全基因组关联研究揭示了一组与地中海玉米螟抗性相关的基因(Sesamia undagrioides.在玉米多样性小组中。BMC Plant Biol. 2015;15:15。
- 76.
荷兰jb。利用SAS Proc混合估算基因型相关性及其使用多变量限制最大似然估计的基因型相关性及其标准误差。农作物科学。2006; 46:642-56。
- 77。
Bradbury PJ,张Z,Kroon de,Casstevens TM,Ramdoss Y,Buckler Es。TASSEL:多样化样本中复杂性状的关联映射软件。生物信息学。2007; 23(19):2633-5。
- 78。
余建军,王志强,王志强,等。一种用于关联映射的统一混合模型方法,该方法考虑了多个层次的相关性。Nat麝猫。2006;38(2):203 - 8。
- 79。
张志强,张志强,张志强,等。适用于全基因组关联研究的混合线性模型方法。Nat麝猫。2010;42(4):355 - 60。
- 80.
基于再样本模型平均的结构化种群映射。遗传学。2009;182(4):1263 - 77。
- 81.
Panagiotou OA, Ioannidis JP。全基因组显著性阈值应该是什么?边缘性遗传关联的经验复制。中华流行病学杂志。2012;41(1):273-86。
- 82.
R:统计计算的语言和环境。在., 3.0.1版。奥地利维也纳:统计计算R基金会;2013.
- 83.
哈珀LC,Schaeffer ML,蓟J,Gardiner J,Andorf C,Campbell D,Cannon E,Braun B,Birkett S,Lawrence C等人。MaizeGDB Genome浏览器教程:通过视频到生物学家的数据库外展的一个示例。数据库。2011年; 2011:1-7。
致谢
我们感谢维戈大学(西班牙)“水校园农业食品研究和转移中心”提供的支持。
资金
本研究由西班牙加利西亚自治政府(项目IN607A/013)和西班牙“Secretaría de Estado de Investigación, Desarrollo e Innovación”资助,并与欧洲社会基金共同资助AGL2015-67313-C2-1-R和AGL2015-67313-C2-2-R项目。圣地亚哥承认博士后合同“Ramón y Cajal”,由“Secretaría de Estado de Investigación, Desarrollo e Innovación”资助,并由西班牙“维戈大学”和欧洲社会基金共同资助。
数据和材料的可用性
本研究中生成和分析的表型数据集可向通讯作者索取。如科学界提出要求,NCRPIS会将植物材料分发给科学界(https://www.maizegdb.org/data_center/stock?id=3100329.).
作者信息
隶属关系
贡献
AB和RAM构思了这项研究;AB,LFS,RS和AC协助现场实验和数据收集;AB和LFS执行了数据的统计分析并起草了初始稿件。AB编辑了稿件。所有作者都已读取并批准了稿件的最终版本。
通讯作者
道德声明
伦理批准和同意参与
不适用
同意出版
不适用
相互竞争的利益
作者声明他们没有竞争利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Samayoa,L.F.,Cao,A.,Santiago,R.et al。玉米籽粒伏马菌素含量的全基因组关联分析。BMC植物杂志19,166(2019)。https://doi.org/10.1186/s12870-019-1759-1
已收到:
接受:
发表:
关键字
- 玉米
- 镰刀菌素verticillioides
- Fumonisin
- 反抗
- 基因组协会研究
- 候选基因