- 研究文章
- 开放获取
- 发布:
嗜环素基因的全基因组鉴定gossypium hirsutum和具有抗真菌活性的CYP的功能特征verticillium dahliae.
BMC植物生物学体积19, 文章编号:272.(2019)
抽象的
背景
Cellophilins(Cyps)属于肽基脯氨酰CIS /反式异构酶(PPIASE)超家族,在植物对生物和非生物应激的反应期间起重要作用。
结果
在此,在基因组中鉴定了总共79个CypsGossypium hirsutum。其中,65个GH型仅含有一个环托宾型PPIASE域,其他14个GHCYPS包含额外的域。一些人CIS.- 与植物激素信号相关的元素在上游预测ghcyps.orf。表达分析显示ghcyps.响应冷,热,盐,钉和栓和verticillium dahliae.感染。此外,功能重要性ghcyp-3黄萎病抗性也在本研究中提出。ghcyp3具有胞质定位和核定位。过度表达ghcyp-3在拟南芥显著提高了植株对黄萎病的抗性。重组GHCYP-3显示PPIASE活动和明显的抑制作用大丽花的离体培养.而且,来自的提取物ghcyp-3转基因拟南芥对分生孢子萌发和菌丝生长均有明显抑制作用诉dahliae.
结论
我们的研究通过生物信息学工具确定了棉CYP基因的家庭成员。差异表达模式ghcyps.在各种非生物胁迫下诉dahliae感染条件对候选基因的生物学功能提供全面的理解。此外,GHCYP-3涉及棉花的抵抗力诉dahliae可能通过抗真菌活性感染。
背景
Allotetraploid.gossypium hirsutumL.是最重要的纤维作物,因其高产而在世界范围内种植[1].环境压力,如冷,干旱,热,盐度,各种害虫和病原体,威胁棉花生长,产量和纤维质量。例如,大约300万公顷的棉花受到疣状枯萎病,在中国每年的经济损失超过120亿元人民币。黄萎病,最严重的疾病,影响中国棉花生产,由土壤传播的真菌引起黄毛茛属植物。目前,传统的交叉育种植物已经培养了很少的抗性品种G. Hirsutum,这促进了世界上棉花总产量的95%[2].利用植物抗性基因进行基因工程正在成为提高棉花抗病性的一种选择诉dahliae.
Cellophilins(Cyps),具有肽基脯氨酰CIS / TRANS.异构酶(PPIASE)活性,分类在蛋白质的免疫蛋白家族中[3.].CYPS在各种生物过程中发挥重要作用,包括转录规则[4.,蛋白质折叠[5.], 信号转导 [6.]及活性氧(活性氧)规管[7.].随着全基因组测序的开展,植物cyp的鉴定和表征主要是在拟南芥蒂利亚纳(29 Atcyps)[8.],奥雅萨苜蓿(27个易播)[9.] 和大豆(62 GmCYPs) (10].大多数研究揭示了植物CYP的涉及主要是不同类型的非生物压力。例如,拟南芥CYPS显示出对伤害的反应证据[11].米OsCYP19-4对寒冷的反应显示出超过10倍的上调。Overexpressing的OsCYP19-4可以增强水稻植物具有显着增加的分蘖和尖峰数,因此增强了粒度[12].转基因植物overexpressingOsCYP21-4表现出对盐度和过氧化氢处理的耐受性增强[13].鸽豌豆异位表达(Cajanus Cajan.l .)CYP.那CCCYP., 在拟南芥对干旱,盐度和极端气温进行高级别耐受性[14].在植物病原系统中,针对生物胁迫,特别是针对病原菌感染的植物CYPs研究较少。还有胡椒(Cacyp1.)基因表达响应于Xanthomonas Campestris.光伏.实验和Collettrichum gleooosporioides[15].真菌感染Fusariumsolani.F。SP.eumartii.增加了Solanum Tuberosusm.CYP基因stcyp.块茎中的mRNA [16].表达诉酿酒用葡萄VviCyP高度诱导Plasmopara viticola.[17].在棉花中,一种类似于亲环素的基因GhCyp1被克隆了G. Hirsutum.过度表达GhCyp1在转基因烟草植物中赋予盐压力较高的耐受性假单胞菌含油pv。Tabaci.与对照植物比较的感染[18].
2015年,人类的基因组G. Hirsutuml . acc。测序德克萨斯州标记-1(TM-1),预测了70,000,000个蛋白质编码基因(NAU 1.1版)[19那20.].最近,一种改进的新组装基因组G. Hirsutuml . acc。生成TM-1 (NAU版本2.1)[21].该基因组测序项目有助于对棉花中所有CYP基因的调查.在本研究中,CYP基因家族成员G. Hirsutum以及它们在各种非生物胁迫下的表达模式诉dahliae系统调查感染情况。进一步分析了ghcyp3的功能,揭示了其在棉花抗病中的作用诉dahliae感染。我们的研究将开明对未来多变量应力响应的Cype基因在Cype基因的功能中的新见解,并为棉花抗性育种提供更多候选基因。
结果
共鉴定出79个CYPsG. HirsutumTM-1
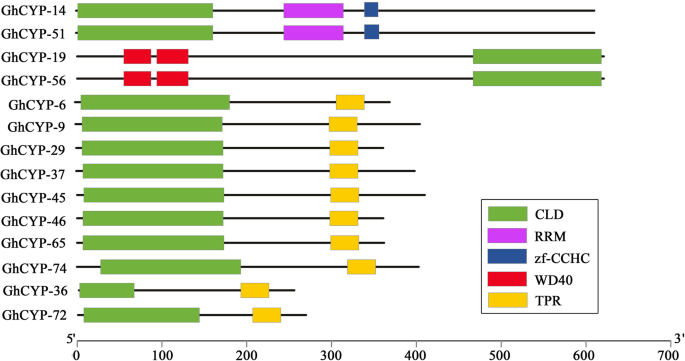
执行了一个本地BLASTP搜索拟南芥CYP蛋白作为查询,导致79个CYP候选人G. HirsutumNAU版本1.1,74 CYPS来自G. HirsutumJGI版本1.0和78个cyp来自G. HirsutumNAU版本2.1(表1).将候选基因提交到Pfam以确认亲环蛋白型PPIase结构域(CLD, PF00160)的存在,并将其命名为ghcyp1至ghcyp79。CYP个体的特征,包括CDS长度、蛋白长度、分子量和等电点(pI)见表1.蛋白质长度从69个氨基酸(AA)残基(GHCOP-70)至801AA(GHCOP-55)变化。分子量为7.5kDa(GHCOP-70)至90.5kDa(GHCOP-55),并且PI值范围为4.6至12.0。大多数GHCYP预期在细胞质中。此外,一些GHCYPS表现出叶绿体,线粒体,核和细胞外定位。在79个GHCYPS中,65只含有一个CLD结构域,但其余的14个GH型含有额外的结构域,包括诸如tPR,PF00515,PF07719,PF13181,PF13414),锌指(ZF-CCHC,PF00098),RNA识别图案(RRM,PF00076)和WD40(PF00400)(图。1).
CIS.- 与荷尔蒙信号有可能相关ghcyps.
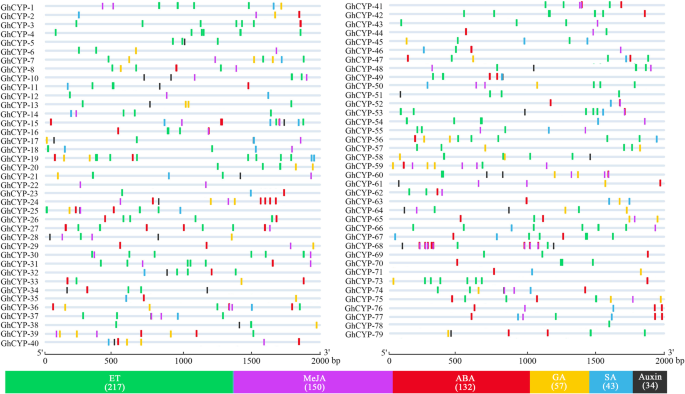
这里我们调查了CIS.- 与激素信号有可能相关的,在它们上游的-2 kB 5'侧翼区域中的荷尔蒙信号GhCYPs。总共有六种类型的激素相关CIS.-元素在启动子中被预测(图。2).这些ghcyps.66.ghcyps.乙烯(ET)反应元件(ERE)是否35ghcyps.含有水杨酸(SA)响应元素(TCA元素),47ghcyps.Harbored脱离酸(ABA)响应元素(ABRE),38ghcyps.具有赤霉素(GA)响应元件(P-box;TATC-box), 47ghcyps.含有甲基己酸酯(MEJA)响应元件(CGTCA-MOTIF)和26个具有型助长响应元件(TGA-BOX; AUXRRR-CORE)。总共,217CIS.- 与et,150相关的元素CIS.- 与meja相关的,132CIS.-元素与ABA相关,57CIS.- 与GA相关的元素,43CIS.-元素与SA和34CIS.- 所有与植物蛋白相关的元素ghcyps.(图。2).激素反应性的富集CIS.- 在这些上游的元素GhCYPS提示它们可能参与植物对各种激素信号通路的反应。
表达式模式ghcyps.在各种非生物胁迫下
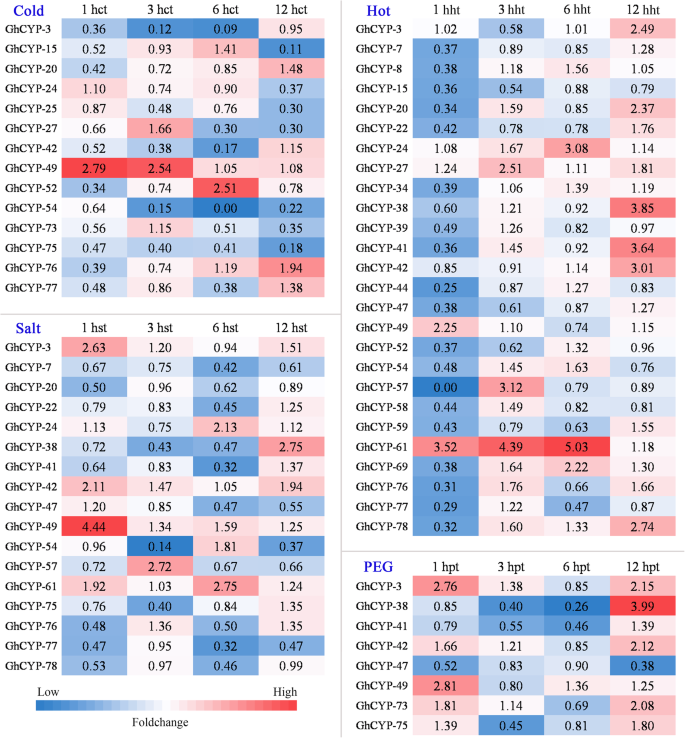
表达谱的ghcyps.使用高通量RNA-SEQ数据(附加文件)在四种不同的非生物胁迫条件下进行棉花植物的根2:表S2)。每百万片段(FPKM)的外显子的低碎片的转录物可能是虚假装配。因此,在这项研究中ghcyps.用FPKM> 10并存在于至少两个样品中,被鉴定为潜在表达的转录物。我们专注于各种应力中的显着差异表达的基因(折叠变化[Fc]> 2或Fc <0.5)。ghcyps.图2中列出了显着的差异表达至少一个治疗时间。3..在冷治疗中,14岁ghcyps.常见地分开明显下调ghcyp-49.在1 HCT(冷处理后数小时)和3 HCT和ghcyp-52.在6hct,表达明显上调。在1 hht(热处理后数小时),22 / 26ghcyps.是对热处理的反应。其中,只有表达水平ghcyp-49.和ghcyp - 61显着上调。在3 HHT,6 HHT和12 HHT,只有12ghcyps.表现出不同的表达模式…在这些基因中,多达11个基因上调。大多数GhCYP基因在盐处理条件下被下调ghcyp-3那GHCYP-24那ghcyp-38.那ghcyp-42.那ghcyp-49.那ghcyp-57.和ghcyp - 61.经PEG(聚乙二醇)处理后,仅8ghcyps.表现出差异表达模式,其中,ghcyp-3那ghcyp-42.那ghcyp-49.和ghcyp - 73差异,ghcyp-41.那ghcyp-47.和ghcyp - 75受到了监管。只是表达ghcyp-38.PEG处理后3hpt和6hpt表达下调,12hpt表达上调。这些表达模式表明CYPs承担多种功能,帮助棉花应对各种复杂的环境挑战。
表达谱的ghcyps.在压力下诉dahliae
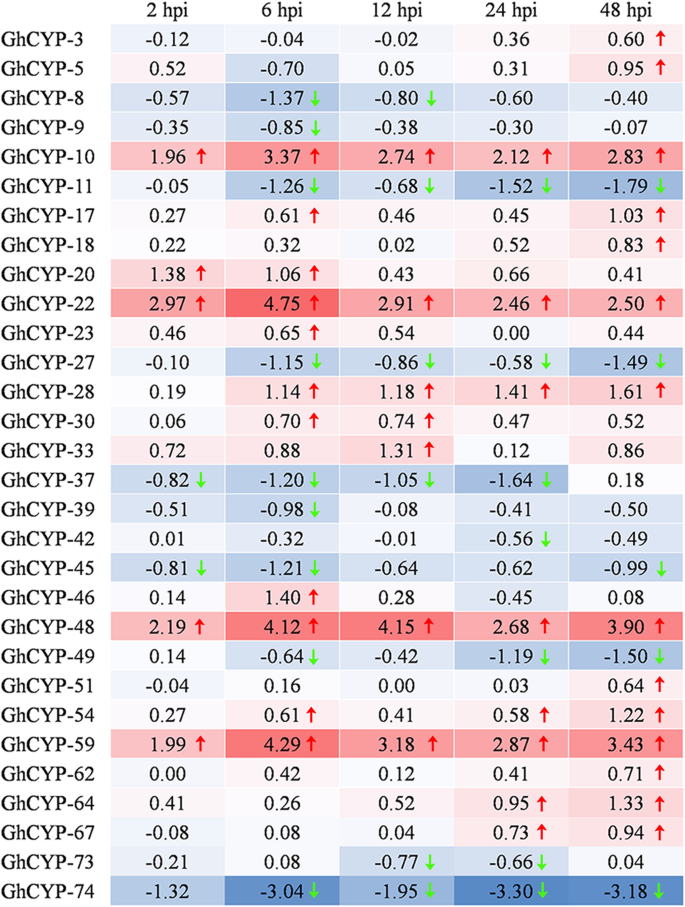
为了更好地理解CYP.棉花抗性的家庭基因诉dahliae,表达谱通过RNA-SEQ获得。共30岁GhCYP基因显示差异表达至少一种时间点(HPI,接种后的HPI,小时),包括19个上调基因和11个下调基因(图。4.).值得注意的是,水平的GhCYP-10那GHCYP-22.那GHCYP-48.和ghcyp-59.在所有五个治疗时间点上调。另外,表达了GhCYP-11那ghcyp-27.那GhCYP-37那GHCYP-45.和ghcyp - 74在大多数时间点下调。这些结果表明GhCYPS与棉花的相互作用有关V. Dahliae。
GHCYP-3包含保守的氨基酸残基并具有PPIASE活动
ghcyp-3,克隆G. Hirsutum简历。JM20含有单环旋蛋白结构域,173个氨基酸残基,其分子量为18.2kDa和8.34的PI。与先前表征的对齐拟南芥和人CYP(ATCOP19-1和HCYPA)揭示了GHCYP-3含有七个保守的氨基酸残基,其关键影响PPIASE活性(图。5.一种)。ghcyp-3被发现以未经充气的棉花植物的根,茎和叶子表达V. Dalihae.(图。5.b)。在35s启动子的控制下构建了GFP的GHCYP-3的翻译融合,然后在洋葱表皮细胞中瞬时表达。GHCYP-3-GFP的荧光成像轰击洋葱表皮细胞显示细胞质和核定位(图。5.C)。
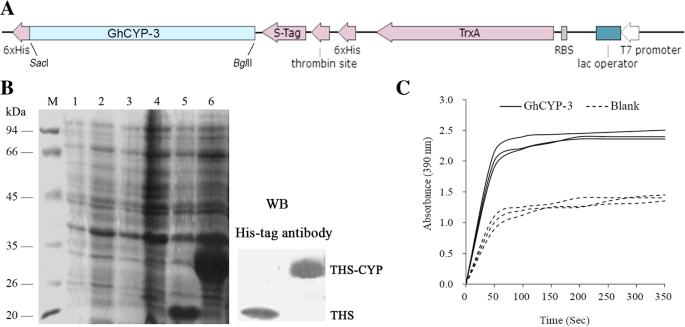
将GHCYP-3 ORF克隆到PET-32A中囊我和BglII位点,构建重组质粒(图。6.一种)。SDS-PAGE和Western印迹分析显示,融合TRXA-6×HIS-S-TAG-6×他(THS,20.4 KDA;空向量作为控制)和TRXA-6×HIS-TAG-GHCYP3(THS-CYP,34.6kDa)蛋白质在中表达了大肠杆菌BL21(DE3)在37℃下,具有1mm IPTG的4小时(图。6.b)。使用镍亲和力纯化重组THS-CYP蛋白。此外,我们使用合成肽合成肽琥珀酰基-Ala-Pro-Phe-Nitroanilide通过偶联的测定测量重组蛋白的PPIASE活性。在重组GHCOP-3存在下观察肽底物的异构化,显示出高于坯料的OD值,阴性对照(图。6.C)。这些结果表明,GHCYP-3具有PPIASE活动体外.
重组GHCYP-3的PPIASE活动测定体外。一种那ghcyp-3和囊我和Bgl通过PCR扩增II位点,并克隆到原核表达载体PET-32a中。B.重组GHCYP-3的表达和纯化大肠杆菌.用1mM IPTG诱导重组GHCOP-3表达3小时。将所得蛋白质分离10%SDS-PAGE,并使用他的抗体通过Western印迹分析。34.6 KDA重组TRXA-6×HIS-S-TAG-GHCYP-3(THS-CYP)蛋白(箭头)在镍 - NTA琼脂糖柱上纯化。米,标志;Lane 1-2,空载体PET-32A没有IPTG;Lane 3-4,没有IPTG的PET-32A- GHCYP-3;泳道5,带有IPTG的空向量PET-32a;泳道6,具有IPTG的PET-32A- GHCYP-3。C,使用蛋白酶偶联的测定来测量重组GHCOP-3的PPIASE活性。四肽底物(Suc-Ala-Phe-phe-phe-2,4-二氟化硅氧烷)的脯氨酰CIS-Trans异构化被390nm的吸光度的增加反映。在没有GHCOP-3(空白)的情况下,曲线在350s的过程中表示SUC-AFPF-PNA衬底的异构化,并且在200nM重组GHCOP-3蛋白存在下。值代表三个生物重复的平均值
ghcyp3的表达上调响应诉dahliae侵犯
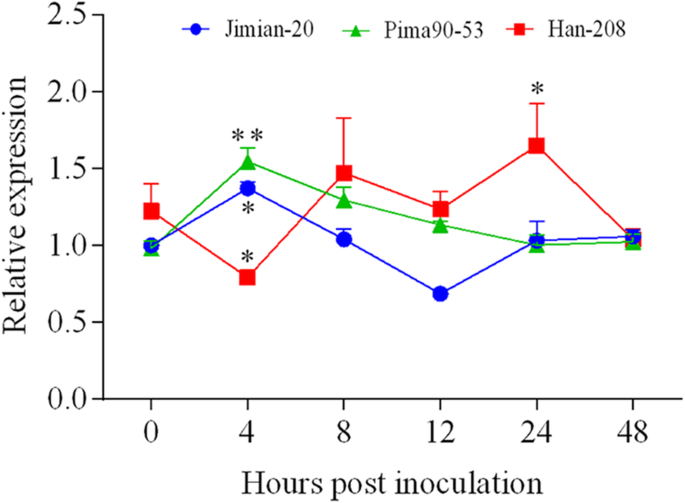
以不同程度的抗性分析三种棉栽培中GHCYP-3的表达模式诉dahliae,在0,4,8,12,24和48 HPI中取样了两周历史纯棉幼苗的根源。QRT-PCR结果显示,与0 HPI相比,GHCOP-3的转录水平在4 HPI的两种耐药品种PIMA90-53和JM-20中显着上调。但是,在相同的接种时间,ghcyp-3在易感的Han-208中,表达量显著下调,达到24 hpi前的最高表达量(图2)7.).这些结果表明ghcyp-3上调和提前参与棉花的相互作用诉dahliae抗易感品种.
过度表达ghcyp-3在拟南芥改善植物黄萎病抗性
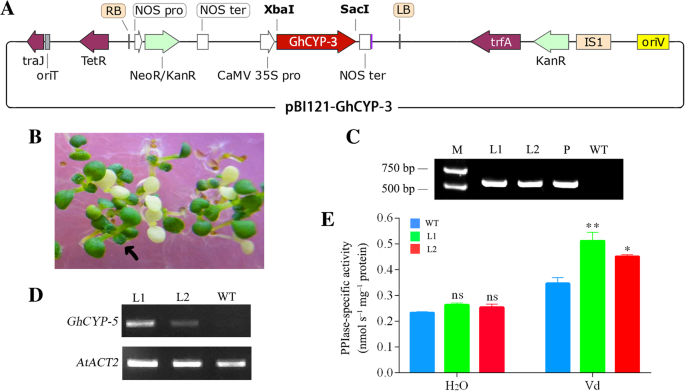
进一步评估是否ghcyp-3在植物抗黄萎病过程中,我们设计了引物来扩增其ORFghcyp-3转入植物表达载体pBI121(图。8.A), which will makeghcyp-3转基因中的过度表达拟南芥植物。通过选择含卡霉素的培养基(图。8.b), 10个势T1产生转基因素。在PCR验证基因插入后(图。8.c),T的两行3.一代显示ghcyp-3过度表达(图。8.d)进行PPIase活性和黄萎病抗性分析。
遗传转化拟南芥和ghcyp-3转基因株系的鉴定。一种,PBI121-GHCYP-3矢量的示意图。B.,Kanamycin抗阳性幼苗的抵抗筛选;C,来自卡那霉素抗性线的基因组DNA的PCR分析。D.,半qpcr确认表达ghcyp-3在转基因线。atact2.(AT3G18780)作为内标。E., PPIase活性的野生型(WT)和两个转基因品系。数据代表三个独立实验的平均值±SE (n> 20)。星号表示WT与转基因株系之间存在显著差异(Sidak’s multiple comparison test;ns=无显著性差异,*P<0.05, **P<0.01)。米,标志;L1和L2,转基因拟南芥线;P,PBI121-GHCYP-3质粒为阳性对照
在无情的条件下(用H治疗2O),与野生型相比,两个表达ghcyp3的转基因株系的PPIase活性没有显著增强。然而,这两种转基因株系,感染了诉dahliae对于3d,显示PPIASE活性增加0.51±0.03(L1)和0.45±0.03 nmol·s-1·毫克-1蛋白质(L2)相比为0.35±0.03 nmol·s-1·毫克-1WT中观察到的蛋白(图。8.e)。
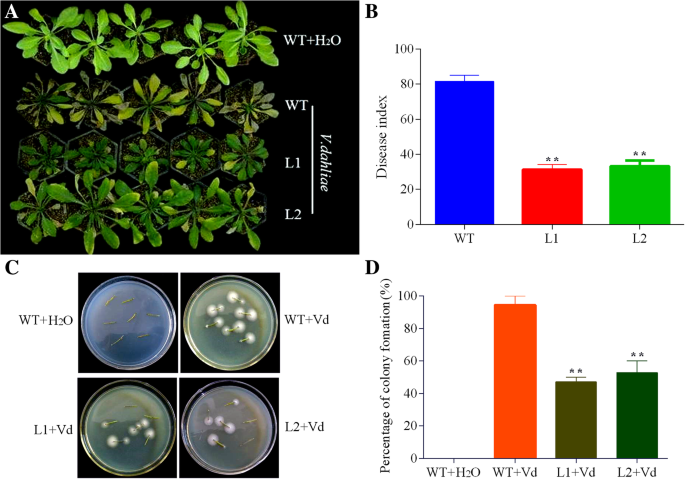
为了应对V. Dahlia.与野生型相比,两个独立的过表达品系在15 dpi时表现出更少的萎蔫和更小的叶片黄化程度(图2)。9.一种)。疾病评估进一步表明转基因系的疾病指数显着低于WT的疾病指数(图。9.b)。此外,我们通过分离和培养检查了感染的WT和转基因植物茎中的定植诉dahliae在PDA(马铃薯右旋糖浆)上8天。结果,与WT相比的转基因植物中较少的真菌菌落(图。9.C和D)。这些真菌回收测定表明,GHCYP-3具有生长抑制作用的专业效果诉dahliae.
GHCYP-3对此表现出明显的抑制作用诉dahliae
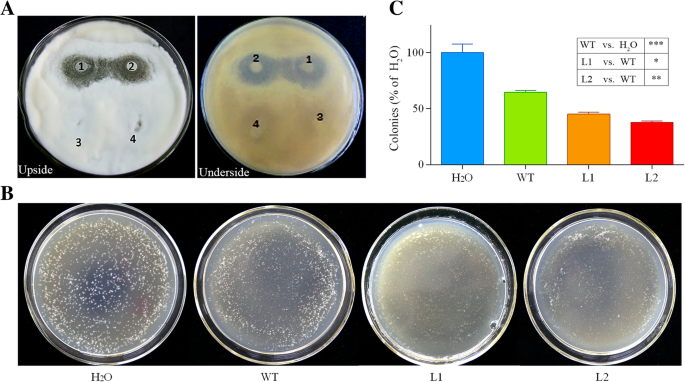
我们进一步评估了GHCYP-3的抑制作用诉dahliae.如图所示。10围绕含有重组GHCOP-3的盘形成的一个不同的抑制区。此外,诉dahliae用来自WT和转基因素的植物提取物接种孢子,然后在PDA板上涂布。48小时后,与H相比,所有植物的提取物显着降低了菌落数量2o(作为控制)。然而,平板上的真菌菌落数含有转基因提取物显着小于WT(图。10B和C)。这些结果表明,GHCYP-3可以有效地抑制Conidia发芽和菌丝生长诉dahliae在体外.
讨论
在几种植物中,CYP基因家族已被系统地分析,例如拟南芥[8.], 白饭 [22]和大豆[10].最近,又鉴定出78个CYP基因G. Hirsutuml . acc。来自Illumina配对端基因组测序(NAU version 1.1)的TM-1,由Chen等人[23].现在,NAU版本2.1,高度精确的参考级基因组组装和注释G. Hirsutum,被生成[21].在新的NAU版本2.1中成功填补和纠正了相当大量的差距和错误的组件[21].因此,在本研究中,我们通过整合NAU 1.1,JGI数据库和NAU 2.1(表)来通过整合NAU 1.1版,共鉴定了79个CYP基因(表1).与Chen等人之前的报道相比,本研究确定了补充的三个cyp (ghcyp49、ghcyp60和ghcyp70)。此外,删除了JGI数据库和NAU 2.1版本中无法发现的两个cyp Gh_Sca140771G01和Gh_A12G1281。从而使候选CYP基因G. Hirsutum更可靠。
79个cyp都进去了G. Hirsutum有保守的PPIASE域名(CLD)。其中,14个GH型是多域蛋白质(图。1).除CLD外,ghcyp14和ghcyp51还含有RRM和zf-CCHC。RRM结构域被发现存在于参与RNA加工的蛋白质中,它介导与各种RNA的结合以执行管家功能和调节机制[24].含有锌指的蛋白质通常与DNA和RNA相互作用,主要用于改变特定蛋白质的结合特异性。此外,预计GHCYP-14和GHCYP-51将在核中本地化(表格1).因此,这两种CYP可能介导核糖体关联,而CLD催化肽基脯氨酸CIS-TRANS.新生多肽的异构化。ghcyp19和ghcyp56包含WD40结构域,通常作为蛋白质相互作用的刚性支架[25].其他10个多域Ghcyps含有TPR结构域,主要作为蛋白质复合物的形成和Invune反应中参与的RNA代谢调节剂的互动支架[26那27].
基因表达调控通过启动子区中的特异性顺式调节元素已经发展成为一种主要的适应机制,以应对植物中的环境压力[28].植物激素对植物开发和防御的调节至关重要[29].因此,对推定的分析CIS.- 与激素有关的调节元素有助于推进我们对的理解ghcyps.包括棉花的抗逆性。在GhCYPs的潜在启动子区域检测到6种激素(ET, MeJA, ABA, GA, SA和生长素)的响应调控元件(图)。2),表明GHCYPS涉及不同的激素介导的信号传导途径。
2010年,我们利用抑制消减杂交(suppression subtractive hybridization, SSH)技术,从cDNA文库中分离到203条est序列诉dahliae.其中,EST编码了与CYP同源性的部分多肽[30.].这是CYP参与棉花和植物病原体之间的相互作用的第一份报告.在2011年,GhCyp1被克隆了G. Hirsutum简历。中棉35.过表达GhCyp1在转基因烟草植物中赋予盐压力较高的耐受性p .两pv。Tabaci.与对照植物比较的感染[18].这里是嗜环蛋白基因家族的RNA-seq表达分析G. Hirsutum揭示了许多基因可能在各种应力响应中发挥重要作用(图。3.和4.).据我们所知,几乎所有报告的CYP基因都会通过其上调表达参与植物应激反应,例如OsCYP19-4和OsCYP21-4从米饭反对冷[12]和盐[13],CCCYP.从鸽子豌豆抵御干旱、盐度和极端温度[14],cyps来自拟南芥反对伤害[11],以及几个嗜环素基因对植物病原体感染的反应[15那16那17].因此,棉花中Cyp基因的表达显着高,如Ghcyp-49和Ghcyp-52至Cold,Ghcyp-3,Ghcyp-24,Ghcyp-42,Ghcyp-49 Ghcyp-57和Ghcyp-61至盐,GHCYP-61-3,GHCYP-38,GHCYP-38,GHCYP-42,GHCYP-61至HOT,GHCYP-3,GHCYP-42,GHCYP-49和GHCYP-73至PEG,以及GHCYP-3,GHCYP-5,GHCYP-10,GHCYP-17,GHCYP-20,GHCYP-22,GHCYP-23,GHCYP-28,GHCYP-30,GHCYP-33,GHCYP-46,GHCYP-48,GHCYP-48,GHCYP-51,GHCYP-54,GHCYP-59,GHCYP-62,GHCYP-64和GHCYP-67至诉dahliae在这些压力条件下表明可能重要性。然而,需要进一步的功能性研究来解开这些候选者在棉花反应对生物和非生物胁迫条件下的精确作用。
GHCYP-3包含与其相关的上述EST序列V. Dahliae-感染并在GHCOP1中显示氨基酸序列中的98%相似性。因此,GHCYP-3可能在调节棉免疫应答方面发挥重要作用。表达结果(图。7.)和过表达分析(图。9.)进一步推测ghcyp-3参与了棉花防御诉dahliae.植物CYPs可以定位于多种细胞器,如ER [31],叶绿体[9.],高尔基[13]、细胞质及细胞核[32那33].有趣的是,GhCYP3-GFP融合蛋白定位于洋葱表皮细胞的细胞质和细胞核(图。5.C)。提出核定定位在基因表达调节中发挥可能作用[33].GMCYP1作为激活A的酶活性的“辅助者”疫霉突变RXLR效应器AVR3B以PPIASE活动依赖方式[34].此外,对GMCOP1进行了证明与异戊类药物调节剂GMMYB176和14-3-3蛋白相互作用,表明它参与异黄酮代谢并发挥国防作用[33].证明了ATCYP57参与其中A. Thaliana.回应p .两影响调用累积和愈合积累的感染PAD4(肽基精氨酸脱亚胺酶4)的表达,它与EDS1(增强疾病易感性1)相互作用,提供植物的基础免疫应答。核定位使得作者推断AtCYP57可以直接调控防御基因的翻译[32].因此,我们推断通过直接与一些转录因子直接相互作用以调节防渗基因的翻译,可以在细胞核中,在细胞核中,可以在细胞核中推断GMCYP1的抵抗函数。
另外,ghcyp3也位于细胞质中,这表明它需要发挥一些额外的作用,可能包括直接的抗真菌活性。已从包括人参在内的一些植物中报道了CYPs的抗真菌活性[35],大白菜[36],鹰嘴豆[37]黑眼豌豆[38].在我们的研究中,重组GHCYP-3显示了明显的抑制作用诉dahliae(图。10a).在自然状态下,植物中CYP的浓度在平板中并不高。此外,目前还没有明确的证据表明CYP通过直接的体内抗真菌活性参与植物对病原菌的抗性。但是,我们不排除这种可能性,因为从ghcyp-3转基因拟南芥对分生孢子萌发和菌丝生长均有明显抑制作用诉dahliae(图。10b)。许多表征抗真菌蛋白活性在真菌细胞壁,血浆膜和细胞内靶标中[39].例如,布福林2从胃组织Bufo Bufo Gargarizans.能通过质膜转运,并在与真菌DNA和RNA相互作用时表现出抗真菌活性[40].在感染过程中,诉dahliae形成渗透PEG和专门的真菌 - 宿主界面到秘密分泌效应蛋白[41].这可能是寄主植物产生的抗真菌蛋白(包括ghcyp3)遇到并进入其细胞质的一个机会V. Dahliae。此外,我们确定了10个推定的CYP(VDCYPS)诉dahliae甚高频数据链。17genome with very high sequence similarity with GhCYP-3 (Additional file3.:表S3)。这些意味着GHCYP-3可以替代VDCYPs并在细胞质中进行相同的生物学功能V. Dahliae。因此,我们推断ghcyp3的抗真菌活性已经被证明是由于影响VdCYPs的正常功能,这对VdCYPs的发展至关重要诉dahliae.尽管如此,需要进一步研究来确认这种大胆的扣除。
结论
这是Cyp系列棉花旨在帮助澄清基因序列特征和表达模式的第一次系统分析。推定的顺式调节元素预测和表达发散表明GhCYP基因参与多种植物激素调控途径和对各种非生物胁迫的响应诉dahliae感染。这些结果将提供用于选择候选基因的潜在线索,以进一步深入研究功能表征。此外,GHCYP-3显示细胞质和核定位。异源过表达ghcyp-3在拟南芥显著提高了植株对黄萎病的抗性。重组ghcyp3和提取物ghcyp-3转基因拟南芥表现出明显的抑制活性诉dahliae.这些结果表明ghcyp-3与棉花对诉dahliae可能是通过抗真菌活性的感染,并且它将为棉花分子育种中的黄萎病枯萎耐受性提供重要候选基因。
方法
CYP家族基因的鉴定与表征G. Hirsutum
基因组组装G. Hirsutum南京农业大学的TM-1 (NAU版本1.1和2.1)和JGI(版本1.0)来自CottonFGD网站(https://cottonfgd.org/).拟南芥CYPS从TAIR网站访问(https://www.Arabidopsis.org/)被用作查询以识别推定的CYPG. Hirsutum利用生物培养软件(宜必思生物科学,Carlsbad,Ca,USA)通过当地爆炸的基因组。通过PFAM数据库进一步验证已识别的GHCYPS(http://pfam.xfam.org.).利用ExPASy程序计算各蛋白的分子量(MW)和等电点(pI) (http://www.expasy.org/).信号肽用SignalP 4.1程序进行预测。氨基酸序列与DNAMAN软件(Vers. 7;Lynnon Corporation, Quebec, Canada),使用默认参数。大提琴v2.5 (http://cello.life.nctu.edu.tw/)用于GHCOP的亚细胞定位预测。推定CIS.-启动子区域的作用元件使用NAU版本2.1数据库与Plant CARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).
基因组宽表达分析ghcyps.
棉花CYP基因在不同非生物胁迫下的全基因组表达分析诉dahliae从NCBI数据库(SRP044705)下载并从我们的RNA-seq数据中提取的高通量RNA序列数据进行感染[42].具有FPKM≥10的基因用于进一步表达分析。
植物材料和诉dahliae菌株
棉花种子G. Hirsutum简历。Ji Mian 20(JM20),Han208,CCRI8和G. Barbadense.简历。PIMA90-53在河北农业大学教育部作物种质资源中保留了PIMA90-53,保定,中国保定。在28°C / 25℃(日/夜)温度下,棉幼苗在商业灭菌土壤中生长,具有16-H光/ 8-H-and and。A. Thaliana.在含有蛭石土的盆中含有温度,在23℃,20°C的夜晚,在16/8 h光周期下。诉dahliae突出林锌株林锌棉植物中分离,生长在河北省林溪县农业领域,中国[43].这些高度侵略性的脱落诉dahliae菌株在PDA上维持。根据前面的描述制备结算悬浮液[44]并调整为107.每毫升孢子和106.每毫升蒸馏水的孢子用于接种棉花和拟南芥, 分别。该植物被感染了诉dahliae使用土壤浸液法[44].用针直接注入10 mL分生孢子悬浮液,不刺入每个罐的底部,用同样的方法接种无菌水作为对照。
基因克隆和亚细胞定位
从JM20的叶组织中提取总RNA,用RNA植物加试剂(天根生物科技)。使用Primescript TM RT试剂盒和GDNA橡皮擦(Takara,China)从10μg总RNA的等分试样合成第一链cDNA。ghcyp-3用引物CYP-F1和CYP-R1扩增(附加文件1:表S1),基于GH_A01G1361的序列设计(G. Hirsutuml . acc。TM-1)[20.].一种ghcyp-3-GFP融合构建体在35S启动子的控制下通过克隆到其中萨尔我和BAM二元矢量pcame的嗨网站。单独表达GFP的载体作为对照。洋葱中蛋白质亚细胞定位(Allium Cepa.)根据阳议定书(2015)的方案确定表皮细胞[44].
QRT-PCR和半定量PCR
用上述方法制备总RNA和cDNA。使用SYBR Green (TaKaRa,中国)的qPCR试剂盒,在CFX96 Real-Time PCR检测系统(Bio-Rad, Hercules, CA, USA)上进行qRT-PCR。qPCR条件为95℃3 min, 95℃15 s, 58℃15 s, 72℃20 s,共40个周期。棉花泛素14 (UBQ14)基因作为内标[45].通过2-Δct.方法。半定量RT-PCR是用Applied Biosystems®2720 Thermal Cycler进行的Arabidopsis Atact2.(AT3G18780)为内部标准[46].将所得产物溶于1.5%琼脂糖凝胶上。所有引物都列在附加文件中1:针对所有定量实验分析表S1三种生物学和三种技术复制。
转基因的生成和评价抗性拟南芥
ghcyp-3被克隆到pbi121矢量XBA.我和囊用PCR引物CYP的网站X和cyp-S.(附加文件1:表S1)。嵌合结构被引入农杆菌肿瘤术菌株GV3101拟南芥使用花浸法进行的转换[47].在含有50mg L的MS(MURASHIGE和SKOOG)培养基上选择推定的转化体-1然后通过PCR进行基因插入和半定量RT-PCR进行基因表达进一步验证。独立T1转基因系用于产生t3.代,随机选择作为代表线并进行分析。疾病的严重程度拟南芥植物造成的诉dahliae根据叶子上表现出的症状评估。如前所述计算疾病指数(DI)[48].根据Fradin(2009)的方法,通过评估从茎段中恢复的黄萎病定殖来评价该植物的抗性[49.].在每种处理中,使用18个单独的植物,并将所有实验重复三次。
重组蛋白的纯化及PPIase活性测定
这ghcyp-3ORF以正向引物CYP-克隆到表达载体pET-32a (+) (Novagen, Darmstadt, Germany)BG.- f和反引物CYP-SA- r(附加文件1:表S1),它将介绍Bgl二世和囊我分别进入ORF的5'和3'结束。用他的标签诱导Ghcyp-3蛋白的表达大肠杆菌BL21(DE3)(Transgen Biotech,北京,中国),最终集中的1.0mmol·L-1当OD时,将异丙基-β-D-硫酰基吡喃酸(IPTG)加入到培养物中600值达到0.4-0.6,在收获前允许培养物继续生长4-6小时。蛋白质在SDS-PAGE凝胶上分离,并使用抗HIS-Tag小鼠单克隆抗体(1:5000; CW Biotech,北京,中国)检测。使用6倍His标记的蛋白质纯化试剂盒(CW Biotech,中国)纯化重组蛋白。测定重组蛋白的PPIASE活性体外利用四肽底物su - aapf - pna (N-succinyl-Ala-Leu-Pro-Phe-p-nitroanilide;由Yoon(2016)描述的Shimadzu UV-2450分光光度计(Shimadzu,京都,日本)[12].所有测量均分析了三个生物学重复和两个技术重复。
测定抗真菌活性
测试重组蛋白的抗真菌活性对抗诉dahliae使用滤纸盘扩散法。诉dahliae孢子在PDA培养基板上均匀地涂布,然后在28℃下培养60小时。浸渍有测试蛋白的6mm直径的灭菌纸盘被置于先前的PDA培养基的表面上诉dahliae.将板接种在25℃下10天。提取物的抗真菌活性拟南芥植物改变了ghcyp-3如前所述执行[50.]随着以下修改。分析悬浮液调节到10的密度5.Conidia ml.-1,并在PDA上在25°C下发芽过夜。总匀浆(5克)从10拟南芥通过直接研磨植物在液氮中的细粉中制备植物,没有添加缓冲液。随后,通过在25℃下以10000g离心10分钟来收集提取物。将结合悬浮液(25μl)与225μl萃取物混合,并在25℃下温育1小时。将混合物(50μl)涂布在PDA平板上,并在25℃下孵育48小时,并列过真菌菌落。所有实验全部重复三次。
统计分析
每种测定至少三次进行所有实验。使用GraphPadPrism®6软件(Graph Pad,San Diego,CA)进行统计分析。除非另有说明,否则通过使用差异分析(ANOVA)进行评估数据,然后是Dunnett的多重比较测试。
数据和材料的可用性
在当前研究中产生或分析的数据包括在这篇发表的文章及其补充数据文件中,并可从通信作者在合理的要求下获得。
缩写
- 阿巴:
-
脱盐酸
- 伊稳定石:
-
脱落酸响应元件
- CLD:
-
亲环蛋白型PPIase结构域
- CYP:
-
cyclophilin.
- 迪:
-
疾病指数
- EDS1:
-
增强疾病易感性1
- 之前:
-
乙烯响应元件
- 等:
-
乙烯
- FC:
-
折叠变化
- FPKM:
-
每千碱基外显子的片段,每百万片段的图谱
- GA:
-
吉布林素
- HCT:
-
冷治疗后的小时
- 遗传性出血性毛细血管扩张症:
-
热处理后数小时
- HPI:
-
接种后的小时
- HPT:
-
钉治疗后的小时数
- Meja:
-
茉莉酸甲酯
- 女士:
-
Murashige和Skoog.
- PAD4:
-
肽基精氨酸脱氨酶型4型
- PDA:
-
马铃薯葡萄糖琼脂
- 挂钩:
-
聚乙二醇
- PI:
-
等电点
- PPIASE:
-
肽基脯氨酰CIS /反式异构酶
- ROS:
-
反应性氧气
- RRM:
-
RNA识别主题
- SA:
-
水杨酸
- TPR:
-
般的肽样重复
- WT:
-
野生型
参考
- 1.
Chen Zj,Scheffler,Dennis E,Triplett Ba,张T,Guo W,Chen X,Betelly DM,Rabinowicz PD,Town CD,等。朝向棉花(Gossypium)基因组。植物理性。2007; 145(4):1303-10。
- 2.
张健,傅林,张健。皮马黄萎病抗性种质鉴定及种质转移Gossypium barbadense.)转为陆地棉(G. Hirsutum).Euphytica。2012; 187(2):147-60。
- 3.
植物免疫亲和素:功能上的多功能性超越蛋白质成熟。新植醇。2005;166(3):753 - 69。
- 4.
Olga B, Marek Z, Yamile M, Tatsiana S, Maria K, Andrea BJNAR。核多结构域嗜环蛋白atCyp59 RNA靶点的鉴定及其对PPIase活性的影响核酸学报2013;41(3):1783-96。
- 5。
嗜环素:寻找功能的蛋白质。植物学报。2013;8(1):e22734。
- 6。
Kristine NB,Mallis RJ,Fulton DB,Andreotti啊。用肽基 - 脯氨酰异构酶环旋蛋白A的调节。Proc Natl Acad Sci U S A. 2002; 99(4):1899-904。
- 7。
关键词:环孢素A,环孢素A,细胞毒性,肌细胞分化,氧化应激美国实验生物学学会联合会j . 2002; 16(16): 1633 - 5。
- 8。
Romano PG, Horton P, Gray JE。这拟南芥Cellophilin基因家族。植物理性。2004; 134(4):1268-82。
- 9。
Juncheul A,Daewon K,You Yn,Minsook S,Jeongmee P,Hyunsik H,Beomgi K,Sheng L,Hyesun C.稻米分类(奥雅萨苜蓿L.japonica nipponbare.)免疫亲和素(FKBPs, CYPs)及水分胁迫下的表达模式。植物学报。2010;10(1):1 - 22。
- 10.
MainaliHR,Chapman P,Dhaubhadel S.基因组 - 西方细胞苷基因家族分析(大豆).植物生态学报。2014;14(1):1 - 11。
- 11.
Chou It,Gasser CS。Cellophilin基因家族的表征拟南芥蒂利亚纳众所周知的环托蛋白蛋白的系统发育分析。植物mol biol。1997年; 35(6):873。
- 12.
尹dh, Sang SL, Park HJ, lyji, Chong WS, Liu JR, Kim BG, Ahn JC, Cho HS。过表达OsCYP19-4提高水稻对冷胁迫的耐受性和产量(奥雅萨苜蓿).J Exp Bot. 2016;67(1): 69-82。
- 13.
Lee Ss,Park Hj,Jung Wy,Lee A,Yoon DH,You Yn,Kim HS,Kim BG,Ahn JC,Cho HS。一种新型高尔基常驻环旋蛋白OSC721-4增加了水稻中的氧化应激耐受性。前植物SCI。2015; 6:797。
- 14.
Sekhar K,Priyanka B,Reddy VD,Rao KV。综合性环疗(CCCYP)基因的分离和表征及其在拟南芥中的过表达赋予多种非生物应激耐受性。植物细胞环境。2010; 33(8):1324-38。
- 15.
关键词:辣椒,嗜环素,基因表达,非生物胁迫植物病理学杂志。2001;59(4):189-99。
- 16。
Godoy Av,Lazzaro As,CasalonguéCA,San Segundo B.表达式Solanum Tuberosum.细胞苷基因受真菌感染和非生物胁迫条件调节。植物SCI。2000; 152(2):123-34。
- 17。
Figueiredo A, Monteiro F, Pais MS, Rex M, Töpfer R, Zyprian E.嗜环素:葡萄植株霜霉病抗性候选基因。Acta Horticulturae。2014;1046(1046):371 - 8。
- 18。
朱思,王y,李y,bhatti kh,田y,wu j.过表达棉番荔枝素(GhCyp1)在转基因烟草植物中,赋予盐胁迫的双重耐受性和假单胞菌含油pv。Tabaci.感染。植物理性生物化学。2011; 49(11):1264-71。
- 19。
李飞,粉丝,卢克,萧g,zou cs,kohel rj,ma zy,shang hh,ma xf,wujy等。栽培高地棉花的基因组序列(gossypium hirsutumTM-1)提供对基因组进化的见解。NAT BIOTECHNOL。2015; 33(5):524-30。
- 20.
张TZ,胡y,江口,方l,关xy,陈杰,张jb,萨斯岛,scheffler,btelly dm,等。分子素棉花的测序(gossypium hirsutuml . acc。TM-1)提供了一种用于纤维改进的资源。NAT BIOTECHNOL。2015; 33(5):531-7。
- 21.
胡y,陈俊,方l,张z,ma w,niu y,ju l,deng j,zhao t,lian j等。Gossypium barbadense.和gossypium hirsutum基因组提供了对同种异体四倍体棉的起源和演化的见解。NAT Genet。2019; 51(4):739-48。
- 22.
水稻和拟南芥嗜环素基因家族的全基因组分析及其与酵母的比较。植物学报。2012;7(12):1653。
- 23.
陈Q,陈Q-J,Sun G-Q,Zheng K,Yao Z-P,Han Y-H,Wang L-P,Duan Y-J,Yu D-Q,Qu Y-Y.纤维发育中棉花棉酚基因家族基因组综合鉴定Gossypium barbadense..中华医学杂志。2019;20(2):349。
- 24.
Albam,PagèsM.含有RNA识别基序的植物蛋白。趋势植物SCI。1998年; 3(97):15-21。
- 25。
史密斯TF,Gaitatzes C,Saxena K,Neer EJ。WD重复:用于各种功能的常见架构。趋势Biochem SCI。1999年; 24(5):181-5。
- 26。
核基因HCF107编码一种膜相关的R-TPR (RNA四三肽重复序列)蛋白,该蛋白参与了质粒psbH基因的表达拟南芥.工厂J. 2005; 42(5):720-30。
- 27。
Chen L,Hamada S,Fujiwara M,Zhu T,Thao NP,Wong HL,Krishna P,Ueda T,Kaku H,Shibuya N等人。跳跃/ STI1-HSP90伴侣复合物促进了水稻先天免疫中PAMP受体的成熟和运输。细胞宿主微生物。2010; 7(3):185-96。
- 28。
Dirk W,Roman B,Joachim S.转录响应多样性的监管代码及其与基因组结构性质的关系A. Thaliana..公共科学图书馆遗传学。2007;3 (2):e11。
- 29。
王超,刘勇,李树生,韩国志。植物激素信号传导机制的起源与进化。植物杂志。2015;167(3):872 - 86。
- 30。
张春媛,王雪峰,张国英,吕庆伟,迟建金,李志坤,马志勇。陆地棉抗病性品种抑减杂交文库的est分析verticillium dahliae..棉花科学。2010;22(01):17-22。
- 31。
Saito T,Niwa Y,Ashida H,Tanaka K,Kawamukai M,Matsuda H,Nakagawa T.细胞苷的表达,其含有氨基末端内质网靶向信号。植物细胞生理。1999; 40(1):77-87。
- 32。
Pogorelko GV,Mokryakova M,Fursova OV,Abdeeva I,Piruzian ES,Bruskin SA。三个特征Arabidopsis Thaliana Immunophilin参与植物防御反应的基因假单胞菌含油.基因。2014;。538(1):12日至22日
- 33.
Mainali HR,Vadivel Ak,Li X,Gijzen M,Dhaubhadel S. Soybean Cellophilin Gmcyp1与异戊类稳压器GMMYB176相互作用。SCI REP。2017; 7:39550。
- 34.
关键词:Avr3b, nudix水解酶,植物亲和素,植物亲和素,酶活性公共科学图书馆Pathog。2015;11 (8):e1005139。
- 35.
张H,王继,李S,王S,刘米,王W,赵Y.抗真菌环旋蛋白蛋白的分子克隆,表达,纯化和功能表征Panax Ginseng..生物医学报告。2017; 7(6):527-31。
- 36.
Lee JR, Park S-C, Kim J-Y, Lee SS, Park Y, Cheong G-W,咸K-S, Lee SY。一种具有抗真菌活性的大白菜嗜环素的分子和功能特性。生物化学学报。2007;353(3):672-8。
- 37.
叶XY,吴TB。从鹰嘴豆中分离一种新的具有有丝分裂、抗真菌和抗hiv -1逆转录酶活性的亲环素样蛋白。生命科学。2002;70(10):1129 - 38。
- 38.
叶XY,吴TB。从黑眼豆中分离出具有抗有丝分裂、抗病毒和抗真菌活性的亲环蛋白Unguilin。蛋白质化学。2001;20(5):353-9。
- 39。
THEIS T,STAHL U.抗真菌蛋白:目标,机制和前瞻性应用。细胞mol寿命。2004; 61(4):437-55。
- 40。
Chan BP, Kim HS, Sun CK。抗菌肽布福林II的作用机制:布福林II通过穿透细胞膜抑制细胞功能来杀灭微生物。生物化学学报。1998;44(1):253-7。
- 41。
周tt,赵友,郭慧。分泌蛋白在根部感染期间递送至静止体组织的渗透界面verticillium dahliae..公共科学图书馆Pathog。2017;13 (3):e1006275。
- 42。
张勇,王旭,荣伟,杨军,李志,吴磊,张刚,马志强Gossypium barbadense.而不是G. Hirsutum与抵抗力相关verticillium dahliae..Mol植物微生物相互作用。2017; 30(12):984-96。
- 43.
王GN,赵果,岳XW,李泽,张y,张gy,吴lq,王xf,ma zy。致病性和ISSR遗传分化verticillium dahliae.分离自河北省棉花种植区。棉花科学。2012;24(4):348 - 57。
- 44.
杨杰,吉L,王X,张y,吴l,杨y,ma z.过表达3-脱氧-7-磷酸骨合酶基因gossypium hirsutum提高拟南芥抗性枯萎病。植物细胞批准。2015; 34(8):1429-41。
- 45.
Artico S,Nardeli Sm,Brilhante O,Grossi-de-SA MF,Alves-Ferreira M.识别和评估新参考基因gossypium hirsutum用于准确归一化实时定量RT-PCR数据。BMC植物BIOL。2010; 10:49。
- 46.
chechowski T, Stitt M, Altmann T, Udvardi MK, Scheible W-R。基因的全基因组鉴定和检测拟南芥.植物杂志。2005;139(1):5。
- 47.
花的倾斜:一种简化的方法农杆菌介断的转换拟南芥蒂利亚纳.植物j . 1998; 16(6): 735 - 43。
- 48.
张b,杨y,陈t,yu w,liu t,li h,风扇x,ren y,shen d,liu l等。岛棉花Gbve1编码受体样蛋白的基因赋予抗脱落和非落叶分离株的抗性verticillium dahliae..Plos一个。2012; 7(12):E51091。
- 49。
FRADIN EF,Zhang Z,Juarez Ayala JC,Castroverde CD,Nazar RN,Robb J,Liu CM,Thomma BP。番茄介导的黄萎病抗性的遗传解剖VE1..植物理性。2009; 150(1):320-32。
- 50.
Cary JW, Jaynes JM,克利夫兰TRK。转基因表达的基因编码的合成抗菌肽导致抑制真菌生长在体外和植物。植物科学。2000;154(2):171 - 81。
致谢
所有作者都感谢实验室成员寻求帮助,建议和讨论。
资金
来自中国国家重点研发计划的补助金(2016YFD0101006),河北省顶级人才基金以及河北农业大学作物科学研究小组建设基金(TD2016C328)得到了支持这项工作。除了提供资金以支持这项工作之外,没有资助机构都没有参与研究。
作者信息
从属关系
贡献
JY,XW和ZM设计了实验。JY进行了研究并写了稿件。GW和LJ进行QRT-PCR并评估转基因拟南芥的抗性诉dahliae.LH和CZ纯化重组蛋白并测定其抗真菌活性。HK和YZ进行了数据分析。所有作者都已阅读并批准该手稿的发表。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
杨,J.,王,G.,Ke,H.等等。嗜环素基因的全基因组鉴定gossypium hirsutum和具有抗真菌活性的CYP的功能特征verticillium dahliae..BMC植物BIOL.19,272(2019)。https://doi.org/10.1186/s12870-019-1848.1.
已收到:
公认:
发表:
关键词
- cyclophilin.
- 棉花
- 电阻
- verticillium dahliae.
- 抗真菌活动