抽象的
背景
干药疾病引起的Plasmodiophora brassicae(植物霉素,rhizaria)是经济上最重要的疾病之一芸苔作物。受感染植物的典型特征是形成肥厚的根,并伴有代谢和激素稳态的改变。并非所有受感染植物的根都表现出相同的表型变化。一些根未受感染,另一些则长出不同大小的瘿。本研究的目的是分析和比较植物内部的异质性p . brassicae根胆子和同一宿主植物的症状根(甘蓝使用转录组分析从奥地利的一个商业领域收集的。
结果
无症状根与胆组织的转录组差异显著。无症状的根表现出先前描述的抗病植物的转录组特征。在无症状的根中,参与宿主细胞壁合成和增强的基因表达上调,表明对宿主的耐受性提高p . brassicae.相反,参与细胞壁降解和改性方法的基因,如膨胀等膨胀中的根胆汁。激素代谢差异不同于症状根和胆量。芸苔类固醇合成在根脑中下调,而茉莉酸合成在症状根中下调。在症状根中,细胞素素代谢和信号传导除了一个CKX6同源物,其被强烈下调。与根胆组织相比,水杨酸(SA)介导的防御反应在症状根中上调。这可能是由分泌的苯甲酸/水杨酸甲基转移酶从病原体(PBBSMT)引起的,这是胆组织中最高表达的病原体基因之一。PBBSMT衍生的甲基-SA可能导致未感染的根部的病原体耐受性增加。
结论
根瘤病感染植株和未感染植株的根在抗根瘤病和感病宿主之间表现出类似于先前描述的转录组差异。本文所描述的植物内异质性表明,为了更好地了解根茎病的定位,对根茎病植株的空间分析将是了解这一重要的经济病害的关键。
背景
干药疾病是最重要的疾病之一芸苔全球作物占大约10%的损失芸苔蔬菜,饲料和油籽作物[1].club broot是由Plasmodiophora brassicae,一种专性生物营养原生生物,在分类学上属于真核生物超群Rhizaria中的Phytomyxea [2,3.].这种土传病原体具有复杂的生命周期。游动孢子感染原发疟原虫形成的根毛。这些疟原虫发育成次级游动孢子,次级游动孢子被释放到土壤中,再次感染根皮层,次级疟原虫在根皮层发育[4].次级疟原虫成熟为静止孢子,释放到土壤中。在受感染的宿主中,感染引起组织分裂和细胞伸长,导致受感染的根过度战利品,形成典型的根瘿或根杆状根(图1)。1).
Plasmodiophora brassicae只能在与其主持人的共同文化中种植和研究。这阻碍了对分子基础的目标和大规模研究p . brassicae与宿主的相互作用[5].由于干毒病疾病的经济重要性,众多研究分析了植物病原体相互作用的生物学,生理学和分子生物学的具体方面,以更好地理解和控制疾病。这些实验研究中的第一个基于Arabidopsis / Plasmodiophora.Pathosystem e.g.[6,7].在过去的几年中,越来越多的芸苔(主机)基因组可用[8,9,10,11],几个p . brassicae基因组[12,13,14,15]允许新的研究方法,包括有针对性的转录组研究。与未感染的植物相比,存在杆菌感染植物根源的(植物)转录om的分析[14,16,17,18],宿主品种易感和耐受性的球杆素[14,19,或宿主的反应不同p . brassicae分离[6,16,20.,21].
植物感染了p . brassicae表现出明显的生理变化,包括细胞壁生物合成、植物激素代谢和植物防御相关过程。扩展素基因,涉及植物细胞的扩展和伸长[22],上调p . brassicae受感染的根[6,16,23].在p . brassicae受感染的根葡聚糖吲哚糖基糖基酶/水解酶(xth)的酶活性增加[24,而早期回应p . brassicae感染是提供木质素前体的苯基丙素途径上调[18].随着甘蓝的发展进展,干旱组织的木质化减少了[25]和参与木质素化过程的基因被下调[26].另一方面,细胞壁增厚和木质化被认为是限制病原菌在耐受性的传播b . oleracea[27),B. Rapa.[28].
根茎病症状的发展伴随着植物激素稳态的变化[6,17,29].在根砧发育过程中,生长素介导宿主细胞的分裂和伸长。生长素在根砧发育过程中随时间增加,在根砧中积累p . brassicae感染的组织在水槽中像播出[29].此外,属于生长素结合蛋白GH3家族的基因在杆状茎发育过程中受到不同的调控[30.]鉴定了一个GH3蛋白基因(PBGH3; CEP01995.1)p . brassicae基因组(12].细胞分裂素(ck)最初增加,但随着胆汁形成的开始再次减少[17].同时p . brassicae疟原虫产生少量的克氏杆菌[31.].因此,CKS在疾病发展中发挥至关重要的作用,而不仅仅是通过它们对细胞分裂的调节,而且通过它们对糖代谢和转化酶产生的干扰,这可能对营养至关重要p . brassicae[32.,33.].
应激和防御相关的植物激素,如水杨酸(SA)、茉莉酸(JA)、油菜素内酯(BR)和乙烯(ET)以及它们的调控途径也在对病原体感染的反应中发生变化[34.].SA的积累在植物防御对生物营养病原体中起着关键作用,通常导致局部的过敏反应和诱导病原相关(PR)基因。全身获得的抗性(SAR)是在暴露于微生物或化学刺激的elictors之后SA通过SA激活的诱导抗性的一种诱导抗性的形式[35.].高水平的内源性SA和外源性SA降低了对宿主的感染p . brassicae[20.,36.].在耐受宿主中,SA相关基因在感染时被诱导[16,21,37.].的SAR-deficientNPR1-1.和Sa缺乏的等抚养合酶1(ICS1)sid2 rabidopsis.突变体表现出对p . brassicae,而Bik-1突变体,升高的SA水平,更具抗性[38.].通过SAR诱导发病性相关的防御蛋白质,并且在易受易受的抗性方面表达更高度B. Rapa.和拟南芥物种(14,39.,40].p . brassicae可能通过分泌甲基转移酶(PbBSMT;AFK13134.1)。这种sabath样甲基转移酶已被证明在体外将SA转化为甲基水杨酸盐(MeSA) [41.].拟议的功能在Planta.在本地感染的组织去除SA作为台面波动。拟南芥表达PbBMST基因的突变体表现出较高的易感性p . brassicae[42.].
的p . brassicaePBGH3还能够在体外用氨基酸将JA缀合[12].一般来说,JA与对坏死营养微生物的耐药性有关[43.,44.].在A. Thaliana.在受感染的根组织中诱导了几个JA应答基因,JA在瘿中积累[6,45.].jasMonate抗性1(jar1.)突变体,在JA-Ile积累受损,表现出较高的易感性p . brassicae[16,45.].因此,JA反应导致对某些菌株的基础抗性p . brassicae在A. Thaliana.Col-0 [45.].但在部分抵抗力拟南芥与敏感的Col-0相比,bur0仅发现较弱的JA反应[46.].一般来说,马蹄莲易感主宿主显示出高水平的JA响应,而在抗性主机中减少了[14,19].如果JA在特定宿主中由JA诱导脂族或芳香族葡糖苷产量,则可能导致这些差异可能是由于发生的[47.].
本研究的目的是产生第一个数据集的根组织特异性转录反应的个别植物在棒根发育。通常,受棒根病感染的植株并不是在所有的根部都出现症状,有些根表现出强烈的症状,而有些根本没有症状(图1)。1).我们收集了大头菜(芸苔甘蓝醛。gongylodes) 感染p . brassicae(PbraAT)来自奥地利的一块田地。我们比较了同一染病植物不同形态的根瘤和无症状根。我们从细胞壁代谢、激素代谢和防御反应等方面分析了它们转录组结构的异同。
结果
转录组分析
从所有图书馆共获得1.43亿个高质量的reads,平均长度为125 bp(附加文件2:表S1)。总共10940个基因包括同种型进行了预测p . brassicae和42712年b . oleracea.大约50%的p . brassicae85%的大头菜转录本可以使用eggNOG-mapper进行功能注释。只有0.0005%的无症状根样本(SL)匹配p . brassicae转录物,表明这些根源没有被感染p . brassicae.在白色主轴静脉(WG)和褐色的主轴胆量(BG)文库23和33%的读数匹配p . brassicae(附加文件1:图S1)。
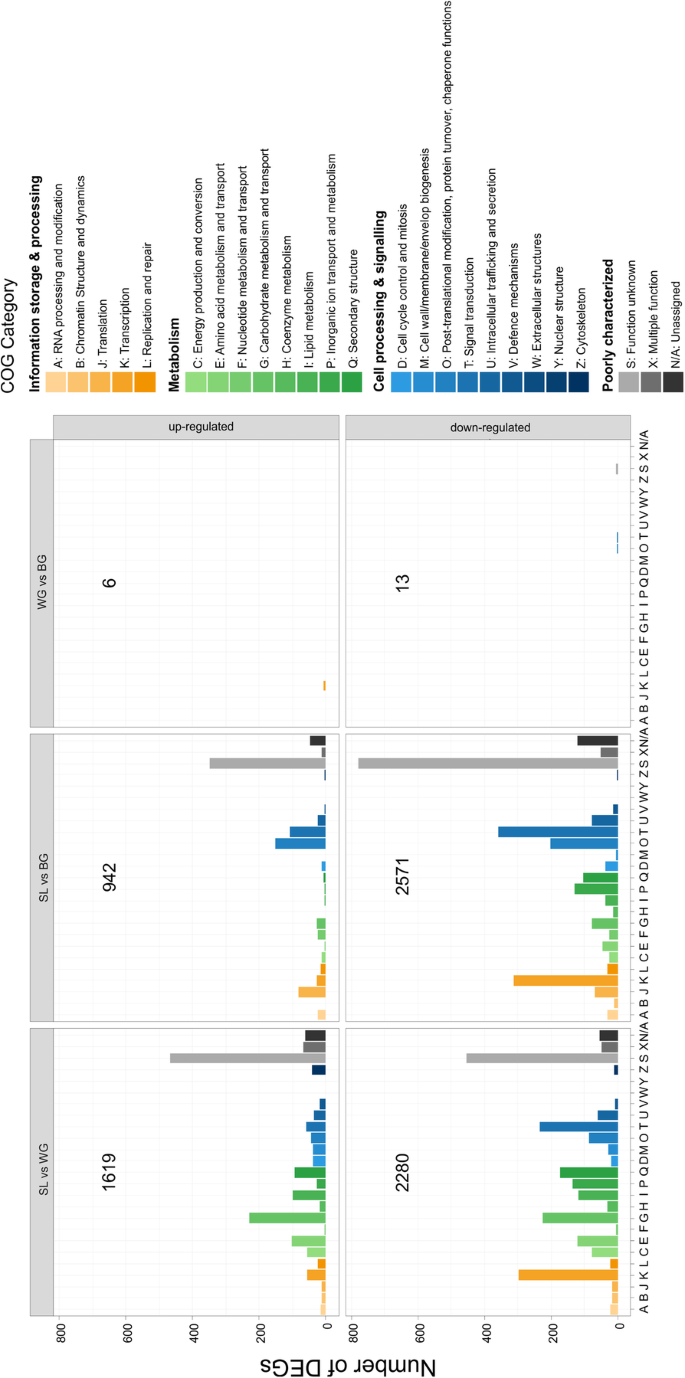
转录组(SL、WG、BG)共包含5204个差异表达基因(DEGs)。与SL相比,在WG 1619中,deg表达上调,2280表达下调(图1)。2,附加文件2在BG中,942个基因表达上调,2571个基因表达下调。在所有的deg中,790个被归类于COG(聚类Of Orthologous Groups)类别“信息和存储处理”,1401个被归类于“代谢”,1245个被归类于“细胞过程和信号”,1768个被归类于“特征不明显”。2,附加文件2:表S3)。BG和WG之间只有19种植物基因差别表达(附加文件2:表S4)。
植物细胞壁代谢
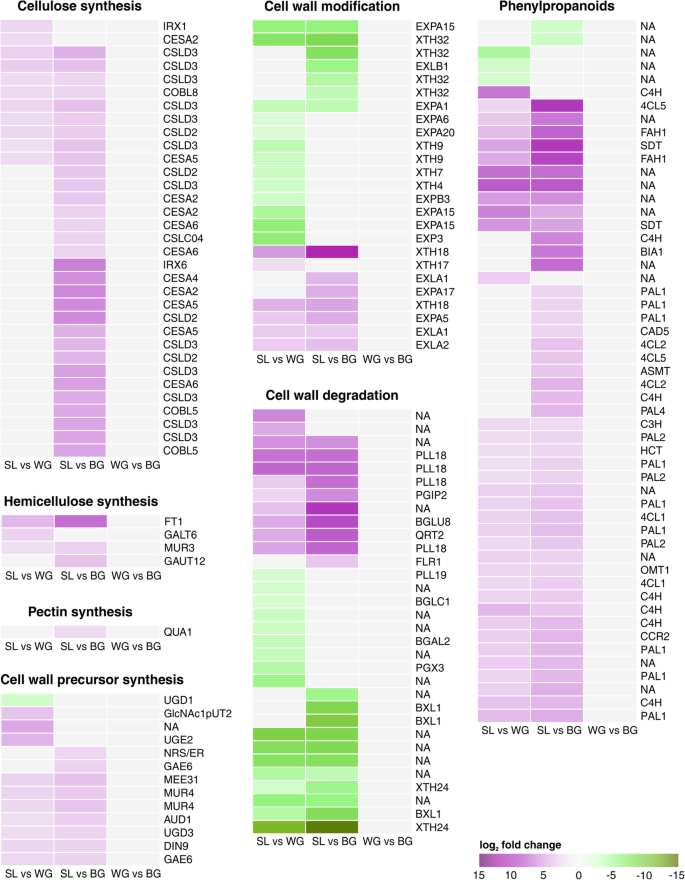
在b . oleracea在被感染植物的5204个DEGs中(SL vs WG vs BG)有161个参与细胞壁的合成、修饰、降解或苯丙代谢。与胆组织相比,参与细胞壁强化的纤维素、半纤维素、果胶和木质素合成基因在SL中上调(图2)。3.),下调参与细胞壁改性和降解的基因(图。3.).细胞壁基因表达的变化在SL和BG之间比SL和WG之间更突出。在SL A UDP-D-葡糖醛酸4-截止酶6(GAE6)同源物中,负责合成UDP-D-葡糖醛酸,果胶的主结构块[48.]表达上调。与WG和BG相比,SL中预测的expansin (EXP)和expansin like (EXL)基因主要下调(图)。3.).编码xth的基因是SL中下调幅度最大的基因,XTH24是所有下调幅度最大的基因。与WG和BG相比,SL中苯丙素途径上调(图)。3.).这包括苯丙氨酸解氨酶1 (PAL1)同源物,木质素生物合成的关键酶。木质素也是木质部的一部分,与BG相比,SL中木质素发生基因表达上调。在SL中也可诱导类黄酮代谢1:图S2)。
Kohlabi细胞壁代谢。群集的Meatmaps的日志2fold改变deg值。与WG和BG相比,SL中涉及细胞壁成分合成过程的基因普遍上调,而分解代谢和修饰基因主要下调。与WG和BG相比,没有deg出现。上调基因用紫色表示,下调基因用绿色表示。拟南芥同源染色体。基因被注释并根据Mapman / Mercator分类。NA:未由Mapman分配。包括KEGG,EGGNOG和TAIR注释(包括KEGG,EGHNOG和TAIR注释)的附加文件信息3.
植物激素
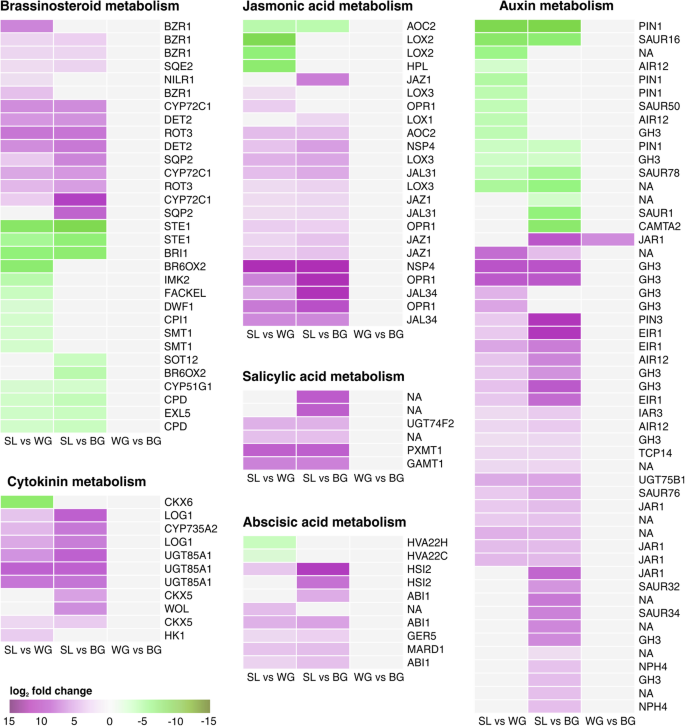
与S1相比,在WG和Bg中改变CK和养蛋白代谢(图。4).与WG相比,SL中CKX6(细胞分裂素氧化酶/脱氢酶6)同源物下调。CKX5同源物、CK受体和CK调节的udp -糖基转移酶在SL中上调。与根瘤相比,CK合成基因CYP735A2(细胞色素P450)和LOG1(孤独的家伙1)在SL中上调(图)。4).在ck信号转导的下游,我们发现了ARR(拟南芥反应调节剂;ck信号靶)基因(图。4).类型-B ARR在WG和BG中差异表达,而差分表达类型-A ARR专用于BG。与Bg相比,在SL中升高了一个推定的AHK4(拟南芥组氨酸激酶4; CK-受体)基因。虽然SL中的表达值低,但是在未检测到的Bg中升高。与Root胆相比,在SL中发现了没有含量的AHPS(拟南芥组氨酸磷光酯蛋白)。与胆组织相比,大多数养蛋白相关的果酒,毒素响应因子(ARF和IAAS)和IAA氨基酸缀合物合成酶(GH3)上调(附加文件1:图S3)。然而,下调GH3.2的IAA7(阻滞诱导型诱导基因的阻遏物)和同源物。在S1中还原销形成的1(PIN1)基因的表达(图。4),在上调和下调的℃下发现Saur(小型养蛋白上调的RNA)和Air12(在根培养物蛋白12样)基因中(根培养蛋白12样)基因)(图。4).与瘿瘤相比,SL中芥子酶和腈酶的表达上调(附加文件1:图S4)。在BG中,与WG相比,与生长素合成和调控相关的两个转录本下调(附加文件)2:表S4)。
Kohlrabi phytohormone新陈代谢。日志的热量2fold改变deg值。SL中涉及细胞分裂素、茉莉酸、水杨酸和脱落酸代谢的基因上调。油菜素内酯的编码基因分为两类:BR生物合成后期(下调)和早期固醇生物合成(上调)。与根瘿相比,SL中上调和下调的DEGs中均存在与生长素代谢相关的基因。在WG和BG之间发现了一个deg (JAR1)。上调基因用紫色表示,下调基因用绿色表示。拟南芥同源染色体。基因根据MapMan/Mercator注释和分类,除了细胞分裂素代谢的基因被描述为[17].NA:未由Mapman分配。包括KEGG,EGGNOG和TAIR注释(包括KEGG,EGHNOG和TAIR注释)的附加文件信息4
与胆汁相比,早期甾醇生物合成基因,例如类固醇还原酶Det2,在SL中上调(图。4).然而,Br生物合成基因通常在S1中调节下调(图。4,包括DWF1 (dwarf 1)或BRI1 (BR受体油菜素内酯不敏感1)等关键基因。
与WG和BG相比,SL中ABA信号转导相关基因如ABI1 (ABA不敏感1)和HSI2(糖诱导基因2高表达)的表达上调(图2)。4而ABA相关转录因子WRKY18和HVA22A/C同源物在SL中表达下调(图。4,附加文件1:图S5)。
植物防御
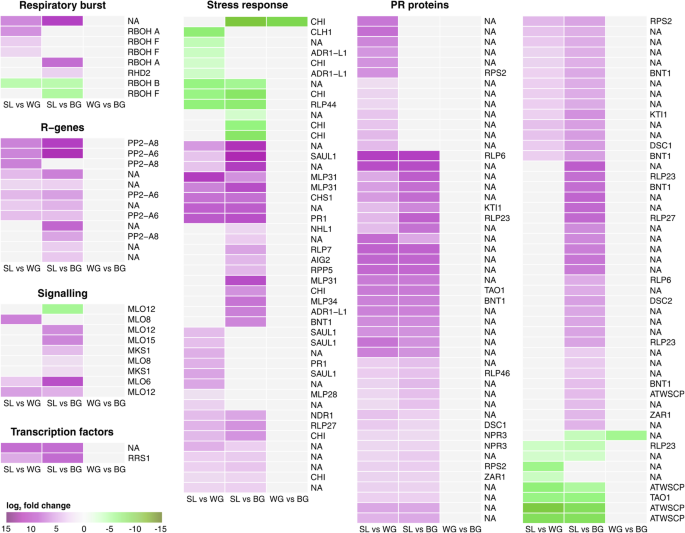
通常,与WG和Bg相比,在SL中上调抗病蛋白基因(图。5,附加文件1:图S6)。从病原体识别基因、信号蛋白和转录因子到致病相关蛋白,整个病原体防御的信号级联都受到了影响。在被感染植物中(SL、WG、BG)预测的防御相关DEGs中,60个被划分为TIR-NBS-LRR (Toll/白介素-1受体核苷酸结合位点富亮氨酸重复)类蛋白。与根瘿相比,r基因中只有PP2-A6和PP2-A8(韧皮部蛋白2-A)可以被注释,并且在SL中表达上调。5).表达抗病蛋白RSP4的基因未在组织类型之间改变(附加文件5).编码用于MLO(MILDED抗性基因座O)和MKS1(MAP激酶底物1)的信号传导基因在SL中上调(图。5),虽然观察到曲线或SRF1的表达(RSP4-RDL1)基因的表达没有差异(附加文件5).与根瘿相比,SL中参与生物胁迫信号级联的两个转录因子(MapMan bin 20.1.5)上调(图2)。5).MAP3K(促丝裂原激活激酶激酶激酶)和RSH(Rela / Spot Homolog)基因在感染植物内没有差异表达(附加文件5).
Kohlabi的生物应激反应。日志的热量2fold改变deg值。与根胆相比,几乎所有的DEG都在SL中调节。在WG和BG之间发现了两个下调的次数,一丁质酶(CHI)和未知功能的基因。上调基因用紫色表示,下调基因用绿色表示。拟南芥同源染色体。基因被注释并根据Mapman / Mercator分类。NA:未由Mapmman分配。包括KEGG,EGGNOG和TAIR注释(包括KEGG,EGHNOG和TAIR注释)的附加文件信息5
与虫胆相比,SL中与BRI1和BAK1 (BRI1相关受体激酶)相互作用以诱导防御反应的BIK1(葡萄孢诱导激酶1)上调(附加文件)1:图S7)。
在SL样品中,诸如LOX2(脂氧合酶2),AOC(联烯氧化环酶)和HPL(海藻酶)的相关基因进行了下调,而其他LOX基因和JA酰胺合成酶GAR1上调与胆量相比(图。4).在BG和WG之间发现了一个下调的JAR1的异构型。我们发现我们的研究中没有氨基葡萄糖生物合成基因。
与胆量相比,SA修饰的基因如SA甲基化SABATH甲基转移酶基因(PXMT1,GAMT1)和SA-葡糖苷酶(UGT74F2)上调(图。4).SA诱导的PR1基因在SL中被诱导(图。5,附加文件1:图S6)。在我们的样品中,PR-基因表达稳压剂NPR1(PR1的非富沸点)在我们的样品中没有差异表达。通过NPR1调节PR1表达的基因,Wrky70在S1中下调,而NPR3和TGA3被上调(图。5,附加文件1:图S5)。Tao1抗病蛋白的基因,其在SL中诱导PR1表达,以及建立过敏反应和SAR所需的NDR1(非种族特异性疾病抗性1)基因。由NDR1激活的抗病蛋白RPS2的基因在S1中也上调(图。5,附加文件1:图S6)。另外,在S1中下调编码用于蛋白酶抑制剂基因,R-基因或一些几章酶的其他防御相关基因(图。5).
p . brassicae基因表达
的p . brassicae具有最高FPKM值的基因属于增长和细胞过程相关的COG类别,如翻译,转录和信号转导,也具有能量转化和碳水化合物和脂质代谢(附加文件1:图S8)。的p . brassicaePbBSMT基因是表达量最高的病原体基因之一(附加文件)2:表S5, S6)。其他高表达基因包括热休克蛋白、谷胱甘肽- s -转移酶、锚蛋白重复结构域蛋白、核糖体基因和功能未知的基因(附加文件)2:表S5, S6)。PbGH3基因在我们的样本中没有表达。的p . brassicae蛋白酶基因PRO1,被认为参与孢子萌发[49.],在WG和BG中表达。
WG和BG样品只有五间p . brassicae鉴定了DEGs,编码HSP,染色体维持蛋白,dna定向rna聚合酶,逆转录转座子和Scl Tal1中断位点蛋白(附加文件)2:表S7)。
累积所有FPKM值显示最多测序的读数p . brassicae从根瘿提取的RNA (WG和BG)映射到COG类别“翻译后修饰,蛋白质转换,伴侣功能”和“翻译”(附加文件)1:图S9)。很少p . brassicae读取是在从SL得到的数据中发现的(附加文件1:图S1, S10),这些极有可能来自附着的孢子或土壤颗粒污染。
讨论
根瘤病植株无症状根系表现出抗/耐根瘤植株的转录组特征
我们发现来自同一植物的无症状根和杆状根在转录组谱上表现出差异,类似于前面描述的抗病和易感植物之间的根差异[40,50.].症状根的基因表达模式类似于用于抗性主体所描述的图案,而在球杆状组织模式中类似于在易感植物中观察的组织模式。
先前据报道,妨碍了细胞壁的加固妨碍了p . brassicae在耐药b . oleracea[27),B. Rapa.愈伤组织文化(28].与根瘤组织相比,SL组织中木质素生物合成基因上调(图。3.).在感染植物的芽中观察到诱导的跛足过程[23抗性和易感之间b . oleracea品种(21].Pal1,Lignin,SA中的关键酶(下面讨论)和黄酮类生物合成[51.,52.,53.与杆菌组织相比,在症状根部上调(图。3.).木质素生物合成的增加和PAL1的上调已被描述为抗根瘤油籽B. Rapa.线携带抗性基因RCR1 [53.,而过表达PAL1的愈伤组织培养物抗p . brassicae[28].因此,根系强化似乎是植物耐受机制的一部分p . brassicae它的基因组中只有有限的植物细胞壁降解酶[12,13],并通过一种叫做“施塔谢尔和罗尔”的特殊挤出体的机械力感染宿主[4].一次p . brassicae已讨论通过PlasmodesMata讨论了根部组织中的运动和传播的主体,在根组织中进行展开[27,54.,55.].通过症状根部的基因表达模式表明,细胞壁的稳定性增加(图。3.)或用于抗性植物[27,28,需要更高的机械力才能成功感染尚未感染的根或在宿主细胞之间移动。因此,寄主细胞的细胞壁增强可能是一个相当大的障碍p . brassicae.与胆量相比,SL比较增加的结果也可能是压抑Xylem发展的结果p . brassicae受感染的主机(56.].
在受感染植物无症状的根中,由激素调节的防御相关途径表现出的模式通常与诱导的植物防御有关(图。4).另一方面,马蹄形组织表现出抑制SA防御相关过程。SA生物合成基因在SL中上调,但在胆量中被下调。水杨酸可以通过同胞(ICS途径)或苯丙氨酸(通过PAL途径)合成[36.,43.].因此,无症状根中PAL1基因的上调也可能与依赖于pal的SA合成有关,但棒根中的大多数SA是通过ICS途径产生的[36.].基于ICS1(不显著)和WRKY28的高表达(附加文件1:图S5)SA的合成很可能在SL中诱导。在球杆状抵抗宿主中,通常诱导SA - 防御[14,36.,39.],而SA缺陷sid2(ICS1)突变体拟南芥更容易受到影响p . brassicae感染(38.].
植物组织中高水平的SA有助于减少新的p . brassicae感染[20.,但单靠SA不足以诱导抗性p . brassicae[36.].因为SA水平增加了球杆菌组织,p . brassicae被认为是sabath型甲基转移酶的秘密[PbBSMT;42,43],是表达量最高的基因之一p . brassicae在这项研究中(附加文件2:表S5, S6)。PbBSMT已被证明能甲基化水杨酸,有助于胆汁中SA的局部减少[41.].MESA是植物中SA的主要运输形式,在诱导SAR中具有关键作用[57.,58.].因此,基于我们的数据,我们假设这一点p . brassicae通过PBBMST介导的甲基化减少胆汁中的SA浓度[41.].产生的MeSA可以触发植物远处部分与sa相关的防御,这些防御对新的病原体感染变得有弹性。
SA下游的过程是通过NPR1介导的(在我们的数据集中没有差异表达)。NPR1与TGA3结合后诱导pr基因表达[59.].在其与WRKY70的相互作用中,NPR1用作SA Biosynthesis基因ICS1的负调节剂[60.].因此,在SL中观察到TGA3的上调(附加文件1:图S5)会导致SL中pr基因的表达。与瘿虫相比,SL中WRKY70的表达减少会导致无症状的根组织中SA的产生增加。此外,我们发现NPR3基因的上调,编码sa防御基因的阻遏因子[61.],在SL与虫瘿(图进行比较。5).当与SA结合时,NPR3将失去抑制SA防御基因的功能[61.].在SL中NPR3的高表达可能是必要的,以补偿无症状根中SA合成的负面影响。
茉莉酸导致对某些菌株的基础抗性P. Brassicae。拟南芥Col-0和A. Thaliana.在JA-Ile积累受损的突变体表现出较高的易感性p . brassicae[16,45.].在A. Thaliana.在受感染的根组织中诱导了几个JA应答基因,JA在瘿中积累[6,45.].但在部分抵抗力拟南芥与敏感的Col-0相比,bur0仅发现较弱的JA反应[46.].这些差异可能是由于JA在特定宿主中诱导产生脂肪族或芳香硫代葡萄糖苷[47.].一般来说,马蹄莲易感主宿主显示出高水平的JA响应,而在抗性主机中减少了[14,19].在我们的样本中,JAZ基因在SL中的表达高于胆汁组织(图。4).JAZ蛋白在JA信号中作为JA共受体和转录抑制因子[62.,降低了SL中JA的合成b . oleracea植物,其中JAZ表达上调在抗性植物和JA合成在易感植物[被高度诱导21].在ja代谢基因HPL中,LOX2在瘿虫中的表达上调。LOX2是oxylipin挥发物形成所必需的[63.].HPL蛋白与ja合成所必需的底物竞争,产生挥发性和非挥发性oxylipin [64.].HPL和LOX2在虫瘿中的高表达可能导致挥发性醛的产生,而不是JA在虫瘿中的积累。
在SL中,br合成和br信号转导基因下调(图。4).BRs是棒根组织发育所必需的[65.],因而是在生物圈也妨碍还原p . brassicae类受体细胞质激酶BIK1是一种br合成的负调控因子[66.],在SL中诱发(附加文件1:图S7)。拟南芥bik1基因敲除突变体对p . brassicae缺乏典型的病原体表型的[14,38.].对于Bik1,SL根的表达不同于耐植物,如拟南芥bik1基因敲除突变体对p . brassicae[14,38.].在拟南芥bik1杆状芽病抗性可能不是由于BIK1对BR的调节功能,而是由于PR1在该突变体中的表达增加[38.].
同一植物的症状根和球杆素的转录om明显不同
梅花根和无症状根相同p . brassicae感染的植物显示出明显不同的基因表达模式。球杆素的形态变化与减少细胞壁稳定性和生长相关过程的基因表达。细胞壁 - 松动过程的基因,如膨胀蛋白和曲线[67.,68.,在胆汁组织中表达上调(图。3.).报告了膨胀蛋白的上调拟南芥棒状硬化根组织(6,23,而XTH活动在B. Rapa.杆菌[24].对胆组织中木葡聚糖、木聚糖、半纤维素、果胶和木质素合成的抑制意味着胆组织中细胞壁稳定性和硬度的进一步降低,这与以前的发现类似[21,65.].GAE6表达降低支持根肿病发展的虫瘿:rapidopsis gae1.,gae6,gae1 / gae6突变体的叶细胞壁中含有较低水平的果胶,这使它们更容易受到假单胞菌含油和Botrytis cinerea[69.].类似的机制可能受益p . brassicae.木质素途径的诱导是早期反应(48 h)拟南芥[18].在我们研究中调查的褐色kohlrabi胆量中,褐化基因是下调的p . brassicae在已经建立的组织中抑制宿主木质化。在显著CCoAOMT(咖啡酰辅酶a o -甲基转移酶)的下调也暗示了木质化的减少[26].这里,尽管没有统计学意义,CCoAOMT在根瘿中也比SL表达低,这意味着根瘤中木质素生物合成减少。
植物根部的显着肥大随着生长激素CK和毒素的稳态而变化,似乎是主机和时间依赖的[29,40].除CKX6外,SL中细胞分裂素相关基因上调(图。4).激素平衡的微调似乎是球杆菌病发展至关重要[29].CK水平的升高通过增加细胞分裂对疾病的发生发展非常重要。然而,在胆汁形成开始时,CK代谢基因包括CK合成和降解酶受到抑制[6,17].在SL中更活跃的CK代谢可能以CKX过表达的方式干扰了根瘤的发育拟南芥突变体显示胆汁形成减少[6].在我们的大头菜样品中,与WG相比,SL中CKX6的表达明显下调,但与BG相比没有下调(图2)。4).CKX6在WG中的高表达表明存在疟原虫,因为该基因仅在含有p . brassicae疟原虫[65.].虽然AHK4被描述为高度诱导感染A. Thalinana.植物10dpi [6],在另一项研究中,AHK和AHP基因在感染和未感染之间的表达没有差异拟南芥在以后的时间点[17].与这些发现相似的是,在我们的更长的感染大头菜植株中,AHK和AHP基因在SL和根瘿之间没有差异表达。表达水平也非常低,表明这些基因在分析的根中没有主要作用。ar5基因在染病根和下胚轴组织16和26 dpi中下调A. Thaliana.[17],但在另一项研究中,ar5在受感染根中上调了10dpi [6].为了芸苔主机,尚未描述ARR5的ARR5表达尚未描述。在我们的样本ARR5水平中,BG增加,但在SL和WG之间没有看到差异。ARR5基因似乎在这里研究的感染阶段没有突出作用。还证明了p . brassicae通过PbCKX干扰CK平衡p . brassicae在本研究中未见PbCKX基因表达。
与胆量相比,可以将来自次级代谢物或芳族氨基酸的血清素合成毒素的硫代脲酶和硝酸酯酶(附加文件1:图S4),但先前据报道旨在诱发拟南芥擦伤(6,70].生长素诱导的GH3基因家族将IAA与几种氨基酸结合,参与植物对非生物和生物胁迫的各种反应。研究表明,GH3.2基因在马铃薯根中特异表达拟南芥[30.],并且在Kohlrabi胆量中也上调。表达式的p . brassicae在本研究中未检测到PbGH3基因并没有出现在生长素在我们的样本胆的舞台上扮演一个角色(或JA)的动态平衡。
除了在SL中所描述的防御反应与抗性植物的防御反应相似外,我们还观察到SL中进一步的防御相关基因的上调(图)。5,附加文件1:图S6)。同系物的拟南芥在SL收费IL-1受体的疾病抗性蛋白涛,NDR1和RPS2基因是上调的。这些基因赋予对在活体营养细菌病原体拟南芥识别效果[71.,72.].在豆类根中,NDR1也通过激活防御反应抑制线虫寄生[73.].因此,我们发现这些蛋白质可能也参与了对p . brassicae.鉴定的差异表达的磷酸蛋白PP2-A6和PP2-A8的同源物含有TIR结构域,因此被分类为R-Genes [74.].然而,韧皮部蛋白在植物中扮演不同的角色[75.],它们的差异表达也可能是根瘤病期间韧皮部发育改变的结果[17,33.,56.].
由于瘿瘤的形成和细根数量的减少,感染根瘤的植物面临着水和养分供应减少等非生物胁迫。ABA相关基因的差异表达(图。4因此,可能对胆汁中非生物应激的反应。较低的供水也可能是Xylem生产减少的结果[56.].
结论
梅花根和无症状根相同p . brassicae感染的植物表现出非常不同的基因表达模式。如在无症状根增加细胞壁的稳定性在植物激素代谢的差异可能是负责瘿组织在不同的结果和无症状的根源。这些结果强调,在解释根肿转录或整根系统的任何其他数据起源可能导致生物相关签名的稀释。这显然需要进一步的研究分析根肿病感染的植物内和跨组织的特定模式。作为参与性反应的基因p . brassicae在症状根中上调,这可能有助于鉴定抗性育种的新型性状。
方法
抽样
Kohlrabi“紫色维也纳”植物从一个杆菌收集p . brassicae2016年8月,在Ranggen(蒂罗尔,奥地利,47°15 ' 27″N 11°12 ' 37″E)的田间,经农民同意。收集这些示例不需要其他权限。根据可见性质,根样品可分为无症状根(SL)、外观蜡样的白色锭子瘿(WG)和较大的褐色锭子瘿(BG)(图。1).从三种单独的球杆菌感染植物中以三种唾液染成样品。在取样品(类别SL,WG和BG)并转移到RNA之前,用自来水彻底洗涤胆汁用自来水洗涤晚些时候™(Ambion, Austin, TX, USA),直到RNA提取。
RNA提取和测序
切除根瘿的外层,将修剪后的根茎和无症状的根茎在液氮中快速冷冻,转移到1.5 mL含RNase无氧化锆珠(直径0.5 mm和2mm)的管中。使用快速prep (MP Biomedicals, Santa Ana, CA, USA)在6 m s的时间内均质40 s- 1然后用杵手工研磨,反复冷冻。根据制造商的说明,使用Qiagen RNeasy Plant Mini Kit (Qiagen, Hilden, Germany)提取总RNA,但在洗脱前使用额外的80%乙醇柱洗。使用安捷伦生物分析仪2100(安捷伦技术公司,Palo Alto, CA, USA)测定RNA的数量和质量。额外的RNA质量评估,polyA选择(SENSE mRNA-Seq Library Prep Kit;Lexogen,维也纳,奥地利),图书馆建设(9个图书馆;3x SL, 3x WG, 3x BG),并在VBCF NGS单元(奥地利维也纳)进行测序。测序在Illumina HiSeq 2500平台(Illumina, San Diego, CA, USA)上进行,采用v4化学法对链特异性配对端库(2 × 125 bp)进行测序。
生物信息学
使用FastQC (https://www.bioinformatics.babraham.ac.uk/projects/fastqc/).除去Illumina适配器,使用Trimmomatic V0.36(滑动窗5bp;平均质量得分> 20)保持良好的质量读数。76.].在重复的FASTQC检查后进一步处理具有最小长度为75bp的读数,以确认质量改进。转录物使用Trinity v2.2组装De Novo组装[77.]与链特异性库型(RF)和剪辑的Jaccard选项。使用嵌入式三位一体RSEM [进行表达推定78.只保留每百万碱基至少一个片段(FPKM > 1)和亚型百分比(IsoPct) > 1%的转录本。
使用BLASTN喷出组装的转录物[79.的编码序列(CDS)b . oleracea[10;http://brassicadb.org/brad/datasets/pub/Genomes/Brassica_oleracea/V1.1/和一个自定义数据库,该数据库包含p . brassicae株E3 [12pt3 [13],如果该转录本来源于病原体或宿主(e值< 10- 5).在这两个参考数据库爆炸命中成绩单手动分析,根据其序列同一性和E值,以确定其来源。以任何参考没有命中转录物喷砂(BLASTP)对国家生物技术信息中心(NCBI)的非冗余蛋白质数据库和手动分配给相应的物种或丢弃用于进一步分析。与最佳匹配的十字花科参考序列转录物分配给主机转录。与命中成绩单p . brassicae序列被分配到病原体转录组。使用TransDecoder v3.0.1预测开放阅读帧(ORFs) (https://github.com/TransDecoder/).仅使用每个转录本最长的ORF进行进一步分析。翻译的肽序列使用KEGG(京都基因和基因组百科全书)自动注释服务器(KAAS)注释[80]和蛋酒映射器v0.99.3 [81.].使用金刚砂另外注释Kohlrabi基因[82.]使用默认设置。墨卡托类别被用于MapMan v3.6.0RC1 [83.将预测基因进入群组。推定的分泌蛋白p . brassicae在Phobius v1.01中预测[84.]及SignalP v4.1 [85.结合TMHMM 2.0 [86.].使用DBCAN预测碳水化合物活性酶[87.].
日志2使用带默认设置的edger计算差异表达基因(DEGS)的折叠变化[88.].所有具有错误发现率(FDR)<0.05的次数都被视为DEG。使用R V3.3.2创建所选Mercator / Mapman类别的Heatmaps [89.]与封装“pheatmap” v1.0.8(https://cran.r-project.org/web/packages/pheatmap/index.html)采用UPGMA聚类。预测的标签b . oleracea根据它们的同源物完成基因A. Thaliana.从拟南芥信息资源TAIR(拟南芥信息资源)中提取基因,并在必要时进行调整。使用R包' ggplot2 ' v2.2.1可视化了丰富的deg [90.].
数据和材料的可用性
在目前的研究中生成和分析的数据集可在欧洲核苷酸档案(ENA;https://www.ebi.ac.uk/ena.)存储库(Accessions ERR2567399-ERR2567408)或可从相应的作者请求。
缩写
- 阿巴:
-
脱盐酸
- BG:
-
棕色主轴胆
- BR:
-
油菜素内酯
- CD:
-
编码序列
- CK:
-
cytokinin.
- 齿轮:
-
局部群体的簇
- 度:
-
差异表达基因
- DPI:
-
接种后的日子
- 等:
-
乙烯
- 罗斯福:
-
错误发现率
- FPKM:
-
每百万千碱基片段
- IsoPct:
-
同种型比例
- 是:
-
茉莉酸
- 台面:
-
水杨酸甲酯
- NCBI:
-
国家生物技术信息中心
- 子:
-
开放阅读框架
- PbraAT:
-
奥地利p . brassicae领域人口
- PR:
-
发病机制相关
- RNA:
-
核糖核酸
- SA:
-
水杨酸
- 山姆:
-
S-腺苷甲硫氨酸
- SL:
-
无症状根
- TAIR:
-
拟南芥信息资源
- WG:
-
白色锭胆
参考
- 1.
迪克森克。脂质炎铜鱼症和干旱性疾病的发生和经济影响。J工厂增长调节。2009; 28(3):194-202。
- 2.
Bulman S, Braselton JP。4 Rhizaria: Phytomyxea。在:DJ ML, Spatafora JW,编辑。分类学和进化。施普林格柏林海德堡;2014.p . 99 - 112。
- 3。
王志强,王志强,王志强,等。植物融合酶寄主跨界转移的研究进展。BMC Evol Biol. 2014;14(1):33。
- 4.
Kageyama k,asano t。玻璃蛋白酶糖尿病的生命周期。J工厂增长调节。2009; 28(3):203-11。
- 5。
Schwelm A,Badstober J,Bulman S,Desoignies N,Etemadi M,瀑布Re,Gachon Cmm,Lugref A,Lukes J,Merz U等人。不在您通常的前10名:引起植物和藻类的原权。莫尔植物途径。2018; 19(4):1029-44。
- 6。
西门子J,Keller I,Sarx J,Kunz S,Schuller A,Nagel W,Schmulling T,Parniske M,Ludwig-Muller J.转录组合体分析拟南芥杆菌标准分析表明疾病发展中的细胞分离激素的关键作用。Mol植物微生物相互作用。2006; 19(5):480-94。
- 7。
Devos S,Laukens K,Deckers P,Van der Straeten D,Van der Straeten D,纽约州D,van Onckelen H,Witters E,Prinsen E.一种激素和蛋白质组方法,用于在拟南芥中进行初始代谢事件的初始代谢事件。Mol植物微生物相互作用。2006; 19(12):1431-43。
- 8。
王旭,王浩,王健,孙锐,吴军,刘胜,白勇,文建华,Bancroft I,程飞,等。中多倍体作物油菜的基因组。Nat麝猫。2011;43(10):1035 - 9。
- 9。
Chalhoub B,Denoeud F,Liu S,Parkin Ia,Tang H,Wang X,Chiquet J,Belcram H,Tong C,Samans B等。植物遗传学。晚期新石器时代芸苔油菜籽基因组的早期大型国民多倍曲面演变。科学。2014; 345(6199):950-3。
- 10.
Liu S, Liu Y, Yang X, Tong C, Edwards D, Parkin IA, Zhao M, Ma J, Yu J, Huang S, et al. .甘蓝基因组揭示了多倍体基因组的不对称进化。Nat Commun。2014;5:3930。
- 11.
郑楼孙R,侯X,郑H,张楼,张勇,刘B,梁Ĵ,壮男,刘Y,等人。亚基因组并行选择与形态类型多样化和收敛作物驯化在芜菁和甘蓝相关联。NAT Genet。2016; 48(10):1218至1224年。
- 12.
Schwelm A,Fogelqvist J,Reckaust A,JülkeS,Lilja T,Bonilla-Rosso G,Karlsson M,Shevchenko A,DhangaNi V,Choi SR等。的Plasmodiophora brassicae基因组揭示了其生命周期和几丁质合酶的祖先。Sci众议员2015;5:11153。
- 13。
Rolfe Sa,Strelkov Se,Links Mg,Clarke We,Robinson Sj,Djavaheri M,Malinowski R,Haddadi P,喀古塔斯,Parkin IAP,等。植物病原体浆粒细胞薄荷菌的紧凑基因组适用于与宿主芸苔属SPP的细胞内相互作用。BMC基因组学。2016; 17(1):1-15。
- 14。
BI K,HE ZC,Gao ZX,Zhao Y,Fu YP,Cheng Js,谢JT,江DH,陈T.脂质滴草脂肪滴的集成OMICS研究。SCI批准。2016; 6:36965。
- 15.
Daval S, Belcour A, Gazengel K, Legrand L, Gouzy J, Cottret L, Lebreton L, Aigu Y, Mougel C, Manzanares-Dauleux MJ。芥菜疟原虫基因组计算分析:线粒体序列描述和代谢途径数据库设计。基因组学,2018;在出版社。
- 16。
Agarwal A,Kaul V,Faggian R,Rookes Je,Ludwig-Muller J,Cahill DM。拟南芥初级阶段全局宿主基因表达分析 - 拟南芥 - Plasmodiophora Brassicae相互作用。Funct植物Biol。2011; 38(6):462-78。
- 17。
Malinowski R, Novák O, Borhan MH, Spíchal L, Strnad M, Rolfe SA。细胞分裂素在根茎病中的作用。植物病理学杂志。2016;145(3):543-57。
- 18。
赵Y, Bi K,陈高Z, T,刘H,谢J,程J,傅Y,江d .转录组分析,拟南芥在回应Plasmodiophora brassicae在早期感染。Microbiol前面。2017;8:673。
- 19。
Jubault M,Hamon C,Gravot A,Lariagon C,Delourme R,Bouchereau A,Manzanares-Dauleux MJ。根精氨酸分解代谢和聚胺代谢在球杆菌易受和部分抗性拟南芥基因型中的差异调节。植物理性。2008; 146(4):2008-19。
- 20.
洛夫洛克DA,唐纳德CE,康兰XA,卡希尔DM。在花椰菜的根肿病水杨酸抑制(甘蓝甘蓝变种谷子)引起的专biotroph根肿。Australas植物径。2013; 42(2):141-53。
- 21.
张X,刘y,方z,李z,杨l,zhuang m,zhang y,lv h。西兰花的比较转录组分析(芸苔甘蓝醛。italica.)和野生甘蓝(Brassica macrocarpa Guss.)的响应Plasmodiophora brassicae在不同的感染阶段Front Plant Sci. 2016:7(1929)。
- 22.
Cosgrove DJ。植物细胞壁的生长。NAT Rev Mol Cell Bio。2005; 6(11):850-61。
- 23.
伊拉尼斯,培训B,Waldner M,Nayidu N,Tu J,Kusalik AJ,Todd CD,Wei Y,Bonham-Smith PC。拟南芥芽和根系中对疟原虫感染的反应转录体分析。BMC基因组学。2018; 19(1):23。
- 24。
Devos S,Vissenberg K,Versenberg K,Prinsen E. Prinsen E.通过Plasmodiophora Brassicae感染大白菜导致植物生长的刺激:对细胞壁代谢和激素平衡的影响。新植物。2005; 166(1):241-50。
- 25。
Deora A,Gossen Bd,McDonald Mr。油菜素抗疟原虫抗抗抗性的感染,发育和表达的细胞学。Ann Appl Biol。2013; 163(1):56-71。
- 26。
Cao T, Srivastava S, Rahman MH, Kav NNV, Hotte N, Deyholos MK, Strelkov SE。甘蓝型油菜根茎中蛋白质组水平的变化。植物科学。2008;174(1):97 - 115。
- 27。
Donald Ec,Jaudzems G,Porter IJ。Plasmodiophora Brassicae在球杆菌抗性和易感芸薹属奥莱拉西宿主的病理学。植物别墅。2008; 57(2):201-9。
- 28。
高桥H, Muraoka S, Ito K, Mitsui T, Hori H, Kiso A. brassicae休眠孢子只在杆状病敏感萝卜的愈伤组织中增殖,而在抗杆状病萝卜的愈伤组织中增加PAL活性。植物生物技术。2001;18(4):267 - 74。
- 29.
路德维希 - 穆勒Ĵ,Prinsen的E,罗尔夫SA,斯科尔斯JD。根肿病在代谢过程和植物激素的作用。J工厂增长调节。2009; 28(3):229-44。
- 30.
Jahn L,Mucha S,Bergmann S,Horn C,Staswick P,Steffens B,Siemens J,Ludwig-Muller J. The Holkroot Pancogog(Plasmodiophora Brassicae)影响植物蛋白信号传导调节拟南芥中的蟾蜍稳态。植物。2013; 2(4):726-49。
- 31.
Müller P, Hilgenberg W.玉米素和玉米素核糖体在茎根组织中的异构体:芸苔属反式玉米素生物合成的证据。杂志。1986;66(2):245 - 50。
- 32.
Siemens J, Gonzalez MC, Wolf S, Hofmann C, Greiner S, Du Y, Rausch T, Roitsch T, Ludwig-Muller J.胞外转化酶参与拟南芥根瘤病的调控。植物病理学杂志。2011;12(3):247-62。
- 33.
Walerowski P,Gundel A,Yahaya N,Truman W,Sobczak M,Olszak M,Rolfe S,Borisjuk L,Malinowski R.Rabroot疾病刺激了Phloem分化的早期步骤,促进了在发育中的甜味蔗糖运输司机。植物细胞。2018; 30(12):3058-73。
- 34.
黄志强,王志强,王志强,等。植物激素途径与病原菌效应的关系。植物细胞,2014,26(6):2285 - 309。
- 35.
Klessig DF,Choi HW,Dempsey Da。全身性获得性抗性和水杨酸:过去。Mol Plant Microbe互动:现在和未来;2018年。
- 36.
关键词:拟南芥,水杨酸,水杨酸,感染途径,水杨酸植物病理学杂志。2016;17(8):1237-51。
- 37.
王志强,王志强,王志强,等。芸薹属疟原虫的分子生物学特性。植物生长规律。2009;28(3):245-51。
- 38。
陈T, Bi K, Z,高Z,赵Y, Y,程J,谢J,江d拟南芥突变体bik1展品强烈抵抗Plasmodiophora brassicae。杂志。2016;7:402。
- 39。
Jubault M, Lariagon C, Taconnat L, Renou JP, Gravot A, Delourme R, Manzanares-Dauleux MJ。拟南芥对棒根病的部分抗性是基于寄主初级代谢和靶向细胞分裂扩张能力的变化。功能整合基因组学。2013;13(2):191-205。
- 40。
贾华,魏旭,杨勇,袁勇,魏飞,赵永强,杨胜,姚庆,王振田,等。根RNA-seq分析显示,在甘蓝感染根际疟原虫后,对根际疟原虫敏感的白菜和对根际疟原虫抗性的白菜之间存在明显的转录组景观。土壤植物。2017;421(1 - 2):93 - 105。
- 41。
I, Rusak G, Keenan S, Bulman S.一种新的甲基转移酶,从胞内病原菌芸苔胞浆虫(Plasmodiophora brassicae)中甲基化水杨酸。植物学报。2015;16。
- 42。
Bulman S,Richter F,Marschollek S,Benade F,Jülke,Ludwig-MüllerJ.拟南芥表达植物病原原生生物sabath型甲基转移酶基因PbBSMTPlasmodiophora brassicae,表现为叶黄变和寄主易感性改变。植物医学杂志》2018。
- 43。
作者:王志刚,王志刚,王志刚。植物免疫的激素调节。Cell Dev Biol. 2012; 28:489-521。
- 44.
傅ZQ,董X的系统获得性抗性:转向局部感染到全球防卫。Annu Rev植物Biol。2013; 64:839-63。
- 45.
Gravot A, Deleu C, Wagner G, Lariagon C, Lugan R, Todd C, Wendehenne D, Delourme R, Bouchereau A, manzanales - dauleux MJ。拟南芥根瘤感染过程中精氨酸酶的诱导抑制癌变的发生。植物生理学杂志。2012;53(5):901-11。
- 46.
Lemarié S, Robert-Seilaniantz A, Lariagon C, Lemoine J, Marnet N, Jubault M, Manzanares-Dauleux MJ, Gravot A.茉莉酸和水杨酸途径都有助于拟南芥对生物营养棒根病剂Plasmodiophora brassicae的抗性。植物生理学报。2015;56
- 47.
徐L,杨H,任L,陈W,刘L,刘F,Zeng L,Yan R,Chen K,方X. jasmonic介导的脂族葡萄糖苷代谢参与Brassica Napus L.前植物SCI。2018; 9:750。
- 48。
果胶的生物合成。植物杂志。2010;153(2):384 - 95。
- 49。
冯杰,湖汉·王,斯德·塞尔·斯(Strelkov Se,Gossen BD,周QX,Peng G.来自Plasmodiophora Brassicae的丝氨酸蛋白酶Pro1的分子表征刺激休息孢子萌发。莫尔植物途径。2010; 11(4):503-12。
- 50.
陈杰,庞W,陈B,张建,胶Z.甘蓝型抗性和-Splyeles近代性近代型近代抗性抗菌性抗性和-ceply等位基因早期感染的转录体分析。前植物SCI。2016; 6:1183。
- 51.
楚mg,歌曲t,粉丝kc,张xg,刘xj,chang a,lahlali r,mcgregor l,gossen bd,peng g等。RCR1的精细映射及其对Plasmophora Brassica植物感染过程中转录组图案的影响。BMC基因组学。2014; 15。
- 52.
曲T,楚呒,Lahlali R,于女,彭G.猎枪通过在芜菁基因RCR1赋予根肿病(甘蓝根肿)抗性的无标记的蛋白质组分析。前植物SCI。2016; 7:1013。
- 53.
Lahlali R,Song T,Chu M,Yu F,Kumar S,Karunakaran C,Peng G.使用傅里叶变换红外光谱和RT-PCR评估与脱粒电阻相关的细胞壁组分的变化。int j mol sci。2017; 18(10):2058。
- 54.
李志强,李志强,李志强,等。甘蓝胞浆菌对甘蓝组织病理学和形态的影响[j] .浙江农业学报。2011;
- 55.
生物营养相互作用的解纠缠:mrna的原位定位在单个细胞水平上破译植物和藻类病原体-宿主的相互作用。bioRxiv。2018;378794.
- 56.
Malinowski R,Smith Ja,Fleming Aj,Scholes JD,Rolfe Sa。在马蹄形感染的拟南芥中吞噬形成是由于宿主的现有共同活动的增加,但对于完成病原生命周期不是必不可少的。工厂J. 2012; 71(2):226-38。
- 57.
Vlot AC Dempsey DA Klessig DF。水杨酸,一种抗疾病的多面激素。植物病理学杂志2009;47:177-206。
- 58.
Park SW,Kaimoyo E,Kumar D,Mosher S,Klessig DF。水杨酸甲酯是用于植物系统获得性的关键移动信号。科学。2007; 318(5847):113-6。
- 59.
关键词:NPR1,植物免疫应答,转录调控,转录后修饰,动态调控细胞宿主微生物。2015;18(2):169-82。
- 60。
王D,Amornsiripanitch N,Dong X.一种基因组方法,用于识别植物系统性质抗性的转录网络中的监管节点。PLOS PARCOG。2006; 2(11):E123。
- 61。
丁Y,Sun T,AO K,Peng Y,Zhang Y,Li X,Zhang Y. Zhangy ancore的作用对植物免疫的转录调节中的水杨酸受体NPR1和NPR3 / NPR4。细胞。2018; 173(6):1454-67 E1415。
- 62。
kazan k,礼仪jm。Jaz压缩机和植物激素串扰的编排。趋势植物SCI。2012; 17(1):22-31。
- 63。
Mochizuki S,Sugimoto K,Koeduka T,Matsui K.拟南芥脂氧合酶2对于形成绿叶挥发物和五碳挥发物至关重要。费用。2016; 590(7):1017-27。
- 64。
Wasternack C,遗址B. jasmonals:生物合成,感知,信号转导和植物应激反应,生长和发育的作用。2007年植物学年度审查的更新。Ann Bot。2013; 111(6):1021-58。
- 65。
激光显微解剖耦合到拟南芥根的转录谱分析表明油菜素内酯在杆状茎形成中的作用。植物生理学报。2014;55(2):392-411。
- 66。
林WW,Lu DP,高XQ,姜,马XY,王震,Mengiste T,他P,Shan Lb.受体样细胞质激酶BIK1的植物免疫和芸苔类固醇信号传导途径的逆调节。P Natl Acad Sci USA。2013; 110(29):12114-9。
- 67。
唐斯BP,Steinbaker Cr,Crowell DN。来自大豆激素调节β-扩展蛋白的表达和处理。植物理性。2001; 126(1):244-52。
- 68.
Sun Y,Veerabomma S,Abdel-Mageed Ha,Fokar M,Asami T,Yoshida S,Allen Rd。芸苔类固醇调节培养的棉胚轴上的纤维开发。植物细胞生理。2005; 46(8):1384-91。
- 69.
Bethke G, Thao A, Xiong G, Li B, Soltis NE, Hatsugai N, Hillmer RA, Katagiri F, Kliebenstein DJ, Pauly M,等。果胶的生物合成对拟南芥细胞壁完整性和免疫至关重要。植物细胞。2016;28(2):537 - 56。
- 70.
Grsic-Rauschs,Kobelt P,西门子JM,Bischoff M,Ludwig-Muller J.拟南芥症状疾病症状症状症状中硝基酶的表达和定位。植物理性。2000; 122(2):369-78。
- 71.
科平杰P,Repetti PP,天B,Dahlbeck d,Mehlert A,Staskawicz BJ。在拟南芥中提高细菌病抗性质膜本地化NDR1蛋白结果过表达。植物杂志2004; 40(2):225-37。
- 72.
Eitas TK, Nimchuk ZL, Dangl JL。拟南芥TAO1是一个TIR-NB-LRR蛋白,有助于紫花假单胞菌效应AvrB诱导的抗病。中国科学院院刊2008;105(17):6475-80。
- 73.
麦克奈尔,裤子SR,Sharma K,Niruala P,Lawrence GW,Klink VP。非种族特异性疾病抗性1(NDR1)的甘氨酸最大同源物改变防御基因表达,同时在不同遗传背景下对不同根病原菌的抵抗响应期间运作。植物理性生物化学。2017; 114:60-71。
- 74.
Meyers BC, Morgante M, Michelmore RW。TIR-X和TIR-NBS蛋白:拟南芥和其他植物基因组中编码的两个与抗病相关的新家族TIR-NBS- lrr蛋白。植物j . 2002; 32(1): 77 - 92。
- 75.
Dinant S,Clark Am,Zhu Y,Vilaine F,Palauqui J-C,Kusiak C,Thompson Ga。韧皮素(Phloem蛋白2)中的超家族的多样性在Agenperms中。植物理性。2003; 131(1):114-28。
- 76.
Trimmomatic:用于Illumina序列数据的灵活微调器。生物信息学。2014;30(15):2114 - 20。
- 77.
Grabherr Mg,Haas Bj,Yassour M,Levin JZ,Thompson Da,Amit I,Adiconis X,Fan L,Raychowdhury R,Zeng Q等。来自RNA-SEQ数据的全长转录组件没有参考基因组。NAT BIOTECHNOL。2011; 29(7):644-52。
- 78.
Li B,杜威CN。RSEM:具有或不具有参考基因组的RNA-SEQ数据的准确转录物定量。BMC生物信息学。2011; 12:323。
- 79.
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ。基本的局部对齐搜索工具。中华医学会昆虫学分会。
- 80.
KAAS:一种自动基因组注释和路径重建服务器。核酸Res. 2007;35(Web服务器版):W182-5。
- 81.
Huerta-Cepas J, Szklarczyk D, Forslund K, Cook H, Heller D, Walter MC, Rattei T, Mende DR, Sunagawa S, Kuhn M, et al. eggNOG 4.5:一种具有改进功能注释的真核、原核和病毒序列的层次orthology框架。核酸Res. 2016;44(D1): D286-93。
- 82.
Lohse M, Nagel A, Herter T, May P, Schroda M, Zrenner R, Tohge T, Fernie AR, Stitt M, Usadel B. Mercator:用于植物序列数据基因组规模功能注释的快速和简单的web服务器。植物学报。2014;37(5):1250-8。
- 83。
Usadel B, Poree F, Nagel A, Lohse M, Czedik-Eysenberg A, Stitt M.使用MapMan可视化和比较植物组学数据的指南:作物物种玉米的一个案例研究。植物学报。2009;32(9):1211-29。
- 84。
Källl,krogh a,sonnhammer ell。一种组合的跨膜拓扑和信号肽预测方法。J Mol Biol。2004; 338(5):1027-36。
- 85。
利用SignalP预测分泌蛋白。出自:Kihara D,编辑。蛋白质功能预测:方法与方案。纽约,NY:施普林格纽约;2017.59 - 73页。
- 86。
Krogh A,Larsson B,Von Heijne G,Sonnhammer El。用隐马尔可夫模型预测跨膜蛋白拓扑:完成基因组的应用。J Mol Biol。2001; 305(3):567-80。
- 87。
Yin Y,Mao X,Yang J,Chen X,Mao F,Xu Y. DBCan:用于自动碳水化合物 - 活性酶注释的网页资源。核酸RES。2012; 40(Web服务器问题):W445-51。
- 88。
罗宾逊MD,麦卡锡DJ,SMYTH GK。编辑:用于数字基因表达数据的差异表达分析的生物导体包。生物信息学。2010; 26(1):139-40。
- 89。
R核心团队:R:统计计算的语言和环境。在.奥地利维也纳:统计计算R基金会;2016.
- 90。
Wickham H. GGPLOT2:用于数据分析的优雅图形。在。纽约:Springer-Verlag;2009年。
致谢
我们感谢Srilakshmy Harikrishnan对生物信息学分析的讨论。M. H. Borham(加拿大农业和农业食品,萨斯卡通科学广场107号,SK S7N0X2,加拿大)提供了PT3数据。Illumina测序在VBCF NGS单元进行(www.vbcf.ac.at).
资金
S.C.和S.N.由奥地利科学基金资助(授予Y0801-B16)和A.S.按FORMAS,瑞典研究委员会(授予2015-1317),仅限财务支持。
作者信息
从属关系
贡献
实验概念和设计:SN。湿实验室工作:SC.生物信息学和统计分析:SC.结果分析:SC, AS, SN。手稿:SC, AS, SN。图表:SC.所有作者阅读并批准最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
图S1。Kohlrabi(Brassica oleracea.),Plasmodiophora brassicae读取。受感染植物无症状根(SL)的样本含量低于0.0005%p . brassicae读取。p . brassicae读分区从WG的23%增加到BG的33%。图S2:Kohlrabi黄酮类药物代谢。群集的Meatmaps的日志2fold改变deg值。与WG和BG相比,没有deg出现。拟南芥同源染色体。na:未分配。图S3:kohlrabi疾病响应因子。群集的Meatmaps的日志2fold改变deg值。与WG和BG相比,存在一种DEG (AXR3)。拟南芥同源染色体。图S4:Kohlrabi myrosinase和硝酸酶。群集的Meatmaps的日志2fold改变deg值。与WG和BG相比,没有deg出现。拟南芥同源染色体。na:未分配。图S5:大头菜WRKY和bZIP转录因子。群集的Meatmaps的日志2fold改变deg值。与WG和BG相比,没有deg出现。拟南芥同源染色体。na:未分配。图S6:植物-病原互作的KEGG图。与瘿虫相比,SL中上调基因呈紫色,下调基因呈绿色。被紫色和绿色遮蔽的基因在不同的同源或异构体中上调或下调。图S7:大头菜激酶。群集的Meatmaps的日志2fold改变deg值。与WG和BG相比,没有deg出现。拟南芥同源染色体。na:未分配。图S8:数量p . brassicae每个COG类别中杆状茎感染大头菜根的基因。条形图表示所有文库中发现的基因总数。未赋值的基因(n= 5482)没有说明。图S9:累积的FPKM值p . brassicae从WG和BG样品中获得的。未说明未分配的基因。图S10:累积的FPKM值p . brassicae从SL样品获得的读取。未说明未分配的基因。(DOCX 2519 KB)
额外的文件2:
表S1。排序库的总(原始)和高质量读取。只保留最小长度为75 bp、滑动窗口为5 bp、平均质量评分为> 20的读本。Illumina适配器被移除。表S2:比较了三种根组织类型。表S3:受感染植物中的每齿轮类别的Kohlrabi Degs。给出了SL VS WG,SL VS BG和WG VS BG的总次数。各个DEG可能发生在多个比较中,但仅计算一次。包含大多数DEG的五个类别以粗体突出显示。橙色:信息和存储处理;绿色:新陈代谢;蓝色:蜂窝过程和信号;灰色:特色差。表S4:BG和WG之间的Kohlrabi Degs的完整列表。功能注释由Eggnog Mapper返回。上调基因以红色,下调基因突出显示为蓝色。表S5:二十个最高的表达基因Plasmodiophora brassicae在wg。与eggNOG mapper预测的注释相同。推定的分泌蛋白标记(●).FPKM:每百万千票(外显子)的片段百万读。na:未分配。表S6:二十个最高的表达基因Plasmodiophora brassicaeBG。与eggNOG mapper预测的注释相同。推定的分泌蛋白标记(●).FPKM:每百万千票(外显子)的片段百万读。na:未分配。表S7:Plasmodiophora brassicaeBG和WG之间的次数。注释由Eggnog Mapper预测。BG中的上调基因以蓝色的BG中的红色,下调基因突出显示。(DocX 31 KB)
额外的文件3:
苤细胞壁代谢热图,包括转录标识符和集群系统树。引导零被添加到基因标识符中以获得更好的可视化。每个单独的Heatmap的其他数据都提供在各个电子表格中。log2折叠更改值和附加注释信息。这些电子表格还包括未在热带中绘制的非差异表达基因。ñ。s .:没有显着表达差异。(ODS 1488 KB)
额外的文件4:
Kohlrabi植物激素代谢热量包括转录物标识符和簇树枝状图。引导零被添加到基因标识符中以获得更好的可视化。每个单独的Heatmap的其他数据都提供在各个电子表格中。log2折叠更改值和附加注释信息。这些电子表格还包括未在热带中绘制的非差异表达基因。ñ。s .:没有显着表达差异。(ODS 1435 KB)
额外的文件5:
Kohlrabi Heatmaps的生物应力响应,包括转录物标识符和簇树枝状图。引导零被添加到基因标识符中以获得更好的可视化。每个单独的Heatmap的其他数据都提供在各个电子表格中。log2折叠更改值和附加注释信息。这些电子表格还包括未在热带中绘制的非差异表达基因。ñ。s .:没有显着表达差异。(ODS 1406 KB)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
根茎病无症状根的转录组反应(芸苔甘蓝醛。gongylodes)反射抗性植物。BMC植物BIOL.19,288(2019)。https://doi.org/10.1186/s12870-019-1902-z
收到了:
接受:
发表:
关键词
- 干酪队
- Host-pathogen交互
- Plasmodiophora brassicae
- Brassica oleracea.
- 根转录组
- 素材主义者