摘要
背景
MYB转录因子家族是植物中最大的转录因子家族之一,在植物生长和发育中起着多方面的作用。然而,苹果中涉及病原体抗性的MyB转录因子仍然明白。
结果
我们从苹果公司找到了一个新的MYB家族成员,并给它命名MdMYB30。MdMYB30定位于细胞核,并在苹果幼叶中高度表达。转录的MdMYB30是由聚乙二醇和脱落酸等非生物胁迫诱导的。扫描电镜和气相色谱-质谱分析证实了异位表达MdMYB30在拟南芥中,蜡质含量、蜡晶数量和蜡质相关基因的转录发生了变化。MdMYB30绑定到MdKCS1启动子激活其表达和调节蜡生物合成。MdMYB30也有助于植物表面性质和增加对细菌菌株的抗性太平洋标准时间DC3000。此外,在苹果果实和转基因苹果愈伤组织中进行的病毒转化证明了这一点MdMYB30增加阻力Botryosphaeria dothidea.我们的研究结果表明MdMYB30在苹果表皮蜡质积累和提高抗病性方面起着重要作用。
结论
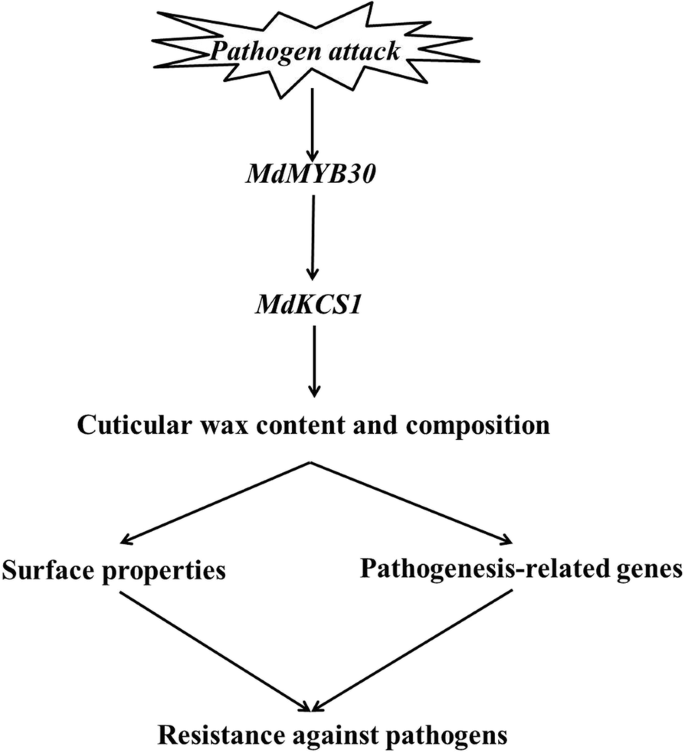
MdMYB30绑定到MdKCS1基因启动子激活其转录,调控表皮蜡质含量和组成,从而影响表皮性质和致病相关基因的表达,从而对病原菌产生抗性。MdMYB30似乎是植物角质层形成的关键元素,并赋予苹果对病原菌的耐受性。
背景
苹果 (Malus×Divelsa.)是一个重要的水果作物,通常是全世界种植。苹果上的光泽和光滑度是决定苹果市场价值的重要特征,因为无病的闪亮水果对消费者更具吸引力。切割蜡负责抗苹果病原体和光泽度。
植物切割结构由基于物理位置的两部分组成:靠近电池壁的Cutin,以及暴露在空气中的震动蜡。蜡晶的弹性膜覆盖植物表面[1].表皮蜡质在抵御外部环境胁迫方面起着至关重要的作用,如作为蒸腾屏障和与病原体相互作用。植物表皮蜡的基本成分是甚长链脂肪酸及其衍生物。角质层合成途径可分为三种反应:(1)从头合成C16和C18脂肪酸;(2) VLCFAs的延伸:第一阶段产生的C16和C18脂肪酸在内质网上延伸形成C20-C36 VLCFAs;(3)醛、醇、烷烃、酮、酯等VLCFA衍生物的合成[2].
表皮蜡作为蒸腾屏障的作用已得到广泛的研究。在玉米中,去除野生玉米表面的蜡层会促进叶片表面锈病附着细胞的形成[3.].此外,叶子表面的表皮蜡还可以用来防御天敌[4].有些脂质可能在细胞凋亡过程中作为信号物质,抵御外部入侵[5].
MYB转录因子在所有真核生物中都很常见;然而,这种蛋白家族在高等植物中尤其庞大。动物MYB蛋白家族包含三个MYB保守结构域重复序列(R1、R2和R3),而大多数植物MYB转录因子属于R2R3类型,与生长调节过程相关[6].据报道,MYB蛋白质与调节次生新陈代谢的一系列功能有关,例如表皮蜡[5],形态发生[7],非生物和生物应激反应[8,9].MYB家族成员的功能已被广泛研究。OverexpressingMYB94在拟南芥叶片中,蜡质负荷增加约两倍MYB94与蜡类相关基因的启动子结合以增强它们的表达[10].程序性细胞死亡是与植物疾病抗性密切相关的过敏反应。AtMYB30是无毒和毒性病原体攻击反应中细胞死亡的主动调节因子[11].MYB30、MYB55和MYB110是三个MYB蛋白,通过微生物相关分子模式(MAMP)处理转录诱导,增强对真菌和细菌病原体的抗性,在水稻植物免疫中发挥重要作用[12].此外,AtMYB30显示对反应性氧物质(ROS)的重大反应,并抑制根细胞伸长。该过程涉及与VLCFA运输相关的多种基因;因此,在ROS - 根细胞 - 蜡生物合成 - 植物免疫应答之间提供分子链接[13].
水果作物的角质层为整个果实的完整提供形态学支持,也影响生长和成熟[14].角质层蜡的组成和含量可能导致果实品质特性的差异,如采后抗失水、抗病原菌侵染、抗开裂等[15,16,17].关于水果蜡的大量研究集中在蜡形态和生物合成上,而是关于调节蜡生物合成的分子途径的几乎不少及其在苹果中的作用。在这里,我们确定了一个名为的Apple R2R3 MYB TFMdMYB30.此外,ectopically表达MdMYB30通过改变蜡的组成和表面性质来改善抗病性。这些结果表明了MdMYB30阳性调节蜡生物合成,并作为病原体抵抗机制。
结果
鉴定MYB30苹果中的基因
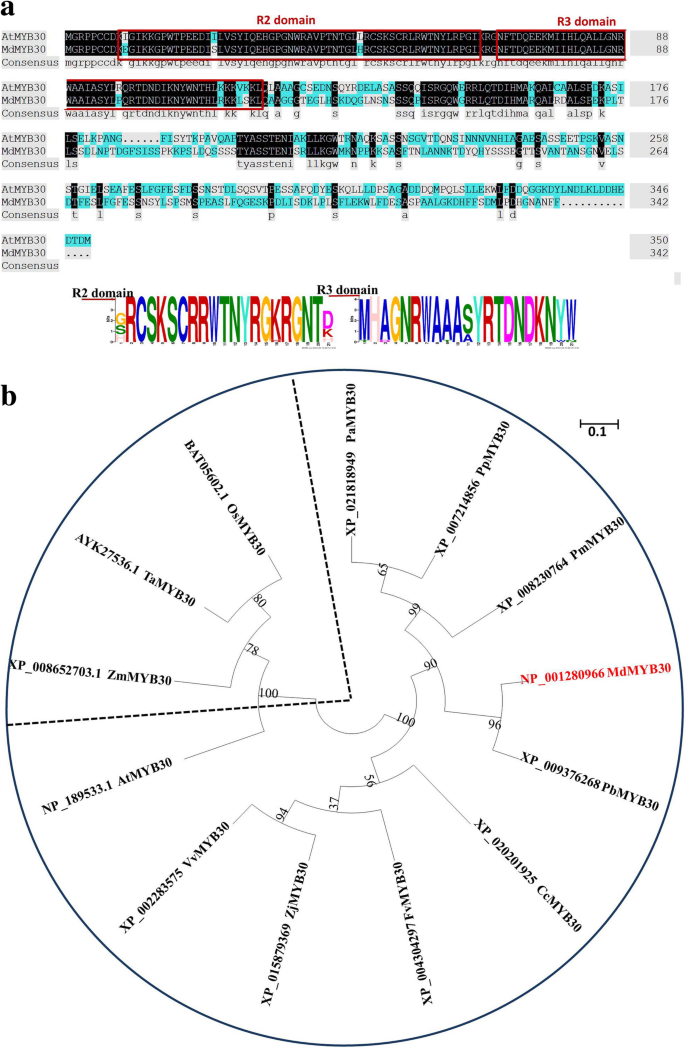
分开MdMYB30基因,AtMYB30采用同源检索的方法,以基因为诱饵,在苹果中进行序列搜索。我们选择了与AtMYB30同源性最高的基因,将其命名为MdMYB30 (MDP0000149102)。的MdMYB30cDNA包含两个非编码区域(附加文件1:图S1),以及MdMYB30ORF编码DNAMAN 6.0软件预测的342氨基酸多肽[18].我们分析了MdMYB30和AtMYB30的氨基酸序列。数字1a显示MdMYB30和AtMYB30蛋白序列高度相似,含有保守的R2R3结构域。
MdMYB30基因序列比对及系统发育分析。一个MdMYB30和AtMYB30氨基酸序列的比对。两个保存完好的图案的位置用红线标出。MdMYB30和AtMYB30蛋白的DNA结合需要保守的R2和R3结构域。MdMYB30和AtMYB30蛋白中残基的保守性由每个字母的高度表示。比特分数表示序列中每个保守motif的信息(要解释图例中的颜色,请参阅本文的网页版本)。b植物MYB30蛋白的系统发育关系分析。对NCBI数据库中MdMYB30和其他12种植物MYB30蛋白序列进行系统发育分析。红色字体表示MdMYB30,比例尺表示分支长度。MdMYB30: NP_001280966马吕斯有明显;PbMYB30: XP_009376268;PmMYB30: XP_008230764李属却已;PAMYB30:XP_021818949.李属鸟结核;PPMYB30:XP_007214856Prunus Persica;FvMYB30: XP_004304297草莓属vesca;ZjMYB30: XP_015879369酸枣;VvMYB30: XP_002283575葡萄;CcMYB30: XP_020201925Cajanus毛竹;TaMYB30: AYK27536.1小麦;OsMYB30: BAT05602.1栽培稻;ZmMYB30 XP_008652703.1玉米;ATMYB30:NP_189533.1.1.拟南芥
构建系统进化树,研究MYB30s在物种间的进化关系(图。1B;附加文件1:文件S1)。结果表明,苹果MdMYB30与梨PbMYB30 (XP_009376268)亲缘关系最密切,因为它们属于同一进化枝。MdMYB30与玉米ZmMYB30 (XP_008652703.1)、小麦TaMYB30 (AYK27536.1)和水稻OsMYB30 (BAT05602.1)亲缘关系最远,因为这三种植物都是单子叶植物。系统发育树表明双子叶植物和单子叶植物之间有明确的分界。
MDMYB30在核中本地化,并通过非生物应激诱导
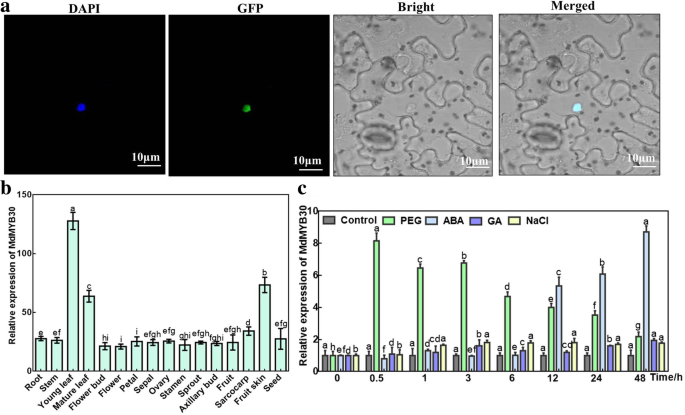
蛋白质的定位对其功能非常重要。数字2a表示绿色荧光信号与蓝色荧光信号在细胞核内融合,说明MdMYB30定位于细胞核。的MdMYB30对苹果各组织的转录分析表明,虽然在所有被检测组织中均有组成性表达,但表达水平不同,说明其特异功能MdMYB30在其高表达的组织中(图。2b)。
的亚细胞定位和表达模式MdMYB30。一个MdMYB30蛋白的亚细胞定位尼古利亚娜·宾夕法尼亚州.35S:MdMYB30-GFP融合构建的瞬时表达n benthamiana.瞬时感染3天后,在共聚焦显微镜下观察绿色荧光。4 ',6-二氨基-2-苯基吲哚(DAPI)染料能特异性染色细胞核,而融合蛋白绿色荧光完全与细胞核重叠(比例尺:10 μm)。b表达谱的MdMYB30在各种苹果组织(根,茎,年轻和成熟叶子,花芽,花,花瓣,萼片,卵巢,雄蕊,豆芽,腋芽,水果,Sarcocarp,果皮和种子)。苹果肌动蛋白表达用作对照。c表达水平的MdMYB30对PEG、ABA、GA和NaCl的响应。误差棒表示标准差(SD;n = 3). Data are mean ± SD of three independent replicates. Different lowercase letters indicate significant differences atP< 0.05
开始调查MdMYB30压力反应,CIS-元素MdMYB30通过应用PlantCare软件产生启动子[19].许多调控序列MdMYB30启动子包括参与热、低温、干旱胁迫的元件,参与植物的SA、ABA、GA等元件,以及几种光响应元件(见表)1),这表明MdMYB30与植物对各种非生物应激的反应密切相关。
随后,我们分析了表达式MdMYB30分别用PEG、ABA、GA和NaCl处理(图2)。2C)。在体外繁殖的苹果幼苗用于该实验。的MdMYB30PEG处理后,转录水平在0.5 h时迅速上升至峰值,随后逐渐下降。MdMYB30在ABA处理的早期,ABA的表达量没有变化,但在处理12 h后急剧增加,在48 h达到最大值。没有变化MdMYB30分别检测GA和NaCl处理后的转录水平。
MdMYB30在生物和非生物胁迫中的作用
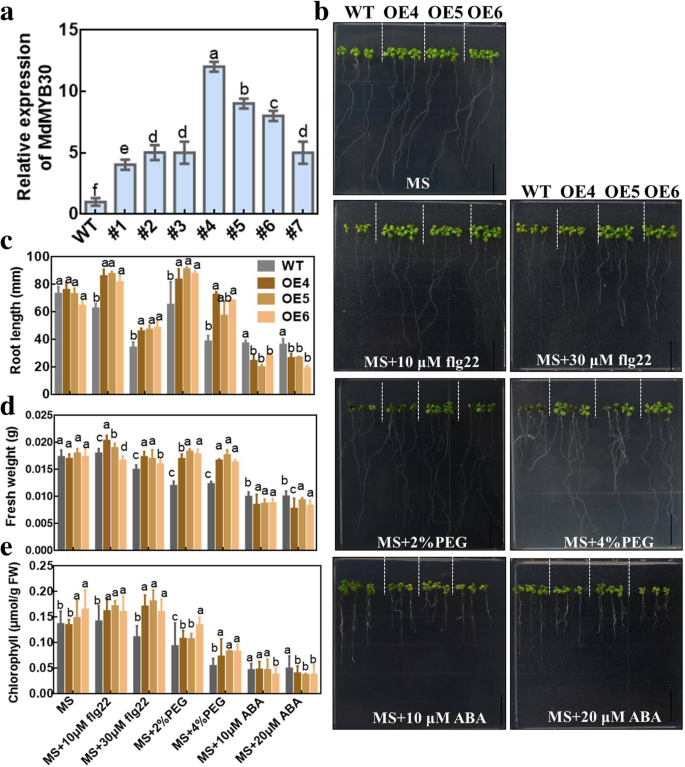
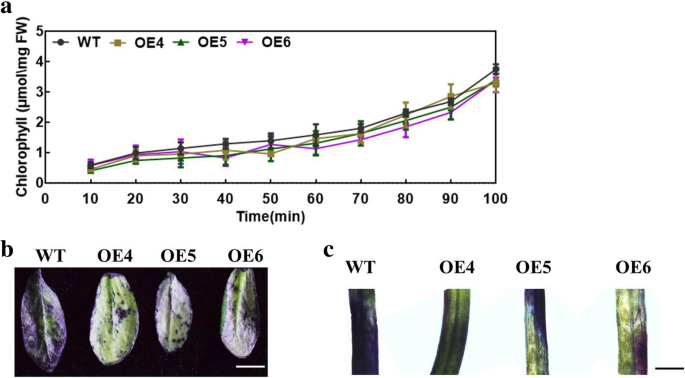
我们改变了MdMYB30进入野生型拟南芥来调查MdMYB30在压力期间。六是独立的MdMYB30ectopically表达(MdMYB30获得了qPCR鉴定的拟南芥株系。MdMYB30OE4,OE5和OE6更高MdMYB30为后续实验选择转录水平(图。3.a).我们监测了flg22诱导的免疫反应、peg诱导的渗透胁迫和ABA敏感性MdMYB30在拟南芥中的异位表达。WT和MdMYB30正常MS培养基中的异位表达拟南芥。MdMYB30与WT相比,flg22和PEG处理下的异位表达根长MdMYB30与wt相比,在ABA处理下显着抑制异位表达。随着FLG22,PEG和ABA浓度的增加,根伸长率的变化更为明显(图。3.b, c).鲜重和叶绿素MdMYB30与野生型相比,经flg22和PEG处理后异位表达量显著增加,而经ABA处理后异位表达量下降,说明了异位表达MdMYB30品系增加了对生物胁迫和渗透胁迫的抗性,并提高了对ABA的敏感性。3.一部)。因此,这些数据表明MdMYB30参与对生物和非生物胁迫的反应。
MdMYB30参与生物和非生物应激反应。一个异位表达的鉴别拟南芥QRT-PCR的MDMYB30的表达水平。b野生型和MdMYB30异位表达的拟南芥,添加或不添加10 μM flg22, 30 μM flg22, 2% PEG, 4% PEG, 10 μM ABA或20 μM ABA(标尺:1 cm)。C-E.根的长度c,鲜重d,叶绿素含量e在b拟南芥幼苗。拟南芥叶绿素μmol/g FW(鲜重= FW)。误差柱代表标准差(SD;n = 3). Data are mean ± SD of three independent replicates. Different lowercase letters indicate significant differences atP< 0.05
MdMYB30改变表皮蜡负荷和成分
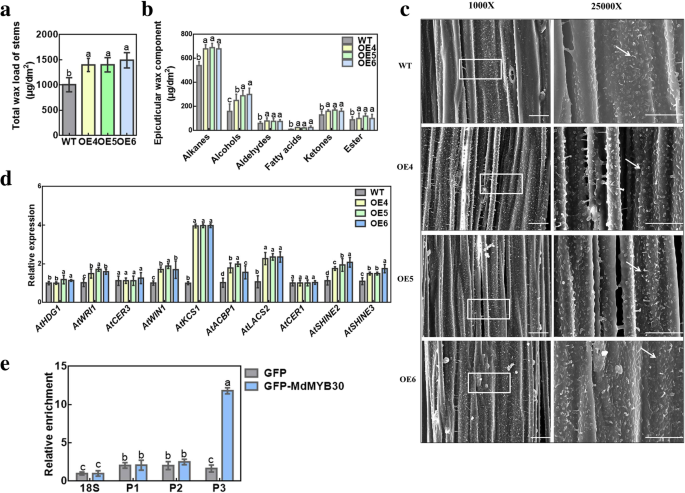
以前的研究已经证明了这一点AtMYB30是拟南芥蜡生物合成的重要调控因子[20.].总蜡MdMYB30提取异位表达和WT拟南芥以研究功能MdMYB30在蜡积累。异位表达的总蜡量有显著差异MdMYB30和WT拟南芥。茎、叶的蜡质总量比叶、茎高1.5 ~ 1.3倍MdMYB30OE株系与WT株系比较(图。4一种;附加文件1:图S2a;附加文件1:表S1)。采用气相色谱-质谱联用技术对茎蜡成分进行测定。角质层蜡的组成分析表明,蜡中烷烃、醇类、醛类、脂肪酸、酮类和酯类的含量增加MdMYB30其中,脂肪酸的增加幅度最大,是WT的2.6倍以上(图2)。4B;附加文件1:表S2)。C29烷烃、C31醇类、C29醛类、C16脂肪酸、C29酮类、C29和C30酯类均显著增加MdMYB30与WT中的异位表达谱进行比较,提供了证据MdMYB30在角质层蜡的生物合成中起着重要的作用1:图开通)。
蜡载荷,组成,角质层蜡晶体形态和WT和蜡相关基因表达的变化MdMYB30异位表达植物。一个以6周龄拟南芥为材料,计算其单位面积的茎总表皮蜡质含量MdMYB30异位表达。b6周龄拟南芥的蜡状蜡构成为wt和MdMYB30异位表达。c6周龄拟南芥的蜡晶形态来自WT和MdMYB30扫描电镜检测异位表达谱(比例尺:10 μm)。表面MdMYB30用蜡晶体和蜡沉积覆盖异位表达系,而野生型表面仅显示少量的蜡沉积(箭头指向迹象蜡晶体)。在×1000 /×25000放大率(白色盒子点到放大区域)监测蜡晶体。d蜡合成相关基因的表达MdMYB30拟南芥异位表达与野生型。e用来自空向量(EV)和MyB30-GFP OE的交联15天苹果Calli提取的细胞核分析。的Md18S基因被用作对照,其为芯片样品提供了背景水平。P1,P2和P3代表推定的绑定MYB独联体-Elements在MdKCS1分别启动子。误差柱代表标准差(SD;n = 3). Data are mean ± SD of three independent replicates. Different lowercase letters indicate significant differences atP< 0.05
我们在茎中检查了蜡晶体形态MYB30异位表达与WT植物,但电镜未发现蜡晶形态差异;然而,MdMYB30异位表达的拟南芥比野生型表现出更多的表皮蜡质晶体(图。4c).同样,在异位表达的拟南芥叶片中也检测了蜡晶体,仅检测到少量增加(附加文件1:图S2c)。因此,表达式MdMYB30改变了茎和叶中的蜡晶的数量。
此外,蜡生物合成基因的转录水平,包括AtHDG1,AtWRI1,AtCER3,AtWIN1,ATKCS1,AtACBP1,Atlacs2.,AtCER1,AtSHINE2,AtSHINE3WT和MdMYB30通过QRT-PCR检测异位表达的线。异位表达MdMYB30上调数个蜡类相关基因的转录,如AtWRI1,AtWIN1,ATKCS1,AtACBP1,Atlacs2.,AtSHINE2,AtSHINE3,这表明MdMYB30促进蜡的生物合成(图。4d)。有趣的是,ATKCS1显著上调MdMYB30异位表达植物。因此,我们分析了MdKCS1启动子序列,发现三个可能与MdMYB30蛋白相互作用的基序(P1, P2, P3)1:图S3)。采用ChIP-PCR检测MdMYB30是否直接结合MdKCS1启动子。结果表明,MdMYB30特异性结合于tattt基序的P3序列中MdKCS1调控蜡合成的启动子(图。4e)。
MdMYB30具有改变表皮蜡质特性和表皮通透性的作用
蜡层的厚度与角质层的渗透性有关。采用叶绿素浸出法研究了黄瓜角质层膜的性质MdMYB30异位表达植物发生变化。结果表明,叶绿素的提取速度较慢MdMYB30与WT相比,异位表达的植物(图。5a),表明在不同表达拟南芥中叶绿素浸出的叶绿素浸出的更高的粘接性。随后,甲苯胺蓝染色实验表明MdMYB30无论莲座叶还是茎染色,异位表达系都比WT更难染色。5b, c)。这些结果表明MdMYB30明显改变了表皮蜡的渗透性。
MdMYB30赋予抵抗力太平洋标准时间DC3000
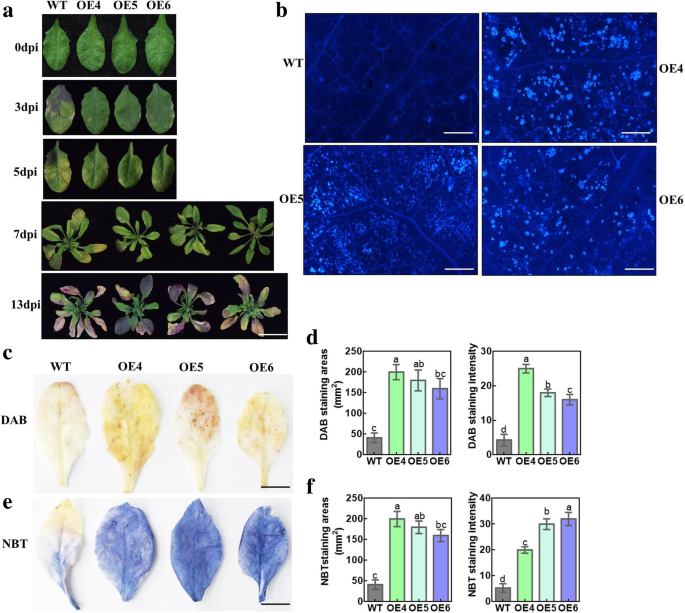
切割蜡作为对压力源和病原体的物理障碍,是植物防御反应的化学威慑和活化剂。我们是否评估了MdMYB30影响阻力太平洋标准时间DC3000,是一种细菌病原体。结果表明,WT叶片在接种3 d后变黄太平洋标准时间DC3000;然而,树叶的MdMYB30异位表达谱线很少泛黄。随着时间的推移,敏感性变得越来越严重,几乎所有的WT莲座叶片在感染13 d后发生褪绿,而异位表达系的叶片在所有时间点都更健康,提示了这一点MdMYB30异位表达赋予了对病原体的抗性(图。6a). ROS水平与病原体感染密切相关。检测异位表达系接种后是否改变ROS水平太平洋标准时间5 D DC3000,ROS反应性染料DAB和NBT用于测试O.2−和H2O2受感染莲座叶的含量。结果显示异位表达MdMYB30在WT中观察到弱染色(图。6氟)。相应地,异位表达品系的胼胝质含量也有所提高太平洋标准时间DC3000感染与WT相比(图。6b),证明MdMYB30增强抵抗太平洋标准时间DC3000。
异位表达MdMYB30在拟南芥中增加抗性太平洋标准时间DC3000。一个WT的表型,MdMYB30OE4,OE5和OE6感染太平洋标准时间DC3000为0,3,5,7和13天(秤条:1厘米)。b胼胝质沉积MdMYB30异位表达拟南芥感染太平洋标准时间DC3000为5天(秤条:500μm)。cH . 3 ',3 ' -二氨基联苯胺(DAB)染色2O2在wt和wt和MdMYB30异位表达拟南芥感染太平洋标准时间DC3000为期5天。d用ImageJ软件测定DAB染色区域及强度。e硝基蓝四唑(NBT)染色的超氧化物在野生型和MdMYB30异位表达拟南芥感染太平洋标准时间DC3000为期5天。f用ImageJ软件检测NBT染色区域及染色强度。不同字母的条形图在PTukey单因素检验< 0.05。数据为平均值±标准差。至少进行了三次生物重复
MdMYB30积极的调节b . dothidea通过苹果果实的瞬态转换攻击
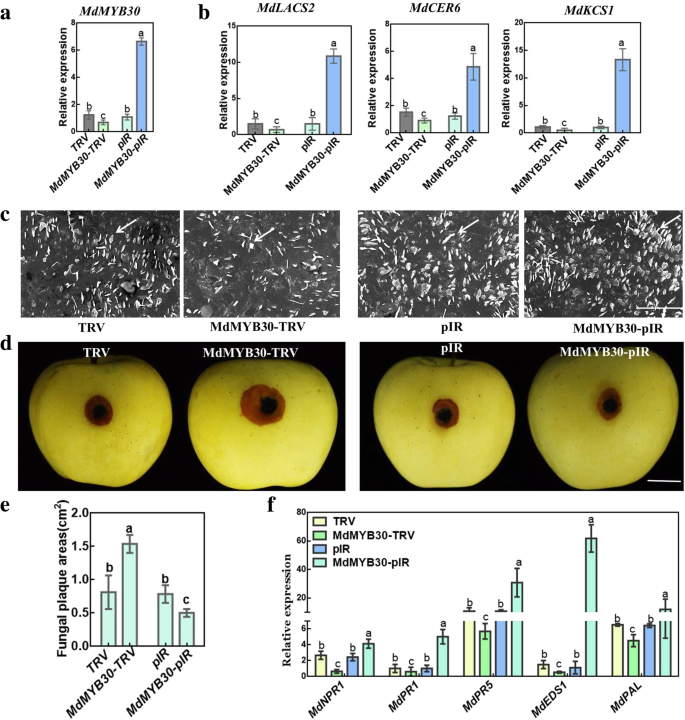
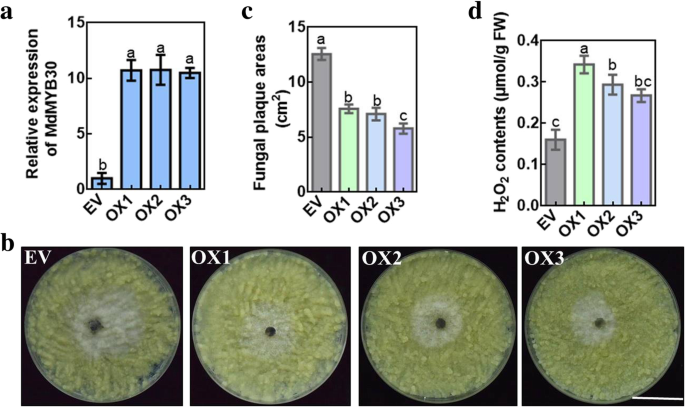
的表达MdMYB30是通过基于病毒载体的瞬时转化来增加或抑制MdMYB30提高苹果对病原菌的抗性。在这里,独立的MdMYB30-TRV和MdMYB30-pIR瞬时表达MdMYB30分别下调或显着上调mRNA水平(图。7a).首先,我们检测了注射点蜡相关基因的转录,三个蜡相关基因与MdMYB30表达式(无花果。7b).此外,过度表达MdMYB30根据对照相比,根据SEM加速了注射部位周围的蜡晶的数量(图。7C)。相应地,过度表达MdMYB30与空载体相比,其抑制增加了病变增加了损伤(图。7d, e). qRT-PCR结果显示,致病相关基因的转录,包括MdNPR1,MDPR1,MDPR5.,MdEDS1,mdpal.与对照组相比,TRV-MdMYB30注射位点降低,而pIR-MdMYB30注射位点增加(图2)。7f).随后,函数MdMYB30在苹果疾病中证实了抗病性。我们过度表达MdMYB30在苹果愈伤组织中获得3个MdMYB30overexpressing (MdMYB30OX)转基因株系(图。8一种)。然后,我们测试了Apple Calli的免疫力b . dothidea,发现过表达MdMYB30与空载体相比,病变明显减少(图。8b, c)。MdMYB30牛转基因苹果calli具有更高的h水平2O2而不是空向量(图。8d)。这些发现表明了这一点MdMYB30积极调节苹果果实中的蜡积聚,并加强苹果抵抗力B. dothidea。
MdMYB30调节角质层蜡质相关抗性b . dothidea在苹果果实。一个表达水平的MdMYB30根据qRT-PCR检测。MdMYB30-pIR是MdMYB30瞬态过度表达矢量,而MDMYB30-TRV是MdMYB30瞬态反义向量。空pIR和TRV载体作为对照。b在注射部位表达蜡合成相关基因。c扫描注射部位周围受感染苹果果皮的切割蜡晶体图案的电子显微图像(秤条:10μm)。MDMYB30-TRV / MDMYB30-PIR注射部位周围的蜡晶体的数量较少/多于TRV / PIR空向量对应物(箭头指向迹象蜡晶体)。dTRV、MdMYB30-TRV、pIR和MdMYB30-pIR感染后的表型b . dothidea注射后4天。(比例尺:1厘米)e感染后苹果的真菌斑块区域b . dothidea4天。f用qRT-PCR检测苹果侵染后注射部位周围抗病相关基因的表达b . dothidea4天
讨论
弹性蜡参与许多生理过程,是植物的空中部位的主要保护物质。MYB TFS参与了众多进程[6,21,22].几个R2R3型MYB TFS通过可能的切割依赖性途径在生物压力下发挥基本作用[23,24,但R2R3-MYB蛋白在苹果抗病中的作用尚不清楚。
蛋白质的亚细胞定位与其功能密切相关。据报道,许多MYB蛋白定位于细胞核。在小麦(小麦l .)TaMYB1如洋葱表皮细胞中的体内亚细胞靶向实验所示的核局部化[25].在拟南芥中,MYB21和MYB24是在它们相互作用的原子核中吗myc2./3./4/5通过BHLH-MYB综合体调节雄蕊生长和种子产生的蛋白质[26].核定位转录因子MYB2与bHLH蛋白相互作用芹菜graveolens调节花青素的生物合成[27].在本研究中,MdMYB30的荧光信号显示其位于细胞核内,说明MdMYB30作为转录因子(TF)可能靶向定位于细胞核内参与蜡合成的基因。
植物MYB TFS在监管途径和面临各种压力源的网络中起重要作用。在l .紫色,LPMYB1与WT相比,异常表达拟南芥表现出增强的干旱和耐盐性[28].在拟南芥中,AtMYC2和/或AtMYB2过表达的植物对ABA表现出更高的敏感性,一些ABA诱导基因表达上调,表明这两种蛋白在干旱胁迫下转录激活ABA诱导基因的表达[22].在本研究中,异位表达MdMYB30拟南芥对非生物(PEG和ABA)和生物(flg22和B. DOTHIDEA)压力源。
以往的研究表明,表皮蜡主要由烷烃、醇类、醛类、游离酸类、酮类和酯类组成。其中,烷烃占40-60%,醇占15-20%,醛占5-10%,游离酸占5-9%,酮占15-20%,酯占< 10%。拟南芥中烷烃含量的增加对蜡质的影响最大[29,30.,31].我们的研究结果表明,与前一款的蜡含量与以前的蜡含量一致,与WT相比,蜡含量最明显的增加是脂肪酸。我们怀疑脂肪酸可能在植物表皮的抗病抵抗中发挥作用。拟南芥长链酰基-CoA合成酶的研究(LACS2)突变体的研究表明,表皮蜡质组分、结构和渗透性的改变可能导致较强的抗性葡萄孢菌[32].蜡含量的增加通常会导致晶体结构的变化和蜡晶的量[33,34].图中,表皮蜡质负荷和蜡晶体数量增加MdMYB30拟南芥的异位表达,可能是由于表皮蜡质组成的改变。
以前的报告表明ATKCS1,AtFDH,atd3.基因参与VLCFA生物合成途径。MyB30通过增加内质网中的VLCFA的生物合成来直接激活这些基因的启动子以调节细胞死亡[5].表皮蜡质相关基因MYB96在干旱和ABA的诱导下转录,特异性结合到蜡质生物合成相关的几个结构基因的启动子区域.蜡质含量的增加导致植物抗旱性的增强[35].我们的结果表明,酶编码基因和转录因子显著增加MdMYB30异位表达拟南芥与wt相比。其中,ATKCS1是最明显的,哪个是一致的MdMYB30绑定到MdKCS1启动子,从而激活其表达。
由于甲苯胺蓝无需溶剂直接进入植物组织,因此该方法可用于研究角质层膜的渗透性[32].用甲苯胺蓝染色法测定表皮蜡质透性。之前的一项研究表明蚕豆根尖感染豆黄色马赛克病毒的叶子呈现更高的h2O2与控制相比,MDA水平[36].在这里,MdMYB30转基因苹果愈伤组织和异位表达拟南芥叶片的O2−和H2O2内容比WT治疗后太平洋标准时间DC3000和b . dothidea分别4天。事实上,活性氧的爆发被认为是对生物压力的最早反应之一[37].ROS的爆发增强了植物的抗病能力,增加了细胞壁的变化[38].这些发现支持了之前的观点并证实了这一点MdMYB30正调控植物抗病性。
结论
总之,我们提出的证据表明MdMYB30我们提出了一个工作模型来解释这个过程(图。9).简单来讲,特遣部队MdMYB30通过激活表达调控表皮蜡的生物合成MdKCS1.因此,ectopically表达MdMYB30显著增加了表皮蜡的总量,改变了表皮蜡的成分;因此,通过改变表面性质和致病相关基因来抵抗病原体。
方法
植物材料和生长条件
野生型‘Orin’苹果愈伤组织在23-25℃暗培养,每3周传代一次。“Royal Gala”组培苗在23-25℃,16 h/8 h光周期下培养,每月传代一次。继代培养基使用后依次为[39].拟南芥(生态型‘哥伦比亚’)在19-22℃的长日(16 h/8 h)光照培养箱中培养。烟草(尼古利亚娜·宾夕法尼亚州)在23-25°C下生长,光周期为14 h/10 h。
为了进行组织表达实验,研究人员从5岁的“皇家Gala”苹果树上取下了单个苹果组织。胁迫反应试验的苹果幼苗处理方法参照前面所述[40].这些苹果果实在开花140天后从“金色美味”果树上取样。b . dothidea在马铃薯葡萄糖琼脂(PDA)培养基上24°C培养[41.].
“Orin”苹果愈伤组织是由日本国立果树科学研究所的Moriguchi教授进行的。‘御Gala’树取自山东农业大学实验站。“金鲜”水果来自泰安附近的一个商业果园。我们声明植物材料的收集符合机构,国家或国际准则。
系统发育树构建及氨基酸序列分析
拟南芥MYB30的同源物是从蛋白质爆炸计划获得的(http://www.ncbi.nlm.nih.gov/BLAST/).使用Mega 7.0和DNaman 6.0软件进行系统发育树和多序列对齐。Meme Suite(http://meme-suite.org/)软件获取MYB30S的功能图形。MdMYB30蛋白结构域通过NCBI网站(https://www.ncbi.nlm.nih.gov/structure/cdd/wrpsb.cgi.).
质粒构建与植物遗传转化
以‘Royal Gala’组培苗叶片提取RNA,克隆MdMYB30 cDNA。利用利用SalI和BamHI酶切位点设计的引物MdMYB30- pr - f (5 ' -GTCGACATGGGGAGGCCTCCTTGCT-3 ')和MdMYB30- pr - r (5 ' -GGATCC GAAAAAGTTAGCATTTCCATGATCT-3 ')扩增出1026 bp的MdMYB30 cDNA。将扩增产物插入PRI-GFP中,获得MdMYB30-GFP融合蛋白。苹果愈伤组织和拟南芥的转化遵循[42.,43.),分别。
亚细胞定位
将MdMYB30全长序列插入到GFP载体中,构建重组质粒MdMYB30-GFP。35S::MdMYB30-GFP,用于烟草转化[44.].使用激光扫描共聚焦显微镜(Zeiss LSM 510 Meta,Jena,德国)检测荧光信号。
蜡提取,气相色谱 - 质谱(GC-MS)分析,扫描电子显微镜(SEM)
采用以下步骤对表皮蜡进行详尽的提取:氯仿萃取、氮气吹干、衍生化反应,以及前面描述的样品分析[39,45.].如前所述进行扫描电镜[39].步骤可概括为:取样、真空冷冻干燥、金喷处理、镜观察。
染色质免疫沉淀(ChIP)-聚合酶链反应(PCR)分析
采用EpiTect ChIP OneDay Kit进行ChIP- pcr分析,方法参照[46.].用于ChIP-PCR分析的引物列在附加文件中1:表S3。
基因表达分析
利用RNA Plant Plus Reagent Kit (Tiangen, Beijing, China)和TRIzol试剂(Invitrogen, Carlsbad, CA, USA)分离植物总RNA。使用PrimeScript™RT试剂试剂盒和gDNA橡皮(TaKaRa,志贺,日本)进行逆转录。定量RT-PCR检测采用Step One Plus™Real-Time PCR系统(Thermo Fisher Scientific, Waltham, MA, USA)检测蜡质和抗病相关基因的转录水平。qRT-PCR根据[47.].用于qRT-PCR的引物列于附加文件1:表S3。
叶绿素浸出试验
采集4周龄幼苗的莲座。叶绿素含量的测定方法如下:[48.,49.].
甲苯胺蓝染色
甲苯胺蓝染色检测叶片表面透性,根据[45.].
病原体感染分析
WT和转基因拟南芥的叶片被取样并如前所述感染[50.].拟南芥菌株侵染分析两pv番茄DC3000 (太平洋标准时间DC3000),按照[51.].太平洋标准时间DC3000是拟南芥与病原菌相互作用的模型菌株。苹果愈伤组织接种b . dothidea是根据[50.].
ROS化验
H2O2根据[52.].施用硝基唑唑鎓(NBT)和3,3-二氨基苯胺(DAB)染色方法以确定O.2−和H2O2水平分别[50.,53.].
胼胝质染色
感染后4天太平洋标准时间DC3000,在固定液(甲醛:乙酸:乙醇:h)中漂洗20 h2O, 3.7%: 5%: 50%: 41.3%, by vol.)。将样品从固定液中取出,用8 M NaOH浸泡5-6小时;去除氢氧化钠,用去离子水洗涤10 min;去除水分,加入0.01% (w/v)苯胺蓝染料溶液,在黑暗中浸泡1 h。如前所述,使用ImageJ软件对胼胝质沉积物进行了定量统计[50.].
苹果果实的病毒载体构建和农药
根据[中的病毒载体54.].引物对MdMYB30- f (5 ' - atggggaggcctccttgct -3 ')/−R (5 ' - GAAAAAGTTAGCATTTCCATGATCT-3 ')用于扩增全长MdMYB30,并将其插入到pIR载体中生成pIR-MdMYB30结构(附加文件)1:表S3)。然后,将全长cDNA的一部分MdMYB30(15 ~ 348 bp)克隆并以反义方向插入烟草摇粒病毒(TRV)载体中,得到反义构建物TRV- mdmyb30。采用瞬时注射法,如[55.].注射后,将果实置于室温黑暗下放置3天Botryosphaeria dothidea用接种环接种在注射点处,在潮湿的条件下在室温下放置在黑暗中,并加热b . dothidea3天后观察。
统计分析
每个实验设置3次重复,数据基于3次平行实验的结果。使用数据处理系统(DPS)对数据进行显著性分析(http://www.chinadps.net/).采用Tukey单因素检验。所有数据集都以相同的方式进行分析。一个p-Value <0.05被认为是显着的。
数据和材料的可用性
关于本研究的所有数据已包含在目前的手稿或补充中的表格和/或图形中。作者很高兴在合理的要求时分享分析/原始数据和工厂材料。
缩写
- b . dothidea:
-
Botryosphaeria dothidea
- 子:
-
开放阅读框架
- 太平洋标准时间DC3000:
-
细菌菌株两光伏番茄
- ROS:
-
反应性氧气
- 扫描电镜:
-
扫描电子显微镜
- vlcfas:
-
非常长链脂肪酸
参考文献
- 1.
李志刚,李志刚,李志刚。生物合成角质和亚皮内聚合物的研究进展。植物学报。2012;15(3):329-37。
- 2.
齐CH,赵XY,江汉,郑PF,刘,李伊,郝yj。苹果的隔离和功能识别Mdcer1.基因。acta botanica yunnanica(云南植物研究)2018;
- 3.
Beattie GA, Marcell LM。角质层蜡生物合成变化对玉米叶片表面理化性质和形貌的影响。植物学报。2002;25(1):1 - 16。
- 4.
Eigenbrode SD。植物表皮蜡花对掠食性昆虫附着和效力的影响。节肢动物学报2004;33(1):91-102。
- 5。
MYB转录因子调控拟南芥超敏细胞死亡反应的超长链脂肪酸生物合成。植物细胞。2008;20(3):752 - 67。
- 6。
关键词:拟南芥;R2R3-MYB基因;植物学报。2001;4(5):447-56。
- 7。
相同的myb相关植物转录因子可以指定几种表皮细胞类型的发育。发展。1998;125(17):3497 - 508。
- 8。
Sugimoto K, Shin T, Hirohiko H. myb相关转录因子NtMYB2是烟草反转录转座子Tto1和防御相关基因的调控因子。植物细胞。2000;12(12):2511 - 27所示。
- 9。
在拟南芥中,BOTRYTIS敏感基因编码一个R2R3 MYB转录因子蛋白,这是拟南芥生物和非生物胁迫响应所必需的。植物细胞。2003;(11):2551 - 65。
- 10.
李某,Suh Mc。采用拟南芥中的MyB94转录因子上调了切割蜡生物合成。植物细胞生理。2014; 56(1):48-60。
- 11.
Vailleau F, Daniel X, Tronchet M, Montillet JL, Triantaphylides C, Roby D. A R2R3-MYB基因,AtMYB30,在植物应对病原菌攻击的超敏感细胞死亡程序中起积极调节作用。中国科学(d辑:地球科学)2002;99(15):10179-84。
- 12.
MYB转录因子MYB30、MYB55和MYB110激活HCAA合成途径,增强水稻的免疫功能。植物生理学报。2018;59(5):903-15。
- 13.
Kaho M,Hiromasa M,Tomotaka I,Takamasa S,Mika N,Satomi S,Atsushi M,Tetsuya H,Yasuomi T,Wolfgang B,Hornaka T. MyB30链接ROS信号传导,根细胞伸长率和植物免疫反应。Proc Natl Acad Sci U S A. 2018; 115(20):E4710-9。
- 14.
SaladiéM,Matas AJ,Isaacson T,Jenks Ma,Goodwin Sm,Niklas KJ,Fernie A,Shackel K,Labavitch J,小林R,Lytovchenko A.重新评估影响番茄果实软化和完整性的关键因素。植物理性。2007; 144(2):1012-28。
- 15.
王志强,王志强。植物表面的疏水涂层:表皮蜡晶体及其形态、结晶度和分子自组装。微米。2008;39:759 - 72。
- 16。
Matas AJ, Cobb ED, Bartsch JA, Paolillo DJ, Niklas KJ。生物力学和解剖学Lycopersicon esculentum果皮和酶处理的样品。中国科学(d辑:地球科学)2004;91:352-60。
- 17。
番茄果实角质层缺乏角质持续影响抗微生物感染和生物力学特性,但不影响蒸腾失水。植物j . 2009; 60(2): 363 - 77。
- 18。
宗XJ,李德普,顾lk,李dq,刘lx,hu xl。脱落酸和过氧化氢诱导新型玉米C c Map激酶基因,ZMMPK7,其负责去除反应性氧物质。Planta。2009; 229(3):485。
- 19。
Lescot M, Déhais P, Thijs G, Marchal K, Moreau Y, Peer YV, Rouzé P, Rombauts S. PlantCARE,植物顺式作用调控元件数据库和启动子序列硅分析工具的门户网站。核酸学报2002;30(1):325-7。
- 20.
Raffaele S,Rivas S.调节并受到调节:通过ATMYB30转录因子整合防御和其他信号。前植物SCI。2013; 4:98。
- 21.
金海林,王志强,王志强。植物myb基因家族的多功能性和多样性。植物学报。1999;41(5):577-85。
- 22.
拟南芥AtMYC2 (bHLH)和AtMYB2 (MYB)在脱落酸信号转导中起转录激活作用。植物细胞。2003;15(1):63 - 78。
- 23.
关键词:拟南芥,MYB96,抗旱性,抗旱性亚麻荠漂白亚麻纤维卷通过表皮蜡的积累。植物学报2014;33(9):1535-46。
- 24.
关键词:拟南芥,EsWAX1,抗坏血酸,表皮蜡质,抗旱性植物生理生化。2014;75:24-35。
- 25.
陈RG,NI ZF,NIE XL,Qin YX,DONG GQ,SUN QX。在小麦中编码MYB转录因子的基因的分离与表征(Triticum Aestivem L.).植物SCI。2005; 169(6):1146-54。
- 26.
齐涛涛,黄华,宋绍生,谢德兴。拟南芥中bHLH-MYB复合物对茉莉酸介导的雄蕊发育和种子生产的调控。植物细胞。2015;27(6):1620 - 33所示。
- 27.
冯轲,刘建新,段爱清,李涛,杨qq,徐志生,熊爱生。AgMYB2转录因子参与调控紫芹菜花青素生物合成(Apium graveolens L.).足底。2018;248(5):1249 - 61。
- 28.
姚明明,蒋勇,陆xx,王波,周鹏,吴太良扁豆紫色干旱增加了拟南芥对非生物胁迫的耐受性。中国人民大学学报(自然科学版)2016;43(10):1089-00。
- 29.
Bourdenx B,Bernard A,Domergue F,StéphanieP,Amandine L,Dominique R,Marjorie P,Denis V,Richard Ph,Johnathan An,Renél,JérômeJ.Hoverexpressionof ArabidopsisECERIFERUM1促进蜡长链烷烃的生物合成,并影响植物对生物和非生物胁迫的反应。植物杂志。2011;156(1):29-45。
- 30.
王Ty,xing JW,刘X,姚yy,hu z,彭h,ni z. gcn5通过组蛋白乙酰化有助于干扰蜡生物合成CER3在拟南芥中。J Exp Bot。2018; 69(12):2911-22。
- 31.
Jenks MA, Rashotte AM, Tuttle HA, Feldmann KA拟南芥表皮蜡质和叶片形态的突变体。植物杂志。1996;110(2):377 - 85。
- 32.
Bessire M, Chassot C, Jacquat AC, Humphry M, Borel S, Petétot JCM, Nawrath C葡萄孢菌.EMBO j . 2007; 26(8): 2158 - 68。
- 33.
王伟,黄强,刘艳,王伟。管道清蜡机理的实验研究。在SPE年度技术会议和展览会上。Soc Pet Eng. 2015;
- 34.
Wang Y, Wan L, Zhang L, Zhang Z, Zhang H, Quan R, Huang R. An ethylene response factor OsWR1 in drought胁迫下转录激活蜡合成相关基因并增加蜡产量。acta botanica sinica(云南植物学报). 2012;40(3):457 - 461。
- 35.
PIL JS,SAET BL,MI CS,MI-JEONG P,Young SG,Chung-Mo P. MyB96转录因子在拟南芥中的干旱条件下调节切割蜡生物合成。植物细胞。2011; 23(3):1138-52。
- 36.
大豆黄花叶病毒侵染和水杨酸处理对大豆叶片抗氧化活性和蛋白质组成的影响。植物生理学报。2010;32(5):891-904。
- 37.
peg - grossman S, melmed - book N, Levine A.共生感染中ROS的产生抑制致病相关基因的表达。植物信号行为。2012;7:409-15。
- 38.
拟南芥细胞壁损伤诱导的木质素生物合成受活性氧和茉莉酸依赖过程的调控。植物杂志。2011;156:1364 - 74。
- 39。
张镱锂,张春林,王光良,王应祥,齐超,尤春霞,李媛媛,郝玉军。苹果AP2/EREBP转录因子MdSHINE2通过调控蜡质生物合成获得抗旱性。足底。2019;249(5):1627 - 43。
- 40。
张春林,毛凯,周丽娟,王光良,张玉玲,李媛媛,郝玉娟。苹果长链酰基辅酶a合成酶的全基因组鉴定、鉴定及不同胁迫下的表达分析植物生理学报。2018;32(4):449 - 454。
- 41。
刘晓霞,梁勇,张伟,霍勇,冯绍华,何鑫,吴胜,陈晓霞。拟南芥fls2突变体对细菌鞭毛蛋白flg22的识别及其对苹果环腐病的免疫抗性。园艺学报,2018;45(5):827-44。
- 42。
安建平,李洪辉,宋立强,苏玲,刘旭,尤彩霞,郝玉杰。苹果bHLH转录因子MdMYC2的克隆及功能分析。植物生理学报2016;108:24-31。
- 43。
农杆菌介导的拟南芥转化的一种简化方法。植物j . 1998; 16(6): 735 - 43。
- 44.
孙明辉,马庆军,胡德广,朱雪平,尤春霞,舒海瑞,郝玉军。葡萄糖传感器MdHXK1磷酸化液泡膜Na+/小时+交换者改善耐盐性。植物理性。2018; 176(4):2977-90。
- 45.
在拟南芥中,AP2结构域转录因子SHINE分支激活蜡质生物合成,改变角质层特性,并在过表达时赋予耐旱性。植物细胞。2004;16(9):2463 - 80。
- 46.
安建平,张新文,毕淑琴,尤彩霞,王雪峰,郝玉军。MdbHLH93是调控苹果叶片衰老的激活剂,ABA和MdBT2以拮抗的方式调控MdbHLH93。新植醇。2019;222(2):735 - 51。
- 47.
jp,张xw,xu rr,你cx,wang xf,hao yj。Apple MDERF4通过抑制MDERF3转录来负调节耐盐性。植物SCI。2018; 276:181-8。
- 48.
王泽,田XJ,赵琦,刘紫房,李XF,任yk,唐jq,方j,xu qi,bu qy。E3扎酶干旱过度敏感通过促进转录因子ROC4在水稻中的降解,负调控角质层蜡的生物合成。植物细胞。2018;30(1):228 - 44。
- 49.
拟南芥fiddlehead-1突变体细胞间相互作用的发育调控:表皮细胞壁和角质层的作用。Dev沸腾。189(2): 311 - 1997; 21。
- 50.
汉普,董烨,古嘉诗,余杰,胡迪格,荷园。苹果u-box e3 ubiquitin连接酶mdpub29有助于激活对真菌病原体的植物免疫应答Botryosphaeria dothidea.足底。2019;249(4):1177 - 88。
- 51.
辛晓峰,盛玉华。丁香假单胞菌。番茄DC3000:植物抗病敏感性和激素信号转导的模型病原体。植物病理学杂志。2013;51:473-98。
- 52.
关键词:锌指蛋白,ZFP36,脱落酸诱导的抗氧化防御,抗氧化应激J Exp Bot. 2014; 65:5795-809。
- 53.
赵H,徐L,Su T,江y,胡l,Ma F.褪黑激素调节碳水化合物遗产和防御丁香假单胞菌。番茄DC 3000在拟南芥中的侵染。中国海洋大学学报(自然科学版)2015;59(1):109-19。
- 54.
Li L, Lomonossoff GP。农业感染作为一种快速繁殖的方法豇豆马赛克virus-based结构。中国病毒学杂志。2002;105(2):343-8。
- 55.
李伊,毛泽东,赵开,你是cx,郝yj。MDCOP1泛素E3连接酶与MDMYB1相互作用以调节苹果中的光诱导的花青素生物合成和红色果实着色。植物理性。2012; 160(2):1011-22。
确认
我们要感谢日本国家果树科学研究所的Moriguchi教授,他培育了“Orin”苹果愈伤组织。
资金
国家重点研发计划项目(no . 2018YFD1000200);国家自然科学基金项目(no . 31772275);山东省优秀青年自然科学基金项目(no . ZR2018JL014)资助。资助方不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
从属关系
贡献
YYL和YJH发起并设计了这项研究。YLZ、CLZ、GLW、YXW、CHQ、QZ和CXY进行了实验。YLZ分析了数据。YYL提供试剂/材料/分析工具。手稿是YLZ写的。YYL和YLZ对手稿进行了修改。所有作者均已阅读并批准本稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
图S1。MdMYB30基因组和cDNA序列示意图。UTR:翻译区。图S2。WT植物的蜡载荷,组合物和蜡晶体形态的变化和MdMYB30扫描电镜观察异位表达植物。一个叶子的总皮肤蜡含量,每单位面积为来自WT和的6周龄拟南芥MdMYB30异位表达。b表皮蜡由烷烃、醇类、醛类、脂肪酸、酮类和酯类组成MdMYB30GC-MS分析异位表达植物。蜡的成分按碳链长度和化学性质分类。c6周龄拟南芥的蜡晶体形态来自wt和MdMYB30异位表达线(秤条:10μm)。误差柱代表标准差(SD;n = 3). Data are mean ± SD of three independent replicates. Different lowercase letters indicate significant differences atP< 0.05.图S3。基因组结构和引物(由P1-P3表示)的示意图MdKCS1由ChIP-qPCR基因。白框代表引物集,黑框代表ATG开始开放阅读框(ORF)。表S1。野生型拟南芥总表皮蜡质,MdMYB30OE4, OE5和OE6表面积。表S2。表皮蜡成分(μg/dm2)在野生型拟南芥茎中,MdMYB30OE4, OE5, OE6。表S3。本研究使用的引物。文件S1。分析MdMYB30及其同源基因的氨基酸序列,分析其系统发育关系。(邮政编码1525 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
张,yl。,张,cl。,王,gl。et al。R2R3 MYB转录因子MdMYB30通过调控表皮蜡质的生物合成来调控植物对病原菌的抗性。BMC植物BIOL.19,362(2019)。https://doi.org/10.1186/s12870-019-1918-4
收到了:
接受:
发表:
关键字
- 苹果
- 粘膜蜡
- MdMYB30
- 病原体耐药性