抽象的
背景
除纤维外,棉花植物还产生大量含油和蛋白质含量高的种子。这些种子的使用受到限制,因为它们的萜类棉酚含量高,对人和牲畜有害。利用基因工程方法,“超低棉酚棉籽”(ULGCS)植物是通过敲除一种催化棉酚前体形成的酶而产生的。这是通过rnai介导的靶基因的沉默使用的靶基因来完成的使用α-球蛋白促销活动。由于Gossypol也是针对叶片食草食草症的重要防御机制,ULGCS植物可能比非工程植物具有较低的食草动物抵抗力。因此,我们测试了两种ULGC棉线对非洲棉叶虫的构成和诱导的直接抗虫抗性,Spodoptera littoralis.。
结果
当喂养来自茉莉酸诱导的未造成的植物和植物的完全扩张的真实叶子时,食草动物同样受ULGC线和对照(Coker 312)线的影响。然而,当被毛虫造成植物损伤时,S. Littoralis.幼虫在ULGCS植物上表现更好。Terpenoid分析表明,ULGCS系同等诱导为对照植物。两条线中的一种萜件水平总是较低。在子叶子的情况下,毛虫在ULGCS棉上比常规棉花更好。这可能是由ULGCS子叶中减少的茂棒水平造成的。
结论
尽管有那些效果,ULGSC棉的抗虫可被认为是大部分完整的,因此,植物可能是对常规棉花品种的有趣替代品。
背景
来自属的棉花植物Gossypium是纤维的主要来源之一。今天95%的棉花来自gossypium hirsutum(Malvaceae:Malvales)[1].除了它的纤维外,棉花植物还产生大量的种子(每千克棉绒1.65千克种子)[2].种子富含蛋白质,是油脂源的宝贵源[3.那4.].然而,它们通常含有高浓度的萜类萜醇,存在于种子核的腺体内。棉花植物的大多数外观零件也具有骶骨腺体,并且植物的绿色部位中的那些含有不仅含有Gossypol,而且含有Hemigossypolone和HeLiocides 1-4,所有这些都来自于相同的生物合成途径。已知八曲醇对非反刍动物动物有毒[5.].因此,棉花育种的主要目标是为不产生八曲润的植物选择。育种者通过生产所谓的Glandless棉花来实现这一目标[2].然而,Gossypol和相关的三萜是一种重要的草食草和病原体抵抗因子,其叶子咀嚼草食物或植物激素茉莉酸的直接应用,棉防御反应的关键调节器[6.].因此,Glandless棉质更容易受到害虫和疾病的影响[6.那7.].因此,需要棉花植物产生具有低水平的棉酚种子,但在其他植物零件中的萜类化合物不变。使用遗传工程方法,通过敲降生产δ-双子烯合酶的产生,催化δ-双子烯的形成,达到δ-双子烯的形成,产生这种“超低高型棉籽”(ULGCS)植物,这是一种拟畴脂的前体。这是通过rnai介导的靶基因的沉默使用的靶基因来完成的使用α-球蛋白促销活动[8.那9.].2018年10月,美国监管机构批准了一个转换事件TAM66274(我们的稿件中的第66-274行)[10.])。
与这些ULGCS植物有关的一个问题是它们可以对草本病变和/或疾病产生增加的易感性。以前的诱导萜类化产量的工作主要集中在水杨酸驱动的抗性上对抗疾病[11.[茉莉酸驱动的诱导途径没有任何数据存在,这些途径通常与植物的损伤和棉花植物的损伤有关Heliothis那Helicoverpa.和Spodoptera.物种(所有Lepidoptera:noctuidae)。由于棉萜类化对棉花昆虫抵抗很重要[6.那7.[该途径的变化可能对植物健康产生显着影响,最终产生巨大的屈服。虽然Rathore等人。[11.[报道,在真正叶片中的组成型萜类产量在ULGCS线上不会受到损害,在子叶中大大降低。因此,ULGCS棉的子叶中缺乏猪肉可以使这些植物的幼苗比常规植物更敏感到草食虫攻击。虽然前一项研究表明,ULGCS棉对真菌病原体的反应Rhizoctonia solani.(天竺葵:Ceratobasidiaceae)是完整的[11.]但没有收集数据的抗虫性。
在这项研究中,我们使用两种不同的转基因事件及其非转化的亲本CV测试了ULGCS棉中构成型和诱导抗虫性的强度。焦化312.我们测试了通用食草动物的表现Spodoptera littoralis.(Lepidoptera:noctuidae)作为模型物种。蛾是多伏,在非洲发现的多球食草中,中东和地中海地区,众所周知,在56个家庭中攻击至少130种不同的植物种类[12.].Spodoptera littoralis.被认为是一种重要的害虫物种,主要是一种植物饲养者,与棉花的其他害虫相比是水果饲养者的。此外,该物种是植物 - 昆虫互动的重要模型物种,这使得数据更容易将数据放入更广泛的背景中。
我们喂养了S. Littoralis.用来自三种选定的棉线的子叶伴有几个性能参数,以测试ULGCS棉的低棉酚含量是否有益于食草动物。通过高效液相色谱(HPLC)测量子葡萄糖浓度,以将幼虫性能的变化连接到植物化学的变化。在第二步中,我们在所选择的棉线的真实叶子上分析了幼虫性能。从植物中喂食幼虫,植物被造成的植物,损坏S. Littoralis.幼虫,或通过茉莉酸治疗诱导。此外,我们在选择条件下评估了幼虫行为,以检测朝向不同植物的吸引力变化。
结果
Cotyledon测定
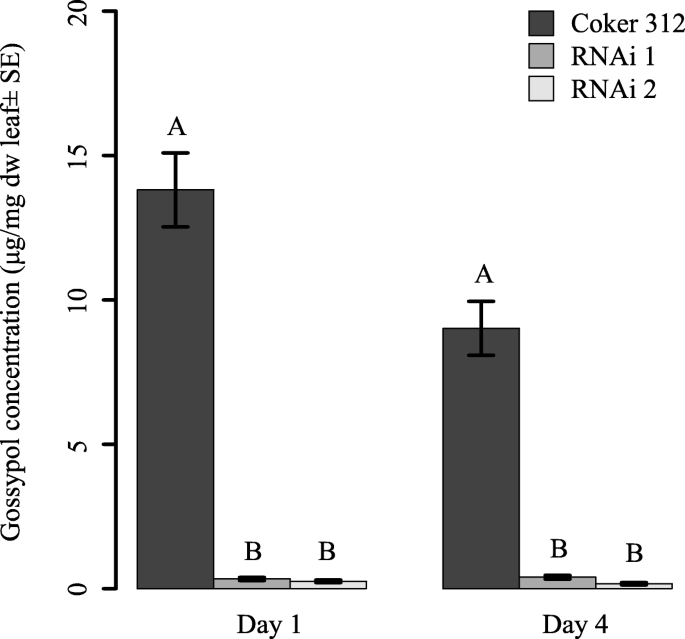
Terpenoid内容
子叶含有Gossypol,但没有可测量的血液色调物,H1 + H4和HeLiocides H2 + H3。两种ULGCS棉线(第1天:F)中的棉酚浓度要低得多2,78 = 83.6,P. < 0.001; day 4: F2,81 = 67.7;P. < 0.001), and in some cases not detectable (RNAi 1: day 1: 28.6% of tested plants, day 4: 20.0% of tested plants; RNAi 2: day 1: 33.3% of tested plants, day 4: 38.9% of tested plants) when compared to non-transgenic near isoline (Coker 312) (Fig.1).来自非转基因植物的子叶中子叶浓度显着下降在测定的开始(第1天)和收获第二个子叶的时间点(第4天)(f1,62= 9.2,P. = 0.004) (Fig.1).
幼虫表现
当从所有三种棉线喂食子叶子时,对生存没有任何效果S. Littoralis.幼虫在七天喂食期间(表1).然而,四个七天后幼虫重量的差异是明显的,与两个ULGC线相比,幼虫的幼虫重量显着降低。七天后,与两个ULGC线相比,幼虫从克洛克312叶片椎间盘中消耗显着较少(表1).
真叶测定
Terpenoid内容
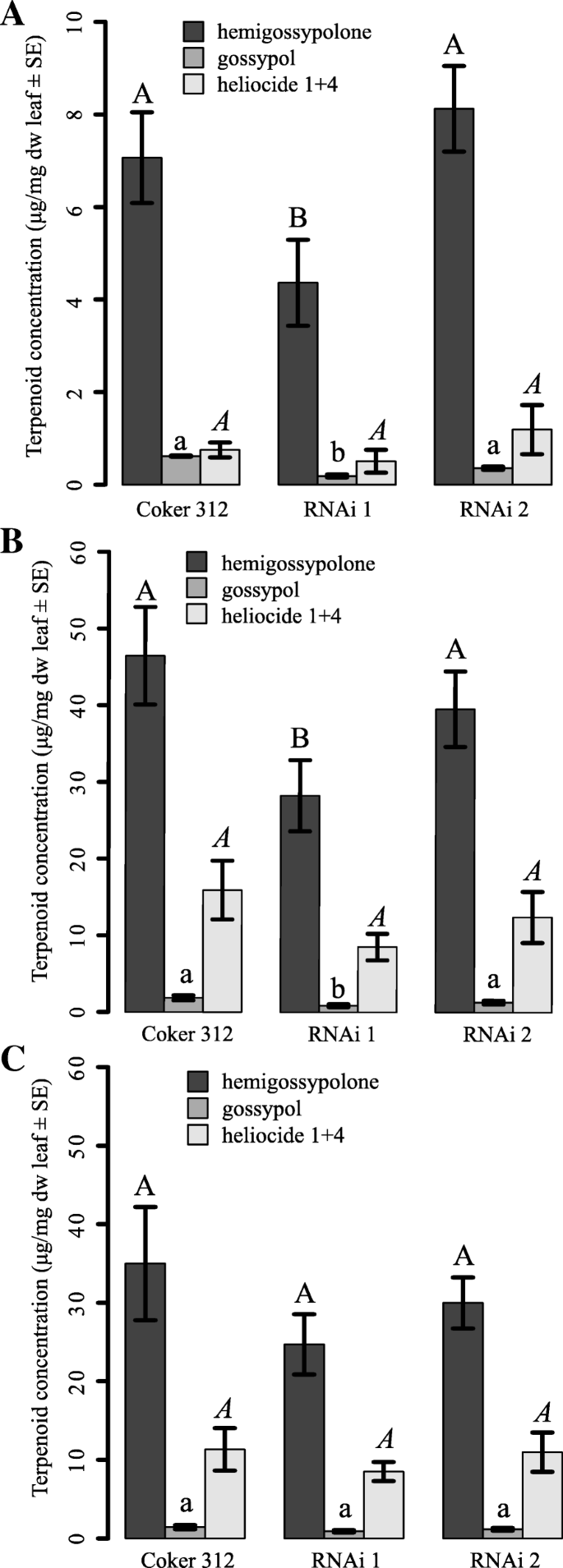
血清色调浓度受植物类型和治疗的影响,但没有检测到显着的相互作用(植物:F.2,187 = 5.3,P. = 0.006; Treatment F2,185 = 49.7,P. < 0.001, Plant × Treatment F4,181 = 1.0,P. = 0.389). Gossypol concentration was affected by plant type and treatment but there was no significant interaction detected (Plant: F2,183 = 12.0,P. < 0.001; Treatment F2,181= 23.6,P. < 0.001, Plant × Treatment F4,177 = 1.0,P. = 0.390). Heliocide 1 + 4 concentration was not affected by plant type, but by treatment. There was no significant interaction detected (Plant: F2,184 = 2.67,P. = 0.072; Treatment F2,182 = 27.92,P. < 0.001, Plant × Treatment F4,178 = 0.85,P. = 0.498).
未经治疗的ULGC和Coker 312棉的最小叶子含有大量的Gossypol,Hemigossypolone和HiLiocides H1 + H4。我们无法验证HeLiocides H2 + H3的存在。依托312和RNAi 2的血粒细胞苷和棉酚的浓度相等,但RNAi 1的含量显着降低(血粒细胞酮:F.2,66 = 4.95,P. = 0.021; gossypol: F2,63 = 8.09,P. < 0.001; Fig.2一种)。H1 + H4的浓度H1 + H4在植物中没有显着差异(F.2,64 = 0.902,P. = 0.411).
为了诱导植物,他们被侵染了S. Littoralis.在实验开始之前的幼虫。植物类型对消耗的叶子区域没有影响(焦化:21.9±2.42厘米2±SE;RNAi 1:19.4±2.34厘米2±SE;RNAi 2:22.6±2.97厘米2±SE;方差分析:F2,50 = 0.521;P. = 0.597). This leaf damage resulted in a strongly increased concentration of terpenoids in the youngest leaf compared to uninduced plants (Fig.2b)。同样,来自RNAi 1的叶子含有比剩余的植物类型显着降低胚乳和血液色调物(图。2B)(血清色调剂F.2,59 = 3.185,P. = 0.049, gossypol F2,59 = 5.306,P. = 0.008), while no difference was detected for heliocides H1 + H4 (F2,58 = 1.639,P. = 0.203).
与茉莉酸治疗的植物与未解释的植物相比,萜类化合物的含量增加,但浓度低于植物感染的植物S. Littoralis.(图。2C)。然而,在分析的任何三萜类化合物的三种植物类型中没有发现含量的显着差异(血红素样酮:F.2,56 = 1.042,P. = 0.359; gossypol: F2,55 = 1.838,P. = 0.169; H1 + H4: F2,56 = 0.536,P. = 0.388) (Fig.2C)。
幼虫表现
什么时候S. Littoralis.在其发育的前七天中,来自不同棉花植物的叶片圆盘上,我们发现因子植物类型没有强烈影响,但诱导和未受关注的植物之间存在强烈差异。四次七天后,幼虫在未处理植物的叶片上喂养叶片通常较重,与幼虫的圆盘相比,较大的叶面积来自S. Littoralis.- 血液或茉莉酸处理的植物(表2和3.).整体分析显示,植物类型对消耗的叶面积没有影响,只有在四天后对幼虫重量的影响,但在七天之后没有影响。然而,在所有情况下,植物类型和治疗之间的相互作用是可检测的。最好通过幼虫在诱导的ULGCS棉线上进行更好的表现来解释S. Littoralis.与类似治疗的胶质312相比,喂养,正如增加幼虫重量和较大的叶片区域所示。通过交互图评估这些交互,可以在附加文件中找到1:图。S1-S4)。生存率不受植物类型或治疗的影响,也没有显着的相互作用(植物:χ22,182 = 0.33,P. = 0.850; Treatment χ22,180 = 0.12,P. = 0.940, Plant x Treatment χ22,176 = 0.85,P. = 0.931).
对于在三种棉线未经处理的植物上的幼虫的子集中,幼虫被允许完成它们对蛹阶段的发展。14天后,我们发现植物类型的植物类型没有显着差异(f2,47 = 2.80;P.= 0.07)、发育时间(χ22,39 = 0.65;P. = 0.72), pupation rate (χ22,57 = 0.48;P. = 0.79), pupal weight (F2,37 = 2.36;P. = 0.11), or sex ratio (χ22,39 = 0.67;P. = 0.72).
偏好测定
我们进行了一系列选择的测定,以建立ULGCS棉花类型更具吸引力S. Littoralis.幼虫比焦点312(表4.).当植物同样地治疗植物时,幼虫没有偏好于任何植物类型(即,由毛毛虫受损,或用茉莉酸处理)。偏好指数[计算为:(叶面积消耗植物A - 叶面积消耗植物B)/消耗总叶面积,所有这些比较在−0.30和0.12之间变化。
进行额外的测定以评估幼虫的响应,当给予联合和诱导的选择时(两者S. Littoralis.和茉莉酸)从同一植物类型中叶(表4.).在这些测定中,我们发现无论植物类型还是诱导类型,我们发现了对未受作用的植物材料的偏好。当幼虫被允许在未被造成的之间选择时S. Littoralis.损坏的植物,偏好指数变化在0.57和0.76之间(表4.).索引的统计比较表明,与克洛克312相比,这两个转基因系中的这种反应类似(Coker与RNai 1:V = 280;P. = 0.130; Coker vs. RNAi 2: V = 222;P. = 0.665). Similar results were obtained in the comparisons between undamaged and jasmonic acid treated plants where the preference indices varied between 0.39 and 0.52 (Table4.).比较两种转基因株系与Coker 312 (Coker vs. RNAi 1: V = 217;P. = 0.665; Coker vs. RNAi 2: V = 175;P. = 0.665).
讨论
在本研究期间,我们评估了与常规非转化的棉花植物相比,两种ULGC棉线是否具有降低的抗虫性。
Terpenoid(Hemigossypolone,Gossypol,Heliocide H1 + H4)浓度的比较来自Coker 312的真实叶片和两个ULGC系列在两个ULGC线(RNAi1)中的一种叶片中显示出显着较低的浓度。在未判断和诱导的植物中,该模式是显而易见的。然而,这似乎并不是Δ-起角单合成活性的一般副作用,其已被证明是完全种子特异性的[9.那10.那13.].此外,与常规对照植物相比,第二线(RNAi 2)中的萜类化产量与常规对照植物相似,并且在两条线中诱导响应毛虫损伤或用茉莉酸治疗。两种ULGCS棉线之间的差异可能是由于组织培养和非常长的再生过程导致躯体变异。继发植物代谢物浓度可以不同,不同品种,品种或基因型也适用于棉花[14.].因此,可以预期不同线的uLGC和常规棉之间的一些变化。然而,在选择最合适的转化线以进行进一步发展时,应该考虑这种变化。之前报告了不同RNAi线之间的特萜浓度的某些差异[11.].我们的RNAi 2最近被美国监管机构批准为事件TAM66274 [10.].
和预期的一样,用S. Littoralis.结果表明,在诱导棉花植株上,其生长性能(增重、耗叶面积)降低。在未受损害或经茉莉酸处理的植株中,无显著差异S. Littoralis.观察到三种棉线中的性能。然而,当植物以前被毛毛虫损坏时,S. Littorals.与Coker 312控制厂相比,两种ULGC线路的性能显着更好。与RNAi 2植物相比,RNAi1植物中萜类浓度较低的事实对毛毛虫性能没有影响。因此,植物中的一些其他植物化学变化可能是对毛虫损伤的反应[15.].
行为选择实验显示不偏好S. Littoralis.三种棉线中的任何一种幼虫。然而,来自未解释的植物的叶片始终优于来自诱导植物的植物。
由于它们显着更容易受到易受的影响,因此图片更清楚S. Littoralis.损害。在ULGCS子叶中棉酚含量非常低的报道之前[11.].最有可能的是,子叶中,从种子本身接受萜类化合物,这将解释为什么ULGCS系列含有少量的萜件[11.].虽然S. Littoralis.不是棉花幼苗,其他食草动物的相关害虫,例如,蓟马或跳蚤甲虫,在这个阶段可能会造成重大损害[16.].因此,ULGCS棉花的害虫管理策略需要考虑到这种潜在的脆弱性,以防止由于昆虫损伤导致的屈服损失在这一非常早期的生长期。这可能不是棉花种子治疗的生产区域的关注,棉花是常见的[17.那18.].
植物可以通过容忍损坏或主动捍卫自己的损害来对食草损伤作出反应[19.].由于关联成本或生物量损失,这两种策略都是昂贵的20.那21.]但是在维持生殖成功时,这两种情况的成本都超过了两种情况22.].但是,在农艺情境下,高收益率在经济上重要而不是成功的复制。因此,植物通常在准害虫条件下生长,其中除草剂被除去,例如通过使用杀虫剂[1].近年来,目标一直是通过加强食草动物抗性特征来减少杀虫剂的应用。在棉花中,诱导型萜件发挥着不产生这些萜类化合物的重要作用和植物对食草动物和病原体的抗性较小6.那23.因此,保持这种抗性特性对于ULGCS棉的长期成功也是非常重要的。棉花植物中的食草动物损伤增加了萜类化合物和其他相关抗性特征的丰富,对食草动物产生负面影响[24.].虽然以前的研究关注了ULGCS棉花基于萜类的抗性机制,但他们没有解决这一特性对植物-昆虫相互作用的影响。之前的一项研究测试了ULGCS幼苗的抗病能力,没有发现它们对这种真菌的敏感性有任何差异R. Solani.[11.].我们的研究通过将ULGCS棉花的阻力研究扩展到抗虫机制来补充这项以往的工作。虽然棉花三萜胶在草食物和病原体抵抗中发挥作用,但这些被认为是不同的调节,因此转化可能不同地影响这些途径。我们的研究表明,在考虑真正的叶子时,百萜类抗虫抗性在测试的ULGCS线中保持完整。
随着我们的研究在受控实验室条件下进行,重要的是在各种气候条件下验证该领域的结果,并在属于不同饲养公会的多个草食虫的压力下。Palle等人的研究。[13.]发现在现场条件下,ULGCS中的百萜浓度(包括本研究中使用的RNAi 1线)和常规植物在野外条件下类似。虽然我们发现RNAi1线中的萜烯酸(血清色调剂,胃葡萄酒醇)浓度降低,但结果的这些差异可能是通过在场和温室条件下的不同反应的不同反应来解释。总体而言,德克萨斯A&M的7年的现场研究尚未在RNAi转基因ULGCS系和未转化的植物之间表明害虫敏感性的任何差异[10.那13.].此外,与非转基因对照相比,在美国在美国棉带上进行了八种不同,多状态的监管场试验,在两年内进行两年超过2年。与非转基因对照相比,RNAi线的易受敏感性较高25.].
虽然我们找不到ULGCS棉花在直接的基于Terpenoid的抗虫性状的强烈影响,但在本研究中不考虑间接抗性性状。后者很重要,因为他们吸引/逮捕棉食食草动物的自然敌人到受感染的植物[19.].本招聘中的一个关键部分是释放草食虫诱导的挥发物(HIVP)。该系统采用棉花良好研究,棉花挥发性混合物富含小萜烯,如δ-甲肾上腺素[26.].随着ULGCS棉抑制种子中δ-起角丁烯合酶的生产,这可能影响植物挥发性混合物的组成,然而,仅在生长的早期阶段期间。
结论
我们发现,与常规棉线相比,ULGCS棉线的基于三萜类的本构体棉花线的诱导抗虫抗性几乎受到遗传转化的影响。同时,这些植物如预期的那样在种子中大大减少了种子中的萜类化合物。因此,囊曲面含量和抑制子叶含量较弱S. Littoralis.幼虫在ULGCS子叶上表现优于传统的。因此,在发芽后的早期阶段,ULGCS棉花植物可能更容易受到昆虫损伤,并且可能需要额外的化学保护,因为许多棉花种植国家的农民常规实践。
方法
昆虫
鸡蛋的S. Littoralis.由Syngenta提供,并每周从瑞士的斯坦伊斯坦定期发送。幼虫在25°C,70%RH保持,A 16:8日:夜光循环,并用Heliothis Theelfly Diet(Ward Science,Rochester Ny,USA)喂养,直到他们达到了所需的阶段。
植物
使用两个ULGCS线(RNAi 1:Line 66-49b; RNAi 2:Line 66-274)(见[11.]有关线的描述)。另外,用于产生两个ULGCS系的非转基因克罗克312植物,父族(未转化的)栽培品种用作对照(称为“常规棉)”)。所有植物材料都由Keerti S. Rathore(德克萨斯州A&M University,USA)提供。植物最初在气候室中的小盆中生长,其中25°C,70%RH和16:8日:夜光循环。10天后,将植物转移到3升塑料盆,含有腐殖质的土壤,富含15毫克的缓释肥料Manna Cote 4米(Wilhelm Haug GmbH,Ammerbuch,德国)。它们被迁移到气候控制的温室,并在与气候室中的相同条件下生长。4周后,植物曾经用10N:10p:8k受精10ml / l。在温室中,植物封闭在纱布笼中(高度,71厘米;直径,35厘米;网格宽,0.264毫米),以保护它们免受玻璃虫害。在播种后10天使用在鼠李顿阶段的实验所需的植物,而4-5周后使用用于真实假测定的植物。
植物诱导
具有四个完全开发的真实叶子的植物,并没有显示出由草食虫或疾病引起的任何损害的迹象,以三种不同的方式之一处理:(i)植物被留下未经处理的(对照),(II)植物诱导4.8 μmol of jasmonic acid (Sigma-Aldrich; MO, USA), or (iii) plants were induced by releasing three pre-weighted 2nd instarS. Littoralis.幼虫在第二个或第三个真叶(从植物底部计数)。使用organdy布袋含有幼虫在叶子上含有幼虫。将茉莉酸施用于1ml乙醇:水溶液(20μl乙醇:980μl水)中。将溶液直接施加到植物的茎上,从而允许通过地下组织和低于下组织吸收茉莉酸。Hagenbucher等。[27.]和艾森辛格等人。[28.[茉莉酸的应用诱导棉花萜类防御。1周后,植物用于不同的实验。损坏和表现S. Littoralis.通过称重存活的幼虫并通过扫描叶片测量饲养损坏并使用软件图像J 1.48(NIH,USA; [29.])。
用子叶的性能测定
进行该饲料实验以评估性能S. Littoralis.不同棉系子叶上的幼虫。植物按上述方式生长,但仍保留在气候室中。这些植株在播种10天后使用。所有植株未处理(未诱导)。从这些子叶中,取1厘米的叶圆盘,转移到128孔塑料生物测定托盘的孔中,该托盘用16个细胞托盘盖密封(Bio-Serv;美国新泽西弗兰明)。剩余叶材料在−80°C保存,用于萜类定量。每个孔的底部用1%琼脂凝胶覆盖,以保持叶盘湿润。使用琼脂是因为它完全结合水,因此可以防止小液滴的形成,这对极度敏感的新生儿是危险的。每个椎间盘上有一个新生儿S. Littoralis.被安置。4天后,将幼虫转移到3厘米直径的培养皿中,含有来自同一植物的第二个胞段的新的3cm叶片。培养皿的底部被膏药覆盖(Quickmix; Quickmix-Gruppe,Osnabrück,德国)提供水分。膏药用于较旧的幼虫,因为它具有不能消耗的优点,并且与琼脂相比不能提供能量。共7天后,终止测定。使用Image J 1.48的4天和7天后记录以下数据:幼虫存活,重量,幼虫阶段和消耗的叶面积。每个棉线测试总共30-32个幼虫。
性能测定与真实叶子
进行该馈电实验以评估是否表现S. Littoralis.受转型或归纳的影响。因此,收集来自所有三条线的植物的最小植物和所有三种诱导处理的叶片以用于进料测定。
从这些叶片中,取出1cm叶片,并转移到128孔塑料生物测定托盘的孔中,其用16个细胞托架(Bio-Serv)密封。剩余叶材料在−80°C保存,用于萜类定量。如上所述,用1%琼脂 - 凝胶覆盖每个孔的底部以防止叶片湿润。在每个叶片上,一个单一的新生儿S. Littoralis.被安置。4天后,将幼虫转移到3厘米直径的培养皿中,含有来自同一植物的新的3厘米叶片,从当时从实际最小的完全发育的叶片中检索。培养皿的底部被膏药(Quickmix)覆盖,以提供水分。在额外的一天之后,终止实验。在4天和7天后记录以下数据:幼虫存活,重量和消耗的叶面积。该实验中使用的每种植物用于喂养四种不同的幼虫。每种植物类型和治疗,以这种方式测试了总共20种植物。汇集了幼虫的数据,从一株植物饲喂叶片以避免伪复制,导致20个复制(每次治疗总测试80个幼虫)。为在实验期间死亡的幼虫记录的数据不包括在核对参数的分析中。
三种植物系未处理植株上的一组幼虫,使其发育完成至蛹期。从每一株植物中随机选取1只前7天存活的幼虫,用同一株植物的叶圆盘喂食,直到化蛹或死亡。记录成虫存活、发育时间、性比、化蛹后14 d体重和化蛹后3 d体重。这部分实验没有用诱导植物进行,因为晚龄期的食物消耗高S. Littoralis.在实验的整个持续时间内,难以将幼虫提供一致的质量(诱导程度)。
偏好测定
进行该实验以建立转化和萜类化诱导影响饲料偏好S. Littoralis.在选择的条件下。在试验开始时,采收每株幼嫩发育完全的叶片,切取直径为2厘米的叶盘。来自两种不同植物的叶盘被放置在一个直径9厘米的培养皿和一个单独的3龄幼虫的相对两侧S. Littoralis.幼虫在中间释放。然后将培养皿移动到气候柜(25°C,70%RH和16:8日:夜光循环)。24小时后,通过扫描盘并使用图像J 1.48测量消耗的叶面积来定量消耗的叶片表面。从该数据集中,计算偏好指数:(叶面积消耗植物A - 叶面积消耗植物B)/消耗总叶面积。来自一种植物对的圆盘用于测试三种不同的幼虫,总共有20种植物对进行测试。将三个圆盘切割后留下的叶片储存在-80℃并用于Terpenoid定量。为避免伪复制,合并幼虫与来自同一植物的叶片测试的数据,导致20个复制(每次治疗总共测试60次幼虫)。
Terpenoid量化
通过HPLC系统分析了在不同实验中收集的植物材料(1090系列219 II,Hewlett-Packard,USA;专栏:Varian Polaris酰胺C-18柱,150×2.0mm,3μm,配备了预先突出的C18,4×3.0 mm,Supelco保安系统)。HPLC分析遵循Hagenbucher等人描述的方法。[27.],其能够定量棉酚,血液溶质,环偶H1 + H4和环偶氮H2 + H3。
统计数据
使用植物类型的GLM作为独立变量和依赖变量存活率(由于过分分解),重量(γ分布)和消耗的叶面积(γ分布)来分析子叶测定。随后使用Tukey的HSD测试分离方式。
使用具有植物类型,感应处理的GLM和作为独立变量的相互作用进行分析具有真实叶片的性能测定。依赖性变量是生存率(Quasipoisson,由于过度分散),重量(伽马分布)和消耗的叶面积(伽马分布)。随后使用Tukey的HSD测试分离方式。使用GLM分析在整个开发时间内喂养的幼虫数据。因此,我们使用植物类型作为独立变量,同时蛹重量(伽马分布),开发时间(泊松分布),14天(伽玛分布)和性别比(二项式分布)作为从属变量。
分析偏好(表示为消耗叶面积)S.幼虫对于选择实验中的两种叶片之一,进行单面Wilcoxon签名级别测试。随后使用双面WILCOXON签名级别测试进行不同选择测试之间的偏好指数。
使用具有植物型,诱导处理的GLM和作为独立变量的相互作用,分析成熟棉花叶片的三萜含量。依赖性变量是偶曲润浓度(正态分布),血细胞样蛋白浓度(正态分布)和环偶1 + 4浓度(正态分布)。对于深度分析,用GLM(假设正常分布)对三种治疗中的每种治疗(未处理,)分析萜类化合物的浓度(未处理,S. Littoralis.经茉莉酸处理)。这些分析是对三种萜类分别进行的。随后使用Tukey的HSD测试分离方式。
使用R3.1.0统计软件进行分析所有数据(https://www.r-project.org/).
可用性数据和材料
作者确认发现结果的所有数据都是完全可用的,无需限制。所有相关数据都可以在图表数据存储库上使用(http://dx.doi.org/10.6084/m9.figshare.8329760.).
缩写
- HPLC:
-
高效液相色谱
- RNAi 1:
-
ULGCS棉线66-49B
- RNAi 2:
-
ULGCS棉花线66-274
- RNAi:
-
RNA干扰
- ULGCS:
-
超低高型棉籽
参考
- 1。
TRAPORO C,WILSON IW,INTER WN,WILSON LJ。使用宿主植物阻力增强通用棉花系统的综合虫害管理。前植物SCI。2016; 7:500。
- 2。
Cai Y,谢y,李J.Liangless种子和棉花的腺体植物研究。回顾。Agron Center Dev。2010; 30:181-90。
- 3.
Watkins SE,Waldroup PW。高蛋白棉籽粕在肉鸡饮食中的利用。J Appl Poult Res。1995年; 4:310-31。
- 4.
Bertrand JA,Sudduth TQ,Condon A,Jenkins TC,Calhoun MC。整个棉籽的营养含量。j乳制品sci。2005; 88:1470-7。
- 5。
Risco Ca,Chase CC Jr. Gossypol。在:d'mello jpf,编辑器。植物和真菌毒物手册。Boca Raton,FL:CRC压力;1997. p。87-98。
- 6。
王志强,王志强,王志强,等。棉花对节肢动物的抗性机制及其与天敌的相互作用。《植物科学》2013;32:458-82。
- 7。
Jenkins Jn,Maxwell FG,Lafever HN。昆虫对腺体和无柔性棉的比较偏好。j econ entomol。1966年; 59:352-6。
- 8。
Sunilkumar G, Connell JP, Smith CW, Reddy AS, Rathore KS。棉花α -球蛋白启动子在转基因棉花、拟南芥和烟草中的分离及功能研究。转基因研究》2002;11:347-59。
- 9。
Sunilkumar G,Leanne M,Campbell L,Puckhaber LS,Stipanovic Rd,Rathore Ks。通过组织特异性减少有毒棉毒蛋白的人工营养用工程棉籽。Proc Natl Acad Sci U S A. 2006; 103:18054-9。
- 10。
USDA-APHIS。德克萨斯州A&MAGRILIFE研究;在棉籽中的超低型棉酚水平遗传设计的棉花的非降级状态的确定。Docket No. APHIS-2017-0097。2018年。https://www.govinfo.gov/content/pkg/fr-2018-10-17/pdf/2018-22545.pdf.。2019年5月28日访问。
- 11.
Rathore Ks,Sundaram S,Sunilkumar G,Campbell LM,Puckhaber L,Marcel S,Palle SR,Stipanovic Rd,Wedegaertner Tc。超低高型棉籽:种子特异性,RNAi介导的表型的代理稳定性和种子萌发后萜类化型的恢复。植物生物科技J. 2012; 10:174-83。
- 12.
Pogue G.世界修订的属性Spodoptera.。mem am entomol soc。2002; 43:1-202。
- 13。
Palle SR,Campbell LM,Pandeya D,Puckhaber L,Tollack LK,Marcel S,Sundaram S,Stipanovic Rd,Wedegaertner Tc,Hinze L,Rathore Ks。RNAi介导的超低型棉糖棉籽特征:在现场条件下转基因素的性能。植物生物科技J. 2013; 11:296-304。
- 14。
Altmann DW,Stipanovic Rd,Bell Aa。A,D和AD基因组棉花的叶面颜料腺体中的萜烯曲线:抗害虫抵抗力的旋气潜力。j hered。1990; 81:447-54。
- 15.
艾森辛格M,Glauser G,Meissle M,Romeis J.食草动物的差异影响来自三个饲养公会对全身次生代谢物诱导,植物激素水平和植物介导的食草中相互作用。J Chem Ecol。2018; 44:1178-89。
- 16。
Matthews Ga,Tunstall JP。棉花害虫。瓦莱德福:CAB INTERINATIONS;1994年。
- 17。
艾伦kc,lutrell rg,sappington tw,hesler ls,papiernik sk。棉花选定早期昆虫害虫的频率和丰富。j积分害虫管理。2018; 9:20。
- 18。
北jh,gore j,catchot al,Stewart Sd,Lorenz Gm,莫纳FR,厨师博士,肯尼斯DL,DoDDS DM。南中南棉中新烟碱杀虫剂种子治疗的价值(gossypium hirsutum[Malvales:Malvaceae])生产系统。j econ entomol。2018; 111:10-5。
- 19。
Schoonhoven LM,Van Loon Jja,Dicke M.昆虫植物生物学。第二次。牛津:牛津大学出版社;2005年。
- 20.
施特劳斯SY,Agrawal AA。植物耐受草药的生态与演变。趋势ECOL EVOL。1999年; 14:179-85。
- 21.
Neilson EH,Gooder JQ,Woodrow IE,MøllerBL。植物化学防守:以什么成本?趋势植物SCI。2013; 18:250-8。
- 22。
Heil M.诱导抗性的生态成本。CurrOp植物BIOL。2002; 5:345-50。
- 23。
Bottger GT, Sheehan ET, Lukefahr MJ。棉花棉酚含量与抗虫性的关系。昆虫学报1964;57:283-5。
- 24。
Zebelo S, Disi J, Balusu R, Reeves B, Fadamiro H。Spodoptera exigua.在棉花中调节Gossypol生物合成gossypium hirsutum。J工厂互动。2017; 12:121-7。
- 25。
USDA-APHIS。申请确定超低型棉花种子TAM66274的非调节状态。德克萨斯州A&M Agrilife Research,IPGB-2017-001。2017年。https://www.aphis.usda.gov/brs/aphisdocs/17_29201p.pdf。2019年5月28日访问。
- 26。
Hagenbucher S,Birgersson G,Chattington S,Anderson P. Domestication影响了一般主义食草动物的选择行为和性能。延期植物ECOL EVOL SYTS。2016; 23:63-72。
- 27。
Hagenbucher S,WäckersFL,Wettstein Fe,Olson DM,Ruomeis JR,Romeis J.技术的害虫折磨:BT棉花益处毛皮损伤的伤害降低。Proc R SoC B. 2013; 280:20130042。
- 28。
艾森辛格M,Meissle M,Hagenbucher S,Wettstein F,Naranjo Se,Romeis J.棉花防御诱导模式在空间,时间和定量不同的草药水平。前植物SCI。2017; 8:234。
- 29。
施耐德CA,Rasband Ws,Eliceiri Kw。nih图像到imagej:25年的图像分析。NAT方法。2012; 9:671-5。
致谢
我们感谢Syngenta(瑞士Steina)提供鸡蛋批次S. Littoralis。
资金
该研究得到了瑞士国家科学基金会(SNF授予号码31003A-149794)的支持。资助者在研究设计,数据收集和分析中没有作用,决定发布或准备稿件。
作者信息
从属关系
贡献
JR和MM构想了该项目。SH,ME,MM,KSR和JR设计了实验。SH和我进行了实验。SH分析了数据并写了稿件。所有作者都致力于写作并批准了稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
SH,MM,MM,JR宣布他们没有竞争利益。KR是美国专利7999148,8987554,10273495与ULGCS技术和美国专利申请号有关。16030593(发布编号20190008113 A1)与TAM66274相关。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
额外的文件1:
图S1。消耗的叶面积的相互作用图S. Littoralis.4天后的幼虫。图S2。消耗的叶面积的相互作用图S. Littoralis.7天后的幼虫。图S3。重量的相互作用曲线S. Littoralis.4天后的幼虫。图S4。重量的相互作用曲线S. Littoralis.7天后的幼虫。(DocX 3984 KB)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Hagenbucher,S.,艾森辛格,M.,Meissle,M。等等。rnai介导的超低高型棉花棉花本构和诱导抗虫性。BMC植物BIOL.19,322(2019)。https://doi.org/10.1186/s12870-019-1921-9.
收到了:
公认:
发表:
关键词
- ULGCS
- 无柔性棉
- gossypium hirsutum
- Gossypol.
- Spodoptera littoralis.
- 转基因作物
- TAM66274