摘要
背景
茎叶枯病(SB),由酸铵骨肉组,是扁豆生产的毁灭性疾病。虽然众所周知的是镜头ervoides具有比栽培的扁豆种类更高的频率,具有优异的SB抗性,几乎没有关于调节SB抗性的分子基础L. ervoides..因此,对SB的抗性进行全面的分子研究L. ervoides.需要利用基因库的这种野生资源,以供植物育种者在抗性育种中使用。
结果
真菌生长的显微和qPCR定量显示,接种后48、96和144 h (hpi)是疾病发展的有趣时间点L. ervoides.重组自交系LR-66-637(抗SB)和LR-66-577(感SB)。在0、48、96和144 hpi的转录组测序结果显示,有8810个基因是经刺激后的疾病应答基因S. Botryosum..其中7526个基因在两个ril中表现出相似的表达趋势,其中一些可能参与了非宿主抗性。其余1284个基因为ril间差异表达基因(DEGs)。其中,LR-66-637中上调的712个DEGs主要富集在“碳水化合物代谢过程”、“细胞壁组织或生物发生”和“多糖代谢过程”。相比之下,在LR-66-577中有另外572个DEGs上调,其中一些在“氧化还原过程”、“天冬酰胺代谢过程”和“天冬酰胺生物合成过程”中富集。将DEGs与抗病qtl中鉴定的基因进行比较,发现共有9个基因,其中3个基因在由5个ril组成的抗病和感病群体中存在差异表达。结果表明,编码钙转运atp酶和谷氨酸受体3.2的2个基因为候选抗性基因,1个功能未知的基因为候选易感基因。
结论
本研究为抵抗和易感性的机制提供了新的洞察L. ervoides.瑞来斯回应S. Botryosum.感染。此外,我们还鉴定了一些候选的抗性或易感基因,如果它们在抗性或易感中的作用得到证实,将对抗病育种具有重要的价值。
背景
栽培的扁豆(镜片玉米粉Medikus SSP。culinaris)是2016年全球产量为630万吨的最大农艺上最重要的粮食豆类之一,主要由加拿大(50.8%),印度(16.8%),土耳其(5.8%)和美国(4.0%)贡献[1].非生物和生物胁迫降低了扁豆的产量潜力,因此育种努力集中在抗性对这些应力的抗性的发展。主要的育种策略一直依赖于精英育种线或品种之间的交叉的优越个体。由于某些兴趣特征和密切相关的育种线的杂交驱动的密集选择,扁豆种质的遗传变异不可避免地是狭窄的[2].作物中的有限遗传变异性是对生物和非生物胁迫的作物脆弱性的提高风险,植物育种者和种植者之间的主要问题是相似的主要问题[3.].脱果枯萎病(SB),由虚无养殖的Ascomycete引起酸铵骨肉组Wallr。,is a devastating disease of lentil in several lentil-producing countries, including Canada, India, the USA, and Australia which together account for over 70% of global production [4,5].该病原体通过空气传播的分生孢子感染植物,在植物上形成连续的分生孢子循环。在SB的早期阶段,疾病症状表现为扁豆叶片上的褐色到浅棕色斑点。随着感染的进展,这些最初的斑点扩展到整个叶子,导致叶子完全干燥,然后落叶。在最后阶段,SB症状也会出现在茎干上,阻碍营养和水的运输,最终杀死宿主。这种病原体造成的经济损失可高达80% [6].一些扁平的扁豆产地,特别是在孟加拉国(审查)的一些扁平物品区域开发了几种SB的商业品种([7])。
对一系列作物品种的研究表明,许多等位基因代表广泛的遗传多样性和表型变异存在于野生种质中[8].来自外来文库的新型疾病抵抗等位基因是许多农作物遗传改善的有用策略[3.,9].在扁豆,Podder等。[77 70丁醇的含量评估了在属中七种物种的70个扁豆载体中的抗病镜片并发现了L. ervoides.(Brign)。Grande比其他物种表现出更高频率的抗锑性。通过先进的胚珠拯救技术,克服了种间生殖障碍L. ervoides.和L. Culinaris.[10.],兴趣迟扰有用的基因L. ervoides.精英品种一直在强烈增加,特别是因为对其他疾病如ascochyta枯萎的疾病(由ascochyta lentis.瓦西里耶夫斯基)和炭疽病(由Collettrichum Lentis.该物种也已经确定了该物种[11.].
到目前为止,对SB耐药分子基础的详细了解L. ervoides.目前尚缺乏相关信息,唯一可用的信息是在一个基于单核苷酸多态性(SNP)的F9重组自交系(RIL)人口L. ervoides.[11.].这些QTL区间(2-LOD)相对较大(6 ~ 21 MB),包含数百个基因,因此在分子标记辅助选择中直接使用有限,对候选抗性基因的鉴定也较为困难[11.].
对SB抗性的功能理解已经在模式植物如番茄(番茄l .)和拟南芥蒂利亚纳(l)Heynh。在番茄中,Yang等人[12.]在赋予SB的260kb染色体区域中映射了单个占优势轨迹(由美国黄瓜(Enjoji) W. Yamam.),并鉴定了两个推测的耐药基因,编码一个富半胱氨酸受体样激酶(CRK)和一个受体样激酶(RLK)。这说明番茄的抗性可能是通过植物与病原菌的识别介导的。在A. Thaliana.,di等人。[13.]报道了一种编码聚半乳糖醛酸酶抑制蛋白(PGIP)的基因S. Solani.感染期。由于PGIP属于大型富含亮氨酸的重复(LRR)蛋白,怀疑过敏反应(HR)可能会影响SB抗性A. Thaliana.[13.].然而,由于对坏死营养病原体的抗性具有高度复杂性,这些机制是否可以推广到其他植物物种尚不清楚。因此,对SB的抗性进行全面的分子研究L. ervoides.不仅会使扁豆育种效果益处,而且还扩大了模型植物系统以外的系统中的SB抵抗知识。
近年来,随着下一代高通量测序技术的发展,RNA的研究得到了显著的改善。下一代测序技术产生了大量的数据,适用于跨治疗、时间点和基因型的全基因组基因表达的深度量化[14.].在小扁豆,几个RNA测序(RNA-Seq的)进行研究以轮廓转录,开发分子标记或研究各种生物和非生物胁迫植物反应[15.,16.,17.,18.,19.].这些研究大部分是在没有参考基因组的帮助下通过从头组装进行的。从头组装的常见问题有对齐错误、全长转录本重建问题和嵌合错误[20.].作为L. Culinaris.基因组最近被Bett等人构成。[21.[基于参考的转录组件,并鼓励提高下游分析。
随着RNA转录是一种高动态的过程,适当的取样时间对于捕获感兴趣的基因具有高度重视,并且实现这一点,通过微观观察和定量聚合酶链反应(QPCR)实施的真菌发育的定量评估是有前途的选择。有几项研究证明,这两种方法良好地整合了一系列主持人的真菌生物量和发育的视觉和数字评估[22.,23.,24.].在这项研究中,我们招募了那些方法和rils9L. ervoides.RIL人口LR-66 [11.]研究SB阻力L. ervoides..首先,我们进行了显微镜和qPCR研究,以定量的发展S. Botryosum.在接种后的头10天内。其次,我们对两种SB感染的RILs进行了时间序列RNA-Seq实验,它们表现出了不同的SB敏感性。基因表达数据被提交到差异表达基因分析(DEG),以了解SB防御反应的调控途径。为了进一步筛选控制SB抗性和易感的候选基因,我们利用来自LR-66群体的敏感和抗性ril进行了批量分离基因表达分析,以验证这些位于已鉴定qtl中的deg的表达[11.].本研究的目的是扩展我们对SB抗性的了解,并鉴定可能的抗性基因,以便于利用L. ervoides.在商业扁豆育种中。
结果
真菌发育的量化
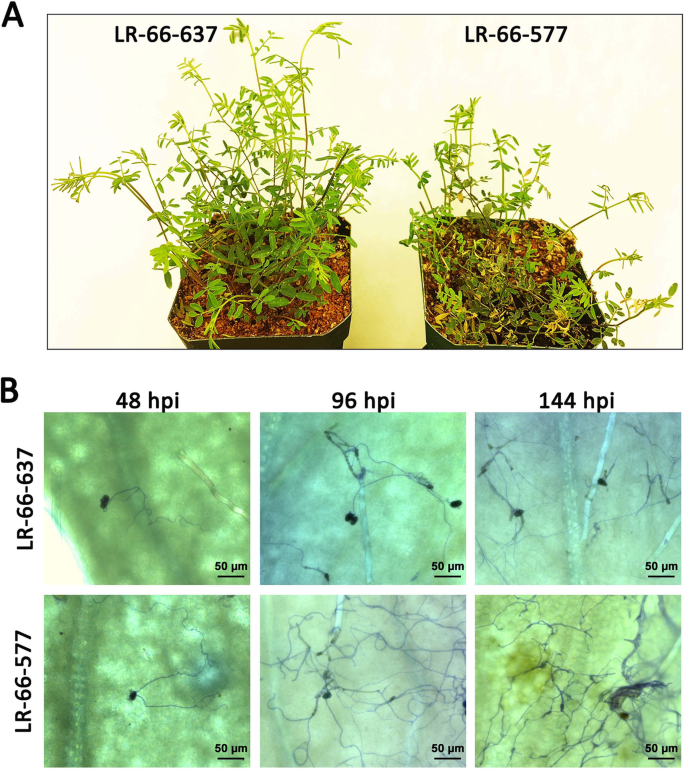
我们的接种实验S. Botryosum.分离SB19导致明显更多的疾病L. ervoides.RIL LR-66-577高于LR-66-637(图1)1).记录接种后48 h的分生孢子萌发率、渗透率和芽管长度(图。2一种)。结果表明,48 HPI,分类萌发随着时间的推移而增加,其最高水平(LR-66-637,LR-66-677的98.5%)。近似50%的分泌物发芽,生物管在6 HPI(两个rils)中成功渗透到植物表皮细胞中,其增加到69.6%(LR-66-637)或67.2%(LR-66-577)12 HPI。叶片表面上的生细管长度从12-24hpi定量,并揭示了12hpi的大约200μm(两个rils)增加到395μm(LR-66-637)或486μm(LR-66-577)的大致增加在24 HPI。然而,对于这些真菌生长参数,抗性RIL LR-66-637和易感RIL-66-577之间没有统计差异。在48 HPI,我们开始观察小传单上的杂种斑点。由于受感染的植物显示出72 HPI的叶坏死证据,我们决定以24-H间隔从72至144 HPI记录坏死叶组织的百分比。结果表明,在此期间,敏感的RIL-66-577敏感的RIL LR-66-577敏感的RIL-66-577比抗性叶片组织百分比显着更高。
为了证实这一趋势,我们使用qPCR来评估相对真菌生物量(图。2b)。结果表明,在48 HPI之前,真菌生长缓慢,但在48 HPI后加速。在48 HPI之前没有看到统计差异,这与我们的组织病理学观察同意,但在易感LR-66-577中显着更高的真菌生物量,直至240 HPI的观察结束。有趣的是,在耐药和易感rils中,相对真菌生物量减少,表明扁豆植物的膨胀和生长超过真菌生长,作为通过SB19的新一代空气传播的SB19的空气传播的次级感染循环基本上被固定到期在袋中缺乏封闭单个罐的袋中的空气潮,以保持高空气湿度。基于这些观察结果,我们决定在48,96和144 HPI下收集样品进行进一步分析。
不同时间点的RILS样品中变异性分析
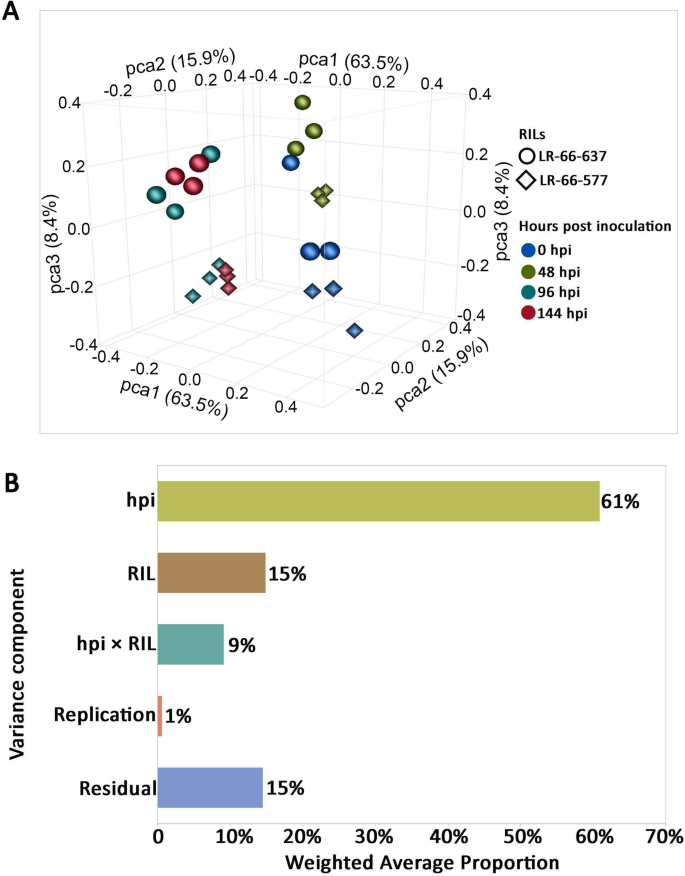
为了评估不同时间点的RIL样本的基因表达的可变性,我们进行了主成分分析(PCA)以减少数据维度以易于可视化。这表明样品的三种复制在排除在0 HPI的LR-66-637的一个重复之后聚集在一起,该HPI偏离其他重复。该样品被认为是一个异常值,因此从随后的分析中丢弃。在去除这个异常之后,PCA绘图清楚地分离出0和48 HPI的相同RIL的样品,但不在96和144 HPI中定位在一起(图。3.a). PCA也从LR-66-577样本中分离出LR-66-637,特别是96和144 hpi。
为了进一步将方差比例归因于已知的方差来源,我们对这些样本进行了主方差成分分析(PVCA)。结果表明,hpi、RILs和RILs × hpi的互作共同占总方差的85%(图2)。3.b).在这些效应中,hpi贡献的方差比例最大(61%),其次是RILs(15%)和RILs × hpi的互作(9%)。方差的很小一部分(1%)被划分为重复项,这是预期的。其余14%的方差比例不能用模型的影响来解释,归因于残差。
常见疾病应答基因分析
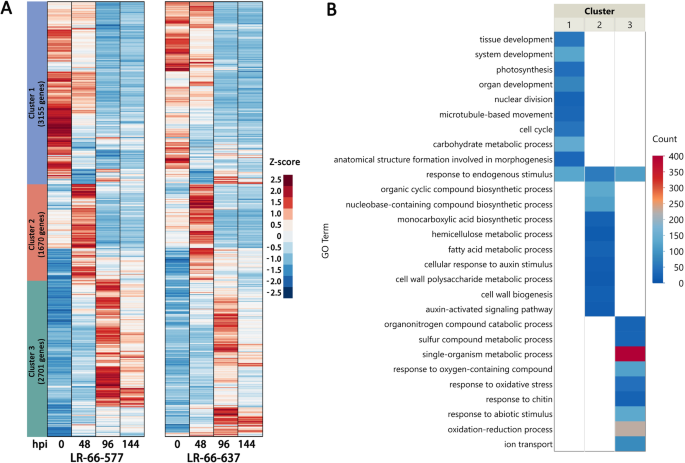
在0 HPI的LR-66-637和LR-66-577之间的可变转录组谱表明,RIL之间的差异表达基因也与除疾病防御反应之外的植物特征相关。因此,为了限制差异基因表达(DGE)分析对可能参与疾病防御反应的那些基因,我们首先将48,96和144 HPI的基因表达与0 HPI相比,这导致共有8810个基因在48至144 HPI之间的SB19感染过程中显示差异基因表达(折叠变化> 2或FDR <0.05)。表达式Heatmap显示LR-66-637和LR-66-577在其表达式模式中表现出一些类似的特征(附加文件1:图S1)。这些数据表明,在与SB19的初始攻击之后,大部分疾病响应基因以抗性和敏感的rils在抗性和敏感的rils中重编程。为了鉴定这些基因,我们在48,96和144 HPI之间进行了DGE分析,发现绝大多数8810个疾病响应基因(7526个基因)没有差异表达(折叠变化<2或FDR> 0.05)rils之间。这些基因可参与植物的非宿主抗性,这是一种非特异性和广谱防御机制,其普遍存在植物中作为对微生物的防御[25.].
这些7526个基因的数据提交给K-均值聚类(图4a)和基因本体(GO)映射分析(图。4b).结果,获得了三个不同的基因簇。聚类1包含3155个基因,主要在96和144 hpi下调。GO定位分析显示,该聚类基因主要富集发育相关的GO术语,如“组织发育”、“系统发育”、“器官发育”、“核分裂”、“参与形态发生的解剖结构形成”等。和能量合成相关的氧化石墨烯术语,如“光合作用”和“碳水化合物代谢过程”(图。4b,附加文件2:表S1和附加文件3.:表S2)。
聚类2和3分别含有1670和2701个基因。聚类2的基因表达峰值为48 hpi,而聚类3的基因表达峰值分别为96和144 hpi。聚类2中最丰富的GO术语是与细胞壁相关的过程,如“半纤维素代谢过程”、“细胞壁多糖代谢过程”、“脂肪酸代谢过程”和“细胞壁生物发生”,表明两种ril在感染早期都经历了显著的细胞壁修饰。与“氧化应激反应”、“含氧化合物反应”和“氧化还原过程”相关的第3类疾病应答基因表明,在SB19感染晚期过程中,两个ril中活性氧(ROS)均被促进。
基因间差异表达的分析
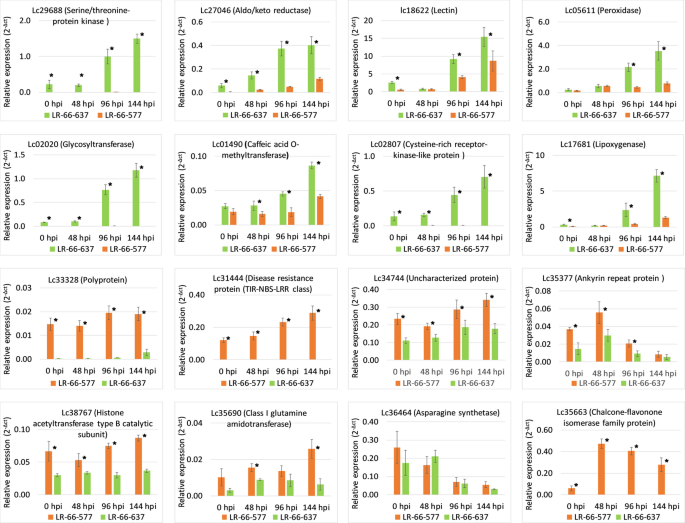
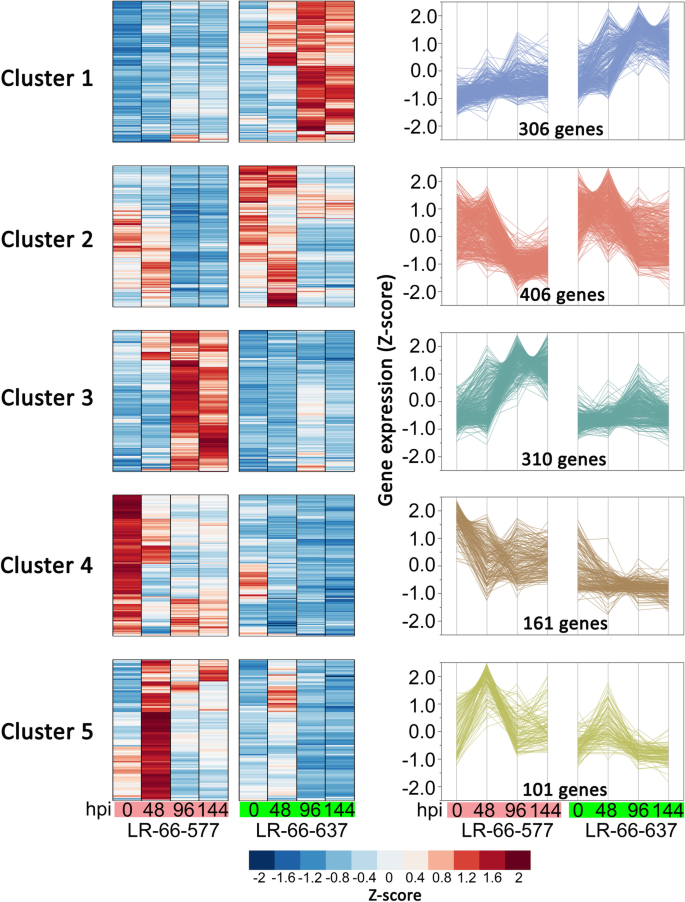
在8810个疾病响应基因中,1284个基因在48,96和144 HPI的LR-66-637和LR-66-577之间差异表达(折叠变化> 2,FDR <0.05)(附加档案4:表S3)。我们在LR-66-637中任意选择的八个上调,并在LR-66-577中上调了另外八次,用于在独立的SB19接种实验中验证QPCR验证(图。5).除1例(94%)外,其余均表现出与RNA-Seq实验一致的表达趋势,表明DEGs的表达在独立实验中是可重复的。
为了更好地显示基因,将1284个DEGs分层聚类成5个表达簇(图1)。6).第1群(306个基因)和第2群(406个基因)的基因在耐药RIL LR-66-637中表达上调,而第3群(310个基因)、第4群(161个基因)和第5群(101个基因)的基因在易感RIL LR-66-577中表达上调。根据它们的表达模式,推测1、2类群中的712个基因与抗性增强相关S. Botryosum.在LR-66-637中,第3、4和5群中的572个基因与LR-66-577中的病原菌易感性有关。
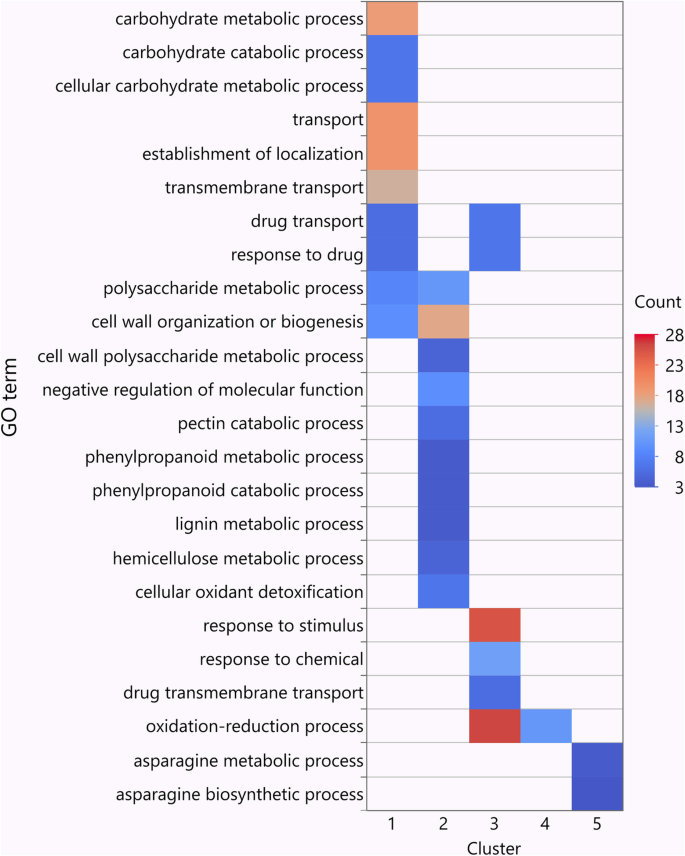
为了了解他们的生物学相关性,我们对每个集群中的那些参数进行了富集分析(图。7,附加文件5:表S4和附加文件6:表S5)。聚类1中的基因主要富集在参与多种初级代谢和运输过程的基因中,包括“碳水化合物代谢过程”、“细胞碳水化合物代谢过程”、“多糖代谢过程”、“运输”、“定位建立”和“跨膜运输”。聚类2中,大量基因富集于“细胞壁组织或生物发生”、“细胞壁多糖代谢过程”、“果胶分解代谢过程”和“半纤维素代谢过程”等细胞壁相关过程中。在第3组中,与“氧化还原过程”、“对刺激的反应”和“对化学物质的反应”等免疫反应相关的基因中,大多数基因都被富集。对于簇4和簇5中的其余262个基因,HR相关的氧化石墨烯功能为“氧化还原过程”,以及两个pcd相关的氧化石墨烯术语为“天冬酰胺代谢过程”和“天冬酰胺生物合成过程”,表明在SB19感染早期,LR-66-577的HR活性较高[26.].
使用QTL和散装偏析基因表达分析的候选抗性基因的筛选
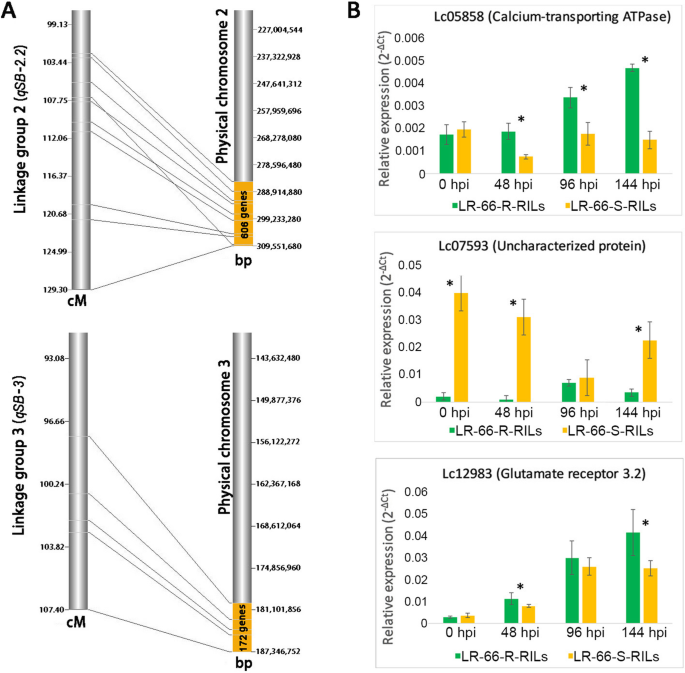
此前,在RIL群体LR-66的snp连锁图谱中发现了三个与SB19抗性相关的显著QTL区间[11.].为了缩小基于RNA-SEQ的抗性或易感性基因候选候选者,将1284℃与QTL置信区间(2-LOD)进行比较,导致鉴定在LR中的九个基因或下调-66-637在48,96和144 HPI。在这九个基因中,六个基因在QTL中定位qsb - 2.23个QTLQSB-3时间间隔。通过对5个最抗硒基因和5个最敏感基因库的表达分析,发现2个基因(Lc05858:钙转运atp酶;Lc07593:无特征蛋白)qsb - 2.2和一个基因(Lc12983:谷氨酸receptor3.2)在QSB-3以与RNA-SEQ分析的抗性RIL LR-66-637和易感LR-66-577类似的方式表达(图。8和额外的文件7:表S6)。定量PCR另外两个这些基因的(Lc09908和Lc07065)是非决定性的,和四种基因(Lc06015,Lc10098,Lc11261和Lc13725)中显示的两个池之间相似的表达,这表明它们更容易与其他不同的特定关联到LR-66-637和LR-66-577。
对于Lc07593,我们观察到该基因在sb19敏感的ril中比抗性ril高表达,表明Lc07593可能是一个易感基因,上调该基因可能会增加SB的易感性。另一方面,Lc05858和Lc12983可能是抗病基因,表现出与Lc07593反向表达的趋势。
讨论
彻底了解病原体如何与宿主相互作用,对于确定感染过程中转录组分析的适当时间至关重要。在本研究中,抗性RIL LR-66-637与敏感RIL LR-66-577在24 hpi前SB19的发育差异可以忽略不计,说明RIL LR-66-637对SB19的抗性可能是基于真菌的穿透后抑制作用。类似的观察结果也被报道S. Botryosum.在考林及吉尔克里斯特地区感染紫花苜蓿[27.发现…的发展S. Botryosum.在感染的早期,抗抗性,中度抗性和敏感的苜蓿克隆没有差异。在48至144 hpi期间,真菌生物量开始积累在rils中,表明这一点S. Botryosum.引发植物毒素的释放以破坏宿主细胞约48 HPI。LR-66-577中的生物质积累比LR-66-637在LR-66-637中显着高,可能由于LR-66-637中对植物毒素的耐受性增强而不是LR-66-577 [28.].因此,48,96和144 hpi被认为是值得进一步探索基因表达的有趣时间点。
PCA和PVCA是可视化整体基因表达变异性和检测样本中的异常值的有用工具[29.].在此处排除PCA图中的异常后,可以明显地分离在96和144 HPI的其他中收集的48 HPI中的样品显而易见,这明确反映了96和144 HPI的基因重编程是相似的,但与48 HPI不同。PCA还从LR-66-577样品中分离LR-66-637,表明LR-66-637和LR-66-577的转录组响应在SB19攻击后不同。由于这种分离在96或144 HPI中比48 HPI更明显,因此预期HPI×RIL的显着相互作用效果。这些结果证实,RILS的转录om以其他转录组研究中观察到的时间依赖性方式对SB19感染作出反应[30.,31.,32.].
非宿主抗性是一种非特异性的广谱防御机制,普遍存在于植物中,作为对微生物的防御[25.,33.].通过分析两条rils的那些疾病响应基因,我们观察到,两条rils下调的大量基因富集在一系列相关和能量综合相关的GO条款中。这些结果似乎表明,无论其对病原体的抗性水平不同,Sb19感染扰乱了两个rils的正常生长和能量合成。由于对植物中的坏死性的抗性总是处于不完整的形式,营养成分戒断S. Botryosum.通常发生在宿主物种的所有个体中[34.].病原菌侵染导致侵染部位光合作用降低,对能量同化产生负面影响,干扰植物的正常发育和生长[35.].这已在各种患病植物中被广泛报道[36.,37.,38.].另一方面,也存在在接种后上调的基因,在48 HPI或96和144 HPI。由于这些基因大多富含细胞壁相关和氧化还原过程,似乎在SB19感染过程中在某些时间点促进了细胞壁修饰和ROS。病原体和宿主之间的任何类型的相互作用将触发一些细胞壁修改[25.,33.,34.].当通过病原体强调植物,释放可变量的RO以激活下游信号转导途径和一系列防御基因的表达[39.,40,41.].ROS的激活是一种常见的非宿主抗性形式,普遍发生在植物中,无论它们在抗病水平上的差异[42.,43.,44.].
除了这些常见的疾病响应基因外,在LR-66-637和LR-66-577之间,另外1284个疾病响应基因差异表达。这些基因中的一些可能有助于两个rils之间的疾病抵抗程度的差异。根据表达模式和富集这些基因的阶段,我们发现LR-66-637主要上调各种碳水化合物代谢,运输和细胞壁相关过程。扁豆上的其他基因表达数据 -S. Botryosum.但基于RNA-Seq实验,抗性基因型CDC-Robin、964a-46或ILL7537接种后,一系列代谢过程(有机物代谢、单生物代谢或细胞葡聚糖代谢)均有较强的上调ascochyta lentis,另一种扁豆病原体被认为是一种坏死营养物[15.,16.].此外,Yang等人[45.研究了番茄美国黄瓜系统并发现在耐药番茄基因型中激活了几种“定位”,“转运蛋白活动”和“分子传感器活性”的转移条款,提出这些活动的上调与之相关美国黄瓜阻力。碳水化合物和转运体被认为是植物免疫系统的重要组成部分,前者产生能量以维持一系列防御相关代谢物和碳基聚合物的持续生产,后者实现信号转导、能量转运和有毒化合物的挤出[46.,47.,48.].从理论上讲,这些过程的促进符合抗病性疾病的升高[35.,48.,49.].Morkunas等人[50.]发现蔗糖高水平占多种黄酮类化合物的积累,其导致黄羽扇豆,以增强抗性Fusarium oxysporum.同样,据报道,两种植物ATP结合盒式磁带转运仪的上调NPPDR1和PEN3,可以提高疾病抗病性病原体Botrytis cinerea和Plectosphaerella cucumerina在拟南芥分别为(49.,51.].
与LR-66-577相比,LR-66-637对细胞壁的几个相关过程的促进表明其启动了额外的细胞壁修饰。在扁豆-答:慢病毒系统,Khorramdelazad等。[15.还报告了在抗性基因型ILL7537中的Go术语“细胞壁”的显着富集。在病原体的攻击过程中,宿主的细胞壁被通过病原体释放的一系列细胞壁降解酶损坏。如果这种细胞壁降解可以被宿主阻止,则预期耐药表型[52.].在番茄,miedes和lorences [53.]的研究发现,在受到攻击时,适当水平的木葡聚糖(半纤维素的一种形式)对于保持细胞壁的完整性至关重要青霉菌expansum.在拟南芥, Lionetti等人[54.)发现,B. Cinerea通过增加果胶甲基酯化破坏了微生物降解植物细胞壁的能力,增强了抗性。因此,我们假设,在细胞壁过程中基因的上调可能在一定程度上补偿了因感染造成的细胞壁损伤,从而提高了LR-66-637对SB的抗性。
相比之下,LR-66-577似乎以一种完全不同的形式对SB19入侵作出反应,考虑到该RIL中大多数上调的基因对参与“氧化还原过程”的基因富集。这表明,在SB19入侵后,LR-66-577的氧化还原稳态发生了实质性的改变,这在之前的其他系统中也有报道[55.].受损细胞氧化还原状态的变化可以释放多种活性氧,包括单线态氧、超氧自由基和过氧化氢,这些活性氧的积累可以触发植物的超敏感反应和程序性细胞死亡(PCD),导致叶子坏死,最终叶子开裂[56.,57.].由于坏死营养体可以在死亡组织中茁壮成长,一些研究报告称,坏死营养体能够劫持植物的免疫系统,并利用宿主的HR机制来提高它们的毒性[39.,58.,59.].从这些结果来看,我们假设在SB19感染过程中LR-66-577的LR-66-577中促进了HR和PCD在LR-66-637中显着升高,导致LR-66-577中的敏感性。
以往的证据表明,HR和PCD在很大程度上是通过R基因的激活而诱导的[56.,57.,58.,59.].在本研究中,我们观察到在感染过程中,LR-66-577中的一些TIR-NBS-LRR和CC-NBS-LRR基因的上调强于LR-66-637(附加文件5:表S4)。在扁豆-答:慢病毒系统,Sari等[16.]发现一种TIR-NBS-LRR基因在接种后两种易感扁豆基因型中也显著上调答:慢病毒.这些结果证实了R基因、细胞死亡和坏死病原菌感染后易感性之间的关联[39.].但是,有另一套TIR-NBS-LRR,NBS-LRR和NB-ARC基因在LR-66-637具有较高的表达比LR-66-577,如所预期的抗性基因型的。这样的R基因的参与也有报道在扁豆- 晶状体A.系统,和Khorramdelazad等。[15.]推测,在il7537中一个较强的NB-ARC基因上调导致抗性增强。综上所述,这支持了r基因作为真正的抗性基因以及它们作为易感因素可能扮演的角色这一新兴图景[34.].
比较的先前鉴定的QTL电阻LR DEGS-66 [11.],我们确定了九个抗性基因候选者,并通过批量分离分析进一步探索它们。在批量分离分析(BSA)中,两个游泳池的表型极端倾向于在表征表征的基因存在下不同,或者对特性负责的基因的表达水平不同[60.].结合基因表达研究的牛血清白蛋白经常被用于识别多种植物物种中的候选基因(如[61.,62.,63.])。在抗性基因库中发现钙转运atp酶(Lc05858)和受体3.2 (Lc12983)的高表达,表明它们可能是可能的抗性基因。钙转运atp酶,如Lc05858,可以在钙内流和外流调节中发挥重要作用,以维持适当的细胞钙稳态,这一变化被认为启动钙信号,触发一系列影响植物生长的下游反应,生物及非生物压力的发展及反应[64.,65.,66.].朱等。[67.[报道,基因编码钙ATP酶的表达降低了HR假单胞菌inringae-受感染的西红柿,NbCA1(ER-本地化IIB型钙ATP酶)与野生型相比,植物展示了加速编程的细胞死亡(PCD)。同样,Boursiac等人。[68.发现击倒的ACA4和ACA11(两种钙- atp酶)通过使钙信号通路失活而引起更高频率的hr样病变拟南芥接种P. inringae..由此推测,SB19感染过程中Lc05858的上调导致了钙转运的激活和HR、PCD的抑制。与敏感ril相比,抗性ril中谷氨酸受体3.2 Lc12983在48和144 hpi水平的上调也可能影响钙调节,突出了其在扁豆中的潜在重要性S. Botryosum.交互。先前的一项研究表明,谷氨酸受体主要负责谷氨酸依赖的膜去极化和钙转运[69., Kang等[70和Manzoor等人[71.]观察到谷氨酸样受体的上调AtG13.3或AtGlur3.2升高的钙流入并赋予增强抗性拟南芥对抗陆地疗法B. Cinerea.然而,需要进一步的功能研究来证实这些基因在耐药性中的作用。
与抗性rils相比,在SB19易感rils中,在SB19易感rils中高度表达了一种编码的一种基因,表明LC07593可以是易感基因。然而,该基因对数据库中的任何良好表征基因没有同源,因此不能解决其功能。可能需要涉及蛋白质纯化,结构建模和蛋白质 - 蛋白质相互作用分析的未来作品以了解其生物学功能。
方法
植物材料和接种物制备
本研究中使用的RILS LR-66-577(易感SB)和LR-66-637(抗SB)是选中的过分分离L. ervoides.Ril群体LR-66来自于萨斯喀彻温省大学作物开发中心(萨斯冈,SK,加拿大)作物开发中心开发的L01-827A×IG 72815的十字架[11.].在该群体中,明显的海侵分离和疾病严重程度在11 - 80%之间,表明在抗SB中存在流利的遗传变异[11.].在播种前,对种子进行划线,以促进萌发。种子被播种在10厘米的塑料罐中,装满了Fafard®发芽混合剂(Sungro Horticulture®Ltd., Vancouver, BC, Canada)。所有植株均在恒温23℃、光照16 h /暗8 h的生长室内生长。每盆只留四株供后续接种试验。接种物是从侵染物中制备的S. Botryosum.孤立的SB19起源于加拿大萨斯喀彻温省东南部。冷冻保存的SB19孢子在燕麦粥V8琼脂培养基上振兴[150ml V8果汁(Campbell Co.,Canada,Canada),10 G Difco™马铃薯葡萄糖琼脂(Becton Dickinson和Co.,Franklin Lake,NJ,USA),3克碳酸钙,850毫升无菌水。在室温下孵育七天后,通过泛洪和刮板从培养皿中收集分类并刮削。将结合悬浮液过滤通过两层miracloth,并调整为1×105condia毫升- 1使用血细胞计数器。接种前每1000 mL悬浮液中加入两滴Tween 20 (Sigma, Saint Louis, MO, USA)。
病原体接种和实验设计
将4周的老植株喷洒孢子悬浮液,直至脱落,相当于每株约2 - 2.5 mL。一个花盆里的四株植物代表了三种生物复制中的一种,并被汇集起来产生一个生物复制。盆栽采用完全随机设计,在100%湿度的喷雾室中浸泡48 h,以促进分生孢子萌发。48 hpi后,将接种的植株从喷雾室中取出,每个花盆装入半透明塑料袋中,花盆保持在23℃,光周期16 h。分别在0、6、12、24、48、72、96、120、144、196和240 hpi下采样,立即在液氮中冷冻,然后保存在-80°C冰箱中以备以后使用。
真菌发展的测定
显微镜为基础的方法和定量PCR被用来量化SB19的生长植物。用于qPCR,靶向RNA的基因聚合酶II第二最大亚基(RPL-4)以扩增SB19的gDNA中和延伸因子(LcEF1α)量化L. ervoides.(附加文件8:表S7)。SDS方法[72.用于从生物体中提取GDNA,使用分光光度计(Nanodrop TM 8000,Thermo Scientific,Waltham,USA)来量化DNA浓度,将其调节至25ngμl- 1对所有样本。每个qPCR反应包含2 μl DNA模板,5 μl SYBR®Green(目录编号为SYBR®Green)。10 μM正、反引物各0.2 μl,分子级水2.6 μl。使用默认的快速运行程序在QuantStudio™3系统(Applied Biosystems Inc., Foster City, CA, USA)中进行qPCR扩增。根据Weβling和Panstruga提出的标准[24.],相对真菌生物量以RPL-4和LcEF1α之间扩增的gDNA的比例来估计。
用于显微镜定量,每生物学重复6个小叶在每个6,12,24,48,72,96,120,144,196,和240的HPI收集。The collected leaflets were cleared in CMAA fixation solution (60% methanol, 30% chloroform, 10% acetic acid) for at least 24 h at room temperature to eliminate chlorophyll in cells. Once treated, they were immersed in a series of decreasing ethanol concentrations of 70% for 1 h, 50% for 1.5 h and 30% for 1.5 h. Staining was performed by immersing leaflets in 0.05% trypan blue overnight. Well stained leaflets were mounted on glass slides in a droplet of 50% glycerol and evaluated under a Zeiss Axioskop 40 microscope (Carl Zeiss, Göttingen, Germany). High-quality photos were generated using a Pixelink A686C camera (Pixelink, Rochester, NY, USA) and Zeiss Axiovision software (Carl Zeiss, Oberkochen, Germany). To quantify fungal development during the incubation process, we record percentage of conidial germination, percentage of conidia resulting in successful penetration (% conidial penetration), and germ tube length. Furthermore, the percentage area of dead tissue per leaflet was visually estimated (% leaf necrosis). Data were analyzed using SAS 9.3 (SAS Institute, Inc., Cary, NC, USA). Normality of errors was assessed with the Shapiro-Wilk test and homogeneity of variance with the Levene’s tests. The mean separation between RILs were conducted using Student’s t-test method (P<0.05)。
RNA测序和原始数据处理
在0,48,96和144 HPI中收集样品,其中三种生物重复为LR-66-570和LR-66-629,总共24个样品。使用RNEasy植物迷你试剂盒(Cat No.74904,Qiagen Company,Hilden,Germany),从冷冻叶中从冷冻叶中进行总RNA提取。RNA的质量和浓度在Agilent 2100 Bioanalyzer(Agilent Technologies,Santa Clara,CA,USA)中进行评估。只使用Truseq Slanded Total RNA(Illumina,Inc.,CA,USA)使用高质量的RNA样品(RNA完整性数> 7)图书馆施工。然后使用Truseq SBS KIT-HS V4(Illumina)将构建的文库加载到Hiseq 2500系统中,以进行125bp对结束的测序。
返回的原始读取的质量控制在Trimmomatic(版本0.36)中实现了[73.]在以下参数下消除低质量读取和适配器:TRUSEQ3-PE-2.FA:2:30:10,领先:3,尾随:3,滑动窗口:4:15和Minlen:36。清洁的读数与参考基因组对齐镜片玉米粉V1.2 (21.]使用STAR(默认设置,版本2.6.1a) [74.].结果,大约90%的reads与所有样本的参考基因组唯一对齐,确认了高质量的测序和绘图(附加文件9:图S2)。在作图过程中,采用STAR量子模式进行基因计数。在使用JMP Genomics 8.0 (SAS Institute, JMP Genomics®,JMP Genomics®)统计软件进行主成分分析(PCA)和主方差成分分析(PVCA)之前,每个样本的基因表达数据首先使用每百万转录本的每千碱基片段(FPKM)方法归一化。
差异表达基因(DEGs)鉴定
在比较rils之间的基因表达之前,首先对来自0hPI的样品中的基因表达的比较与在48,96和144 HPI中收集的那些,以确定显着反应Sb19感染的那些基因。这些比较在R包DESEQ2中进行了[75.]使用假发现率(FDR)<0.05和基因表达折叠变化> 2的阈值> 2.在鉴定的疾病响应基因中,我们在LR-66-637和LR-66-577样品之间进行了一对比较每个时间点(48,96和144 HPI)。此处应用了先前使用的相同的阈值以宣告显着的参数。将所得的DEG提交给JMP基因组学8.0(JMPGenomics®,SAS学院),用于K-Means聚类分析。每个簇的基因具有已知的Medicago truncatula然后使用PANTHER(版本14.1)将同源基因映射到基因本体论(GO)数据库(http://www.pantherdb.org).
qPCR验证
为了验证RNA-Seq实验中捕获的基因表达的重复性,按照相同的实验条件和设置,分别对LR-66-570和LR-66-629进行单独接种实验。采集染病叶片样品,按上述方法处理,从RNA-Seq数据分析中鉴定出16个deg和1个内参基因(LcEF1α)进行qPCR扩增(附加文件)10.:表S8)。每个PCR反应由2μLDNA模板,5μLSSYBR绿色,0.2μL的每10μm正向和反向引物,和2.6μL分子级水。使用具有默认设置的快速运行程序在QuantStudio™3系统(Applied Biosystems Inc.)中执行QPCR。计算每个感兴趣基因的相对表达是计算为\({2} ^ { - \ left({ct} _ {gene \ of \ of \ lift} - {ct} _ {Reference} \ offer)} \)Livak和Schmittgen推荐[76.].使用学生的T-Test方法进行rils之间的平均分离(P<0.05)。
批量偏析基因表达分析
根据对LR-66群体的表型评估结果[11.选取抗锑性最高的5个品系(LR-66-526、LR-66-543、LR-66-643、LR-66-658和LR-66-712)和最感锑性最高的5个品系(LR-66-594、LR-66-605、LR-66-697、LR-66-706和LR-66-727)分别构建抗性和感锑体。在相同的试验条件和环境条件下,在0、48、96和144 hpi条件下进行接种试验。各RIL的总RNA提取、定量及qPCR均采用上述方法。每个RIL在两个池中分别作为一个生物重复处理,因此每个池由5个生物重复组成。对与之前描述的数量性状位点共定位的差异表达基因Lc09908、Lc07593、Lc05858、Lc06015、Lc10098、Lc7065、Lc12983、Lc11261、Lc13725进行qPCR反应和基因表达估计。池之间的平均分离使用学生t检验方法(P<0.05)。
可用性数据和材料
支持本研究结果的所有数据均包含在本文或其补充信息文件中。本研究中生成的其他数据集可在通信作者(Sabine Banniza)的合理要求下获得。
缩写
- DEG:
-
差异表达基因
- DGE:
-
差异基因表达
- FPKM:
-
每千碱基每百万份转录产物的片段
- 去:
-
基因本体论
- 现病史:
-
小时后接种
- 人力资源:
-
过敏反应
- 主成分分析:
-
主成分分析
- 纤毛运动:
-
程序性细胞死亡
- PVCA:
-
主方差分量分析
- QTL:
-
定量特质基因座
- 瑞来斯:
-
重组自交系
- RNA-SEQ:
-
RNA-sequencing
- ROS:
-
反应性氧气
- 某人:
-
Stemphylium枯萎
参考文献
- 1。
遗传邮件。联合国粮食及农业组织(粮农组织)统计年鉴统计年鉴罗马:联合国渔业和水产养殖部,粮食和农业组织(粮农组织)。2017年。
- 2。
Khazaei H, Caron CT, Fedoruk M, Diapari M, Vandenberg A, Coyne CJ,等。栽培扁豆的遗传多样性(镜片玉米粉及其与世界农业生态区的关系。植物学报。2016;7:1093。
- 3。
Zamir D.改善植物育种与异国情调的遗传文库。NAT Rev Genet。2001; 2(12):983-9。
- 4.
Bayaa B,扁豆氏氏症。在:艾伦D,Lenne J,编辑。食品和牧场豆类的病理学。瓦莱德福德,奥克森,英国:驾驶室陷阱;1998. p。473。
- 5。
温湿期对扁豆茎枯病发育的影响。工厂说。2010;94:1219-24。
- 6。
Bakr Ma,Ahmed F.丁硫烃枯萎病的发展及其化学对照。孟加拉国J工厂帕索尔。1991; 8:39-40。
- 7。
PODDER R,Banniza S,Vandenberg A.筛选野生和培养的扁豆种质,用于抵抗氧基苯铵枯萎病。植物类型康复。2012; 11(01):26-35。
- 8。
坦克斯利SD,纳尔逊JC。先进的回CrossQTL分析:一种同时发现和转移来自未存在的种质的宝贵QTL进入精英育种线的方法。Al Appl Genet。1996; 92(2):191-203。
- 9。
利用杂交技术拓宽栽培扁豆的遗传基础镜片玉米粉“Eston”和L. ervoides.72815年加入搞笑。acta botanica sinica(云南植物学报),2013;53:1037 - 47。
- 10。
王志强,王志强,王志强,等。小扁豆炭疽病抗性的种间转移[j]。作物科学。2009;49:825-30。
- 11.
Bhadauria V,Ramsay L,Bett Ke,Banniza S. QTL Mapping揭示了野生扁豆种类的真菌疾病抗性遗传决定因素镜头ervoides.Sci众议员2017;7(1):3231。
- 12.
杨H,赵特,江j,王某,王a,李杰,等。番茄的映射和筛选Stemphylium黄瓜抗性基因,Sm该研究基于大量分离分析和基因组重测序。BMC Plant Biol. 2017;17:266。
- 13。
狄春霞,张辉,孙志龙,贾海林,杨琳,司建,等。聚半乳糖醛酸酶抑制蛋白的空间分布拟南芥以及由Stemphylium以上感染。基因。2012;506(1):150 - 5。
- 14。
韩义,高S,Muegge K,张W,周B. RNA测序和挑战的先进应用。生物形象BIOL见解。2015; 9(4):29-46。
- 15.
杨杨等。扁豆的转录组分析(镜片玉米粉)的前24小时ascochyta lentis.感染揭示了关键防御反应基因。BMC基因组学。2018; 19(1):108。
- 16。
小扁豆品系的基因型依赖互作研究ascochyta lentis..植物学报2017;8:764。
- 17。
扁豆参考转录组的产生和特征研究(镜片玉米粉Medik)。中华医学杂志。2016;17(11):1887。
- 18。
Singh D,Singh CK,淘金J,Tomar RSS,Chaturvedi Ak,Gaikwad K,等。扁豆的转录体分析(镜片玉米粉Medikus)响应幼苗干旱胁迫。BMC基因组学。2017年; 18:206。
- 19。
verma p,shah n,bhatia s.表达的基因目录和来自的分子标记德诺维扁平序列综合扁豆读数(镜片玉米粉Medik。)转录组。植物Biotechnol J. 2013; 11(7):894-905。
- 20.
温加罗A,佩赫N,马丁J-V,McCairns RJS,MévyJ-P,Chappaz R,等人。挑战与进步在非模式生物转录组组装。Plos一个。2017; 12(9):e0185020。
- 21.
Bett K, Ramsay L, Chan C, Sharpre A, Cook D, Penmetsa R,等。扁豆1.0及以上。美国圣地亚哥:植物和动物基因组第十四届会议;2016.
- 22.
horevaj p,milus ea,bluhm bh。为了量化的实时QPCR测定镰刀菌素graminearum小麦内核的生物量。J appl microbiol。2011; 111(2):396-406。
- 23.
实时荧光定量PCR法测定真菌根内生菌生物量的适用性应用环境微生物学报。2010;76(17):5764-72。
- 24.
利用qPCR和分生孢子计数快速测定植物与白粉病的互作。工厂方法。2012;8(1):35。
- 25.
Lee Ha,Lee Hy,Seo E,Lee J,Kim SB,OH S等人。目前对植物非健康抵抗的谅解。Mol植物微生物相互作用。2017; 30(1):5-15。
- 26.
辣椒天门冬酰胺合成酶1(英文)CAAS1.)所需的植物氮同化和防御反应,微生物病原体。植物杂志2011; 67:749-62。
- 27.
cowling wa。吉尔克里斯特。苜蓿感染病原体毒力与宿主抗性的表达酸铵骨肉组.植物病理学。1982;72:36-42。
- 28.
Barash I,Pupkin G,Netzer D,Kashman Y.一种新型烯醇β-酮醛生产的植物毒素酸铵骨肉组f . sp。Lycopersici.:部分化学和生物学特征。植物杂志。1982;69(1):23-7。
- 29.
C, Rosas U, Banta J, Bhambhra N, puruganan m拟南芥自然中的基因表达。公共科学图书馆麝猫。2012;8 (4):e1002662。
- 30.
高艳,何旭,吴斌,龙强,邵涛,王志,等。时间-过程转录组分析揭示了人参抗性基因的诱导作用Cylindrocarpon Destructans.使用RNA-Seq感染。《公共科学图书馆•综合》。2016;11 (2):e0149408。
- 31。
Amuge T, Berger DK, Katari MS, Myburg AA, Goldman SL, Ferguson ME。木薯时间序列转录组分析(木薯耐乌干达木薯褐条病毒感染的品种。Sci众议员2017;7:9747。
- 32。
Nobori T,Velasquez Ac,Wu J,Kvitko BH,Kremer JM,Wang Y等。植物免疫下细菌病原体的转录综合景观。Proc Natl Acad Sci U S A. 2018; 115(13):E3055-64。
- 33。
李志强,李志强,李志强。宿主抵抗与非宿主抵抗:具有相似武器库的不同战争。植物病理学。2015;105(5):580 - 7。
- 34。
王XL,江妮,刘杰,刘·沃德,王文。效应和宿主免疫在植物 - 病症的真菌相互作用中的作用。毒力。2014; 5(7):722-32。
- 35。
伯杰S,Sinha Ak,Roitsch T.植物生理学符合植物病理学:植物初级代谢和植物病原体相互作用。J Exp Bot。2007; 58:4019-26。
- 36。
De Cremer K, Mathys J, Vos C, Froenicke L, Michelmore RW, cammuue BPA,等。基于rnaseq的转录组分析摘要以被真菌坏死菌感染的Botrytis cinerea.植物细胞环境。2013; 36(11):1992-2007。
- 37。
Rudd JJ, Kanyuka K, Hassani-Pak K, Derbyshire M, Andongabo A, Devonshire J,等。感染周期的转录组和代谢物分析Zymoseptoria tritici在小麦上揭示了与植物免疫的双相相互作用,包括不同的病原体染色体贡献和半生物营养生活方式定义的变化。植物杂志。2015;167(3):1158 - 85。
- 38。
香港W¯¯,陈N,刘T,朱Ĵ,王建,他X等。黄瓜的大规模转录组分析和Botrytis cinerea在感染期间。Plos一个。2015; 10(11):E0142221。
- 39。
哈蒙德·科克克,鲁德·吉尔。植物阻力信令被病症的真菌病原体劫持。植物信号表现。2008; 3(11):993-5。
- 40。
Chowdhury S,Basu A,Kundu S. Biotrophy-Necrotoctrophy开关在病原体中引起抗性和易感芝麻的差异反应,涉及不同阶段的多个信号通路。SCI批准。2017; 7(1):17251。
- 41。
Rossi Fr,Krapp Ar,Bisaro F,Maiale Sj,Pieckenstain FL,Carrillo N.在叶绿体中产生的反应性氧物种有助于烟草叶片感染被病神营养真菌有助于烟草感染Botrytis cinerea.工厂J. 2017; 92(5):761-73。
- 42.
Tanaka K, Hadwiger LA。非寄主抗性:活性氧(ROS)信号在豌豆组织中诱导PR基因和抗病之前引起DNA损伤。植物病理学杂志。2017;98:18-24。
- 43.
福利RC, Kidd BN, Hane JK, Anderson JP, Singh KB。活性氧在坏死营养真菌的感染中起作用,辣椒在小麦。《公共科学图书馆•综合》。2016;11 (3):e0152548。
- 44.
Rojas cm,Senthil-Kumar M,Wang K,Ryu Cm,Kaundal A,Mysore Ks。乙醇酸氧化酶在非健康抗性期间调节反应性氧物质介导的信号转导烟草benthamiana和拟南芥.植物细胞,2012;24(1):336 - 52。
- 45.
杨H,赵T,江j,陈x,张h,刘g等。转录组分析Sm- 介绍过敏反应Stemphylium黄瓜在番茄中。前植物SCI。2017; 8:1257。
- 46.
博尔顿MD。火灾的主要代谢和植物防御燃料。莫尔植物微生物。2009; 22(5):487-97。
- 47.
除了细胞解毒:植物中MDR转运蛋白同源物的过多生理作用。杂志。2014;5:201。
- 48.
等。关键词:烟草;降低番茄茎对坏死营养真菌的敏感性Botrytis cinerea与宿主糖池中果糖含量的特定调节有关。安机器人。2017;119(5):931 - 43。
- 49.
Stukkens Y,Bultreys A,GREC S,Trombik T,Vanham d,Boutry M.NPPDR1,一种抗脂肪药物抵抗型ATP结合盒式磁带转运蛋白烟草plumbaginifolia在植物抗病中起着重要作用。植物杂志。2005;139:341-52。
- 50。
关键词:蔗糖,串音,交互作用Fusarium oxysporum在苯丙途径和黄酮在黄羽豆胚轴的积累和定位。植物生理学杂志。2011;168(5):424-33。
- 51。
陈志强,陈志强,陈志强,等。Arabidopsis Pen3 / PDR8,一种ATP结合盒转运体,有助于对通过直接穿透进入的不适当病原体产生非宿主抗性。植物细胞。2006;18:731-46。
- 52。
Malinovsky FG,Fangel Ju,Willats WG。细胞壁在植物免疫中的作用。前植物SCI。2014; 6(5):178。
- 53。
meedes E, Lorences EP。木葡聚糖内转葡糖苷酶/水解酶(xths.)在番茄果实中侵染青霉菌expansum链接。[J] .食品科学。2007;55(22):9021-6。
- 54。
Lionetti V,Raiola A,Camardella L,Giovane A,Obel N,Pauly F,等。果胶甲基酯酶抑制剂的过度表达拟南芥限制真菌感染Botrytis cinerea.植物杂志。2007;143:1871 - 80。
- 55。
授予JJ,Loake GJ。反应性氧中间体和同源氧化还原信号在抗病性中的作用。植物理性。2000; 124(1):21-30。
- 56。
Frederickson Matika DE, Loake GJ。植物免疫功能的氧化还原调节。抗氧化氧化还原信号。2014;21(9):1373-88。
- 57。
基于氧化还原和活性氧的信号通路在叶绿体光合作用中的作用。植物杂志。2016;171(3):1541 - 50。
- 58。
植物信号成分EDS1和SGT1增强由坏死营养病原体引起的疾病Botrytis cinerea.新植物。2007; 175(1):131-9。
- 59。
Lorang JM, Sweat TA, Wolpert TJ。通过“抗性”基因赋予植物抗病能力。中国科学(d辑:地球科学)2007;104(37):14861-6。
- 60。
刘绍华,叶志强,唐海峰,王志强。基于BSR-Seq的基因定位方法。《公共科学图书馆•综合》。2012;7 (5):e36406。
- 61。
顾啊,孟c,陈y,wei l,dong h,lu y等。偶联SEQ-BSA和RNA-SEQ分析揭示了与大白菜中标题类型相关的分子途径和基因。前群体。2017; 8:176。
- 62。
Ramirez-Gonzalez R,Segovia V,Bird N,Fenwick P,Holdgate S,Berry S等人。RNA-SEQ膨胀的分离分析能够鉴定六倍体小麦中的高分辨率遗传标志物。植物Biotechnol J. 2014; 13:613-24。
- 63。
张晓东,张晓东,彭刚,等。通过大体积分离RNA测序的全基因组变异分析,揭示了一种主要的基因对芸苔病的抗性芸苔属植物oleracea.Sci众议员2018;8:17657。
- 64。
布什DS。植物细胞中的钙调控及其在信号传导中的作用。Annu Rev植物植物植物Mol Biol。1995; 46(1):95-122。
- 65。
桑德斯D,佩洛克斯J,布朗利C,哈珀JF。钙离子在信号传导的十字路口。植物学报。2002;14(增刊1):S401-17。
- 66.
马伟,柏科维茨。感恩的死亡:植物先天免疫中的钙和细胞死亡。细胞Microbiol。2007;9(11):2571 - 85。
- 67.
Zhu X,Caplan J,Mamillapalli P,Czymmek K,Dinesh-Kumar Sp。内质网钙ATP酶在先天免疫介导的编程细胞死亡中的作用。Embo J.2010; 29(5):1007-18。
- 68.
Boursiac Y,Lee S,Romanways,空白R,Sladek C,Chung W等人。破坏真空钙 - ATP酶拟南芥导致水杨酸依赖的程序性细胞死亡途径的激活。植物杂志。2010;154:1158 - 71。
- 69.
Forde BG,Roberts Mr。植物中谷氨酸受体样通道:植物防御中作为氨基酸传感器的作用?F1000prime批准。2014; 6:37。
- 70。
康S,Kim Hb,Lee H,Choi Jy,Heu S,OH CJ等。过度表达拟南芥小萝卜的质膜靶向谷氨酸受体增加谷氨酸介导的钙2+涌入和延迟真菌感染。mol细胞。2006; 21(3):418-27。
- 71。
引用本文:王志强,王志强,王志强,等。参与谷氨酸受体ATGLR3.3.在植物防御、信号传导和抗性中Hyaloperonospora Arabidopsidis..植物j . 2013; 76(3): 466 - 80。
- 72。
Goldenberger D, Perschil I, Ritzler M, Altwegg M.一个简单的“通用”DNA提取程序使用SDS和蛋白酶K是兼容的直接PCR扩增。PCR方法应用1995;4(6):368-70。
- 73。
Bolger Am,Lohse M,Usadel B. Trimmomatic:用于Illumina序列数据的灵活修剪器。生物信息学。2014; 30(15):2114-20。
- 74。
利用STAR优化RNA-Seq图谱。方法:中国生物医学杂志2016;1415:245-62。
- 75。
利用DESeq2对RNA-Seq数据的折叠变化和离散度进行调节估计。基因组医学杂志。2014;15(12):550。
- 76。
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据-ΔΔct方法。方法。2001; 25(4):402-8。
确认
我们要感谢nimlash Thangam Sivachandrakumar、Stephanie Boechler和Preeni Bawa在植物接种方面的帮助和宝贵建议。我们也感谢Jerlene Halliday的慷慨提供了LcEF1α的引物序列。
资金
该项目通过NSERC-CRD授予的Sabine Banniza提供资助,由萨斯喀彻温省脉搏种植者和西方谷物研究基金会的行业贡献。资金机构没有参与设计,实验措施或对本研究的数据分析或写作稿件。
作者信息
从属关系
贡献
ZC接种植物,收集的样品,进行生物质测定,分析了RNA-SEQ数据,并起草了稿件。LL辅助所有这些实验。KK对植物进行疾病进展进行了组织病理学评估。SB构思和监督该项目并修订了稿件。所有作者均批准了最终提交。
通讯作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
所有作者同意出版。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1
图S1。8810抗性基因的表达热线抗性镜头ervoidesil -66-637和敏感RIL -66-577分别为0、48、96和144 hpi酸铵骨肉组(隔离SB19)。(JPG 2425 KB)
附加文件2:
表S1。常见的匍柄疫病响应基因GO富集分析。(XLSX 216 KB)
附加文件3:
表S2。富集的浓度浓度响应基因的富集术语。(XLSX 9 kb)
附加文件4:
表S3。识别1284次的信息镜头ervoidesRILs LR-66-637和LR-66-577分别为48、96和144 hpi酸铵骨肉组.(XLSX 157 kb)
附加文件5:
表S4。氧化石墨烯之间的富集分析镜头ervoides瑞来斯。(XLSX 39 KB)
附加文件6:
表S5。高富集的氧化石墨烯项之间镜头ervoides瑞来斯。(XLSX 9 kb)
附加文件7:
表S6。通过RNA-SEQ鉴定的DEG,其在遗传地图上与两个酸铵抗性QTL间隔共定位镜头ervoides.通过散装Seageragtion分析进一步探索基因。(XLSX 10 kb)
附加文件8:
表S7。序列和扩增效率酸铵骨肉组和镜头ervoides -特定的引物。(XLSX 9 kb)
附加文件9:
图S2。24个图书馆的映射摘要镜片玉米粉参考基因组。(JPG 1023 KB)
附加文件10:
表S8。qPCR验证16个基因的引物信息。(XLSX 10 kb)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
曹志刚,李磊,卡普尔。等等。利用转录组测序方法探索野生扁豆品种抗茎叶枯病的候选基因镜头ervoides.BMC植物BIOL.19,399(2019)。https://doi.org/10.1186/s12870-019-2013-6
已收到:
接受:
发表:
关键词
- RNA-Seq
- 酸铵骨肉组
- 抗病性
- 组织病理学