- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
生理和转录组分析GydF4y2BaPoa pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海对冷胁迫的响应GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba20.GydF4y2Ba文章编号:GydF4y2Ba362GydF4y2Ba(GydF4y2Ba2020.GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
低温限制了植物的生长和发展和地理分布。GydF4y2BaPoa pratensis.GydF4y2Ba是一种主要生长在城市地区的凉季草坪草。然而,冬季温度低或春秋寒冷事件可能导致GydF4y2Bap.pratensis.GydF4y2Ba死亡率,影响草坪的外观。GydF4y2Bap.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海(PQ)广泛分布于青藏高原以上3000米以上。PQ具有比商业栽培更大的耐寒性GydF4y2Bap.pratensis.GydF4y2Ba品种。然而,对低温PQ响应机制的现有研究主要集中在生理和生化观点上,而PQ转录组在对冷应激响应期间的变化尚未报告。GydF4y2Ba
结果GydF4y2Ba
探讨PQ冷响应的分子机制,鉴定提高PQ耐低温性的基因GydF4y2Bap.pratensis.GydF4y2Ba,我们分析和比较了PQ和冷敏感的转录组GydF4y2Bap.pratensis.GydF4y2Ba简历。低温胁迫下的巴伦(PB) RNA测序在PQ和PB处理与对照比较中,我们分别鉴定了5996和3285个差异表达基因(DEGs),其中5612个是PQ特异性的DEGs。基于DEGs, PQ中显著富集了“淀粉和蔗糖代谢”、“内质网蛋白加工”、“苯丙氨酸代谢”和“糖酵解/糖异生”等重要的京都基因和基因组百科全书(KEGG)通路,以及“淀粉和蔗糖代谢”、“苯丙素生物合成”、“糖酵解/糖异生”等重要通路。PB中“半乳糖代谢”和“谷胱甘肽代谢”显著富集。此外,“糖酵解”和“柠檬酸循环(TCA循环)”途径被鉴定为参与耐寒性GydF4y2Bap.pratensis.GydF4y2Ba.GydF4y2Ba
结论GydF4y2Ba
正如我们所知,这是第一次探索转录组的研究GydF4y2Bap.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海。我们的研究不仅提供了重要的见解,在分子机制GydF4y2Bap.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海对冷胁迫的响应,也系统揭示了糖酵解和三羧酸循环关键基因和产物在冷胁迫响应中的变化,有助于耐冷育种GydF4y2Bap.pratensis.GydF4y2Ba基因型。GydF4y2Ba
背景GydF4y2Ba
冷应力是一种常见的环境压力因素,是限制植物生长,发展和地理分布的主要因素之一[GydF4y2Ba1GydF4y2Ba].植物在冷胁迫下会出现一些症状,如表面损伤、水分流失/干燥、组织分解、加速衰老/乙烯产生、加速腐烂和死亡[GydF4y2Ba2GydF4y2Ba].然而,植物也可以通过改变其表型和生理特征来应对冷胁迫,例如激活相关信号通路[GydF4y2Ba3.GydF4y2Ba],诱导抗氧化酶和膜系统[GydF4y2Ba4.GydF4y2Ba].植物对冷胁迫的适应及其调控系统包括生物水平上各种系统调控的综合反应,如遗传调控、转录后调控、翻译后修饰和代谢反馈[GydF4y2Ba5.GydF4y2Ba].研究植物如何通过改变其遗传表达来对这些生物学过程进行响应的重要意义。然而,这些变化可以包括许多相关基因的表达。因此,难以单独研究单一代谢途径来揭示冷响应系统的复杂网络。GydF4y2Ba
在寒冷胁迫下,植物会产生一系列的反应。这些反应主要包括信号级联、膜脂成分修饰、清除活性氧(ROS)、合成渗透保护剂[GydF4y2Ba6.GydF4y2Ba[与冷应激反应相关的基因表达水平的变化。调节冷响应基因表达的信号传递转导途径是植物响应冷应激的关键过程。目前,三种最探索和报告的途径是ABA积累诱导的脱落酸(ABA)信号传导途径[GydF4y2Ba7.GydF4y2Ba,脱水反应元件结合蛋白1s (GydF4y2BaDREB1GydF4y2Ba)/C-repeat结合因子(GydF4y2BacbfGydF4y2Ba)由钙信号级联引起的途径[GydF4y2Ba8.GydF4y2Ba[CORS]和促丝裂解剂活化蛋白激酶(MAPK)级联途径[GydF4y2Ba9.GydF4y2Ba),分别。ABA被认为是一种应激激素,其生物合成过程是植物中最快的代谢反应之一[GydF4y2Ba10GydF4y2Ba],可以调节气孔闭合,降低水分损失和维持细胞生长[GydF4y2Ba11GydF4y2Ba].的GydF4y2BaDREB1 / CBFS.GydF4y2Ba是冷反应的中心途径之一,并通过结合脱水反应元件/C-repeat (GydF4y2BaDRE / CRTGydF4y2Ba) COR基因启动子区域的顺式元件[GydF4y2Ba12GydF4y2Ba那GydF4y2Ba13GydF4y2Ba].MAPK级联通路也是调节冷应答基因最重要的信号通路,主要涉及多个转录因子家族[GydF4y2Ba14GydF4y2Ba]、第二信使(ROS和CaGydF4y2Ba2+GydF4y2Ba)和一些植物激素。ROS通过植物激素的积累诱导活性氧的表达,而活性氧通过调节活性氧清除剂相关基因的表达来减少活性氧对植物的损伤[GydF4y2Ba15GydF4y2Ba].虽然越来越多的COR基因在不同的植物中被识别和注释,但不同的植物可能表现出不同的冷响应机制。因此,我们需要不断探索不同物种的冷反应调控途径和基因。GydF4y2Ba
基于高通量测序平台的转录组测序能够在单核核苷酸水平揭示任何物种的全球转录活动[GydF4y2Ba16GydF4y2Ba].近年来,转录组织为对冷压力的植物反应的研究提供了一种新的视角,并报告了许多研究[GydF4y2Ba17GydF4y2Ba那GydF4y2Ba18GydF4y2Ba那GydF4y2Ba19GydF4y2Ba].许多核基因已从各种物种中鉴定出来,包括GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba20.GydF4y2Ba],GydF4y2Ba栽培稻GydF4y2Ba[GydF4y2Ba21GydF4y2Ba],GydF4y2BaZea Mays.GydF4y2Ba[GydF4y2Ba22GydF4y2Ba)等。此外,利用转录组技术还鉴定了多年生牧草早熟亚科中DEGs的功能和代谢反应。这些草的种类包括GydF4y2Ba莱姆萨山GydF4y2Ba[GydF4y2Ba23GydF4y2Ba],GydF4y2BaLolium perenne.GydF4y2Ba[GydF4y2Ba24GydF4y2Ba),GydF4y2BaBrachypodium distachyonGydF4y2Ba[GydF4y2Ba25GydF4y2Ba].因此,利用转录组技术研究植物在冷胁迫下全基因组基因的差异表达,并结合同源克隆寻找与耐冷相关的关键基因,对植物耐冷育种具有重要的理论和实践意义。GydF4y2Ba
Poa pratensis.GydF4y2Ba是一种优良的禾本科牧草,也是一种冷季型草坪草,主要用于城市草坪建设,广泛用于草地建设和生态治理。而低温是影响黄花楸活跃生长期和休眠期的主要环境因素GydF4y2Bap.pratensis.GydF4y2Ba.在冬季或春秋低温时,GydF4y2Bap.pratensis.GydF4y2Ba可能无法在秋季春季或春季晚些时候生活或可能会成为绿色,从而影响草坪的外观[GydF4y2Ba26GydF4y2Ba].目前,关于如何提高其耐冷性的研究较少GydF4y2Bap.pratensis.GydF4y2Ba.提高草坪耐冷性的途径主要靠田间管理,如合理施肥[GydF4y2Ba27GydF4y2Ba].GydF4y2Bap.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海(PQ),作为GydF4y2Bap.pratensis.GydF4y2Ba在青藏高原的天然草原上广泛发展,中国高度超过3000米。凭借其强大的根系,易于形成草皮,强大的土壤强化能力,PQ在青藏高原高冷区的生态管理和水土保持中发挥着重要作用。此外,PQ比商业栽培品种更冷GydF4y2Bap.pratensis.GydF4y2Ba并且能够在低至−35°C的温度下安全地保持休眠状态[GydF4y2Ba28GydF4y2Ba].据我们所知,对PQ至低温的响应机制的现有研究主要集中在生理和生化的角度上,而PQ转录组在对冷应激的反应期间的变化尚未报告。GydF4y2Ba
在之前的报道中,Zhang等分析了的转录组GydF4y2Bap.pratensis.GydF4y2Ba简历。在冷应激下的“优点”,并鉴定了与冷应激相关的一些次数,例如冷诱导的蛋白质,抗氧化酶和OsmoreGulation蛋白[GydF4y2Ba29GydF4y2Ba].然而,这些DEGS所涉及的代谢途径未深入分析。在这项研究中,我们比较了冷耐寒PQ和冷敏感之间的表型和生理差异GydF4y2Bap.pratensis.GydF4y2Ba简历。“男爵”(PB)。然后是两种不同的分子反应GydF4y2Bap.pratensis.GydF4y2Ba使用转录组方法分析对冷应激的基因型,并且深入研究了相关的代谢途径。研究结果为获得PQ适应对冷应力的分子机制的更具体了解,以及寻找基因的基础,以及提高低温耐受性的基因GydF4y2Bap.pratensis.GydF4y2Ba.GydF4y2Ba
结果GydF4y2Ba
对冷胁迫的表型和生理反应GydF4y2Ba
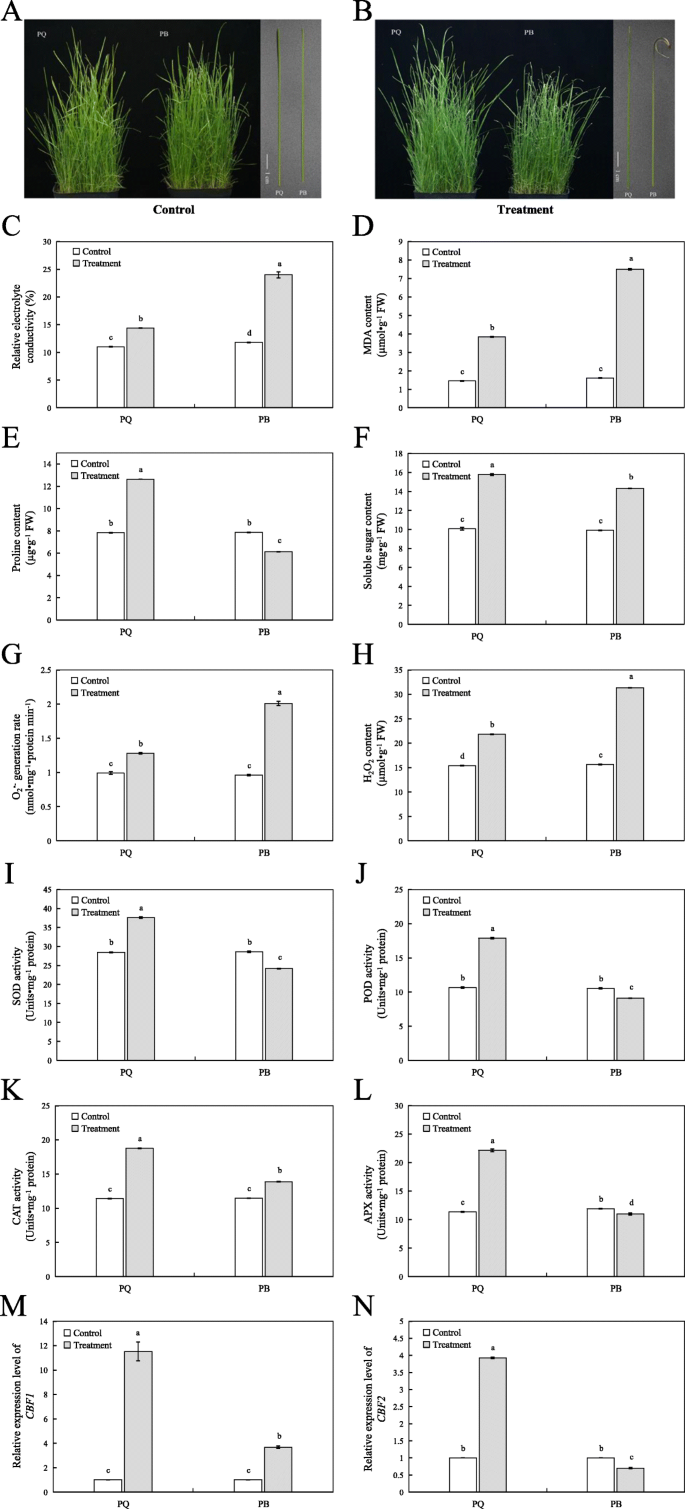
在冷胁迫下,两种基因型的表型和生理变化显著(图2)。GydF4y2Ba1GydF4y2Ba).在控制条件下,两种基因型的生长良好,叶子没有枯萎或模具(图。GydF4y2Ba1GydF4y2Ba一种)。在冷处理72小时和24小时后,PQ的叶片形态没有显着变化,但PB的叶尖已经干燥和枯萎了(图。GydF4y2Ba1GydF4y2Bab)。相对电解质电导率(REC)和丙二醛(MDA)通常用于测量膜损伤和细胞稳定性。在冷应力下,膜系统和植物细胞中ROS代谢的平衡被摧毁[GydF4y2Ba30.GydF4y2Ba].因此,在冷应力下PQ和PB的REC和MDA含量显着增加。但是,PQ的增加比PB更小。REC的提高率为30.76%vs 98.30%,MDA的速率为164.83%vs 357.67%(图。GydF4y2Ba1GydF4y2Bac和d).游离脯氨酸(Pro)和可溶性糖(SS)有助于维持细胞膜的稳定性[GydF4y2Ba31GydF4y2Ba].与对照条件相比,PQ的PR含量增加了61.30%,而Pb中的Pb含量下降24.94%(图。GydF4y2Ba1GydF4y2Bae)。两种基因型的SS含量在冷应力下显着增加。与对照条件相比,PQ中的SS含量增加了53.20%,Pb中的45.14%(图。GydF4y2Ba1GydF4y2Baf).在冷胁迫下,超氧自由基(OGydF4y2Ba2GydF4y2Ba·-GydF4y2Ba)生成率和过氧化氢(HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba)与对照条件下的两种基因型的含量显着增加(图。GydF4y2Ba1GydF4y2Bag和h)GydF4y2Ba2GydF4y2Ba·-GydF4y2Ba生成率和hGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2BaPQ的含量均低于Pb的含量(图。GydF4y2Ba1GydF4y2Bag和h)。此外,我们还确定了两种基因型的叶片中的抗氧化酶活性。结果表明,与对照条件相比,超氧化物歧化酶(SOD),过氧化物酶(POD),PQ的过氧化物酶(APX)活性显着改善(图。GydF4y2Ba1GydF4y2Ba我,j,k和l)。然而,在Pb中,除猫活性外,SOD,POD和APX的活性显着低于对照条件中的活性(图。GydF4y2Ba1GydF4y2Bai, j, k和l)。C-repeat结合因子(GydF4y2BaCBFGydF4y2Ba/ /脱水响应元件结合因子(GydF4y2Ba含有DREBGydF4y2Ba)是植物冷响应中最有效的途径之一[GydF4y2Ba32GydF4y2Ba].与上述生理变化相似的是GydF4y2BaCBF1GydF4y2Ba和GydF4y2BaCBF2GydF4y2Ba在冷胁迫下,PQ显著高于PB(图2)。GydF4y2Ba1GydF4y2Ba结果表明,PQ比PB具有更强的耐寒性。GydF4y2Ba
表型和生理反应两种GydF4y2Bap.pratensis.GydF4y2Ba对照和冷胁迫条件下的品种。表型变化GydF4y2Ba一种GydF4y2Ba和GydF4y2BaB.GydF4y2Ba)、REC (GydF4y2BaCGydF4y2Ba),MDA(GydF4y2BaD.GydF4y2Ba)、专业(GydF4y2BaE.GydF4y2Ba),SS内容(GydF4y2BaFGydF4y2Ba),O.GydF4y2Ba2GydF4y2Ba·-GydF4y2Ba生成率(GydF4y2BaGGydF4y2Ba), HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba内容(GydF4y2BaHGydF4y2Ba)、SOD (GydF4y2Ba一世GydF4y2Ba)、豆荚(GydF4y2BajGydF4y2Ba), 猫 (GydF4y2BaK.GydF4y2Ba)及APX (GydF4y2BaL.GydF4y2Ba)活动,GydF4y2BaCBF1GydF4y2Ba(GydF4y2BamGydF4y2Ba),GydF4y2BaCBF2GydF4y2Ba(GydF4y2BaNGydF4y2Ba)表达水平测定。所有数据以平均值±SE表示,来自三个独立的实验重复。不同字母表示at有显著差异GydF4y2BaP.GydF4y2Ba< 0.05GydF4y2Ba
RNA测序(RNA-seq)和转录组组装GydF4y2Ba
为了分析这两个基因型在对照和冷胁迫条件下的转录组和基因表达谱,从这两个基因型的叶片中提取了12个cDNA样本,并利用Illumina HiSeq 2500平台进行了测序。每个样本都有超过4200万原始读取、超过4100万干净读取和超过6.20 G干净基础(附加文件GydF4y2Ba1GydF4y2Ba:表S1)。此外,Q20百分比的碱基误差率为0.02%,Q20百分比超过97.00%,Q30百分比超过93.00%(附加文件GydF4y2Ba1GydF4y2Ba:表S1)。GC含量为55.49和56.87%。从12个样本中获得了总读取的1.573,862,822(附加文件GydF4y2Ba1GydF4y2Ba:表S1)。在删除低质量的读取和适配器序列后,获得了567,006,774个干净的读取(附加文件GydF4y2Ba1GydF4y2Ba:表S1)。干净基的容量为84.45 G(附加文件1:表S1)。所有干净的数据由Trinity软件重新组装,并对组装结果进行评估。12个样本共获得94479个转录本。转录本的平均长度为454.62 bp, N50长度为502 bpGydF4y2Ba2GydF4y2Ba:表S2)。此外,获得了458,419个unigenes,平均长度为326.19 bp,n50长度为336 bp(附加文件GydF4y2Ba2GydF4y2Ba:表S2)。GydF4y2Ba
基因注释和功能分类GydF4y2Ba
为了分析和预测unigenes的功能,我们通过BLAST和6个公共数据库对转录组组装获得的所有unigenes进行功能注释。在458,419个unigenes中,有183,701个(40.07%)在6个数据库中至少有一个显著匹配。其中,非冗余蛋白序列数据库(NR)、Swiss-prot、Pfam、COG、GO和KEGG数据库共发现174,005(37.96%)、98,674(21.52%)、80,568(17.58%)、14,768(3.22%)、130,023(28.36%)和61,759(13.47%)单基因。分别(附加文件GydF4y2Ba3.GydF4y2Ba:表S3)。NR数据库产生了最多的匹配。与其他物种进行比较GydF4y2Bap.pratensis.GydF4y2Ba是GydF4y2BaAegilops Tauschii.GydF4y2Ba(32.59%),GydF4y2BaBrachypodium distachyonGydF4y2Ba(20.49%),GydF4y2Ba大麦芽GydF4y2Ba(11.07%)和GydF4y2Ba小麦属植物urartuGydF4y2Ba(9.34%)(附加文件GydF4y2Ba4.GydF4y2Ba:图S1A)。GydF4y2Ba
利用氧化石墨烯分析对预测函数进行分类GydF4y2Bap.pratensis.GydF4y2Baunigenes。总共130,023个未成功注释并分为三个主要类别,包括生物过程,细胞组分和分子函数。细胞(56,852),代谢(53,563),单生体(32,677),细胞(53,360),细胞部分(52,984),膜(44,360),结合(75,473),催化活性(68,189)和转运蛋白活性(7212)三类中最主导的术语(附加文件GydF4y2Ba4.GydF4y2Ba:图印地)。GydF4y2Ba
为了进一步预测unigene的功能和评估转录组的完整性,我们在COG数据库中搜索了所有的unigene。基于COG数据库,14768个unigenes被分为25个功能类别。“翻译、核糖体结构和生物发生”(938)是最大的一组,其次是“一般功能预测”(753)、“翻译后修饰、蛋白质转换、伴侣”(730)、“信号转导机制”(648)、“复制、重组和修复”(497)、“碳水化合物的运输和代谢”(447),“功能未知”(421)和“能量的产生和转换”(408)(补充文件GydF4y2Ba4.GydF4y2Ba:图就是S1C)。GydF4y2Ba
低温胁迫下差异表达基因(DEGs)的鉴定GydF4y2Ba
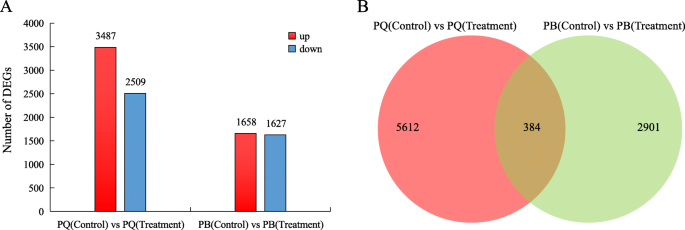
通过计算每千碱基外显子模型每百万图读(TPM)的转录本来分析每个基因的表达水平。与对照相比,PQ和PB在冷胁迫下基因表达量发生了显著变化,但变化的基因数量不同。在PQ中,共鉴定出5996个DEGs,其中3487个表达上调,2509个表达下调(图)。GydF4y2Ba2GydF4y2Baa).在PB中,1658和1627 DEGs分别上调和下调(图2)。GydF4y2Ba2GydF4y2Ba一种)。计算通过比较两种基因型而获得的次数的数量,并且它们的常见的含量和独特的粉末显示在VENN图中(图。GydF4y2Ba2GydF4y2Bab)。结果表明,5612次特异于PQ,2901特异于Pb,384℃在两种基因型之间共享相同的模式(图。GydF4y2Ba2GydF4y2Bab)。GydF4y2Ba
基因本体(GO)富集分析GydF4y2Ba
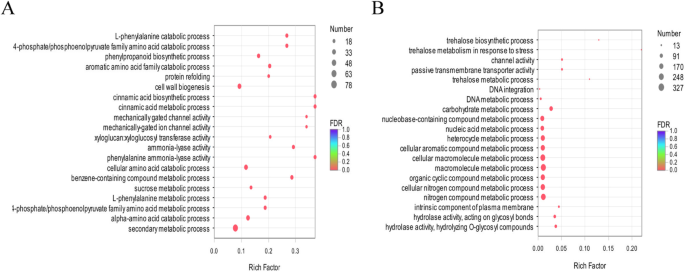
对两种基因型的DEGs进行GO富集分析。结果显示,在PQ中,5996个DEGs被分为1151个GO项,包括“生物过程”(671)、“细胞成分”(138)和“分子功能”(342)三类(补充文件)GydF4y2Ba5.GydF4y2Ba:图S2)。根据修正后的GydF4y2BaP.GydF4y2Ba-values中,我们选择了30个最富GO的术语,其中主要的生物过程术语为“代谢过程”(1629个基因)、“细胞过程”(1568个基因)和“单生物过程”(1041个基因)(附加文件)GydF4y2Ba5.GydF4y2Ba:图S2)。初级细胞成分术语为“细胞”(1646个基因)、“细胞部分”(1631个基因)和“膜”(1341个基因)。主要的分子功能术语是“催化活性”(2008个基因)和“结合”(1862个基因)。由气泡图显示,富集最显著的氧化石墨烯术语为“次级代谢过程”(GO: 0019748)、“细胞壁生物发生”(GO: 0042546)、“细胞氨基酸分解过程”(GO: 0009063)和“α -氨基酸分解过程”(GO: 1901606)(图1)。GydF4y2Ba3.GydF4y2Ba一种)。GydF4y2Ba
3285个deg在PB中被分为650个GO术语,包括“生物过程”(360个)、“细胞成分”(65个)和“分子功能”(225个)GydF4y2Ba5.GydF4y2Ba:图S2)。在最丰富的30个GO术语中,主要的生物过程术语是“代谢过程”(810个基因)、“细胞过程”(713个基因)和“单生物过程”(541个基因)。初级细胞成分术语为“细胞”(790个基因)、“细胞部分”(722个基因)和“膜”(698个基因)(附加文件)GydF4y2Ba5.GydF4y2Ba:图S2)。主要分子函数术语是“催化活性”(1081个基因)和“结合”(904个基因)。就生物过程,细胞成分和分子函数类别而言,最具显着富集的GO术语是“大分子代谢过程”(GO:0043170),“细胞大分子代谢过程”(GO:0044260)和“氮化合物代谢过程”“(GO:0006807)(图。GydF4y2Ba3.GydF4y2Bab)。GydF4y2Ba
DEGs的KEGG途径富集分析GydF4y2Ba
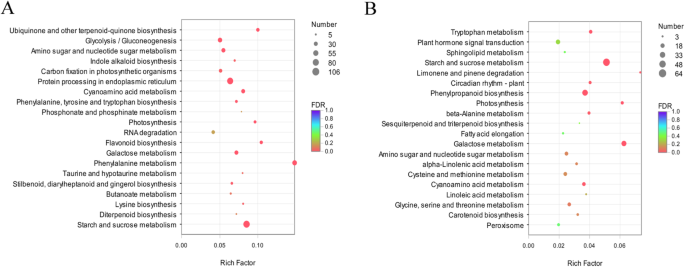
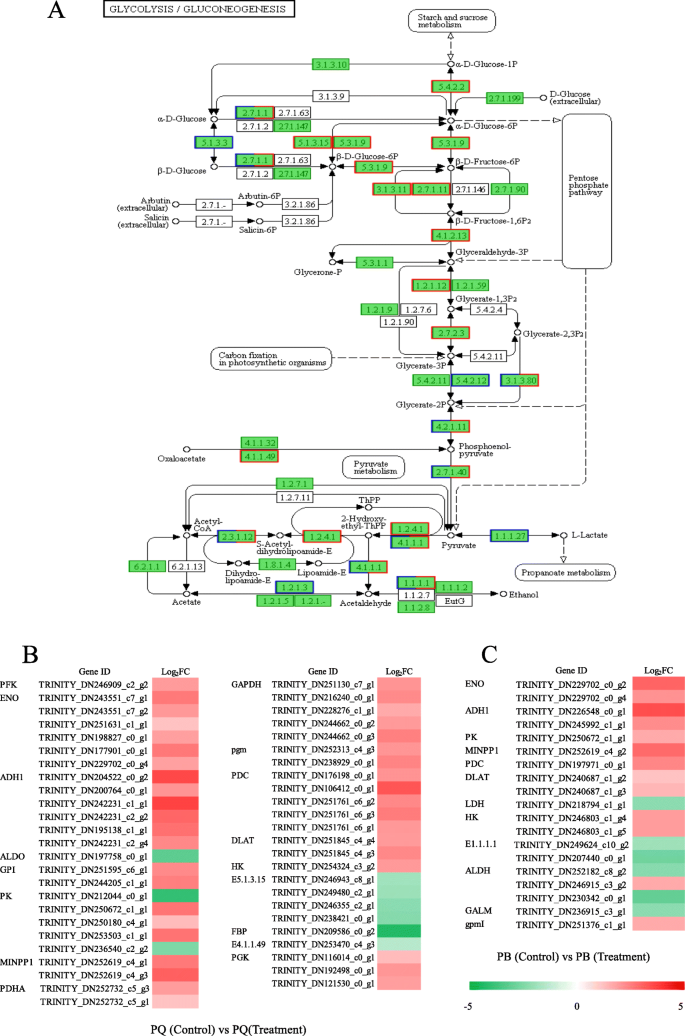
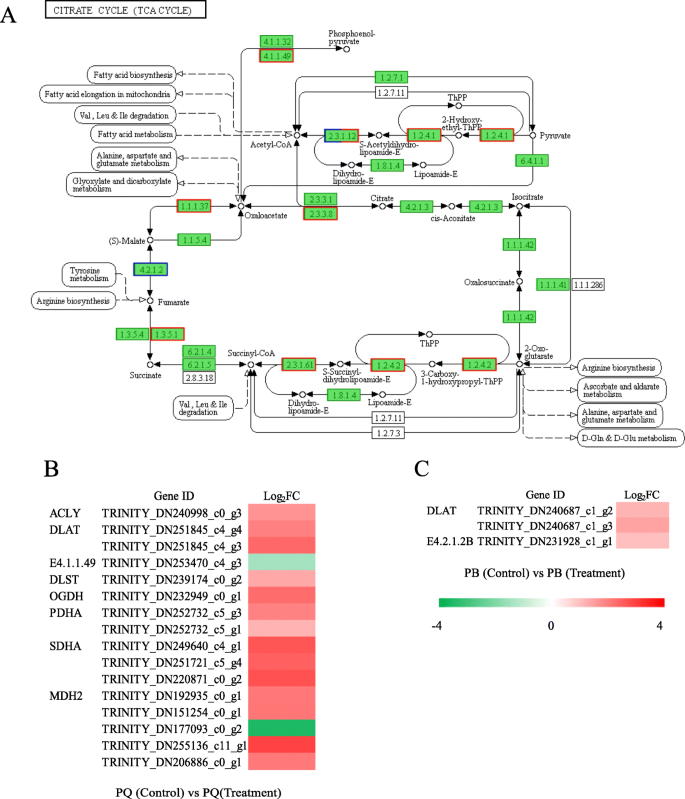
要了解Degs的功能,我们将参加DEG映射到KEGG数据库中的规范路径。PQ中的DEGS被分配到119 kegg途径。大多数途径被分组为“新陈代谢”类别,例如“碳水化合物代谢”(225个基因),“氨基酸代谢”(190个基因)和“能量代谢”(96个基因),其次是“遗传信息处理”和“环境信息处理”类别(附加文件GydF4y2Ba6.GydF4y2Ba:图S3A)。根据富集的deg的数量,我们列出了前20条途径(图。GydF4y2Ba4.GydF4y2Ba).最显著富集的途径是“淀粉和蔗糖代谢”(ko00500)、“内质网蛋白加工”(ko04141)、“苯丙氨酸代谢”(ko00360)和“糖酵解/糖异生”(ko00010)(图。GydF4y2Ba4.GydF4y2Ba一种)。PB中的DEGS分配给109 Kegg途径。类似地,大多数途径被分组为“代谢”类别,例如“碳水化合物代谢”(112个基因),“能量代谢”(45个基因)和“其他氨基酸的代谢”(31种基因)(附加档案GydF4y2Ba6.GydF4y2Ba:图S3B)。富集分析表明,显著富集的KEGG途径为“淀粉和蔗糖代谢”(ko00500)、“苯丙素生物合成”(ko00940)、“半乳糖代谢”(ko00052)和“谷胱甘肽代谢”(ko00480)(图4)。GydF4y2Ba4.GydF4y2Bab).以上结果表明,低温胁迫影响了两种基因型的“淀粉和蔗糖代谢”途径。比较PQ和PB的KEGG通路,我们最感兴趣的是在PQ中富集较高而在PB中富集较低的通路,如“糖酵解/糖异生”和“柠檬酸循环(TCA循环)”。进一步分析了其与耐冷性的关系GydF4y2Bap.pratensis.GydF4y2Ba.GydF4y2Ba
参与糖酵解和柠檬酸循环(TCA循环)的DEGsGydF4y2Ba
糖醇分解,作为提供ATP,还原剂和植物生长和发展代谢物的关键呼吸道途径[GydF4y2Ba33GydF4y2Ba].在本研究中,从PQ中鉴定了49个参与糖酵解途径的deg。40个编码糖酵解相关关键酶的DEGs显著上调(图。GydF4y2Ba5.GydF4y2Bab)。这些是磷酰型酶(EC 5.4.2.2),六酮酶(EC 2.7.1.1),葡萄糖-6-磷酸异构酶(EC 5.3.1.9),6-磷过滤液(EC 2.7.1.11),甘油醛3-磷酸脱氢酶(EC 1.2。1.12),磷酸糖激酶(EC 2.7.2.3),2,3-双次磷酸酯3-磷酸酶(EC 3.1.3.80),烯醇酶(EC 4.2.1.11),丙酮酸激酶(EC 2.7.1.40),丙酮酸脱氢酶E2(EC 2.3.1.12),丙酮酸脱羧酶(EC 4.1.1.1)和醇脱氢酶(EC 1.1.1.1)(图。GydF4y2Ba5.GydF4y2Ba一种)。在冷应激下,参与该途径的PB 19次(图。GydF4y2Ba5.GydF4y2Bac). 13个编码糖酵解相关蛋白的DEGs显著上调。这些DEGs包括己糖激酶、2,3-二磷酸甘油酸独立磷酸甘油酸突变酶(EC 5.4.2.12)、2,3-二磷酸甘油酸3-磷酸酶、烯醇化酶、丙酮酸激酶、丙酮酸脱氢酶E2、丙酮酸脱羧酶、醛脱氢酶(EC 1.2.1.3)和乙醇脱氢酶(图5.4.2.12)。GydF4y2Ba5.GydF4y2Ba一种)。GydF4y2Ba
柠檬酸盐循环(TCA循环)是在高等植物线粒体中发生的重要碳代谢途径。它是呼吸期间葡萄糖有氧分解的主要方法,其逐渐氧化并分解糖浆产物丙酮酸中的COGydF4y2Ba2GydF4y2Ba和HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba,生成NADH、FADHGydF4y2Ba2GydF4y2Ba和ATP来支持耐受性。在我们的研究中,有16个DEGs(14个上调,2个下调)(图。GydF4y2Ba6.GydF4y2Bab),主要包括一些关键酶,如丙酮酸脱氢酶E2 (EC 2.3.1.12)、丙酮酸脱氢酶E1 (EC 1.2.4.1)、ATP柠檬酸(pro-S)裂解酶(EC 2.3.3.8)、苹果酸脱氢酶(EC 1.1.1.37)、琥珀酸脱氢酶(EC 1.3.5.1)、2-羟戊二酸脱氢酶E2 (EC 2.3.1.61)、2-羟戊二酸脱氢酶E1 (EC 1.2.4.2)、和磷酸烯醇丙酮酸羧激酶(EC 4.1.1.49),从PQ中鉴定为参与TCA循环途径(图。GydF4y2Ba6.GydF4y2Baa).然而,从PB中仅鉴定出3个DEGs(3个上调)参与“TCA循环”途径(图)。GydF4y2Ba6.GydF4y2Bac)。这是丙酮酸脱氢酶E2 (EC 2.3.1.12)和富马酸水合酶(EC 4.2.1.2)(图2)。GydF4y2Ba6.GydF4y2Ba一种)。GydF4y2Ba
影响碳水化合物、糖酵解产物和三羧酸循环产物的含量及相关酶活性GydF4y2Bap.pratensis.GydF4y2Ba冷胁迫下的品种GydF4y2Ba
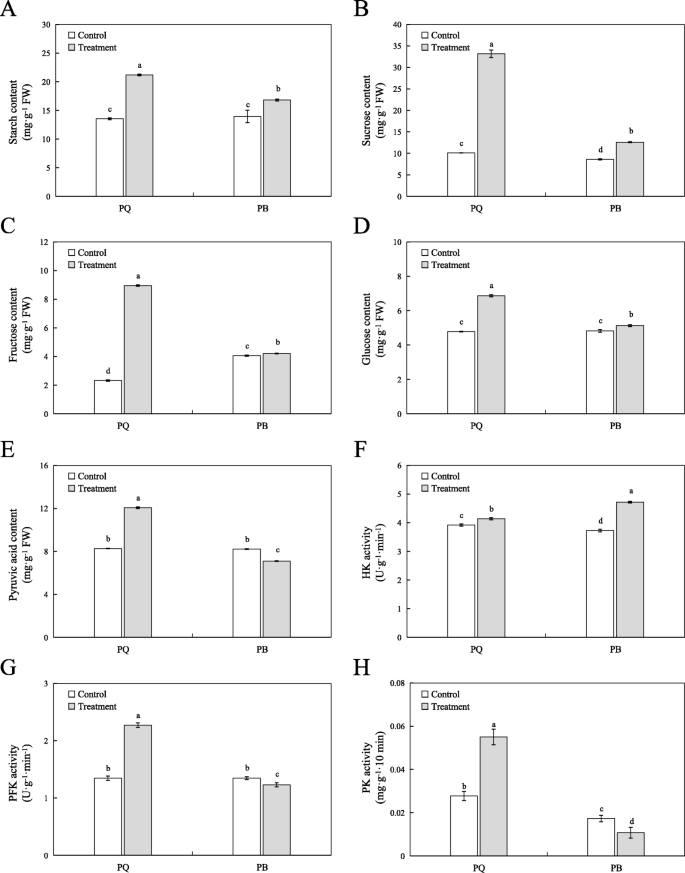
PQ和PB的淀粉,蔗糖,果糖和葡萄糖含量显着增加,但PQ的增加高于PB(增加率为60.95%Vs 19.56,229.31%Vs 49.23,68.61%Vs 4.73和分别为44.75%vs 3.64%)(图。GydF4y2Ba7.GydF4y2BaA,B,C和D)。丙酮酸是有机酸的型号前体,在原发性代谢中起着关键作用。同时,它也是糖酵解途径和TCA周期的接头[GydF4y2Ba34GydF4y2Ba].与对照条件相比,PQ的丙酮酸含量增加46.43%,而Pb的降低减少了13.17%(图。GydF4y2Ba7.GydF4y2Bae)。六酮酶(HK),磷化氢氨基酶(PFK)和丙酮酸激酶(PK)是糖酵解途径中最重要的不可逆酶。在冷应激下,与对照条件相比,PQ的HK,PFK和PK活性分别增加了5.56,60.43和126.92%(图。GydF4y2Ba7.GydF4y2Ba而在PB中,除HK活性外,PFK和PK活性均显著低于对照(图2)。GydF4y2Ba7.GydF4y2BaF g和h)。GydF4y2Ba
影响糖类和糖酵解产物含量及相关酶活性的两个因素GydF4y2Bap.pratensis.GydF4y2Ba冷胁迫下的品种。淀粉(GydF4y2Ba一种GydF4y2Ba)、蔗糖(GydF4y2BaB.GydF4y2Ba)、果糖(GydF4y2BaCGydF4y2Ba)、葡萄糖(GydF4y2BaD.GydF4y2Ba),丙酮酸含量(GydF4y2BaE.GydF4y2Ba),香港(GydF4y2BaFGydF4y2Ba),pfk(GydF4y2BaGGydF4y2Ba)、PK (GydF4y2BaHGydF4y2Ba)活性测定。所有数据以平均值±SE表示,来自三个独立的实验重复。不同字母表示at有显著差异GydF4y2BaP.GydF4y2Ba< 0.05GydF4y2Ba
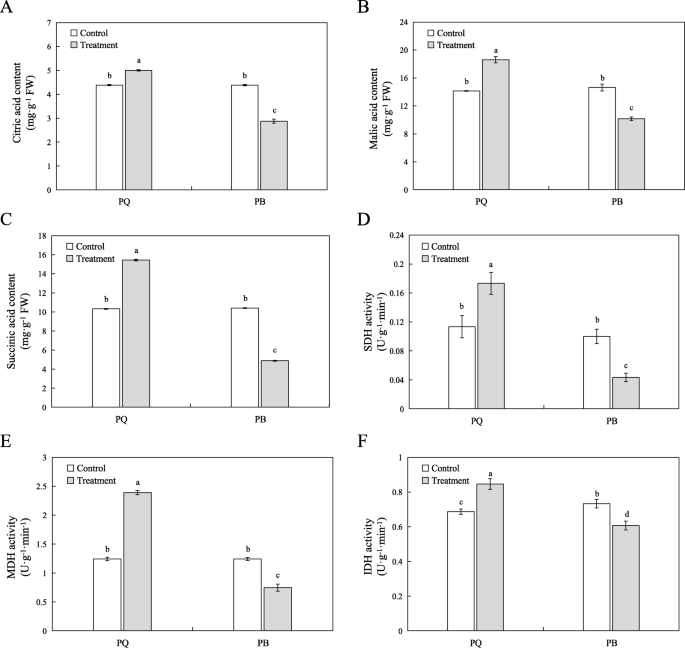
柠檬酸,苹果酸和琥珀酸是TCA循环途径中的主要有机酸。在该研究中,与对照条件相比,冷应力显着增加了PQ中PQ中柠檬酸,苹果酸和琥珀酸的水平,分别增加了13.47,33.50和49.37%(图。GydF4y2Ba8.GydF4y2Baa,b和c)。然而,冷应力显着降低了Pb中这三种有机酸的水平(图。GydF4y2Ba8.GydF4y2Ba琥珀酸脱氢酶(SDH)、苹果酸脱氢酶(MDH)和异柠檬酸脱氢酶(IDH)是TCA循环途径中的几个关键酶。结果表明,与对照条件相比,PQ的SDH、MDH和IDH活性显著提高(图2)。GydF4y2Ba8.GydF4y2BaD, e和f)。然而,在PB中,SDH,MDH和IDH的活性显着低于对照条件下的活性(图。GydF4y2Ba8.GydF4y2BaD, e和f)。GydF4y2Ba
柠檬酸盐循环(TCA循环)产物含量及其相关酶活性的影响GydF4y2Bap.pratensis.GydF4y2Ba冷胁迫下的品种。柠檬酸(GydF4y2Ba一种GydF4y2Ba)、苹果酸(GydF4y2BaB.GydF4y2Ba),琥珀酸含量(GydF4y2BaCGydF4y2Ba),SDH(GydF4y2BaD.GydF4y2Ba)、MDH (GydF4y2BaE.GydF4y2Ba),IDH(GydF4y2BaFGydF4y2Ba)活性测定。所有数据以平均值±SE表示,来自三个独立的实验重复。不同字母表示at有显著差异GydF4y2BaP.GydF4y2Ba< 0.05GydF4y2Ba
使用定量QRT-PCR验证DEGSGydF4y2Ba
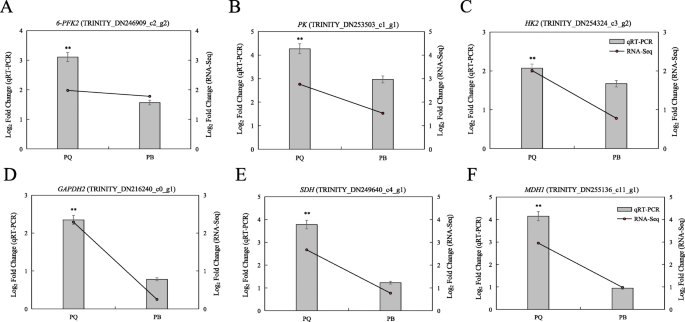
为了验证RNA-seq获得的数据,我们选择了6个DEGs进行qRT-PCR。这6个基因作为糖酵解和三羧酸循环中代表性的关键基因,参与了冷胁迫耐受性的研究。我们的结果表明,在冷胁迫下,这6个基因在PQ中的表达水平显著高于在PB中的表达水平(图2)。GydF4y2Ba9.GydF4y2Ba).这说明这些具有代表性的关键基因的高表达是PQ适应冷胁迫的重要功能因素。虽然在fold-changes上存在差异,但qRT-PCR分析的基因表达模式与RNA-Seq方法分析的基因表达模式相似,这也证实了RNA-Seq结果的可靠性。GydF4y2Ba
讨论GydF4y2Ba
低温是植物常见的环境胁迫因子。植物通过改变形态和物理生化特性来应对冷胁迫[GydF4y2Ba35GydF4y2Ba].分子和遗传学研究表明,这些变化可能包括许多相关基因的表达[GydF4y2Ba36GydF4y2Ba].RNA-SEQ为植物对冷应力的反应提供了新的途径。因此,使用RNA-SEQ技术来了解涉及冷应激信号网络中涉及的生理反应的机制是植物冷耐寒育种的关键。在这项研究中,我们使用RNA-SEQ技术来分析和比较冷耐寒的转录组GydF4y2Bap.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海(PQ)与寒敏感GydF4y2Bap.pratensis.GydF4y2Ba简历。以鉴定PQ中可能参与耐冷胁迫的基因。研究结果有助于更好地了解PQ在冷胁迫下的分子机制,并对培养具有一定的指导意义GydF4y2Bap.pratensis.GydF4y2Ba变种对冷应激的耐受性。下面讨论PQ中冷响应的一些特征。GydF4y2Ba
碳水化合物含量的变化直接影响植物的生理活动,如光合作用、呼吸和代谢过程[GydF4y2Ba37GydF4y2Ba].最近的研究表明,枇杷的碳水化合物代谢途径在冷胁迫下最为敏感,转录组测序获得的DEGs主要与糖酵解、丙酮酸代谢、淀粉和蔗糖代谢、戊糖和葡萄糖醛酸的相互转化以及果糖和甘露糖的代谢途径有关[GydF4y2Ba38GydF4y2Ba].这些观察结果与我们的结果一致。我们的研究结果还表明GydF4y2Bap.pratensis.GydF4y2Ba对冷压力最敏感。在这两者中GydF4y2Bap.pratensis.GydF4y2Ba品种,与碳水化合物代谢相关的许多次数映射到“淀粉和蔗糖代谢”,“糖酵解”和“半乳糖代谢”途径,包括PQ和112中的225(图。GydF4y2Ba4.GydF4y2Ba和附加文件GydF4y2Ba6.GydF4y2Ba:图S3)。在低温胁迫下,碳水化合物可以作为渗透保护剂稳定细胞膜并清除ROS,从而保护植物免受氧化损伤[GydF4y2Ba39GydF4y2Ba那GydF4y2Ba40GydF4y2Ba].一些研究表明,在冷耐寒'FARSTER'中观察到Fructan含量和果糖转移酶基因转录诱导GydF4y2BaLolium perenne.GydF4y2Ba高于冷敏感的'veyo'GydF4y2BaLolium perenne.GydF4y2Ba[GydF4y2Ba24GydF4y2Ba].此外,在低温胁迫下,甜瓜叶片中积累了大量的淀粉、蔗糖和己糖[GydF4y2Ba41GydF4y2Ba].这些研究表明,耐冷基因型的某些碳水化合物含量高于冷敏感基因型。在我们的研究中,耐寒PQ中总可溶性糖、淀粉、蔗糖、果糖和葡萄糖的积累量大于冷敏感PB,这与之前的报道一致(图)。GydF4y2Ba1GydF4y2Baf和无花果。GydF4y2Ba7.GydF4y2Baa, b, c和d)GydF4y2Ba2GydF4y2Ba·-GydF4y2Ba生成率和hGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2BaPQ的含量均低于Pb的含量(图。GydF4y2Ba1GydF4y2BaG和H)表明碳水化合物也在稳定细胞膜和去除ROS中发挥作用。植物中有多种碳水化合物[GydF4y2Ba42GydF4y2Ba那GydF4y2Ba43GydF4y2Ba那GydF4y2Ba44GydF4y2Ba].不同种类的碳水化合物可以参与保持细胞膜结构功能的稳定性[GydF4y2Ba45GydF4y2Ba].然而,在冷应激下,不同品种植物累积的碳水化合物类型也存在显着差异。以前的研究报道说,在冷应力下,奖金含量更多GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba42GydF4y2Ba,而蔗糖和果糖主要在GydF4y2BaTriticum Aestivum.GydF4y2Ba[GydF4y2Ba43GydF4y2Ba),GydF4y2BaSecale Cereale.GydF4y2Ba[GydF4y2Ba44GydF4y2Ba].我们的结果表明,PQ和PB的蔗糖含量在冷胁迫下显著增加,且PQ的增加幅度显著高于PB(图2)。GydF4y2Ba7.GydF4y2BaB),这表明在整个胁迫过程中蔗糖的积累主要影响这两种植物的耐冷性GydF4y2Bap.pratensis.GydF4y2Ba品种。我们和其他人的研究表明,蔗糖是一种可溶性碳水化合物,它在植物适应非生物胁迫中有潜在的作用[GydF4y2Ba46GydF4y2Ba].以前的研究表明,葡萄糖和ABA均诱导非生物应激的关键调节基因的表达,例如GydF4y2BaCBF3GydF4y2Ba那GydF4y2BaCOR15AGydF4y2Ba和GydF4y2BaRD29AGydF4y2Ba[GydF4y2Ba47GydF4y2Ba那GydF4y2Ba48GydF4y2Ba].此外,一些茉莉酸、脱落酸和GydF4y2Ba天哪GydF4y2Ba基因由可溶性糖控制[GydF4y2Ba48GydF4y2Ba].因此,这些结果表明,碳水化合物在PQ对冷胁迫的响应中起着关键作用。GydF4y2Ba
糖酵解途径不仅是植物呼吸的主要途径之一,而且是调节碳水化合物代谢的重要途径。通过糖酵解途径进一步代谢葡萄糖和果糖,产生能量(ATP),还原剂(NADH)和丙酮酸酸[GydF4y2Ba49GydF4y2Ba].在许多非生物胁迫下,糖酵解通常参与调节植物对环境的适应性[GydF4y2Ba50GydF4y2Ba].已有研究报道,小麦和水稻在Al胁迫下可以调控糖酵解途径相关基因[GydF4y2Ba51GydF4y2Ba那GydF4y2Ba52GydF4y2Ba].在本研究中,我们比较了PQ和Pb的Kegg途径,发现两种基因型富集在糖酵解途径中,但PQ中的富集富集显着高于Pb(图。GydF4y2Ba5.GydF4y2Ba).从PQ中鉴定四十九的次数以参与糖酵解途径,并且显着上调了40℃的编码与糖醇相关的关键酶进行了显着上调(图。GydF4y2Ba5.GydF4y2Bab).此外,我们选取糖酵解途径的4个关键的deg进行qRT-PCR验证,结果表明,这些deg在冷胁迫下表达量增加,但PQ的表达量增加大于PB。这些结果表明,PQ可以有效地调节糖酵解途径关键基因的表达水平,缓解冷胁迫的抑制。糖酵解途径的关键酶主要有己糖激酶(HK, EC 2.7.1.1)、6-磷酸果糖激酶(PFK, EC 2.7.1.11)、甘油醛3-磷酸脱氢酶(GAPDH, EC 1.2.1.12)和丙酮酸激酶(PK, EC 2.7.1.40)等。糖酵解途径是一个复杂的代谢过程,受相关酶活动的影响[GydF4y2Ba53GydF4y2Ba].HK、PFK和PK是糖酵解途径中关键的限速酶。以往的研究表明,低水平的HK活性可以抑制植物衰老,调节植物的渗透性,以适应环境[GydF4y2Ba54GydF4y2Ba那GydF4y2Ba55GydF4y2Ba].在本研究中,我们发现PQ和PB的HK活性在冷胁迫后显著增加,但PQ的增加幅度小于PB(图2)。GydF4y2Ba7.GydF4y2Baf),表明低活性的HK能提高植物的耐冷性。研究发现,降低PK和PFK活性可以抑制糖酵解途径及其他与中间代谢相关的途径[GydF4y2Ba55GydF4y2Ba].我们的研究发现,冷胁迫降低了PB中PFK和PK的活性,这对植物的呼吸代谢是有害的。GydF4y2Ba7.GydF4y2Bag和h)。相反,PQ中PFK和PK的活性显着增加,其加速了糖酵解代谢(图。GydF4y2Ba7.GydF4y2Bag和h)。相应地,编码这些酶的基因也增加了它们的表达量。PFK活性的提高可以加速果糖-6-磷酸向果糖-1,6-二磷酸的转化,并为TCA循环提供更多的草酰乙酸和丙酮酸[GydF4y2Ba56GydF4y2Ba].丙酮酸是一种重要的有机酸,其与TCA循环连接糖酵解途径[GydF4y2Ba34GydF4y2Ba].在本研究中,在冷应激下PQ中的丙酮酸酸含量显着增加,这提供了更多的TCA循环物质(图。GydF4y2Ba7.GydF4y2Bae).我们的RNA-seq数据和糖酵解代谢的深入分析表明,糖酵解途径在PQ对冷胁迫反应的适应机制中发挥着重要作用。GydF4y2Ba
TCA循环不仅是连接碳水化合物、氨基酸、脂类和蛋白质代谢的桥梁,也是产生能量和降低能量驱动代谢的引擎[GydF4y2Ba57GydF4y2Ba].TCA循环中有八个酶,其是柠檬酸合酶(CSY,EC 2.3.3.1),亚氨酶(ACO,EC 4.2.1.3),异柠檬酸脱氢酶(IDH,EC 1.1.1.41),α-酮戊酸脱氢酶(αKGDH,EC 1.2.4.2),琥珀酰基-COA合成酶(SCOAL,EC 6.2.1.4),琥珀酸钠脱氢酶(SDH,EC 1.3.5.1),富马酶(FUM,EC 4.2.1.2)和苹果酸脱氢酶(MDH,EC 1.1.1.37).在番茄的TCA突变体中,FUM,MDH和αKGDH在调节TCA周期中发挥关键作用[GydF4y2Ba58GydF4y2Ba].在非生物胁迫下,TCA循环是植物重要的保护系统之一[GydF4y2Ba59GydF4y2Ba].最近,Wu等人[GydF4y2Ba60GydF4y2Ba的转录组和代谢组GydF4y2Ba石斛兰officinaleGydF4y2Ba结果表明,三羧酸循环中柠檬酸、琥珀酸和延胡索酸等几种重要中间产物的积累导致异柠檬酸裂解酶(ICL)、ACO和SDH活性升高。我们的RNA-seq数据显示,PQ中TCA循环通路中富集了16个DEGs,而PB中仅富集了3个DEGs(图)。GydF4y2Ba6.GydF4y2BaB和c)。在PQ中富集的16次主要涉及编码TCA循环途径的关键酶,例如MDH和SDH(图。GydF4y2Ba6.GydF4y2Baa).我们的研究发现,冷胁迫显著降低了PB中TCA循环的关键酶MDH、SDH和IDH的活性(图2)。GydF4y2Ba8.GydF4y2BaD, e和f)。结果,抑制了TCA循环,减少了有机酸的产生,最终降低了代谢率,这抑制了线粒体电子传输链[GydF4y2Ba61GydF4y2Ba,影响PB的正常生理代谢(图。GydF4y2Ba8.GydF4y2Ba而PQ中MDH、SDH和IDH活性在冷胁迫下显著升高,导致柠檬酸、苹果酸和琥珀酸含量增加(图2)。GydF4y2Ba8.GydF4y2Ba).值得注意的是MDH活动增加最多。这有助于TCA循环正常运作,并为其他代谢途径提供更多的有机物。TCA循环有助于细胞的能量代谢,能量代谢相关基因的表达对逆境下植物的生长发育非常重要[GydF4y2Ba62GydF4y2Ba].通常,光合作用是植物细胞能源的主要过程。在应力下,抑制光合作用,糖酵解和TCA循环将为细胞提供能量[GydF4y2Ba59GydF4y2Ba].这些结果表明,PQ可以通过积极调节糖酵解和TCA循环途径相关基因和酶活性来应对冷胁迫。因此,揭示糖酵解和TCA循环基因的分子功能可以为植物发育提供更深入的认识。GydF4y2Ba
结论GydF4y2Ba
作为。的变体之一GydF4y2Bap.pratensis.GydF4y2Ba那GydF4y2Bap.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海比商业栽培品种更冷GydF4y2Bap.pratensis.GydF4y2Ba.在这项研究中,我们分析了生理调控和转录变化GydF4y2Bap.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海对寒冷敏感GydF4y2Bap.pratensis.GydF4y2Ba简历。冷压力下的“男爵”。我们在治疗组和对照组之间鉴定了5996和3285个DEGsGydF4y2Bap.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海和GydF4y2Bap.pratensis.GydF4y2Ba简历。' Baron ',分别具有5612个特异性基因GydF4y2Bap.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海。糖酵解和柠檬酸循环(TCA循环)相关基因,如GydF4y2Ba香港GydF4y2Ba那GydF4y2BaPFK.GydF4y2Ba那GydF4y2BaGAPDHGydF4y2Ba那GydF4y2BaPKGydF4y2Ba那GydF4y2BaSDH.GydF4y2Ba和GydF4y2BaMDHGydF4y2Ba发现,被发现参与耐寒胁迫的耐受性GydF4y2Bap.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海。进一步的研究表明GydF4y2Bap.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海可以提高相关基因的表达水平,调节糖酵解和三羧酸循环中相关酶的活性,显著增加有机酸和丙酮酸的产量,为防御冷胁迫提供更多的物质和能量,从而提高了耐冷性GydF4y2Bap.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海。因此,我们在响应于冷应力建立了糖酵解和TCA周期的假设模型(图。GydF4y2Ba10GydF4y2Ba).我们的研究不仅提供了重要的见解,在分子机制GydF4y2Bap.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海对冷胁迫的响应,也系统揭示了糖酵解和三羧酸循环关键基因和产物在冷胁迫响应中的变化,有助于耐冷育种GydF4y2Bap.pratensis.GydF4y2Ba基因型。GydF4y2Ba
方法GydF4y2Ba
植物材料和冷治疗GydF4y2Ba
种子GydF4y2BaPoa pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海(PQ)是从青海动物科学和兽医学院获得的。秦鹏周(青海动物科学和兽医学院)在2005年4月20日承担了PQ的正式识别PQ并获得了法律许可(样本No.278)。但是,没有公开的植物标本型可以存入这种材料的凭证标本目前。种子GydF4y2BaPoa pratensis.GydF4y2Ba简历。“Baron”(PB)取自北京三叶草技术开发中心(北京,中国),是一种商业品种GydF4y2BaPoa pratensis.GydF4y2Ba.这两种基因型的种子在甘肃农业大学人工气候会议上生长,兰州甘肃,中国兰州甘肃,在控制条件下:(25±1)/(20±1)°C,在16/8 H光/黑暗中循环,光密度为20-40μm·sGydF4y2Ba−1GydF4y2Ba·米GydF4y2Ba−2GydF4y2Ba,相对湿度为50-60%。2月龄幼苗移入0°C低温人工气候箱,25±1°C幼苗作为对照条件。72 h后,从三个独立的冷处理或对照分枝中收集整个叶片。室温恢复24 h后进行表型观察。所有样品均用液氮冷冻,−80℃保存,用于RNA提取和生理分析。进行三个独立的实验重复,每个重复包含三个独立的生物学重复。GydF4y2Ba
生理学和生理学分析GydF4y2BaCBFGydF4y2BaS表达水平GydF4y2Ba
相对电解质电导率(REC)的测定依据Lutts等人[GydF4y2Ba63GydF4y2Ba].采用硫代巴比妥酸法测定丙二醛(MDA)含量[GydF4y2Ba64GydF4y2Ba].采用磺基水杨酸-茚三酮法测定游离脯氨酸(Pro)含量[GydF4y2Ba65GydF4y2Ba].用蒽酮法测定可溶性糖(SS)含量[GydF4y2Ba66GydF4y2Ba].超氧自由基(OGydF4y2Ba2GydF4y2Ba·-GydF4y2Ba)通过羟胺氧化测定产生率[GydF4y2Ba67GydF4y2Ba].过氧化氢(HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba)根据Willekens等人测量。[GydF4y2Ba68GydF4y2Ba].超氧化物歧化酶(SOD, EC 1.15.1.11)活性测定GydF4y2Ba69GydF4y2Ba].根据机会和Maehly测量过氧化物酶(POD,EC 1.11.1.7)活性[GydF4y2Ba70GydF4y2Ba].根据Xu等人的研究,测定了过氧化氢酶(CAT, EC 1.11.1.6)和抗坏血酸过氧化物酶(APX, EC 1.11.1.11)的活性[GydF4y2Ba71GydF4y2Ba].C-repeat结合因子特异性引物(GydF4y2BaCBFGydF4y2Bas)是根据Zhang等人设计的[GydF4y2Ba29GydF4y2Ba].在qRT-PCR分析GydF4y2BaCBFGydF4y2Ba年代,GydF4y2Ba肌动蛋白GydF4y2Ba基因被用作内部对照[GydF4y2Ba72GydF4y2Ba,将表达式数据归一化到控制条件(设为1),采用比较阈值循环法。GydF4y2Ba
RNA提取及质量控制GydF4y2Ba
根据制造商的说明,使用Trizol®试剂(天根Biotech,北京)从叶子中提取总RNA。使用1%琼脂糖电泳监测RNA降解和污染。使用Nanodrop分光光度计(Spectramax®FACKPROPTM,SHOPLUCLICULAS设备,中国)评估RNA纯度。使用Agilent 2100生物分析仪(Agilent Technologies,Ca,USA)评估RNA完整性,并且还进一步分析了仅具有8至10的RNA完整性数(卷的RNA样品。GydF4y2Ba
Illumina cDNA文库的构建与测序GydF4y2Ba
在测试RNA样品后,使用用寡核苷酸(DT)富集MRNA。随后,使用碎片缓冲液将MRNA片段分成短片段。基于短mRNA片段,使用随机的六聚体引物来合成第一链cDNA,随后使用DNA聚合酶I和RNase H合成双链cDNA。使用AMPure XP珠粒纯化双链cDNA。E.ND.repaired, and adaptor ligation was carried out after the addition of the ‘A’ tail. Finally, PCR was performed, and the PCR products were purified using AMPure XP beads to obtain the final cDNA library. The cDNA library was constructed and sequenced using the Illumina HiSeq2500 platform by Major Biomedical Technology Co., Ltd. (Shanghai, China).
转录组组装和基因功能注释GydF4y2Ba
Illumina测序得到的原始数据通过CASAVA (v 1.70)碱基识别进行分析,然后转化为原始序列,得到原始reads。通过去除含有适配器的读片、含有5%以上模糊碱基(“N”)的读片和低质量读片(> 50% q值≤5的碱基),可以获得干净的读片。Clean reads是由Trinity (v 2.90)重新组装的(GydF4y2Bahttp://trinityrnaseq.github.ioGydF4y2Ba).从剪接的转录本序列中选取最长的转录本作为“unigene”,统计所有转录本和unigene,用于后续的生物信息学分析。GydF4y2Ba
所有装配的单基因在非冗余蛋白(NR)中进行比对和注释(GydF4y2Bahttp://www.ncbi.nlm.nih.gov/GydF4y2Ba), Swiss-Prot (GydF4y2Bahttp://www.expasy.ch/sprot/GydF4y2Ba),包含了(GydF4y2Bahttp://pfam.xfam.org/GydF4y2Ba)、同源蛋白组簇(COG) (GydF4y2Bahttp://www.ncbi.nlm.nih.gov/COGGydF4y2Ba)、基因本体论(GO) (GydF4y2Bahttp://www.geneontology.org.GydF4y2Ba)、京都基因与基因组百科全书(KEGG) (GydF4y2Bahttp://www.genome.jp/kegg/GydF4y2Ba)数据库使用BLASTx工具(v 2.2.28+), e值≤10GydF4y2Ba−5GydF4y2Ba临界点。最好的爆炸击球用于确定unigenes的序列方向。GydF4y2Ba
基因表达差异的深入分析GydF4y2Ba
将Trinity (v 2.90)剪接得到的转录组序列作为参考序列,每个样本的clean reads通过RSEM (v 1.3.1)映射到参考序列(GydF4y2Bahttp://deweylab.biostat.wisc.edu/rsem/GydF4y2Ba).通过计算每千碱基外显子模型每百万图读(TPM)的转录本来分析每个基因的表达水平。DESEQ(V 1.20.0)软件用于识别成对比较中的DEG。用假发现速率(FDR)≤0.05,鉴定治疗和对照样品之间的次数。基因与A.GydF4y2BaP.GydF4y2Ba-value (Padjust) < 0.01和log的绝对值GydF4y2Ba2GydF4y2BaDESeq发现的fold change≥1被认为是差异表达。GO富集分析采用GOseq (v 1.24.0) R包,修正了基因长度偏倚。采用Major Biomedical Technology Co., Ltd.开发的工艺对基因集中的基因或转录本进行KEGG通路富集分析。计算原理与GO函数富集分析相同。当校正p值(Padjust) < 0.05时,认为该KEGG通路显著富集。GydF4y2Ba
碳水化合物,糖酵解和TCA循环产物含量和相关酶活性的测量GydF4y2Ba
蔗糖、果糖和葡萄糖含量根据Gomes等人[GydF4y2Ba73GydF4y2Ba经过一些修改。取新鲜叶片1 g,用液氮研磨,−20℃保存至冻干。取0.5 g冻干物料于5 mL去离子水中均质。将混合物离心并过滤,得到上清液。0.2 mL上清经高效液相色谱(HPLC)分析,如Gomes等[GydF4y2Ba73GydF4y2Ba].用Gomes等人的酶法测定淀粉含量[GydF4y2Ba73GydF4y2Ba].吡啶酸含量由Schwimmer和Weston方法测定[GydF4y2Ba74GydF4y2Ba],由Anthon修改[GydF4y2Ba75GydF4y2Ba].根据Schaffer和Petreikov [GydF4y2Ba76GydF4y2Ba].根据Mustroph等人的方法测定磷酸果糖激酶(PFK)活性[GydF4y2Ba77GydF4y2Ba].丙酮酸激酶(PK)的测定依据Schweizer和Erismann [GydF4y2Ba78GydF4y2Ba].GydF4y2Ba
根据Wang等人测定柠檬酸,苹果酸和琥珀酸。[GydF4y2Ba79GydF4y2Ba].具体地,用液氮研磨1g新鲜叶子,并加入5ml乙醇。将混合物离心并通过0.45μm膜过滤,得到通过HPLC纯化和分析的上清液。在25℃下,在反相C-18柱(250mm×4.5mm,5μm,Solarbio,北京,中国)进行分离。流动相是5:95(v / v)甲醇:水和流速为0.8ml·minGydF4y2Ba−1GydF4y2Ba.在210nm下使用磷酸钾溶液(pH2.7)作为流动相,在210nm下检测有机酸。通过将它们的保留时间与已知标准进行比较来确定有机酸(柠檬酸,苹果酸和琥珀酸)的相应峰。根据Green等人测量琥珀酸脱氢酶(SDH)活性。[GydF4y2Ba80GydF4y2Ba].采用Dannel等人的方法测定苹果酸脱氢酶(MDH)活性[GydF4y2Ba81.GydF4y2Ba].异柠檬酸脱氢酶(IDH)活性根据Bergmeyer等人的方法测定[GydF4y2Ba82.GydF4y2Ba].GydF4y2Ba
定量实时PCR(QRT-PCR)验证GydF4y2Ba
为了验证RNA-SEQ数据的可靠性和准确性,选择六种基因进行QRT-PCR验证。根据制造商的说明,使用Trizol®试剂(Tiangen Biotech,北京)的两种基因型的对照组和冷组中提取总RNA。根据制造商的说明,使用Primescript™1 St Strand cDNA合成套件(Solarbio,北京)合成cDNA。根据制造商的说明,使用轻环-96实时PCR系统(Roche Life Science,Shangai BimeDical Technology,大连)的说明,使用轻的Cycl®96实时PCR系统(Roche Life Scients,Sybr®Mucomedical技术,根据制造商的说明,将CDNA稀释并扩增。反应条件为94℃,5分钟,其次为95℃的40℃,60℃,1分钟。使用2计算基因表达的相对水平GydF4y2Ba-ΔΔctGydF4y2Ba公式 [GydF4y2Ba83.GydF4y2Ba].的GydF4y2Bap.pratensis.GydF4y2Ba推定GydF4y2Ba肌动蛋白GydF4y2Ba基因被用作内源性对照[GydF4y2Ba72GydF4y2Ba].特定的引物(附加文件GydF4y2Ba7.GydF4y2Ba:表S4)采用Primer软件设计(v 6.24, Primer, Quebec City, Canada)。qRT-PCR分析包括三个独立的技术重复和三个生物学重复。GydF4y2Ba
可用性数据和材料GydF4y2Ba
Illumina原始序列数据保存在美国国家生物技术信息中心(NCBI),并可在序列读取档案(SRA)数据库(GydF4y2Bahttps://www.ncbi.nlm.nih.gov/sra.GydF4y2Ba).登录号是prjna598031(GydF4y2Bahttps://www.ncbi.nlm.nih.gov/bioproject/PRJNA598031GydF4y2Ba),其中包括12个加入条目(SRR10800767-SRR10800778)。本研究期间产生或分析的所有数据均包含在本文和it补充信息文件中。GydF4y2Ba
缩写GydF4y2Ba
- PQ:GydF4y2Ba
-
p.pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海GydF4y2Ba
- PB:GydF4y2Ba
-
p.pratensis.GydF4y2Ba简历。“男爵”GydF4y2Ba
- RNA-seq:GydF4y2Ba
-
RNA序列GydF4y2Ba
- 可见:GydF4y2Ba
-
差异表达基因GydF4y2Ba
- Kegg:GydF4y2Ba
-
京都基因和基因组百科全书GydF4y2Ba
- ROS:GydF4y2Ba
-
活性氧GydF4y2Ba
- 阿坝:GydF4y2Ba
-
脱落酸GydF4y2Ba
- DREB1:GydF4y2Ba
-
脱水反应元件结合蛋白1sGydF4y2Ba
- cbf:GydF4y2Ba
-
C-repeat绑定因素GydF4y2Ba
- MAPK:GydF4y2Ba
-
增殖蛋白激酶GydF4y2Ba
- cor:GydF4y2Ba
-
Cold-responsiveGydF4y2Ba
- DRE / CRT:GydF4y2Ba
-
脱水响应 - 元素/ C重复GydF4y2Ba
- 矩形:GydF4y2Ba
-
相对电解质电导率GydF4y2Ba
- MDA:GydF4y2Ba
-
丙二醛GydF4y2Ba
- 亲:GydF4y2Ba
-
自由脯氨酸GydF4y2Ba
- SS:GydF4y2Ba
-
可溶性糖GydF4y2Ba
- HGydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2Ba:GydF4y2Ba
-
过氧化氢GydF4y2Ba
- SOD:GydF4y2Ba
-
超氧化物歧化酶GydF4y2Ba
- 圆荚体:GydF4y2Ba
-
过氧化物酶GydF4y2Ba
- 猫:GydF4y2Ba
-
过氧化氢酶GydF4y2Ba
- APX型:GydF4y2Ba
-
抗坏血酸过氧化物酶GydF4y2Ba
- rin:GydF4y2Ba
-
RNA完整数据GydF4y2Ba
- NR:GydF4y2Ba
-
非冗余蛋白GydF4y2Ba
- 齿轮:GydF4y2Ba
-
直际蛋白质群体GydF4y2Ba
- 走:GydF4y2Ba
-
基因本体论GydF4y2Ba
- FPKM:GydF4y2Ba
-
每百万千克碎片读取GydF4y2Ba
- 罗斯福:GydF4y2Ba
-
错误发现率GydF4y2Ba
- 高效液相色谱法:GydF4y2Ba
-
高效液相色谱法GydF4y2Ba
- 香港:GydF4y2Ba
-
己糖激酶GydF4y2Ba
- PFK:GydF4y2Ba
-
磷氨基酶GydF4y2Ba
- PK:GydF4y2Ba
-
丙酮酸激酶GydF4y2Ba
- SDH:GydF4y2Ba
-
琥珀酸脱氢酶GydF4y2Ba
- MDH:GydF4y2Ba
-
苹果酸dehydrogenasGydF4y2Ba
- IDH:GydF4y2Ba
-
异柠檬酸脱氢酶GydF4y2Ba
- CSY:GydF4y2Ba
-
柠檬酸盐合成酶GydF4y2Ba
- 华:GydF4y2Ba
-
顺乌头酸酶GydF4y2Ba
- αkgdh:GydF4y2Ba
-
α酮戊二酸脱氢酶GydF4y2Ba
- SCoAL:GydF4y2Ba
-
琥珀酰基CoA合成酶GydF4y2Ba
- 嬉笑:GydF4y2Ba
-
延胡索酸酶GydF4y2Ba
- ICL:GydF4y2Ba
-
异柠檬酸裂解酶GydF4y2Ba
- QRT-PCR:GydF4y2Ba
-
定量实时聚合酶链反应GydF4y2Ba
参考文献GydF4y2Ba
- 1.GydF4y2Ba
朱建平,朱建平。植物冷胁迫驯化过程中的基因调控。方法Mol Biol. 2010; 639:39-55 ..GydF4y2Ba
- 2.GydF4y2Ba
Sharma P,Sharma N,Deswal R.植物中低温响应的分子生物学。生物散文。2005; 27:1048-59。GydF4y2Ba
- 3.GydF4y2Ba
陈志强,陈志强,陈志强,等。杉木幼苗低温驯化过程中活性氧清除剂的研究进展。低温生物学。1998;37:38-45。GydF4y2Ba
- 4.GydF4y2Ba
Hare PD, Cress WA, Staden JV。剖析胁迫过程中渗透积累的作用。植物学报1998;21:535-53。GydF4y2Ba
- 5.GydF4y2Ba
Thomashow MF。植物冷适应:冷冻耐受性基因和调节机制。Annu Rev植物Biol。1999; 50:571-99。GydF4y2Ba
- 6.GydF4y2Ba
王X,赵Q,MA C,张Z,曹H,孔Y.全球转录组概况GydF4y2Ba茶树GydF4y2Ba在寒冷的适应环境。BMC基因组学。2013;14:415。GydF4y2Ba
- 7.GydF4y2Ba
Hossain MA, Cho JI, Han M, Ahn CH, Jeon JS, An G, Park PB。abre结合的bZIP转录因子GydF4y2BaOsABF2GydF4y2Ba是稻米中非生物应激和ABA信号的正稳压因素。J植物理性。2010; 167:1512-20。GydF4y2Ba
- 8。GydF4y2Ba
张强,姜宁,王光良,洪勇,王铮。水稻冷感知及冷响应网络研究进展。作物科学技术,2013;1:104。GydF4y2Ba
- 9。GydF4y2Ba
谢g,kato h,sasaki k,Imai R.一种冷诱导的米饭稻草,GydF4y2BaOsTrx23GydF4y2Ba的激酶活性负调控GydF4y2BaOsMPK3GydF4y2Ba和GydF4y2BaOsMPK6GydF4y2Ba体外。2月。2009;583:2734-8。GydF4y2Ba
- 10.GydF4y2Ba
李建军,李建军,李建军,等。植物对脱落酸和非生物胁迫的耐受性。植物学报2016;7:571。GydF4y2Ba
- 11.GydF4y2Ba
Peleg Z,Blumwald E.激素平衡和作物植物中的非生物胁迫耐受性。CurrOp植物BIOL。2011; 14:290-5。GydF4y2Ba
- 12.GydF4y2Ba
Carvallo Ma,Pino Mt,Jeknic Z,Zou C,Doherty CJ,Shiu Sh,Chen Th,Thomashow MF。三种植物种类的低温转录om和CBF调节件的比较:GydF4y2Ba茄属植物commersoniiGydF4y2Ba那GydF4y2BaSolanum Tuberosum.GydF4y2Ba,GydF4y2Ba拟南芥GydF4y2Ba.中国生物医学工程学报。2011;62(11):3807-19。GydF4y2Ba
- 13.GydF4y2Ba
谢泰,李振堂,杨鹏,赵丽玲,张洋洋,王永春,陈敏敏。2002。异质表达的GydF4y2Ba拟南芥GydF4y2BaC-重复/脱水响应元件结合因子1基因赋予转基因番茄中的冷却和氧化应力升高。植物理性。2002; 129(3):1086-94。GydF4y2Ba
- 14.GydF4y2Ba
Pitzschke A,Schikora A,Hirt H. Mapk级联信号线在植物防御中。CurrOp植物BIOL。2009; 12:421-6。GydF4y2Ba
- 15.GydF4y2Ba
塔尔科夫斯基,范登电子公司。可溶性糖引发的耐寒性:一个多方面的对策。植物科学学报2015;6:203。GydF4y2Ba
- 16.GydF4y2Ba
Wang X, Elling AA, Li X, Li N, Peng Z, He G, Sun H, Qi Y, Liu XS, Deng X.全基因组和器官特异性的表观遗传修饰及其与mRNA和小RNA转录组的关系。植物细胞。2009;21:1053 - 69。GydF4y2Ba
- 17.GydF4y2Ba
王敏,张新宁,刘建华。基于深度测序的三叶橙转录组特征分析(GydF4y2Baponcirus trifoliataGydF4y2Ba(l)raf。)响应冷应激。BMC基因组学。2015; 16:555。GydF4y2Ba
- 18.GydF4y2Ba
Mousavi S,Alisoltani A,Shiran B,Reparahi H,Ebrahimie E,Imani A,Houshmand S. de Novo转录组组装和差异表达基因的比较分析GydF4y2BaPrunus Dulcis.GydF4y2Ba轧机。对冰冻压力的反应。《公共科学图书馆•综合》。2014;9 (8):e104541。GydF4y2Ba
- 19。GydF4y2Ba
Moliterni VMC,巴黎R,Onofri C,Orrùl,Cattivelli L,Pacifico D,Avanzato C,Ferrarini A,Delledonne M,Mandolino G.响应低温β寻常蛋白的早期转录变化。Planta。2015; 242(1):187-201。GydF4y2Ba
- 20.GydF4y2Ba
关键词:HD2B组蛋白去乙酰化酶(histone deacetylase, HD2B),种子休眠GydF4y2Ba拟南芥GydF4y2Ba.工厂J. 2013; 74:815-28。GydF4y2Ba
- 21.GydF4y2Ba
关键词:胁迫响应,转录组,转录组学GydF4y2Ba栽培稻GydF4y2Ba和GydF4y2Ba拟南芥GydF4y2Ba.BMC Plant Biol. 2010;10:262。GydF4y2Ba
- 22.GydF4y2Ba
Fenza MD,Hogg B,Grant J,Barth S.玉米初级根对苗木出苗的低温的转录组反应。peerj。2017; 5(2):E2839。GydF4y2Ba
- 23.GydF4y2Ba
关键词:羊草,转录组,转录组分析,变异机制GydF4y2Ba莱姆萨山GydF4y2Ba与机械伤害相比,对脱落的反应。Plos一个。2014; 9(2):E89495。GydF4y2Ba
- 24.GydF4y2Ba
abynayake SW, Byrne S, Nagy I, Jonavičienė K, Etzerodt TP, bolt B, Asp tGydF4y2BaLolium perenne.GydF4y2Ba在两个基因分型的冷驯化过程中转录组适应不同的气候条件。BMC植物BIOL。2015; 15:250。GydF4y2Ba
- 25.GydF4y2Ba
牧师高清,福克斯SE,Rowley ER,Murray Jr,Michael TP,Mockler TC。全球基因表达分析GydF4y2BaBrachypodium distachyonGydF4y2Ba揭示了广泛的网络可塑性,以应对非生物压力。Plos一个。2014; 9(1):E87499。GydF4y2Ba
- 26.GydF4y2Ba
Malyshev AV, Henry HAL。霜冻损害和草对冬季氮素的吸收GydF4y2BaPoa pratensis.GydF4y2Ba营养生长与生殖生长的结果。植物生态。2012;213(11):1739 - 47。GydF4y2Ba
- 27.GydF4y2Ba
威尔金森jf,duff dt。抗施肥对肯塔基蓝草抗寒,颜色和生长的影响。农艺J. 1972; 64(3):345-8。GydF4y2Ba
- 28.GydF4y2Ba
周QP,Yan Hb,Han ZL,Liu WH。根瘤菌型牧草品种驯化繁殖GydF4y2BaPoa pratensis.GydF4y2BaL. var.GydF4y2BaAnceps.GydF4y2Ba俗气东西。简历。青海在高寒地区。草地学报,2008;16(4):328-35。GydF4y2Ba
- 29.GydF4y2Ba
张磊,任军,李涛,王安,谭丹。GydF4y2Ba德诺维GydF4y2Ba冷处理肯塔基蓝草(GydF4y2BaPoa pratensis.GydF4y2Ba)分析涉及耐寒性的基因。j园艺。2016; 3:182。GydF4y2Ba
- 30.GydF4y2Ba
蒙特罗帕梅洛MB,马丁巴兰科A,埃斯科瓦尔C,埃尔南德斯LE。对汞的早期转录反应:乙烯在汞诱导应激中的作用。新植醇。2014;201:116-30。GydF4y2Ba
- 31.GydF4y2Ba
Duncan Dr,Widholm JM。脯氨酸积累及其对可再生玉米愈伤组织耐寒性的影响。植物理性。1987; 83:703-8。GydF4y2Ba
- 32.GydF4y2Ba
Chinnusamy v,朱茹,朱杰克。植物基因表达的冷应力调节。趋势植物SCI。2007; 12:444-51。GydF4y2Ba
- 33.GydF4y2Ba
Plaxton WC。植物糖酵解的组织与调控。植物学报1996;47:185-214。GydF4y2Ba
- 34.GydF4y2Ba
丙酮酸及其挥发性代谢物的气相测定。环境科学与技术。2010;44(7):2454-60。GydF4y2Ba
- 35.GydF4y2Ba
作物的低温和干旱胁迫:影响、相声和潜在的管理机会。植物学报。2018;9:393。GydF4y2Ba
- 36.GydF4y2Ba
Shinozaki K,Yamaguchi-Shinozaki K,Seki M.干旱和冷应力反应中基因表达的监管网络。CurrOp植物BIOL。2003; 6:410-7 ..GydF4y2Ba
- 37.GydF4y2Ba
渗透胁迫和盐胁迫对小麦幼苗可溶性糖含量的影响。作物科学。2000;40:482-7。GydF4y2Ba
- 38.GydF4y2Ba
徐居,李谢,陈杰。枇杷中冷冻应激反应的比较转录组分析(GydF4y2Ba枇杷GydF4y2Ba)小果实。植物学报2017;130:893-907。GydF4y2Ba
- 39.GydF4y2Ba
关键词:黑麦草,果聚糖,冷驯化,代谢abstract:植物学报,2015b;6:329。GydF4y2Ba
- 40。GydF4y2Ba
付俊杰,苗永杰,邵丽华,胡天明,杨培忠。新转录组测序和基因表达谱分析GydF4y2BaElymus nutans.GydF4y2Ba冷应激。Bmc染色体组。2016;17:870。GydF4y2Ba
- 41.GydF4y2Ba
保罗·乔丹,Driscoll SP, DW律师。冷却对向日葵光合作用、碳水化合物和同化物输出量的影响。中国生物医学工程学报1991;42:845-52。GydF4y2Ba
- 42.GydF4y2Ba
下调α -半乳糖苷酶可提高转基因矮牵牛花的抗冻性。植物杂志。2003;133(2):901 - 9。GydF4y2Ba
- 43.GydF4y2Ba
曾y,yu J,Cang J,Liu L,Mu Y,Wang J,张D.冬小麦中相关关键酶的糖积累和表达水平的检测(GydF4y2BaTriticum Aestivum.GydF4y2Bal)在低温下。生物化学学报。2011;75(4):681-7。GydF4y2Ba
- 44.GydF4y2Ba
Koster KL,Lynch DV。PUMA黑麦冷驯化过程中的溶质积分和隔室。植物理性。1992年; 98(1):108-13。GydF4y2Ba
- 45.GydF4y2Ba
陈金龙,高军,张敏,蔡明杰,徐慧娟,姜建国,田志勇,王宏东。通过dSTORM成像系统定位七种主要碳水化合物在细胞膜上。Sci众议员2016;6:30247。GydF4y2Ba
- 46.GydF4y2Ba
McKersie BD, Leshem YY。栽培植物的应激和应激应对。卷4。Dordrecht: Kluwer学术出版社;1994.GydF4y2Ba
- 47.GydF4y2Ba
王志强,王志强,王志强,等。一种新的水稻液泡反转运蛋白的超表达GydF4y2Baosarp.GydF4y2Ba提高烟草的耐盐性。植物生理学杂志。2008;49:880-90。GydF4y2Ba
- 48.GydF4y2Ba
王泽,李FM,熊YC,徐公会。在渐进式土壤干燥过程中,冬小麦冬小麦介导的土壤 - 水阈值范围和耐旱耐受。J工厂增长调节。2008; 27:309-19。GydF4y2Ba
- 49.GydF4y2Ba
Berg JM,Tymoczko JL,Stryer L.糖酵解和葡糖生成。生物化学第7 edn,Wh Whe Freeman;2010年。GydF4y2Ba
- 50。GydF4y2Ba
张杰,张y,杜伊,陈Sy,唐人力。烟草的动态代谢响应(GydF4y2Ba烟草GydF4y2Ba盐胁迫对植物的影响。蛋白质组学杂志2011;10(4):194 - 194。GydF4y2Ba
- 51。GydF4y2Ba
Hamilton CA Good AG Taylor GJ。铝诱导抗铝小麦液泡ATP酶和线粒体ATP合酶的研究。植物杂志。2001;125:2068 - 77。GydF4y2Ba
- 52。GydF4y2Ba
王志强,徐学勇,龚QQ,谢超,范伟,杨建林,林群生,郑淑娟。利用iTRAQ对水稻根蛋白质组的研究,为植物对铝胁迫的耐受机制提供了综合认识。J蛋白质组。2014;98:189 - 205。GydF4y2Ba
- 53.GydF4y2Ba
安德森·勒,卡罗尔·AA。在豌豆叶片发育中的木质部管状分子的次生细胞壁加厚中存在7种碳代谢酶,其中包括3种卡尔文循环同工酶。acta botanica yunnanica(云南植物研究),2004;GydF4y2Ba
- 54.GydF4y2Ba
短句来源差P, Gemes K, Horvath F, Szepesi A, Simon ML, Tari I.生根培养基处理水杨酸干扰气孔响应,COGydF4y2Ba2GydF4y2Ba提高番茄固着率和碳水化合物代谢,降低后续盐胁迫的有害影响。植物医学杂志。2011;13(1):105 - 14所示。GydF4y2Ba
- 55.GydF4y2Ba
Jang Jc,Leon P,Zhou L,Sheen J. Hexokinase作为高等植物中的糖传感器。植物细胞。1997; 9(1):5-19。GydF4y2Ba
- 56.GydF4y2Ba
pep羧化酶活性:在盐胁迫下C-4和C-3物种中的作用比较。作物学报,2010;196(3):185-92。GydF4y2Ba
- 57.GydF4y2Ba
关键词:荷花,种子发育,初级代谢,蛋白质组学,蛋白质组学GydF4y2BaNelumbo NuciferaGydF4y2Ba).前植物SCI。2016; 7:750。GydF4y2Ba
- 58.GydF4y2Ba
光合作用和异养植物组织中三羧酸循环的代谢控制和调节。植物学报。2012;35(1):1 - 21。GydF4y2Ba
- 59.GydF4y2Ba
Fernie AR, Carrari F, Sweetlove LJ。呼吸代谢:糖酵解、三羧酸循环和线粒体电子运输。植物学报。2004;7(3):254-61。GydF4y2Ba
- 60。GydF4y2Ba
吴ZG,江W,陈股,曼联,陶祖,江慈思。寒冷转录组和代谢物的见解GydF4y2Ba石斛兰officinaleGydF4y2Ba:冷适应过程中代谢和基因调控网络的全球重新编程。植物学报2016;7:1653。GydF4y2Ba
- 61。GydF4y2Ba
吴德志,蔡光国,陈明明,叶立忠,陈振华,张海涛,戴飞,吴福彬,张桂平。野生和栽培大麦对盐胁迫的组织代谢响应。《公共科学图书馆•综合》。2013;8 (1):e55431。GydF4y2Ba
- 62。GydF4y2Ba
Avin Wittenberg T, Tzin V, Angelovici R, Less H, Galili gGydF4y2Ba拟南芥GydF4y2Ba植物应激和营养线索。工厂j . 2012, 70(6): 954 - 66。GydF4y2Ba
- 63。GydF4y2Ba
Lutts S,Kinet J,Bouharmont J.Nacl诱导米饭中的衰老(GydF4y2Ba栽培稻GydF4y2BaL.)盐度抗性不同的栽培品种。Ann Bot。1996年; 78:389-98。GydF4y2Ba
- 64。GydF4y2Ba
Dhindsa RS, Plumb-Dhindsa P, Thorpe TA。叶片衰老:与膜透性和脂质过氧化水平升高,超氧化物歧化酶和过氧化氢酶水平降低有关。中国农业大学学报(自然科学版);GydF4y2Ba
- 65.GydF4y2Ba
贝茨LS,Waldren RP,Hinde ID。快速测定水应激研究的游离脯氨酸。植物土壤。1973; 39:205-7。GydF4y2Ba
- 66.GydF4y2Ba
Buysse J,Merckx R.改进的比色法量量化植物组织的糖含量。J Exp Bot。1993年; 44:1627-9。GydF4y2Ba
- 67.GydF4y2Ba
ELSTNER EF,Heupel A.抑制亚硝酸亚硝酸钙的形成:超氧化物歧化酶的简单测定。肛门生物化学。1976; 70:616-20。GydF4y2Ba
- 68.GydF4y2Ba
Willekens H,Chamnongpol S,Davey M,Schraudner M,Langebartels C,Montagu MV,inzéd,营地WV。过氧化氢酶是H的水槽GydF4y2Ba2GydF4y2BaO.GydF4y2Ba2GydF4y2BaC3植物中的压力防御是必不可少的。Embo J. 1997; 16:4806-16。GydF4y2Ba
- 69.GydF4y2Ba
Giannopolitis CN,ries sk。超氧化物歧化酶:I.在高等植物中发生。植物理性。1977年; 59:309-14。GydF4y2Ba
- 70。GydF4y2Ba
机会b,maehly ac。测定过氧化氢酶和过氧化物酶。方法酶。1955; 2:764-75。GydF4y2Ba
- 71。GydF4y2Ba
徐海霞,杨勇,谢林,李晓燕,冯超,陈建伟,徐家杰。枇杷冷冻反应中多种脱水素的参与(GydF4y2Ba枇杷GydF4y2Ba).Plos一个。2014; 9:E87575。GydF4y2Ba
- 72。GydF4y2Ba
Niu KJ,Shi Y,MA HL。肯塔基蓝草中基因表达分析的候选参考基因的选择(GydF4y2BaPoa pratensis.GydF4y2Ba在非生物胁迫下。前面。植物科学。2017 b; 8:193。GydF4y2Ba
- 73。GydF4y2Ba
Gomes HT, Bartos PMC, Silva CO, Do Amaral LIV, ScherwinskiPereira JE。非洲油棕体细胞胚胎发生获取和发育阶段的比较生化分析(GydF4y2BaElaeis Guineensis.GydF4y2Bajacq。)。植物生长调节。2014; 74(2):199-208。GydF4y2Ba
- 74。GydF4y2Ba
Schwimmer S, Weston WJ。洋葱的风味和气味,丙酮酸在洋葱中的酶促发展作为刺激性的衡量。[J] .农业食品化学学报,1961;9(4):301-4.]GydF4y2Ba
- 75。GydF4y2Ba
洋葱丙酮酸测定法。中国农业科学。2003;83(12):1210-3。GydF4y2Ba
- 76。GydF4y2Ba
陈志强,陈志强,陈志强,等。番茄果实中果糖含量对果糖激酶和蔗糖合酶活性的影响。杂志。1997;101(4):800 - 6。GydF4y2Ba
- 77.GydF4y2Ba
水稻磷酸果糖激酶基因家族及其在缺氧胁迫下的表达。植物科学学报,2013;4(7):125。GydF4y2Ba
- 78.GydF4y2Ba
Schweizer P,Erismann Kh。硝酸盐和铵营养非染色的影响GydF4y2Ba菜豆GydF4y2BaL.关于磷酸丙酯羧化酶和丙酮酸激酶活性。植物理性。1985; 78(3):455-8。GydF4y2Ba
- 79.GydF4y2Ba
王颖,马飞,李敏,梁丹,邹建军。干旱条件下猕猴桃植株对外源ABA的生理响应。植物生长规律。2011;64(1):63-74。GydF4y2Ba
- 80。GydF4y2Ba
格林JR,诺斯科特DH。玉米根冠细胞膜生产黏液多糖过程中合成的聚戊烯酰磷酸糖(GydF4y2BaZea Mays.GydF4y2Ba).Biochem J. 1979; 178:661-71。GydF4y2Ba
- 81。GydF4y2Ba
Dannel F,Pfeffer H,Marschner H.从向日葵叶中分离起泡液及其用于研究氮气供应对胚乳pH的影响。J植物理性。1995年; 146(3):273-8。GydF4y2Ba
- 82。GydF4y2Ba
生化试剂用酶:己糖激酶。方法酶肛门。1974;1:473。GydF4y2Ba
- 83。GydF4y2Ba
Livak KJ,Schmittgen TD。使用实时定量PCR和2Δ/Δ(CT)方法分析相对基因表达数据。方法。2001; 25:402-8。GydF4y2Ba
确认GydF4y2Ba
我们感谢青藏高原优质牧草种质重点实验室提供的种子GydF4y2BaPoa pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海。GydF4y2Ba
资金GydF4y2Ba
这项工作受青海省科技部门重点实验室发展专项项目“高级饲料地质重点实验室”(青藏高原高级牧草状种子“(2020-ZJ-Y03)。资金机构没有参与数据的设计和收集,分析和对数据的解释以及写作稿件。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
HM和XM构思了这项研究。WD和CZ进行了实验。HJ协助进行数据分析。WD写了手稿。HM和HJ对我们的工作和手稿做出了有益的评论。所有作者阅读并批准了最终的手稿。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
作者声明不存在利益冲突。GydF4y2Ba
附加信息GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
补充信息GydF4y2Ba
附加文件1:表S1。GydF4y2Ba
RNA测序数据概述。GydF4y2Ba
附加文件2:表S2。GydF4y2Ba
普通野豌豆转录组集合的概要统计。GydF4y2Ba
附加文件3:表S3。GydF4y2Ba
NR、Swiss-Prot、PFAM、COG、GO和KEGG数据库中unigenes的功能注释GydF4y2Ba
附加文件4:图S1。GydF4y2Ba
组装转录组的功能注释。(GydF4y2Ba一种GydF4y2Ba)物种分布top BLAST命中;(GydF4y2BaB.GydF4y2Ba) GO功能类别图;(GydF4y2BaCGydF4y2Ba) COG功能分类图。GydF4y2Ba
附加文件5:图S2。GydF4y2Ba
冷应力下PQ与PB之间的DEGs的GO注释。GydF4y2Ba
附加文件6:图S3。GydF4y2Ba
PQ的KEGG通路分类(GydF4y2Ba一种GydF4y2Ba)和Pb(GydF4y2BaB.GydF4y2Ba).GydF4y2Ba
附加文件7:表S4GydF4y2Ba
.用于QRT-PCR的引物列表。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba.创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
董伟,马旭东,蒋海峰。GydF4y2Ba等等。GydF4y2Ba生理和转录组分析GydF4y2BaPoa pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海对冷胁迫的响应。GydF4y2BaBMC植物杂志GydF4y2Ba20.GydF4y2Ba362(2020)。https://doi.org/10.1186/s12870-020-02559-1GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-020-02559-1GydF4y2Ba
关键词GydF4y2Ba
- 冷应激GydF4y2Ba
- Poa pratensis.GydF4y2Bavar。GydF4y2BaAnceps.GydF4y2Ba简历。青海GydF4y2Ba
- 表型和生理变化GydF4y2Ba
- 转录组GydF4y2Ba
- 差异表达基因GydF4y2Ba