摘要
背景
为进一步了解春小麦花期籽粒减产的生理机制,对3个基因型进行了研究1(先进的线),L2(vorobey)和l3.(PunJab-11)]在受控温室条件下研究了在田间干旱下的产量潜力,通过预扣灌注,在开花期施加干旱胁迫,直到所有植物可用水耗尽,而含水量的对照植物保持在95%罐水持有能力。
结果
与基因型L相比1和L2,在基因型L中发现晶粒数(NGS),谷物产量(GY)和收获指数(HI)的显着降低3.,主要是由于其在干旱下的核心流产(KA)。观察到与NGS和HI两种NGS和HI的叶麦脱石岩还原酶(MDHAR)的显着正相关。相反,谷胱甘肽S-转移酶(GST)和真空转化酶(VAVINV)的显着负相关性在源极和水槽内被发现用NGS和HI。同样地,注意到叶脱离酸(ABA)与NGS的显着负相关。此外,叶醛糖酶和细胞壁过氧化物酶(CWPOX)活性显着且正相关,与千粒重量(TKW)有关。
结论
可以选择与产率性状和叶片醛糖酶和CWPOX的更高活性相关的不同的生理标志物作为预测生物标志物,用于更高的TKW。此外,叶片内的MDHAR的更高活性可以选择作为在干旱下小麦中的较高NGS的预测生物标志物。然而,可以选择叶子和穗内的疫苗和GST的降低活性作为较高的NGS和HI的生物标志物。结果强调了抗氧化剂和碳水化合物 - 代谢酶在小麦作物中源水槽平衡调节中的作用,其可用作生物签名,用于未来干燥气候的干旱弹性小麦基因型的育种和选择。
背景
在一项不断减少的水景中培养小麦已经提出了巨大的挑战,以满足全球粮食安全。在整个小麦生长阶段至关重要的水,但是出平坦和破裂后阶段被认为对干旱更敏感[1,2,3.]。这些阶段的有限的水可用性直接影响谷物数量和粒度,导致产量潜力严重降低[1]。过去,这种作物得到了改善[4[但是,需要了解滋生干旱弹性小麦的深入生理机制。主要是,通过闭合气孔来实现植物干旱避免。这种气孔闭合主要通过脱落酸(ABA)诱导,所述脱落酸(ABA)通过Xylem血管从根部运输到叶子,以诱导气孔闭合[5]。在干旱条件下具有高产潜力的植物基因型经常调节气孔以保持较高的光合速率,同时降低蒸腾速率,因此水分利用效率的提高导致生物量和粮食产量的减少较少[6,7]。
众所周知,干旱下的光合作用降低与叶子的改性碳水化合物代谢相关[8,9]。另一方面,有报道称干旱胁迫下生殖组织中碳水化合物代谢受损导致库强度降低[10]。在干旱条件下,有限的碳供应造成了库器官之间的竞争,从而导致库强度和产量降低[11]。一些关键的代谢酶已经报道了它们在源和库糖转化中的重要作用。这些酶在非生物耐受性方面的作用也得到了证实。Albacete等[12]发现过表达细胞壁转化酶基因(CIN1)可以提高植物对干旱胁迫的适应能力。在严重干旱胁迫条件下,当很少或没有光合产物被合成或转移到发育中的碳汇时,细胞壁转化酶(cwInv)活性可能会下降[12,而植物可能转而利用储存的碳水化合物来满足它们的能量需求[13,14]。该响应可以与其他转化酶的增加的活性相关,如细胞质(CytinV)和真空转化酶(VacinV),该逆转酶(vacinV),该设施从源源中的光氧化源的重新化[15]。VacInv在糖的储存中发挥作用,较高的VacInv活性刺激储存的碳水化合物重新进入生殖器官,这是正常植物生长所必需的[16]。通过有助于细胞扩张,棉纤维的速度较高,较高的疫苗活性与棉纤维更快17]。VacinV的过度表达在棉花中增加气孔开口,表明疫苗病在气孔调节中的作用[18]。在拟南芥,有报道称,在干旱和盐胁迫下,通过增加vacInv活性来调节渗透势[19]。类似地,ABA诱导的真菌活性的增加有助于六糖累积,因此玉米叶片渗透调节[20.]。增长A. Thaliana.未受蔗糖合酶(SuSy)缺乏的影响,但由于cytInv缺乏而严重减少,说明cytInv在协调代谢中发挥着更为重要的作用[21]。aldolase是糖酵解的重要酶在植物发育中发挥着重要作用,调节和生物和非生物胁迫耐受性[22]。在干旱胁迫下在鸡豆中发现了蛋白酶活性的减少[23],而醛缩酶的过表达在烟草增加光合速率,生长和生物量[24]。
碳水化合物的分配取决于碳库强度,而碳库强度在水分亏缺时发生变化[25]。谷物的开发需要从源源到水槽的碳水化合物的运输。在玉米中观察到由于源组织内的可溶性糖的轻微降低而导致的大量内核流产和有限的颗粒填充26]。同样,二磷酸腺苷-葡萄糖焦磷酸化酶(AGPase)的活性与籽粒灌浆有关[27.]。在干旱胁迫下,在小麦和水稻中报道了具有显影晶粒的AgPase的正相关[15] [28.],虽然在小麦的敏感基因型中报告了AgPase活性的降低[29.]。
因此,碳水化合物催化酶活性的调节响应于作物植物的源和水槽器官中的干旱将在确定生殖发育和产量方面发挥至关重要的作用。在过去,许多研究人员在含水良好和干旱条件下已经研究了个体酶的作用[12,19,30.]然而,受干旱胁迫影响的小麦产量构成因素与源库碳水化合物代谢之间的整体相关性仍不清楚,值得进一步研究。
干旱胁迫还诱导植物细胞内活性氧(ROS)的积累[31.]。植物通过酶和非酶促抗氧化剂排毒ROS。第一线的非生物胁迫耐受性包括超氧化物歧化酶(SOD),过氧化氢酶(猫),过氧化物酶(POX)和不同的研究报告了稳定的猫[32.]同时增强了SOD和POX的活性[33.,34.,35.]在压力条件下。同样地,抗坏血酸 - 谷胱甘肽循环的其他抗氧化酶,例如单羟基血基酸盐还原酶(MDHAR),脱氢原料还原酶(DHAR)和谷胱甘肽还原酶(GR)是在非生物胁迫下维持氧化还原稳态的重要性[31.,36.]。研究报道在干旱胁迫下水稻MDHAR的活性增加,小麦干旱胁迫下增强DHAR的活性以及GR [33.,35.,36.]。此外,谷胱甘肽- s -转移酶(GST)在减少植物体内氧化损伤方面也发挥着重要作用[37.,38.]改善对不同压力的耐受性[38.]。这些抗氧化剂活性较高的植物基因型在逆境条件下有望获得更高的产量。研究已经进行,以了解这些抗氧化剂在小麦干旱胁迫中的作用[33.,35.然而,它们与碳水化合物代谢酶有关的作用可以解释旱灾耐受的机制。
在这项研究中,三个小麦基因型的反应即l1(先进的线),L2(vorobey)和l3.在控制温室条件下,通过盆栽试验在花期施加干旱胁迫,研究了干旱胁迫下产量潜力对比的(punjabl -11)。本研究旨在探讨在充足水分和干旱胁迫条件下,玉米叶片、穗部碳水化合物代谢和抗氧化酶活性特征的变化及其与产量及其属性的关系。研究结果将有助于寻找具有鉴别性的生物标志物,为今后抗旱小麦品种的选育制定策略。
结果
叶煤气交换和水关系
气孔导度(Gs)、光合速率(An)、相对含水量(RWC)和渗透势(Ψπ)。与水分充足的对照相比,干旱胁迫显著降低了Gs、An、RWC和Ψπ在所有基因型中1).基因型对于渗透调节(OA)显着不同,并且在基因型L中记录OA的最高值2而最低为以L1(表2).
叶片中碳水化合物代谢酶的活动
在对照条件下,三种基因型之间的叶片漂湿反转酶(VacinV)的活性显着差异。vacinv的最高活动被记录在l中3.和l最低1.与水分充足的条件相比,在干旱胁迫下,vacInv的活性没有显著差异。所有基因型在对照条件下表现出相似的胞质转化酶(cytInv)活性,而干旱导致胞质转化酶(cytInv)活性不显著增加。cwInv的活性在各基因型之间具有统计学相似性3.活性低于L1和L2控制条件。与水分充足的对照相比,干旱显著增强了该酶的活性(见表3)3.).
3种基因型间AGPase和UGPase活性差异显著,其中L基因型的AGPase和UGPase活性最低2与其他两种基因型相比,与水分充足的对照相比,干旱显著降低了叶片AGPase活性。干旱不影响UGPase的活性。此外,果糖激酶(FK)的活性在基因型之间存在显著差异,其中,基因型L的活性更高3.关于其他两个基因型。与含水灌注对照相比,干旱显着降低了FK的活性。六酮酶(HXK)的活性既不受基因型的影响也不受干旱;然而,水*基因型之间的相互作用显着,从0.2〜0.07 nkat g增加- 1在基因型l中观察到的fw2(表3.).
磷酸葡萄糖异构酶(PGI)、磷酸果糖激酶(PFK)活性在3种基因型间差异显著,L基因型最高3.与其他两种基因型相比。干旱不影响PGM、PGI和PFK的活性。醛缩酶活性在不同基因型间无显著差异。与水分充足的对照相比,醛缩酶活性在干旱条件下显著降低(表1)3.).
穗状花水代谢酶的活动
不同基因型之间,vacInv的活性差异显著,L3.关于l1和L2.与含水良好的对照相比,疫苗的活性不会受到干旱的显着影响。三种基因型中的细胞蛋白酶的活性在其中,在L中记录更高的活性1与其他两种基因型相比,与水分充足的对照相比,干旱条件下cytInv的活性显著增加。三种基因型中cwInv的活性相同,且不受干旱的影响(表1)3.).
在基因型之间发现AGPase活性的显着差异,L是最高的2与其他两个基因型相比,干旱对AGPase的活性没有显著影响。基因型和干旱对UGPase的活性都没有显著影响。FK和HXK的活性在基因型之间存在显著差异,其中在L2与其他两种基因型相比,干旱没有显着影响FK活性(表3.).相比之下,干旱条件下HXK的活性显著增加(表1)3.).
PGM和PFK的活性在基因型间存在显著差异,L1与其他两种基因型比较(表3.).PGI活性在不同基因型间存在显著差异,L的活性较高2.干旱对PGM和PGI活性的影响不显著。与水分充足的对照相比,干旱显著增强了PFK的活性。醛缩酶活性既不受基因型的影响,也不受干旱的影响3.).
叶片脱落酸浓度与抗氧化活性
3个基因型叶片ABA浓度差异显著,其中L2与其他两种基因型相比。与水分充足的对照相比,干旱条件下叶片ABA浓度显著升高。水分*基因型对叶片ABA浓度也有显著的交互作用,其中L基因型对ABA浓度的影响最为显著3.(表4).
基因型和干旱均未对DHAR、MDHAR和GR的活性产生统计学影响。GST基因型间差异显著,其中L基因型活性最高1与其他两种基因型相比。与水分充足的对照相比,干旱显著增加了GST的活性。同样,水*基因型的互作也很显著,从1.49 nkat g显著增加到10.27 nkat g- 1fw以基因型l记录3..基因型中POX活性的差异很大,其中在基因型L中观察到更大的活性1与其他两个相比。然而,在浇水和干旱的植物之间记录了痘痘活性的非显着差异。类似地,在基因型中的差异也显着,在基因型L中观察到CWPOX的最高活性3.与其他两种基因型相比。此外,CWPOX受干旱显着影响(表4).
脱落酸和抗氧化剂活性在峰值内
在基因型中,ABA浓度是显着的,其中最高ABA被记录在L中1与其他两种基因型相比。正如预期的那样,干旱显著增加了ABA浓度,与水分充足的对照相比。水分*基因型对穗部ABA浓度也有显著的交互作用,其中L基因型的ABA浓度因干旱而显著增加3.关于l1和L3.(表4).
GST活性的基因型中的差异是显着的,并且在基因型L中记录了最高值1和l最低3..与水分充足的对照相比,干旱显著增加了GST的活性。同样,DHAR活性在基因型间也存在显著差异,其中L2与其他两种基因型相比。GR活性在不同基因型间存在显著差异,L的GR活性最高1.水分充足和干旱胁迫下的植物DHAR和GR活性无显著差异。GR存在显著的水*基因型互作,干旱胁迫下GR活性显著降低1.痘痘的基因型中差异是显着的,并且在l中观察到最高值3..痘的活性在干旱胁迫下没有显着改变(表4).此外,任何基因型也没有显着影响CWPOX的活性。差异在MDHAR活性的基因型中是显着的,其中L的最低值2与其他基因型相比。相对于水分充足的控制,干旱没有影响MDHAR的活动(见表)4).
农艺参数
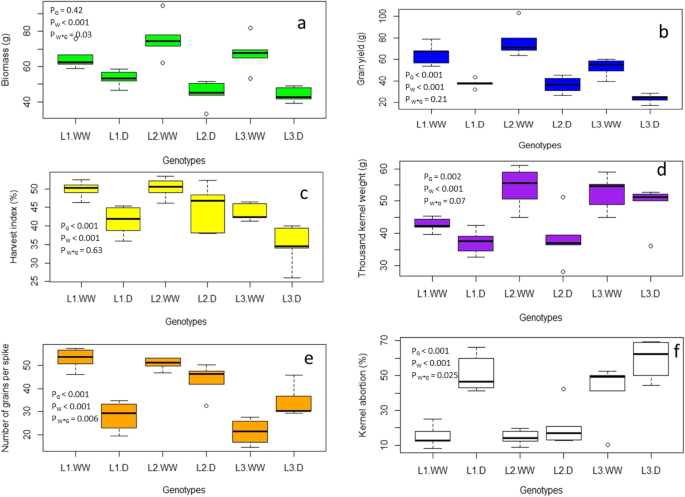
射击生物质在三种基因型中相同,而与对照相比,干旱显着降低。水*基因型在芽生物质之间存在显着的相互作用,其中干旱在植物生物质中减少了L2与其他两个基因型相比(图。1a).粮食产量罐- 13个基因型间的收获指数(HI)和GY差异显著3.有最低的gy和hi。与浇水良好的控制相比,在干旱下显着减少了GY和HI(图。2大成》)。
TKW基因型间也存在显著差异,L最高3.与浇水控制相比,干旱显着降低了TKW(图。1d)。谷物穗数- 1(NGS)在3种基因型间差异显著,其中L最高2最低的l3..此外,与浇水控制良好,干旱明显减少了NGS。另外,对NGS记录了水*基因型的显着相互作用,其中在基因型L中发现了由于干旱引起的明显谷物减少1与l相比2和L3.(无花果。1e)。所有基因型中籽粒流产(KA)在显着不同。最高的Ka以基因型L记录3.和l最低1(无花果。1F)。与含水良好的对照相比,干旱显着增加了Ka。此外,水*基因型之间的相互作用也显着且显着的减少在l中被注意到1.
产量性状与酶活性之间的主要成分分析和组合相关性
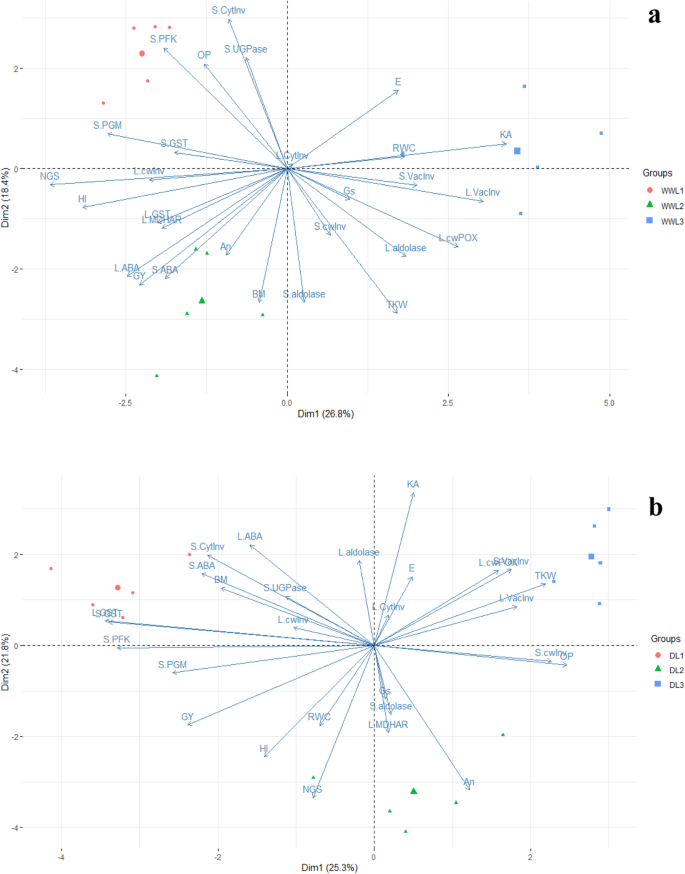
分居PCA分析了下生长良好的浇灌,进行干旱胁迫条件下可视化产量性状与酶活性之间的关联工厂。主成分1(DIM1)和主成分2(DIM2)分别描述了用于充分浇水处理变量间26.8和18.4%的变异。DIM1和DIM2的双标图分析表明NGS,GY的群集和HI更接近的,L.cwInv和L.MDHAR的活性,这些变量是在对L.vacInv,S.vacInv群集的方向相反,并L.cwPOX。S和L.aldolase的活动集群接近BM和在相反的方向上S-cytInv(图2a)干旱条件下,PC的变异率分别为25.3和21.8%1和电脑2分别(图。2b) 这些PC的双标图显示NGS、RWC、HI和GY聚集在更靠近An、Gs、s.醛缩酶和L.MDHAR的地方,并且与L.vacInv和s.vacInv、KA、TKW和L.cwPOX的方向相反。
叶片参数与产量相关性状的组合相关性
GST和Ψ与ABA呈较强的正相关(≤0.56***)πcwInv、cytInv为中等(≤0.46**),KA为弱(≤0.36**)。ABA与An、Gs、E呈强负相关(≤- 0.56***),与NGS呈中度负相关(≤- 0.46***),与醛缩酶、cwPOX、BM、GY、NGS呈弱负相关(≤- 0.36*)5).cwInv与GST、Ψ呈中度正相关π.TKW为强阴性,An、Gs、E为中阴性,醛缩酶、BM、GY为弱阴性。CytInv与An呈弱负相关。VacInv与Ψ呈弱正相关π,适度消极,HI和GY和NGS弱阴性。用CwPOX,A,GS,E,BM和TKW估计醛糖酶的强阳性相关性,并且在GY中适度和阳性,而Aldolase的相关性强并与GST和ψ负相关π.
用GS,E和TKW测量CWPOX的中度正相关,与A和BM弱阳性。MDHAR与OA,NGS,GY和HI显示了中度和正相关的相关性。GST的相关性强烈且阴性与NGS,TKW和HI的中等和阴性,中等和阴性。负ψπ除了KA之外,与大多数产量相关性状显示负相关。然而,这种相关性与A,GS,E,BM,GY和HI均具有中等且弱,分别与NGS和TKW中等。OA的强烈和正相关估计是弱者与NGS弱和阳性的估计。
除TKW为中等正相关外,大多数产量相关性状均与An呈强正相关。除NGS、TKW和HI为中度正相关外,Gs与An的相关性相似。An和Gs与KA呈负相关。E在NGS和HI时呈弱阳性。GY与NGS和HI呈较强的正相关,与TKW呈较弱的正相关。与GY相似,NGS与HI呈正相关。KA与GY、NGS、HI呈较强的负相关(表)5).
穗部参数与产量相关性状的相关性
ABA与GST活性呈强正相关,与PFK活性呈中度正相关,与An活性呈弱正相关。ABA与g呈中度负相关,与E呈弱负相关,与vacInv呈强正相关。据估计,vacInv与UGPase和PFK呈强正相关,与GST呈中度阳性,与PGM呈弱阳性。CytInv与醛缩酶、An、BM、GY、TKW呈弱负相关。vacInv与KA呈弱正相关,与PGM、BM、GY、HI呈弱负相关(表)6).
UGP酶表现出中等和消极与千粒重和弱的和负面的有。PGM和磷酸果糖激酶的强负相关性与千粒重估计。PFK也表现出较强的和消极与千粒重中等和消极用,GS和BM和弱和消极与E和GY。醛缩酶表现出与弱,但与GST负弱的正相关关系。GST的强负相关用,GS,E,BM和GY与NGS,千粒重和HI中等负估计。
讨论
通过研究不同基因型在丰水和干旱胁迫下的产量潜力,可以更好地了解粮食产量损失的生理生化机制。在本研究中,三种基因型(L1,我2和L3.),在田间有不同的产量潜力。基因型L1和L3.分别为耐旱型和干旱敏感型2是适度耐受的(基于它们在现场的性能的中间产量潜力)。
花期干旱胁迫导致光合产物的有效性有限,从而改变了库容量[39.]降低植物生物量、产量,最终降低收获指数[40]“花期干旱”导致小麦产量下降的原因是粒数和单株粒重减少[41.,42.]。此外,叶片和穗关键碳水化合物代谢酶的修饰可能与源活性和库强度的降低有关,从而增加籽粒败育,降低千粒重[43.]。碳水化合物的有限供应和关键碳水化合物代谢酶活性的改变可能会引起植物内部进一步的修饰。此外,活性氧(ROS)的产生和通过抗氧化剂解毒是植物应对干旱胁迫的最主要机制之一[33.]。
a、OA与HI的相关性
众所周知,干旱降低了作物植物的碳同化作用和光合产物供给[44.]。这种有限的同时光合酸盐还可以修改两个来源中的关键碳水化合物新陈代谢的动态到水槽器官[45.]。在干旱条件下,叶片光合作用、气孔导度和蒸腾速率均显著降低。An的降低可能是由于来源限制导致小麦基因型籽粒产量下降的原因。渗透调节(OA)是植物在干旱胁迫下适应的重要机制[46.]。Moinuddin等。[47.研究表明,干旱条件下,小麦籽粒产量与OA呈正相关。相比之下,我们的结果显示L的OA更高2没有缓解干旱胁迫引起的粮食产量。植物在干旱下渗透地调节的高能力可以帮助植物在压力期间存活,然而,可以降低OA往往导致代谢成本的产量[48.]。同意以前对OA的更高代谢要求的调查结果,我们发现与OA的强烈正相关(表5),表明较高的An可能有助于较高的OA。HI描述了光合产物按干质量划分为生殖部分的过程。L有较高的An和HI2与其他两种基因型比较(表1和无花果。1C分别表示光合素对HI的贡献的重要作用。符合此,伯爵和戴维斯[49.[由于在干旱条件下玉米的光合活性辐射供应有限,报告了一个降低的嗨。通过碳水化合物代谢酶的活性进一步研究A和HI之间的关系。
HI与叶片ABA浓度及碳水化合物代谢酶活性的相关性
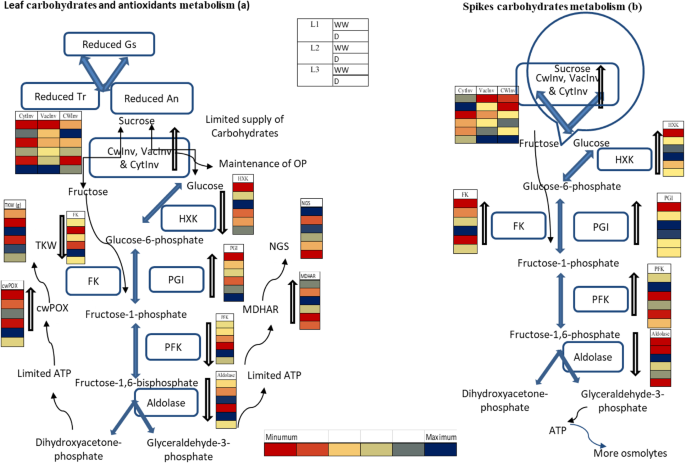
首先,在干旱条件下,叶片中碳水化合物代谢酶的活性降低,穗中的活性增加(醛缩酶和转化酶除外)。ABA与cwInv呈正相关(表1)5), Ji等也报道了类似的结果[50.],在干旱胁迫条件下,ABA浓度较高,vacInv活性较高,说明ABA浓度较高可能对转化酶活性有调节作用。几项研究报道,质体、细胞质和液泡内碳水化合物的亚细胞代谢参与应激相关反应[51.,52.]。Yamada等人报道了vacInv在干旱条件下的更高活性[19与此同时,我们还记录了干旱条件下vacInv的更高活性。另一方面,叶片中转化酶活性的增加会导致己糖的积累,从而导致更负的Ψπ正如L的情况一样3.在本研究中(表格3.&2分别;表格5).在Ψ之间估计了相似的相关性和更密切的双图关联π和细胞质转化酶,表明贮藏糖在干旱条件下作为渗透剂的作用(表5和图。2一种)。叶子和叶子中的低嗨和高疫苗活性;在基因型l中记录钉中的高活性3.(无花果。1C&表3.分别)。同样,最高的叶片细胞蛋白活和最低HI以相同的基因型记录,而其他基因型则为其他基因型。Roitsch和González[16据报道,在干旱胁迫条件下,真空转化酶的活性调节糖转运进入生殖零件。进一步表明蔗糖在源中水解,从而将易位减少到沉陷进入水槽中,导致降低的HI。此外,我们的实验表明,转化酶同工酶与HI的相关性(表5)为阴性,与早期的研究结果一致[53.]。总之,我们的研究结果表明,ABA累积较高与转化酶的活性相关,这可以指示ABA调节转化酶活性的功能。然而,增加的转化酶活性可能无法促进研究的基因型中的增加。相反,被解放的糖被用来减少ψπ促进植物中的OA。
碳水化合物代谢酶活性与NGS的相关性
进一步研究了NGS和TKW与关键碳水化合物代谢酶活性的关联,以阐明HI反应。NGS在干旱胁迫下严重减少,最高KA记录在干旱敏感基因型L中3.中度干旱响应型L2.早期的研究经常报告干旱胁迫下的谷物数量减少[54.,55.]。Cattivelli等人[56.[报道,干旱严重影响过化学性化学作用,直接影响谷物数并最终造成粮食产量。Simkin等人。[57.[报道,通过增加光合速率/活性可以显着提高谷物产量。这里,在基因型L中记录了NGS和较高AN和NGS的显着相关性2相较于其他基因型(表5).Semenov等人。[58.由于光合作用减少,还报告了较少的颗粒。NGS与关键碳水化合物代谢酶活性的相关性研究,并通过PCA双滴度与阴影疫皮的负相关和相反的关联(表6和图。2b). L基因型的spike vacInv活性较高3.这个基因型的NGS也最低。Yamada等人[19]报道的非生物诱导型转运仪用于单糖拟南芥ESL1可能通过影响干旱条件下植物细胞中糖的积累,与液泡转化酶的活性协同调节渗透压。这进一步表明,有限的光合速率可能迫使植物在严重干旱条件下利用储存的碳水化合物,但在我们的研究中在糖酵解过程中,蔗糖通过转化酶转化为葡萄糖和果糖。己糖在HXK和FK的帮助下进一步磷酸化[59.]。在本研究中,HXK和FK的活性降低被记录在叶。酒店不配套的文献来解释我们的发现。不过,惠特克等。[60.]报道了HXK活性较高的叶片Sporobolus Stapfianus.可能对耐旱性负责。同样,Fulda等人。[61.[报道,SLFRK3,在水赤字条件下在向日葵的耐旱植物中升高了对FK活性的蛋白质。Karni和Aloni [62.]也报道了热胁迫下花药FK活性降低。这些研究虽然报道在不同的植物种类和组织中,但我们的研究和以前的文献表明,在干旱条件下糖的运输是有限的。这种有限的糖供应可能导致种子败育,导致粒数降低。下文进一步讨论了干旱条件下HI的变化与籽粒灌浆过程中关键碳水化合物代谢酶的作用。
碳水化合物催化酶与TKW的相关性
在干旱条件下维持较高的TKW是小麦高产的必要条件。在本试验中,干旱敏感型L的TKW最高,HI最低3.在干旱条件下,双批次分析表明TKW与叶片醛缩酶密切相关。单独观察到,叶片醛缩酶活性与TKW显著正相关,且通过PCA双批次更紧密相关(表1)5和图。2b)。据报道,醛糖酶在制定植物开发的理化过程中发挥关键作用[63.]和对非生物压力的反应[64.,65.,66.,67.]。在干旱下报告了aldolase的特定活动的连续下降[23]。而编码叶醛缩酶的基因过表达则提高了烟草植株的光合速率、生长和生物量产量[24]。与先前的研究结果一致,在L的观察这里叶醛缩酶和千粒重较高的活性较高3.(表3.和无花果。1d分别)。此外,Simkin等人[68研究表明,刺激sedoheptulose 1,7-二磷酸酶和果糖1,6-二磷酸醛缩酶可提高光合效率和种子产量拟南芥.同样,不同中间酶的作用I.e.e.ugpase,其是蔗糖合成/击穿的关键酶[69PGM,提供糖酵解和PFK的中间产物,可以通过变构抑制来调节糖酵解过程[70还评估了。在干旱条件下也发现了TKW与穗UGPase,PGM和PFK的负相关(表6).目前尚无相关文献证实本研究结果,但AGPase与籽粒填充呈正相关[27.,29.]。具有收缩2基因(SH2R6Hs)的玉米和水稻转基因,其编码改变的AgPase活性显示出生物质和种子重量增加[71,72]。过度的talsu i.基因显著提高了AGPase活性,与胚乳淀粉质量、每穗粒数和单粒重呈正相关[73,表明这些酶活性的改变与籽粒灌浆过程有关,从而影响籽粒TKW。
抗氧化酶与HI,NGS和TKW的相关性
为了解抗氧化酶活性在干旱胁迫下维持收获指数中的可能作用,对抗氧化酶活性与HI、NGS和TKW进行了相关性分析。在抗氧化酶中,在干旱条件下,叶和穗的GST活性均有增加4).康明斯等人。[37.]和roxas等人。[38.还报道了转基因烟草中氧化胁迫下GST的活性增加。从先前的报告中发散,随着NG的增加和叶片产量特征的叶子和穗GST显着的负相关性,记录了GST活性的降低(表格5和无花果。1e)。相比之下,注意到叶mdhar活性与嗨的正相关(表5),表明源组织中MDHAR活性较高的植物能够维持氧化还原稳态,这可能增强植物对干旱胁迫的抗性,从而维持光合HI。Melandri等[74]报道较高的DHAR活性可降低水稻中的干旱诱导的谷物产量损失。另外,叶MDHAR的活性与NGS呈正相关,表明源中该抗氧化剂的更高活性可以增强小麦植物在维持晶粒数的耐旱性(图。1E),尽管潜在的机制仍然未知。与我们的结果一致,Sudan等人[75据报道,在干旱胁迫下增加了MDHAR表达和酶活性。同样,Sultana等人。[76报道过表达MDHAR有助于水稻耐盐胁迫。Eltayeb等人[77[报道烟草中Mdhar基因的过表达参与干旱条件下的渗透胁迫耐受性。
此外,本研究还发现叶片cwPOX和醛缩酶与TKW之间存在正相关关系和更密切的双图关联(表)5和图。2一种)。Veljovic-Jovanovic等人报告了干旱下的痘的活性更高。[78[Devi等人的工作[33.],表明干旱条件下较高的POX活性有助于维持小麦产量。我们的结果与先前支持叶片cwPOX活性更高的研究结果一致(见表2)5)这可能是TKW减少的原因。这些发现解释说,植物可以通过维持Mdhar和Cwpox的更高活动来维持NGS和TKW。
结论
本研究结果表明,花期干旱胁迫抑制了光合作用,进而降低了源活性和光合产物对库的供应。这种有限的光合产物供应可能导致小麦基因型中NGS和TKW的减少。基因型L1在充分浇水和受控条件下保持较高的粮食产量,主要是由于维持较高的NGS、RWC和ψπ虽然基因型L3.粮食产量下降主要是由于RWC减少,Ψπ干旱条件下的KA较高。源叶中的醛糖酶,MDHAR,A,GS和E的高活性可能有助于维持从源源的碳水化合物从源中重组,因此持续的NGS以及HI(图。3.),而较高的醛缩酶和cwPOX活性使植株保持较高的TKW。在干旱条件下,vacInv和GST在源和库中的高活性可能促进了渗透剂的产生,而Ψ则表明了这一点π来自源和水槽的碳水化合物易位和水槽进入糖更高的碳水化合物易位可能对NGS和TKW产生负面影响。本研究的结果提供了一些关于调节小麦籽粒产量的生物化学机制的洞察,以应对干旱胁迫,并通过生理标志物预测对干旱的不同耐受性,这些生理标志物可用作育种耐旱小麦品种的重要生物标志物,以便将来的干旱性气候培育耐旱小麦品种.
方法
植物材料及生长条件
三个基因型(L1(先进的线),L2(vorobey)和l3.选择了由墨西哥国际玉米和小麦改良中心(CIMMYT)和巴基斯坦阿尤布农业研究所(AARI)分别开发的大田条件下对比抗旱性的。基因型L1和L3.分别是耐旱性和干旱敏感性,而L2为中度干旱反应(表7).4粒种子分别播种于4盆容量升(含泥炭、泥炭、32%有机质、pH = 5.6 ~ 6.4、EC = 0.45 mS cm)的土壤中- 1),疏苗出苗1周后仅保留2株。在水分充足的条件下,每个基因型24个重复。
出苗后数天施用自动施肥(灌溉+必需养分混合)。此外,通过人工称重,每个罐子的重量都保持在同一水平面上。白天/夜间温度保持在22/16°C,白天/夜间光周期保持在16/8 h。夜间维持0.5 μmol光合有效辐射(PAR),白天维持360 μmol光合有效辐射(PAR)。相对湿度维持在55 ~ 60%。当所有植物的开花率达到50%时,使用feekes ' scale 10.3 [81[在施加干旱胁迫之前,收获了每种基因型的4个复制,以研究不同的农业生理参数。将每种基因型的剩余20份分为两组:在花出平坦的一个组合(10个罐)和其他套装(10罐)的水状态下灌溉,保存在95%罐水持续容量中。通过称重记录每罐的每日蒸散(ET)。总转移的土壤水是在95%的水持续容量(约3.2kg罐重量)的罐重量之间的变化,并且当干旱植物的蒸散量减少到良好浇水植物的10%(当罐重量为Ca时。1.6 kg).
叶子和尖刺抽样
压力在花序中施加,直到罐中的所有可用水被消耗。在基因型L.1和L2干旱治疗在基因型L期间持续了9天3.干旱治疗持续了8天。在应力期结束时,样品从浇水和压力植物中取出。选择每个植物的两个主要分蘖进行抽样。在紧紧缠绕成铝箔后,将来自每个耕断器的旗叶和来自每个耕断的连接秒,并在液氮中捕获冷冻。将这些样品保持在-80℃直至进一步用于分析抗氧化剂和碳水化合物代谢酶活性和渗透潜力。然后,收获每种治疗的5个复制,以研究其生态生理学和植物干生物量(附加文件1).
气态交流和植物水关系
叶片光合速率(AN,μmolm- 2年代- 1)和气孔电导(GS,Mol M- 2年代- 1)从11:00至14:00 H之间的完全扩展的标志叶确定,具有便携式光合系统(Licor-6400xt,Li-Cor,Ne,USA)。测量在20°C腔室温度和1500μmolm下进行- 2年代- 1光合活性辐射(PAR)和400ppm CO2在比色皿中浓度。根据Jensen等人的方法,在标志叶中测定相对含水量(RWC)。(2000)[82]。RWC计算如下:
其中FW和DW是叶鲜重和干重,分别和TW是叶肿胀重量。
为了测量渗透势(Ψπ植物组织的),包裹在铝箔中冷冻物质解冻,挤压,和一片滤纸浸入得到汁液。ψπ使用干湿计(C-52样品室,Wescor公司,Logan, UT, USA)连接到数据记录仪(Wescor的露点微电压表,型号HR-33 T)进行测定。同样,使用以下公式记录渗透调节(OA);
用于酶分析的样品提取
样本提取遵循Jammer等人的方案[30.]。简而言之,叶片和穗中除穗轴外的10个小穗在液氮中均质。用40 mM TRIS-HCl pH 7.6和3 mM MgCl组成的提取缓冲液1 ml分别提取叶片和穗部材料250 mg和500 mg2,1mM EDTA,0.1mM PMSF,1mM苯胺,14.34mmβ-巯基乙醇,24μmnadp和milliq h2在植物原料中加入O,得到透析提取液。每一个样本都要切一根透析管(每1ml样本约3- 4cm),并用标有数字的夹子密封。透析管置于冷水(4°C)中15分钟。将提取的上清按安排用移液管移入透析管。取出透析管中的气泡,然后用另一个夹子将透析管的另一端密封。同样,1毫升高盐缓冲液包括1 M Tris HCl pH 7.6, 500 mM氯化镁2,250 mm EDTA,4 M NACL,DDH2加入o以获得细胞壁提取物。
选择11种碳水化合物代谢酶,检测其在叶片和穗部组织中的活性。用透析提取液测定vacInv、cytInv、AGPase、UGPase、HXK、FK、PGM、PGI、PFK、醛缩酶活性,用细胞壁提取液测定cwInv活性。
碳水化合物代谢酶测定
Jammer等人描述的方法。[30.]用来测定转化酶的活性。在平底96孔板中加入5 μl的提取物,测定所有转化酶的活性。同时,添加5 μl 100 mM蔗糖和5 μl pH 4.5 (454 mM Na .)的反应缓冲液2HPO4在透析液和细胞壁提取物中加入pH为6.8的反应缓冲液(772 mM Na),分别测定空泡转化酶(vacInv)和细胞壁转化酶(cwInv)的活性2HPO4/ 114mM柠檬酸)被加入透析提取物中以确定细胞质转化酶(CytinV)的活性。蔗糖未加入对照。同样地,葡萄糖标准(0-50nmol)加入校准曲线。在加入蒸馏水后在37℃下在37℃下在37℃下孵育将这些板孵育30分钟,以提高50μL的总反应体积。从培养箱中除去后,将平板置于室温20分钟。200μl的神荚试剂(10 u ml- 1上帝,0.8 U ml- 1pod)和0.8 mg ml- 10.1中的ABTS M磷酸钾缓冲液,pH 在每个孔中加入7.0。在405处测量吸光度 平板阅读器的nm。Sung等人的原理[83用于确定所有逆变酶的活性。
使用Jammer等人描述的更高的通量方法测定所有剩余的碳水化合物酶活性。[30.]。因为HXK和FK的活性是按照Petreikov等人的原则确定的[84]。此外,100 mM果糖,50 mM NAD, 100 mM ATP, 3500 U ml- 1pgi,1000 u m ml- 1G6PDH(从leuconostoc肠系膜)和常见的缓冲液(由pH8.0,0.25m EDTA,0.5米MgCl组成1M Tris HCl组成。2)用于确定FK的活性。没有使用TPI,用100mM葡萄糖替换100毫米果糖以测定HXK的活性。对于UGPase和AgPase的活性,Pelleschi等人的原理。[8和Appeldoorn等人。[85使用了)。再次,葡萄糖和果糖是从控制删去。For the activity of AGPase and UGPase, common buffer, 10% BSA, 100 mM Na-PPi, 10 mM NADP, 50 mM 3-PG, 1.28 U ml- 1G6PDH从酿酒酵母,1000毫升- 1分别用PGM、50 mM ADP-Glucose(用于AGPase)和100 mM UGP-glucose(用于UGPase)测定AGPase和UGPase的活性。然而,对照样品中省略了adp -葡萄糖和udp -葡萄糖。同样,Manjunath等人的原理[86]测定PGM的活性。接着,测定PGM 1 M Tris-HCl pH 8.0, 0.5 M MgCl的活性26-bisP, 100mm Glc-1- p *, 10mm NADP, 6000 U ml- 1G6PDH(从酿酒酵母用过)。PGI的活动是以周和程的原则确定的[87]。然而,为了确定动作PGI 10MM GLC-1,6-BISP和100mM GLC-1-P *,用Fruct-6-P *和L;GLC-1-P *和FRUCT-6-P *。MasterMix使用常见缓冲区,25 mm果肉-1,6-BISP *,25 mm NADH,GPDH 2100 U ML- 1, TPI 6000 U ml- 1.另外,PFK活性测定以下Klotz的等人的原理。[88]。同样,除了共同缓冲液,100 mm果肉-6-P *,25mm Nadh,100 mm ATP,372 U mL- 1aldolase,GPDH 2100 U ML- 1, TPI 6000 U ml- 1用于PFK的活动。在对照样品中省略Fruct-6-P *作为衬底。通过Schwab等人的原理确定醛氏酶的活性。[89]。在340 nm处吸光度30分钟,在此期间监测读数/峰值的偏差,并计算nkat g FW的比酶活性- 1.GEN5 v3.04.17软件(Biotek的仪器公司)被用于测量不同的酶的吸光度。
抗氧化酶活性
Fimognari等人描述的方法。[90]用于确定不同的抗氧化剂和96孔板格式的同时,进行光度测定的活动被利用的活动。简要地说,基于吉村等人的原则确定为抗坏血酸过氧化物酶(APX)活动。[91]。反应用的是透析提取物。主混合由50毫米KPO组成4缓冲液pH 7.6, 0.25 mM抗坏血酸和0.5 mM H2O2,在290 nm处记录吸光度。控制H也是如此2O2是省略了92]。对于Aebi的过氧化度(猫)原则的活动[93)之后。主混合含有50毫米KPO4缓冲液pH 7, 0.001%消泡剂204和100mm H2O2与透析提取物混合,并在240nm处记录吸光度。同样,对于控制反应h2O2如fimognari等人所述,被省略。[90]。测定过氧化物酶(POX)或细胞壁过氧化物酶(cwPOX)的活性Polle等[94使用了)。为了测定POX活性的方法的由加西亚 - 莱莫斯等人描述。[92]再次将透析提取物与含有100%的主混合物混合 mM KPO4缓冲液pH 7,2 mM愈创木酚0.15 mM H2O2是使用。在450nm和H处测定吸光度2O2为控制反应省略。而细胞壁提取物用于测定cwPOX的活性。超氧化物歧化酶(SOD)活性测定遵循McCord和Fridovich的原理[95]。同样,透析提取液与含有50 mM KPO的主混合剂混合4缓冲液pH 7.8, 0.1 mM EDTA, 0.05 mM细胞色素c, 10 mM黄嘌呤和0.0002 U mg- 1黄嘌呤氧化酶。如fimognari等人所述,在550nm处记录吸光度。[90]。然而,黄嘌呤在对照反应中被省略了。Edwards等人谷胱甘肽还原酶(GR)的活性[96使用了)。透析提取液与含有100 mM pH为7.8的Tris HCl缓冲液、25 mM NADPH和30 mM谷胱甘肽氧化(GSSG)的主混合物混合。在340 nm处检测40 min的吸光度,对照反应省略GSSG。Dalton等人的脱氢抗坏血酸还原酶(DHAR)的活性[97)之后。再次,透析提取液与由100 mM KPO组成的主混合液混合4pH值为6.5时,减少50 mM谷胱甘肽(GSH)和50 mM脱氢抗坏血酸(DHA)。活性测定在290 nm 40 min, DHA不用于对照反应。Arrigoni等人所描述的单脱氢抗坏血酸还原酶(MDHAR)的活性[98)之后。将透析提取物与50mm KPO组成的反应混合物混合4缓冲液pH 7.2, 25 mM NADH, 5 U μl- 1抗坏血酸氧化酶(OAA)和50mM抗坏血酸盐。在340nm下测量活性40分钟,并在对照反应中省略抗坏血酸。另外,通过Li等人的原理确定谷胱甘肽S-转移酶(GST)的活性。[99]。再次将透析提取液与反应混合物(100mm KPO)混合4缓冲液pH 7.4, 50 mM GSH和2,4-二硝基氯苯(CDNB))。在334 nm处测定吸光度30分钟,CDNB不用于对照反应。
脱钙酸测定
通过使用ABA单克隆抗体(AFRC MAC252),采用酶联免疫吸附法(ELISA)测定叶片和穗样品中的ABA浓度(Asch, 2000)。
农艺性状的测量
在干旱处理结束时,每个处理的花盆都要重新浇水,直到植株成熟。根据Zadoks等人的描述确定了植物成熟期[81]。收获在成熟时完成,并记录后的特质:
- 一种)
穗粒数- 1(NGS):从每个复制中采集5个峰值,并记录它们的平均值;
- b)
从每种复制计算千粒重(TKW):千内核,其重量以克(G)记录;
- C)
内核堕胎(KA):KA使用以下公式记录:
- d)
(谷物穗数- 1/小花峰值数量- 1)× 100.
- e)
植物锅- 1(BM):每盆两株植株均从土壤水平收获,整株植株重量以克(g)表示;
- f)
籽粒产量锅- 1(GY):将罐内的穗粒打粒成粒,其重量以克(g)表示;
- g)
使用以下公式记录收获指数(HI):谷物产量(g)/生物质(g)×100。
统计分析
采用RStudio 1.0.153进行方差分析(双向方差分析),揭示基因型、水分及其交互作用对测定变量的显著性P= 0.05水平。函数性能EANALYTIC.进行了相关分析,而devtools,firecoextar.和fviz_pca_biplot被用来做之间的主成分分析和绘制biplot主成分1和主成分2“L”和“S”表明叶和峰值抗氧化剂或碳水化合物代谢酶或激素biplot图像,“L-aldolase”是用于叶醛缩酶酶和“S-aldolase”是用于醛缩酶酶。
数据和材料的可用性
在当前研究期间使用和/或分析的数据集可从相应的作者获得合理的请求。
缩写
- cwInv:
-
细胞壁转化酶
- cytinv:
-
细胞质转化酶
- vacinv:
-
在液泡转化酶
- UGP酶:
-
UDP葡萄糖磷酸化酶
- AGPase:
-
ADP-glucose磷酸化酶
- HXK:
-
己糖激酶
- 颗:
-
Fructokinase.
- 的PGM:
-
Phosphoglucomutase
- PGI:
-
Phosphoglucoisomerase
- PFK:
-
磷酸果糖激酶
- RWC:
-
相对含水量
- ψπ:
-
叶渗透潜力
- 门店:
-
穗粒数- 1
- BM:
-
植物生物量
- 千粒重:
-
千粒重
- 孔侑:
-
粮食产量
- 你好:
-
收获指数
- cwpox:
-
细胞壁过氧化物酶
- MDHAR:
-
单羟基血萎阴毛酸还原酶
- 阿巴:
-
脱落酸
- 销售税:
-
谷胱甘肽 - 转移酶
- 一个:
-
光合作用
- GS:
-
气孔电导
- E:
-
蒸腾率
参考
- 1.
Öztürk A, Aydin F.生育期水分胁迫对冬小麦某些品质性状的影响。中国农业科学,2004;190:93-9。
- 2.
Farooq M,Hussain M,Siddique Khm。在开花和籽粒灌装时期麦子的干旱胁迫。CRIT Rev Plant Sci。2014; 33:331-49。
- 3.
刘凤英,刘凤英,刘凤英。干旱条件下小麦农艺生理特性的分子标记研究。中国科学(d辑:地球科学)2020;
- 4.
Mwadzingeni L,Shimelis H,Dube E,Laing MD,Tsilo TJ。育种育种耐旱性:进步和技术。j infrogric。2016; 15:935-43。https://doi.org/10.1016/s2095 - 3119 (15) 61102 - 9.
- 5。
王文杰,张建军。干旱土壤对植物生长发育的调控。植物生理学报1991;42:55-76。
- 6。
李啊,李H,李伊,张科技通过降低气孔电导和蒸腾率来提高水利用效率,以保持抗旱小麦的耳朵光合速率。作物J. 2017; 5:231-9。https://doi.org/10.1016/j.cj.2017.01.001.
- 7.
刘芳,刘凤英,刘凤英,等。CO2浓度对小麦花期中干旱胁迫的影响。中国农业科学。2020。在出版社。https://doi.org/10.1111/jac.12442.
- 8.
Pelleschi S,Rocher JP,Prioul JL。水限制对成熟玉米叶片碳水化合物代谢和光合作用的影响。植物细胞环境。1997; 20:493-503。
- 9
Kim J- y, Mahé A, Brangeon J, Prioul J- l。玉米液泡转化酶,IVR2.,被水胁迫引起的。器官/组织特异性和表达的昼夜调节。植物理性。2002; 124:71-84。
- 10.
Setter TL,Flannigan Ba,Melkonian J.由于水资源赤字和玉米阴影而导致的内核集。农作物科学。2001; 41:1530。https://doi.org/10.2135/cropsci2001.4151530x.
- 11.
Cuartero J,Fernández-muñozR.番茄和盐度。SCI Hortic。1998年; 78:83-125。
- 12.
Albacete A,Canerero-Navarro E,GroßkinskyDK,Arias Cl,Balibrea Me,Bru R等。细胞壁转化酶基因的异位过度表达CIN1.在番茄中导致脱水避免。J Exp Bot。2015; 66:863-78。
- 13。
Marty F.植物真空。植物细胞。1999; 11:587-600。
- 14。
Sturm A.倒置。植物开发和蔗糖分区中的主要结构,功能和作用。植物理性。1999年; 121(9月):1-7。
- 15。
杨军,张军,王志强,徐刚,朱强。灌浆期水分亏缺小麦籽粒蔗糖-淀粉转化关键酶的活性。植物杂志。2004;135:1621-9。
- 16。
Roitsch T,GonzálezM.植物转化酶的功能和调节:甜美的感觉。趋势植物SCI。2004; 9:606-12。
- 17
王磊,李旭,连辉,倪东,何勇,陈旭,等。有证据表明液泡转化酶的高活性对棉花纤维和拟南芥根伸长分别通过渗透依赖和独立途径。植物杂志。2010;154:744-56。
- 18
倪达。液泡转化酶在调控中的作用拟南芥气孔开放。acta physiol植物。2012; 34:2449-52。
- 19
引用本文:Yamada K, Osakabe Y, Mizoi J, Nakashima K, Fujita Y, Shinozaki K, et al.函数分析拟南芥非糖的非生物应激诱导扩散转运蛋白。J Biol Chem。2010; 285:1138-46。
- 20.
Trouverie J, Chateau-Joubert S, Thévenot C, Jacquemot MP, Prioul JL。脱落酸或葡萄糖对玉米幼苗叶片和根系液泡转化酶的调控。足底。2004;219:894 - 905。
- 21.
Barratt DHP, Findlay K, Pike M, Wellner N, Lunn J,等。正常的生长拟南芥需要细胞质转化酶,但不需要蔗糖合酶。美国科学院学报,2009;106:13124–9。
- 22.
吕G-Y,过X-G,解L-P,解C-G,张X-H,羊Y,等人。分子表征,基因进化和果糖-1,6-二磷酸醛缩酶(FBA)基因家族在小麦表达分析(Triticum Aestivum.l .)。植物学报,2017;https://doi.org/10.3389/fpls.2017.01030.
- 23.
关键词:糖酵解酶,酶活性,基因表达Cicer Arietinum.暴露于水缺陷的压力。Appl Biochem Biotechnol。2014; 173:2241-53。
- 24.
Uematsu K,Suzuki N,Iwamae T,Inui M,Yukawa H.增加了果糖1,6-双磷酸醛糖酶,增强了烟草植物的生长和光合作用。J Exp Bot。2012; 63:3001-9。
- 25。
杨军,张军,王震,朱强,刘磊。灌浆期水分胁迫下小麦茎秆果聚糖和蔗糖代谢酶活性的变化。足底。2004;220:331-43。
- 26。
王志强,王志强,王志强,等。玉米碳水化合物的来源-库调控与碳水化合物代谢。作物科学。1991;32:751-6。
- 27。
陈志强,陈志强,陈志强,等。水稻超重穗型籽粒灌浆过程中蔗糖-淀粉转化酶的活性及其与籽粒灌浆的关系。植物保护学报2007;10:442-50。https://doi.org/10.1626/pps.10.442.
- 28。
张浩,李辉,袁磊,王志强,杨军,张建军。花后交替湿润和适度干燥对水稻弱穗蔗糖-淀粉转化关键酶活性的影响。J Exp Bot. 2012; 63:215-27。
- 29。
Kaur V, Madaan S, Behl RK。小麦adp -葡萄糖焦磷酸化酶活性与产量潜力的关系:对独立和联合高温和干旱胁迫的响应谷物Res Commun. 2017; 45:181-91。
- 30.
引用本文:Jammer A, Gasperl A, Luschin-Ebengreuth N, Heyneke E, Chu H, Cantero-Navarro E, et al.简单和稳健的测定关键碳水化合物代谢酶的活性特征的生理表型在模型和作物植物。J Exp Bot. 2015; 66:5531-42。
- 31.
胁迫下小麦植株的抗氧化反应。Genet Mol Biol. 2016; 39:1-6。
- 32.
Luna CM, Pastori GM, Driscoll S, Groten K, Bernard S, Foyer CH. H.干旱防治2O2在小麦积累,过氧化氢酶(CAT)活性和CAT基因表达。J Exp Bot。2005; 56:417-23。
- 33.
Devi R, Kaur N, Gupta AK抗氧化酶在描述小麦耐旱性方面的潜力(Triticum Aestivum.l .)。印度j生物志法生物麦子。2012; 49:257-65。
- 34.
任杰,孙丽娜,张启元,宋新世。抗旱性与抗氧化酶活性有关Cerasus humilis.幼苗。Biomed Res Int. 2016;2016:9851095。
- 35.
王征镒,李富民,熊永春,徐兵兵。土壤渐进干燥过程中,活性氧稳态调节了冬小麦土壤水分化学信号阈值范围和抗旱性。植物生长规律。2008;27:309-19。
- 36.
Park AK, Kim IS, Do H, Jeon BW, Lee CW, Roh SJ,等。单脱氢抗坏血酸还原酶的结构和催化机理粳稻.Sci众议员2016;6:33903。https://doi.org/10.1038/srep33903.
- 37。
康明斯我,科尔DJ,爱德华兹R.一种谷胱甘肽转移如谷胱甘肽过氧化物酶抗中发挥作用,以黑色草多的除草剂的作用。植物杂志1999; 18:285-92。
- 38。
Roxas vp,史密斯rk,艾伦er,allen rd。谷胱甘肽S-转移酶/谷胱甘肽过氧化物酶的过表达增强了应力期间转基因烟草幼苗的生长。NAT BIOTECHNOL。1997年; 15:988-91。
- 39。
做Pt,谨慎的m,sulpice r,cause m,fernie ar。水果载荷对番茄果皮代谢物的影响茄属植物chmielewskii血栓分流。植物理性。2010; 154:1128-42。https://doi.org/10.1104/pp.110.163030.
- 40.
Blum A.植物育种压力环境。博卡拉顿:美国:CRC媒体;1988年。
- 41.
巴拿巴B,耶格尔K,干旱和热胁迫对谷物生殖过程FEHER A.的影响。植物细胞环境。2008; 31:11-38。
- 42.
关键词:小麦,花前期,高温,干旱,产量,交互作用《粮食与社会》2010;38:514-20。
- 43.
李X,Ulfat A,Shokat S,Liu S,Zhu X,Liu F.叶片中碳水化合物代谢酶的回应与股份有限公司2小麦海拔、氮肥及其与籽粒产量的关系Environ Exp Bot. 2019; 164:149-56。https://doi.org/10.1016/j.envexpbot.2019.05.008.
- 44.
Sehgal A,Sita K,Siddique Khm,Kumar R,Oliver MJ。粮食作物种子填充的干旱或/和热应激影响:对功能性生物化学,种子产量和营养质量的影响。前植物SCI。2018; 9(11月):1705。
- 45.
刘芳,延森CR,安达信MN。干旱胁迫对大豆生殖发育早期叶片和荚果碳水化合物浓度的影响及其对荚果结实的影响。作物学报2004;86:1-13。
- 46.
萧TC。植物对水分胁迫的反应。《植物生理学月刊》1973;24:519-70。
- 47.
Moinuddin FRA, Sayre KD,雷诺兹议员水分亏缺条件下小麦渗透调节与产量的关系阿格龙j . 2005; 97:1062 - 71。
- 48.
琼斯hg。植物和小气候。环境植物生物学的定量方法。第3版。剑桥:剑桥大学出版社;2013年。
- 49.
伯爵HJ,戴维斯射频。干旱胁迫对叶片和玉米叶片叶片和整个冠层辐射的影响。Agron J. 2003; 95:688-96。
- 50。
王志强,王志强,王志强,等。水稻开花时细胞壁转化酶基因的组织特异性表达及干旱响应。acta botanica sinica(云南植物学报)2005;59:945-64。
- 51。
Fürtauer L, Weckwerth W, Nägele T.植物代谢组亚细胞分析的台式分馏程序。植物科学学报2016;7:1912。
- 52。
霍尔米勒二世、奈格尔T、奥古斯丁H、斯图茨S、威克沃思W、海耶股份公司。小鼠冷驯化过程中代谢的亚细胞重编程拟南芥.植物学报。2017;40:602-10。
- 53.
刘F,安德森Mn,Jacobsen Se,Jensen Cr。大豆的气孔控制和水利用效率(大豆(L. Merr.)。环境Exp Bot, 2005; 54:33-40。
- 54.
Dolferus R,Ji X,Richards Ra。谷物中的非生物应激和谷物数控制。植物SCI。2011; 181:331-41。https://doi.org/10.1016/j.plantsci.2011.05.015.
- 55.
张继,张某,程米,江H,张X,彭别,等。干旱对水稻和小麦农艺性状的影响:荟萃分析。int j Environ Res公共健康。2018; 15:839。
- 56.
Cattivelli L, Rizza F, Badeck F- w, Mazzucotelli E, Mastrangelo AM, Francia E, et al.;作物抗旱性的改善:从育种到基因组学的综合观点。F Crop Res. 2008; 105:1-14。
- 57.
Simkin AJ,López calcagno PE,加利福尼亚州雷恩斯。养活世界:提高光合效率以实现可持续作物生产。J Exp Bot.2019;70:1119–40。
- 58.
Semenov MA, Stratonovitch P, Alghabari F, Gooding MJ。使欧洲小麦适应气候变化。谷物科学。2014;59:45 - 56。https://doi.org/10.1016/j.jcs.2014.01.006.
- 59.
陈志强,陈志强,陈志强,等。不同形态果糖激酶和己糖激酶对马铃薯块茎发育的底物特异性和产物抑制作用。足底。1993;190:166 - 75。
- 60。
Whittaker A,Bochicchio A,Vazzana C,Lindsey G,Farrant J.叶六酮酶活性和代谢物水平的变化响应干燥耐受物种干燥Sporobolus Stapfianus.和Xerophyta VISCOSA.J Exp Bot. 2001; 52:961-9。
- 61。
Fulda S,Mikkat S,Stegmann H,喇叭R.在向日葵中干旱胁迫适应的生理学和蛋白质组学(Helianthus Annuus.l .)。植物医学杂志。2011;13:632-42。
- 62.
Karni L,Aloni B. Fructokinase和Hexokinase来自花粉谷物的甜椒(甜椒L.):高温和CO的条件下,在花粉萌发的作用可能2丰富。Ann Bot。2002; 90:607-12。
- 63.
张斌,李伟,常旭,李瑞,景瑞。干旱和热胁迫下小麦灌浆期水溶性碳水化合物有利等位基因对粒重的影响。《公共科学图书馆•综合》。2014;9:e102917。
- 64.
卢W,唐X,霍y,徐河,齐S,黄杰等。果糖1,6-双磷酸醛糖酶基因的鉴定与表征拟南芥揭示一种对非生物胁迫的不同反应的基因家族。基因。2012; 503:65-74。https://doi.org/10.1016/j.gene.2012.04.042.
- 65.
陈志强,陈志强,陈志强,等。燕麦叶绿体中醛缩酶基因的克隆与表达分析。植物学报。2000;44:487 - 498。
- 66.
Purev M, Kim MK, Samdan N, Yang D-C。一种新型果糖-1,6-二磷酸醛缩酶基因的分离党参生长状况以及该基因对非生物胁迫反应的分析。Mol Biol.2008;42:179–86。
- 67.
Sarry Je,Kuhn L,Ducruix C,Lafaye A,Junot C,Hugouvieux v等。早期回应拟南芥蛋白质和代谢物分析分析探索的细胞至镉暴露。蛋白质组学。2006; 6:2180-98。
- 68.
李志强,李志强,李志强,等。同时刺激sedoheptulose 1,7-二磷酸酶,果糖1,6-二磷酸醛缩酶和光呼吸甘氨酸脱羧酶h蛋白增加CO2同化作用、营养生物量和种子产量拟南芥.植物生物技术学报2016;15:805-16。
- 69.
Kleczkowski La,Geisler M,Ciereszko I,Johansson H. UDP-葡萄糖酸化酶。一种新蛋白质,具有新的技巧。植物理性。2004; 134:912-8。
- 70.
Sciacovelli M,Gaude E,Hilvo M,Frezza C.癌细胞的代谢改变。在:酶学中的方法。1埃德:elsevier inc;2014. p。1-23。https://doi.org/10.1016/B978-0-12-416618-9.00001-7.
- 71.
等。小麦胚乳adp -葡萄糖焦磷酸化酶活性的提高提高了种子产量。中国科学院院刊2002;99:1724-9。
- 72.
Smidansky Ed,Martin Jm,Hannah Lc,Fischer Am,Giroux MJ。通过胚乳ADP-葡萄糖聚磷酸化酶放松管制赋予水稻种子产量和植物生物质增加。Planta。2003; 216:656-64。
- 73.
康G,刘G,Peng X,Wei L,Wang C,Zhu Yj等。通过过表达细胞溶质AGP酶大亚基基因增加常见小麦的淀粉含量和粒重。植物理性生物化学。2013; 73:93-8。https://doi.org/10.1016/j.plaphy.2013.09.003.
- 74。
干旱胁迫下水稻产量稳定性的生物标志物研究。J Exp Bot. 2019; 71:669-83。
- 75。
氧化应激诱导单脱氢抗坏血酸还原酶基因的表达Eleusine coracana.植物学报。2015;21:551-8。
- 76。
Sultana S, Khew CY, Morshed MM, Namasivayam P, Napis S, Ho CL。红树林植物单脱氢抗坏血酸还原酶(AeMDHAR)的过度表达赋予水稻耐盐性。植物生理学报。2012;29(4):429 - 434。https://doi.org/10.1016/j.jplph.2011.09.004.
- 77.
Eltayeb AE,Kawano N,Badawi GH,Kaminaka H,Sanekata T,Shibahara T等人。转基因烟草中单羟基血基酸盐还原酶的过度表达赋予臭氧,盐和聚乙二醇胁迫的耐受性增强。Planta。2007; 225:1255-64。https://doi.org/10.1007/s00425-006-0417-7.
- 78.
关键词:过氧化物酶,超氧化物歧化酶,衰老,干旱Ramonda serbica.J Exp Bot。2006; 57:1759年至1768年。
- 79.
Singh S, Vikram P, Sehgal D, Burgueño J, Sharma A, Singh SK,等。通过面向影响的预育种利用小麦种质库的遗传潜力,为未来粮食和营养安全服务。Sci众议员2018;8:12527。https://doi.org/10.1038/s41598-018-30667-4.
- 80.
Hassan R, Waheed MQ, Shokat S, Rehman-Arif MA, Tariq R, Arif M,等。利用序列相关扩增多态性(SRAP)标记估计巴基斯坦小麦种质资源的基因组多样性。谷物Res Commun. 2020; 48:33-40。doi: org/https://doi.org/10.1007/s42976-019-00006-y.
- 81.
Zadoks JC,Chang TT,Konzak CF.谷物的生长阶段的十进制代码。杂草res。1974年; 14:415-21。
- 82.
Jensena Cr,Jacobsen S-E,Andersen Mn,Núñezn,安德森SD,Rasmussen L,Mogensen Vo。土壤干燥过程中藜藜(藜普藜。)叶片气体交换及水关系特征。2000; 13:11-25。
- 83。
宋淑娟,许丹平,Black CC.主动填充蔗糖库的鉴定。植物杂志。1989;89:1117-21。
- 84。
戴宁,陈志强,陈志强。天然和酵母表达的番茄果实果糖激酶酶的特性。植物化学。2001;58:841-7。
- 85。
Appeldoorn NJG, De Bruijn SM, Koot-Gronsveld EAM, Visser RGF, Vreugdenhil D, Van der Plas LHW。马铃薯块茎早期蔗糖向己糖-磷酸转化酶的发育变化。足底。1997;202:220-6。
- 86.
Manjunath S,Kenneth Lee C-H,Van Winkle P,Bailey-Serres J.玉米细胞磷酸磷素酶的分子和生化特征。在开发过程中表达和响应氧缺陷。植物理性。1998年; 117:997-1006。https://doi.org/10.1104/Pp.117.3.997.
- 87.
周锐,程磊。6-磷酸山梨醇对苹果叶片磷酸葡萄糖异构酶的竞争抑制作用。植物生理学报。2008;65:903 - 10。
- 88.
伤人增加贮藏甜菜根的糖酵解活性,但不增加可溶性糖酵解活性。采后生物技术。2006;41:48-55。
- 89.
施瓦布W,Aharoni A,拉布T,佩雷斯AG,桑斯C.胞质醛缩酶是在草莓果实催熟相关酶(阿纳纳萨草莓).植物化学。2001; 56:407-15。
- 90。
Fimognari l,dölkerr,kaselyte g,jensen cng,akhtar ss,großkinskydk等。单一的半高通量测定生理表型关键抗氧化酶活性鉴定。植物方法。2020; 16:42。
- 91。
菠菜抗坏血酸过氧化物酶同工酶在氧化应激反应中的表达。植物杂志。2000;123:223-33。
- 92。
Garcia-Lemos Am,Großkinskydk,Stokholm Ms,Lund OS,Nicolaisen MH,Roitsch TG等人。根相关的微生物社区诺登曼尼亚州:抗氧化酶和植物生长的微生物群落相互作用。前微生物。2019; 10:1937。
- 93。
过氧化氢酶的体外培养。方法Enzymol。1984;105:121-6。
- 94.
Polle A,Otter T,Seifert F.挪威云杉针叶中的质外体过氧化物酶和木质化(Picea abieS L.)。植物理性。1994年; 106:53-60。
- 95.
超氧化物歧化酶。红铜素的酶功能(血铜素)。中国生物化学杂志。
- 96.
Edwards EA,Rawsthorne S,Mullineaux PM。豌豆叶片多种形式的谷胱甘肽还原酶的亚细胞分布(Pisum sativum.l .)。Planta。1990; 180:278-84。
- 97.
Dalton da,Russell Sa,Hanus Fj,Pascoe Ga,埃文斯HJ。抗坏血酸和谷胱甘肽的酶促反应,以防止过氧化物损伤大豆根结节。PROC NATL ACAD SCI。2006; 83:3811-5。
- 98.
ARRIGONI O,Dipierro S,Borraccino G.抗坏血酸自由基还原酶,抗坏血酸系统的关键酶。费用。1981; 125:242-4。
- 99。
李z,zhen r,rea pa。1-氯-2,4-二硝基苯引发的真空谷胱甘肽-S缀合物转运活性增加。植物理性。1995年; 109:177-85。
致谢
我们也感谢萨基布·萨利姆Akhtar和刘若英Hvidberg彼得森技术帮助,以保持实验和数据收集。
宣言
作者声明他们没有利益冲突。
资金
这项工作得到沙特阿拉伯伊斯兰开发银行的资助,资助号为36/114153。资助机构在设计实验、收集、分析和解释数据以及撰写手稿方面不起作用。
作者信息
从属关系
贡献
SS和FL构思了利用DKG的智力贡献和TR的技术建议来规划这项研究的想法。SS在FL的帮助下在玻璃房子条件下进行了实验。酶和抗氧化剂的实验室工作通过TR和FL的持续建议进行。数据分析由SS、FL和DKG完成。数据由SS、DKG、TR和FL解释。手稿由SS撰写,并使用FL DKG和TR的有价值的输入进行了大量修改。所有合著者都批准了手稿的最终版本。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
没有金融和非财政竞争利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1。
实验示意图,胁迫期间不同基因型的耗水量,不同治疗和再浇水直至成熟度。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Shokat,S.,Großkinsky,D.K.,Roitsch,T.等等。在水分充足和干旱条件下生长的三个春小麦基因型,叶片和穗的碳水化合物代谢和抗氧化酶活性与产量表现有关。BMC植物BIOL.20.400(2020)。https://doi.org/10.1186/s12870-020-02581-3
收到了:
接受:
发表:
关键词
- 抗氧化活性
- 碳水化合物新陈代谢
- 干旱
- 内核堕胎
- 小麦