- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
硫化氢通过促进铁可用性和植物激素水平来减轻铁缺乏症gydF4y2Ba大豆gydF4y2Ba幼苗gydF4y2Ba
BMC植物生物学gydF4y2Ba卷gydF4y2Ba20.gydF4y2Ba文章编号:gydF4y2Ba383gydF4y2Ba(gydF4y2Ba2020.gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
硫化氢(HgydF4y2Ba2gydF4y2Ba参与调节植物的生理过程。我们研究了HgydF4y2Ba2gydF4y2Ba改善了大豆的铁(Fe)缺乏症(gydF4y2Ba大豆gydF4y2Bal .)幼苗。多学科研究方法包括生理、生化、分子和转录组方法gydF4y2Ba2gydF4y2BaS在调节大豆幼苗中的FE供货方面的作用。gydF4y2Ba
结果gydF4y2Ba
结果表明,HgydF4y2Ba2gydF4y2BaS完全防止叶片间萎缩,在Fe缺陷条件下导致大豆幼苗生物量增加。此外,H.gydF4y2Ba2gydF4y2BaS通过调节铁螯合物还原酶(FCR)活性和硫代谢相关基因表达水平来降低根染色的妊娠Fe,增加叶片和根部的Fe含量,从而促进大豆幼苗中的光合作用。另外,hgydF4y2Ba2gydF4y2Ba通过调节在Fe缺陷溶液中生长的大豆幼苗中的植物激素相关基因表达丰度来改变植物激素浓度。此外,有机酸生物合成和相关基因表达在调节H时也发挥了至关重要的作用gydF4y2Ba2gydF4y2Bas介导的大豆幼苗缺铁的缓解。gydF4y2Ba
结论gydF4y2Ba
我们的结果表明,H的Fe缺乏减轻了gydF4y2Ba2gydF4y2Ba通过增强铁的获取和同化,从而调节植物体内的激素和有机酸的合成。gydF4y2Ba
背景gydF4y2Ba
铁是植物生长发育和人类健康生活所必需的微量营养素。铁作为一种普遍的辅助因子,在光合作用、呼吸作用、激素生物合成、形态发生、细胞酶反应和植物生长发育过程中发挥着重要作用[gydF4y2Ba1gydF4y2Ba那gydF4y2Ba2gydF4y2Ba].虽然土壤中Fe含量较高,但由于氧化态Fe(III)在碱性土壤中的复合溶解度较低,作物往往难以吸收利用[gydF4y2Ba3.gydF4y2Ba].缺铁还会导致叶片脉间褪绿和叶绿素生物合成障碍,进而影响植物的光合作用和生长发育[gydF4y2Ba4.gydF4y2Ba].因此,Fe的摄取和可用性与植物生长和作物生产率密切相关。gydF4y2Ba
Fe吸收,运输和循环可以严格控制植物细胞的FE丰度[gydF4y2Ba5.gydF4y2Ba那gydF4y2Ba6.gydF4y2Ba].植物已经进化了两种不同的机制,用于从根圈获得Fe以适应Fe缺陷的环境。策略I植物物种(所有Dicots和非禾本科单子叶植物)在至少三个步骤中应对Fe缺乏:(1)质子的释放以酸化H酸化gydF4y2Ba+gydF4y2Ba-ATPase,(2)螯合肼还原酶(FCR)介导的铁螯合物还原酶活性,其催化了铁螯合物的减少到FegydF4y2Ba2+gydF4y2Ba(3)铁的吸收gydF4y2Ba2+gydF4y2Ba通过高亲和的金属转运体IRT1(铁调节转运体1),负责运输铁gydF4y2Ba2+gydF4y2Ba进入根细胞[gydF4y2Ba3.gydF4y2Ba那gydF4y2Ba7.gydF4y2Ba那gydF4y2Ba8.gydF4y2Ba].策略II植物物种(禾本科单子叶植物)对缺铁的反应分为四个步骤:(1)植物铁载体(muginetic acid, MAs)在根内的生物合成,(2)植物铁载体(PS)分泌到根际,(3)通过PSs螯合溶解土壤中不溶性铁,(4)根吸收铁-植物铁载体复合物[gydF4y2Ba9.gydF4y2Ba那gydF4y2Ba10gydF4y2Ba].gydF4y2Ba
植物在缺铁土壤中已经进化出一系列的生理和形态反应来维持铁的动态平衡。例如,basic helix-loop-helix (bHLH)作为一种转录调节元件,已被证实可以调节植物对缺铁的适应[gydF4y2Ba11gydF4y2Ba].Fe缺乏可以迅速诱导高表达水平gydF4y2BaBhlhs.gydF4y2Ba,而随后的Fe重新补充可以抑制gydF4y2BabHLHgydF4y2Ba表达[gydF4y2Ba12gydF4y2Ba].此外,铁蛋白是一种铁储存蛋白,定位于质体中,在发育和应激条件下发挥作用。此外,叶片中的铁蛋白Fe可作为含铁蛋白形成的初始库,铁蛋白的积累可维持铁的稳态,并保护铁介导的氧化应激和非生物应激[gydF4y2Ba11gydF4y2Ba那gydF4y2Ba13gydF4y2Ba].在gydF4y2Ba拟南芥gydF4y2Ba,铁蛋白由多尾族编码[gydF4y2Ba14gydF4y2Ba].在铁蛋白中,表达水平gydF4y2BaATTER1.gydF4y2Ba响应FE申请增加了[gydF4y2Ba15gydF4y2Ba].gydF4y2Ba
几种植物激素特别参与缺铁反应的过程[gydF4y2Ba11gydF4y2Ba那gydF4y2Ba16gydF4y2Ba].例如,生长素在缺铁时根系的形态变化中起着至关重要的作用,缺铁导致生长素合成增加[gydF4y2Ba17gydF4y2Ba].缺铁显著诱导乙烯过量产生,乙烯调控一系列铁获取基因的转录调控[gydF4y2Ba18gydF4y2Ba那gydF4y2Ba19gydF4y2Ba].脱落酸(ABA)通过促进铁从根向枝的运输和再分配来缓解缺铁引起的褪绿病[gydF4y2Ba20.gydF4y2Ba].此外,另外三种其他激素,包括细胞素素(CTK),茉满半酸酯(JA)和芸苔类化合物(BRS),可以负面调节植物中的Fe缺乏响应[gydF4y2Ba21gydF4y2Ba那gydF4y2Ba22gydF4y2Ba].例如,外源CTK和甲基-JA治疗明显抑制植物中Fe采集相关基因的表达水平,例如gydF4y2Ba爱好者gydF4y2Ba那gydF4y2Bafro2.gydF4y2Ba,gydF4y2Ba适合gydF4y2Ba[gydF4y2Ba21gydF4y2Ba那gydF4y2Ba23gydF4y2Ba].类似地,BRS作为类固醇激素,在植物对各种环境压力的反应中起重要作用。Wang等人。[gydF4y2Ba24gydF4y2Ba发现BR生物合成型突变体显示出与Fe缺乏的耐受性比野生型植物更高。Shen等人。[gydF4y2Ba25gydF4y2Ba]报道SA激活铁易位以适应缺铁环境。然而,其他信号分子与植物激素的相互作用是否参与了铁同化的调控尚不清楚。gydF4y2Ba
最近,许多研究表明硫化氢(HgydF4y2Ba2gydF4y2BaS)作为一种类似于一氧化氮(NO)和一氧化碳(CO)的信号分子,在植物的各种生物过程中起着重要的作用。例如,以前的研究表明HgydF4y2Ba2gydF4y2BaS促进种子萌发[gydF4y2Ba26gydF4y2Ba],减轻铜和铝胁迫的氧化损伤[gydF4y2Ba27gydF4y2Ba那gydF4y2Ba28gydF4y2Ba],抵消叶绿素损失[gydF4y2Ba29gydF4y2Ba],并通过增强甘薯幼苗叶片抗氧化酶胁迫来缓解渗透胁迫[gydF4y2Ba30.gydF4y2Ba].此外,HgydF4y2Ba2gydF4y2Ba植物中的S [gydF4y2Ba31gydF4y2Ba那gydF4y2Ba32gydF4y2Ba].H.gydF4y2Ba2gydF4y2BaS通过增强多胺和糖的生物合成来诱导抗旱性gydF4y2BaSpinacia oleraceagydF4y2Ba苗(gydF4y2Ba33gydF4y2Ba].此外,锌(Zn)毒性、镉(Cd)毒性和热应激均可被HgydF4y2Ba2gydF4y2Ba年代(gydF4y2Ba34gydF4y2Ba那gydF4y2Ba35gydF4y2Ba那gydF4y2Ba36gydF4y2Ba那gydF4y2Ba37gydF4y2Ba].H.gydF4y2Ba2gydF4y2BaS诱导气孔闭合并参与保护细胞中的脱离酸(ABA)依赖性信号通路[gydF4y2Ba38gydF4y2Ba].我们以前的研究表明hgydF4y2Ba2gydF4y2BaS增强光合作用gydF4y2BaSpinacia oleraceagydF4y2Ba苗(gydF4y2Ba39gydF4y2Ba].gydF4y2Ba
以前公布的研究表明,NO和CO通过影响植物中的FCR活性和Fe同化相关基因表达来调节Fe代谢[gydF4y2Ba11gydF4y2Ba那gydF4y2Ba18gydF4y2Ba那gydF4y2Ba40gydF4y2Ba].有趣的是,HgydF4y2Ba2gydF4y2BaS改进策略II工厂(gydF4y2Ba玉米gydF4y2Ba)通过增加根对铁的吸收和叶对铁的运输来适应缺铁[gydF4y2Ba10gydF4y2Ba].然而,与策略II植物相反,无论是hgydF4y2Ba2gydF4y2BaS参与调节策略,我植物对Fe缺乏的反应仍然不清楚。gydF4y2Ba
目前工作的目的是调查如何gydF4y2Ba2gydF4y2BaS可改善大豆幼苗缺铁现象。我们的假设是HgydF4y2Ba2gydF4y2BaS对大豆幼苗应对缺铁有有益的影响。为了检验这一假设,我们考察了HgydF4y2Ba2gydF4y2Ba使用生理和转录组织方法对大豆幼苗根系的Fe储存和可用性。gydF4y2Ba
结果gydF4y2Ba
NaHS抑制缺铁条件下的干生物量和叶绿素损失gydF4y2Ba大豆gydF4y2Ba植物gydF4y2Ba
以NaHS作为外源HgydF4y2Ba2gydF4y2BaHosoki等人所描述的S捐赠者[gydF4y2Ba41gydF4y2Ba].NaHS成功地抑制了无NaHS营养液和1μΜ Fe(III)-EDTA处理15 d大豆植株的缺铁症状(图。gydF4y2Ba1gydF4y2Baa)。相比之下,没有Nahs生长的植物变得严重褪黄。然而,在Fe - 足够的(+ Fe)条件下,NaHs对大豆生长表型的影响不显着(图。gydF4y2Ba1gydF4y2Baa). NaHS处理15 d后,与未处理相比,缺铁(−Fe)植株叶片、茎和根的干重显著增加gydF4y2Ba2gydF4y2BaS对+Fe植株的干重无影响(表1)gydF4y2Ba1gydF4y2Ba).此外,在处理15 d后,叶绿素含量显着降低,但是NaHs显着抑制了大豆叶中的Fe缺乏诱导的叶绿素损失(表gydF4y2Ba1gydF4y2Ba).此外,在+Fe条件下,NaHS也显著提高了大豆叶片叶绿素含量(表2)gydF4y2Ba1gydF4y2Ba).区分H的作用gydF4y2Ba2gydF4y2BaS来自其他含硫衍生物和钠,一系列含硫和含钠的化学物质,包括Nahs,NagydF4y2Ba2gydF4y2Ba年代,NagydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4.gydF4y2Ba,nagydF4y2Ba2gydF4y2Ba所以gydF4y2Ba3.gydF4y2Ba, NaHSOgydF4y2Ba4.gydF4y2Ba, NaHSOgydF4y2Ba3.gydF4y2Ba, NaAC (100 μM)处理缺铁条件下的大豆幼苗。缺铁处理15 d后,叶绿素含量并没有引起Na的显著增加gydF4y2Ba+gydF4y2Ba或与NaHS处理相比的其他含硫化合物处理(图SgydF4y2Ba1gydF4y2Ba).gydF4y2Ba
nahs对表型的影响(gydF4y2BaA.gydF4y2Ba),干生物量(gydF4y2BabgydF4y2Ba和gydF4y2BacgydF4y2Ba)和叶绿素含量(gydF4y2BadgydF4y2Ba和gydF4y2BaegydF4y2Ba)铁缺陷gydF4y2Ba大豆gydF4y2Ba植物。3-W老年人gydF4y2BaG. Max.gydF4y2Ba添加或不添加100 μM NaHS的1 μM Fe(III)-EDTA(−Fe)或50 μM Fe(III)-EDTA (+Fe)营养液处理15 d的幼苗,B和C分别显示了-Fe或+Fe植株的干重。D和E分别表示-Fe和+ Fe植物的叶绿素含量。误差柱代表平均值±SE。*表示在gydF4y2BaP.gydF4y2Ba< 0.05。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+ Fe + Nahs,用100μmnah和50μmfe处理的幼苗gydF4y2Ba
进一步阐明HgydF4y2Ba2gydF4y2BaS介导的Fe缺陷应力时间过程实验的改善以研究相关生理指标的动态。例如,在-Fe条件下,总干生物质在-FE条件下的NaHS处理的植物中具有明显的增加(图。gydF4y2Ba1gydF4y2Bab),并保持大致相同的高浓度叶绿素(1.2mg ggydF4y2Ba−1gydF4y2BaFW)仅在+ Fe处理下(图。gydF4y2Ba1gydF4y2Ba而在+Fe条件下,NaHS对全处理期干生物量没有显著影响,但显著提高了叶绿素含量(图2)。gydF4y2Ba1gydF4y2BaC和e)。gydF4y2Ba
Nahs治疗增加了铁积累gydF4y2Ba大豆gydF4y2Ba植物gydF4y2Ba
NaHS处理的植物中的Fe浓度明显高于对照组(在-Fe的植物中未在15d条件下(表)(表gydF4y2Ba1gydF4y2Ba).例如,与未与NaHs治疗的人相比,Fe浓度在NaHS处理的植物的叶片中增加了30%(表gydF4y2Ba1gydF4y2Ba).此外,在+Fe条件下,NaHS处理的植物根系中Fe含量增加了2倍以上,但叶和茎中的Fe含量不受NaHS的影响(表)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
NaHS调节根沐浴溶液,FCR活性和根部妊娠Fe含量的pH值,以熨斗采集gydF4y2Ba大豆gydF4y2Ba植物gydF4y2Ba
在-FE治疗的全部期间,根浴溶液的pH从7.3〜6.1大大降低,但是与单独的-Fe处理中的那些相比,NaHS处理的植物仅缓慢降低(图。gydF4y2Ba2gydF4y2Baa)。然而,在+ Fe处理下,沐浴溶液的pH在9和12d中显示出+ Fe和+ Fe + NaHS处理之间的显着差异,但在任何其他时间点没有发现显着差异(图。gydF4y2Ba2gydF4y2Bab).在-Fe处理的整个过程中,不同NaHS处理的FCR活性差异很大(图2)。gydF4y2Ba2gydF4y2Bac)。在前3天中,NaHS处理的植物中FCR活性比单独的-FE处理显着更高(图。gydF4y2Ba2gydF4y2Bac)。然而,从第6 d到试验结束,nahs处理植株的FCR活性逐渐下降(图。gydF4y2Ba2gydF4y2Bac)。在+ Fe治疗下,除了3d之外,NaHs在整个实验期间没有显着影响FCR活性(图。gydF4y2Ba2gydF4y2Bad).质外铁是植物中主要的铁库之一。在3 d和9 d, nahs处理植株的根内质铁含量分别比单独处理降低了11.1和19.8%(图4)。gydF4y2Ba2gydF4y2Bae)。在+ Fe条件下,除了12d的实验期外,Nahs并没有显着影响根部的痉挛Fe含量(图。gydF4y2Ba2gydF4y2Baf)。gydF4y2Ba
NaHS对根沐浴溶液pH的影响(gydF4y2BaA.gydF4y2Ba和gydF4y2BabgydF4y2Ba),铁螯合物还原酶(FCR)活性(gydF4y2BacgydF4y2Ba和gydF4y2BadgydF4y2Ba)和根Applast Fe含量(gydF4y2BaegydF4y2Ba和gydF4y2BafgydF4y2Ba)铁缺陷gydF4y2Ba大豆gydF4y2Ba植物。3-W老年人gydF4y2BaG. Max.gydF4y2Ba用含有1 μM Fe(III)-EDTA或50 μM Fe(III)-EDTA的营养液(添加或不添加100 μM NaHS)处理幼苗15 d, A和B分别显示了-Fe或+ Fe植物根浴液的pH值。C和D分别显示了-Fe和+ Fe植物的铁螯合还原酶(FCR)活性。E和F分别表示-Fe和+ Fe植物根质外体铁含量。误差柱代表平均值±SE。*表示在gydF4y2BaP.gydF4y2Ba< 0.05。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+ Fe + Nahs,用100μmnah和50μmfe处理的幼苗gydF4y2Ba
nahs对内源性h的影响gydF4y2Ba2gydF4y2BaS、谷胱甘肽和NPTs的含量gydF4y2Ba大豆gydF4y2Ba植物gydF4y2Ba
内源性H的高积累gydF4y2Ba2gydF4y2Ba在-Fe和+ Fe条件下观察了外源NaHS对大豆幼苗叶片和根系S的影响(表2)gydF4y2Ba2gydF4y2Ba).此外,通过在-Fe和+ Fe条件下的NaHs外源施加叶片和根部的NPT含量增加(表gydF4y2Ba2gydF4y2Ba).另外,叶片和根部的GSH含量减少5.3倍,在-FE条件下分别增加了5.3倍,14%。同样地,在+ Fe条件下,在大豆幼苗中,Nahs的GSH和根中的GSH含量得到增强(表gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
NaHS对不同基因表达影响的转录组分析gydF4y2Ba大豆gydF4y2Ba植物对缺铁的反应gydF4y2Ba
我们构建了12个样本(每个处理3个重复)的RNA-Seq文库。利用Illumina Hiseq 4000平台对这些RNA文库进行测序,共得到50,315 998(−Fe)、56,902,806(−Fe + NaHS)、60,885,868 (+Fe + NaHS)和50,140 356 (+Fe + NaHS)序列reads(表S)gydF4y2Ba1gydF4y2Ba).每个处理的数据复制率都很高,RgydF4y2Ba2gydF4y2Ba约为0.9(图SgydF4y2Ba6.gydF4y2Ba).表S概述了测序和组装的概况gydF4y2Ba1gydF4y2Ba和表S.gydF4y2Ba2gydF4y2Ba.我们汇集了短读,并将它们与大豆基因组对齐,发现大约87.31-89.19%的读数映射到基因(表SgydF4y2Ba1gydF4y2Ba).gydF4y2Ba
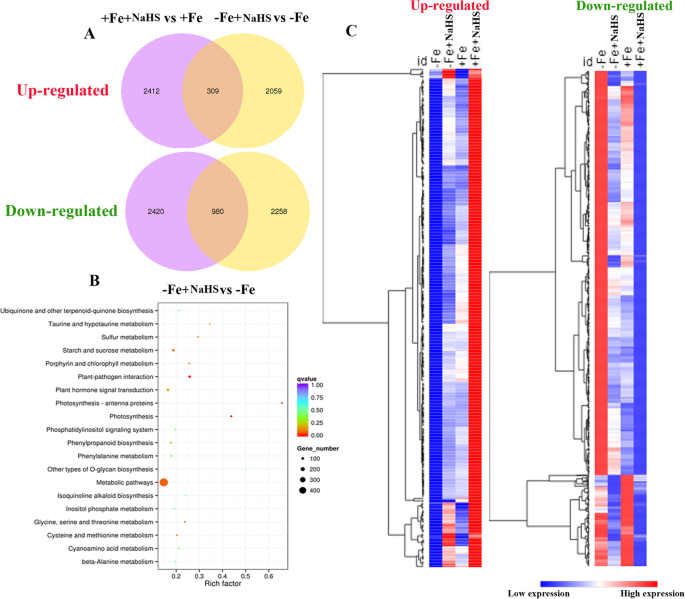
基于本研究中的12个文库的深度测序,从Fe缺乏治疗中的大豆根检测到54,718个基因,其在大豆中的至少82%的参考基因中覆盖。此外,在使用条件下,NaH的施加受影响5606℃,其中2368是上调基因,3238是下调的基因(图SgydF4y2Ba7.gydF4y2Ba同样,在+Fe条件下,NaHS调控6121个DEGs,其中2721个为上调基因,3400个为下调基因(图S)gydF4y2Ba7.gydF4y2Bab)。在这些次数中,在-FE和+ Fe条件下,分别通过NaHs共同上升和 - 在-FE和+ Fe条件下进行309和980℃。(图。gydF4y2Ba5.gydF4y2Baa)。这些上调和下调的DEG在图1中聚集。gydF4y2Ba3.gydF4y2Bac。详细信息列于表s中gydF4y2Ba5.gydF4y2Ba-gydF4y2Ba8.gydF4y2Ba.此外,为了了解DEGs的功能,我们使用KEGG通路网络来识别它们在不同代谢通路中的富集。显著富集的KEGG通路通过agydF4y2BaP.gydF4y2Ba-基于超几何分布的。例如,在-Fe条件下,NaHS处理显著富集了20条途径。KEGG通路网络分析表明,在-Fe条件下,“硫代谢”、“植物激素信号转导”、“代谢”、“卟啉和叶绿素代谢”、“半胱氨酸和蛋氨酸”等均显著富集(图2)。gydF4y2Ba3.gydF4y2Bab)。同时,去分析在图4中列出了gydF4y2Ba8.gydF4y2Ba.gydF4y2Ba
全局转录组对缺铁和NaHS治疗响应。gydF4y2BaA.gydF4y2Ba维恩图显示了NaHS处理在缺铁和缺铁条件下,根中DEGs的上调和下调gydF4y2Ba大豆gydF4y2Ba植物。gydF4y2BabgydF4y2Ba在铁缺乏条件下,NaHs治疗的基因和基因组学(Kegg)途径的特异性富集京都植物(Kegg)途径(gydF4y2BacgydF4y2Ba)在缺铁和充足铁条件下,NaHS处理对309个DEGs上调(左)和980个DEGs下调(右)的层次聚类分析gydF4y2Ba大豆gydF4y2Ba植物。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+Fe + NaHS, 100 μM NaHS和50 μM Fe处理幼苗。更多信息可在gydF4y2Ba补充材料gydF4y2Ba
NaHS调控缺铁患者体内铁稳态相关基因的表达gydF4y2Ba大豆gydF4y2Ba植物gydF4y2Ba
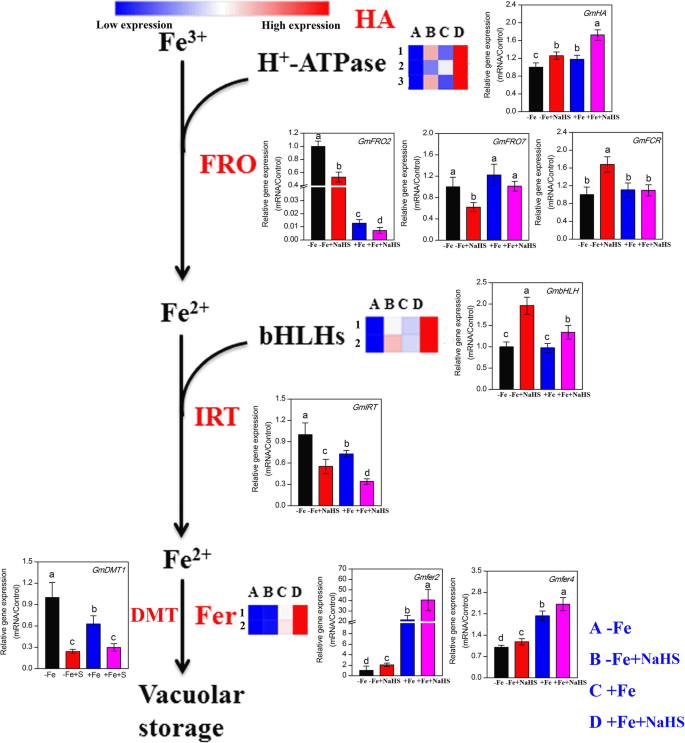
转录组数据显示,铁稳态相关基因包括3gydF4y2BaH.gydF4y2Ba+gydF4y2Ba腺苷三磷酸酶gydF4y2Ba(gydF4y2Ba哈gydF4y2Ba)基因,2gydF4y2BaBhlhs.gydF4y2Ba基因和2种丁辛基因(gydF4y2Ba拿来gydF4y2Ba),在-Fe和+ Fe条件下由NaHs调节(通过图3中的聚类呈现转录组数据。gydF4y2Ba4.gydF4y2Ba).为了进一步确认转录组结果,我们采用了qRT-PCR方法(qRT-PCR数据以图中的柱状图显示)。gydF4y2Ba4.gydF4y2Ba).如图1所示。gydF4y2Ba4.gydF4y2Ba,表达水平为3gydF4y2BaGmHAsgydF4y2Ba在-Fe和+ Fe条件下的NaHS处理中上调基因。此外,QRT-PCR结果还表明,NaHs显着促进了曲折的质量gydF4y2BaGMHAgydF4y2Ba基因在相同条件下。另外,表达丰富的gydF4y2BaGmFRO2gydF4y2Ba和gydF4y2BaGMFRO7.gydF4y2Ba在-Fe条件下,NaHS明显降低。相比之下,表达水平的gydF4y2BaGMFCR.gydF4y2Ba在相同条件下,NaHS显著增强。此外,在+Fe条件下,NaHS影响表达丰度gydF4y2BaGMFRO7.gydF4y2Ba和gydF4y2BaGMFCR.gydF4y2Ba在大豆幼苗的根部。此外,转录组数据显示,2gydF4y2BaGmbhlhs.gydF4y2Ba在-Fe和+ Fe条件下明显增加了NaH,并且QRT-PCR分析进一步证实了这些结果。的表达水平gydF4y2BaGmIRTgydF4y2Ba和gydF4y2BaGmDMT1gydF4y2Ba在-Fe和+ Fe条件下,NaHS显著下调。最后,2gydF4y2BaGmfersgydF4y2Ba在-Fe条件下,NaHS的表达水平不受NaHS的影响,但在+Fe条件下,这两个基因的表达水平较-Fe处理显著升高。同样,qRT-PCR分析也表明,Fe和NaHS可以明显提高表达水平gydF4y2BaGMFER2.gydF4y2Ba和gydF4y2BaGMFER4.gydF4y2Ba大豆幼苗根部的基因。gydF4y2Ba
铁同化途径中的基因受到在铁缺乏症下的NaHS治疗的调节和根部的铁缺乏gydF4y2Ba大豆gydF4y2Ba植物。基因的转录物水平列于该图中,详细的DEG在补充表S中列出gydF4y2Ba5.gydF4y2Ba.利用RT-PCR技术分析了铁同化基因的表达。每个基因的相对mRNA水平归一化为gydF4y2Bagmeif1b和gmactingydF4y2Ba.数据显示为平均值±SE(gydF4y2BangydF4y2Ba= 3)。标有不同字母的列表示在gydF4y2BaP.gydF4y2Ba< 0.05。在补充表S中提供基因名称的缩写gydF4y2Ba3.gydF4y2Ba.A: -Fe, 1 μM Fe;B: -Fe + NaHS, 100 μM NaHS和1 μM Fe处理的幼苗;C: +Fe, 50 μM Fe;D: +Fe + NaHS, 100 μM NaHS和50 μM Fe处理的幼苗gydF4y2Ba
Nahs影响硫缺陷中硫的代谢相关基因的表达gydF4y2Ba大豆gydF4y2Ba植物gydF4y2Ba
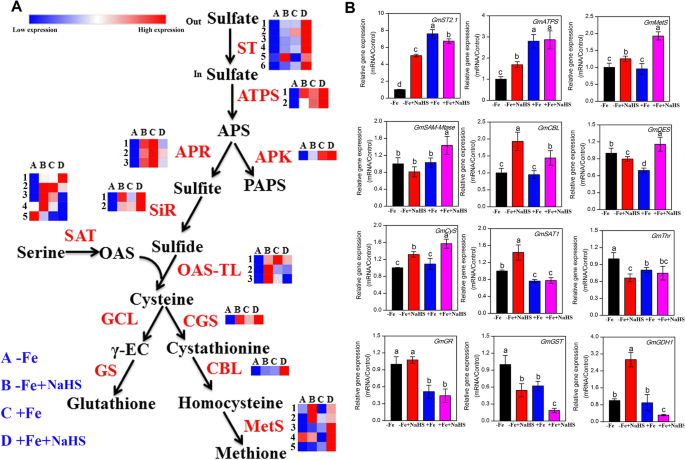
硫代谢相关基因,包括gydF4y2Ba公司gydF4y2Ba那gydF4y2Bagmatps.gydF4y2Ba那gydF4y2BaGmAPKgydF4y2Ba那gydF4y2BaGmAPRgydF4y2Ba那gydF4y2BaGmSiRgydF4y2Ba那gydF4y2BaGMSAT.gydF4y2Ba那gydF4y2BaGmOAS-TLgydF4y2Ba那gydF4y2BaGmCGSgydF4y2Ba那gydF4y2BaGMCBL.gydF4y2Ba,gydF4y2BaGmmets.gydF4y2Ba,通过使用转录组法在-Fe和+ Fe条件下的大豆根系中的NaH被调节(图。gydF4y2Ba5.gydF4y2Baa)。6的表达丰富gydF4y2BaGMSTS.gydF4y2Ba在-Fe和+ Fe条件下,NaHS显著增强了大豆根系中基因的表达。gydF4y2Ba5.gydF4y2Baa)。同样,QRT-PCR结果表明,NAHS显着上调了表达gydF4y2BaGMST2.1gydF4y2Ba在-Fe植物的根中,但这种基因表达水平略微降低+ Fe条件下(图。gydF4y2Ba5.gydF4y2Bab). 2的表达水平gydF4y2Bagmatps.gydF4y2Ba与在大豆幼苗根系中的存在或不存在的植物中,基因与未在豆幼苗根系中的存在或不存在的植物中没有用NaH治疗的植物,基因显示出明显的增加;QRT-PCR分析进一步证实了这些结果(图。gydF4y2Ba5.gydF4y2Ba).此外,Nahs显然增加了3的表达水平gydF4y2BaGMAPRgydF4y2Ba-Fe植物根的基因。而在+Fe条件下,NaHS明显降低了这三个基因的表达量。类似地,2的表达式gydF4y2BaGmSiRgydF4y2Ba和gydF4y2BaGmAPKgydF4y2BaNaHS在-Fe和+ Fe条件下上调基因表达。表达层次为5gydF4y2BaGMSAT.gydF4y2Ba在-Fe和+ Fe植物的根部,Nah改变基因,QRT-PCR数据表明gydF4y2BaGmSAT1gydF4y2Ba基因表达水平在-FE条件下由NaH升调,但在+ Fe植物中不受影响(图。gydF4y2Ba5.gydF4y2Ba).此外,3的表达丰富gydF4y2BaGmOAS-TLgydF4y2BaNaHS处理对-Fe植物的基因表达增强,而在+Fe条件下这3个基因表达显著下调。的基因表达水平gydF4y2BaGMCYS.gydF4y2Ba在-Fe和+ Fe条件下,NaHS上调。此外,表达丰富gydF4y2BaGmCGSgydF4y2Ba和gydF4y2BaGMCBL.gydF4y2Ba在大豆幼苗根系中明显被NaH诱导,并且QRT-PCR数据进一步证实了这一结果。有趣的是,Nahs治疗略微抑制了表达水平gydF4y2BaGMDES.gydF4y2Ba在-Fe条件下,NaHS显著上调了该基因的表达量。最后,5gydF4y2BaGmMetSsgydF4y2Ba基因在-Fe和+ Fe条件下受到NaHS不同程度的影响,qRT-PCR数据表明,NaHS处理可上调大豆幼苗根系中基因的表达丰度。此外,我们还分析了其他硫或应激相关基因,包括gydF4y2BaGMYAM-MTase.gydF4y2Ba那gydF4y2BaGMGR.gydF4y2Ba那gydF4y2BaGmGSTgydF4y2Ba,gydF4y2BaGmGDH1gydF4y2Ba,在-Fe植物根中进行qRT-PCR检测。的表达水平gydF4y2Ba格斯克gydF4y2Ba和gydF4y2BaGmGSTgydF4y2Ba在大豆幼苗根系中的NaHs下,在核心条件下显着下调,但在相同的条件下,NaHs治疗确实影响了表达丰富的gydF4y2BaGMYAM-MTase.gydF4y2Ba和gydF4y2BaGMGR.gydF4y2Ba基因。但是,表达水平gydF4y2BaGmGDH1gydF4y2BaNaHS在-Fe条件下显著上调基因表达,而在+Fe条件下则相反。gydF4y2Ba
硫磺同化途径中的基因受到在铁缺乏症下的NAHS治疗和根系中的铁缺乏gydF4y2Ba大豆gydF4y2Ba植物。gydF4y2BaA.gydF4y2Ba此图中列出了基因的转录水平,详细的DEGs列于补充表SgydF4y2Ba6.gydF4y2Ba.gydF4y2BabgydF4y2Ba硫同化基因的表达gydF4y2Ba大豆gydF4y2Ba植物在铁缺乏条件下使用RT-PCR。每个基因的相对mRNA水平归一化为gydF4y2Bagmeif1b和gmactingydF4y2Ba.数据以平均值±SE表示(n = 3)。标有不同字母的列表示在gydF4y2BaP.gydF4y2Ba< 0.05。在补充表S中提供基因名称的缩写gydF4y2Ba3.gydF4y2Ba.A: -Fe, 1 μM Fe;B: -Fe + NaHS, 100 μM NaHS和1 μM Fe处理的幼苗;C: +Fe, 50 μM Fe;D: +Fe + NaHS, 100 μM NaHS和50 μM Fe处理的幼苗gydF4y2Ba
植物激素在Nahs诱导的熨缺乏症中发挥着重要作用gydF4y2Ba大豆gydF4y2Ba植物gydF4y2Ba
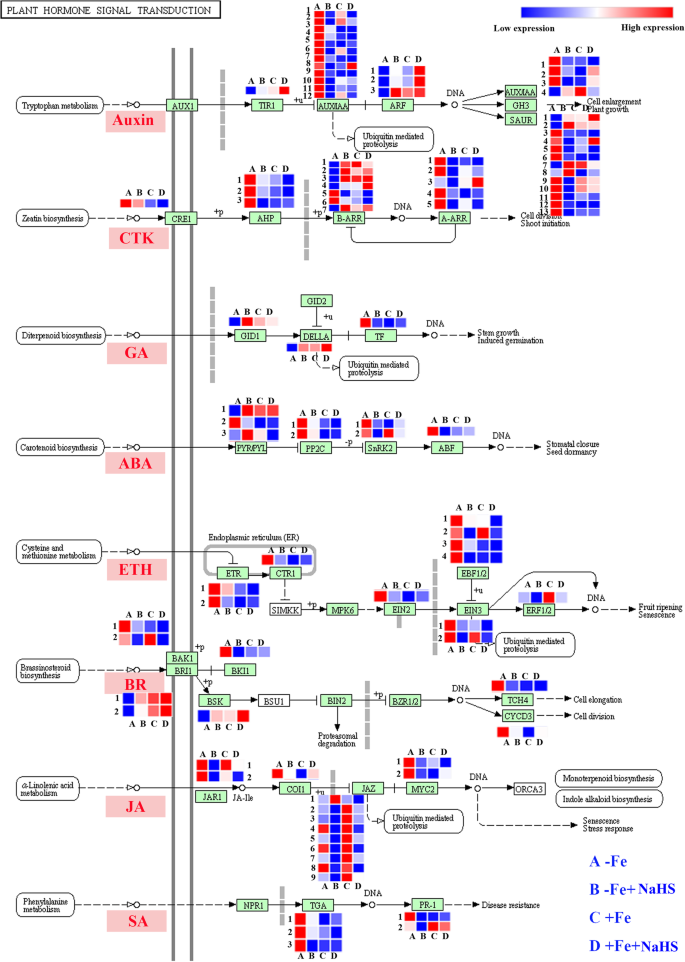
如图1所示。gydF4y2Ba6.gydF4y2Ba,在生长素途径中,1gydF4y2BaGmTIR1gydF4y2Ba和3gydF4y2BaGmARFsgydF4y2Ba在-Fe和+ Fe条件下,NaHS显著增加了大豆幼苗根系中基因的表达。相比之下,12gydF4y2BaGmAUX / IAAgydF4y2Ba在-Fe和+ Fe条件下,NaHS均下调s基因。同样的,大多数gydF4y2BaGMGH3.gydF4y2Ba和gydF4y2BaGMSAur.gydF4y2Ba在-Fe条件下,NaHS治疗明显降低了表达水平。此外,在Cytokinine(CTK)途径中,NaHS治疗显着下调了表达水平gydF4y2BaGmCRE1, GmAHPgydF4y2Ba那gydF4y2BaGMA-Arr.gydF4y2Ba和2gydF4y2BaGmb-arr.gydF4y2Ba在-Fe条件下,其他5个基因的表达量均有所下降gydF4y2BaGmb-arr.gydF4y2Ba大豆幼苗根中基因表达上调。相反,在赤霉素(gibberellin, GA)通路中gydF4y2BaGmGID1gydF4y2Ba和gydF4y2BaGMDella.gydF4y2Ba在-FE条件下,NaHS治疗明显上调,但是gydF4y2BaGmTFgydF4y2Ba在相同条件下显然是下调的。此外,NAHS治疗显着降低了基因表达水平gydF4y2BaGMPP2CgydF4y2Ba那gydF4y2BaGmSnRK2gydF4y2Ba,gydF4y2BaGmABFgydF4y2Ba在-Fe条件下的脱离酸(ABA)途径中。尽管如此,2gydF4y2Bagmpyt / pyl.gydF4y2Ba大豆幼苗根中基因表达上调。在乙烯(Eth)途径中,所有基因的表达水平,包括gydF4y2BaGMETR.gydF4y2Ba那gydF4y2BaGMCTR1gydF4y2Ba那gydF4y2Bagmein2gydF4y2Ba那gydF4y2BaGmEBF1/2gydF4y2Ba那gydF4y2Bagmein3.gydF4y2Ba,gydF4y2BaGmERF1/2gydF4y2Ba在-Fe条件下,NaHS显著下调了大豆幼苗根系的叶绿素含量。此外,在油菜素内酯(brassinosteroids, BR)通路中gydF4y2BaGmabak1.gydF4y2Ba那gydF4y2BaGmBKI1gydF4y2Ba那gydF4y2BaGMTCH4.gydF4y2Ba,gydF4y2BaGmCYCD3gydF4y2BaNaHS明显降低了-Fe植物根系中的基因含量。然而,表达丰度gydF4y2BaGmBRI1gydF4y2Ba和gydF4y2BaGmbsk.gydF4y2Ba在相同条件下得到增强。此外,在-Fe条件下,NaHS处理显著下调了大豆幼苗根系中含有茉莉酸(JA)途径的所有基因gydF4y2Bagmjar1gydF4y2Ba那gydF4y2BaGmCOI1gydF4y2Ba那gydF4y2BaGmJAZgydF4y2Ba,gydF4y2BaGMMYC2gydF4y2Ba.最后,表达丰富的gydF4y2BaGmTGAgydF4y2Ba和gydF4y2BaGMPR-1gydF4y2Ba在-FE条件下由NaHS治疗显着下调。gydF4y2Ba
在缺铁和缺铁条件下,NaHS处理对植物激素途径中的基因进行调控gydF4y2Ba大豆gydF4y2Ba植物。基因的转录物水平列于图中,详细的DEG在补充表S中列出gydF4y2Ba7.gydF4y2Ba.CTK,细胞分裂素;赤霉素GA;脱落酸ABA;乙,乙;BR, brassinosteroid;是的,茉莉酸;SA,水杨酸;A: -Fe, 1 μM Fe;B: -Fe + NaHS, 100 μM NaHS和1 μM Fe处理的幼苗; C: +Fe, 50 μM Fe; D: +Fe + NaHS, seedlings treated with 100 μM NaHS and 50 μM Fe
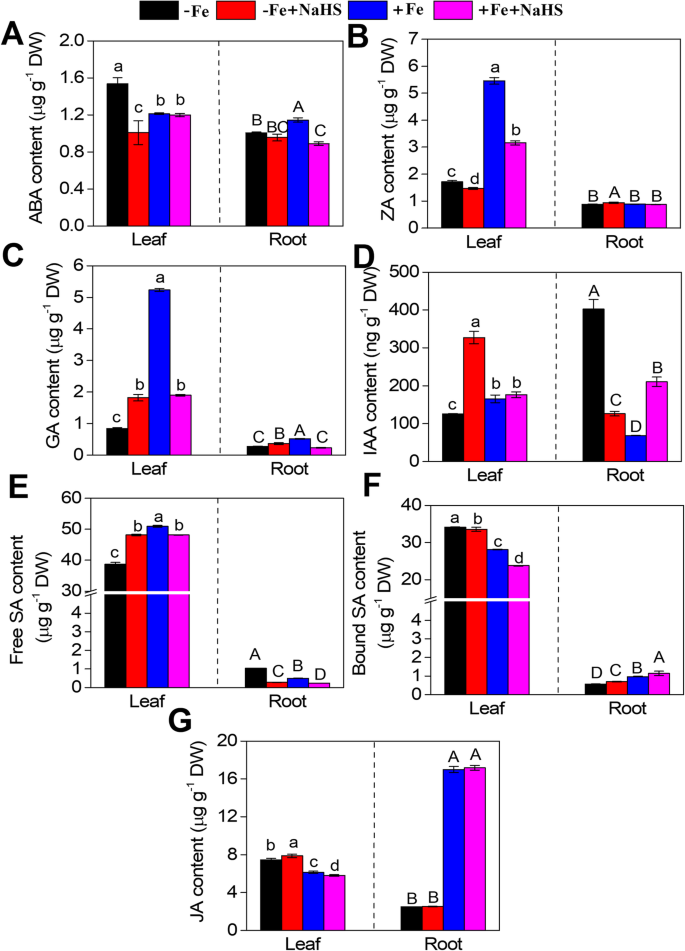
植物激素的含量受到-FE条件下的NaH的影响(图。gydF4y2Ba7.gydF4y2Ba).例如,NaHS治疗在-Fe植物的叶片中显着降低了ABA和ZA(Zeep,Za,植物中的天然细胞质),但在根中这种差异并不明显(图。gydF4y2Ba7.gydF4y2Baa,b)。相比之下,在-FE条件下,NaHs的叶片和根叶中的GA含量增加,但GA含量显示在+ Fe条件下明显减少(图。gydF4y2Ba7.gydF4y2Bac)。此外,在-FE条件下,NaHs明显增加了大豆幼苗叶片中的IAA含量,但是在相同条件下,NaHs治疗降低了根部的IAA含量(图。gydF4y2Ba7.gydF4y2Bad).在-Fe条件下,NaHS处理促进了叶片中游离SA的合成,但降低了根系中游离SA的含量(图2)。gydF4y2Ba7.gydF4y2Bae)。相比之下,叶片中的结合SA含量显示出略微降低,但在-Fe和+ Fe条件下的根部增加(图。gydF4y2Ba7.gydF4y2Baf). NaHS在-Fe条件下略微提高了叶片JA含量,而在+Fe条件下降低了JA含量(图2)。gydF4y2Ba7.gydF4y2Bag)。此外,NaHs并未影响在咖啡和+ Fe条件下的根源中的JA含量(图。gydF4y2Ba7.gydF4y2Bag)。gydF4y2Ba
缺铁和NaHS处理对大豆脱落酸含量的影响(gydF4y2BaA.gydF4y2Ba),Zeatin(Za)(gydF4y2BabgydF4y2Ba)、赤霉素(GA) (gydF4y2BacgydF4y2Ba)、吲哚乙酸(IAA) (gydF4y2BadgydF4y2Ba)、游离水杨酸(SA) (gydF4y2BaegydF4y2Ba),结合水杨酸(SA)(gydF4y2BafgydF4y2Ba)、茉莉酸(JA) (gydF4y2BaggydF4y2Ba)在叶子和根部gydF4y2Ba大豆gydF4y2Ba植物。3-W老年人gydF4y2BaG. Max.gydF4y2Ba用含有1μmFe(iii)-edta或50μmFe(III)-edta的营养溶液处理幼苗,或者没有100μmnah 15 d。误差柱代表平均值±SE。标有不同字母的列表示在gydF4y2BaP.gydF4y2Ba< 0.05。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+ Fe + Nahs,用100μmnah和50μmfe处理的幼苗gydF4y2Ba
NaHS调控缺铁患者有机酸代谢相关基因的表达和有机酸含量gydF4y2Ba大豆gydF4y2Ba植物gydF4y2Ba
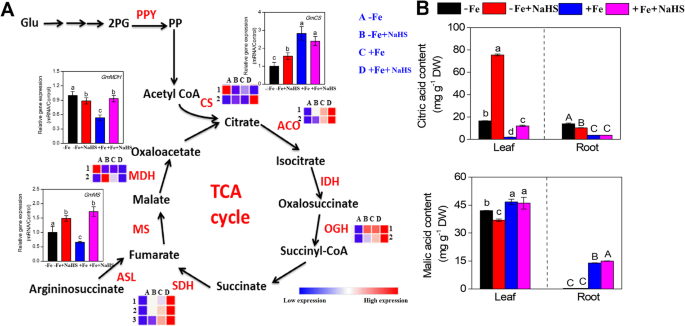
有机酸代谢相关基因在-Fe植物根系中的表达丰度受NaHS调控(图2)。gydF4y2Ba8.gydF4y2Baa)。例如,表达水平为2gydF4y2BaGMCS.gydF4y2Ba在-Fe和+ Fe条件下,基因受到NaH的影响,QRT-PCR数据显示NaH上调的基因表达水平gydF4y2BaGMCS.gydF4y2Ba在咖啡条件下,但在+ Fe条件下没有发现显着效果。另外,表达水平gydF4y2BaGmACOgydF4y2Ba那gydF4y2BaGmOGHgydF4y2Ba和gydF4y2BaGMSDH.gydF4y2Ba在-Fe和+ Fe条件下,NaHS明显上调基因表达。同样,NaHS处理也显著提高了的基因表达水平gydF4y2BaGMMS.gydF4y2Ba在大豆幼苗根系中的咖啡和+ fe条件下。此外,表达丰富的2gydF4y2BaGMMDHS.gydF4y2BaqRT-PCR结果显示,在-Fe条件下,NaHS略微下调了这些基因的表达水平,而在+Fe条件下,这些基因的表达水平显著上调。此外,我们还分析了-铁和+铁条件下大豆幼苗叶片和根系中柠檬酸和苹果酸的含量。如图1所示。gydF4y2Ba8.gydF4y2Bab,在-Fe和+ Fe条件下,NaHS处理显著提高了叶片中的柠檬酸含量,而在根系中,NaHS处理在-Fe条件下略微降低了柠檬酸含量。而-Fe植物叶片中苹果酸含量对NaHS处理的响应明显降低。gydF4y2Ba
A.gydF4y2Ba植物有机酸途径的基因受到铁缺乏症和铁的铁缺乏和铁合成条件下的NaHS治疗gydF4y2Ba大豆gydF4y2Ba植物。基因的转录物水平列于该图中,详细的DEG在补充表S中列出gydF4y2Ba8.gydF4y2Ba.在补充表S中提供基因名称的缩写gydF4y2Ba3.gydF4y2Ba.每个基因的相对mRNA水平归一化为gydF4y2Bagmeif1b和gmactingydF4y2Ba.数据以平均值±SE表示(n = 3)。gydF4y2BabgydF4y2Ba缺铁和NaHS供应对红叶和根系柠檬酸和苹果酸含量的影响gydF4y2Ba大豆gydF4y2Ba植物。误差柱代表平均值±SE。标有不同字母的列表示在gydF4y2BaP.gydF4y2Ba< 0.05。A: -Fe, 1 μM Fe;B: -Fe + NaHS, 100 μM NaHS和1 μM Fe处理的幼苗;C: +Fe, 50 μM Fe;D: +Fe + NaHS, 100 μM NaHS和50 μM Fe处理的幼苗gydF4y2Ba
讨论gydF4y2Ba
H.gydF4y2Ba2gydF4y2BaS调节铁缺乏植物中叶绿素生物合成和光合作用gydF4y2Ba
大豆(gydF4y2Ba大豆gydF4y2BaL.)是属于豆科植物家族的农艺作物,是植物物种,具有第二最高铁(Fe)含量[gydF4y2Ba42gydF4y2Ba].大豆对缺铁褪绿症特别敏感[gydF4y2Ba42gydF4y2Ba].暴露于Fe缺乏,叶绿素生物合成和光合作用被显着抑制,对大豆产量产生负面影响[gydF4y2Ba42gydF4y2Ba那gydF4y2Ba43gydF4y2Ba].缺铁导致叶绿素生物合成降低,进而导致幼叶黄变,叶面积和地上根干重减少[gydF4y2Ba44gydF4y2Ba那gydF4y2Ba45gydF4y2Ba].此外,Fe对豆类共生根结节的建立和功能至关重要,参与氮固定[gydF4y2Ba46gydF4y2Ba那gydF4y2Ba47gydF4y2Ba].在低碳条件下,豆科植物可能需要制定参与收购和利用Fe的机制,以保护其共生器官免受FE的低可用性[gydF4y2Ba48gydF4y2Ba].因此,大豆可以用作理解Fe缺乏耐受机制的新模型工厂。在本研究中,我们的研究结果表明,与Fe充足相比,Fe缺乏可能会显着抑制结节数并降低大豆植物中的结节干重,但是NaHs的应用可以显然可以减轻结核数量和干燥的Fe缺乏诱导的降低大豆植物的重量(图.. SgydF4y2Ba2gydF4y2Ba此外,在+Fe条件下,NaHS也能促进大豆植株的根瘤数量和根瘤重量(图SgydF4y2Ba2gydF4y2BaA和B).这些结果与先前的研究一致,即低铁条件可以抑制豆科植物根瘤的数量[gydF4y2Ba46gydF4y2Ba那gydF4y2Ba47gydF4y2Ba].此外,缺铁破坏叶绿体超微结构,降解叶绿体蛋白质成分[gydF4y2Ba7.gydF4y2Ba那gydF4y2Ba40gydF4y2Ba],进一步抑制植物中的光合作用和光系统II [gydF4y2Ba7.gydF4y2Ba].在本研究中,经历Fe缺乏15d的大豆幼苗呈现出具有间的叶片繁殖和低叶绿素浓度(图。gydF4y2Ba1gydF4y2Ba和表gydF4y2Ba1gydF4y2Ba).同样地,氯仑阳炎的典型表型gydF4y2Ba拟南芥gydF4y2Ba据报道,在FE缺陷溶液中生长的番茄和玉米幼苗[gydF4y2Ba10gydF4y2Ba那gydF4y2Ba11gydF4y2Ba那gydF4y2Ba20.gydF4y2Ba].有趣的是,NaHS显著提高了缺铁大豆幼苗的叶绿素含量,这与我们之前的研究结果一致gydF4y2Ba2gydF4y2BaS促进玉米幼苗在缺铁条件下叶绿素合成,一种策略II植物[gydF4y2Ba10gydF4y2Ba].此外,缺铁导致叶绿素减少,导致植物光合作用和光系统II减少[gydF4y2Ba49gydF4y2Ba].此外,由Fe缺乏症引起的氯化叶片表现出较低的气孔孔和较低的光合速率,并且在WUE的最终减少[gydF4y2Ba50gydF4y2Ba].此外,Fe缺陷会影响光合电子传输,持续减少碳同化和生物量[gydF4y2Ba51gydF4y2Ba].在本研究中,光响应曲线表明,NaHs促进了光合作用,并且该过程与Fe缺陷植物中的Fe采集密切相关(图。gydF4y2Ba3.gydF4y2Ba此外,NaHS也显著提高了水分利用效率(WUE)(图SgydF4y2Ba3.gydF4y2BaD).在我们之前对玉米幼苗在缺铁溶液中生长的研究中也得到了同样的结果[gydF4y2Ba10gydF4y2Ba].在-Fe和+ Fe条件下,NaHS对大豆幼苗光合作用和光系统II的响应不同。例如,在-Fe条件下,NaHS的施用可以促进光合作用和叶绿素荧光参数,包括PSII、ETR、Fv/Fm、Fv ' /Fm '等,但在+Fe条件下,这种响应不明显,甚至出现下降(图SgydF4y2Ba3.gydF4y2Ba和SgydF4y2Ba4.gydF4y2Ba).可能的解释是在-Fe条件下,HgydF4y2Ba2gydF4y2BaS在保护植物免受缺铁损伤方面发挥着积极的作用,但在+Fe条件下,植物可以正常生长发育,不需要其他信号分子,如HgydF4y2Ba2gydF4y2BaS.在Fe缺陷条件下,玉米幼苗也发现了同样的现象[gydF4y2Ba10gydF4y2Ba].类似地,ABA或Putrescine对植物中的-Fe和+ Fe条件之间的生理指标具有不同的反应[gydF4y2Ba20.gydF4y2Ba那gydF4y2Ba52gydF4y2Ba].一起服用,上述结果表明hgydF4y2Ba2gydF4y2Bas对大豆幼苗光合作用和光系统II的改善可能与铁的有效性有关。gydF4y2Ba
H.gydF4y2Ba2gydF4y2BaS通过在铁缺陷植物中改变FCR酶活性和铁稳态相关基因表达来促进铁累积gydF4y2Ba
Fe Socosuttasis相关基因在植物中调节Fe吸收和易位[gydF4y2Ba53gydF4y2Ba[和Fe缺乏诱导的氯化是从旧叶子的限制的Fe Mobilis。在本研究中,NaH在-FE条件下大豆幼苗组织中的Fe积累显着改善了Fe积累(表gydF4y2Ba1gydF4y2Ba).此外,高铁浓度并不影响其他微量元素(Mn、Cu和Zn)的缺乏(图SgydF4y2Ba5.gydF4y2Ba).这些结果与前一项研究的结果一致表明,没有和ABA调节番茄和拟南芥的Fe积累和运输[gydF4y2Ba11gydF4y2Ba那gydF4y2Ba20.gydF4y2Ba].此外,表皮细胞膜中的三个连续活动参与了大豆植物根部对铁的吸收[gydF4y2Ba42gydF4y2Ba].质子通过细胞膜结合的HgydF4y2Ba+gydF4y2Ba- 表皮细胞中的蛋白酶(AHA)是第一活性。然后,第二次活动是fegydF4y2Ba3 +gydF4y2Ba减少到可溶性FegydF4y2Ba2+gydF4y2Ba货物收据。最后,铁调节转运体1 (IRT1)转运铁gydF4y2Ba2+gydF4y2Ba离子进入表皮细胞[gydF4y2Ba8.gydF4y2Ba].在本研究中,我们发现在处理期间缺铁诱导的大豆幼苗根系FCR活性增加,但NaHS抑制了缺铁诱导的根系FCR活性的增加(图。gydF4y2Ba2gydF4y2Bac),暗示gydF4y2Ba2gydF4y2BaS在植物缺铁反应中起着重要的调节作用。同样,之前的研究发现FCR活性与大豆植株中的铁浓度有关[gydF4y2Ba54gydF4y2Ba].通过质子ATPase介导的根际酸化是策略I植物的另一个重要的Fe缺乏症,并且这种反应与Plasmalemalocalized H的活性有关gydF4y2Ba+gydF4y2Ba-ATPase。有趣的是,NaHs显着抑制了TeaT沐浴溶液的pH的Fe缺乏诱导的降低。此外,最近的证据表明,在Fe缺陷下可以部分重新加入根吻斗塑料Fe [gydF4y2Ba20.gydF4y2Ba那gydF4y2Ba55gydF4y2Ba].图中,在缺铁条件下,根的质外体铁含量明显下降,在NaHS存在下下降更明显(图2)。gydF4y2Ba2gydF4y2Bae),表明HgydF4y2Ba2gydF4y2BaS促进大豆幼苗根质外体铁的再利用。这一过程的可能机理如下gydF4y2Ba2gydF4y2Bas与固定在术中固定的Fe反应,使得通过根细胞吸收的Fe用于易于拍摄。gydF4y2Ba
我们使用转录组和RT-PCR方法来分析Fe Socyostasis相关基因表达丰富,这使得更好地了解Fe缺乏诱导的氯化和H的作用gydF4y2Ba2gydF4y2Ba在铁的获取和光合作用中。我们的研究结果表明,NaHS显著刺激了gydF4y2BaGMHAgydF4y2Ba在Fe缺乏症条件下的基因,这些结果与先前研究的结果一致,表明NO和其他信号分子可以通过影响质子ATP酶来调节Fe缺陷的响应(gydF4y2Ba啊哈gydF4y2Ba)基因表达[gydF4y2Ba52gydF4y2Ba那gydF4y2Ba56gydF4y2Ba那gydF4y2Ba57gydF4y2Ba].此外,以往的研究表明,表达上调gydF4y2BaFCR.gydF4y2Ba和gydF4y2Ba爱好者gydF4y2Ba预计将增加根系中的Fe习得,从而加强植物耐受Fe缺陷[gydF4y2Ba20.gydF4y2Ba那gydF4y2Ba51gydF4y2Ba那gydF4y2Ba52gydF4y2Ba].我们的结果表明表达水平gydF4y2BaGMFCR.gydF4y2Ba在缺铁条件下,NaHS明显增加,而其他两个基因,如gydF4y2BaGmFRO2gydF4y2Ba和gydF4y2BaGMFRO7.gydF4y2Ba,在相同条件下显著下调(图。gydF4y2Ba4.gydF4y2Ba).对这种现象的一个可能的解释是hgydF4y2Ba2gydF4y2BaS-DELVEDIED FE缺乏响应主要增加了表达gydF4y2BaGMFCR.gydF4y2Ba而不是丰富的表达gydF4y2BaGmFRO2gydF4y2Ba和gydF4y2BaGMFRO7.gydF4y2Ba在大豆。铁蛋白充当Fe储存蛋白,并在Fe缺陷条件下发挥Fe Mobilization和Passion的主要作用[gydF4y2Ba15gydF4y2Ba那gydF4y2Ba58gydF4y2Ba].此外,铁蛋白主要位于叶绿体中并在植物中使用足够的Fe时积聚。在这里,表达gydF4y2BaGMFER2.gydF4y2Ba和gydF4y2BaGMFER4.gydF4y2Ba被NaHS上调(图。gydF4y2Ba4.gydF4y2Ba),表明HgydF4y2Ba2gydF4y2Ba通过调节大豆幼苗中的铁蛋白丰度,促进了Fe缺乏条件下的Fe Mobilization和分布。同样,此前的研究还表明NO和谷胱甘肽促进铁蛋白mRNA和蛋白质的积累gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba58gydF4y2Ba那gydF4y2Ba59gydF4y2Ba].此外,之前的研究表明,BHLHS作为转录者调节剂,在维持植物中的Fe SoosoTasis中起着关键作用。在这里,表达gydF4y2BagmbhlhgydF4y2Ba在-Fe和+ Fe条件下增加NaH(图。gydF4y2Ba4.gydF4y2Ba),表明HgydF4y2Ba2gydF4y2BaS通过影响转录调节子的表达丰度来促进大豆幼苗对缺铁的适应性。大豆二价金属转运体1 (GmDMT1)是一种二价金属离子转运体NRAMP/DMT1家族的大豆同源物gydF4y2BaGmDMT1gydF4y2Ba在铁结核内环境平衡中起重要作用[gydF4y2Ba60.gydF4y2Ba].同样,我们发现Fe缺陷诱导更高的表达gydF4y2BaGmDMT1gydF4y2Ba,但NaHS抑制了- fe诱导的大豆根中该基因表达的增加(图。gydF4y2Ba4.gydF4y2Ba).综合来看,这些结果表明HgydF4y2Ba2gydF4y2BaS是用于在-FE和+ Fe条件下的大豆幼苗中表达铁稳态相关基因和相关酶活性的必要信号分子。gydF4y2Ba
H.gydF4y2Ba2gydF4y2BaS可以通过调节含硫代谢物和硫代谢相关基因的表达来应对铁缺乏gydF4y2Ba大豆gydF4y2Ba植物gydF4y2Ba
以前的研究表明,有限的S可用性降低了Fe摄取,并且Fe缺乏导致硫酸盐摄取和同化的调节[gydF4y2Ba61.gydF4y2Ba那gydF4y2Ba62.gydF4y2Ba].值得注意的是,S的供应可以帮助工厂应对铁短缺[gydF4y2Ba61.gydF4y2Ba].例如,番茄幼苗在植物的S营养状况与其应对Fe缺乏的能力之间表现出阳性相关性,这与FCR活性,IRT表达和编码硫酸盐转运蛋白(STS)的基因的表达有关(STS)[gydF4y2Ba61.gydF4y2Ba].此外,Zuchi等人。[gydF4y2Ba63.gydF4y2Ba]显示,在暴露于S和Fe饥饿的番茄植物中,不诱导FCR活性,但缺乏似乎似乎防止了对Fe缺乏的典型反应的发展,并且Fe缺乏显着上调了属于的大多数硫酸盐转运蛋白基因对于Group1,2和4.先前的结果表明,S和Fe之间的这种相互作用触发了复杂响应机制的激活,以假设植物正常生长和发育。然而,与之前的研究不同,我们的研究主要集中在H的功能上gydF4y2Ba2gydF4y2BaS信号传导而不是硫营养,从而改善大豆幼苗对Fe缺乏的调整。例如,在-fe和+ Fe条件下,NaHs导致高源性H的积累gydF4y2Ba2gydF4y2BaS、谷胱甘肽和NPTs在大豆幼苗叶片和根系中的含量gydF4y2Ba2gydF4y2Ba).这些结果表明,NaHs不仅直接促进了内源性H的合成gydF4y2Ba2gydF4y2BaS,但也通过在根中调节硫代谢相关的基因表达来喂入半胱氨酸和GSH合成。gydF4y2Ba
植物中硫同化的途径分为两个反应序列:硫酸盐还原和半胱氨酸合成[gydF4y2Ba64.gydF4y2Ba].通过转录组和qRT-PCR分析,我们发现大豆幼苗根系中大多数硫同化相关基因在-Fe和+ Fe条件下受到NaHS的调控(图)。gydF4y2Ba5.gydF4y2Ba).例如,NaHS增加了gydF4y2Baoastl.gydF4y2Ba基因和减少gydF4y2BaDES.gydF4y2Ba玉米幼苗的基因表达[gydF4y2Ba10gydF4y2Ba].同样的现象在gydF4y2BaS. Oleracea.gydF4y2Ba苗(gydF4y2Ba39gydF4y2Ba].此外,在-Fe条件下,NaHS通过影响基因表达水平显著提高了蛋氨酸的生物合成gydF4y2BaGmmets.gydF4y2Ba.最后,我们发现其他含s的化合物或酶,如GR、GST和GDH的转录丰度都是由H调控的gydF4y2Ba2gydF4y2Bas低于咖啡和+ fe条件。因此,得出结论是gydF4y2Ba2gydF4y2BaS作为信号分子,可以通过增加含硫代谢物和调节大豆幼苗硫代谢相关基因的转录丰度来应对缺铁。gydF4y2Ba
植物激素在H中发挥着重要作用gydF4y2Ba2gydF4y2Bas能缓解体内缺铁gydF4y2Ba大豆gydF4y2Ba植物gydF4y2Ba
植物激素和信号分子通过诱导铁获取和稳态相关基因的表达参与策略I植物对铁缺乏的响应[gydF4y2Ba20.gydF4y2Ba那gydF4y2Ba25gydF4y2Ba].例如,在助线信令路径中,gydF4y2BaGmAUX / IAAgydF4y2Ba那gydF4y2BaGMGH3.gydF4y2Ba和gydF4y2BaGMSAur.gydF4y2Ba在-Fe条件下被NaHS下调,但其他两个基因,gydF4y2BaGmTIR1gydF4y2Ba和gydF4y2BaGmARFgydF4y2Ba,在相同条件下显著上调。此外,我们的研究结果表明,在-Fe条件下,NaHS降低了根中生长素IAA的合成,但增加了叶中生长素IAA的合成(图2)。gydF4y2Ba7.gydF4y2Bad),建议hgydF4y2Ba2gydF4y2BaS通过影响大豆幼苗生长素水平和生长素相关基因表达丰度来调控铁缺乏的适应性。同样,aux1介导的生长素分布对缺铁依赖的侧根伸长是必需的[gydF4y2Ba65.gydF4y2Ba].此外,以往的研究表明,缺铁会导致生长素合成增加,高浓度的生长素也会增强与铁同化相关的基因表达[gydF4y2Ba56gydF4y2Ba那gydF4y2Ba66.gydF4y2Ba].此外,我们的结果表明HgydF4y2Ba2gydF4y2Ba通过影响植物中的肉毒蛋白(Za)含量,植物中的天然细胞素素(CTK),在-FE条件下,通过影响植物中的天然细胞素素(CTK),对植物中的CTK相关基因表达丰度进行降低调节CTK相关基因表达丰度来调节FE同化。先前的研究表明,作为Fe缺乏响应的负调节剂的CTK显着抑制了几种相关基因,例如gydF4y2BaIRT1gydF4y2Ba和gydF4y2Bafro1.gydF4y2Ba[gydF4y2Ba21gydF4y2Ba],按照我们的研究。在FE条件下,NaHS通过抑制大豆幼苗中CTK和CTK相关基因表达水平的合成增强了对Fe缺乏的适应性(图。gydF4y2Ba6.gydF4y2Ba和gydF4y2Ba7.gydF4y2Bab).此外,在赤霉素(gibberellin, GA)信号通路中,基因表达丰度gydF4y2BaGmGID1gydF4y2Ba和gydF4y2BaGMDella.gydF4y2Ba在-Fe条件下,NaHS处理明显上调TF的表达,而在相同条件下TF的表达略有下调。在-Fe条件下,NaHS增加了叶片和根系中的GA含量(图2)。gydF4y2Ba7.gydF4y2Bac),暗示gydF4y2Ba2gydF4y2Ba通过上调表达式,S信令可以通过um-conse表达来肯定控制GA水平gydF4y2BaGmGID1gydF4y2Ba和gydF4y2BaGMDella.gydF4y2Ba在Fe缺乏条件下的大豆植物中。有趣的是,外源性施用的气体在Fe缺陷和Fe - 充足条件下诱导了几种Fe摄取相关基因的表达gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba67.gydF4y2Ba].此外,先前的研究表明,Ga信号传导通过调节表达丰度来控制Fe含量gydF4y2Ba德拉斯gydF4y2Ba和gydF4y2Ba适合gydF4y2Ba- 相关的转录因子基因[gydF4y2Ba68.gydF4y2Ba].同样,在-Fe条件下,NaHS降低了ABA信号通路相关基因的表达丰度。此外,在-Fe条件下,NaHS抑制了叶和根中ABA的合成(图2)。gydF4y2Ba7.gydF4y2Baa),建议hgydF4y2Ba2gydF4y2BaS可能调控缺铁条件下ABA的合成和相关基因的表达丰度。已有研究表明,外源ABA处理通过促进铁在茎根之间的运输和再分配,缓解了铁缺乏引起的褪绿病[gydF4y2Ba20.gydF4y2Ba].外源ABA的施用通过调控铁的表达水平,明显提高铁的吸收gydF4y2BaCmbHLH1gydF4y2Ba在菊花中,表明ABA可以在Fe吸收过程中被肯定地调节[gydF4y2Ba69.gydF4y2Ba].在策略I植物中,通过乙烯(Eth)控制一系列Fe收集基因的转录调节[gydF4y2Ba18gydF4y2Ba那gydF4y2Ba19gydF4y2Ba那gydF4y2Ba70gydF4y2Ba].此外,乙烯反应因子gydF4y2BaAterf4.gydF4y2Ba负面调节FE缺陷的反应gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba70gydF4y2Ba].有趣的是,我们的研究结果表明,一系列乙烯信号通路相关基因的转录调控是由HgydF4y2Ba2gydF4y2Ba在-Fe条件下,乙烯与HgydF4y2Ba2gydF4y2BaS调节大豆幼苗的Fe缺陷反应。另外,芸苔类固醇(BR)信号传导途径相关基因的表达丰度受到NaHs的影响。BRS调节植物中的许多生理过程[gydF4y2Ba71.gydF4y2Ba].它们在调节对Fe缺乏的反应方面发挥着重要作用,BR生物合成型突变体呈现出比野生类型更大的耐受性,这表明BRS充当Fe缺乏响应的负调节剂[gydF4y2Ba72.gydF4y2Ba].茉莉酸酯(JAs)参与调节植物缺铁[gydF4y2Ba23gydF4y2Ba那gydF4y2Ba73.gydF4y2Ba].JAs信号在水稻根系缺铁反应的早期就被激活,这部分是由转录因子调控的gydF4y2BaIDEF1.gydF4y2Ba以及泛素连接酶gydF4y2BaOSHRZgydF4y2Ba[gydF4y2Ba73.gydF4y2Ba].许多JA信号相关基因的成绩单丰富,包括gydF4y2Ba奥斯哈兹gydF4y2Ba那gydF4y2BaOsCOIsgydF4y2Ba,gydF4y2Baosjars.gydF4y2Ba,受缺铁影响[gydF4y2Ba73.gydF4y2Ba].在本研究中,我们发现这些基因包括gydF4y2Bagmjar1gydF4y2Ba那gydF4y2BaGmCOI1gydF4y2Ba那gydF4y2BaGmJAZgydF4y2Ba,gydF4y2BaGMMYC2gydF4y2Ba在-Fe条件下,NaHS下调了参与JA信号通路的JA含量,而在-Fe条件下,NaHS对根系JA含量没有影响(图2)。gydF4y2Ba7.gydF4y2Bag).在植物中,转录本丰度gydF4y2BabHLH38gydF4y2Ba和gydF4y2BabHLH39gydF4y2Ba在施用水杨酸(SA)之后,显着诱导,这表明SA与FE缺陷反应之间的紧密关系进行了紧密关系[gydF4y2Ba25gydF4y2Ba那gydF4y2Ba74.gydF4y2Ba].同样,我们的结果表明转录水平gydF4y2BaGmTGAgydF4y2Ba和gydF4y2BaGMPR-1gydF4y2Ba在-Fe条件下,NaHS下调了根系中SA信号通路的通路。在-Fe条件下,NaHS改变了游离SA和结合SA的含量(图2)。gydF4y2Ba7.gydF4y2Ba综上所述,缺铁反应受HgydF4y2Ba2gydF4y2Ba通过调控大豆幼苗中植物激素的生物合成和信号转导相关基因的表达丰度,研究了大豆S信号转导和几种不同植物激素之间一系列复杂的相互作用。gydF4y2Ba
有机酸生物合成相关基因表达和有机酸含量受到H调节gydF4y2Ba2gydF4y2Ba在缺铁gydF4y2Ba大豆gydF4y2Ba植物gydF4y2Ba
柠檬酸盐被认为是木质炎SAP中存在的羧酸盐之间最有可能的Fe转运主要候选者[gydF4y2Ba75.gydF4y2Ba].此外,增加羧酸盐浓度,包括柠檬酸盐和苹果酸盐,以及在植物根组织中增强TCA循环相关转录物的表达,对于缓解Fe缺陷的反应是重要的[gydF4y2Ba76.gydF4y2Ba].此外,三羧酸相关酶如柠檬酸合酶(CS)、苹果酸脱氢酶(MDH)和异柠檬酸脱氢酶(NADP)增加gydF4y2Ba+gydF4y2Ba-IDH)已在缺铁的几种物种中观察到[gydF4y2Ba77.gydF4y2Ba].然而,直到最近,文献中的信息很少有关H的效果gydF4y2Ba2gydF4y2BaS信号在有机酸代谢中的作用。例如,我们之前的研究表明HgydF4y2Ba2gydF4y2BaS对铝诱导大麦根尖柠檬酸盐分泌的影响[gydF4y2Ba28gydF4y2Ba,暗示着HgydF4y2Ba2gydF4y2BaS负责在某些压力条件下有机酸池的变化。在这项研究中,我们的结果清楚地表明,根据Fe缺乏,NaHs影响有机酸代谢(柠檬酸和苹果酸)和与TCA循环相关的基因转录水平gydF4y2BaGMCS.gydF4y2Ba那gydF4y2BaGmACOgydF4y2Ba那gydF4y2BaGMMDH.gydF4y2Ba那gydF4y2BaGMMS.gydF4y2Ba在大豆的根部(图。gydF4y2Ba8.gydF4y2Ba).在一项减轻硅的缺铁反应的研究中也发现了类似的结果[gydF4y2Ba76.gydF4y2Ba].以上结果表明,HgydF4y2Ba2gydF4y2BaS调控TCA相关基因表达和有机酸合成,进一步增强大豆植株对缺铁的适应能力。此外,关于HgydF4y2Ba2gydF4y2BaS对大豆的Fe缺陷反应是稀缺的。最近对大豆研究的分析表明,大豆应该用作理解Fe缺乏耐受机制的新模型植物,发现一系列Fe缺陷调节有关相关基因[gydF4y2Ba42gydF4y2Ba].我们的结果进一步证明了hgydF4y2Ba2gydF4y2BaS信号通过控制有机酸代谢以及参与大豆幼苗TCA循环的缺铁相关基因的转录激活,直接或间接地影响铁的获取和运输。gydF4y2Ba
结论gydF4y2Ba
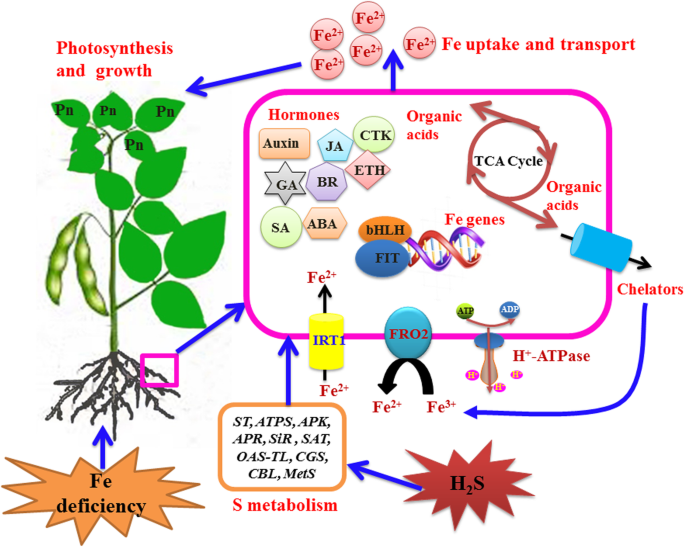
基于以上结果和目前植物对缺铁反应机制的了解,HgydF4y2Ba2gydF4y2Ba已经提高了大豆幼苗对Fe缺乏的适应。如图1所示。gydF4y2Ba9.gydF4y2Ba,本结果表明h的作用gydF4y2Ba2gydF4y2Ba通过调节FCR活性和铁稳态及硫代谢相关基因表达水平,增加质外体铁和根、叶铁积累,从而促进大豆幼苗的光合作用和生长。另外,外生HgydF4y2Ba2gydF4y2BaS通过调节缺铁大豆幼苗中植物激素相关基因的表达丰度来改变植物激素浓度。有机酸的生物合成和相关基因的表达也在HgydF4y2Ba2gydF4y2Bas介导的大豆幼苗缺铁的缓解。gydF4y2Ba
h的示意图gydF4y2Ba2gydF4y2Bas缓解根铁缺乏gydF4y2Ba大豆gydF4y2Ba植物。CTK,细胞分裂素;赤霉素GA;脱落酸ABA;乙,乙;BR, brassinosteroid;是的,茉莉酸;SA,水杨酸;IRT1,铁调节转运体;FRO2:铁还原氧化酶2; bHLH, basic helix-loop-helix protein; FIT; Pn, photosynthesis; ST, sulphate transporter; ATPS, ATP sulfurylase; APK, adenylylsulphate kinase; APR, phosphoadenosine phosphosulphate reductase; SiR, sulphite reductase; SAT, serineO.gydF4y2Ba- - 乙酰转移酶;OAS-TL,gydF4y2BaO.gydF4y2Ba- 乙酰碱(硫醇)裂解酶;CGS,胱硫氨酸γ-合酶;CBL,胱硫脲β-裂解酶;Mets,甲硫氨酸合成酶gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
大豆种子(gydF4y2Ba大豆gydF4y2BaL.中华13)从河南农业科学院获得。将种子在75%乙醇中灭菌3分钟,然后在10%次氯酸钠溶液中另外10分钟,然后用蒸馏水洗涤并在土壤中发芽(Pindstrup Mosebrug A / S,丹麦):蛭石(1:1)6天的混合物。幼苗(六天)被转移到塑料盆(每壶六个幼苗),它填充了1.5升营养溶液。营养液的组成如下:0.25mm kHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4.gydF4y2Ba,0.5 mm mgsogydF4y2Ba4.gydF4y2BaCa(NOgydF4y2Ba3.gydF4y2Ba)gydF4y2Ba2gydF4y2Ba, 1毫米KNOgydF4y2Ba3.gydF4y2Ba;微量元素组成为10 μM HgydF4y2Ba3.gydF4y2Ba博gydF4y2Ba3.gydF4y2Ba, 0.5 μΜ MnSOgydF4y2Ba4.gydF4y2Ba,0.5μμznsogydF4y2Ba4.gydF4y2Ba, 0.1 μΜ CuSOgydF4y2Ba4.gydF4y2Ba,0.1μm(nhgydF4y2Ba4.gydF4y2Ba)gydF4y2Ba6.gydF4y2Ba莫gydF4y2Ba7.gydF4y2BaO.gydF4y2Ba24gydF4y2Ba.铁被提供为50μmfe(iii)-edta。植物在增长室(Thermo Scientific,Thermo Fisher,USA)的控制环境条件下生长,光/暗时期为14/10小时,相对湿度为70%,温度为21/26°C(夜/天)和280μmolm的光合活性辐射(par)gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba.gydF4y2Ba
在用50μMFE(III)-EdTA供应的营养溶液中预先培养幼苗,然后以+ Fe(50μM)或-Fe(1μM)营养溶液(1μM)营养溶液在+ Fe(50μM)或没有供应100μMnaHs,-fe,1μmfe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+Fe + NaHS, 100 μM NaHS和50 μM Fe处理幼苗。每次治疗都是由十二壶(每次重复的三个盆)组成。每次治疗都有四次重复。用Delta 320 pH电极(Mettler Toledo,瑞士)将营养溶液的pH调节至7.0,并完全再次更新每4d并连续充气。gydF4y2Ba
叶绿素测定gydF4y2Ba
叶绿素含量按Lichtenthaler方法测定[gydF4y2Ba78.gydF4y2Ba].新鲜大豆叶(0.2g)用液氮粉末,使用四个80%(v / v)丙酮水溶液,直至观察到完全漂白。通过470,646和663nm的OD吸光度计算总叶绿素含量。gydF4y2Ba
铁含量分析gydF4y2Ba
对于总Fe含量分析,用1.5mm CaCl洗涤收获的根,茎和叶子三次gydF4y2Ba2,gydF4y2Ba然后是一个gydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4.gydF4y2Ba:H.gydF4y2Ba2gydF4y2BaO.gydF4y2Ba2gydF4y2Ba(5:1)试剂混合物用于在消化嵌段中在420℃下消化植物样品。使用原子吸收分光光度计(Hitachi Z2000,日本,日本)测量总Fe浓度[gydF4y2Ba10gydF4y2Ba].gydF4y2Ba
根据Jin等人分析妊娠Fe含量。[gydF4y2Ba55gydF4y2Ba].将根转移到含有150ml Aerated 0.5mm Caso的烧杯中gydF4y2Ba4.gydF4y2Ba15分钟。然后将根部放入填充150ml 1.5mm 2.2-双吡啶的管中。用n鼓泡溶液gydF4y2Ba2gydF4y2Ba12.5 mM Na加入前后5 mingydF4y2Ba2gydF4y2BaS.gydF4y2Ba2gydF4y2BaO.gydF4y2Ba4.gydF4y2Ba取代氧气。最后,在520 nm波长下测定了Fe(II)-联吡啶配合物的分光光度。空白测量不需要样品。gydF4y2Ba
溶液pH测量gydF4y2Ba
营养液的pH值每3 d用Delta 320 pH电极(metttler Toledo, Zurich, Switzerland)测量一次。gydF4y2Ba
根系FCR活性测定gydF4y2Ba
根据Grusak的方法测定FCR活性[gydF4y2Ba79.gydF4y2Ba].将整根置于填充有5ml测定溶液的试管中。测定溶液含有0.5毫米CASOgydF4y2Ba4.gydF4y2Ba0.1 mM 4-形态线乙磺酸,0.1 mM bathophenanthroline- disodium salt hydrate (BPDS), 100 mM Fe(III)-EDTA,用1 M NaOH调节检测溶液的pH至5.5。试管在25°C的暗室中放置1小时,用手旋转10分钟。用分光光度计在535 nm处测定测定液,测定Fe(III) [BPDS]的浓度。gydF4y2Ba3.gydF4y2Ba的消光系数为22.14 mMgydF4y2Ba−1gydF4y2Ba厘米gydF4y2Ba−1gydF4y2Ba.这些数据被记录为相对根FCR活性的手段。gydF4y2Ba
内源性H的测定gydF4y2Ba2gydF4y2BaS、谷胱甘肽和非蛋白硫醇含量gydF4y2Ba
内源性HgydF4y2Ba2gydF4y2Ba根据Sekiya等人描述的方法确定S含量。和陈等人。[gydF4y2Ba39gydF4y2Ba那gydF4y2Ba80gydF4y2Ba做了一些小的修改。还原谷胱甘肽含量由谷胱甘肽试剂试剂盒(中国南京建城生物工程研究所)根据Chen等人描述的方法测定。[gydF4y2Ba28gydF4y2Ba].根据Del Longo等人分析非蛋白质硫醇(NPTS)的总含量。[gydF4y2Ba81.gydF4y2Ba]有一些修改。gydF4y2Ba
RNA提取、测序和文库构建gydF4y2Ba
用-Fe、-Fe + NaHS、+Fe和+Fe + NaHS处理15 d的大豆根样品进行RNA-Seq分析。转录组实验在北京诺金公司的协助下,按照Wang等人的方法进行[gydF4y2Ba82.gydF4y2Ba].对于每种处理,将三种单独的根部汇集在一起,以产生一个混合样品,对RNA-SEQ分析中的每种治疗评估了三种生物重复。gydF4y2Ba
以每个样品总RNA量5 μg作为RNA样品制备的输入材料。所有样品的RIN值均在8.0以上。根据制造商的说明,使用Illumina TruSeq™RNA样品制备试剂盒(Illumina, San Diego, CA, USA)生成测序库。测序产生的原始图像数据通过base调用转换为序列数据,称为Raw data/ Raw reads,以fastq格式存储[gydF4y2Ba83.gydF4y2Ba].同时计算干净数据的Q20、Q30、GC含量和序列重复水平。所有的下游分析都基于高质量的清洁数据。gydF4y2Ba
GO和KEGG通路gydF4y2Ba
根据Wang等人的方法,利用大豆基因组注释中的基因本体论(GO)对差异表达基因(DEGs)进行功能分类[gydF4y2Ba82.gydF4y2Ba].经修正的GO术语gydF4y2BaP.gydF4y2Ba-值< 0.05被认为显著富集。gydF4y2Ba
KEGG是一个了解生物系统高级功能和效用的数据库资源。该路径主要是用于富集分析的公共路径相关数据库,如gydF4y2Bahttp://www.genome.jp.kegg/gydF4y2Ba.gydF4y2Ba
植物激素的测定gydF4y2Ba
根据制造商的说明使用激素提取试剂盒从样品中提取植物激素(科明生物技术有限公司)。、苏州、中国、gydF4y2Bawww.cominbio.com.gydF4y2Ba).gydF4y2Ba
为了测定ABA,新鲜叶子和根组织(~ 100 mg)被密封在含有1 ml ABA标准提取缓冲试剂I的2ml试管中。将混合物在4°C中轻轻搅拌过夜,然后在8000 g离心10分钟。收集上相,加入0.5 ml试剂II进行三次萃取脱色。将水相调整到pH 2.8,与上层的有机相结合,然后用氮气鼓风机进行干燥。流动相为等体积0.5 ml,在样品瓶中过滤针滤器进行检测。每个样品10微升注入Kromasil C18反相柱(250 mm × 4.6 mm),使用HPLC系统(Rigol L3000, Rigol, Beijing, China)进行分析。流动相为甲醇和1%乙酸水溶液。柱温30℃,流速0.8 ml/min。紫外检测波长为254 nm,进样时间为35 min。每个样品至少进行三个独立的生物学重复。gydF4y2Ba
ZA和GA的提取方法与ABA相同。每个样品10微升注入Kromasil C18反相柱(250 mm × 4.6 mm),使用HPLC系统(Rigol L3000, Rigol, Beijing, China)进行分析。流动相为甲醇和1%乙酸水溶液。柱温30℃,流速1 ml/min,紫外检测波长254 nm,进样时间40 min。每个样品至少进行三个独立的生物学重复。gydF4y2Ba
对于IAA测定,提取方法与ABA相同。每个样品10微升注入Kromasil C18反相柱(250 mm × 4.6 mm),使用HPLC系统(Rigol L3000, Rigol, Beijing, China)进行分析。流动相包括甲醇和超纯水(400mL:600mL)。柱温为30℃,流速为0.8ml / min,采样时间为40分钟。激发波长为275nm,发射波长为345nm。每个样品至少进行三个独立的生物学重复。gydF4y2Ba
JA的提取方法与ABA相同。每个样品10微升注入Kromasil C18反相柱(250 mm × 4.6 mm),使用HPLC系统(Rigol L3000, Rigol, Beijing, China)进行分析。流动相为甲醇和0.1%甲酸水溶液。柱温35℃,流速0.8 ml/min,进样时间40 min。紫外波长为230 nm。每个样品至少进行三个独立的生物学重复。gydF4y2Ba
为了测定SA,将新鲜叶子和根组织(~ 100mg)用研浆研磨,加入1ml预冷试剂I,在4°C下提取过夜。离心8000 g 10 min,收集上清液,用0.5 ml试剂提取残渣2 h。取上清液,结合三次,40℃蒸发至无有机相,加入试剂II 20 μl,摇匀1 min。加入试剂III (1 ml)三次提取,将上有机相转移到新的EP管中,氮气干燥,并加入0.5 ml流动相进行溶解。样品用针状过滤器过滤。测试结果为free SA。然后在低水相中加入0.5 ml试剂IV,振荡1 h,再加入1 ml试剂III和0.5 ml流动相溶出。剩余结果为绑定SA。每个样品10微升注入Kromasil C18反相柱(250 mm × 4.6 mm),使用HPLC系统(Rigol L3000, Rigol, Beijing, China)进行分析。流动相为1%乙酸水溶液和甲醇(40:60)。 The column temperature was 35 °C, the flow rate was 0.8 ml/min, and the sampling time was 40 min. The excitation wavelength was 294 nm, and the emission wavelength was 426 nm. At least three independent biological replicates of each sample were performed.
柠檬酸和苹果酸含量的测定gydF4y2Ba
新鲜的叶子和根用于测量柠檬酸和苹果酸内容物[gydF4y2Ba76.gydF4y2Ba].样品(~ 100mg)立即在液态氮中冷冻gydF4y2Ba2gydF4y2Ba和彻底接地并用1ml甲醇萃取:去离子H.gydF4y2Ba2gydF4y2BaO(3:1; v / v)混合物。在分析之前,用0.22μM-孔孔尼龙注射器过滤器(现象,托兰斯,CA)过滤所有样品。将提取物与甲醇(3:1; v / v)混合并使用HPLC系统(Agilent 1100,Agilent,SC,USA)分析,含有Kromasil C18反相柱(250mm×4.6mm)以分离柠檬酸来自不同样品的苹果酸。柱温,流速和取样时间分别为25℃,0.8ml / min和20分钟。阵列检测器设置为214nm。gydF4y2Ba
使用QRT-PCR验证mRNA-SEQ数据gydF4y2Ba
为了确认RNA-SEQ数据,使用QRT-PCR进行一些不同的键基因。根据Chen等人的方法,将总RNA与M-MLV逆转录酶(Takara,大连)的逆转录成第一链CDNA。(2011)。20μlQRT-PCR反应混合物包含以下:1μL正向和反向引物,包括铁稳态相关基因,硫代谢相关基因,植物激素相关基因和有机酸合成相关基因(表SgydF4y2Ba3.gydF4y2Ba), 2 μl cDNA, 10 μl Faststart Universal SYBR Green Master (ROX, Mannheim, Germany)。利用PCR条件对这些基因的dsDNA合成进行扩增和检测,如表S所示gydF4y2Ba4.gydF4y2Ba.每个样本有三个独立的重复。使用比较阈值循环(CT)方法计算相对基因表达水平。gydF4y2Bagmeif1b和gmactingydF4y2Ba是内部控制。基因mRNA转录丰度值表示为2gydF4y2Ba——ΔΔCtgydF4y2Ba[gydF4y2Ba84.gydF4y2Ba].qRT-PCR使用QuantStudio™6 Flex系统(Life Technologies, Thermos, USA)进行。gydF4y2Ba
统计分析gydF4y2Ba
对于干重,使用根浴溶液的pH和叶绿素荧光参数,二十重复。对于生理和生物化学分析,进行至少三种重复。每个实验都包含三种生物重复。使用SPSS 13.0(SPSS Inc.,Chicago,IL)中的单向或双向ANOVA测试统计显着性,结果表示为平均值±SE。hoc比较使用Tukey测试进行了显着性水平的gydF4y2BaP.gydF4y2Ba< 0.05。gydF4y2Ba
可用性数据和材料gydF4y2Ba
我们的原始Illumina序列数据存放在国家生物技术信息中心(NCBI)中,并在序列读取归档(SRA)数据库中访问(gydF4y2Bahttp://www.ncbi.nlm.nih.gov/sragydF4y2Ba).登录号为PRJNA655258 (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/bioproject/PRJNA655258gydF4y2Ba),包括12项,包括12项(SAMN15731791-SAMN15731802)。本研究期间生成或分析的所有数据都包含在本发布的文章和补充信息文件中。gydF4y2Ba
缩写gydF4y2Ba
- 与原:gydF4y2Ba
-
细胞分裂素gydF4y2Ba
- GA:gydF4y2Ba
-
吉布林素gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱盐酸gydF4y2Ba
- 乙:gydF4y2Ba
-
乙烯gydF4y2Ba
- BR:gydF4y2Ba
-
BrassinosteroidgydF4y2Ba
- 是:gydF4y2Ba
-
茉莉酸gydF4y2Ba
- SA:gydF4y2Ba
-
水杨酸gydF4y2Ba
- IRT1:gydF4y2Ba
-
铁调节器运输车gydF4y2Ba
- FRO2:gydF4y2Ba
-
铁还原氧化酶2gydF4y2Ba
- bHLH:gydF4y2Ba
-
基本螺旋环 - 螺旋蛋白gydF4y2Ba
- Pn:gydF4y2Ba
-
光合作用gydF4y2Ba
- WUE:gydF4y2Ba
-
水分利用效率gydF4y2Ba
- 圣:gydF4y2Ba
-
硫酸盐转运蛋白gydF4y2Ba
- atp:gydF4y2Ba
-
ATP硫酸化酶gydF4y2Ba
- APK:gydF4y2Ba
-
腺苷素硫酸盐激酶gydF4y2Ba
- APR:gydF4y2Ba
-
Phosphoadenosine phosphosulphate还原酶gydF4y2Ba
- 先生:gydF4y2Ba
-
亚硫酸盐还原酶gydF4y2Ba
- 星期六:gydF4y2Ba
-
丝氨酸gydF4y2BaO.gydF4y2Ba- 乙酰转移酶gydF4y2Ba
- OAS-TL:gydF4y2Ba
-
O.gydF4y2Ba-acetylserine(硫醇)裂合酶gydF4y2Ba
- 研究生院理事会:gydF4y2Ba
-
胱硫胺γ-合成酶gydF4y2Ba
- CBL:gydF4y2Ba
-
胱硫醚beta-lyasegydF4y2Ba
- 大都会:gydF4y2Ba
-
甲硫氨酸合成酶gydF4y2Ba
参考资料gydF4y2Ba
- 1.gydF4y2Ba
Guerinot ml。改善水稻产量 - 熨烫细节。自然生物技术。2001; 19:417。gydF4y2Ba
- 2.gydF4y2Ba
铁矿山开采的新途径。新植醇。2017;214(2):521 - 5。gydF4y2Ba
- 3.gydF4y2Ba
王志强,王志强,王志强,等。拟南芥铁吸收的分子机制。植物科学进展。2015;20(2):124-33。gydF4y2Ba
- 4.gydF4y2Ba
Ramirez L,Simontacchi M,Murgia I,Zabaleta E,Lamattina L.一氧化氮,亚硝基铁综合物,铁蛋白和脱脂蛋白:装备良好的队伍,以保护植物铁袜。植物SCI。2011; 181(5):582-92。gydF4y2Ba
- 5.gydF4y2Ba
Tsai Hh,Schmidt W.一种方式。还是另一个?植物的熨斗吸收。新植物。2017; 214(2):500-5。gydF4y2Ba
- 6。gydF4y2Ba
Lucena JJ,Hernandez-Apaolaza L.植物中的铁营养:概述。植物土壤。2017; 418(1-2):1-4。gydF4y2Ba
- 7。gydF4y2Ba
居里C, Briat J-F。植物中铁的运输和信号转导。植物学报。2003;54(1):183-206。gydF4y2Ba
- 8。gydF4y2Ba
沃克艾尔,康诺利艾尔。泵铁时间:高等植物缺铁信号机制。植物学报。2008;11(5):530-5。gydF4y2Ba
- 9。gydF4y2Ba
摩根富林明。植物根系对三种丰富的土壤矿物质:硅、铝和铁的响应。植物学报,2005;24(4):267-81。gydF4y2Ba
- 10.gydF4y2Ba
陈J,吴FH、商欧美王WH,胡锦涛WJ,西蒙M,刘X,上官ZP、郑霍奇金淋巴瘤。硫化氢提高了对gydF4y2Ba玉米gydF4y2Ba幼苗对铁缺乏症。J Exp Bot。2015; 66(21):6605-22。gydF4y2Ba
- 11.gydF4y2Ba
Graziano M,Lamattina L.番茄根的铁缺乏的分子和生理反应需要一氧化氮积累。工厂J. 2007; 52(5):949-60。gydF4y2Ba
- 12.gydF4y2Ba
梁刚,张曼敏,李晓林,艾强,于迪强。bHLH转录因子bHLH115调节体内铁的稳态gydF4y2Ba拟南芥gydF4y2Ba.J Exp Bot。2017; 68(7):1743-55。gydF4y2Ba
- 13.gydF4y2Ba
Briat摩根富林明。铁蛋白在植物中的作用。植物营养学报,1996;19(8-9):1331-42。gydF4y2Ba
- 14.gydF4y2Ba
一个铁依赖的调控序列参与的转录控制的特性gydF4y2BaATTER1.gydF4y2Ba和gydF4y2BaZmFer1gydF4y2Ba植物铁蛋白基因通过铁。生物化学学报。2001;276(8):5584-90。gydF4y2Ba
- 15.gydF4y2Ba
Briat JF, Ravet K, Arnaud N, Duc C, Boucherez J, Touraine B, Cellier F, Gaymard F.对铁蛋白合成和功能的新见解强调了植物中铁稳态和氧化应激之间的联系。安机器人。2010;105(5):811 - 22所示。gydF4y2Ba
- 16.gydF4y2Ba
李国杰,宋海英,李波辉,Kronzucker HJ,史文敏。植物生长素抗性1和pin - form2保护铁胁迫下拟南芥侧根的形成。植物杂志。2015;169(4):2608 - 23所示。gydF4y2Ba
- 17。gydF4y2Ba
Schmidt W,Schikora A.不同的途径涉及磷酸盐和铁胁迫引起的根表皮细胞发育的改变。植物理性。2001; 125(4):2078-84。gydF4y2Ba
- 18。gydF4y2Ba
GarcíaMJ,Lucena C,Romera FJ,Alcántarae,Pérez-vicente r.乙烯和一氧化氮参与拟南芥中铁采集和稳态相关的关键基因的上调。J Exp Bot。2010; 61(14):3885-99。gydF4y2Ba
- 19。gydF4y2Ba
Lucena C, Waters BM, Romera FJ, García MJ, Morales M, Alcántara E, Pérez-Vicente rgydF4y2Ba+gydF4y2Ba- atp酶基因表达通过影响FER(或FER-like)基因活性。中国生物医学工程学报。2006;57(15):4145-54。gydF4y2Ba
- 20.gydF4y2Ba
雷光军,朱晓峰,王志伟,董峰,董ny,郑淑娟。脱落酸通过促进根铁的再利用和从根到茎的运输来缓解拟南芥的铁缺乏。植物学报。2014;37(4):852-63。gydF4y2Ba
- 21.gydF4y2Ba
Séguéla M, Briat J-F, Vert G, Curie C.细胞分裂素通过生长依赖途径负调控拟南芥根铁吸收机制。植物j . 2008; 55(2): 289 - 300。gydF4y2Ba
- 22.gydF4y2Ba
对信号的感知:植物缺铁反应的调控。acta physica sinica, 2012; 32(9):1521 - 1530。gydF4y2Ba
- 23.gydF4y2Ba
王志强,王志强,王志强,等。茉莉酸对缺铁基因表达的抑制作用。植物生理学报。2011;49(5):530-6。gydF4y2Ba
- 24.gydF4y2Ba
王b,李克,张w-h。芸苔类固醇涉及水稻的Fe SoosoTasis(gydF4y2Ba栽培稻gydF4y2Bal .)。中国农业科学。2015;66(9):2749-61。gydF4y2Ba
- 25.gydF4y2Ba
沉C,杨y,刘k,张l,u o,太阳t,王h.内源水杨酸在拟南芥中的铁缺乏响应中的参与。J Exp Bot。2016; 67(14):4179-93。gydF4y2Ba
- 26。gydF4y2Ba
(1)硫化氢对拟南芥种子萌发的影响;(2)硫化氢对拟南芥种子萌发的影响。植物学报,2016;gydF4y2Ba
- 27。gydF4y2Ba
Ali B,Qian P,Sun R,Farooq Ma,Gill Ra,王J,Azam M,Zhou W.硫化氢缓解铝诱导的变化gydF4y2Ba芸苔属植物显著gydF4y2Ba正如植物的理化和超微结构研究所揭示的那样。Environ SCI Poll Res。2015; 22(4):3068-81。gydF4y2Ba
- 28。gydF4y2Ba
陈健,王文辉,吴方华,尤春英,刘太田,董晓军,何建新,郑海林。硫化氢减轻铝对大麦幼苗的毒性。土壤植物。2013;362(1 - 2):301 - 18。gydF4y2Ba
- 29。gydF4y2Ba
胡,刘德,李P,沉W.硫化氢延迟储存水菠菜的叶片变黄(gydF4y2Ba番薯aquaticagydF4y2Ba),通过延缓叶绿素的分解,维持能量状态和提高抗氧化能力。生物技术。2015;108:8-20。gydF4y2Ba
- 30。gydF4y2Ba
张浩,叶玉坤,王胜,罗建平,唐杰,马德发。硫化氢可以抵消甘薯幼苗叶片的叶绿素损失,减轻渗透胁迫下的氧化损伤。植物生长规律。2009;58(3):243-50。gydF4y2Ba
- 31.gydF4y2Ba
陈杰,王夫,吴fh,他,刘x,上官zp,郑hl。硫化氢通过在大麦幼苗根系中通过一氧化氮介导的IONOSOSTAS维持耐盐性。SCI REP。2015; 5:12516。gydF4y2Ba
- 32.gydF4y2Ba
Mostofa MG, Saegusa D, Fujita M, Tran LSP。硫化氢通过维持钠来调节水稻的耐盐性gydF4y2Ba+gydF4y2Ba/ KgydF4y2Ba+gydF4y2Ba在过度盐胁迫下平衡,矿物稳态和氧化代谢。前植物SCI。2015; 6:14。gydF4y2Ba
- 33.gydF4y2Ba
陈杰,尚云涛,王文辉,陈小勇,何明梅,郑海林,上官志平。硫化氢介导的多胺和糖的变化参与了硫化氢诱导的耐旱性gydF4y2BaSpinacia oleraceagydF4y2Ba幼苗。前植物SCI。2016; 7:1173。gydF4y2Ba
- 34.gydF4y2Ba
刘X,陈继,王GH,王WH,沉ZJ,罗先生,高GF,西蒙M,Ghoto K,郑HL。硫化氢通过减少锌吸收和调节抗氧化酶和金属噻吩的表达而在镉/锌高沉淀器的根中表达来减轻锌毒性gydF4y2Ba龙葵gydF4y2BaL.植物土壤。2015; 400:177-92。gydF4y2Ba
- 35.gydF4y2Ba
Shi H,YE T,Chan Z.一氧化氮活化的硫化氢对于百慕大的镉应激反应至关重要(gydF4y2Ba香附子gydF4y2Ba(l)。是。)。植物理性生物生物。2014; 74:99-107。gydF4y2Ba
- 36.gydF4y2Ba
乔志,景涛,刘铮,张磊,金泽,刘东,裴玉华gydF4y2Ba2gydF4y2BaS作为SA的下游信号分子的作用调节拟南芥中的Cd耐受性。植物土壤。2015; 393(1-2):137-46。gydF4y2Ba
- 37.gydF4y2Ba
李志刚,朱立平。硫化氢供体氢氧化钠诱导的甜菜碱积累参与了玉米幼苗耐热性的获得。植物学报。2015;38(1):31-8。gydF4y2Ba
- 38.gydF4y2Ba
García-Mata C,Lamattina L.硫化氢,一种涉及防护电池信号传导的新型汽油反转。新植物。2010; 188(4):977-84。gydF4y2Ba
- 39.gydF4y2Ba
陈俊,吴飞,王夫,郑cj,林gh,东Xj,他jx,pei zm,zheng hl。硫化氢通过促进叶绿体生物发生,光合酶表达和硫醇氧化还原改性而增强光合作用gydF4y2BaSpinacia oleraceagydF4y2Ba幼苗。J Exp Bot。2011; 62(13):4481-93。gydF4y2Ba
- 40.gydF4y2Ba
Graziano M,Beligni MV,Lamattina L.一氧化氮在植物中提高了内部铁可用性。植物理性。2002; 130(4):1852-9。gydF4y2Ba
- 41.gydF4y2Ba
硫化氢作为一种内源性平滑肌松弛剂与一氧化氮协同作用的可能作用。生物物理学报。1997;37(3):527-31。gydF4y2Ba
- 42.gydF4y2Ba
Aksoy E,Maqbool A,Tindas I,Caliskan S. Soybean:一个新的前沿,了解植物中的粘性缺乏耐受机制。植物土壤。2017; 418(1-2):37-44。gydF4y2Ba
- 43.gydF4y2Ba
naeve sl。大豆缺铁萎缩。Agron J. 2006; 98(6):1575-81。gydF4y2Ba
- 44.gydF4y2Ba
Roriz M, Carvalho SMP, Vasconcelos MW。高相对空气湿度影响缺铁大豆植株中矿物质的积累和生长。植物科学学报。2014;5:726。gydF4y2Ba
- 45.gydF4y2Ba
Tiwari, Mamedov F, Grieco M, Suorsa M, Jajoo A, Styring S, Tikkanen M, Aro EM.光系统I中铁硫团簇的光损伤诱导非光化学能量耗散。Nat植物。2016;2(4):9。gydF4y2Ba
- 46.gydF4y2Ba
陈志强,陈志强。磷和铁的互作对大豆固氮的影响。环境实验机器人。2009;66(1):94-9。gydF4y2Ba
- 47.gydF4y2Ba
王志强,王志强,王志强,等。大豆根瘤对铁缺乏的影响。植物学报2014;127(3):455-65。gydF4y2Ba
- 48.gydF4y2Ba
(1)大豆生长、固氮和铵态氮同化的研究进展(gydF4y2Ba菜豆gydF4y2BaL)铁缺乏。土壤植物。2008;312(1/2):49-57。gydF4y2Ba
- 49.gydF4y2Ba
徐酸,李泽,刘静脉,邱bs。铁缺乏对太湖湖中三种盛开的蓝藻物种生长和光合作用的影响。Phycol Res。2017; 65(2):151-9。gydF4y2Ba
- 50。gydF4y2Ba
Larbi A,Abadia A,Abadia J,Morales F.在不同环境中生长的Fe缺陷植物中的光吸收,光化学和羧化的共同调节。Photosynth Res。2006; 89(2-3):113-26。gydF4y2Ba
- 51。gydF4y2Ba
Hantzis LJ, Kroh GE, Jahn CE, Cantrell M, Peers G, Pilon M, Ravet K.缺铁时期的铁经济程序针对特定的铁蛋白。植物杂志。2018;186:596 - 610。gydF4y2Ba
- 52。gydF4y2Ba
朱晓芳,王波,宋文芳,郑淑娟,沈瑞芬。腐胺通过依赖no的根细胞壁铁的再利用缓解拟南芥的铁缺乏。植物杂志。2016;170(1):558 - 67。gydF4y2Ba
- 53。gydF4y2Ba
Tsai Hh,Schmidt W.由植物传播的香豆素调动铁。趋势植物SCI。2017; 22(6):538-48。gydF4y2Ba
- 54。gydF4y2Ba
Santos CS, Roriz M, Carvalho SMP, Vasconcelos MW。生长早期的铁分配影响大豆植株对铁缺乏的反应(gydF4y2Ba大豆gydF4y2Bal .)。趋势植物SCI。2015; 6:12。gydF4y2Ba
- 55。gydF4y2Ba
靳春春,游贵,何艳芳,唐超,吴鹏,郑淑娟。缺铁诱导的酚类物质分泌有利于红三叶草根外体铁的再利用。植物杂志。2007;144(1):278 - 85。gydF4y2Ba
- 56.gydF4y2Ba
陈某,杨杰,秦c,金cw,mo jh,ye t,zheng sj。一氧化氮作用在蟾蜍蛋白的下游,以响应拟南芥的铁缺乏率触发根系螯合物还原酶活性。植物理性。2010; 154(2):810-9。gydF4y2Ba
- 57.gydF4y2Ba
林晓燕,叶玉强,范克勤,金春旺,郑淑娟。增加的蔗糖积累通过促进生长素信号调节拟南芥的缺铁反应。植物杂志。2016;170(2):907 - 20。gydF4y2Ba
- 58.gydF4y2Ba
Shanmugam V,王YW,Tsednee M,Karunakaran K,YEH KC。谷胱甘肽在一氧化氮中介导的氧化铁缺乏信令和拟南芥的铁缺乏耐受性起到重要作用。工厂J. 2015; 84(3):464-77。gydF4y2Ba
- 59.gydF4y2Ba
Murgia I,Delledonne M,Soave C.一氧化氮在拟南芥中介导铁诱导的铁蛋白积累。工厂J. 2002; 30(5):521-8。gydF4y2Ba
- 60。gydF4y2Ba
Kaiser BN, Moreau S, Castelli J, Thomson R, Lambert A, Bogliolo S, Puppo A, Day DA。大豆NRAMP同源物,gydF4y2BaGmDMT1gydF4y2Ba,是一种能够铁铁运输的共生二价金属转运蛋白。工厂J. 2003; 35(3):295-304。gydF4y2Ba
- 61。gydF4y2Ba
关键词:番茄,硫,铁,营养,营养因子,硫,铁植物杂志。2015;169(4):2624 - 39。gydF4y2Ba
- 62。gydF4y2Ba
astolfi s,zuchi s,neumann g,cesco s,di toppi ls,Pinton R.大麦植物对Fe缺乏的响应和CD污染受到S饥饿的影响。J Exp Bot。2012; 63(3):1241-50。gydF4y2Ba
- 63。gydF4y2Ba
硫剥夺限制番茄植株的缺铁反应。足底。2009;230(1):85 - 94。gydF4y2Ba
- 64.gydF4y2Ba
Buchner P,Stuiver Cee,Westerman S,Wirtz M,Hell R,Hawkesford MJ,De Kok LJ。调节硫酸盐摄取及硫酸盐转运基因的表达gydF4y2BaBrassica oleracea.gydF4y2Ba受大气H的影响gydF4y2Ba2gydF4y2BaS和硫酸族硫酸盐营养。植物理性。2004; 136(2):3396-408。gydF4y2Ba
- 65.gydF4y2Ba
通过改变aux1介导的生长素分布,局部铁供应触发拟南芥侧根伸长。植物细胞,2012;24(1):33-49。gydF4y2Ba
- 66.gydF4y2Ba
吴t,张ht,王y,jia ws,xu xf,张xz,韩zh。根部Fe(LLL)还原酶活性和通过铁缺乏质子挤出的诱导由基于生长素的全身信号传导介导的介导gydF4y2Ba马吕斯xiaojinensisgydF4y2Ba.J Exp Bot。2012; 63(2):859-70。gydF4y2Ba
- 67.gydF4y2Ba
Matsuoka K,Furukawa J,Bidadi H,Asahina M,Yamaguchi S,Satoh S.Gibberellin诱导拟南芥中Fe吸收相关基因的表达。植物细胞生理。2014; 55(1):87-98。gydF4y2Ba
- 68.gydF4y2Ba
关键词:拟南芥,铁缺乏,组织特异性调控,赤霉素,拟南芥培养细胞。2016;37(2):190 - 200。gydF4y2Ba
- 69.gydF4y2Ba
赵米,宋A,李鹏,陈某,姜师,陈F.菊花缺乏缺乏Fe缺乏的铁摄入量。SCI批准。2014; 4:6694。gydF4y2Ba
- 70。gydF4y2Ba
刘伟,Karemera NJU,吴涛,杨勇,张旭,徐旭,王颖,韩铮。乙烯反应因子gydF4y2BaAterf4.gydF4y2Ba负面调节缺铁反应gydF4y2Ba拟南芥gydF4y2Ba.Plos一个。2017; 12(10):E0186580。gydF4y2Ba
- 71。gydF4y2Ba
Martins S,Montiel-Jorda A,Cayrel A,Huguet S,Roux CP-L,Ljung K,Vert G.芸苔类固醇信号依赖性根响应长期升高的环境温度。NAT Communce。2017; 8(1):309。gydF4y2Ba
- 72。gydF4y2Ba
王b,李啊,张w-h。芸苔类化合物参与黄瓜的反应(gydF4y2BaCucumis sativusgydF4y2Ba)缺铁。Ann Bot。2012; 110(3):681-8。gydF4y2Ba
- 73。gydF4y2Ba
Kobayashi T,Itai RN,Senoura T,Oikawa T,Ishimaru Y,Ueda M,Nakanishi H,Nishizawa NK。在稻根的烫发反应的早期阶段激活了茉莉酸族信号传导。植物痣Biol。2016; 91(4-5):533-47。gydF4y2Ba
- 74。gydF4y2Ba
康海峰,福莱RC, Oñate-Sánchez L,林C,辛格KB。OBP3是一种dof转录因子,其靶基因包括由水杨酸诱导的新型碱性螺旋-环-螺旋结构域蛋白。植物j . 2003; 35(3): 362 - 72。gydF4y2Ba
- 75。gydF4y2Ba
Rellán-Álvarezr,Giner-Martínez-sierra J,Orduna J,Orera I,Rodríguez-CastrillónJá,García-Alonso Ji,AbadíaJ,Álvarez-FernándezA.识别三铁(III),三柠檬酸三柠檬络合物在铁缺乏型番茄的木质SAP中,用铁重新拍摄:新的洞察厂铁长途运输。植物细胞生理。2010; 51(1):91-102。gydF4y2Ba
- 76。gydF4y2Ba
硅通过促进根质外体铁的动员来缓解黄瓜缺铁现象。新植醇。2013;198(4):1096 - 107。gydF4y2Ba
- 77。gydF4y2Ba
关键词:缺铁,葡萄根茎,有机酸,代谢土壤植物。2015;394(1 - 2):165 - 75。gydF4y2Ba
- 78。gydF4y2Ba
Lichtenthaler港元。叶绿素和类胡萝卜素:光合生物膜的色素。甲安非他明酶:学术出版社;1987.p . 350 - 82。gydF4y2Ba
- 79。gydF4y2Ba
Grusak马。全根铁(III)还原酶活性贯穿铁生长的整个生命周期gydF4y2BaPisum sativum.gydF4y2BaL.(Fabaceae):与培养种子的铁营养相关。Planta。1995年; 197(1):111-7。gydF4y2Ba
- 80。gydF4y2Ba
李志刚,李志刚,李志刚。l -半胱氨酸对硫化氢释放的影响[J]。植物杂志。1982;70(2):430 - 6。gydF4y2Ba
- 81。gydF4y2Ba
Del Longo Ot,GonzálezCA,Pastori Gm,Trippi Vs.两排玉米叶片中的超氧基和高骨质条件下的抗氧化剂防污,差异敏感性敏感性。植物细胞生理。1993; 34(7):1023-8。gydF4y2Ba
- 82.gydF4y2Ba
王国强,郝世生,高斌,陈明森,刘玉刚,杨建军,叶宁华,张建辉。灌浆过程中水稻茎秆碳储备再动员的基因表达调控。植物生理学报。2017;58(8):1391-404。gydF4y2Ba
- 83.gydF4y2Ba
张宁,张慧娟,赵波,孙玉青,曹云英,李锐,吴晓霞,魏达S,李丽,任胜。黄瓜侧根形成中褪黑激素响应基因表达谱的RNA-seq分析。中国科学(d辑:地球科学)2014;56(1):39-50。gydF4y2Ba
- 84。gydF4y2Ba
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据gydF4y2Ba−ΔΔgydF4y2BaCT方法。方法。2001; 25(4):402-8。gydF4y2Ba
致谢gydF4y2Ba
我们致谢并感谢厦门大学海磊郑教授,为改善这份手稿提供了关键的建议和宝贵意见。gydF4y2Ba
资金gydF4y2Ba
本研究得到了中国(NSFC)的自然科学基金(31501822)和中国博士生科学基金(2015 M580876和2016 T90948)的财务支持,以及香港研究赠款理事会(14122415,14177617,AOE / M-05/12,AOE / M-403/16)。资助机构没有参与数据的研究,收集,分析和解释,以及写作稿件。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
JC完成了所有的实验,分析了数据并撰写了手稿。NNZ、QP、XYL协助实验。ZPSG和JHZ帮助修改稿件。JC和GHW策划和设计了研究,撰写和修改了手稿。值得一提的是,所有的作者都阅读并批准了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明,在没有任何可能被解释为潜在利益冲突的商业或财务关系的情况下进行了这项研究。所有作者宣布他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。gydF4y2Ba
补充信息gydF4y2Ba
额外的文件1。gydF4y2Ba
材料和方法。gydF4y2Ba图S1。gydF4y2BaH.gydF4y2Ba2gydF4y2Ba从NaHS中提取的其他含硫或含钠化合物对缺铁时叶绿素浓度的增加没有影响gydF4y2Ba大豆gydF4y2Ba幼苗。gydF4y2Ba大豆gydF4y2Ba用100 μM的不同硫化合物(NaHS、Na)处理幼苗gydF4y2Ba2gydF4y2Ba年代,NagydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4.gydF4y2Ba,nagydF4y2Ba2gydF4y2Ba所以gydF4y2Ba3.gydF4y2Ba, NaHSOgydF4y2Ba4.gydF4y2Ba, NaHSOgydF4y2Ba3.gydF4y2Ba和NaAC在缺铁(−Fe, 1 μM Fe)条件下持续15 d。gydF4y2Ba图S2。gydF4y2BaNaHS对缺铁地区根瘤数和干重的影响gydF4y2Ba大豆gydF4y2Ba植物。3-W老年人gydF4y2Ba大豆gydF4y2Ba用含有1 μM Fe(III)-EDTA或50 μM Fe(III)-EDTA的营养液和不含100 μM NaHS的营养液处理幼苗15 d。误差柱代表平均值±SE。标有不同字母的列表示与的显著差异gydF4y2BaP.gydF4y2Ba< 0.05。gydF4y2Ba图S3。gydF4y2Banahs对净光合作用(pn)(a),气孔电导(gs)(b),颈内有限公司的影响gydF4y2Ba2gydF4y2Ba(C)和水分利用效率(D)gydF4y2Ba大豆gydF4y2Ba植物。3-W老年人gydF4y2Ba大豆gydF4y2Ba用含有1 μM Fe(III)-EDTA或50 μM Fe(III)-EDTA的营养液和不含100 μM NaHS的营养液处理幼苗15 d。误差柱代表平均值±SE。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+Fe + NaHS, 100 μM NaHS和50 μM Fe处理幼苗。gydF4y2Ba图S4。gydF4y2BaNAHS对光束II(PSII)(A),电子传输比(ETR)(B),FV / FM(C)和FV` / FM`(D)的影响gydF4y2Ba大豆gydF4y2Ba植物。3-W老年人gydF4y2Ba大豆gydF4y2Ba用含有1 μM Fe(III)-EDTA或50 μM Fe(III)-EDTA的营养液和不含100 μM NaHS的营养液处理幼苗15 d。误差柱代表平均值±SE。标有不同字母的列表示与的显著差异gydF4y2BaP.gydF4y2Ba< 0.05。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+Fe + NaHS, 100 μM NaHS和50 μM Fe处理幼苗。gydF4y2Ba图S5。gydF4y2BaNaHS对Cu(A-C),Mn(D-F)和Zn(G-I)浓度的耐铁缺陷效应gydF4y2Ba大豆gydF4y2Ba植物。3-W老年人gydF4y2Ba大豆gydF4y2Ba用含有1 μM Fe(III)-EDTA或50 μM Fe(III)-EDTA的营养液和不含100 μM NaHS的营养液处理幼苗15 d。误差柱代表平均值±SE。标有不同字母的列表示与的显著差异gydF4y2BaP.gydF4y2Ba< 0.05。gydF4y2Ba图S6。gydF4y2Ba转录组测序数据的相关性检验gydF4y2Ba大豆gydF4y2Ba的根源。每次处理有三次生物重复。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+Fe + NaHS, 100 μM NaHS和50 μM Fe处理幼苗。gydF4y2Ba图S7。gydF4y2Ba火山图显示DEGsgydF4y2Ba大豆gydF4y2Ba在缺铁条件下用NaHS处理幼苗。生物重要(日志gydF4y2Ba2gydF4y2Ba折数变化)在x轴上表示,且具有统计学意义(log)gydF4y2Ba10gydF4y2Ba)在y轴上表示。统计显著性在gydF4y2BaP.gydF4y2Ba< 0.05。(a)-fe + nahs vs -fe;(b)+ Fe + Nah vs + Fe;(c)-fe vs + fe;(d)+ fe + nah vs -fe + nahs。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+Fe + NaHS, 100 μM NaHS和50 μM Fe处理幼苗。gydF4y2Ba图S8。gydF4y2Ba显着富集的基因本体论(GO)术语(gydF4y2BaP.gydF4y2Ba < 0.05) in the gene expression numbers in the root of大豆gydF4y2Ba在缺铁条件下用Nah治疗。(a)在-fe + nahs下的上调基因与-fe条件;(b)在-Fe + NaHs下的下调基因与-Fe条件;(c)上调基因+ Fe + NaHs Vs + Fe条件;(d)下调基因+ Fe + NaHs Vs + Fe条件下。GO术语属于生物学过程,分子函数和细胞组分分别以绿色,蓝色和器官显示。gydF4y2Ba表S1。gydF4y2Ba转录组测序数据摘要gydF4y2Ba大豆gydF4y2Ba在缺铁条件下用NaHS处理根。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+Fe + NaHS, 100 μM NaHS和50 μM Fe处理幼苗。gydF4y2Ba表S2。gydF4y2Ba不同表达级别间隔中基因的统计gydF4y2Ba大豆gydF4y2Ba在缺铁条件下用NaHS处理根。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+Fe + NaHS, 100 μM NaHS和50 μM Fe处理幼苗。gydF4y2Ba表S3。gydF4y2Ba利用qRT-PCR分析紫花苜蓿根中基因表达的正、反引物序列gydF4y2Ba大豆gydF4y2Ba缺铁条件下育苗。gydF4y2Ba表S4。gydF4y2BaQRT-PCR中用于基因表达分析的DSDNA合成的程序gydF4y2Ba大豆gydF4y2Ba幼苗在铁缺乏症条件下。gydF4y2Ba表S5。gydF4y2Ba利用转录组研究铁同化相关基因表达水平gydF4y2Ba大豆gydF4y2Ba在缺铁条件下用NaHS处理根。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+Fe + NaHS, 100 μM NaHS和50 μM Fe处理幼苗。gydF4y2Ba表S6。gydF4y2Ba硫磺同化相关的基因表达水平使用转录组gydF4y2Ba大豆gydF4y2Ba在缺铁条件下用NaHS处理根。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+Fe + NaHS, 100 μM NaHS和50 μM Fe处理幼苗。gydF4y2Ba表S7。gydF4y2Ba利用转录组研究植物激素相关基因表达水平gydF4y2Ba大豆gydF4y2Ba在缺铁条件下用NaHS处理根。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+Fe + NaHS, 100 μM NaHS和50 μM Fe处理幼苗。gydF4y2Ba表S8。gydF4y2Ba有机酸相关基因表达水平使用转录组gydF4y2Ba大豆gydF4y2Ba在缺铁条件下用NaHS处理根。-Fe, 1 μM Fe;−Fe + NaHS,用100 μM NaHS和1 μM Fe处理的幼苗;+Fe, 50 μM Fe;+Fe + NaHS, 100 μM NaHS和50 μM Fe处理幼苗。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
陈建军,张立新。锅,Q。gydF4y2Ba等等。gydF4y2Ba硫化氢通过促进铁可用性和植物激素水平来减轻铁缺乏症gydF4y2Ba大豆gydF4y2Ba幼苗。gydF4y2BaBMC植物杂志gydF4y2Ba20.gydF4y2Ba383(2020)。https://doi.org/10.1186/s12870-020-02601.2.gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02601.2.gydF4y2Ba
关键词gydF4y2Ba
- 硫化氢(HgydF4y2Ba2gydF4y2BaS)gydF4y2Ba
- 铁同化gydF4y2Ba
- 缺铁gydF4y2Ba
- 有机酸gydF4y2Ba
- 植物荷尔蒙gydF4y2Ba
- 大豆(gydF4y2Ba大豆gydF4y2Ba)gydF4y2Ba