抽象的
背景
钾(K.+)对于大多数植物来说是一种必不可少的离子,因为它参与了增长和发育的调节。K.+植物细胞内稳态的进化促进了植物对K的适应+- 缺点压力。Argonaute1(前)由miR168调节RNA沉默复合体(RISC)的小RNA调节途径在西红柿中。但是,角色miR168在K的背景下AGO1的介导调控+西红柿的缺乏压力尚未阐明。
结果
SLMIR168及其靶基因SlAGO1A在低k之间差异表达+-tolerant JZ34和低K+- 敏感JZ18番茄植物。转基因番茄植物组成思考pri-SlmiR168a具有更强的根系生长,叶片更好的发展,较高的K+以K下的根目录+- 表达转基因番茄素的缺点胁迫rslago1a.(SLMIR168-抗性)和野生型(WT)。深度测序结果显示,62个已知的microrna (mirna)表达上调35 s: rSlAGO1与野生型番茄相比。同样的mirna在35s:slmir168a.与WT植物相比。综合分析发现来自62 miRNA的12 miRNA / mRNA对,包括根生长和细胞蛋白(CTK)/脱落酸(ABA)途径。
结论
监管介导SLMIR168的SlAGO1A在低k下有助于植物开发+压力。此外,这种调节机制可能会影响下游miRNA通路以响应低k+通过CTK / ABA和根生长调制途径的压力。
背景
Macronuriver和微量营养素是必须用于植物生长和发展所必需的元素[1].N(氮),P(磷)和K(钾)在相对大量的植物需要的。缺磷可能降低了植物的生长和生物量生产[2那3.].特别是在番茄生产系统中更重要,这需要大量的氮肥输入[4.].K.+也是一种涉及植物细胞中许多生理过程的必要态营养素,例如Osmoregulation,离子稳态,光合作用,膜潜在维护,细胞库和其他人[5.].这些函数依赖于K的高和相对稳定的浓度+在细胞室和K+在不同的细胞室、细胞和组织之间的运动。因此,K+必须容易运输和k+必须严格调节流量。在土壤中,k+通过植物通过根部吸收而占用。K.+Concentration in the cytoplasm is generally maintained at approximately 100 mM [6.].与高K相比+细胞中浓度,k的浓度+在土壤中非常低。而且,由于植物根源直接接触土壤,K+缺乏信号首先由根细胞,特别是根表皮细胞和根毛细胞[感知7.].植物对K有反应+通过改变根生长和根构造的缺乏,例如抑制初级根和刺激根毛伸长率[8.].我们以前描述了低K+宽容的JZ34和低k+敏感JZ18番茄基因型在K下显示不同的根配置+- 缺陷胁迫[9.].
低K.+应激可以激发许多信号分子的活动,包括反应性氧(ROS),CA2+,植物激素,和微RNA(miRNA)在植物细胞中[10.].在拟南芥,K+缺乏诱导ROS产生和NADPH氧化酶基因的表达RHD2.和过氧化酶基因RCI3.[11.].除了ROS,CA2+也可以作为一个低K+响应信号。加利福尼亚州2+传感器(CBL1和CBL9)参与低k+响应及其靶蛋白激酶CIPK23也与AKT1相互作用+掌声[12.].此外,钙2+报告基因YC3.6也可由低K诱导+压力 [9.].许多植物激素的信号转导途径参与了对K的应答+- 缺点应力,如乙烯,养羊酸,细胞蛋白(CTK)和脱落酸(ABA)。据报道,K下乙烯生产+-缺乏应激是上调的[11.那13.].此外,乙烯信号传导也可以调节AtHAK5转录和根系生长拟南芥蒂利亚纳[14.].此外,低k+治疗通过减少养蛋白转运蛋白1蛋白减少植物蛋白积累[15.].K.+转运体AtTRH1/AtKUP也受AtPIN1定位调控并影响K+- 依赖根系系答:芥[16.那17.].性能+胁迫也诱导OsHAK16p:WOX11,生长素和细胞分裂素信号的整合者,导致根的生长和发育增强[18.].低k下的CTK累积减少+应力,与并用增加的ROS产生[19.].先前的研究表明aba对k的抑制作用+摄取可能与k相关+-Atpase [20.].这一种D.D.ition of 5 μM ABA inhibited the transport of K+在低k下+压力 [21.].统称,这些数据表明,植物激素信号传导途径可以协同调节根形态和k+低钾条件下的运输或积累+压力条件。
发挥关键作用的转录调节,最终介导下游植物的反应,特别是在应激条件下[22].miRNA作为转录后因素,很少在角色反应中调查k+缺乏,与其他营养素相比[23那24].已经表明,MiR444 / Mads盒式型号以及MiR319 / TCP4和MiR396 / GRF介导的途径可能有助于低k+大麦植物的耐受性[25].在o .漂白亚麻纤维卷那miR399由低k引起的+压力 [23].前期研究发现,番茄JZ18和JZ34基因型在K+缺乏应激,由miRNA-seq确定。结果表明,miRNA168在番茄JZ18和JZ34基因型中均有显著差异表达+缺乏应激,并证实了这一点,在番茄中;事实上,miRNA168被证实是针对Argonaute1.(前1)在番茄中[26].在植物中,在RNase III Dicer样1切割之后,MiRNA的miRNA链:miRNA *双链体加载到前蛋白质,其具有单链RNA结合的PAZ结构域和RNASEH样PIWI结构域以催化mRNA切割或翻译镇压[27那28].AGO蛋白是RNA诱导沉默复合体(RISC)的核心元素,RISC是一种转录和转录后调节因子,由小RNA引导抑制靶基因表达。mirna被装载到AGO1中,作为RNA切片机[29].十五沼泽在番茄中检测到基因[30.].SlAGO1A那SlAGO1B, 和SlAGO2A由保守的mirnas定位[30.].在拟南芥,微调后转录后调节miR168和前1水平使其他miRNA的稳态与前1组合,控制miRNA的靶基因表达水平[31].addner和martienssen报告说前1显示由MiRNA的异常分布引起的叶极性缺陷,并且已知其靶标志着叶极性[32].此外,研究表明mirna靶向的几种转录因子的稳态水平在叶中增加前1植物 [33].AGO蛋白水平在病毒防御中也至关重要:AGO蛋白过表达诱导病毒感染期间植物发育紊乱[34].番茄叶卷曲新德里病毒后,AC2与前一个接种的相互作用[35].此外,MiR168A调节斯拉戈1S影响番茄植物中的病因相关基因,改变疾病的抗性[36].
在本研究中,我们旨在评估两者之间的平衡SLMIR168和Slago1(Slago1a.)表达响应k+不足的压力Solanum lycopersicum..我们对低钾反应的植物表型进行了表征+压力赋予35s:slmir168a.和35 s: rSlAGO1.我们发现了35s:slmir168a.植物有较强的根系和叶片更好的发展比那些35 s: rSlAGO1低k下的植物+压力。这促使我们使用miRNA-Seq和mRNA-Seq来评估mirna的潜在调控机制SLMIR168- 介绍的调节SlAGO1A回应k+不足。
结果
差异表达SLMIR168和SlAGO1A在JZ18和JZ34
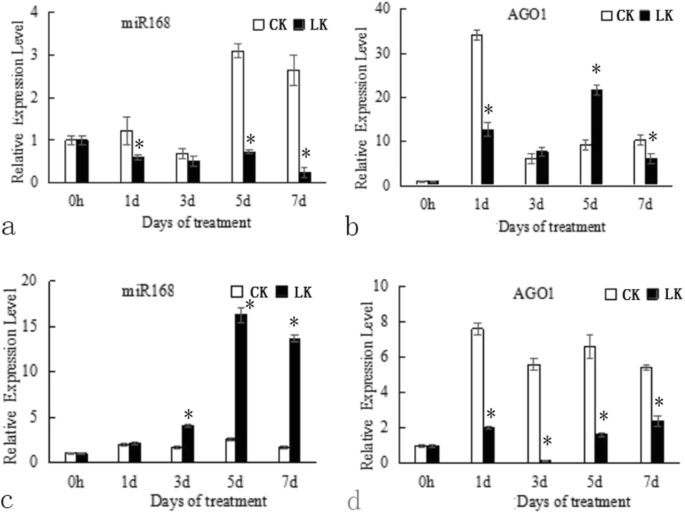
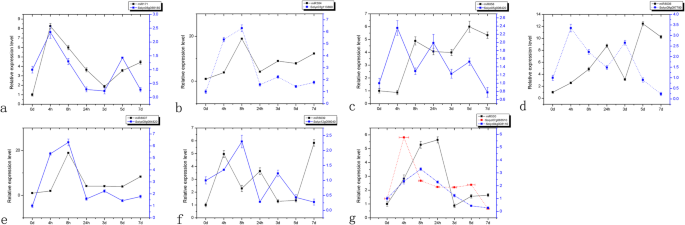
JZ34西红柿(性能+- 与JZ18西红柿相比(低k+- 敏感),显示更好的根开发和k+在K吸收+缺乏条件[9.].根据我们之前的研究中,SLMIR168在jz18和JZ34西红柿之间差异化表达+不足的压力。在本研究中,我们首先进行定量逆转录PCR(RT-PCR)并观察到表达水平SLMIR168正常情况下在JZ18西红柿随时间增加。然而,K下+缺乏压力,SLMIR168水平以时间依赖的方式降低(图。1a).相比之下,在JZ34番茄中SLMIR168在K下显著增加+缺乏胁迫,特别是在3,5和7天后的治疗后(图。1C)。这种表达模式提示SLMIR168表达可能涉及西红柿耐受性的调节+不足。靶基因的表达水平,Slago1a,展示了一种互补模式。SlAGO1AK+在JZ18中缺乏应力治疗3和5天(图。1b)。目标前1A.表达水平明显减少了+与正常条件下相比,JZ34番茄(Fig. 2,图。1d)。作为一个目标SLMIR168那SlAGO1A展示了互补表达模式,表达式SLMIR168实际上响应了低k+压力。差异表达模式SLMIR168和SlAGO1A在低钾胁迫下,JZ18和JZ34之间的差异可能是导致两种番茄基因型的耐受性发生变异的原因之一+压力。
SLMIR168和SlAGO1A在正常钾胁迫下JZ18和JZ34的表达谱+条件和K+缺乏条件。年代一种mples of leaves were collected at 0, 1, 3, 5, and 7 days after treatment.一种.在正常钾胁迫下,JZ18幼苗中miR168的表达水平+和K.+不足的病症;B..这SlAGO1A正常k下JZ18幼苗的表达水平+和K.+不足的病症;C.在正常钾胁迫下,JZ34幼苗中miR168的表达水平+和K.+不足的病症;D..这SlAGO1A正常k下JZ34幼苗的表达水平+和K.+缺乏条件。CK:正常K+(4. mM); LK: K+缺乏(0.5毫米)。误差棒表示三个独立重复的平均值±SE。*与之大的差异P. < 0.05 determined using a Duncan’s test compared with the CK
分析SLMIR168和SlAGO1A不同组织中的表达
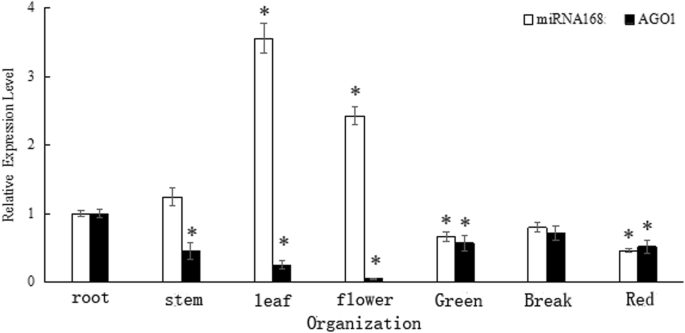
表达SLMIR168和SlAGO1A在番茄植物的不同组织中通过RT-PCR评估(图。2).SLMIR168和SlAGO1A在所有组织中均检测到。的表达水平SLMIR168在叶子和花中最高,然后是根和茎。相反,在茎,叶子和鲜花中,SlAGO1A显示相反的表达模式。
的监管SlAGO1A通过SLMIR168增加植物对钾的耐受性+不足的压力
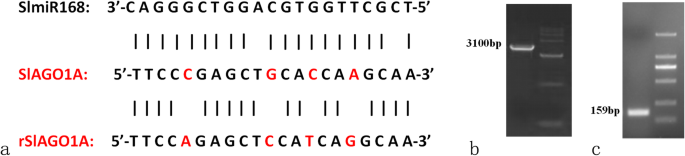
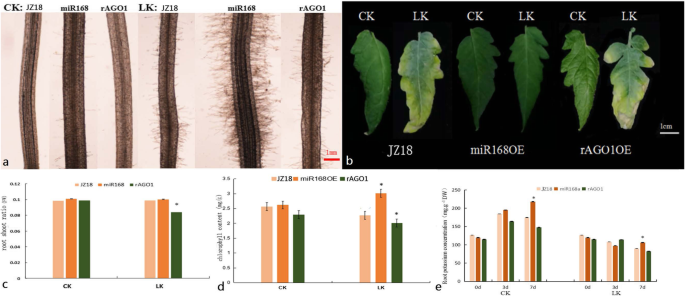
阐明是否…的规定斯拉戈1通过SlmiR168a负责低k的差异+公差,37个转化体的35s:slmir168a.和6个转化体35 s: rSlAGO1获得了。的表达水平SLMIR168目标基因SlAGO1A转化体是在支持文件中列出的(图。8.A和B)。SLMIR168多重构造(rslago1a.)使用点突变产生(图。3.a),没有改变本机蛋白质序列斯拉戈1通过四种碱基的突变。此外,rslago1a.不能受到监管SLMIR168,所以35 s: rSlAGO1变换器可以说明调控的作用SLMIR168.这rSlAGO1和pri-SlmiR168a片段通过PCR对过表达载体的构建(图扩增。3.b和c;参考原始图:图。年代6.和s7.);35s:slmir168a.'第4行和35 s: rSlAGO1选择“第2行”转化体进行实验。wt的根形态,35s:slmir168a., 和35 s: rSlAGO1在正常k的发育7天后,所有这些根本都显示出较大的根系系统+(图S5.).然而,在存在低K+浓度(0.5毫米),根部35s:slmir168a.植物显得强于wt和35 s: rSlAGO1经过7天处理的植株。显微观察发现,根毛数明显增加35s:slmir168a.低钾植物+与wt和wt和wt和wt相比的7天治疗35 s: rSlAGO1植物(图。4.a).在K+缺乏应力(图。4.b)。WT植物的叶片边缘在低k下变为黄色+条件和那些35 s: rSlAGO1植株变黄增加;相比之下,35s:slmir168a.植物没有表现出叶子的黄色。分析根芽比(图。4.c)表明低于K+条件,根冠比35s:slmir168a.植物不与野生型植株相比显著不同。然而,35 s: rSlAGO1与野生型相比,植株的根冠比降低35s:slmir168a.植物。另外,叶绿素含量高度增加35s:slmir168a.植物,但在wt和wt和35 s: rSlAGO1植物在K+缺乏压力与正常k相比+条件(图。4.d)。叶绿素含量35 s: rSlAGO1植物在低k下显着低于WT植物+条件(图。4.d)。叶绿素含量35s:slmir168a.植物比野生型植物显著高于低K值下+条件(图。4.d)。分析K.+根中的内容物(图。4.E)表明,正常ķ下+浓度条件,35s:slmir168a.植株的钾含量增加+随着发育时间的增加,处理7 d时含量最高。在K+缺乏压力,35s:slmir168a.植物也表现出明显高于K+含量比WT植物7天治疗,而35 s: rSlAGO1植物展出了一点k+Contents than WT plants at 7 days treatment. Under low K+浓度条件,35s:slmir168a.植物在K下表现出改善的根和叶生长+不足的压力。而且,35s:slmir168a.植物表现出更高的K.+以K下的根目录+不足的压力。所以35s:slmir168a.植物证明了k的更好耐受性+缺乏压力比35 s: rSlAGO1和wt植物。
WT的形态变化比较,35s:slmir168a.'第4行',和35 s: rSlAGO1“第2行”植物正常K+条件和K+治疗7天后缺乏胁迫。一种.WT的根发区域的变化,35s:slmir168a., 和35 s: rSlAGO1植物under CK and LK conditions after 7 days (100 × magnification) with three biological replicates.B..从WT的自下而上的第五片叶子的差异,35s:slmir168a., 和35 s: rSlAGO115天后CK和LK条件下的植物。C.WT中的根射量比,35s:slmir168a., 和35 s: rSlAGO1植物在CK和LK条件下7天后,三个生物重复。*与CK相比,使用Duncan测试测定的P <0.05的显着差异。D..WT中叶片的叶绿素含量,35s:slmir168a., 和35 s: rSlAGO1植物在CK和LK条件下7天后,具有三个生物学重复。*与CK相比,使用Duncan的测试测定P <0.05的显着差异。E..K.+在WT根的内容,35s:slmir168a., 和35 s: rSlAGO1在3和7天后CK和LK条件下的植物,三个生物重复。*与CK相比,使用Duncan测试测定的P <0.05的显着差异。CK:正常K+(4. mM); LK: K+缺乏(0.5毫米)
分析miRNA测序数据35s:slmir168a.和35 s: rSlAGO1植物
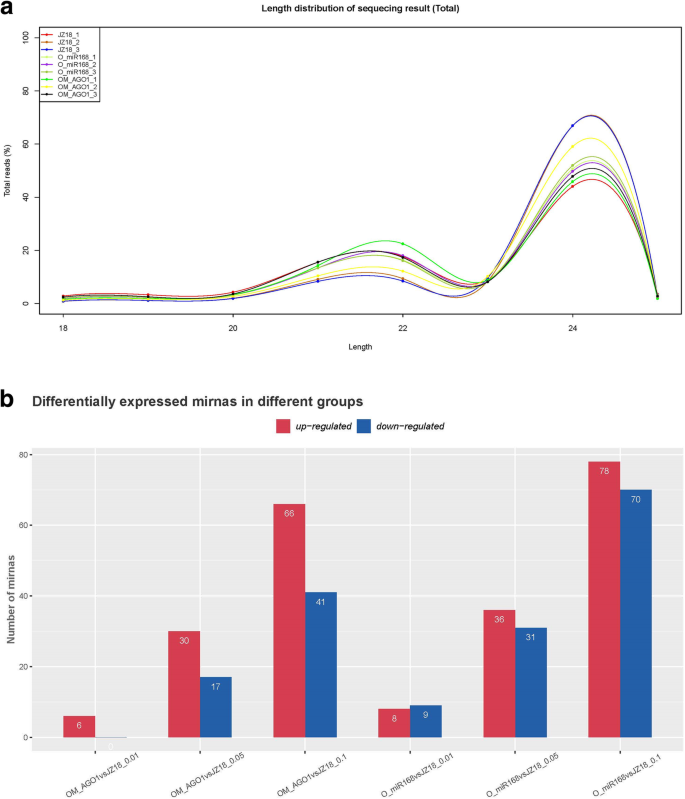
识别由此调节的miRNASLMIR168- 相关的SlAGO1A回应k+缺乏应力,九个小RNA文库由WT构建,35s:slmir168a., 和35 s: rSlAGO1样品。总共12,836,013,14,373,027,13,912,496,14,850,199,17,821,390,12,8556,77,470,288,12,383,616和25,030,158原始读数是针对三种样本的高通量测序和三种重复(表S2).经过数据处理,过滤除miRNAs外的小rna后,有效reads总数为7,163,035、11,223,930、9,849,836、8,542,869、10,694,993、7,571,073、10,7233,320、9,305,655、16,653,370,分别对应2,575,545、4,694,297、4,4110,72、3,159,839、3,691,188、2,895,817、3,862,724、4,199,533、在WT文库中获得了53,931,63个独特的reads,35s:slmir168a., 和35 s: rSlAGO1植物(每次三次重复)。最有效的读数的长度为20-24 nt,读取所有三种基因型中最常见的读数(图。5.a). 9个小RNA库共鉴定出1168个保守mirna和1060个预测的新mirna(表S)3.).关于保守miRNA家庭成员的详细信息是表S中的名单4..总的来说,在所有差异表达的miRNA中包含了68个保守的miRNA家族。
两种转基因番茄植物中表达的miRNA差异分析
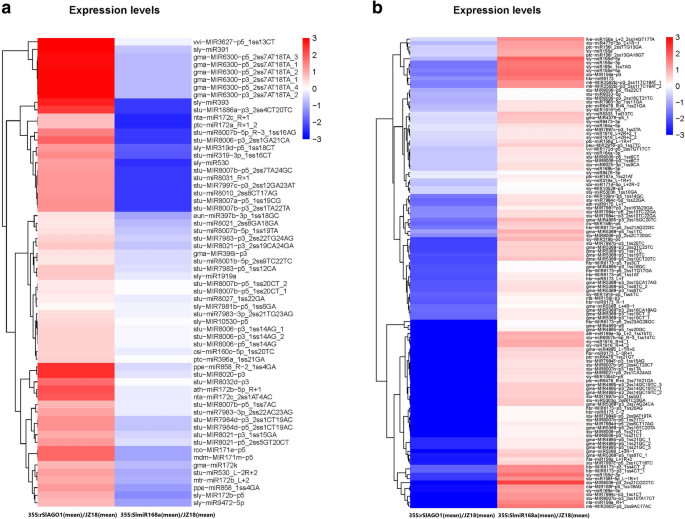
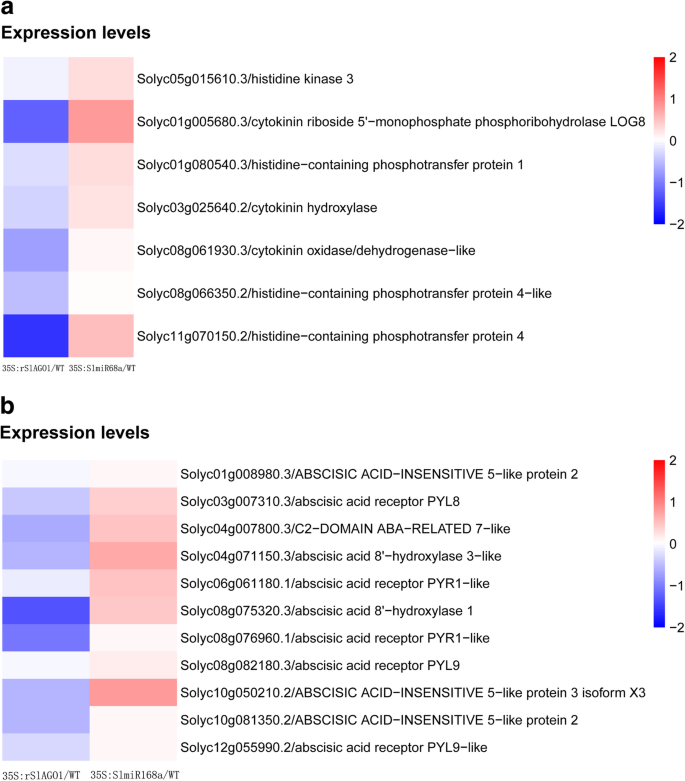
当比较35s:slmir168a.WT植物中,122个miRNAs表达水平显著上调(fold change > 2;P. < 0.1), whereas 110 miRNAs expression levels were significantly downregulated (fold change > 2;P.< 0.1;无花果。5.B;表S.5.).当比较35 s: rSlAGO1具有WT植物的植物,102 miRNA表达水平显着上调(折叠变化> 2;P.< 0.1),而58个mirna表达水平显著下调(fold change > 2;P.< 0.1;无花果。5.B;表S.6.).62次已知的miRNA哪种表达水平的次数是上调的35 s: rSlAGO1比较WT植物,但下调时35s:slmir168a.图中列出了与野生植物相比的植物。6.一种。有120名已知的miRNA,在比较时,表达水平被下调35 s: rSlAGO1和WT植物,但在比较时上调35s:slmir168a.和WT植物(图。6.b)。由62倍已知的miRNA的靶的抑制转录后调控可以通过将含有AGO1蛋白通过miR168在规定的RISC被诱导35 s: rSlAGO1.
miRNA预测靶点的功能分析
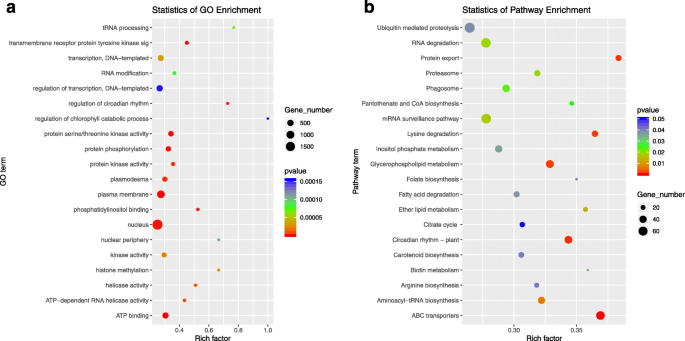
一百七个差异表达了两者的miRNA35 s: rSlAGO1植物与wt和wt和35s:slmir168a.与WT相比,植物被鉴定(表S =7.),所识别的推定靶基因列于表S中8..基因本体(GO)预测目标的浓缩分析鉴定了20个术语,包括细胞核,血浆膜和ATP结合,可显着变化(P.< 0.00015),与WT株系相比(图。7.一种)。对于107种miRNA的预测的靶途径富集分析确定了20个通路,包括ABC转运蛋白,甘油磷脂代谢,昼夜节律的植物,和RNA降解,即改变显著(P.< 0.05),与野生型相比(图。7.b)。
差异表达miRNA和MRNA的综合分析35s:slmir168a.和35 s: rSlAGO1与野生型植物相比,植物
MiRNA和MRNA之间存在调节关系,并且这种关系可以通过目标基因预测来建立。在这项研究中,我们发现113 miRNA / mRNA预测目标对进行比较35s:slmir168a.和WT植物,包括正相关和负相关(表S9.在比较中,93 miRNA / mRNA对35 s: rSlAGO1和WT植物,包括正相关和负相关(表S10.).由于各种调节因素,MIRNA的MRNA的表达没有完全反向关系,检测到正相关和负相关。在大多数情况下,MiRNA促进靶裂解的情况下,选择进一步分析miRNA / mRNA对的互补表达模式。比较中有74个负miRNA / mRNA相互作用对35s:slmir168a.用wt(表S9.相比之下,49个负miRNA / mRNA相互作用对35 s: rSlAGO1用wt(表S10.).虽然以前是众所周知对miRNA稳定的重要性,但它在miRNA生产中的作用尚未成立[27].然而,在比较中,我们选择了10个上调的miRNA和下调的mRNA相互作用对35 s: rSlAGO1与WT和两个下调miRNA和上调mRNA相互作用对的比较35s:slmir168a.用wt(表1).因此,这些mirna被认为是由AGO1蛋白稳定的。GO分析了12对负miRNA/mRNA对,包括28个功能过程,包括ctk激活的信号通路、盐胁迫响应和脱落酸(ABA)响应(Figs。年代1和s3.).此外,12对阴性miRNA/mRNA对的富集分析包括4个途径,包括植物/病原体互作、植物激素信号转导、碱基切除修复和组氨酸代谢(图S2).
RT-PCR鉴定差异表达的miRNA和MRNA
10个差异表达的已知mirna的表达模式(stu-miR530_L-2R + 2那斯图- mir - 8039 - _r + 3 _1ss4ct那STU-MIR-384-5P_R + 1那PPE-MIR-858_1SS4GA那ATH-MIR-171A-3P_L-3R + 1那pc - 3 - p - 276756 -大于那PC-5P-289257_23那pc - 5 - p - 66618 - _119那STU-MIR-8006-P3_1SS8GA_1, 和STU-MIR-8007B-P3_1SS22CT)它们的12个差异表达的靶基因(solyc04g008110.3.1.1.1那solyc07g063510.3.1.1.1.1那solyc03g113890.1.1那solyc06g076850.3.1.1那solyc05g006420.3.1.1.1.1那Solyc08g069180.3.1那solyc12g056040.1.1那solyc05g006420.3.1.1.1.1那solyc04g082420.3.1.1.1.1那Solyc08g066260.3.1那Solyc09g097780.2.1, 和solyc09g064820.1.1通过定量RT-PCR(QRT-PCR)进一步进行(表1).这些mirna / mrna对与miRNA-Seq/mRNA-Seq数据中的表达模式相同。这些相似的表达趋势表明测序数据对进一步的研究是可靠的。
miRNA及其靶基因对k的相关分析+不足的压力
从10个差异表达的成熟miRNA,7个已知miRNA及其8个靶基因被选择。然后,其k个下表达+缺乏应力,通过RT-PCR(图进行评价。8.).根据我们的结果,5个miRNA-target对(stu-miR530 /蛋白质YnbB-like那STU-MIR530 /组氨酸激酶4那stu-mir8039 / tendochitinase a-ligh那PPE-MIR858 / ARR5, 和STU-MIR8006 /冷和干旱调节蛋白质CORA样)在表达水平上表现出负关系,表明可以通过K下通过K的相应MiRNA介导转录抑制+不足的压力。此外,另外三对mirna靶对(ATH-miR171a /U-box结构域52样蛋白,STU-MIR8007B./ Eid1样F箱蛋白3和stu-mir384 /蛋白Loc107012202同种型x1)证明了类似的表达趋势,尽管K后7天的表达模式+缺乏压力是互补的。重要的是,MIRNA表达水平在K后7天内全调节+缺乏胁迫,而目标的表达水平被下调。因此,这些miRNA-target对的表达水平表明它们对K的响应+缺乏性应激随时间的早晚而变化。
CTK / ABA的监管SLMIR168介导SlAGO1A对K的耐受性+番茄植株的缺素胁迫
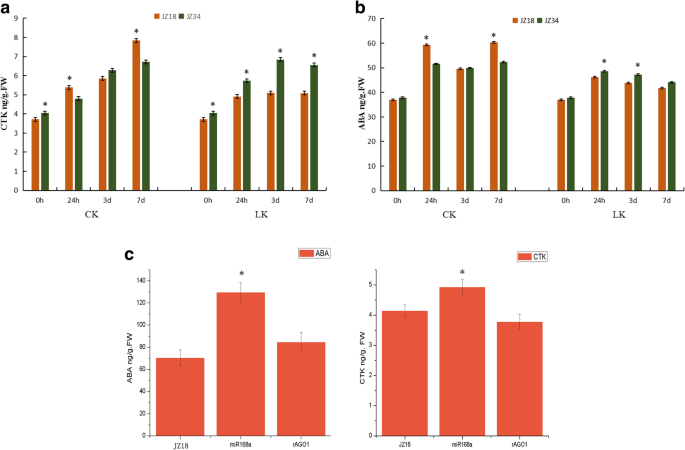
我们发现了许多参与CTK和ABA生物合成的生物合成和信号传导的基因35 s: rSlAGO1并上调35s:slmir168a.植物(图。9.A和B)。这一结果促使我们进一步调查了影响SLMIR168- 相关的SlAGO1A对CTK和ABA途径的调控。事实上,我们发现,在钾胁迫下,JZ18和JZ34番茄的CTK和ABA含量存在差异+缺乏应力(图。10.).特别地,JZ34 CTK含量比显著高于JZ18作为低K+治疗时间增加(图。10.一种)。然而,在正常条件下,JZ34植物中的CTK含量低于JZ18植物。观察到ABA含量相同的图案(图。10.b)。CTK / ABA含量也调查35s:slmir168a.和35 s: rSlAGO1.CTK和ABA含量明显高于35s:slmir168a.比JZ18和35 s: rSlAGO1(无花果。10.C)。我们的研究结果表明,CTK / ABA生物合成和信号通路均增强35s:slmir168a.这表明对低k的耐受性+压力,但降低了35 s: rSlAGO1这表明对低k敏感+压力。
讨论
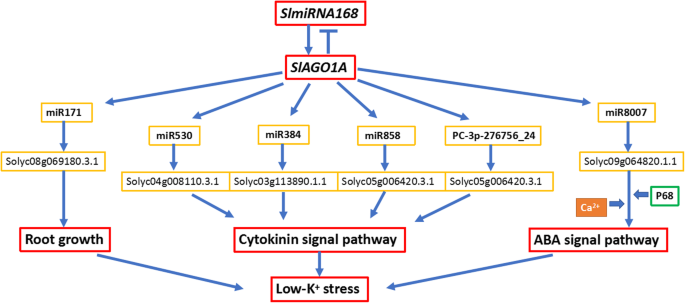
K.+土壤缺乏对农业很重要。植物适应钾的一个重要方面+缺乏胁迫是k的细胞和组织稳态+,这涉及K的迁移+在几个组织中横跨各种膜[37].两种番茄基因型低k+-tolerant JZ34和低K+-敏感型JZ18对K的敏感性差异显著+缺乏和根系形态[9.].此外,在K处理下,JZ34的根毛较多+缺乏治疗比JZ18更强的营养摄取能力+比JZ18 [9.].因此,JZ34保持更高的k+K下的内容+缺乏胁迫比JZ18强。植物无法逃避各种环境压力,它们发展出复杂的调节机制来应对这些压力的影响[38].为了进一步探索JZ18和JZ34差异的分子机制,我们发现JZ18和JZ34的表达SLMIR168响应低k而增加+,而表达目标SlAGO1A低k以下下降+JZ34中的治疗(图。1).这两个SLMIR168和SlAGO1A在根系中的较高水平表达而不是在其他组织中(图。2).此外,35s:slmir168a.根毛比35 s: rSlAGO1和JZ18(图。4.一种)。实际上,除了根,我们还发现植物高度之间的差异35S:SLMIR168A和35S:RSLAGO1植物(图S9.).值得注意的是,缺钾信号首先被根细胞,特别是根表皮细胞和根毛细胞感知到[7.].因此,根表型似乎更重要,响应低k+压力。35s:slmir168a.表现出更容易耐受k+缺乏比35 s: rSlAGO1。此外,mRNA-SEQ还证明了一些钾转运基因不同地表达35S:SLMIR168A和35S:RSLAGO1(表S.11.和s12.).miRNA-Seq和mRNA-Seq的综合分析结果为35 s: rSlAGO1表明是一个成员miR171家庭被显着诱导和目标Solyc08g069180.3.1下调(表1).进一步的分析表明,该靶基因涉及根表皮细胞分化和应激反应。以前的研究表明miR171根内维管束和角质层表达量较高拟南芥[39而这种miRNA在Cd胁迫、干旱和盐胁迫下上调[40那41].miR171也被证明在玉米根系对盐胁迫的反应中有不同的表达[42].与野生型相比,MiR171被显示为在4M-Slago1a植物中上调[26].因此,我们得出结论Solyc08g069180.3.1通过miR171a可以解释两者根系发育的差异吗35s:slmir168a.和35 s: rSlAGO1在K.下+缺乏应力(图。11.).
除了根架构外,植物激素还参与植物反应的信号转导+不足的压力。低K.+压力导致CTK水平降低,这可能刺激ROS积累,根发生长和AtHAK5表达 [19.].KAT1钾通道是通过SRK1 / OST1 / SNRK2.6的ABA信号转导的目标[43].另外,k的表达+释放通道基因植物人在细胞外Ca的存在下,ABA诱导2+[44].在这项研究中,我们发现低k+宽容的番茄JZ34在K下具有较高的CTK / ABA内容物+缺钾胁迫比低钾胁迫更严重+敏感的番茄JZ18。为了比较的表达,序列和miRNA-Seq的结果综合分析35 s: rSlAGO1与JZ18相比表明miR384那miR530, 和mir858.在CTK信号通路和CTK应答中,它们的下调靶点被富集。CTK的积累减少ROS的产生[19.].活性氧的过量产生,破坏植物细胞中的大分子,包括脂质、蛋白质等[45].因此,JZ34对K的耐受性较强+不足应力比JZ18,可能导致MIR168调节的Slago1a影响CTK信号调节植物细胞上ROS的损伤。而且,我们发现目标miR384那miR530, 和mir858.也参与了由KEGG分析植物激素信号转导。此外,该新的miRNA的靶基因pc - 3 - p - 276756 -大于被发现参与CTK反应。有趣的是,在35s:slmir168a., 只要mir8006.和miR8007b下调,并令盐压力和ABA的上调并富集它们上调的靶标。因此,我们的结果表明SlAGO1A诱导抑制靶蛋白表达,由多种mirna调控,包括miR384那miR530那mir858.那mir8007., 和pc - 3 - p - 276756 -大于,通过调节SlmiR168a.更重要的是,在CTK / ABA含量均特别是增加的35秒:mir168a.在我们的研究中。这些miRNA / mRNA对可能影响k的耐受性+通过CTK / ABA信号传导途径植物缺乏胁迫(图。11.).K.+通过ABA信号传输需要细胞外CA2+[44], P68蛋白与AGO1结合,与CaM互作,增强K的积累+在水稻[46].因此,研究了P68表达35s:slmir168a.和35 s: rSlAGO1(图。S4.).P68表达水平降低35 s: rSlAGO1但增加了35s:slmir168a.基于这些研究结果,研究人员发现SlAGO1A受到监管SLMIR168回应k+通过ABA信令的缺陷压力可能需要CA2+.
mirnas装载到前1,它充当植物中的RNA切片机[47].miR168指示的裂解前1基因,这表明miR168调节自身miRNA通路的活动[33].前1-null等位基因降低了一些mirna的表达水平,例如miR171,并增加相应目标mRNA的水平[33].在35s:slmir168a., miR168的表达表明以下调控途径:SLMIR168是上调了,积累了吗SLMIR168压抑表达SlAGO1A.失去了SlAGO1A与RISC结合,靶蛋白的表达受其他与RISC结合的mirna调控SlAGO1A会上调。因此,我们倾向于发现目标的表达是由下调的miRNA表达上调的35s:slmir168a..而且,在35s:slmir168a., miR8006和miR8007下调,其靶标上调。在35 s: rSlAGO1,表达rslago1a.是上调的,rslago1a.不能被SlmiR168,因此,RISC的功能促进了绑定下游MiRNA。因此,靶向其他miRNA的转录后调节,其与RISC结合SlAGO1A将得到加强。最后,我们发现八个miRNA被上调,他们的目标被下调35 s: rSlAGO1.因此,上面的这些miRNA可以与以往的蛋白质相关,并且前面的损伤1-miR168反馈调节可以扰乱适当的维护SlAGO1A用于植物的生长和对环境的反应。此外,在35s:slmir168a.在美国,71个mirna也被发现上调,而它们的靶标下调。这些mirna包括许多广为人知的分子,例如miR167那miR156那miR396那miR166那miR319b, 和miR172.这些miRNA可以参与各种激素信号传导途径,包括唾液,乙烯和赤霉素信号传导。在前一个 -零植物,miR156/157和miR167还发现积累到与WT植物中相似或高的水平[33].此外,Lynn等人[48]报道PINHEAD/ZWILLE与AGO1相似且功能重叠75%。AGO蛋白可以结合长度至少为5 nt的单链RNA和双链RNA,使AGO蛋白在识别其mRNA靶标之前和之后直接与mirna结合[49].前1甚至可能在miRNA处理之前采取行动[32].番茄前的家庭有15名成员,而且SlAGO1A和SlAGO1B受到监管SlmiR168a,SlAGO2A也受miR403调控[30.].如果过度令人累积SLMIR168影响其他以前的家庭成员或其他MIRNA需要进一步确认。此外,我们的结果表明SLMIR168靶向性SlAGO1A可能参与k+枝条和根部的缺陷胁迫。35s:slmir168a.植株对K表现出更强的耐受性+与k下的wt植物相比,缺乏症和射击+缺乏应力(图。4.A和B)。然而,35 s: rSlAGO1植物可以向K显示更敏感+在拍摄缺乏应力比在根(图4.b)。同性恋SlAGO1A和SlAGO1B是88%,但是Q在SlAGO1B远高于那个SlAGO1A[30.].表达SlAGO1A是从不同SlAGO1B在水果发展中[30.].4 m-SlAGO1A在花中显示了一些不同的缺陷,来自4 m-SlAGO1B转换子[26].这些表明,SlAGO1A和SlAGO1B可能在番茄的发育中起着不同的作用。在K+缺乏应力,其他渣油1蛋白,Slago1b可能主要导致根系表型之间的差异35S:SLMIR168A和35S:RSLAGO1植物。重要的是,MiRNA在以前的时间和空间中受到监管,导致精细调整和复杂的监管网络。因此,miR168可以在前1中起作用以通过复杂网络控制miRNA靶的mRNA水平。
基于对miRNA和mRNA的响应至K分析+缺乏压力,我们开发了MIR168介导的模型,介导1次在低k中的功能+耐受性(图。11.).SlAGO1A受到监管SLMIR168回应k+缺乏应力,过度表达SlAGO1A然后诱导表达miR530那miR384和mir858.,从而增强这些参与CTK信号转导的mirna调控的靶点的转录后沉默。SlAGO1A积累也引发miR171表达,然后下调其靶标,涉及根表皮细胞分化,以抑制低k下的根毛生长+压力。而且,SLMIR168- 相关的SlAGO1A调节mir8007.,参与ABA信号通路;加利福尼亚州2+可能在该途径中具有功能。所以调节SLMIR168在这一点SlAGO1A对维护至关重要斯拉戈1在低k下保持正常植物生长的稳定水平+压力。
结论
在这项研究中,RISC含有SlAGO1A由此监管SLMIR168影响了另一个麦芽乳病后调节的部分。这些mirnas(miR530那miR384那mir858.,miR171和miR8007)响应于低K进一步靶mRNA的各种+通过调节根的生长和CTK/ABA的生物合成和信号转导途径。过度的pri-SlmiR168a改善的番茄植物的耐受性,响应于低K+压力。总的来说,我们的结果揭示了新的调节途径SLMIR168- 相关的SlAGO1A响应于低K值+强调和强调…的重要性SlAGO1A保持miRNA积累的稳态。本研究提供了分子和育种机制的新观点,以改善番茄植物对低钾的耐受性+环境压力。
方法
植物材料和生长条件
两种番茄基因型'JZ34'(低k+-tolerant)和“JZ18”(低K值+- 敏感)在我们的实验室中获得了更高的近交线,并详细介绍了低k+2018年Zhao等人发表的[9.].这些番茄种子被保存在我们的实验室中。这些番茄幼苗在标准温室条件下生长,包括每天/夜温度的26/18°C,光周期为16小时光/ 8小时。用水洗涤25天幼苗,然后转移到营养水栽罐中。如前所述进行营养溶液配方[9.].在营养生长阶段(30天),a k+ − deficient condition was induced by reducing the concentration of KNO3.from 4 mM (normal K+)至0.5 mM (K+缺乏)。含4mm KNO的营养液3.作为对照。经过7天的K+缺乏胁迫,植物的不同部位被取样以评估植物根构型,鲜重和k+内容。
测量K.+浓度
将总共0.05g(干重)番茄根加入到含有2ml 0.5M盐酸的10ml离心管中。将样品温育3天,然后加入5ml去离子水,向每个离心管中加入,并将混合物过滤。将过滤的储备溶液稀释10次,K+用火焰光度计测量浓度。每种样品进行三种生物重复评估。
35s:slmir168a.和35 s: rSlAGO1载体构建与番茄转化
PRI-SLMIR168A是利用基因特异性引物制备的。序列确定的聚合酶链反应(PCR)片段克隆到pCAMBIA3301/Luc质粒中,该质粒包含两个35S花菜花叶病毒启动子、卡那霉素抗性标记基因、磷thricin和荧光素酶。将含有预期插入物的重组质粒转移到农杆菌肿瘤术gv3101细胞。使用番茄遗传转化系统将含有载体的患者的患者细胞转化为JZ18西红柿[50].使用QRT-PCR在T1转化体中检测到靶基因的表达及其相应的T2以及检测Kanamycin标志物基因的存在。本研究中使用的所有引物列于补充表S中1.生成rslago1a.(这SLMIR168- 破坏构造),突变SLMIR168目标网站SlAGO1A使用两步PCR诱变插入。这35s:slago1.使用上述相同的方法获得转化体35s:slmir168a..
小RNA测序和差异表达miRNA的分析
35s:slmir168a.那35 s: rSlAGO1,JZ18用作小RNA。总共九个样品(35s:slmir168a.那35 s: rSlAGO1然后收获和JZ18,每次都有三个重复)。从番茄叶中获得的约2.5μg总RNA用于构建Truseq小型RNA样品制备试剂盒(Illumina,San Diego,Ca,USA)的小RNA文库。然后在制造商的说明之后,在LC-Bio(杭州)的Illumina Hiseq2500 50se平台(单端)使用测序。序列的详细信息被提及先前报告的描述[51].识别保守和新的miRNA在表格中总结了2.
MiRNA靶基因预测
GSTAR.PL用于预测差异表达的miRNA靶向的基因。用Rnahybrid程序计算miRNA-cDNA双链体的最小自由能(MFE)[52那53那54]以下参数:MFE比率≥0.65;然后,Allen得分≤0.然后,用于基于Gradome数据的相应目标中的MiRNA潜在地区潜在分割站点http://sites.psu.edu/axtell/software/cleaveland4/)[55].
RNA提取、转录组测序、注释
从JZ18收集番茄宣传叶样品,35 s: rSlAGO1, 和35s:slmir168a.植物在同一阶段和位置,提取总RNA,遵循制造商的指示,构建了Illumina Miseq文库。每个样品有三个生物重复。使用Polyt Oligos磁珠的mRNA从总RNA纯化。片段被碎片缓冲液切割。通过使用随机六聚体引物合成第一链cDNA,然后使用RNase H和DNA聚合酶I转化成双链cDNA,然后与测序适配器连接。通过PCR扩增构建测序文库,并通过使用Illumina Hiseq 2500平台(LC-Bio Technology Co.,Ltd。)进行。对于功能诠释,通过基因本体(GO)BLAST2GO软件进行差异表达的基因富集分析(http://www.blast2go.org/)和kegg自动注释服务器(http://www.genome.jp/tools/kaas/).
整合分析mRNA-seq和miRNA-seq数据
CGT101-COR 1.1软件用于确定使用根据构建的miRNA / mRNA调节网络的miRNA和mRNA之间的可能的正相互作用,通过组合差异来进行miRNA-SEQ数据的综合分析用相关的miRNA定位信息表达miRNA和MRNA。然后还考虑了差异表达的miRNA定位信息。
QRT-PCR分析
采用TRIzol (Takara,中国大连)提取叶片样品的总RNA,然后采用RQ1 Dnase I (Promega, Madison, WI, USA)处理去除基因组DNA污染。用无dna RNA (2 μg)合成cDNA。用于成熟miRNA表达检测的是RT引物,它有效地结合到miRNA的3 '端。靶mrna和成熟miRNA系统的RT-PCR如前所述[56].将模板与ABI 7500序列检测系统和软件(Applied Biosystems,USA)的Sybr Green PCR主混合混合。使用三种技术复制重复每次测量,并混合三种生物重复的RNA样品。将表达水平归一化为番茄U6小核RNA用于miRNA定量,并且肌动蛋白用于mRNA定量[56].引物列于补充表S中1.
ABA和CTK的定量
使用酶联免疫吸附试验方案进行量化ABA和CTK [57].收集新鲜番茄叶片,重量为0.5 g - 1.0 g。ABA和CTK的详细量化方法参考了之前报道的性能[56].这一种B.sorbance of the antibodies against ABA and CTK was recorded at 490 nm. The samples of leaves were repeated with three biological replicates, and three technical replicates.
统计分析
为所有实验评估至少三种生物重复;数据被呈现为平均值±标准偏差。使用SPSS软件(版本17.0)执行统计分析(Duncan的方法的单向ANOVA)。一种P. < 0.05 was considered as statistically significant.
可用性数据和材料
这项研究的原始读取沉积在SRA数据库(http://www.ncbi.nlm.nih.gov/sra/)在NCBI进行SRA登录号(小RNA测序:PRJNA615321;转录组测序:PRJNA615315和PRJNA615767)。
改变历史记录
2021年2月8日
缩写
- 阿坝:
-
脱盐酸
- CTK:
-
cytokinin.
- CK:
-
控制检查
- 路:
-
低钾胁迫
- 走:
-
基因本体论
- Kegg:
-
京都基因和基因组百科全书
- ABC转运:
-
ATP绑定盒式磁带传输车
- RISC:
-
RNA诱导沉默复合物
- RT-PCR:
-
反转录聚合酶链反应
- WT:
-
野生型
- ROS:
-
反应性氧气
- CAM:
-
钙调蛋白
参考
- 1。
Ahammed GJ,吴MJ,王YQ,燕YR,毛Q,Ren JJ,Ma Rh,Liu Ar,Chen Sc。褪黑激素通过改善黄瓜中的铁稳态,抗氧化和次生代谢来减轻铁胁迫。SCI Hortic。2020; 265:109205。
- 2。
Sulieman S,Tran LS。磷酸含磷稳定性作为磷缺乏的适应性策略。植物SCI。2015; 239:36-43。
- 3.
张y,梁y,zhao x,金x,hou lp,shi y,ahammed gj。硅通过改善番茄中的光合作用容量,抗氧化潜力和营养稳态来补偿磷缺陷诱导的生长抑制。Agron J. 2019; 9(733):1-16。
- 4.
沙质土壤中番茄产量、生物量积累、根系分布和灌溉水分利用效率受施氮量和灌溉制度的影响。中国海洋大学学报(自然科学版)。
- 5.
Clarkson DT,Hanson JB。高等植物的矿物营养。Annu Rev植物理性。1980; 31:239-98。
- 6.
Besford Rt,Maw Ga。钾营养对番茄植物生长和水果发育的影响。植物土壤。1975; 42:395-412。
- 7。
歌曲WJ,Xue R,Song Y,Bi Y,Liang Zh,Meng L,Dong CX,王CD,刘加,董建放,张YL。一阶横向根伸长率对低钾的差异响应涉及两种烟草中的一氧化氮。J工厂增长调节。2018; 37:114-27。
- 8。
Cao Y,玻璃广告,克劳福德NM。占拟南芥生长的铵抑制可以通过钾和助长抗性突变Aux1,AxR1和AxR2来逆转。植物理性。1993; 102:983-9。
- 9。
赵XM,刘y,刘X,江j。两种番茄基因型对缺乏缺乏胁迫的比较转录组谱。int j mol sci。2018; 19:2402。
- 10。
王啊。植物中钾转运和信号传导的调节。CurrOp植物BIOL。2017; 39:123-8。
- 11.
Shin R,Schachtman DP。过氧化氢介导植物根系对营养剥夺。Proc Natl Acad Sci U S A. 2004; 101:8827-32。
- 12.
Li L,Kim B,Cheong Yh,Pandey GK,Luan S. A CA2+信号通路调节k+拟南芥低钾反应的通道。《美国国家科学院学报》上。2006; 103(33): 12625。
- 13.
Sakai H,Hua J,Chen GQ,Chang C,Bleecker Ab,Meyerowitz em。ETR2是拟南芥中乙烯信号转导的ETR1样基因。Proc Natl Acad Sci U S A. 1998; 95:5812-7。
- 14.
Schachtman DP。乙烯在植物反应中的作用+不足。前植物SCI。2015; 6:1153。
- 15.
李军,吴文辉,王宇。钾离子通道AKT1参与生长素介导的拟南芥低钾胁迫下根系生长抑制。acta botanica yunnanica(云南植物研究). 2017;59(12)。https://doi.org/10.1111/jipb.12575.
- 16.
Rigas S,Ditengou Fa,Ljung K,Daras G,Tietz O,Palme K,Hatzopoulos P. Root agitropism和根发发育构成了拟南芥根顶部中的毒素稳态调节的偶联发育反应。新植物。2013; 197:1130-41。
- 17.
将引脚指向正确的方向:生长素流出载体的极性定位需要钾转运体。新植醇。2013;197:1027-8。
- 18。
陈克,冯·赫姆,胡qd,qu hy,陈开,yu l,xu gh。通过增强oShak16p提高缺乏钾缺乏钾的耐受性:WOX11控制的根系发展。植物Biotechnol J. 2015; 13(6):833-48。
- 19。
NAM YJ,TRAN LS,Kojima M,Sakakibara H,Nishiyama R,Shin R. cytokinins和细胞蛋白信号对拟南芥钾缺乏症的调节作用。Plos一个。2012; 7:E47797。
- 20。
Dhakal Mr,Erdei L.脱离酸对k的长期影响+在不同的k的年轻小麦植物中运输+的地位。杂志杆菌。1986;68(4):637 - 40。
- 21。
Behl的R,Jeschke WD。在运输,积累脱落酸的作用,K的吸收+和na+在切除的大麦根;伴随阴离子的影响。zeitschrift毛皮pflanzenphysiologie。1979; 95(4):335-53。
- 22。
关键词:SlWRKY81,番茄,脯氨酸合成,抗旱性Sci Hortic。2020;270:109444。
- 23。
胡斌,王伟,邓凯,李华,张振华,张立军,褚超。MicroRNA399在水稻多种营养饥饿反应中的作用。植物科学学报2015;6:188。
- 24。
Kulcheski FR, Correa R, Gomes IA, de Lima JC, maris R. NPK常量营养素和microRNA稳态。植物科学学报2015;6:451。
- 25。
关键词:大麦,低钾胁迫,microrna,靶标,基因型+宽容。J植物理性。2019; 234-235:44-53。
- 26。
西安Z,黄W,杨YW,唐N,超Z,任MZ,李ZG。miR168的影响相变,叶偏上,并通过番茄SlAGO1s果实发育。J Exp Bot。2014; 65(22):6655-66。
- 27。
Reinhart Bj,Weinstein例如Rhoades MW。植物中的microRNA。基因开发。2002; 16:1616-26。
- 28。
Tomari Y, Zamore警局。透视图:用于RNAi的机器。基因Dev。2005;19:517-29。
- 29。
Qi Y,Denli Am,Hannon GJ。拟南芥RNA沉默途径中的生物化学专业化。Mol细胞。2005; 19:421-8。
- 30.
西安ZQ,杨yw,黄某,唐n,王xy,li zg。番茄中斯塔莫家族的分子克隆与表征。BMC植物BIOL。2013; 13:126。
- 31。
Vaucheret H,Mallory AC,Bartel DP。以前1稳态需要MIR168和augo1的共同表现,并优先稳定MIR168 BY AGO1。Mol细胞。2006; 22:129-36。
- 32。
Kidner Ca,Martienssen Ra。空间限制的microRNA通过argount1引导叶极性。自然。2004; 428:81-4。
- 33。
Vaucheret H,巴斯克斯男,克里特P,巴特尔DP。ARGONAUTE1在miRNA途径的行动,并通过miRNA途径及其调控是植物发展至关重要。基因开发。2004; 18:1187年至1197年。
- 34。
白米,杨gs,陈飞,毛泽东,康hx,陈gh,杨烨,谢。含有Solanum Lycopersicum的病毒感染和非生物胁迫的基因组 - 样,野生和RNA依赖性RNA聚合酶基因家族及其表达分析。基因。2012; 501(1):52-62。
- 35。
番茄卷叶新德里病毒(ToLCNDV)编码AC2与宿主mirna直接相互作用。J RNAi Gene Silencing. 2016; 12:515-20。
- 36。
侯XX,崔杰,刘·威力,江,周XX,齐海,蒙友,栾益。LNCRNA39026通过培训MIR168a和诱导PR基因表达,增强了对植物抗植物的抗性。Genet Res。2020; 110(4):1943。
- 37.
Amtmann A,Hammond JP,Armengaud P,White PJ。植物中的营养传感和信号:钾和磷。ADV BOT RES。2005; 43:209-57。
- 38.
Ganie SA,Ahammed GJ,Wani Sh。血管植物一种锌 - 手指(VOZ)转录因子:稻米生物胁迫耐受性耐受性的新调节因子(栽培稻L.)。遗传资源作物evol。2020。https://doi.org/10.1007/S10722-020-00904-9..
- 39.
Mahale Bm,Fakrudin B,Ghosh S,Krishnaraj Pu。LNA在叶片和环境根部组织中原位杂交的MiR171和MiR397a的杂交揭示了表达均匀性,以响应拟南芥射击热休克。j植物生物学习生物。2014; 23(1):93-103。
- 40。
关键词:拟南芥,胁迫,microrna,微阵列分析RNA。2008; 14:836-43。
- 41。
周X,王G,Sutoh K,朱杰,张W.转录族分析植物中冷诱导微大稻草的鉴定。生物学习生物魔Acta。2008; 1779:780-8。
- 42。
丁D,张LF,王H,刘ZJ,张ZX,郑益。MiRNA响应盐胁迫对玉米根盐胁迫的差异表达。Ann Bot。2009; 103:29-38。
- 43。
佐藤A,SATO Y,Fukao Y,Fujiwara M,Umezawa T,Shinozaki K,Hibi T,Taniguchi M,Miyake H,Goto DB,uozumi N.TureNine在Kat1 Potassium渠道的第306位对渠道活动至关重要,是一个ABA激活的SNRK2 / OST1 / SNRK2.6蛋白激酶的靶位点。Biochem J. 2009; 424:439-48。
- 44。
拟南芥钾离子通道基因GORK对水分胁迫的调控作用。2月。2003;554:119-26。
- 45。
Hasan Mk,Ahammed GJ,Sun Sc,Li Mq,Yin Hq,Zhou J. Melatonin抑制镉易位,通过调节含硫的含硫Lycopersicum L.JAgric Food Chem中的硫磺吸收和同化增强植物耐受性。2019年。https://doi.org/10.1021/acs.jafc.9b02404.
- 46。
Banu Msa,Huda Kmk,Sahoo Rk,Garg B,Tula S,伊斯兰教SMS,Tuteja R,Tuteja N. PEP P68通过清除ROS介导的H赋予水稻的盐度胁迫耐受性2O.2和阿尔戈瑙特互动。Plant Mol Biol rep 2015; 33:221-38。
- 47。
Baumberger N, Baulcombe DC。拟南芥ARGONAUTE1是一个RNA切片机,选择性招募microrna和短干扰RNA。Proc。Natl。阿卡。SCI..U S A. 2005; 102:11928-33。
- 48。
PINHEAD/ZWILLE基因在拟南芥发育过程中起多源性作用,并与ARGONAUTE1基因具有重叠功能。Dev。1999;126:469 - 81。
- 49。
闫锦,燕S,Farooq A,韩A,Zeng L,周MM。PAZ结构域的结构和保守RNA结合。自然。2003; 426:468-74。
- 50。
王毅,邹万,萧y,程吕,刘yd,gao s,shi z,江y,qi mf,xu t,li tl。MicroRNA1917靶向CTR4剪接变体,以调节番茄中的乙烯反应。J Exp Bot。2018年2月23日; 69(5):1011-25。
- 51。
张广生,尹世文,毛建强,梁飞,赵超,李鹏,周国强,陈树强,唐志林。缺氧条件下Pelteobagrus vachelli肝脏mRNA-seq和miRNA-seq的综合分析Sci众议员2016;6:22907。
- 52。
Kruger J,Rehmsmeier M.Rnahybrid:MicroRNA目标预测容易,快速灵活。核酸RES。2006; 34:W451-4。
- 53。
Rehmsmeier M, Steffen P, Hochsmann M, Giegerich R. microRNA/靶双链快速有效预测。RNA。2004; 10(10): 1507 - 17所示。
- 54。
RNAplex: RNA-RNA相互作用搜索的快速工具。生物信息学,2008;24(22):2657 - 63。
- 55。
Addo-Quaye C,Miler W,Axtel MJ。Cleaveland:一种用于使用降级数据查找切割的小型RNA目标的管道。生物信息学。2009; 25(1):130-1。
- 56。
刘X,徐T,东XF,刘yd,刘zh,施zh,王yl,qi mf,li tl。胃纤维素和养肝素在果皮中番茄细胞层的作用通过MiRNA在水果套中调节的ARFS表达。acta physiol植物。2016; 38:77-88。
- 57。
Weiler EW,Jourdan PS,Conrad W.完整和斩首的吲哚-3-乙酸的水平,如通过特异性和高敏固相酶免疫测定法测定的特定和脱涂的水氨酸。Planta。1981; 153:561-71。
致谢
我们要感谢Editage(www.editage.cn.)英语语言编辑。
资金
基金资助:国家重点研发计划项目(no . 2019YFD1000301-03);国家自然科学基金项目(no . 31801847);辽宁省博士启动基金项目(no . 20180540059)。关键词:材料构建,miRNA测序,转录组测序,数据分析
作者信息
隶属关系
贡献
LX, LTL和JJ构思和设计了这项研究。LX、TCC和CX进行了实验和数据分析。LX和JJ写了这篇文章。LTL和ZXM对手稿进行了修改。所有作者阅读并批准了手稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
没有宣布利益冲突。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:
表S1。本研究中使用的引物。
附加文件2:表S2。
小RNA深度测序的谱35s:slmir168a.那35 s: rSlAGO1和wt。
附加文件3:表S3。
所有表达miRNA的列表35s:slmir168a.那35 s: rSlAGO1和wt。
附加文件4:表S4。
将表达的保守mirna分为不同的mirna家族。
附加文件5:表S5。
中差异表达的mirna列表35s:slmir168a.与野生型相比。
附加文件6:表S6。
中差异表达的mirna列表35 s: rSlAGO1与野生型相比。
附加文件7:表S7。
预测目标基因的miRNA列表。
附加文件8:表S8。
目标预测注释的差异表达的miRNA。
附加文件9:表S9。
miRNA / mRNA对进行比较35s:slmir168a.通过miRNA-Seq和mRNA-Seq的综合分析,WT植物表达上调/上调、下调/下调、上调/下调、下调/上调。
附加文件10:表S10。
miRNA / mRNA对进行比较35 s: rSlAGO1通过miRNA-Seq和mRNA-Seq的综合分析,WT植物表达上调/上调、下调/下调、上调/下调、下调/上调。
附加文件11:表S11。
差分表达的MRNA列表35s:slmir168a.与野生型相比。
附加文件12:表S12。
差分表达的MRNA列表35 s: rSlAGO1与野生型相比。
附加文件13:表S13。
jz18的根源和枝条的生物量,35秒:mir168a.和35 s: rSlAGO1下的正常和K+缺乏压力条件。
附加文件14:图S1。
在比较中确定的10个负miRNA / mRNA对的分析35 s: rSlAGO1miRNA-Seq和mRNA-Seq综合分析WT植物。
附加文件15:图S2。
在比较中鉴定的10个负miRNA / mRNA对的Kegg途径浓缩分析35 s: rSlAGO1miRNA-Seq和mRNA-Seq综合分析WT植物。
附加文件16:图S3。
GO分析鉴定了2对阴性miRNA/mRNA对的比较35s:slmir168a.miRNA-Seq和mRNA-Seq综合分析WT植物。
附加文件17:图S4。
P68的实时荧光定量PCR验证35s:slmir168a.那35 s: rSlAGO和wt。实验重复三次。
附加文件18:图S5。
WT根生长形态变化的比较,35s:slmir168a., 和35 s: rSlAGO1正常钾下的植物+条件和K+7天后缺乏压力。
附加文件19:图S6。
全长rSlAGO1凝胶和墨水。红线内部部分是图1中的裁剪部分。3 b.标记为10,000 bp。
附加文件20:图S7。
全长的SLMIR168A凝胶和印迹。黑线内部部分是图1中的裁剪部分。3 c.标记为2000年BP。
其他文件21:图S8。
SLMIR168的表达水平35s:slmir168a.转化线;表达水平SlAGO1A在35 s: rSlAGO1转型线。*与之大的差异P. < 0.05 determined using a Duncan’s test compared with the WT.
附加文件22:图S9。
JZ18的整株植物的表型,35s:slmir168a.和35 s: rSlAGO1在正常情况下。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
刘,X.,Tan,C.,Cheng,X.et al。MiR168靶向Argonaute1A介导的MiRNA调节途径,以应对番茄钾缺乏胁迫。BMC植物杂志20,477(2020)。https://doi.org/10.1186/s12870-020-02660-5
已收到:
公认:
发表:
关键字
- Argonaute1.
- miR168
- microRNA.
- 缺钾胁迫
- 根
- 目标基因