- 研究文章
- 开放获取
- 发布:
转录组学和代谢组学分析揭示了LED光质量对形态性状的影响,以及苯丙类衍生化合物的积累Sarcandra glabra幼苗
BMC植物生物学体积20.文章编号:476(2020)
摘要
背景
Sarcandra glabra是一种具有抗氧化、抗菌、抗炎、抗肿瘤作用的常绿传统中草药。光照是影响药材生长和品质的主要因素之一。近年来,光发射二极管(LED)技术的引入已广泛应用于温室植物。然而,这些光对植物生长的影响和苯丙类化合物的调控机制美国glabra尚不清楚。
结果
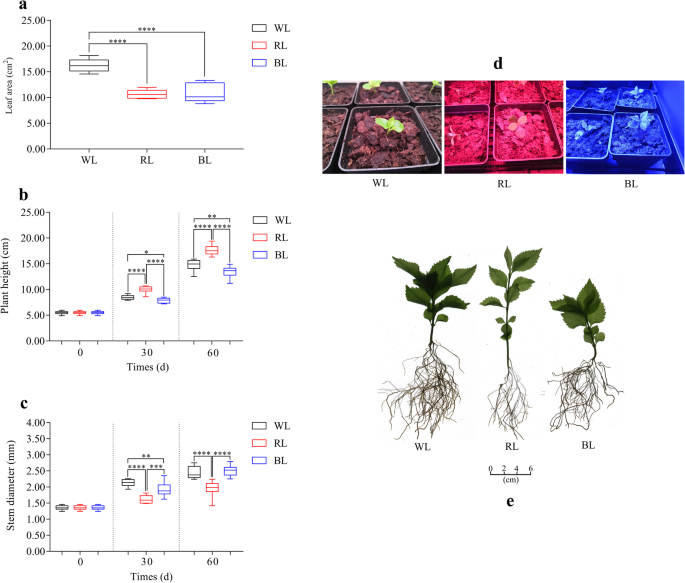
与白光(WL)相比,红色LED光(RL)显著提高了植株高度,降低了茎粗和叶面积,而蓝色LED光(BL)显著降低了植株高度和叶面积美国glabra.根据转录组的分析,在R1(RY)下的BL(逐叶)下的BL(逐叶组织下的叶组织组中,鉴定了861,378,47,10,033,7917和6379个差异表达基因(DEGS)。WL(WY)下的组织,RY与WY,WL(WG)下的根组织与WY,STEM组织分别在WL(WJ)与WG下,WJ与WY下。我们鉴定了几乎所有已知酶的46个基因,其中几乎所有已知的酶参与苯基丙醇生物合成,例如苯丙氨酸氨裂解酶(PAL),Chalcone合酶(CHS)和黄酮合酶(FL)。我们发现分别编码R2R3-MYB蛋白和BHLH蛋白的53个基因,其中几个与黄酮类生物合成有关。基于代谢物分析,共鉴定了454个代谢物,其中44,87和296种化合物在Wy Vs. Ry,Wy和Wy Vs.和WG中差异化。通过在骨飞素,咖啡酸,异毛苷蛋白和Fraxidin的生产中显着减少,而槲皮素和kaempferol的产率显着上调。在RY中,密集晶的酸,肉桂酸和Kaempferol的含量显着下降。此外,在WG中,代谢物的产生(例如绿色酸,粘附性酸和辛链)下降,而其产率显着增加(例如,Esculetin,Fraxetin,Isofraxidin和Fraxidin)。
结论
这些结果提供了进一步了解苯丙烷衍生的化合物的积累模式的调节机制美国glabra在各种光照条件下,使该植物能够发展出最佳的育种条件。
背景
Sarcandra glabra(研究)。中井(草山虎或中草药中节风),属于金盏花科,是一种常绿的传统中草药。美国glabra广泛分布于中国南部及东南亚各地,主要以种子繁殖或无性繁殖(营养繁殖)方式繁殖[1那2].中华人民共和国的药典据报道,整个干燥的植物可以用作药物[3.],它含有丰富的生物活性植物化学物质,不仅有助于保护植物免受非生物或生物应激[4.),也提供抗氧化剂[5.),抗菌6.],抗炎[7.和抗肿瘤药物[8.]属性。以往对该植物的研究主要集中在对其植物化学成分的分离和提取上,可分为6类;有机酸(9.那10),类黄酮(9.],香豆素类[2],萜类化合物[11]、酚酸[2那5.和多糖[1].在这些成分中,类黄酮(如槲皮苷和山奈酚),香豆素(如异丙醇和东莨菪素)和酚酸(如迷迭香酸)与苯丙素的生物合成密切相关。
为解决自然资源有限的问题,满足消费者对安全优质草本产品的需求,中国启动了该项目;《良好农业规范(GAP)》以中药材为基础,提高中药材资源和栽培质量。目前,为了克服我国草药产业面临的问题和挑战,提高药用植物的质量和生长速度,正在进行各种研究,如立体栽培[12或温室栽培[13].因此,生产的生产美国glabra是否正逐渐从传统模式转向更先进、更可持续的耕作方式,如温室栽培.温室栽培被认为是一种种植大量草本植物的有效农业方法,有助于确保产品质量[14].
水、光、温度、土壤养分等环境因子是植物生长发育和高质量的关键因素。在这些因素中,有必要强调光因素,因为它负责光合作用。近年来,新一代发光二极管(LED)技术已应用于温室栽培,为植物更好的生长发育提供了有利条件[15那16].
最近,大量研究表明,特定的LED灯对植物形态发生有显著影响[17那18那19].例如,在较高的BL/RL比值下,番茄幼苗的茎长和叶面积均受到显著限制[19那20.].类似地,当黄瓜幼苗暴露于高百分比的BL时,抑制了幼杆长度和叶面积[21].此外,不同的LED灯显示出对植物中初级和物种特异性次生代谢物的产量的显着影响。例如,BL显着提高了豌豆芽和罗勒中酚类化合物的产率[22那23,黄酮类化合物的产生Cyclocarya成果[24愈伤组织培养中红景天苷的含量红景天imbricata[25].相反,红光和远红光部分诱导水杨酸的产生,从而增加了黄酮类化合物的积累银杏叶[26].此外,研究还发现,黄色LED灯对黄酮类化合物的浓度有一定的影响淫羊藿pseudowushanense[27].这些研究表明,黄酮类化合物和其他酚类化合物来源于苯基丙烷途径,在LED单色光照射下积累。苯基丙素途径也负责香豆素和木质素的产生[28].
到目前为止,人们已经做了很多努力来阐明苯丙素的生物合成,并发现这种复杂的调控网络高度依赖于多种因素,包括酶的相互作用、转录因子(TFs)和环境因素[28那29].对于TFs而言,MYB、bHLH、WDR和MBW复合物(由MYB、bHLH和WD组成)在植物中保存良好,并在苯丙素途径的调控中发挥关键作用[30.那31那32那33那34].
本研究的目的是通过实验比较白光、RL和BL的作用美国glabra并分析这些处理中的转录组学和代谢组学特征。此外,我们还鉴定了参与苯丙类化合物生物合成的功能基因和转录因子(R2R3-MYB和bHLH)及其表达模式。本研究的结果将为更好地了解不同单色LED光对植物生长和次生代谢产物积累的影响提供依据那并促进数量和质量美国glabra通过微调最佳光线培养。
结果
不同光质对植物生长的影响
在终末收获(第60天),RL和BL处理的叶面积显著低于WL处理(图2)。1a).与WL相比,RL处理株高较高,而BL处理株高较低(图2)。1b).在第60天,白光处理和BL处理的植株茎粗显著大于RL处理(图2)。1c).统计数据的细节已在附加文件中列出1S1:表。
Illumina测序、从头组装和参考转录组注释
15个cDNA文库共产生1.05亿原始reads,共获得1.09亿高质量干净reads。在每个文库中大约产生了559 - 9270万个原始reads (NCBI BioProject Accession: PRJNA664220,https://www.ncbi.nlm.nih.gov/bioproject/prjna664220).重新组装的相关参数已在附加文件中描述2S2:表。7个公共数据库的功能注释结果显示,46.9%的unigenes在至少一个数据库中被注释,而只有3.0%的unigenes在所有数据库中被注释(附加文件)3.:表S3)。共33626个unigenes被分为56个功能组,分别属于生物过程、细胞组分和分子功能三类4.:图S1)。
度分析
进行两组差异表达分析。结果表明,861个(BY vs. RY)、378个(BY vs. WY)、47个(RY vs. WY)、10033个(WG vs. WY)、7917个(WJ vs. WG)和6379个(WJ vs. WY)基因表达显著。
富集分析使用GO本体分析(附加文件)进行5.:图S2)。在代谢过程、单生物代谢过程、催化活性、离子结合活性和转移酶活性这5个指标中,DEGs占主导地位。同时,将所有的deg映射到KEGG数据库中(附加文件6.:图S3)。除RY和WY外,在各组中,DEGs富集于苯丙素(包括黄酮类化合物)的生物合成。苯丙类化合物正是从这一生物合成途径中产生的。因此,我们进行了后续实验和分析,基于转录组学和代谢组学分析来描述这种调节机制。
代谢物分析
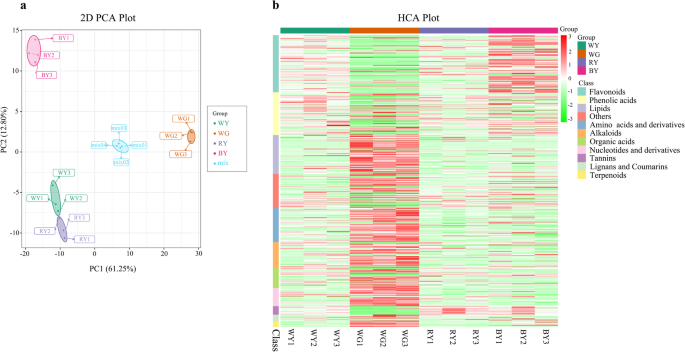
根据UPLC-MS/MS平台和自编数据库的结果,共检测到454种代谢物,包括木脂素和香豆素、黄酮类化合物、酚酸等。其中大部分为苯基丙类化合物,包括黄酮类化合物(90)、酚酸类化合物(66)、木脂素和香豆素类化合物(11)、单宁类化合物(13)1和额外的文件7.:表S4)。其中,从木脂素和香豆素类中分离得到的主要成分有川芎素、东莨菪素、异丙嗪素、川芎素和叶蜡素;从酚酸类中分离得到的主要成分有迷迭香酸、迷迭香基葡萄糖苷、绿原酸和叶蜡素美国glabra样本。
PCA(无花果。2A)结果显示,被检测的样品有显著的差异,它们的复制与同组其他样品的复制大体一致。HCA(无花果。2B)提出代谢谱,并将它们分布到所有样本中的10个类中。与WY和RY相比,BY中大部分类黄酮含量(如槲皮苷和山奈酚)较高。根(WG)和叶(WY、RY和BY)之间化学物质的分布存在显著差异。叶组织中类黄酮、酚酸、单宁等化合物含量较高,而根组织中类脂类、氨基酸及其衍生物生物碱、有机酸、核苷酸及其衍生物、木脂素、香豆素、萜类化合物含量较高。
对比分析结果如表所示2和无花果。3..在WY与RY、WY与BY、WY与WG中分别产生了44、87和296个差异化合物(图2)。3.此外,与WY相比,RY中有11种类黄酮(如山奈酚)和6种酚酸(如隐绿原酸)显著下调(表2)2和无花果。3.d).其中只有3种黄酮醇化合物(山奈酚、山奈酚、辛纳苷)在KEGG通路中与黄酮生物合成相关。在WY组与BY组中,40种黄酮、11种酚酸、2种木脂素和香豆素有显著差异。其中40个化合物表达上调,13个化合物表达下调(见表)2和无花果。3.d)。此外,在类黄酮生物合成中,涂上40种异载物中的8个,其中6个,其中6个以增加3.2至6.2倍,例如槲皮素和kaempferol。然而,碳氢化物和Protocatechuic醛的含量约为4.5倍。对于酚醛酸,七种代谢物含量下调,包括咖啡酸,eSculetin和Sinapinaldede,而其他代谢物含量,而其他代谢物含量含量增加2.5至3.3倍。对于木质汉和香豆素化合物,在逐渐下,Daphetin产量降低9.5倍,氧气膨出的含量增加2.1倍。就Wy对Wg组而言,129种苯丙烷衍生的代谢物显着上调(表2和无花果。3.d).在WY vs. WG组中,黄酮类化合物主要在WY中积累,而在WG中积累较少(图2)。2b).相比之下,在WG中某些香豆素(埃斯库林、异丙草苷和fraxidin)的产量较高,而在WY中其他香豆素(东莨菪素和羟色丁苷)和大多数酚酸类化合物的产量较高。
此外,我们选择了主要的活性成分,并比较了它们在WY、RY、BY和WG组织中的积累模式(图2)。4.).相对于WY, esculetin、咖啡酸、异丙醇、fraxidin、富马酸、顺丁烯二酸的产量显著降低(倍变化≤0.5),而BY中槲皮苷、山奈酚的产量显著上调(倍变化≥2)。此外,隐绿原酸、肉桂酸、叶黄素和芦丁的产量增加了1.5倍。同时,与WY相比,RY处理的芥子酸、叶甲素、叶甲素、落新丁、富马酸和顺丁烯酸产量增加1.3 ~ 1.7倍,隐绿原酸、肉桂酸和山奈酚含量显著降低(倍变化≤0.5)。与WY相比,绿原酸、隐绿原酸、肉桂酸、香豆酸、迷迭香基葡萄糖苷、东莨菪素、槲皮苷、山奈酚、落新丁、根皮素2′- o -葡萄糖苷、槲皮素、芦丁的产量显著降低(倍变化≤0.5);异丙嗪、弗拉西汀、延胡索酸和马来酸在WG中显著增加(倍数变化≥2)。
参与苯丙类生物合成的候选基因
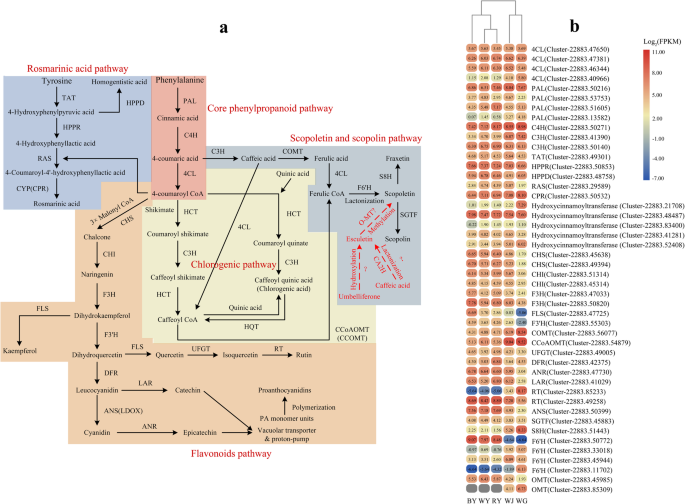
我们已经确定了编码来自类黄酮,香豆素和酚酸生物合成中涉及的大多数酶的46个候选基因(表3.,无花果。5.a, b,附加文件8.:表S5和附加文件9.:表S6)。此外,还发现了与rosmarinic酸生物合成相关的五种基因。黄酮类化合物,酚酸和大多数香豆素的生物合成源自核心苯丙烷型途径,其由PAL,C4h和4Cl酶催化的三个致力于催化。在这项研究中,四个朋友基因,四4 cl基因和一个C4H基因被鉴定,其中朋友基因(群集22,883.50216),4 cl基因(集群- 22883 .47381),C4H基因(集群- 22883 .50271)表现出最高的表达水平比其他成员和显示较高的表达水平的变化中,绿原酸通路中的五个基因编码hydroxycinnamoyltransferases被发现,基因的表达水平(集群- 22883 .48487)远高于其他成员。此外,该基因(Cluster-22,883.48487)在BY中高表达。此外,与其他样本相比,该基因(Cluster-22,883.21708)仅在WG中高表达。东莨菪碱生物合成是由3- o -甲基转移酶(COMT)和4CL在咖啡酸上的酶促反应或由咖啡酰CoA 3- o -甲基转移酶(CCoAOMT)与咖啡酰CoA反应产生的关键前体阿ferulic CoA衍生而来。与WY相比,只有一个COMT的基因(Cluster-22,883.56077)和一个CCoAOMT在该途径中鉴定出基因(Cluster-22,883.54879),其中两者都具有WG的最高表达水平,并在RY和下调下调。此外,特征在于编码2-氧氧化或Fe(II)依赖性二氧基团的五种基因。特别地,F6'H和S8H蛋白属于2-氧代氟丁酸酯和Fe(II) - 依赖性二氧基团系列.大型系统发育树表明,由这五种基因编码的蛋白质高度相似于F6'H或S8H蛋白(附加文件10:图S4)。其中,由一个基因(Cluster-22,883.51443)编码的蛋白质美国glabra与S8H蛋白(XP_030962790.1)的相似性最大Quercus兜水母目.此外,在这些基因中,该基因(Cluster-22,883.51443)在WG中高表达,而另一个基因(Cluster-22,883.50772)在BY中的表达量显著高于其他样本。迷迭香酸的生成途径包括四个连续的酶反应,从前体(酪氨酸)和四种酶酪氨酸转氨酶(TAT)、羟基苯基丙酮酸还原酶(HPPR)、迷迭香酸合成酶(RAS)和细胞色素P450还原酶(CYP)开始。其编码基因分别为Cluster-22,883.49301、Cluster-22,883.50853和Cluster-22,883.50532。对于迷迭香合成酶(RAS)蛋白,未根系统进化树显示,RAS蛋白由该基因(Cluster-22,883.29589)编码美国glabra与RAS蛋白的相似性最大的是胡桃regia(XP_018826314.1)和落花生ipaensis(XP_016205435.1)额外的文件11:图S5)。Cluster-22,883.49301基因在WY、RY和BY中无显著差异表达,而Cluster-22,883.50853在BY中有高表达。Cluster-22,883.50532基因在WG中的表达量显著高于在BY中的表达量,相对于WY和RY的表达量较少。
类黄酮生物合成共享掺入CHS,CHI和F3H酶的核心途径,并且在RY和通过的编码上述酶的这些基因的表达水平均较高。由于中间体化合物(二氢戊戊烯醇)通过核酸酶反应产生,将其流入几个分支以产生花青素,原花青素,黄酮等。Kaempferol的生物合成通过黄酮合成酶(FLS)酶对二氢戊戊烯醇和杂物催化酶被簇-22,883.47725的基因编码,簇-22,883.47725的表达水平在显着上调。Rutin also originates from the precursor of dihydrokaempferol through the enzymatic reactions by flavonoid 3′-hydroxylase (F3’H, encoded by Cluster-22,883.55303), FLS, UDPG flavonoid O-glucosyltransferase (UFGT, encoded by Cluster-22,883.49005), and rhamnosyl transferase (RT, encoded by Cluster-22,883.85233 or Cluster-22,883.49258). These genes (except Cluster-22,883.85233) had similar expression patterns that BL had the potential to induce higher expression levels. Interestingly, the gene of Cluster-22,883.85233 was mainly expressed in WG to synthesize rutin, but Cluster-22,883.49258 showed a higher expression level in WY and WJ. A series of enzymes, including dihydroflavonol 4-reductase (DFR), leucoanthocyanidin reductase (LAR), anthocyanin synthase (ANS), and anthocyanidin reductase (ANR), are responsible for the production of catechin and epicatechin, which eventually synthesize the product of proanthocyanidins (PAs). The genes ofDFR.(Cluster-22,883.42375)和拉(Cluster-22,883.41029)在RY中表达量较高,而编码ANR的Cluster-22,883.47730基因在BY中表达量较高。此外,基因答(Cluster-22,883.50399)在RY和BY中高表达。总的来说,BL和RL的培养提高了许多功能基因的表达水平,如一些同型异构体朋友基因家族,4 cl基因家族,CHS那气那F3h.那C4H,和答.
MYB和bHLH候选转录因子
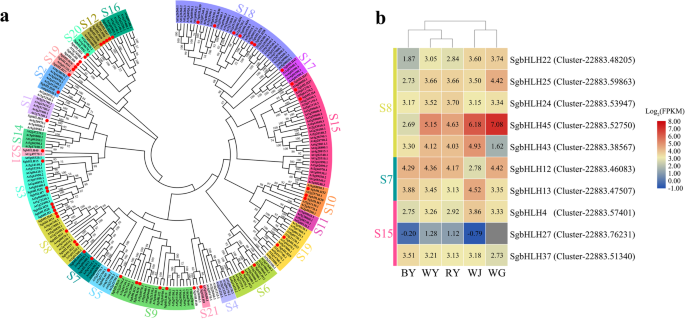
共收集到142个MYB (MYB和MYB相关)基因和61个bHLH基因。对于MYB蛋白,经过筛选,92个MYB基因具有不同数量的高度保守的dna结合域,分为4类:1R-MYB、R2R3-MYB、3R-MYB和4R-MYB蛋白,分别包含35、53、3和1个基因。自拟南芥该研究首次为植物MYB转录因子的描述和分类提供了理论依据。在植物中,R2R3-MYB蛋白是MYB家族中最大的一类。它们参与植物的特定过程,并已被分为亚组拟南芥基于C末端域中的DNA结合结构域和氨基酸基序的保护[31].在这里,我们已经鉴定了53个R2R3-MYB结构域的主要结构美国glabra(附加文件12:图S6).我们用53个R2R3-MYB氨基酸序列构建了系统发育树美国glabra和125个全长R2R3-MYB氨基酸序列拟南芥蒂利亚纳(无花果。6.a).大量研究表明,R2R3-MYB蛋白的某些亚群参与了黄酮类化合物生物合成的调控拟南芥蒂利亚纳,包括S4、S5、S6、S7子组。亚群7中,AtMYB11、AtMYB12和AtMYB111与黄酮醇的生物合成密切相关。SgMYB38与AtMYB111聚类。SgMYB53在S6亚群(AtMYB75/90/113/114)中表现出高度的功能相似性,调控花青素色素通路。在第5亚群中,SgMYB8/14/28/43/27/39的6个R2R3-MYB蛋白与AtMYB123在PAs生物合成途径的同一分支。此外,我们还鉴定了两个R2R3-MYB蛋白:与AtMYB38 (RAX2, S14)氨基酸序列相似的SgMYB6蛋白,以及与16亚群成员聚类的SgMYB32蛋白。热图显示了前面根据Log选择的10个基因的表达模式2(FPKM)值(无花果。6.b).根据转录组结果,测定SGMYB38.(Cluster-22,883.68401)在BY中表达上调。在亚群5中,这6个基因在不同样本间的表达模式不同。的基因SGMYB28.(集群- 22883 .46964),SgMYB8(集群- 22883 .824),SGMYB39.(Cluster-22,883.68770)在WY中表达量最高,高于RY和BY。同时,表达水平SGMYB43(Cluster-22,883.34211)显示BY显著增加。值得注意的是,基因SGMYB27.(Cluster-22,883.3887)在WJ中表达量最高,而SgMYB6(集群- 22883 .63255)和SGMYB32.(Cluster-22,883.11906)在WG中高表达。
BHLH蛋白质是TFS的另一个古老且功能多样的超级家族,这已广泛研究。在该研究中,我们确定了编码具有可区分签名结构域的BHLH蛋白的53个基因。我们用这些53bhlH氨基酸序列构建了系统发育树美国glabra和182全长AtbHLH蛋白序列拟南芥蒂利亚纳(无花果。7.a). SgbHLH域多序列比对结果已显示在附加文件中13:图。S7。如图1所示。7.一个,所有的bHLH蛋白被分为21个亚类指示不同的子类之间的节点值是低的,但是每个亚类内的值很高,这表明后者具有很强的进化关系。特别是,以前的研究表明,bHLH蛋白被分为32个小类[36], S2、S5、S24亚类(对应于AtbHLH蛋白的S8、S7、S15亚类)参与调控黄酮类化合物的生物合成。在S8亚类中,我们鉴定了一组SgbHLH蛋白,即SgbHLH22/24/25/43/45,与其他AtbHLH蛋白成员序列相似。与WY和RY基因表达变化相似相比,这5个编码S8 SgbHLH蛋白的基因在BY中的相对表达量显著降低。特别是,基因SgbHLH45(Cluster-22,883.52750)在WJ和WG中显著上调。在S7亚类中,SgbHLH13和SgbHLH12与At1g63650 (EGL)、At5g41315 (GL3)、At4g00480 (MYC1)和At4g09820 (TT8)聚类,这些亚类与一些R2R3-MYB成员相关,参与调控黄酮类代谢、毛状体形成、表皮细胞fate specification,以及根表皮细胞中毛发和非毛发细胞的形成[36].的基因SgbHLH12(Cluster-22,883.46083)在WY、RY、BY和WG中表达无显著差异,但在WJ中表达量较低。然而,基因SgbHLH13(Cluster-22,883.47507)在WJ中表达量最高。此外,SgbHLH4/27/37的3个bHLH蛋白属于S15亚类。的表达水平SGBHLH4.(Cluster-22,883.57401)在BY和RY中略低于WY,但SgbHLH27(Cluster-22,883.76231)的BY、WJ和WG水平较低。的基因SgbHLH37(Cluster-22,883.51340)的表达水平更高(图。7.b)。
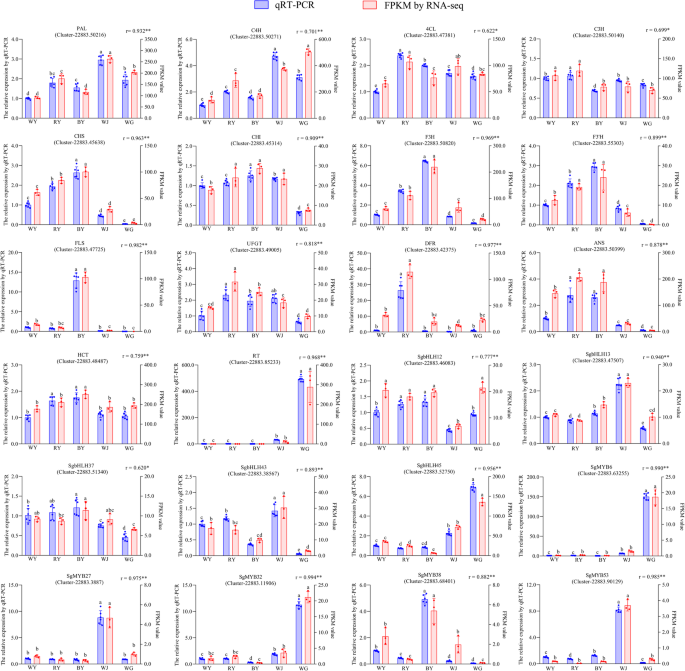
使用QRT-PCR验证转录物表达
为了验证RNA-seq结果的准确性,共选择了24个基因(5个R2R3-MYB基因,5个bHLH基因,另外14个与类黄酮生物合成相关的功能基因)8.:表S5)。qRT-PCR结果显示,筛选出的24个基因的表达水平与RNA-seq获得的表达水平基本一致(图2)。8.).qRT-PCR与RNA-seq的相关系数均较高(r > 0.600)。因此,qRT-PCR结果表明,RNA-seq数据是可靠的,可用于今后的实验。
讨论
不同LED光源对植物形态性状的影响
在本研究中,我们发现单色LED灯光对其形态特征有显著影响美国glabra.具体地,与WL相比,RL显着增加了植物高度并降低了杆直径和叶面积,而BL显着抑制了高度和叶面积美国glabra.在以前的研究中也得到了类似的发现,例如,在RL下萝卜茎被发现是细长的[37].在BL和RL对番茄和其他品种茎伸长的影响试验中,结果表明,随着BL / RL比例的增加,茎长降低[19那38].然而,另一份关于黄瓜的报告显示,与其他治疗相比,幼苗在Bl下显示出高度,幼杆和显微胶质酰增加[39].红色和蓝光是光合作动辐射频谱的重要组成部分(PAR),因此在植物光学发生中发挥着基本作用。植物感觉并通过光感受器(植物)(PHY)(PHY)(PHY)递送光信号[36那40]、隐色素(哭声)[41[光ropins(phot)[42,进而通过信号转导触发植物的生长发育。光敏色素是R/FR光感受器,能够持续感知周围环境并对其作出反应[43].在RL照射下,光敏色素抑制组成型光形态PHOTOMORPHOGENCI 1 (COP1)和光敏色素相互作用因子(PIFs)的活性。基因的表达水平(集群- 22883 .48222)编码COP1蛋白在RY王寅相比显著降低,,这意味着RL加速phy COP1分解,从而诱导几个photomorphogenesis-promoting TFs(如HY5和LAF1)表达水平较高(即可见一斑40].在本研究中,我们发现Cluster-22,883.57986编码HY5和SGMYB32.(Cluster-22,883.11906)编码Laf1显示出更高的表达水平至各种程度。
Cry1、Cry2和Cry3 (Cry- dash)主要介导BL,并参与抑制下胚轴伸长、幼苗去黄化、花的起始、根的发育和其他光响应拟南芥蒂利亚纳[41],而Cry科的成员则因不同的植物而不同[38].同时,Phot家族成员(Phot1和Phot2)被认为是另一种紫外线(UV)和蓝光感光体。Phot1和Phot2以不同的调控方式参与趋光性的调控:Phot1激活需要较低的BL强度阈值,而Phot1和Phot2通过较高的蓝光强度相干介导[38那42].就幼杆伸长率而言,先前的研究表明,其抑制是通过Cry1,Cry2和Phot1期间的幼苗的去甲酸的结合阶段的组合作用来控制[38那41].在本研究中,我们发现Cluster-22,883.51204、Cluster-22,883.48125、Cluster-22,883.53309和Cluster-22,883.50402四个基因分别编码Phot1、Phot2、Cry1和Cry2蛋白,它们参与了对蓝光照射的感知和响应(Additional file)15:图S8)。在这些基因中,相对表达水平Phot1(群集-22,883.51204),和Cry1(Cluster-22,883.53309)基因在BY中表达上调Cry2(Cluster-22,883.50402)基因进行了下调。如前所述,表达水平更高Phot1和Cry1基因抑制了胚轴伸长率美国glabra幼苗,随后与其他信号分子整合,通过转录和翻译后机制介导蓝光调控基因的调控网络[41那44].在之前的一项使用动力学分析方法的研究中,有报道称茎的生长速率是由多种环境信号决定的,如激素和内源性节律[45].为什么不同的进化表型和空中发展应对RL,BL和BL / RL是不一致的不同植物之间的解释是复杂的,需要进一步研究。此外,光敏色素介导的调节的详细机制(例如,茎伸长和芽的生长,也需要进一步的研究[43].
黄酮类化合物和香豆素生物合成的结合分析
All of the flavonoid compounds identified in this study are thought to be derived directly from the reaction between 4-coumaroyl CoA and 3 units of malonyl CoA catalyzed by CHS, CHI, F3’H, F3H, and FLS enzymes (encoded by early biosynthetic genes, EBGs). The intermediate products of this reaction are dihydroflavonols (e.g., dihydrokaempferol or dihydroquercetin) which are subsequently used as substrates in other pathways involved in flavonol, anthocyanin, and proanthocyanidin biosynthesis regulated by downstream genes (designated late biosynthetic genes (LBGs), Fig.5.)(46那47那48那49].我们的代谢谱分析(图。4.)显示,一些黄酮(例如,槲皮素和Kaempferol)的产量均明显高。他们在花粉生育,花卉颜色和UV-B保护中发挥着重要作用[50].在黄酮醇代谢中,FLS属于2-氧戊二酸依赖性双加氧酶,是一种具有多种亚型的分支点酶,以组织特异性和诱导的方式催化二氢山酚向产物的转化[51那52].本研究鉴定了FLS酶编码基因Cluster-22,883.47725。我们注意到黄酮醇的产量因其在WY、RY、BY和WG中的相对表达而不同。给出较高的相对表达式霉基因在蓝光处理下,槲皮苷、山奈酚和芦丁的产量急剧增加美国glabra。肉桂酸和4-香豆酸都是核心苯基丙酸途径前两步的上游产物,因此它们的产生调节了前体向各侧分支的流动,与木脂素、黄酮类化合物和酚酸的生物合成有关。其中,C3H酶催化4-香豆酸转化为咖啡酸合成木质素,咖啡酸随后进入木质素途径。同时,4CL酶催化4-香豆素酸转化为4-香豆素辅酶a, 4-香豆素辅酶a是与莽草酸或奎尼酸结合进入绿原体途径的底物,它还与丙二酰辅酶a一起生成各种类黄酮。代谢产物分析表明,与WY相比,by中肉桂酸和4-香豆酸的初始产物含量分别增加了1.47倍和1.08倍,而咖啡酸的旁路生产受到抑制。因此,4-香豆素酸的产量增加导致4-香豆素辅酶a的合成增多,进而产生更多的黄酮类化合物和绿原酸(如查尔酮和柚皮素)。一般来说,初始前体的积累与生物合成基因的表达水平密切相关,包括朋友那C4H,和4 cl是核心苯丙烷型途径中三种连续犯下的基因,导致类黄酮品种。在答:芥,朋友基因家庭(AtPAL1-AtPAL4),4 cl基因家庭(At4CL1-At4CL4),只有一个成员AtC4H已经被确定和阐述过,其中一些像AtPAL1和atpal2 -被认为在苯基丙素途径中起着重要作用[28那53),而At4CL3被认为偏爱类黄酮生物合成[54].大型系统发育树表明,簇-22,883.50216,Cluster-22,883.50271和Cluster-22,883.47381的基因高度同源PAL1/2那C4H,和4CL3.这些基因分别在蓝光和红光条件下表达量上调,表明这些连续的基因参与了黄酮类化合物的生物合成(附加文件16:图S9)。
香豆素广泛分布于多种植物中,在抵抗植物病原、非生物胁迫、氧化应激、临床疾病等方面具有多种生物活性,是植物的重要特化代谢物美国glabra[4.那5.].由于与香豆素生物合成相关的关键酶法步骤在植物中仍然是未知的,包括美国glabra本研究对目前可能的途径进行了研究,并分析了参与东莨菪素、紫苏素、东莨菪素生物合成的编码f6’h、S8H、SGTF的基因。在无花果。4.在WG中,除东莨菪素和东莨菪素外,川芎素、埃斯库林、异呋虫素和川芎素的产量最多。遗憾的是,KEGG通路数据库中未绘制出异ofraxidin和fraxidin生物合成图谱。fraxetin的大量积累与编码S8H的基因(Cluster-22,883.51443)在WG中较高的表达量密切相关。此外,在RY、BY和WG中,由于表达水平较低,东莨菪素产量降低SGTF.基因(Cluster-22,883.45883),催化scopolin的形成。东莨菪素,除了4CL和F6'H1依次酶促反应由阿诸酸生成东莨菪素的几点[55].其他研究表明,东莨菪素也可以通过o -甲基转移酶(O-MT)的甲基化转化为东莨菪素[4.].在BL条件下,降低的水循环素的产生可能是由其两种前体的阿魏酸和exculetin的产量较少。类似于微量素,骨飞素的生物合成途径起源于umbelliferone或地球上的咖啡酸,尚不清楚[4.].
部分R2R3-MYB和bHLH转录因子调控EBGs和lbg的表达水平
迄今为止,关于R2R3-MYB、bHLH、WDR和MBW配合物的TFs作为植物中苯丙类生物合成的调控因子的研究有很多[48那56那57那58那59那60].这些研究强调了这些TFS和MBW复合物在植物组织和种子涂层中的黄酮类生物合成调节中的重要性。完整的黄酮型途径依赖于EBG和LBG的协调表达。而且,在答:芥, R2R3-MYB蛋白的亚类(S4, S5, S6, S7) [31] BHLH蛋白的亚组(S8,S7和S15)[33,以及几种WD40蛋白[34那61](如TTG1)已被证实在黄酮类化合物生物合成中以一定方式参与了EBGs和lbg的表达调控。在黄酮醇生物合成中,EBG基因受亚群7的AtMYB11/12/111蛋白成员的调控,从而控制黄酮醇的发育[47那62].SgMYB38被归为第7亚组,可能控制表达水平CHS那气那F3h.那F3'H,和霉基因。与WY和RY相比,SGMYB38.基因在BY中显著上调,直接提高了EBGs的表达水平,促进了部分黄酮醇类化合物的积累。此外,这些EBGs的qRT-PCR和RNA-seq数据也证实了这一点。PAs的积累主要分布在种皮最内层,受四种以上MBW复合物的调控,即AtMYB123 (TT2)-TT8/GL3/EGL3-TTG1和AtMYB5-TT8-TTG1ANS(LDOX)那DFR.,和UFGT[30.].AtMYB75/90/113/114-TT8/GL3/EGL3-TTG1的MBW复合物也通过调控营养组织中LBGs的时空表达来确定花青素的生物合成[63].基于这些结果,可以合理地假设MBW复合物靶向基因特异性。因此,在本研究中,我们筛选并鉴定了R2R3-MYB、bHLH和WDR TFs的编码基因。其中SgMYB8/14/27/28/43/39可能编码R2R3-MYB蛋白5亚群的同源蛋白TT2,而由SGMYB53在R2R3-MYB蛋白亚群6成员中显示出高度的功能相似性。预测SgbHLH12/13编码TT8/GL3/EGL3/MYC1,属于中bHLH蛋白亚群7拟南芥而Cluster-22,883.52183基因大部分被认为编码TTG1。我们有理由认为,SgMYB8/14/27/28/43/39-SgbHLH12/13-TTG1的MBW配合物可能参与了PAs的合成,而SgMYB53-SgbHLH12/13-TTG1可能与花青素的生物合成有关。在本研究中,我们鉴定了这些编码TFs的基因,并提出了潜在的MBW复合物美国glabra根据所研究的模型植物。然而,类黄酮生物合成的某些方面仍是未知的:例如,由于无法获得基因组数据美国glabra,尚未鉴定苯基丙二醇途径中涉及的重要基因的拷贝数。对MBW复合物结构,功能和调节的深入分析美国glabra仍然是必需的。
结论
总之,美国glabra不同单色LED光(WL、RL和BL)下培养的幼苗,其植株生长存在显著差异。此外,转录组学和代谢组学分析表明,LED灯对苯丙类生物合成的代谢物积累和功能基因和转录因子(R2R3-MYB和bHLH)的表达模式有显著影响。与白光相比,BL在EBGs和部分lbg中在特定TFs的调控下表达量更高,导致BY中类黄酮产量显著增加。霉基因作为限制因子,降低了RL条件下黄酮醇类化合物的产量。此外,在BY中,所需化合物(如叶甲素、异丙沙星素、叶甲素、富马酸和顺丁烯酸)的产量显著减少,而RL刺激了一些重要化合物(如芥子酸、叶甲素、叶甲素、东莨菪碱、落新丁、延胡索酸、叶甲素和顺丁烯酸)的积累。本研究为深入了解植物中苯丙素的生物合成调控机制提供了有益的参考Sarcandra glabra.
方法
处理和样品收集
种子美国glabra是在中国福建省三明市娄原国有林场采集的。种子在福建农林大学竹子研究所(26°5′N, 119°13′E)恒温恒湿培养箱(25°C, 60%湿度)中培养,当第一对真叶充分展开时,将90株幼苗移栽于黑色聚氯乙烯(PVC)矩形盆(10 × 10 × 8 cm),采用pinstrup基质(pH 5.5)进行栽培。在3种不同光处理(WL, 380 ~ 760 nm;RL 656海里;提单,450海里)。每个处理(WL、RL和BL)有30株幼苗,共90株幼苗,每个处理(30株幼苗)又细分为相同处理的10株幼苗。LED灯、量子传感器和光度计(HR-450)均购自Hipoint公司。光的光合光子通量(PPFD)设置为80 μmol·m−2·年代−1,光周期为16/8 h(昼/夜)。利用HR-450机器分别监测PPFD和光谱的强度。60天后,我们从每个处理中选择9株健康的幼苗,从基质中小心地取出,清洗,并在滤纸上干燥。在每个处理中,在这9株幼苗中,选择3株幼苗作为复合样本(一个重复)。然后,分离每个重复的叶、茎和根,并混合每个处理相同的组织。在本研究中,我们主要关注白光、RL和BL对叶片的影响,以及白光对不同组织的影响美国glabra.因此,选取WY、RY、BY、WJ和WG样品进行三次复制,并立即在液氮中冷冻,在80℃保存,待进一步分析。
形态特征的测定
在整个栽培期间,分别用卷尺和游标卡尺测量株高和茎粗。60天后,使用便携式叶面积仪(LI-3000C, Ecotek)测量上部完全展开的叶片。
RNA提取和转录组分析
采用RNAprep Pure Plant Kit (DP441, TIANGEN BIOTECH)提取总RNA。然后将这些RNA样本用DNase I (Takara)处理,去除基因组DNA污染,送至中国北京诺富基因生物信息学技术公司进行cDNA文库构建和Illumina测序。根据制造商的建议,使用Illumina (NEB, USA)的NEBNext Ultra™RNA Library Prep Kit生成cDNA文库。在Illumina Hiseq平台上对文库准备进行测序,生成配对端读。
de novo集会和注释
对于组装的质量,通过删除包含适配器的读、包含ploy-N的读和来自原始数据的低质量读,可以获得干净的读。采用Trinity方法重新组装干净的reads [64].利用NCBI非冗余蛋白(Nr)、NCBI核苷酸序列(Nt)、蛋白家族(Pfam)、真核生物正交组(KOG)、瑞士- prot数据库、京都基因与基因组百科全书(KEGG)和基因本体论(GO) 7个公共数据库或程序对基因进行注释。
基因表达分析
每千碱基的转录本/百万映射转录本(FPKM)值用于分析基因表达。用R包测量任意两组处理的差异表达分析DEGseq2[65].调整后的P.-值设为0.05为阈值,以确定差异显著性。富集分析使用R包与GO本体进行GOseq[66].利用KEGG数据库对KEGG通路进行注释。修正后的P.-value < 0.05和|日志2(FoldChange)|≥1为阈值,以确定GO和KEGG富集分析下的显著差异。最后,利用TBtools软件和Log软件构建候选基因的热图2FPKM值的换算[67].
MYB和bHLH候选转录因子
根据的转录组数据美国glabra,我们使用PlnTFDB数据库(http://planttfdb.cbi.pku.edu.cn/),以识别MYB和bHLH的资助人[68].根据杜博斯和斯特拉克等人以往的研究,确定了其特征和分类R2R3-MYB.基因家族在拟南芥蒂利亚纳[31那35[我们鉴定并分类了编码R2R3型MYB蛋白的基因美国glabra。此外,根据以前的研究[33那69的bHLH蛋白特征拟南芥蒂利亚纳,我们确定了BHLH蛋白的分布和预测的DNA结合特征美国glabra.
qRT-PCR验证RNA-seq数据
使用具有GDNA橡皮擦(RR047A,Takara,Japan)的Primescript TM RT试剂盒从1μg的总RNA产生第一链cDNA。由Primer Premier 5.0软件(Primer,Canada)设计了基因特异性引物和参考基因(Clathrin衔接络合物,CAC),并由Sunya公司(福州,中国)合成(额外文件17:表S8)。所有分析在每个生物重复中重复两次。采用SYBR Green premix Ex Taq Kit (RR820A, Takara, Japan)在ABI 7500 Real-Time PCR系统(Applied Biosystems, USA)上进行qRT-PCR。检测内参基因的表达水平T.值和计算使用2——ΔΔCT.方法。
系统发育分析
使用DNaman软件执行多序列对准分析。通过使用MEGA7.0构建系统发育树与邻居加入方法,通过CLUSTALW对齐后重复1000个引导方法[70].
代谢组学分析分析
样品制备和提取
同时,将WY、RY、BY和WG样品经三次复制后送往中国武汉的Metware科技公司进行代谢组学分析。冻干的叶子和根在30hz的频率下使用带有氧化锆珠的混合磨粉碎90秒。100毫克的粉末称重,在4°C下使用0.6 ml 70%甲醇水溶液过夜提取。10, 000×g离心10 min后,提取液吸收过滤后进行UPLC-MS/MS分析。
UPLC条件
采用UPLC- esi -MS/MS系统(UPLC, SHIMADZU CBM30A系统;MS, Applied Biosystems 4500Q TRAP)。分析条件为:色谱柱为Waters ACQUITY UPLC HSS T3 C18 (1.8 μm, 2.1 mm × 100 mm);流动相为溶剂A,纯水+ 0.04%乙酸,溶剂B,乙腈+ 0.04%乙酸。样品测量是在95% a和5% B的初始条件下的梯度程序下进行的。在10分钟内,对5% a和95% B进行线性梯度,5% a和95% B的组成保持1分钟。随后,95% a和5.0% B的组成在0.10 min内调整,并维持2.9 min。柱温为40℃,进样量为4 μl。废水交替连接到esi -三重四极线性离子阱(QTRAP)-MS。质量控制样品是由所有样品的等量混合物制成的。在此过程中,为了监测分析条件的稳定性,质量控制样品每10次注射后进行一次检验。
ESI-Q Trap-MS / MS
LIT和三重四极杆(QQQ)扫描通过三重四极杆线性离子阱质谱仪(Q trap), API 4500 Q trap UPLC/MS/MS系统,配备ESI Turbo离子喷雾界面,在正负离子模式下运行,并由Analyst 1.6.3软件(AB Sciex)控制。ESI源运行参数为:离子源,涡轮喷雾;源温度550°C;离子喷淋电压(IS) 5500 V(正离子模式)/−4500 V(负离子模式);离子源气体I (GSI)、气体II (GSII)、帘气(CUR)分别设置为50、60、30.0 psi;碰撞气体(CAD)高。用10和100 μmol L进行仪器调谐和质量校准−1聚丙烯乙二醇溶液,分别在QQQ和LIT模式。QQQ扫描作为MRM(多反应监测)实验,碰撞气体(氮气)设置在5psi。通过进一步优化这两个参数,对单个MRM过渡进行了DP和CE。根据在每个时间段内洗脱的代谢物,监测特定组的MRM转变。
代谢物鉴定与分析
代谢物鉴定采用自编的MWDB数据库(MetWare biological science and Technology Co., Ltd., Wuhan, China)和公开可用的代谢物数据库。根据MRM模式对代谢物进行定量分析,通过QQQ质谱筛选各代谢物的特征离子,获得信号强度。色谱峰的整合和校正使用MultiQuant版本3.0.2 (AB SCIEX,加拿大)。相应的相对代谢物含量以色谱峰面积积分表示。为了研究样品和质量控制样品(混合样品和上述样品的等质量混合样品)之间的代谢差异和变异程度,使用R包进行无监督主成分分析(PCA)PrComp..为了研究不同样本的代谢变化,使用R包进行分层聚类分析(HCA)的热图,在进行HCA分析前,对原始数据进行单位方差(UV)缩放处理。将差异显著的代谢物设置为VIP (variable importance projection)≥1和Log阈值2(翻倍)≥1或≤−1。
统计分析
使用SPSS 20.0软件(IBM,USA)进行统计分析。在不同处理之间的平均差异比较通过方差分析(ANOVA)分析在α0.05,0.01,0.001执行,并且0.0001概率水平。在哪里P.< 0.05,P.< 0.01,P.< 0.001,P.用< 0.0001 *, **, ***, 和* * * *。图表分别使用Graph-Pad Prism 8.0和MS Excel。
数据和材料的可用性
支持本文结论的数据集包含在本文及其附加文件中。转录组原始数据已保存在序列读取档案(SRA)数据库中,登录号为PRJNA664220 (https://www.ncbi.nlm.nih.gov/bioproject/prjna664220).
缩写
- 领导:
-
发光二极管
- WL:
-
白光LED灯
- RL:
-
红色LED灯
- 提单:
-
蓝色LED灯
- 度:
-
差异表达基因
- 工作组:
-
WL下根组织
- WJ:
-
WL下茎组织
- 由:
-
BL下叶组织
- WY:
-
WL下叶组织
- 办法:
-
在R1下的叶组织
- vs .:
-
与
- 差距:
-
良好农业规范
- TFs:
-
转录因素
- MBW:
-
MYB-bHLH-WD40
- Nr:
-
非冗余蛋白质
- Nt:
-
NCBI核苷酸序列
- 包含了:
-
蛋白家族
- KOG:
-
真核生物同源群
- KEGG:
-
京都基因和基因组百科全书
- 走:
-
基因本体论
- FPKM:
-
每千碱基的片段每百万映射的转录本
- PVC:
-
聚氯乙烯
- PPFD:
-
光合光子通量密度
- 存在:
-
定量实时聚合酶链反应
- PCA:
-
主成分分析
- HCA:
-
层序聚类分析
- 紫外线:
-
单位方差
- 朋友:
-
苯丙氨酸氨裂解酶
- C4H:
-
肉桂酸4-hydroxylase
- 4CL:
-
4-coumaroyl辅酶a连接酶
- C3H:
-
Coumarate 3-hydroxylase
- HCT:
-
羟基氨基酰基CoA Shikimate羟基氨基酰基转移酶
- HQT:
-
羟-肉桂酰辅酶a奎宁酸羟肉桂酰转移酶
- COMT:
-
咖啡酸3-O-methyltransferase
- CCOAOMT(CCOMT):
-
Caffeoyl辅酶a 3-O-methyltransferase
- F6'H:
-
Feruloyl-CoA 6'-羟化酶
- S8H:
-
东莨菪亭8-hydroxylase
- SGTF:
-
东莨菪亭葡糖基转移酶
- O-MT:
-
O-methyltransferase
- CHS:
-
Chalcone合成酶
- 气:
-
查耳酮异构酶
- F3H:
-
黄烷酮3-羟化酶
- F3'H:
-
类黄酮3 ' -羟化酶
- 弗尔斯:
-
黄酮醇合成酶
- UFGT:
-
UDPG黄酮类O-glucosyltransferase
- RT:
-
rhamnosyl转移酶
- DFR:
-
Dihydroflavonol 4-reductase
- 政治:
-
leucoanthocyanidin还原酶
- ANR:
-
花青素还原酶
- ANS或LDOX:
-
花青素合成酶或白藻藻苷二氧化根蛋白酶
- 答:
-
酪氨酸氨基转移酶
- HPPR:
-
Hydroxyphenylpyruvate还原酶
- HPPD:
-
4-hydroxyphenylpyruvate加双氧酶
- 拉:
-
迷迭香酸合酶
- CYP (CPR):
-
细胞色素P450还原酶
- CA2H:
-
咖啡酸2-羟化酶
- 功率放大器:
-
原花青素
- 接待员:
-
相关系数
- 票面价值:
-
光合活性辐射
- 体育:
-
光敏色素
- 口号:
-
cryptochromes.
- 辐透:
-
Phototropins
- COP1:
-
构成光学斑荣1
- 进行通信:
-
光敏色素相互作用的因素
- EBGs:
-
早期的生物合成的基因
- lbg:
-
晚期生物合成的基因
- 贵宾:
-
变量投影重要性
参考资料
- 1.
李华,龚欣,王志,潘超,赵颖,高旭,刘伟Sarcandra glabra.国际生物医学杂志。
- 2.
周华,梁军,吕东,胡艳,朱艳,司俊,吴胜Sarcandra glabra通过非靶向高效液相色谱法指纹和靶向电喷雾电离串联质谱/飞行时间质谱分析。食品化学。2013; 138(4):2390-8。
- 3.
中华人民共和国国家药典委员会。中华人民共和国药典(第一卷)北京:化学工业出版社;2015.
- 4.
王志强,王志强,王志强,等。植物中香豆素的生物合成:细胞色素P450酶的一个重要途径。Phytochem启2006;5(2):293 - 308。
- 5.
刘军,李旭,林军,李勇,王涛,姜强,陈东。Sarcandra glabra(草山虎)保护间充质干细胞免受氧化应激。生物评价和机械化学。BMC complete Altern M. 2016;16:423。
- 6.
曹华,谭锐,何锐,唐丽,王旭,姚宁,段伟,胡颖,姚旭,栗原H。Sarcandra glabra提取物降低了抑制压力的小鼠中流感的敏感性和严重程度。基于evid的补充替代医学。2012年; 2012:236539。
- 7.
魏树华,迟军,周敏,李锐,李勇,罗建军,孔亮Sarcandra glabra及其上调的AKT / NRF2 / HO-1信号机构。ind crop prod。2019; 137:367-76。
- 8.
郭旭,沈磊,童勇,张军,吴刚,何强,于胜,叶鑫,邹磊,张震,等。咖啡酸3,4-二羟基苯乙酯的抗肿瘤活性及其药代动力学和代谢特性。植物学期刊.2013; 20(10):904-12。
- 9.
李旭,张艳,曾旭,杨玲,邓艳Sarcandra glabra采用超高压液相色谱- LTQ轨道rap质谱联用技术制备。快速公共质谱。2011;25(17):2439-47。
- 10.
郑伟,王胜,陈旭,胡哲Sarcandra glabra及其药用制剂的毛细管电泳分析。60 Talanta。2003;(5):955 - 60。
- 11.
Yaermaimaiti S,Wang P,Luo J,Li R,Kong L. Sesquiterpenoids来自种子Sarcandra glabra以及潜在的抗炎作用。Fitoterapia。2016;111:7-11。
- 12.
廖鹏,刘鹏,王勇,黄超,兰玲,杨勇,崔旭田七:克服连作障碍的新途径。2018; 126:38-47。
- 13.
丁军,涂华,臧志,黄敏,周松。温室生长环境的精确控制与预测铁皮石斛.计算电子agr。2018; 151:453-9。
- 14.
利用光伏技术的能源可持续温室作物栽培。更新Sust energy Rev. 2019; 109:116-37。
- 15.
Tarakanov I,Yakovleva O,Konovalova I,Paliutina G,Anisimov A.发光二极管:在组合灯光技术的基础研究和作物生产的路上。Acta Hortic。2012; 956:171-8。
- 16.
高亮度led节能光源及其在室内植物栽培中的应用。更新Sust能源Rev. 2009;13(8): 2175-80。
- 17.
De Keyser E,Dhooghe E,Christianens A,Van Labeke M,Van Huylenbroeck J. LED轻质质量加剧了观赏盆栽植物的叶子色素沉着。SCI Hortic。2019; 253:270-5。
- 18.
Berkovich YA, Konovalova IO, Smolyanina SO, Erokhin AN, Avercheva OV, Bassarskaya EM, Kochetova GV, Zhigalova TV, Yakovleva OS, Tarakanov IG。LED作物照明室内空间温室。达到.2017; 6:11-24。
- 19.
王志强,王志强,王志强,等。蓝光和红光对番茄幼苗茎伸长和开花的影响。Acta Hortic。2012;956:261-6。
- 20。
红、蓝网对番茄生理、形态性状、产量和品质的影响Solanum lycopersicum磨坊。)。SCI Hortic。2020; 264:109185。
- 21。
利用led对黄瓜幼苗的生理响应。Environ Exp Bot. 2016; 121:66-74。
- 22。
刘红霞,陈燕,胡涛,张树华,张艳,赵涛,余华,康艳。发光二极管对豆芽中酚类化合物及抗氧化活性的影响。J Funct Foods. 2016; 25:59 - 65。
- 23.
酚酸和类黄酮的合成对蓝色和蓝紫色光的响应取决于植物种类。Environ Exp Bot. 2018; 150:183-7。
- 24.
刘y,方氏,杨开,尚x,富x。光质影响黄酮类化生产及相关基因表达Cyclocarya成果.J Photoch Photobio B. 2018; 179:66-73。
- 25.
关键词:愈伤组织,光质量,生长,次生代谢产物,抗氧化活性红景天imbricataEdgew。J Photoch Photobio B. 2018; 183:258-65。
- 26.
Ni J,Dong L,Jiang Z,Yang X,Sun Z,Li J,Wu Y,徐M.水杨酸诱导的类黄酮堆积银杏叶叶子依赖于红色和远红光。ind crop prod。2018; 118:102-10。
- 27.
杨强,潘军,沈刚,郭斌。黄光对黄酮类化合物生长和积累的促进作用淫羊藿pseudowushanense.J PhotoCh Photobio B. 2019; 197:111550。
- 28.
Fraser cm,Chapple C.苯丙烷途径拟南芥.拟南芥书。2011; 9:E0152。
- 29.
Vogt T.苯基丙醇生物合成。莫尔植物。2010; 3(1):2-20。
- 30。
Xu W, Grain D, Bobet S, Gourrierec J, Thévenin J, Kelemen Z, Lepiniec L, Dubos C. synthesis and characterization of MYB-bHLH-WDR complexes [J]拟南芥种子。新植醇。2014;202(1):132 - 44。
- 31。
杜博斯C, Stracke R, Grotewold E, Weisshaar B, Martin C, Lepiniec L. MYB转录因子拟南芥.植物学报,2010;15(10):573-81。
- 32。
Zimmermann Im,Heim Ma,Weisshaar B,Uhrig JF。全面识别拟南芥蒂利亚纳MYB转录因子与R/ b样BHLH蛋白相互作用。植物j . 2004; 40(1): 22-34。
- 33.
托莱多-奥尔蒂斯,Huq E,鹌鹑博士拟南芥基本/ Helix-Loop-Helix转录因子系列。植物细胞。2003; 15(8):1749-70。
- 34.
Smith TF, Gaitatzes C, Saxena K, Neer EJ。WD重复:用于不同功能的公共架构。生物化学学报。1999;24(5):181-5。
- 35.
R2R3-MYB基因家族拟南芥蒂利亚纳.CurrOp植物BIOL。2001; 4(5):447-56。
- 36.
光敏色素作用于拟南芥发展。J Exp Bot。2010; 61(1):11-24。
- 37.
Samuolienėg,斯蒂瓦斯·r,萨拉斯基塔·萨卡斯基·ėė,Sakalauskienės.duchovs.kisp。红色和蓝色发光二极管照明对萝卜生理指标的影响。分生物的eur J.2011; 6(5):821-8。
- 38.
Huché-Thélier L, Crespel L, Gourrierec JL, Morel P, Sakr S, Leduc N.光信号和植物对蓝色和紫外线辐射的响应——在园艺中的应用前景。Environ Exp Bot. 2016; 121:22-38。
- 39.
利用led对黄瓜幼苗的生理响应。环境实验机器人。2015;29(1):66-74。
- 40.
李,李G,王H,王DX。光敏色素信号机制。《拟南芥丛书》2011;9:e148。
- 41.
于晓霞,刘洪涛,林春华。隐花色素蓝光受体的研究进展。《拟南芥丛书》2010;8:e135。
- 42。
Christie JM。光调素蓝光受体。Annu Rev植物Biol。2007; 58(1):21-45。
- 43。
Demotes-Mainard S, Péron T, Corot A, Bertheloot J, Le Gourrierec J, Pelleschi-Travier S, Crespel L, Morel P, Huché-Thélier L, Boumaza R, et al.;植物对红光和远红光的反应,在园艺上的应用。Environ Exp Bot. 2016; 121:4-21。
- 44。
Sellaro R, Hoecker U, Yanovsky M, Chory J, Casal JJ。红蓝光协同调控拟南芥基因表达与发育咕咕叫医学杂志。2009;19(14):1216 - 20。
- 45。
公园Bm,Folta Km,斯宾布丁EP。茎生长的光电机。CurrOp植物BIOL。2001; 4(5):436-40。
- 46。
Koes R,Quattrocchio F,Mol J.植物中的类黄酮生物合成途径:功能和进化。生物。1994年; 16:123-32。
- 47.
黄酮类化合物:生物合成、生物功能和生物技术应用。植物科学学报2012;3:222。
- 48.
徐W,Dubos C,Lepiniec L. myB-BHLH-WDR复合物对类黄酮生物合成的转录控制。趋势植物SCI。2015; 20(3):176-85。
- 49.
植物代谢多样性:一个调节的视角。植物科学进展,2005;10(2):57-62。
- 50.
王Z,王某,小y,李z,吴m,谢x,李h,mu w,li f,liu p等。HD-ZIP IV转录因子NTHDG2在调节黄酮类生物合成中的功能表征烟草.植物理性生物生物。2020; 146:259-68。
- 51.
欧文生,黄志强,王志强,等。黄酮醇合成酶基因家族的克隆及功能分析拟南芥.植物杂志。2008;147(3):1046 - 61。
- 52。
Lukacin R, Wellmann F, Britsch L, Martens S, Matern u柑橘unshiu是一种双功能双加氧酶。植物化学,2003;62:287 - 92。
- 53。
黄俊,顾敏,赖志,范博,石凯,周勇,于军,陈志明拟南芥PAL基因家族在植物生长发育和对环境胁迫的响应中的作用。植物杂志。2010;153(4):1526 - 38。
- 54。
王强,王志强,王志强。4-香豆酸:辅酶a连接酶拟南芥蒂利亚纳代表一个在Angiospers中的两个进化的不同课程。工厂J. 1999; 19(1):9-20。
- 55。
Siwinska j,Siatkowska k,olry a,grosjean j,Ihnatowicz A. stopoletin 8-羟化酶:一种涉及香豆素生物合成和铁缺乏症的新酶拟南芥.J Exp Bot。2018; 69(7):1735-48。
- 56。
Carretero-Paulet L,Galstyan A,Roig-Villanova I,Martínez-GarcíaJF,Bilbao-Castro JR,Robertson DL。基因组宽分类和植物族转录因子系列的进化分析拟南芥,杨树,水稻,苔藓和藻类。植物杂志。2010;153(3):1398 - 412。
- 57.
Ambawat S,Sharma P,Yadav NR,Yadav RC。MYB转录因子基因作为植物响应的调节因子:概述。physiol mol biol pla。2013; 19(3):307-21。
- 58.
刘家,奥巴顿A,MA P. MYB转录因子作为植物苯丙醇代谢调节因子。莫尔植物。2015; 8(5):689-708。
- 59.
BIPEI Z,MARTIN H.通过表型救援的MBW功能进化分析拟南芥蒂利亚纳.植物学报。2019;10:375。
- 60.
Feller A, Machemer K, Braun EL, Grotewold E. MYB和bHLH植物转录因子的进化和比较分析。植物j . 2011; 66(1): 94 - 116。
- 61.
MYB-bHLH-WD40蛋白复合物与细胞多样性的进化。植物科学进展。2005;10(2):63-70。
- 62.
黄酮醇苷依赖于黄酮醇苷的积累拟南芥蒂利亚纳植物中显示MYB11-、MYB12-和myb111不依赖的黄酮醇苷积累。新植醇。2010;188(4):985 - 1000。
- 63.
Gonzalez A, Zhao M, Leavitt JM, Lloyd AM。TTG1/bHLH/Myb转录复合物对花青素生物合成途径的调控拟南芥幼苗。植物j . 2008; 53(5): 814 - 27所示。
- 64.
Grabherr M, Haas B, Yassour M, Levin J, Thompson D, Amit I, Adiconis X, Fan L, Raychowdhury R, Zeng Q, et al. .没有参考基因组的RNA-Seq数据的全长度转录组组装。生物科技Nat》。2011;29:644-52。
- 65.
利用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。基因组医学杂志。2014;15(12):550。
- 66。
年轻MD,Wakefield MJ,Smyth GK,Oshlack A. RNA-SEQ的基因本体分析:选择偏差。基因组Biol。2010; 11(2):R14。
- 67。
TBtools:一种用于生物大数据交互分析的集成工具。摩尔。2020;13(8):1194 - 202。
- 68。
Pérez-Rodríguez P, Riaño-Pachón DM, Corrêa LGG, Rensing SA, Kersten B, Mueller-Roeber B. PlnTFDB:植物转录因子数据库的更新内容和新特征。核酸Res. 2010;38: D822-7。
- 69。
bHLH蛋白结构域的位置依赖、小团体和预测基序。中国科学(d辑:地球科学)1999;48(5):501-16。
- 70.
suhir K, Glen S, Li M, Christina K, Koichiro T. MEGA X:基于计算平台的分子进化遗传学分析。生物医学进展。2018;35(6):1547-9。
确认
非常感谢顾连峰教授、沈少言博士和郑俊明博士对该手稿的改进提出的有益建议。我们也感谢编辑和审稿人提供的有用和翔实的建议,这些建议导致了本手稿的可能改进。
资金
福建省科技创新平台项目(no . 2008Y2001)。福建省GAP工程技术研究中心。
作者信息
隶属关系
贡献
YZ制定了研究计划。TH收集材料。DX、CZ、M.W.K、DY和KR进行了实验。DX, LC, CZ, M.W.K分析数据并撰写手稿。所有作者都讨论了结果并对手稿进行了评论。所有作者最后都同意出版。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明没有利益冲突。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
统计不同LED灯下的叶面积、株高、茎粗。
附加文件2:表S2。
基于RNA-seq数据的从头组装的统计。
附加文件3:表S3。
7个数据库中注释的unigenes的统计。
附加文件4:图S1。
所有unigenes的Go注释的直方图。
附加文件5:图S2。
BY与RY (Fig.S2a)、BY与WY (Fig.S2b)、WG与WY (Fig.S2c)、WJ与WG (Fig.S2d)、WJ与WY的GO项显著增加。(图S2e)组。
附加文件6:图S3。
BY之间KEGG富集与RY(Fig.S3a),由相对于WY(Fig.S3b),RY与WY(Fig.S3c),WG与WY(Fig.S3d),WJ与WG(图S3E)和WJ与WY(图3F)组。
附加文件7:表S4。
检测到的代谢物的统计美国glabra。
附加文件8:表S5。
已鉴定基因及其FPKM值综述。
附加文件9:表S6。
所选基因的转录序列。
附加文件10:图S4。
19基础上构建氨基属于2-氧化戊二酸(20克)和Fe(II) - 依赖性加氧超家族蛋白的氨基酸序列的系统发生树。
附加文件11:图S5。
在属于羟基氨基酰基苯甲酰酯酶的24个氨基酸序列的基础上构建的系统发育树。
附加文件12:图S6。
其中53个R2R3-MYB结构域的初步结构美国glabra.
附加文件13:图S7。
SgbHLH蛋白家族53个成员bHLH结构域的多序列比对。
附加文件14:表S7。
一百二十五个全长R2R3-MYB氨基酸序列来自拟南芥,53个R2R3-MYB氨基酸序列美国glabra;182全长AtbHLH氨基酸序列拟南芥和53 sgbhlh蛋白序列来自美国glabra。
附加文件15:图S8。
在属于加密色谱(Cry)家族蛋白的11个氨基酸序列的基础上构建的系统发育树(图3A);在属于光醇(Phot)家族蛋白的6个氨基酸序列的基础上构建的系统发育树(图S8B)。
附加文件16:图S9。
在属于苯丙氨酸氨酶(PAL)家族蛋白的8个氨基酸序列的基础上构建的系统发育树(图S9A);在属于p-coumaroyl辅酶的8个氨基酸序列的基础上构建的系统发育树是一种连接酶(4-香豆酰COA连接酶,4cl)家族蛋白(图S9B)。
附加文件17:表S8。
基因特异性qRT-PCR引物。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
谢东,陈磊,周超。et al。转录组学和代谢组学分析揭示了LED光质量对形态性状的影响,以及苯丙类衍生化合物的积累Sarcandra glabra幼苗。BMC植物杂志20,476(2020)。https://doi.org/10.1186/s12870-020-02685-w
收到:
接受:
发表:
关键字
- Sarcandra glabra
- LED灯
- 转录组分析
- 代谢组学分析
- Phenylpropanoid生物合成