- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
硫化氢对黄瓜中的CD诱导的细胞死亡产生负面调节(gydF4y2BaCucumis巨大成功gydF4y2BaL)根尖细胞gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba文章编号:gydF4y2Ba480gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
硫化氢(HgydF4y2Ba2gydF4y2Bas)是涉及调节对重金属应激的耐受性的气体信号分子。在这项研究中,我们调查了H的作用gydF4y2Ba2gydF4y2BaS中的镉(CD-)诱导黄瓜幼苗根尖的细胞死亡。gydF4y2Ba
结果gydF4y2Ba
结果表明,200μMCD引起的细胞死亡,增加了活性氧物质(ROS),染色质缩合的含量,从线粒体和活化的Caspase-3样蛋白酶释放细胞色素C(Cyt C)。用100μM硫化钠(NaHS,H)进行幼苗的预处理gydF4y2Ba2gydF4y2Ba小号供体)有效地缓和生长抑制和降低由镉胁迫根尖的细胞死亡。此外,硫氢化钠+ Cd处理能降低ROS水平和增强的抗氧化酶活性。预处理硫氢化钠也抑制细胞色素c从线粒体的释放,线粒体通透性转换孔(MPTP)的开口部,和caspase-3样在黄瓜的镉胁迫下幼苗的根尖蛋白酶的活性。gydF4y2Ba
结论gydF4y2Ba
HgydF4y2Ba2gydF4y2BaS通过减少ROS的积累、激活抗氧化系统、抑制线粒体Cyt c的释放和减少MPTP的开放来抑制cd诱导的黄瓜根尖细胞死亡。结果表明,HgydF4y2Ba2gydF4y2BaS是cd诱导黄瓜幼苗根尖细胞死亡的负调控因子。gydF4y2Ba
背景gydF4y2Ba
环境作为人类活动的结果,镉(Cd)的污染已经引起了全世界的关注[gydF4y2Ba1gydF4y2Ba].Cd毒性可引起植物ROS升高、氧化损伤、脂质过氧化、细胞死亡和生长抑制[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].在Cd胁迫下,植物表现出叶片卷曲和褪绿等症状[gydF4y2Ba5gydF4y2Ba].根和小麦光合色素合成的伸长率镉胁迫下抑制作用[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].此外,Cd胁迫下菠菜植株的光合作用、氨基酸和蛋白质合成以及植株生长均降低[gydF4y2Ba8gydF4y2Ba].植物已经形成了应对复杂和恶劣环境的生理生化机制,其中一种自卫机制就是硫化氢(HgydF4y2Ba2gydF4y2Bas)。gydF4y2Ba
硫化氢(HgydF4y2Ba2gydF4y2Bas),这是反应性硫种类的重要组成部分[gydF4y2Ba9gydF4y2Ba],最近被列为第三种气体传送器,仅次于一氧化氮(NO)和一氧化碳(CO) [gydF4y2Ba10gydF4y2Ba].在人类中,HgydF4y2Ba2gydF4y2BaS参与血液流动、神经传递、免疫反应、激素分泌和肌肉收缩系统[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].在植物中,低浓度的HgydF4y2Ba2gydF4y2BaS导致了一个气体信号分子的特性,植物可以合成内源性的HgydF4y2Ba2gydF4y2BaS在生物和非生物胁迫条件下[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].HgydF4y2Ba2gydF4y2BaS可通过d-半胱氨酸脱巯基和β-氰基丙氨酸合酶来制造gydF4y2Ba17gydF4y2Ba].HgydF4y2Ba2gydF4y2BaS参与调节植物生长发育,如诱导不定根形成和调节气孔关闭[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].它还与植物对环境刺激的反应有关,如盐、重金属(HMs)、干旱、热和冷胁迫以及病原体感染,这可能会提高植物的耐受性[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].gydF4y2Ba
编程的细胞死亡(PCD)是由细胞本身激活和驱动的过程,并且在遗传和生化水平下是一个有组织的现象。PCD是植物对环境变化的重要过程。PCD涉及几个过程,包括生长和发展,以及对各种不利环境条件的植物适应[gydF4y2Ba24gydF4y2Ba].许多研究表明,PCD可以限制发育和生殖,也与衰老有关[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba[其他过程,如生长[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba“非生物胁迫[gydF4y2Ba29gydF4y2Ba].高浓度的镉可诱导番茄、烟草和烟草的PCD或坏死gydF4y2Ba拟南芥gydF4y2Ba细胞(gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].线粒体在细胞代谢中起着关键作用,在PCD的调控中起着关键作用。线粒体是ros介导的PCD事件的参与者,而线粒体跨膜电位(MTP)也被报道在PCD中必不可少[gydF4y2Ba32gydF4y2Ba].线粒体在ROS介导的PCD过程中发挥着重要作用[gydF4y2Ba33gydF4y2Ba].动物细胞中线粒体介导的PCD通过释放凋亡蛋白酶激活因子(Apaf-1)和Cyt c激活caspase蛋白酶,因为MPTP的开放[gydF4y2Ba34gydF4y2Ba].在许多植物PCD体外应激模型中,线粒体释放Cyt c已被报道[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].许多研究表明,在植物中也有类似的现象[gydF4y2Ba37gydF4y2Ba].此外,细胞色素c和caspase-3样蛋白酶的激活的释放在热应激诱导PCD的烟草细胞中的过程[中也观察到gydF4y2Ba38gydF4y2Ba]但没有研究表明,任何植物中单个蛋白质的水解级联与PCD相关过程有关[gydF4y2Ba39gydF4y2Ba].这些研究表明,植物中可能存在类似于动物细胞凋亡的细胞死亡机制。gydF4y2Ba
目前,关于H的应力缓解作用已有多篇研究gydF4y2Ba2gydF4y2Ba但对H的作用的研究很少gydF4y2Ba2gydF4y2Ba在植物细胞死亡的过程中。此外,HgydF4y2Ba2gydF4y2Ba在植物细胞死亡S分别还不清楚。这项研究的目的是探索H的作用gydF4y2Ba2gydF4y2BaS参与Cd胁迫下黄瓜幼苗细胞死亡的信号事件。gydF4y2Ba
结果gydF4y2Ba
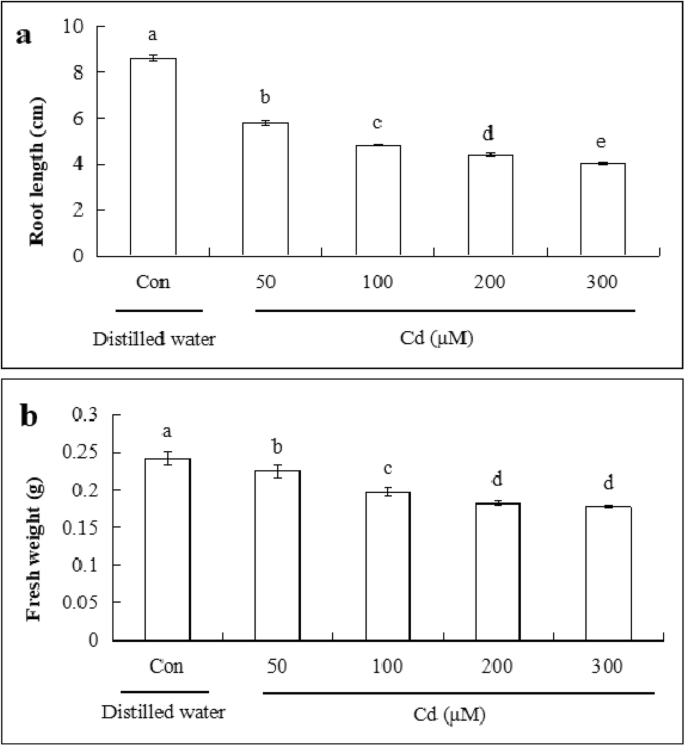
cd胁迫下黄瓜幼苗根长和鲜重的变化gydF4y2Ba
为了研究CD对根长和新鲜重量的黄瓜幼苗的影响,将不同浓度的CD施加48小时。如图所示。gydF4y2Ba1gydF4y2Ba随着Cd浓度的增加,根长和鲜重量显着下降。与对照的控制相比,50μmCD引起的33.0和根长减少了7.6%和鲜重。100μMCD剂量导致根部长度的降低44.0%,鲜重的20.5%。200μm剂量减少了根长度49.2%,重量半重量为27.1%。300μm的Cd引起53.1和根长度和鲜重的28.9%。当浓度为200μm时,根长度约为对照的一半。因此,200μmcdclgydF4y2Ba2gydF4y2Ba被选作进一步实验之用。gydF4y2Ba
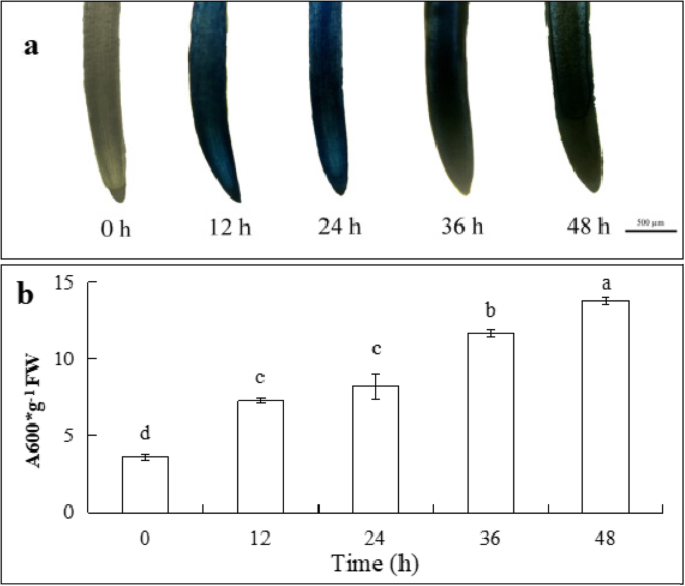
cd胁迫下根尖细胞死亡gydF4y2Ba
因为伊文思蓝可以染色死亡细胞,所以它可以指示死亡细胞的水平。如图所示。gydF4y2Ba2gydF4y2Ba与增加,治疗持续时间(0,12、24、36和48 h),根尖染色逐渐加深,表明死亡的根尖细胞的数量逐渐增加的影响下Cd。伊文思蓝的含量在根提示治疗12 h显著高于控制(图。gydF4y2Ba2gydF4y2Bab), Cd处理48 h后,其含量是对照的2.8倍。这些结果表明,镉通过引起根细胞的死亡来抑制根的伸长。gydF4y2Ba
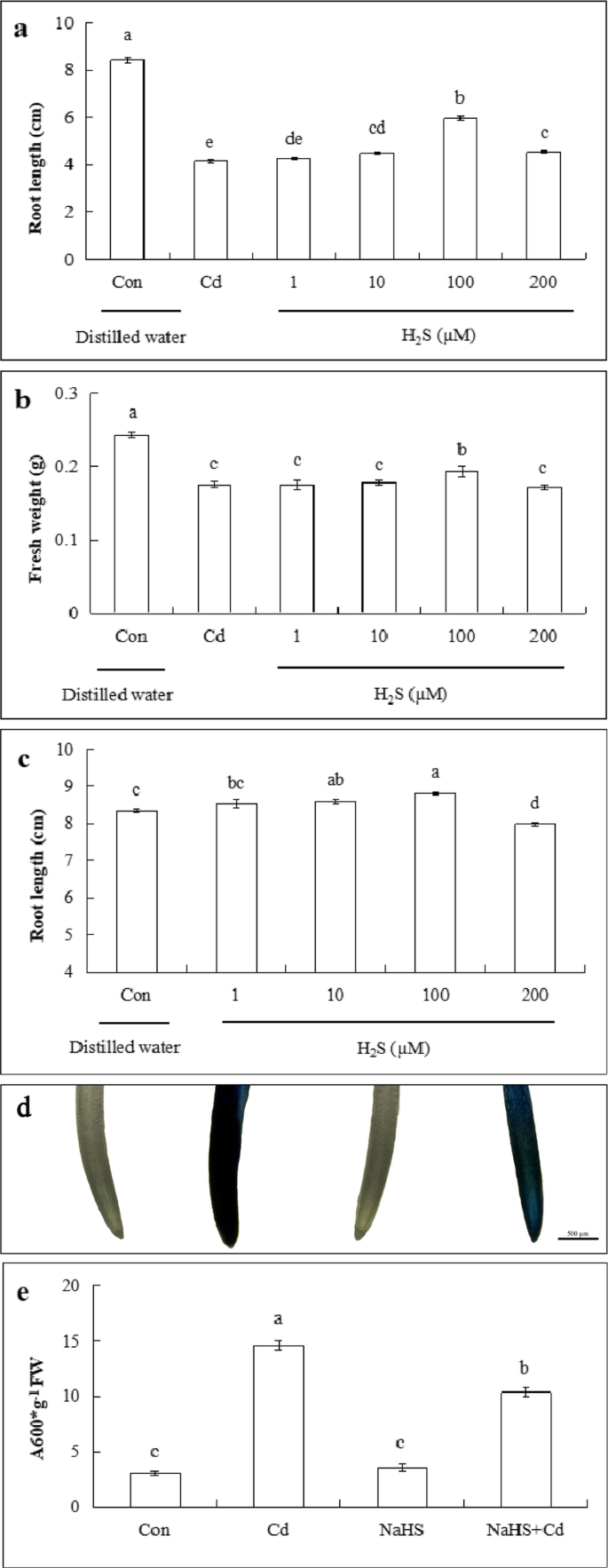
H的影响gydF4y2Ba2gydF4y2BaS对根生长和根尖细胞死亡的影响gydF4y2Ba
为了选择适当的NaH浓度以缓解Cd应激,观察到NaHs预处理在CD胁迫下对不同浓度(1,10,100或200μm)的根长和新鲜重量的黄瓜幼苗的影响。如图所示。gydF4y2Ba3.gydF4y2Baa和b,作为硫氢化钠浓度的增加,黄瓜根长和鲜重增加在第一和然后下降。Compared with the 200 μM Cd treatment, the 1 μM NaHS caused a 2.7 and 0.1% increase in root length and fresh weight of seedlings, respectively. The 10 μM NaHS treatment increased root length and fresh weight by 8.1, and 1.5% compared with that of Cd alone respectively. Both indices reached the highest values when pretreated with 100 μM NaHS under Cd stress, which resulted in 42.9 and 10.3% greater root length and fresh weight, respectively, than that of Cd treatment. However, seedlings treated with the highest concentration of NaHS (200 μM) exhibited a decrease in effects compared with that of 100 μM NaHS treatment. Figure3.gydF4y2Bac表明,在无Cd胁迫条件下,1 ~ 100 μM NaHS浓度对根长有促进作用,而200 μM NaHS处理的根长显著低于其他浓度(1、10和100 μM)。上述结果表明,适宜浓度的NaHS (100 μM)可促进Cd胁迫下黄瓜幼苗的根系伸长。因此,在接下来的实验中使用了100 μM的NaHS。gydF4y2Ba
NaHS对Cd胁迫下黄瓜幼苗根长、鲜重和细胞死亡的影响gydF4y2Ba一个gydF4y2Ba不同浓度(1,10,100和200μm)的NaHs(a hgydF4y2Ba2gydF4y2BaS供体)对根长(gydF4y2BabgydF4y2Ba)和鲜重镉胁迫下黄瓜幼苗。gydF4y2BacgydF4y2BaNAHS在轧制槽中黄瓜幼苗根长的不同浓度(1,10,100和200μm)的影响。gydF4y2BadgydF4y2Ba根呈伊文思蓝染色。gydF4y2BaegydF4y2Ba黄瓜幼苗根尖细胞死亡的定量分析。比例尺为500 μm。结果为三个独立实验平均值±SE (gydF4y2BangydF4y2Ba= 10)。不同的字母表示显著差异(gydF4y2BaPgydF4y2Ba< 0.05;邓肯的多量程测试)。弗兰克-威廉姆斯,鲜重gydF4y2Ba
如图所示。gydF4y2Ba3.gydF4y2Bad,观察不同处理下Evans蓝染色情况。Cd胁迫表现出更深的染色,而对照组、单独的NaHS和NaHS + Cd处理表现出更淡的染色。数字gydF4y2Ba3.gydF4y2Bae表明,Cd胁迫引起的细胞死亡是对照的3.77倍,而NaHS预处理比Cd单独处理减少了29.2%的细胞死亡。对照组和单独NaHS处理的值之间没有差异。gydF4y2Ba
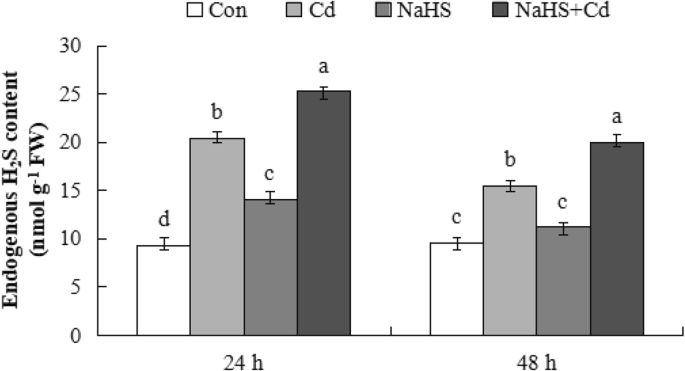
内源性HgydF4y2Ba2gydF4y2Ba■在黄瓜幼苗根系gydF4y2Ba
探讨内生HgydF4y2Ba2gydF4y2BaS含量(内生HgydF4y2Ba2gydF4y2BaS加上根吸收外源HgydF4y2Ba2gydF4y2Ba以黄瓜幼苗根系为材料,测定了根系内源HgydF4y2Ba2gydF4y2Ba在不同的治疗后24和48小时的S含量。如图所示。gydF4y2Ba4gydF4y2Ba在处理24 h后,Cd胁迫、NaHS和NaHS + Cd处理均可引起内源hgydF4y2Ba2gydF4y2BaS含量显著高于对照(分别为119.1、50.7和170.6%)和内生HgydF4y2Ba2gydF4y2BaNaHS + Cd处理S含量显著高于Cd处理(24.2%)。内源HgydF4y2Ba2gydF4y2Ba黄瓜幼苗根系中S含量在48 h后较24 h下降,而内源hgydF4y2Ba2gydF4y2BaNaHS + Cd处理的S含量仍比Con、Cd和NaHS处理分别高107.9、28.8和78.5%。这些结果表明,黄瓜幼苗根系吸收外源HgydF4y2Ba2gydF4y2Ba内源性HgydF4y2Ba2gydF4y2Ba并有助于缓解Cd压力。gydF4y2Ba
HgydF4y2Ba2gydF4y2BaS降低了cd诱导的ROS积累、丙二醛(MDA)和电解质渗漏率(ELP)gydF4y2Ba
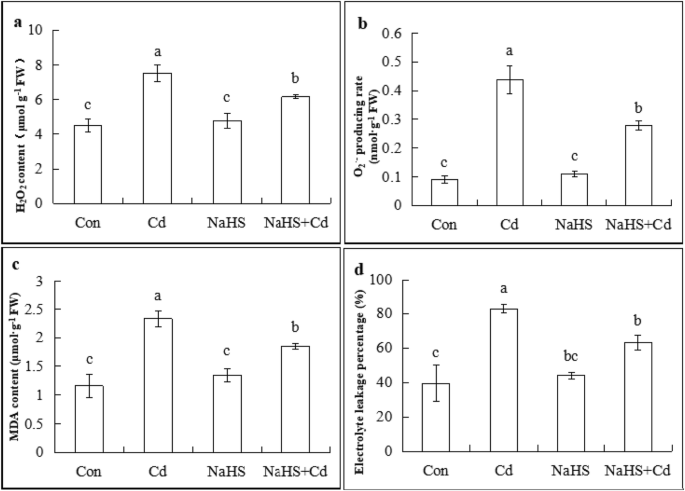
确定h是否gydF4y2Ba2gydF4y2BaS可以调节ROS水平,降低cd诱导的细胞死亡gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和OgydF4y2Ba2gydF4y2Ba·−gydF4y2BaCd胁迫48 h后,黄瓜幼苗根尖含量的变化(图2)。gydF4y2Ba5gydF4y2Baa, b).暴露在200 μM CdCl中gydF4y2Ba2gydF4y2Ba提高了HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba这是比对照的高66.7%,而硫氢化钠+镉显著降低ħgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba内容(17.8%)。在Cd处理下,OgydF4y2Ba2gydF4y2Ba·−gydF4y2Ba是对照组的3.89倍。而NaHS预处理降低了O水平gydF4y2Ba2gydF4y2Ba·−gydF4y2Ba了36.4%。因此,NaHS预处理可有效降低Cd胁迫下ROS的积累,从而保护膜的完整性。gydF4y2Ba
H的影响gydF4y2Ba2gydF4y2Ba年代在HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2BaCd胁迫对黄瓜幼苗根系O2·−、MDA和ELP的影响。以100 μM NaHS预处理的黄瓜幼苗为试验材料,在Cd胁迫48 h后,测定其hgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),O.gydF4y2Ba2gydF4y2Ba·−gydF4y2Ba(gydF4y2BabgydF4y2Ba)、MDA (gydF4y2BacgydF4y2Ba)及ELP (gydF4y2BadgydF4y2Ba).数据为三个独立实验的平均值±SE。不同的字母表示在统计学上有显著差异(gydF4y2BaPgydF4y2Ba< 0.05;邓肯的多量程测试)。弗兰克-威廉姆斯,鲜重gydF4y2Ba
如图所示。gydF4y2Ba5gydF4y2BaC,MDA含量的最高值记录在CD应激下,而MDA含量的最低值是用对照和NaHs获得的。此外,与NAH的预处理与CD应激处理相比,NAH的预处理将MDA含量显着降低20.6%。类似地,NaHS + Cd处理将ELP降低23.7%(图。gydF4y2Ba5gydF4y2Bad)。结果表明hgydF4y2Ba2gydF4y2BaS抑制细胞膜脂质过氧化,保证细胞结构的完整性,提高植物对Cd胁迫的耐受性。gydF4y2Ba
HgydF4y2Ba2gydF4y2BaS激活抗氧化酶,减少氧化损伤gydF4y2Ba
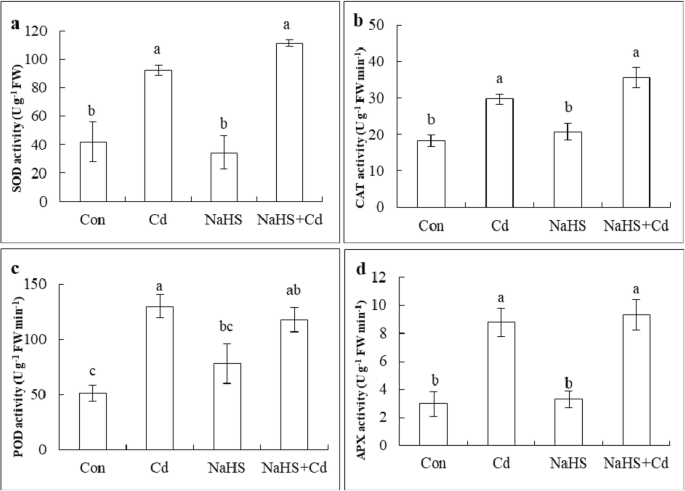
探讨HgydF4y2Ba2gydF4y2BaS, we measured SOD, CAT, POD and APX activity in the root tips of cucumber seedlings after 48 h of Cd treatment. As shown in Fig.6gydF4y2Ba,镉胁迫,SOD,CAT下,POD和APX活性显着增加了119.7%,63.5,分别130.3和194.9%,与对照相比,而对照和硫氢化钠处理单独不表现出显著差异。与CD处理相比,硫氢化钠+镉改善SOD,CAT,POD和APX活性20.5,20.0,10.3和0.6%。这些结果表明,ROS积累的由H减少gydF4y2Ba2gydF4y2BaS依赖于抗氧化酶系统的激活。gydF4y2Ba
NaHS对DAPI染色及荧光定量分析的影响gydF4y2Ba
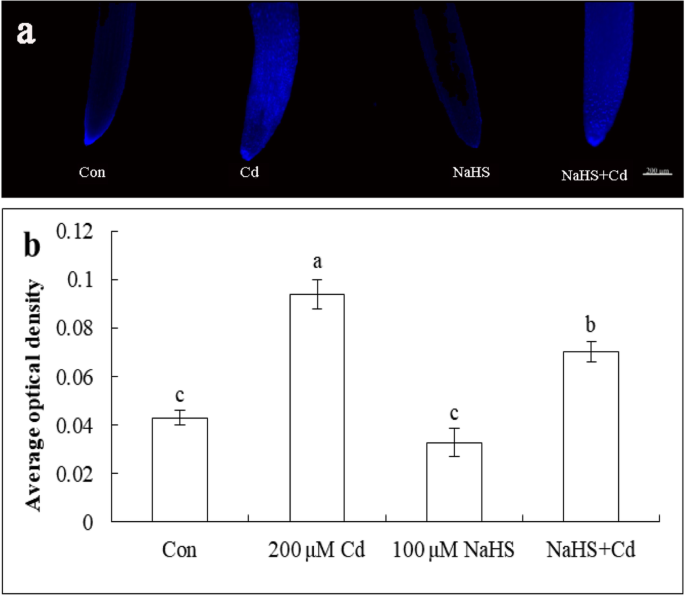
为探讨NaHS对黄瓜幼苗根尖细胞死亡的影响,采用DAPI染色作为细胞死亡的诊断标记。如图所示。gydF4y2Ba7gydF4y2Baa,对照和NaHS预处理均观察到弱荧光。Cd胁迫48 h后,黄瓜幼苗根尖荧光增强;然而,NaHS + Cd处理降低了荧光。荧光定量分析还表明,NaHS + Cd处理较Cd处理显著降低了25.2%的荧光(图2)。gydF4y2Ba7gydF4y2Bab),表明NaHS预处理降低了DAPI染色测定的cd诱导的根尖细胞死亡。gydF4y2Ba
HgydF4y2Ba2gydF4y2BaS在Cd胁迫下抑制来自线粒体和Caspase-3样活性的Cyt C释放gydF4y2Ba
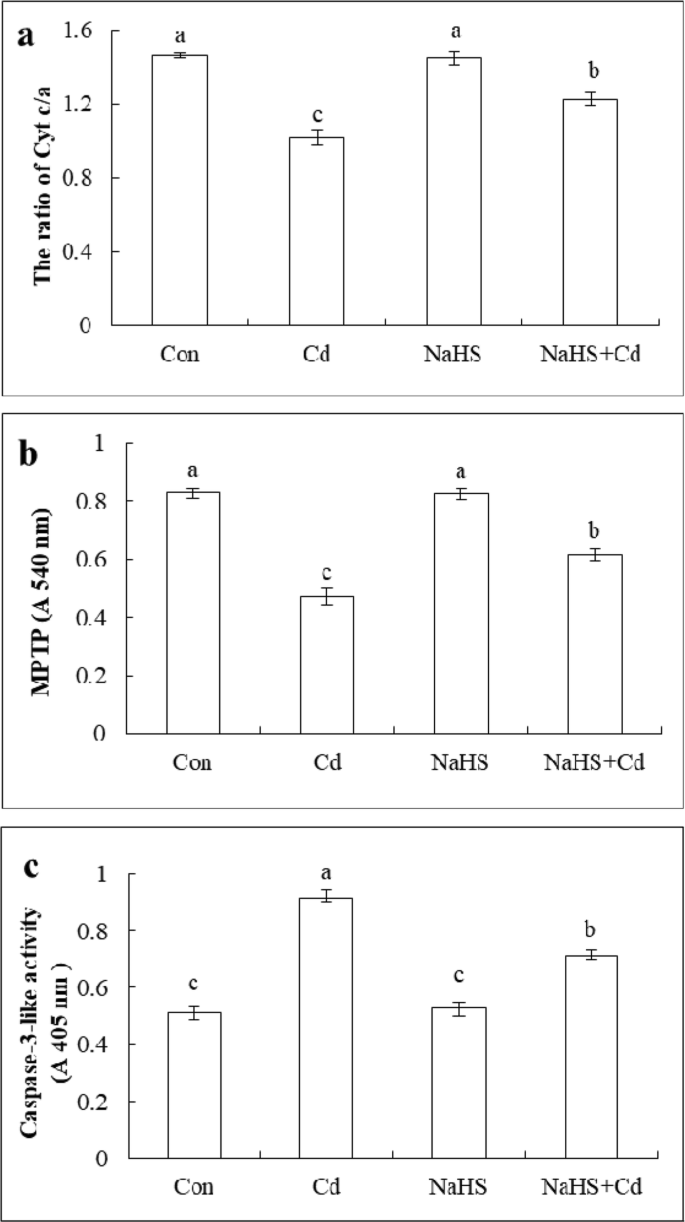
调查H是否gydF4y2Ba2gydF4y2BaS影响Cd胁迫下线粒体Cyt c的释放,测定Cyt c/a和MPTP的含量。Cyt c与线粒体内膜磷脂结合松散,不能自由穿过线粒体外膜,而Cyt a与线粒体内膜结合紧密。因此,Cyt c/a可以反映线粒体内膜中Cyt c的含量。如图所示。gydF4y2Ba8gydF4y2Baa,与对照组相比,Cd处理显著降低了Cyt c/a的43.8%。NaHS + Cd处理的Cyt c/a值较Cd处理显著提高22.6%,但与H处理无显著差异gydF4y2Ba2gydF4y2Ba预处理。如图所示。gydF4y2Ba8gydF4y2BaB,Cd应激显着降低线粒体膜吸收,而对照,并且NaHs和NaHs + Cd处理均分别高于75.3,74.5和30.2%的CD处理。gydF4y2Ba
NaHS对Cd胁迫下黄瓜幼苗根尖线粒体Cyt c/a、MPTP和caspase-3-like活性的影响反对:蒸馏水;Cd: 200 μM Cd应力48 h;NaHS:用100 μM NaHS预处理24 h;硫氢化钠+ Cd;用100 μM NaHS预处理24 h,再用200 μM Cd处理48 h。Cyt c/a (gydF4y2Ba一个gydF4y2Ba)、线粒体膜吸光度(gydF4y2BabgydF4y2Ba)和caspase-3-like (gydF4y2BacgydF4y2Ba)在不同处理48 h后测定。数据为三个独立实验的平均值±SE。不同的字母表示显著差异(gydF4y2BaPgydF4y2Ba< 0.05;邓肯多量程试验)gydF4y2Ba
Caspase-3在动物细胞凋亡中起着重要作用,并且在植物中存在类似的研究。调查H是否gydF4y2Ba2gydF4y2BaS影响caspase-3样活性,在处理48 h后测定酶活性。如图所示。gydF4y2Ba8gydF4y2BaC、caspase-3-like活性明显升高,较对照升高77.8%。NaHS预处理24 h显著降低caspase-3-like活性,较Cd处理降低22.1%。gydF4y2Ba
总的来说,结果表明,Cd的压力可能导致Cyt c释放到细胞质中,增加注射的开放程度MPTP药物,并激活caspase-3-like活动,而硫氢化钠预处理可以抑制这些影响和减少从线粒体释放Cyt c和caspase-3-like活动。gydF4y2Ba
讨论gydF4y2Ba
一些研究表明,镉干扰植物的代谢和生理过程,如缩短根的长度[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba]及叶面积[gydF4y2Ba42gydF4y2Ba]和导致细胞死亡[gydF4y2Ba43gydF4y2Ba].Cd胁迫严重影响大白菜的根系发育和鲜重[gydF4y2Ba44gydF4y2Ba].在大麦植株中,高浓度Cd处理9 h后,与低浓度Cd处理相比,细胞死亡和生长迟缓[gydF4y2Ba45gydF4y2Ba].在该实验中,Cd抑制了根伸长率和降低了黄瓜幼苗的新鲜重量。随着CD浓度的增加,抑制效果显着增强(图。gydF4y2Ba1gydF4y2Ba).一些研究表明CD胁迫会导致植物细胞死亡。淹没的血管植物的叶细胞死亡gydF4y2BaRuppia maritimagydF4y2Ba3或5 d曝光后观察到镉[gydF4y2Ba46gydF4y2Ba].10 μM和100 μM Cd处理分别导致玉米细胞在24 ~ 48 h和12 ~ 24 h出现死亡[gydF4y2Ba47gydF4y2Ba].我们的研究结果表明,暴露于200μMCD的持续时间越长,死的细胞数量越大(图。gydF4y2Ba2gydF4y2Ba).类似地,Zhang等人[gydF4y2Ba48gydF4y2Ba],found that 5 mM Cd treatment led to cell death in Chinese cabbage roots.
HgydF4y2Ba2gydF4y2BaS是动植物中第三个具有多种功能的生理气体信号分子,在缓解重金属胁迫中发挥着重要作用。在铝(Al)胁迫下,大麦幼苗根系伸长受到抑制,而NaHS预处理可有效缓解Al对幼苗根系伸长的抑制[gydF4y2Ba49gydF4y2Ba].在gydF4y2Ba龙葵gydF4y2Bal .幼苗HgydF4y2Ba2gydF4y2BaS调节锌(Zn)在根中的分布和吸收,从而减轻Zn引起的根部发育引起的应力[gydF4y2Ba50gydF4y2Ba].HgydF4y2Ba2gydF4y2BaS是应对重金属胁迫时产生的一种常见气体分子,Cd是重金属胁迫中毒性很强的气体分子之一,对植物造成严重的胁迫[gydF4y2Ba51gydF4y2Ba].在无花果。gydF4y2Ba3.gydF4y2Baa, b, 100 μM NaHS预处理显著降低了Cd胁迫对黄瓜幼苗根长和鲜重的抑制作用。这与其他报告显示HgydF4y2Ba2gydF4y2BaS提高植物对Cd胁迫的耐受性,如谷子[gydF4y2Ba52gydF4y2Ba],gydF4y2Ba芸苔属植物显著gydF4y2Ba[gydF4y2Ba53gydF4y2Ba),而gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba54gydF4y2Ba].同时,在Cd胁迫下,用100 μM NaHS预处理黄瓜,细胞死亡明显减少(图2)。gydF4y2Ba3.gydF4y2BaC,D)。同样,郑艾特。据报道,与外源NaH的预处理显着缓解了豌豆幼苗的缺氧诱导的根尖死亡,并增强了对缺氧应激的耐受性[gydF4y2Ba55gydF4y2Ba].此外,Zhang等也报道NaHS预处理可降低Cd胁迫下小白菜根细胞死亡,促进根伸长[gydF4y2Ba48gydF4y2Ba].我们的结果表明HgydF4y2Ba2gydF4y2Ba小号保护黄瓜根系从镉诱导根系细胞死亡。gydF4y2Ba
ROS是植物有氧呼吸的副产物,其稳定水平取决于ROS产生机制和ROS清除机制之间的相互作用。过量的ROS会对植物造成损害,包括膜过氧化、蛋白质变性、酶失活和DNA损伤,这些都会导致细胞死亡[gydF4y2Ba56gydF4y2Ba].在gydF4y2Ba拟南芥gydF4y2Ba镉可活性在ROS的MPK3 / MPK6信号通路剂量依赖性方式[gydF4y2Ba57gydF4y2Ba].高浓度的Cd使H增加gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba和OgydF4y2Ba2gydF4y2Ba·−gydF4y2Ba氧化损伤,根生长抑制,细胞死亡。此外内生HgydF4y2Ba2gydF4y2BaS通过上调的表达参与了ROS水平的降低gydF4y2BaBr_UPB1sgydF4y2Ba在…的根尖gydF4y2Ba芸苔属植物拉伯gydF4y2Ba[gydF4y2Ba58gydF4y2Ba].在本研究中,我们还发现HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba阿,gydF4y2Ba2gydF4y2Ba·−gydF4y2Ba,黄瓜幼苗根系MDA和ELP显著增加gydF4y2Ba2gydF4y2BaCd处理48 h后,S通过激活抗氧化酶系统抑制氧化损伤和膜过氧化作用(fig .;gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba).Kaya等人也报道HgydF4y2Ba2gydF4y2BaS能提高小麦和草莓抗氧化酶活性,降低氧化应激,减轻Cd的毒性[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba59gydF4y2Ba].金属盐如Al,Iron(Fe)和Cd可以在植物中诱导细胞死亡。当水稻的两种基因型(耐铅)和IR64(铁敏感)暴露于Fe时gydF4y2Ba2+gydF4y2Ba(400 mM)胁迫,诱导IR64品种根尖细胞死亡[gydF4y2Ba60gydF4y2Ba].89毫米以下CdClgydF4y2Ba2gydF4y2Ba3-d黄羽扇豆根(gydF4y2Ba卢比斯花丁gydF4y2BaL.)幼苗在24 h后遭受PCD, tunel阳性反应观察到[gydF4y2Ba61gydF4y2Ba].同样,我们也通过DAPI染色和荧光定量分析观察了细胞死亡的发生(图)。gydF4y2Ba7gydF4y2Ba).活性氧,如OgydF4y2Ba2gydF4y2Ba·−gydF4y2Ba和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba,诱导植物和动物细胞死亡[gydF4y2Ba62gydF4y2Ba].ROS平爆是植物[参与了镉诱导的细胞死亡的最重要的信号gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba].有报道称cd诱导的悬浮细胞死亡gydF4y2Ba拟南芥gydF4y2Ba伴随着h增加gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba内容(gydF4y2Ba65gydF4y2Ba].我们发现,硫氢化钠预处理减少ROS(图积聚。gydF4y2Ba5gydF4y2Ba)和抑制细胞死亡的发生(图。gydF4y2Ba7gydF4y2Ba)gydF4y2Ba通过增加抗氧化酶活性(图。gydF4y2Ba6gydF4y2Ba).我们的结果与Zhang等人的研究结果一致,他们报道NaHS处理延迟了赤霉酸- (GA-)处理糊粉层的细胞死亡过程,降低了ROS水平,增加了抗氧化酶活性[gydF4y2Ba66gydF4y2Ba].HgydF4y2Ba2gydF4y2BaS降低了H的积累gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba,从而抑制cd诱导的DNA片段和染色质凝聚[gydF4y2Ba67gydF4y2Ba].gydF4y2Ba
Cyt c位于线粒体内膜,参与正常细胞呼吸链的电子传递,但不能穿透线粒体外膜。不同凋亡诱导因子可诱导Cyt c的释放并激活细胞死亡,如热休克[gydF4y2Ba37gydF4y2Ba),HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba[gydF4y2Ba68gydF4y2Ba]和铝应力[gydF4y2Ba69gydF4y2Ba].我们的实验也证实了Cd导致Cyt c从线粒体脱离进入细胞质和MPTP开口(图。gydF4y2Ba8gydF4y2Baa,b)。此外,用100μmnah的预处理削弱了促进Cyt C和MPTP的开口的Cd应激的负效应。这与前面的报告一致,表明HgydF4y2Ba2gydF4y2BaS通过抑制Cyt c的释放来抑制细胞凋亡,如SH-SY5Y细胞[gydF4y2Ba70gydF4y2Ba]、RGC-5细胞[gydF4y2Ba71gydF4y2Ba]和老鼠细胞[gydF4y2Ba72gydF4y2Ba].半胱氨酸蛋白酶是一种生物和细胞因子成熟和凋亡的蛋白酶,是半胱氨酸蛋白酶家族的一类。半胱氨酸蛋白酶家族是细胞死亡机制的主要调控因子。当caspase蛋白酶体被刺激和激活时,细胞死亡过程开始,导致细胞死亡调控的执行[gydF4y2Ba73gydF4y2Ba].植物半胱氨酸蛋白酶是在动物细胞中的细胞凋亡过程类似于半胱天冬蛋白酶。它还参与了细胞死亡的植物细胞中调节。聚(ADP核糖)聚合酶(PARP)参加了由H诱导植物细胞死亡gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba,而植物PARP的降解依赖于Cyt c释放到细胞质中,而Cyt c可被特定的caspase-3抑制剂抑制[gydF4y2Ba74gydF4y2Ba].Ye等报道100 μM Cd导致caspase-3-like活性增加gydF4y2Ba拟南芥gydF4y2Ba悬浮细胞(gydF4y2Ba75gydF4y2Ba].我们的结果还表明,在黄瓜幼苗根尖的胱天蛋白酶-3样活性(在CD-诱导增加图。gydF4y2Ba8gydF4y2Bac)。此外,外源NaHS预处理降低了CD胁迫诱导的Caspase-3样活性的增加。同样,H.gydF4y2Ba2gydF4y2BaS改善皮质神经元线粒体功能障碍,抑制ros介导的caspase-3通路[gydF4y2Ba76gydF4y2Ba].HgydF4y2Ba2gydF4y2Ba通过降低Caspase-3活性,S可以抑制大鼠腹膜间皮细胞中高葡萄糖毒性诱导的凋亡[gydF4y2Ba77gydF4y2Ba].gydF4y2Ba
综上所述,我们的数据显示HgydF4y2Ba2gydF4y2BaS抑制黄瓜幼苗根尖中的CD诱导的细胞死亡。CD的应用抑制了根伸长率生长,引起了细胞死亡,并伴随着线粒体Cyt C的释放,MPTP的开口和钙酶-3样活性增加。用外源h预处理gydF4y2Ba2gydF4y2BaS供体NaHS通过减少ROS积累、Cyt c释放和caspase-3样活性来抑制cd诱导的细胞死亡的发生。本研究提示了HgydF4y2Ba2gydF4y2Ba镉胁迫对黄瓜幼苗根系细胞死亡的保护作用,虽然还需要进一步的实验来确定这种保护作用如何在黄瓜生产中应用。gydF4y2Ba
方法gydF4y2Ba
植物材料及处理gydF4y2Ba
黄瓜(gydF4y2BaCucumis巨大成功gydF4y2Ba‘新春4号’种子来源于甘肃省农业科学院,中国兰州。实验1将种子置于铺有滤纸的培养皿中,在28°C黑暗条件下发芽48 h。然后,用不同浓度的氯化镉(50、100、200和300 μM)处理2龄幼苗gydF4y2Ba2gydF4y2Ba)和transferred to an illuminating incubation climate box (25 ± 1 °C, 12 h photoperiod, photo- synthetically active radiation = 200 μmol m−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba) 48小时。实验2用不同浓度(1、10、100和200 μM)的氢氧化钠(NaHS, a h .)对萌发24 h的种子进行预处理gydF4y2Ba2gydF4y2BaS供体)24小时的溶液,然后将幼苗暴露于200μmcdclgydF4y2Ba2gydF4y2Ba48 h。然后测定黄瓜幼苗的根长和鲜重。gydF4y2Ba
检测细胞死亡gydF4y2Ba
伊文思蓝染色已被广泛用于细胞死亡的指示。根据张的方法[gydF4y2Ba48gydF4y2Ba],处理48 h后,用0.25% (w/v)伊文氏蓝染色15 min,水洗3次。在显微镜下观察并拍照(Revolve RVL-100-G, ECHO, USA)。染色后,用1 mL 80%乙醇均质,50℃孵育15分钟,10000离心gydF4y2BaggydF4y2Ba10分钟,然后在600nm下测量吸光度。gydF4y2Ba
内源性H测定gydF4y2Ba2gydF4y2Ba■内容gydF4y2Ba
根据方的方法[gydF4y2Ba78gydF4y2Ba[将0.2g根尖样物加入到5ml 50mM磷酸盐缓冲溶液中(0.2M抗坏血酸(ASA),0.1M EDTA和0.5mL 1M HCl,pH 6.8),将其加入均质中.释放的H.gydF4y2Ba2gydF4y2Ba以1% (w/v)醋酸锌捕收硫。30分钟后,0.3 mL 5 mM二甲基对苯二胺溶于3.5 mM HgydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba加入0.3 mL 50 mM硫酸铁铵。反应15 min后,检测在667 nm处的吸收值。gydF4y2Ba
过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)和超氧阴离子自由基(OgydF4y2Ba2gydF4y2Ba·−gydF4y2Ba)分析gydF4y2Ba
为了确定^ hgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2BaCd胁迫48 h后,我们取0.2 g根尖样品,用预冷的丙酮研磨。然后转移到离心管中,在4°C下3000 rpm离心10分钟。提取液(1 mL)加入0.1 mL 5%硫酸钛和0.2 mL浓氨水中;沉淀于4℃,3000 rpm离心10 min,然后用丙酮洗涤3 - 5次。最后,2mol LgydF4y2Ba−1gydF4y2Ba在沉淀物中加入大欣酸,在415 nm处进行比色分析[gydF4y2Ba79gydF4y2Ba].gydF4y2Ba
为了确定将OgydF4y2Ba2gydF4y2Ba·−gydF4y2Ba含量,根样品(0.2 g)用1 mL磷酸盐缓冲液(pH 7.8)均质,并在4°C下12,000 rpm离心15分钟。上清液中加入盐酸羟胺(1ml)反应1h,再加入对氨基苯磺酸1ml和α-萘胺1ml。溶液在25°C保存20分钟。检测530 nm处的吸收值[gydF4y2Ba49gydF4y2Ba].gydF4y2Ba
丙二醛和ELP的测量gydF4y2Ba
在硫代巴比妥酸反应中加入根样0.2 g,反应液在95℃水浴中浸泡20 min,冷却至室温。最后,分别在450、532和600 nm处测量吸光度值[gydF4y2Ba80gydF4y2Ba].gydF4y2Ba
取根样0.2 g加入10 mL蒸馏水,25℃孵育2 h。然后,通过电导率(EC1)读取溶液。最后,样品在95℃水浴中处理30分钟,然后读取EC2,其中ELP = EC1/EC2 × 100% [gydF4y2Ba81.gydF4y2Ba].gydF4y2Ba
抗氧化酶活性测定gydF4y2Ba
抗氧化酶活性的测定方法由Bu等人描述[gydF4y2Ba82.gydF4y2Ba].根(2 cm长)加入1.5 mL 50 mM PBS缓冲液(1 mM EDTA和1%聚乙烯吡咯烷酮)并均质。匀浆在10,000离心gydF4y2BaggydF4y2Bafor 10 min at 4 °C and the extract was used to detect the activity of antioxidant enzymes.
以抑制硝基蓝四唑(NBT)的光化学还原为基础,在560nm处测定超氧化物歧化酶(SOD)活性。通过微量修饰测定过氧化物酶(POD)活性;酶提取液(0.1 mL)加入2.6 mL愈伤愈醇(0.3%加入50 mM磷酸盐缓冲液,pH 6.5)和0.3 mL 0.6% HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba,然后在470 nm处检测吸光度变化2 min。过氧化氢酶(CAT)在290 nm下检测3分钟,使用2% HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba, 50 μL酶液和50 mM PBS缓冲液。用50 mM PBS缓冲液、15 mM抗坏血酸、50 μL酶提取物、30 mM H在290 nm下检测抗坏血酸过氧化物酶(APX)gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba.gydF4y2Ba
4,6 -二氨基-2-苯基吲哚(DAPI)染色gydF4y2Ba
用前面描述的方法测量DAPI染色[gydF4y2Ba83.gydF4y2Ba经过一些修改。2 cm长的根用4%戊二醛溶液固定24 h后,用蒸馏水冲洗3次。将根浸泡在1 μg mL中gydF4y2Ba−1gydF4y2Ba(w/v) DAPI在室温下浸泡10分钟,然后用蒸馏水洗涤数次。DAPI染色图像用荧光显微镜(Revolve RVL-100-G, ECHO, USA)观察。通过ImageJ软件测量荧光强度。gydF4y2Ba
线粒体Cyt c/a与线粒体通透性过渡孔(MPTP)比值的检测gydF4y2Ba
如先前研究所述[gydF4y2Ba84.gydF4y2Ba]线粒体,在制造商的指示之后,使用套件(Bestbio,BB-3611-1)的套件(Bestbio,BB-3611-1),从4 d岁黄瓜幼苗的根尖中分离出来。加入0.2%BSA的悬浮的线粒体以达到0.5mg mL的终浓度gydF4y2Ba−1gydF4y2Ba,用紫外分光光度计在550 nm和630 nm处测定悬浮液的吸光度。Cyt c/a的比值= A550 / A630。gydF4y2Ba
将分离的线粒体用缓冲液II (5 mM琥珀酸钠、70 mM蔗糖、5 mM HEPES、220 mM甘露醇,pH 7.2)悬浮,调整蛋白浓度为0.3 mg/mL, 20℃孵育2 min。在540 nm处记录吸光度[gydF4y2Ba69gydF4y2Ba].gydF4y2Ba
caspase-3-like的活性gydF4y2Ba
caspase-3样检测试剂盒(Solarbio, BC3830)按照厂家说明书使用。为测定caspase-3样蛋白的活性,采用35 μL提取液+ 65 μL反应缓冲液[5 μL caspase-3底物(DEVD-)]在96孔微量滴定板中进行测定gydF4y2BapgydF4y2Bana),2 mm]。将裂解物在37℃下孵育4小时。用ELISA读取器(CMAX加,分子器件,USA)在405nm中测量混合物。gydF4y2Ba
统计分析gydF4y2Ba
本研究中所有值均重复三次,结果为三次独立实验的均值±标准误差(SE)。采用数据分析进行邓肯多极差检验(gydF4y2BaPgydF4y2Ba< 0.05),使用SPSS 19.0软件(IBM SPSS,芝加哥,美国)。gydF4y2Ba
可用性数据和材料gydF4y2Ba
在当前的研究中生成的数据集可从第一作者在合理的要求。gydF4y2Ba
缩写gydF4y2Ba
- HgydF4y2Ba2gydF4y2Ba史:gydF4y2Ba
-
硫化氢gydF4y2Ba
- 纤毛运动:gydF4y2Ba
-
编程细胞死亡gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba:gydF4y2Ba
-
过氧化氢gydF4y2Ba
- OgydF4y2Ba2gydF4y2Ba·−gydF4y2Ba:gydF4y2Ba
-
超氧化物阴离子自由基gydF4y2Ba
- MDA:gydF4y2Ba
-
丙二醛gydF4y2Ba
- ELP:gydF4y2Ba
-
电解液泄漏比例gydF4y2Ba
- SOD:gydF4y2Ba
-
超氧化物歧化酶gydF4y2Ba
- 圆荚体:gydF4y2Ba
-
过氧化物酶gydF4y2Ba
- 猫:gydF4y2Ba
-
催化剂gydF4y2Ba
- APX型:gydF4y2Ba
-
抗坏血酸过氧化物酶gydF4y2Ba
- Cyt c:gydF4y2Ba
-
细胞色素cgydF4y2Ba
- MPTP:gydF4y2Ba
-
线粒体通透性过渡孔gydF4y2Ba
- GA:gydF4y2Ba
-
赤霉酸gydF4y2Ba
- DAPI:gydF4y2Ba
-
4, 6-Diamidino-2-phenylindolegydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
satarug s,garrett sh,sens ma,sens da。镉,环境暴露和健康结果。环境健康持态度。2010; 118(2):182-90。gydF4y2Ba
- 2.gydF4y2Ba
镉对植物的毒性研究。Met Ions Life Sci. 2013; 11:395-413。gydF4y2Ba
- 3.gydF4y2Ba
林爱,AARTS MGM。植物中锌和镉应激反应的分子机制。细胞mol寿命。2012; 69(19):3187-206。gydF4y2Ba
- 4.gydF4y2Ba
Abedi E:镉胁迫对水稻种子萌发和幼苗生长的影响(gydF4y2BaOriza马唐L。gydF4y2Ba).2019年。gydF4y2Ba
- 5.gydF4y2Ba
Gallego SM, Pena LB, Barcia RA, Azpilicueta CE, Iannone MF, Rosales EP, Zawoznik MS, Groppa MD, Benavides MP。阐明植物中镉的毒性和耐受性:对调节机制的洞察。Environ Exp Bot。2012; 83(5):33-46。gydF4y2Ba
- 6.gydF4y2Ba
li zwan M, Meunier JD, david JC, Pokrovsky OS, Bovet N, Keller C.硅缓解小麦幼苗cd胁迫(gydF4y2Ba圆锥小麦gydF4y2BaL. cv。克劳迪奥)生长在水培。环境科学污染粉丝。2016; 23(2):1414至1427年。gydF4y2Ba
- 7.gydF4y2Ba
关键词:镉胁迫,小麦,氧化防御系统,一氧化氮,硫化氢杂志。2019;168(2):345 - 60。gydF4y2Ba
- 8。gydF4y2Ba
Younis U, Malik SA, Rizwan M, Qayyum MF, Yong SO, Shah MHR, Rehman RA, Ahmad N.生物炭提高菠菜中的镉耐受性(gydF4y2BaSpinacia oleraceagydF4y2Ba),通过改变CD的吸收和生理生化特性。环境科学与技术2016;23(21):1-10。gydF4y2Ba
- 9。gydF4y2Ba
Gruhlke MCH,Slusarenko AJ。反应性硫种类的生物学(RSS)。植物理性生物化学。2012; 59(2):98-107。gydF4y2Ba
- 10.gydF4y2Ba
李志强,王志强,王志强。硫化氢与细胞信号转导的关系。acta Pharmacol Toxicol. 2011;51(1): 169-87。gydF4y2Ba
- 11.gydF4y2Ba
吴凌云,魏博,魏勇,秦建松,陈昆,孟庆河,穆法发,孟卫通,盛明gydF4y2Ba2gydF4y2BaS作为一种生理血管链胎:小鼠的高血压,缺失胱硫脲γ-溶酶。科学。2008; 322(5901):587-90。gydF4y2Ba
- 12.gydF4y2Ba
硫化氢的生理意义:一种开花的气味探索。杂志启;2012 92(2):791 - 896。gydF4y2Ba
- 13.gydF4y2Ba
硫化氢与细胞信号:团队成员还是裁判?植物生理生化学报。2014;78:37-42。gydF4y2Ba
- 14.gydF4y2Ba
Yamasaki H,Cohen MF。植物中硫化氢和一氧化氮的生物环境:基因地球链接植物,微生物和动物生理的气体。一氧化氮。2016; 55:91-100。gydF4y2Ba
- 15.gydF4y2Ba
一氧化氮和硫化氢:调节植物对非生物胁迫防御的两种亲密协作者。植物生长规律。2020;90(3):409-24。gydF4y2Ba
- 16.gydF4y2Ba
胁迫条件下植物生长过程中硫化氢和一氧化氮信号协调的研究。杂志。2020;168(2):301 - 17所示。gydF4y2Ba
- 17.gydF4y2Ba
Maria P, Denisse S, Blatt MR, Carlos GM.硫化氢调节向内校正KgydF4y2Ba+gydF4y2Ba气孔闭合的通道。植物杂志。2015;168(1):29-35。gydF4y2Ba
- 18.gydF4y2Ba
寇宁,向志,崔伟,李丽,沈伟。甲烷下游硫化氢诱导黄瓜不定根发育。acta botanica yunnanica(云南植物研究),2018;gydF4y2Ba
- 19。gydF4y2Ba
马勇,张伟,牛建军,任勇,张飞。硫化氢在盐胁迫下气孔关闭过程中的作用gydF4y2Ba蚕豆根尖gydF4y2Ba.Funct植物Biol。2019; 46(2):136-45。gydF4y2Ba
- 20.gydF4y2Ba
Corpas FJ, Palma JM。HgydF4y2Ba2gydF4y2BaS信号在植物中的作用及其在农业中的应用。J Adv Res. 2020; 24:131-7。gydF4y2Ba
- 21.gydF4y2Ba
植物中的硫化氢:从过量硫的消散到信号分子。一氧化氮。2014;31:13-4。gydF4y2Ba
- 22.gydF4y2Ba
罗胜,Calderón-Urrea A,纪华,廖伟,谢军,吕军,冯志,唐志忠。硫化氢对植物重金属胁迫的缓解作用。土壤植物。2020;449:1-10。gydF4y2Ba
- 23.gydF4y2Ba
关键词:非生物胁迫,外源一氧化氮和硫化氢,抗逆性保护化学剂改善植物非生物胁迫的生物化学研究。gydF4y2Ba
- 24.gydF4y2Ba
acta botanica sinica(云南植物研究中心);acta botanica sinica(云南植物研究中心);植物学报。2015;6(69):69。gydF4y2Ba
- 25.gydF4y2Ba
拟南芥(Arabidopsis saul1)突变体的早期衰老和细胞死亡与pad4依赖的水杨酸途径有关。植物杂志。2012;159(4):1477 - 87。gydF4y2Ba
- 26.gydF4y2Ba
关键词:植物自噬,自噬,基因,功能,相互作用摩尔细胞。2012;34(5):413 - 23所示。gydF4y2Ba
- 27。gydF4y2Ba
马加什F.汤姆,范Hautegem,马蒂亚斯,厢式Durme,亚迪拉,奥维拉-卡里,Marlies,斯曼:由ANAC033 /松布雷罗控制程序性细胞死亡来确定在拟南芥根冠器官大小。Curr Biol。2014; 24(9):931-40。gydF4y2Ba
- 28。gydF4y2Ba
Xuan W, Band LR, Kumpf RP, Van Damme D, Parizot B, De Rop G, Opdenacker D, Moller BK, Skorzinski N, Njo MF。拟南芥中周期性程序性细胞死亡刺激激素信号和根系发育。科学。2016;351(6271):384 - 7。gydF4y2Ba
- 29。gydF4y2Ba
Huh Gh,Damsz B,Matsumoto TK,Reddy MP,Rus Am,Ibeas Ji,Narasimhan ML,Bressan Ra,Hagegawa PM。盐导致离子不平衡诱导的酵母和植物中的编程细胞死亡。工厂J.2010; 29(5):649-59。gydF4y2Ba
- 30.gydF4y2Ba
在镉诱导的拟南芥悬浮培养中,一氧化氮参与了细胞程序性死亡。植物杂志。2009;150:217-28。gydF4y2Ba
- 31.gydF4y2Ba
马伟,徐伟,徐华,陈勇,何智,马明。一氧化氮对镉诱导烟草BY-2细胞程序性死亡的调控作用。足底。2010;232(2):325 - 35。gydF4y2Ba
- 32.gydF4y2Ba
姚N,艾斯菲尔德BJ,格林伯格JT。线粒体——一种通常参与细胞程序性死亡的细胞器gydF4y2Ba拟南芥gydF4y2Ba.植物杂志2010; 40(4):596-610。gydF4y2Ba
- 33.gydF4y2Ba
余辉,李军。细胞死亡的植物和动物细胞器。有机化学。2015;6(16):13852-3。gydF4y2Ba
- 34.gydF4y2Ba
线粒体在细胞死亡过程中的作用。癌症化学药物。2006;57(5):545-53。gydF4y2Ba
- 35.gydF4y2Ba
植物线粒体的膜间空间含有一种可能参与细胞程序性死亡的DNase活性。植物j . 2010; 34(5): 573 - 83。gydF4y2Ba
- 36.gydF4y2Ba
镰刀菌毒素脱氧雪腐镰刀菌醇(deoxynivalenol)能抑制植物程序性细胞凋亡。《公共科学图书馆•综合》。2013;8 (7):e69542。gydF4y2Ba
- 37.gydF4y2Ba
Lam E, ., Kato N, ., Lawton M,。程序性细胞死亡、线粒体与植物超敏反应。自然2001,411(6839):848 - 853。gydF4y2Ba
- 38.gydF4y2Ba
Rosa Anna V, Daniela V, Antonella B, Riccardo Sandro M, Salvatore P, Ersilia M.细胞色素c在烟草亮黄色2细胞中以活性氧依赖的方式释放,并通过caspase样蛋白酶降解,最终导致热休克诱导细胞死亡。植物杂志。2006;141(1):208 - 19所示。gydF4y2Ba
- 39.gydF4y2Ba
Balakireva A,Zamyatnin A.削减蛋白酶和编程的细胞死亡之间的差距。前植物SCI。2019; 10:704。gydF4y2Ba
- 40.gydF4y2Ba
镉干扰杨树生长素生理和木质素化。中国生物医学工程学报。2012;63(3):1413-21。gydF4y2Ba
- 41.gydF4y2Ba
徐军,尹华,刘旭东,李晓霞。盐胁迫对植物镉胁迫响应的影响。足底。2010;231(2):449 - 59。gydF4y2Ba
- 42.gydF4y2Ba
叶面积和蒸腾速率对土壤镉积累和区隔的影响gydF4y2Ba凤仙花wallerianagydF4y2Ba.水空壤污染。2015; 226(1):2246。gydF4y2Ba
- 43.gydF4y2Ba
在BY-2细胞培养中,镉诱导细胞死亡以细胞质空泡化开始,以坏死结束。杂志。2014;151(4):423 - 33所示。gydF4y2Ba
- 44.gydF4y2Ba
齐伟,孙娜娜,姜涛,陈振国,金超。富氢水通过降低小白菜对镉的吸收和提高其抗氧化能力。acta botanica yunnanica(云南植物研究). 2015;gydF4y2Ba
- 45.gydF4y2Ba
Liptáková Ľ, Huttová J, Mistrík I, Tamás L.脂肪加氧酶活性的增强参与了胁迫反应,但与镉短期处理大麦根尖的有害脂质过氧化和细胞死亡无关。植物生理学报。2013;170(7):646-52。gydF4y2Ba
- 46.gydF4y2Ba
Malea P, Kevrekidis T, Mogias A, Adamakis I-DS。被子植物叶片镉积累和死亡细胞发生的动力学gydF4y2BaRuppia maritimagydF4y2Ba.2014年3月机器人;57(2):111 - 22所示。gydF4y2Ba
- 47.gydF4y2Ba
陈志强,王志强,王志强,等。镉-镍互作对玉米根系超氧化物歧化产物产生、细胞活力和膜电位的影响。生物学报。2015;66(2):192-204。gydF4y2Ba
- 48.gydF4y2Ba
张丽,裴颖,王华,金志,刘铮,乔志,方华,张颖。硫化氢通过抑制镉诱导的胡萝卜根活性氧积累减轻细胞死亡。氧化Med Cell Longev. 2015;2015 - 11。gydF4y2Ba
- 49.gydF4y2Ba
陈健,王文辉,吴方华,尤春英,刘太田,董晓军,何建新,郑海林。硫化氢减轻铝对大麦幼苗的毒性。土壤植物。2013;362(1 - 2):301 - 18。gydF4y2Ba
- 50.gydF4y2Ba
刘旭,陈杰,王光华,王文辉,沈志军,罗明君,高发,Simon M, Ghoto K,郑海林。硫化氢通过降低锌吸收和调节镉/锌超蓄积体根中抗氧化酶和金属硫蛋白的基因表达来减轻锌毒性gydF4y2Ba龙葵gydF4y2Ba植物营养与肥料学报,2016;gydF4y2Ba
- 51.gydF4y2Ba
植物与金属的相互作用:新兴的修复技术。2016:263 - 283。gydF4y2Ba
- 52.gydF4y2Ba
Tian B, Qiao Z, Zhang L, Li H, Pei Y. effects of cadmium stress in foxtail millet(谷子)。植物生理生化。2016;109:293-9。gydF4y2Ba
- 53.gydF4y2Ba
Basharat A,鳃RA, Su Y,鳃MB, Shafaqat A, Rafiq MT, Weijun Z.硫化氢减轻镉诱导的形态生理和超微结构变化gydF4y2Ba芸苔属植物显著gydF4y2Ba.生态毒理学与环境科学。2014;110(110C): 197-207。gydF4y2Ba
- 54.gydF4y2Ba
管美美,张洪辉,潘伟,金春旺,林学祥。硫化物通过改变镉的化学形式和亚细胞分布来减轻镉在拟南芥中的毒性。中国环境科学。2018;627:663-70。gydF4y2Ba
- 55.gydF4y2Ba
程伟,张丽,焦灿,苏敏,杨涛,周磊,彭瑞,王瑞,王超。硫化氢缓解缺氧诱导的根尖死亡gydF4y2BaPisum一gydF4y2Ba.植物生理生化学报。2013;70(1):278-86。gydF4y2Ba
- 56.gydF4y2Ba
李志伟。自由基在生物医学中的应用。中华医学杂志。2007;1(4):331-2。gydF4y2Ba
- 57.gydF4y2Ba
刘小敏,金可,金KC,宣钦,韩慧杰,米世杰,金HS,孙香港,朴慧聪,尹DJ。镉通过活性氧的积累激活拟南芥MPK3和MPK6。植物化学。2010;71(5):614 - 8。gydF4y2Ba
- 58.gydF4y2Ba
LV W,Yang L,XU C,Shi Z,Sha Z,仙M,陈J.镉通过调节芸苔属Rapa根尖中的内源性硫化硫化氢的过氧化氢和超氧基自由基的平衡。前植物SCI。2017; 8(985298):232。gydF4y2Ba
- 59.gydF4y2Ba
Kaya C, Aslan M.硫化氢在一定程度上参与了硫胺诱导的草莓对镉毒性的耐受(gydF4y2Ba草莓属x ananassagydF4y2Ba杜赫)植物。环境科学学报2019;27(4):941-53。gydF4y2Ba
- 60.gydF4y2Ba
张Y,郑GH,刘P,歌曲JM,徐GD,CAI MZ。根尖细胞对Fe的形态学和生理反应gydF4y2Ba2+gydF4y2Ba毒性的大米。植物生理学报。2011;33(3):683-9。gydF4y2Ba
- 61.gydF4y2Ba
引用本文:王志刚,王志刚,王志刚。镉诱导黄羽豆根细胞程序性死亡及其信号转导机制的研究进展。华北农学报,2016,29(4):429 - 434。植物生理与生物化学。2012;58:124-34。gydF4y2Ba
- 62.gydF4y2Ba
Jabs T.反应性氧中间体作为植物和动物编程细胞死亡的介质。Biochem pharmacol。1999年; 57(3):231-45。gydF4y2Ba
- 63.gydF4y2Ba
Gallego SM, Pena LB, Barcia RA, Azpilicueta CE, Iannone MF, Rosales EP, Zawoznik MS, Groppa MD, Benavides MP。阐明植物中镉的毒性和耐受性:对调节机制的洞察。Environ Exp Bot. 2012; 83:33-46。gydF4y2Ba
- 64.gydF4y2Ba
勒克司,Martinka男,Vaculík男,白PJ。根系对镉在根际:审查。J Exp Bot。2011; 62(1):21-37。gydF4y2Ba
- 65.gydF4y2Ba
在镉诱导的拟南芥悬浮培养中,一氧化氮参与了细胞程序性死亡。植物杂志。2009;150(1):217 - 28。gydF4y2Ba
- 66.gydF4y2Ba
张艳霞,胡克东,吕凯,李永华,胡丽艳,张学强,阮玲,刘玉生,张辉。NaHS作为一种抗氧化剂延缓大麦糊粉层细胞的程序死亡。2015;2015。gydF4y2Ba
- 67.gydF4y2Ba
关键词:镉,镉,离子交换,细胞毒性,硫化氢植物生理生化学报。2013;65(6):67-74。gydF4y2Ba
- 68.gydF4y2Ba
Tiwari Bs,Belenghi B,Levine A.氧化应激增加呼吸和产生反应性氧物种的产生,导致ATP耗尽,线粒体渗透性转变的开放,以及编程的细胞死亡。植物理性。2002; 128(4):1271-81。gydF4y2Ba
- 69.gydF4y2Ba
他H,黄W,吴TL,顾男,詹Ĵ,王甲,他LF。在花生氧化氮禁止显示铝诱导程序性细胞死亡(gydF4y2Ba落花生hypoganeagydF4y2Ba通过改善线粒体生理特性来改善根尖。一氧化氮。2018;74:47-55。gydF4y2Ba
- 70。gydF4y2Ba
胡丽,陆敏,吴志勇,黄平,边俊。硫化氢通过保护线粒体功能抑制鱼藤酮诱导的细胞凋亡。摩尔杂志。2009;75 (1):27-34 . .gydF4y2Ba
- 71。gydF4y2Ba
奥斯本N.氧化诱导的RGC-5细胞死亡培养涉及线粒体功能障碍,可通过硫化氢减弱。Acta角膜切削2013;91;252年。gydF4y2Ba
- 72。gydF4y2Ba
向志,郭银,建长。硫化氢通过调节凋亡和自噬改善吸烟大鼠左心室功能。细胞凋亡。2014;19(6):998 - 1005。gydF4y2Ba
- 73.gydF4y2Ba
施y。凋亡期间胱天冬酶活化和抑制的机制。细胞res。2002; 9(3):459-70。gydF4y2Ba
- 74.gydF4y2Ba
植物半胱氨酸蛋白酶的功能研究。生物化学学报2004;51(3):609-24。gydF4y2Ba
- 75.gydF4y2Ba
Yun Y,Zhe L,DA X.一氧化氮促进镉诱导拟南芥拟南芥的MPK6介导的Caspase-3样活化。植物细胞环境。2012; 36(11):1-15。gydF4y2Ba
- 76.gydF4y2Ba
罗勇,杨晓霞,赵胜,魏超,尹勇,刘涛,江胜,谢军,万旭,毛敏。硫化氢通过改善线粒体功能障碍和抑制ros介导的caspase-3通路抑制OGD/ r诱导的细胞凋亡。Neurochem Int。2013;63(8):826 - 31所示。gydF4y2Ba
- 77.gydF4y2Ba
李英,李华英,肖松,盛峰,文志,孙永兵。硫化氢对大鼠腹膜间皮细胞高糖毒性的影响。肾元实验。2014;126(3):157-65。gydF4y2Ba
- 78.gydF4y2Ba
方涛,曹志,李军,沈伟,黄磊。生长素诱导的硫化氢生成参与番茄侧根形成。植物生理生化学报。2014;76(5):44-51。gydF4y2Ba
- 79.gydF4y2Ba
王华,侯军,李勇,张勇,黄俊,梁伟。高铝胁迫下大豆胞质葡萄糖-6-磷酸脱氢酶的研究进展。土壤植物。2017;416(1 - 2):一则。gydF4y2Ba
- 80.gydF4y2Ba
关键词:镉胁迫,一氧化氮,硫化氢,镉胁迫gydF4y2Ba香附子gydF4y2Ba(L)。珀耳斯)。植物生理与生物化学。2014;74:99-107。gydF4y2Ba
- 81.gydF4y2Ba
张H,胡莉,胡锦涛,他yd,wang sh,罗jp。硫化氢促进小麦种子萌发,并减轻铜应激的氧化损伤。J Intent Plant Biol。2008; 50(12):1518-29。gydF4y2Ba
- 82.gydF4y2Ba
Bu R, Xie J, Yu J, Liao W, Xiao X, Lv J, Wang C, Ye J, Calderón-Urrea agydF4y2BaCucumis巨大成功gydF4y2Ba硅通过增加抗氧化酶的活性和减轻脂质过氧化作用而减轻幼苗的生长。植物学报,2016;59(3):247-59。gydF4y2Ba
- 83.gydF4y2Ba
刘建军,张志强,唐志强。乙烯对镉胁迫下拟南芥根系发育的影响。植物学报2017;8(1628):253。gydF4y2Ba
- 84.gydF4y2Ba
李江,他Y,马d,他B,王莹,陈B.挥发性化感物质gydF4y2Ba土荆芥ambrosioidesgydF4y2BaL.诱导线粒体介导的钙gydF4y2Ba2+gydF4y2Ba-依赖和caspase依赖的细胞凋亡信号通路。土壤植物。2018;425(1 - 2):297 - 308。gydF4y2Ba
致谢gydF4y2Ba
感谢程立祥博士(甘肃省旱地作物科学重点实验室,甘肃农业大学,兰州730070)提供的方法支持。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了国家重点研究和开发项目(2018 yfd0201205),中国国家自然科学基金(31660584),中国农业研究系统(CARS-23-C-07),甘肃省科技重点项目基金(No.17ZD2NA015)和甘肃引用省自然科学基金,中国(1610 rjza098)。资助方没有参与实验的设计、数据收集和分析、数据解释以及手稿的撰写。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
概念化,SL, ZT和WL;形式分析,SL, ZT, JL;收购资金,客户至上;调查,SL;方法论,SL, WL和ZF;项目管理,JX, JY;资源,客户至上;监督,WL, JX, JY;验证、客户至上;写作-原草案SL; Writing – review & editing, WL and MD. All authors have read and approved the manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
竞争利益gydF4y2Ba
两位作者宣称他们没有相互竞争的利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
罗,S.,唐,Z.,Yu,J.gydF4y2Baet al。gydF4y2Ba硫化氢对黄瓜中的CD诱导的细胞死亡产生负面调节(gydF4y2BaCucumis巨大成功gydF4y2BaL)根尖细胞。gydF4y2BaBMC植物杂志gydF4y2Ba20.gydF4y2Ba480(2020)。https://doi.org/10.1186/s12870-020-02687-8gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02687-8gydF4y2Ba
关键字gydF4y2Ba
- 线粒体gydF4y2Ba
- 细胞色素cgydF4y2Ba
- 氧化损伤gydF4y2Ba
- 细胞死亡gydF4y2Ba
- Caspase-3-like蛋白酶gydF4y2Ba