- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
干旱硬化提高植物的耐旱性gydF4y2Ba烟草gydF4y2Ba在生理、生化和分子水平上gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba,文章号:gydF4y2Ba486gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
干旱胁迫是非生物胁迫中危害最大的一种,对作物生长发育有不良影响。干旱硬化是一种可行的、广泛应用的烟草育苗方法。由于其在提高抗旱性方面的作用,已引起广泛的关注。本研究旨在研究干旱硬化的作用,并揭示烟草抗旱性和抗旱性的多种机制。gydF4y2Ba
结果gydF4y2Ba
本研究对红花大金元(h)和云烟100 (Y)两个烟草品种进行了不同的干旱硬化处理(CK(不干旱硬化)、T1(干旱硬化24 h)、T2(干旱硬化48 h)和T3(干旱硬化72 h),从生理、生化和基因表达水平上对干旱胁迫下两个烟草品种的干旱硬化效应进行了完整的研究框架。结果表明,T2和T3处理显著降低了两个品种在干旱胁迫下的生长。同样,在各种干旱硬化处理中,T3改善了酶(POD, CAT, APX)和非酶(AsA)防御系统,同时提高了脯氨酸和可溶性糖的水平,以减轻氧化损伤的负面影响,并带来烟草植物的渗透调节。最后,不同干旱硬化处理(T1、T2和T3)对两个品种基因表达的调控存在差异,特别是T3干旱硬化处理通过触发脯氨酸(gydF4y2BaP5CS1gydF4y2Ba)、多胺(gydF4y2BaADC2gydF4y2Ba),依赖于aba (gydF4y2BaSnRK2gydF4y2Ba,gydF4y2BaAREB1gydF4y2Ba)和独立路径(gydF4y2BaDREB2BgydF4y2Ba),以及抗氧化防御相关基因(gydF4y2Ba猫gydF4y2Ba,gydF4y2BaAPX1gydF4y2Ba,gydF4y2BaGR2gydF4y2Ba)对干旱胁迫的反应。gydF4y2Ba
结论gydF4y2Ba
干旱硬化对两个烟草品种幼苗的耐旱性和抗旱性做出了重要贡献,一方面是通过减少其生长,另一方面是通过激活生物化学和分子水平上的各种防御机制。研究结果表明,干旱硬化是提高烟草抗旱性和抗旱性的有效策略。这将为今后了解其他植物的耐旱性和适应机制提供一种有用的方法。gydF4y2Ba
图形抽象gydF4y2Ba
干旱硬化处理提高了烟草品种的耐旱性和抗旱性。T1表示干旱硬化24 h, T2表示干旱硬化48 h, T3表示干旱硬化72 hgydF4y2Ba

背景gydF4y2Ba
农业和气候变化相互关联,全球气候变化的速度比以往任何时候都要快[gydF4y2Ba1gydF4y2Ba].水资源有限是全球作物生长、发育和生产的主要制约因素,而气候变化是其主要原因,从而极大地恶化了这一状况,对世界大多数地区的农业产生了不利影响[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].干旱是最重要的非生物胁迫之一,由于物理损伤、生理生化破坏和分子变化,对植物的生长和生产力产生负面影响,导致代谢异常、生长减慢,最终导致植物死亡[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].植物生长发育的减少取决于干旱胁迫的严重程度和持续时间。为了应对和克服干旱胁迫,植物进化出多种策略、防御和适应机制,包括形态、生理、生化和分子修饰[gydF4y2Ba7gydF4y2Ba].上述与干旱胁迫防御和适应相关的修饰包括气孔关闭、细胞适应、膜稳定性、碳固定率、活性氧清除系统、激素调节、胁迫相关基因、信号基因和应激蛋白的诱导。这些修饰在干旱胁迫下的植物生存中起着至关重要的作用[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].gydF4y2Ba
干旱胁迫对植物的影响可以通过应用和控制各种方法/技术来最小化并提供耐受性。这些使植物具有耐旱性的方法/技术和适应策略包括育种技术、植物激素和渗透保护剂对植物或种子的外源应用以及干旱硬化[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba].幼苗具有延展性,因此可以通过早期的低水分胁迫来提高其耐旱性。因此,通过减少或部分灌溉幼苗,使幼苗预先适应干旱胁迫是一种可行而方便的方法[gydF4y2Ba12gydF4y2Ba].干旱硬化不仅不能提高植物的耐旱性,而且还能使植物对其他非生物胁迫(如番茄的冷胁迫)具有耐受性[gydF4y2Ba13gydF4y2Ba]、黄瓜幼苗的冷胁迫[gydF4y2Ba14gydF4y2Ba],同时也使春大麦对重金属的交叉适应[gydF4y2Ba15gydF4y2Ba].一些研究已经证明了干旱硬化在各种植物物种中的重要性,有助于减轻干旱胁迫的负面影响,并使植物具有耐旱性[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].gydF4y2Ba
干旱硬化通过形态表现(提高根冠比、叶伸长、根表面积)提高植物的耐旱性[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba]、生理适应(蒸腾速率、光合作用速率、相对含水量、渗透势、叶绿素含量)[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba19gydF4y2Ba]、生物化学适应(改善抗氧化防御系统、脯氨酸含量、可溶性糖、多胺)[gydF4y2Ba19gydF4y2Ba],以及干旱胁迫下干旱硬化植株脯氨酸和甜菜碱通路相关基因表达量高于非干旱硬化植株的分子表现[gydF4y2Ba20.gydF4y2Ba].移栽前不同时间和强度的水分胁迫可以提高幼苗的成活率。各种研究表明,干旱硬化的时间间隔不同。干旱硬化的水分胁迫时间范围从几天[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba]到几个星期[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba22gydF4y2Ba]在各种植物中。在我们之前的研究中,Khan等人。gydF4y2Ba23gydF4y2Ba],干旱胁迫2 ~ 3天对植物有不良影响,表现为叶片变黄、萎蔫。在此基础上,本研究采用该时间点持续时间进行干旱硬化。gydF4y2Ba
干旱胁迫导致活性氧(ROS)大量积累,不利于植物生长。为了减轻ROS的影响,植物会诱导更高的抗氧化酶活性,并提高其相关基因的表达[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba],这有助于增强植物对干旱胁迫的耐受性和适应性。此外,从抗氧化酶活性及其相关基因在干旱胁迫下的表达调控来看,其他多种基因也受到调控并高表达,如渗透酶生物合成相关基因(gydF4y2BaP5CSgydF4y2Ba,gydF4y2BaADC2gydF4y2Ba) [gydF4y2Ba26gydF4y2Ba],信号基因相似gydF4y2BaSnRK2gydF4y2Ba[gydF4y2Ba27gydF4y2Ba],转录因子,如gydF4y2BaWRKYgydF4y2Ba[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba],gydF4y2BaAREBgydF4y2Ba而且gydF4y2Ba含有DREBgydF4y2Ba[gydF4y2Ba30.gydF4y2Ba],从而使植物具有耐旱性和抗旱性。这些基因可用于研究干旱硬化在烟草抗旱性中的作用。gydF4y2Ba
各种研究都指出了干旱硬化在多种作物中提供耐旱性的重要性。在本研究中,我们从生理、生化和分子水平对两个烟草品种的幼苗进行了调查,以更全面地了解干旱胁迫下通过干旱硬化提供抗旱性的机制。gydF4y2Ba
结果gydF4y2Ba
生长、叶绿素荧光和多色荧光参数的变化gydF4y2Ba
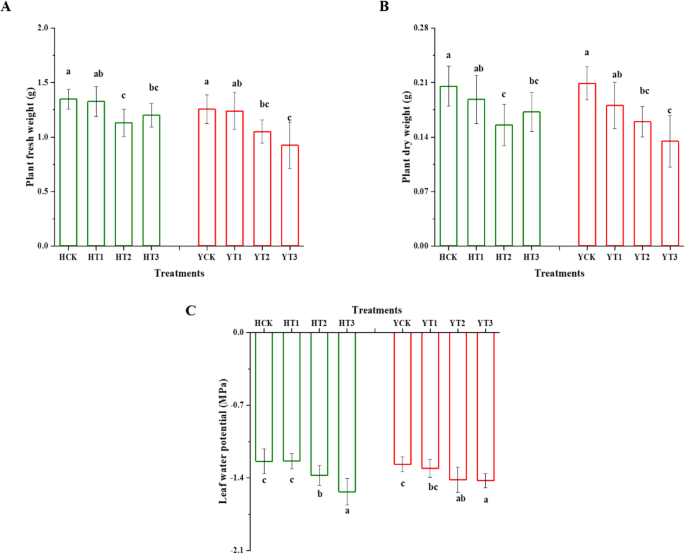
通过不同干旱硬化处理,分析了两个烟草品种在干旱胁迫下的耐旱性。在干旱胁迫下,两个品种在不同干旱硬化处理下的植株鲜度(PFW)和干重(PDW)差异显著(图2)。gydF4y2Ba1gydF4y2Baa和b).干旱胁迫下,H的PFW和PDW分别降低了16和11%,T2和T3分别降低了24和16%,Y的PFW和PDW分别降低了16和26%,T2和T3分别降低了24和36%。同样,在干旱胁迫下,对两个烟草品种的干旱硬化植株和对照植株的叶片水势(LWP)进行了监测。相比之下,两个品种T2和T3处理对干旱胁迫的响应显著降低,而T1和对照在统计学上相似(图2)。gydF4y2Ba1gydF4y2Bac).干旱胁迫对HT2和YT2的响应分别为11%和10%,HT3和YT3的响应分别为24%和12%。gydF4y2Ba
干旱硬化对两个烟草品种干旱胁迫下生长指标和叶片水势的影响植株鲜重(gydF4y2Ba一个gydF4y2Ba),植物干重(gydF4y2BabgydF4y2Ba)及LWP (gydF4y2BacgydF4y2Ba)对干旱胁迫下不同干旱硬化和非干旱硬化处理的差异进行了分析。数值以平均值±SDs表示。使用最小显著性差异(LSD)检验,不同字母表示显著差异,gydF4y2BapgydF4y2Ba< 0.05。HCK表现为红花大金源幼苗无干旱硬化;HT1为红花大金源24 h干旱硬化苗;HT2为红花大金源48 h干旱硬化苗;HT3为红花大金源72 h干旱硬化苗;YCK为云岩-100无干旱硬化苗;YT1表示云烟100抗旱24 h;YT2为云烟-100经过48h干旱硬化的幼苗;YT3表示云烟-100抗旱72 hgydF4y2Ba
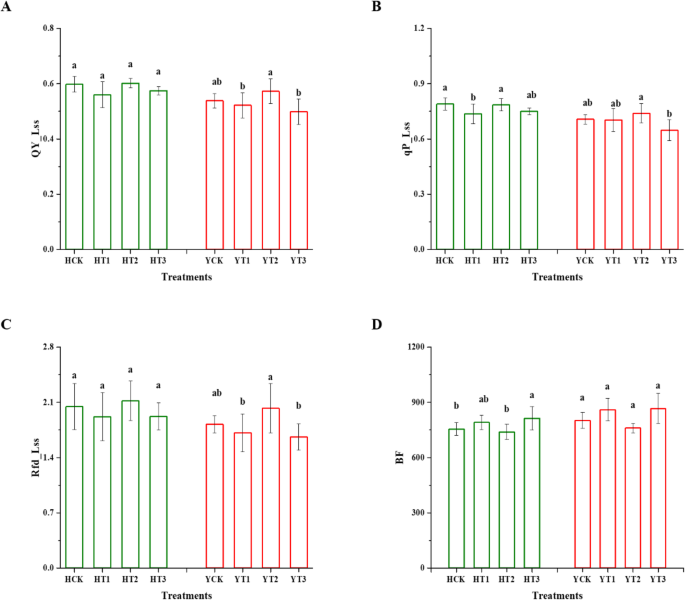
数字gydF4y2Ba2gydF4y2Ba表示叶绿素荧光参数,该参数决定了干旱胁迫下两种烟草品种的干旱硬化植株和非干旱硬化植株的光合性能。在两个品种中,干旱硬化植株在H的T1中qP_Lss(开放反应中心)显著下降,与未干旱硬化植株相比下降了7%,而在Y的T3中观察到下降了8%(图2)。gydF4y2Ba2gydF4y2Bab)。此外,Y在T1和T3的QY_Lss和Rfd_Lss均发生了显著变化,与未经过干旱硬化的植株相比,QY_Lss和Rfd_Lss分别减少了3和7%,6和9%。gydF4y2Ba2gydF4y2Ba蓝色荧光(Blue fluorescence, BF)是从MCF基本参数中选取的多色荧光(multi - colour fluorescence, MCF)参数。在干旱胁迫下,H幼苗经干旱硬化,尤其是T3处理后BF明显高于对照,而Y幼苗经干旱硬化处理后BF无明显变化(图2)。gydF4y2Ba2gydF4y2Bad)。gydF4y2Ba
干旱硬化对叶绿素和多色荧光参数响应的影响。量子量子产额(QY_Lss) (gydF4y2Ba一个gydF4y2Ba)、开放反应中心(qP_Lss) (gydF4y2BabgydF4y2Ba),荧光衰减比(Rfd_Lss) (gydF4y2BacgydF4y2Ba)和蓝色荧光(BF) (gydF4y2BadgydF4y2Ba)的不同干旱硬化和非干旱硬化处理。数据表示均值±SD。不同字母表示LSD的显著差异,gydF4y2BapgydF4y2Ba< 0.05。HCK为无干旱硬化的红花大金源幼苗;HT1为红花大金源24 h干旱硬化苗;HT2为红花大金源48 h干旱硬化苗;HT3为红花大金源72 h干旱硬化苗;YCK为云岩-100无干旱硬化苗;YT1表示云烟100抗旱24 h;YT2为云烟-100经过48h干旱硬化的幼苗;YT3表示云烟-100抗旱72 hgydF4y2Ba
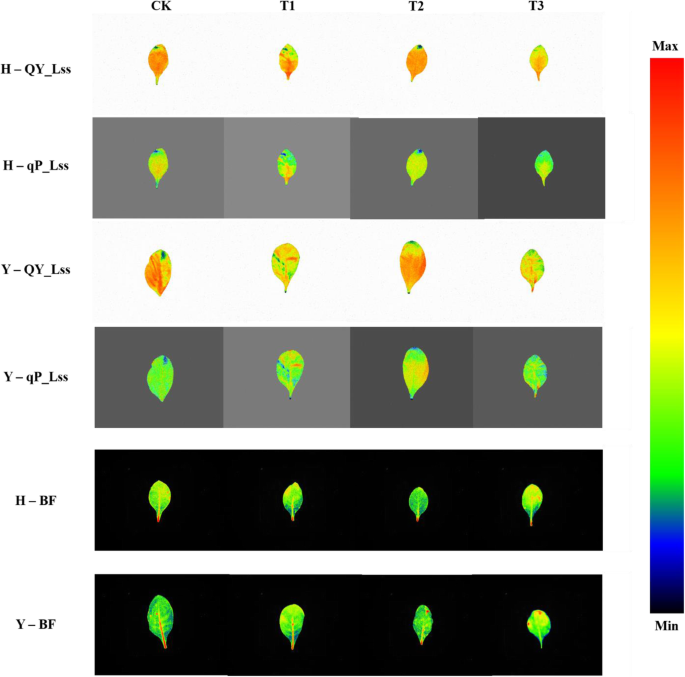
两个品种在干旱胁迫下的QY_Lss和qP_Lss的代表图像以及MCF、对照BF和干旱硬化植株的一个参数如图所示。gydF4y2Ba3.gydF4y2Ba.两个品种QY_Lss和qP_Lss的图像均存在变异,且信号强度从叶尖和叶缘向全叶下降,表现出空间异质性,尤其是在T3。同样,T3叶片BF信号的强度从叶片中部向叶片边缘和叶尖增加,也表现出空间变化。gydF4y2Ba
丙二醛(MDA)和过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)gydF4y2Ba
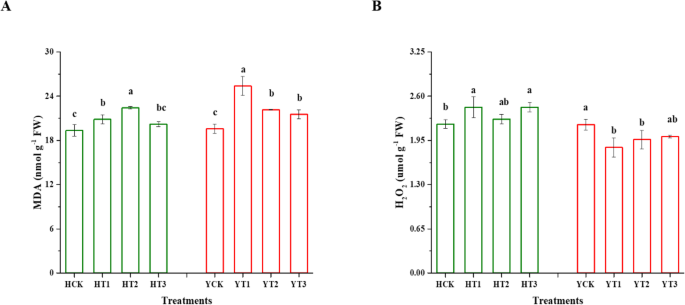
数字gydF4y2Ba4gydF4y2BaMDA和H均有变化gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2BaH和Y品种抗旱和非抗旱植株含量对干旱胁迫的响应。两个品种在不同处理与对照之间均有显著差异。在干旱胁迫下,HT3处理的植株和对照植株MDA含量分别增加了8%和16%。同样,与YCK相比,干旱胁迫使YT1、YT2和YT3植株的MDA含量分别上升了30%、13%和10%。从图中可以看出。gydF4y2Ba4gydF4y2Bab, H也同样增加了11%gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2BaHT1和HT3含量。同样,HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2BaYT1和YT2在干旱胁迫下的含量。gydF4y2Ba
干旱硬化烟草幼苗对干旱胁迫的氧化应激反应。丙二醛含量(gydF4y2Ba一个gydF4y2Ba)和HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba(gydF4y2BabgydF4y2Ba).在对照的情况下,对不同干旱硬化处理的植株施加干旱胁迫。数据为平均值±SDs(不同字母表示在gydF4y2BapgydF4y2BaLSD检验< 0.05)。HCK为无干旱硬化的红花大金源幼苗;HT1为红花大金源24 h干旱硬化苗;HT2为红花大金源48 h干旱硬化苗;HT3为红花大金源72 h干旱硬化苗;YCK为云岩-100无干旱硬化苗;YT1表示云烟100抗旱24 h;YT2为云烟-100经过48h干旱硬化的幼苗;YT3表示云烟-100抗旱72 hgydF4y2Ba
抗氧化酶活性的变化gydF4y2Ba
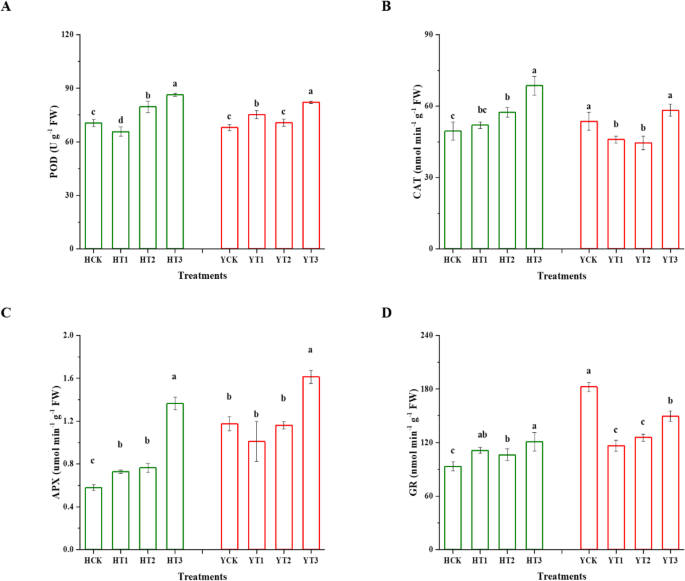
H和Y幼苗中抗氧化酶(POD、CAT、APX和GR)的活性受到显著影响(gydF4y2BapgydF4y2Ba< 0.05)。gydF4y2Ba5gydF4y2Ba).与对照(HCK)相比,干旱胁迫下HT2和HT3的POD活性分别提高了13%和22%。同样,在干旱胁迫下,YT1的POD活性比YCK提高了11%,YT2提高了4%,YT3提高了21%(图2)。gydF4y2Ba5gydF4y2Baa). H品种CAT活性较高(HT2提高16%,HT3提高39%,HT1与HCK无统计学差异),Y品种CAT活性降低(YT3组和YCK组差异不显著,YT1组和YT2组较YCK分别降低14%和17%)(图)。gydF4y2Ba5gydF4y2Bab).图。gydF4y2Ba5gydF4y2Bac,品种H在干旱胁迫下通过干旱硬化提高APX活性。与对照相比,HT1的APX活性提高了26%,HT2提高了32%,HT3提高了136%。同样,与YCK相比,YT3在干旱胁迫下APX活性增加了37%。然而,与对照相比,YT1的APX活性下降了14%。最后,无花果。gydF4y2Ba5gydF4y2Bad表明,在干旱胁迫下,不同干旱硬化处理的GR活性发生了显著变化。经干旱胁迫处理后,HT1和HT3抗旱植株GR活性分别比对照提高了19%和30%。干旱胁迫导致Y系干旱硬化植株(YT1、YT2和YT3) GR活性与非干旱硬化植株(YCK)相比逐渐下降。与对照组相比,YT1、YT2和YT3的GR活性值分别下降了36%、31%和18%。gydF4y2Ba
干旱硬化对干旱胁迫下抗氧化酶活性的影响。干旱胁迫诱导抗氧化酶活性的改变(gydF4y2Ba一个gydF4y2Ba),猫(gydF4y2BabgydF4y2Ba) apx (gydF4y2BacgydF4y2Ba)和GR (gydF4y2BadgydF4y2Ba),不同干旱硬化处理的两个烟草品种的幼苗与未干旱硬化的幼苗。用误差条表示的均值为±SDs,不同字母表示在gydF4y2BapgydF4y2BaLSD检验< 0.05。HCK为无干旱硬化的红花大金源幼苗;HT1为红花大金源24 h干旱硬化苗;HT2为红花大金源48 h干旱硬化苗;HT3为红花大金源72 h干旱硬化苗;YCK为云岩-100无干旱硬化苗;YT1表示云烟100抗旱24 h;YT2为云烟-100经过48h干旱硬化的幼苗;YT3表示云烟-100抗旱72 hgydF4y2Ba
抗坏血酸(AsA)和谷胱甘肽(GSH)含量的变化gydF4y2Ba
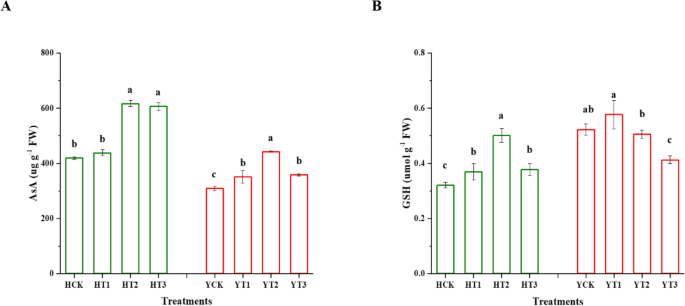
在干旱胁迫下,H和Y品种不同的干旱硬化处理对AsA和GSH含量均有显著影响(图2)。gydF4y2Ba6gydF4y2Ba).HT2和HT3处理的AsA含量分别比对照提高了47%和45%。数字gydF4y2Ba6gydF4y2Baa描述了干旱胁迫下干旱硬化植株YT1、YT2和YT3的AsA含量较非干旱硬化植株(YCK)显著增加了14、43和16%。HT2处理干旱硬化植株GSH含量比未干旱硬化植株(HCK)增加56%,HT3和HT1分别增加17%和15%。同样,干旱胁迫在不同处理下对Y的影响呈显著负向差异。在干旱胁迫下,YT2和YT3的GSH含量比YCK分别降低了3%和21%。gydF4y2Ba
干旱硬化对非酶抗氧化防御系统响应干旱胁迫的影响。干旱胁迫诱导的抗氧化物质含量变化,AsA (gydF4y2Ba一个gydF4y2Ba)及谷胱甘肽(gydF4y2BabgydF4y2Ba)对不同干旱硬化处理的两个烟草品种的幼苗和未干旱硬化的幼苗进行了比较。每个平均值上的误差条为±sd,不同字母表示在gydF4y2BapgydF4y2BaLSD检验< 0.05。HCK为无干旱硬化的红花大金源幼苗;HT1为红花大金源24 h干旱硬化苗;HT2为红花大金源48 h干旱硬化苗;HT3为红花大金源72 h干旱硬化苗;YCK为云岩-100无干旱硬化苗;YT1表示云烟100抗旱24 h;YT2为云烟-100经过48h干旱硬化的幼苗;YT3表示云烟-100抗旱72 hgydF4y2Ba
脯氨酸和可溶性糖(SS)含量变化gydF4y2Ba
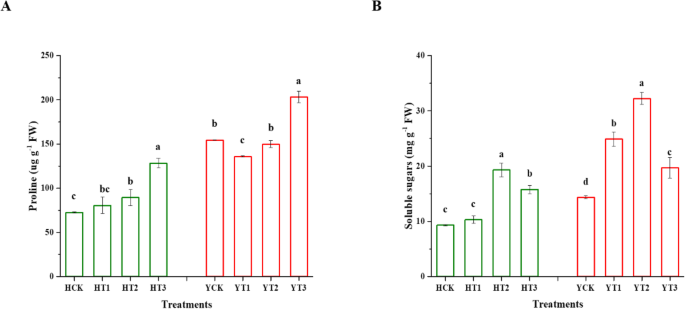
数字gydF4y2Ba7gydF4y2BaA描述了干旱硬化对两个烟草品种脯氨酸含量的影响,以响应干旱胁迫。两个品种在不同处理下对干旱胁迫的响应均有显著变化。与HCK相比,HT3和HT2抗旱植株脯氨酸含量增加了77%和23%。干旱胁迫使YT3的脯氨酸含量比YCK增加32%,YT1的脯氨酸含量比YCK降低12%。同样,在干旱胁迫下,HT2和HT3干旱硬化幼苗的可溶性糖含量分别比非干旱硬化植株高107和69%。此外,YT1、YT2和YT3的干旱硬化植株幼苗对干旱胁迫的响应分别比YCK提高了74、125和37%(图1)。gydF4y2Ba7gydF4y2Bab)。gydF4y2Ba
叶片解剖结构的变化gydF4y2Ba
为了研究在后续干旱胁迫下,干旱硬化对两个品种叶片解剖结构是否有影响。在随后的干旱胁迫条件下,通过干旱硬化处理保持了叶片的总体结构。仍然可以区分上表皮(UE)、下表皮(LE)、栅栏组织(PC)和海绵组织(SC)中的细胞(图。gydF4y2Ba8gydF4y2Ba).然而,在这两个品种的整体叶片结构中,细胞普遍无组织。尤其在T2和T3,栅栏组织和海绵组织中可见明显的组织紊乱、变形和较大的细胞间隙(图2)。gydF4y2Ba8gydF4y2Ba).此外,与其他处理相比,T3处理的栅栏细胞数量更多。gydF4y2Ba
抗氧化-,渗透压生物合成-和应激相关基因的转录表达gydF4y2Ba
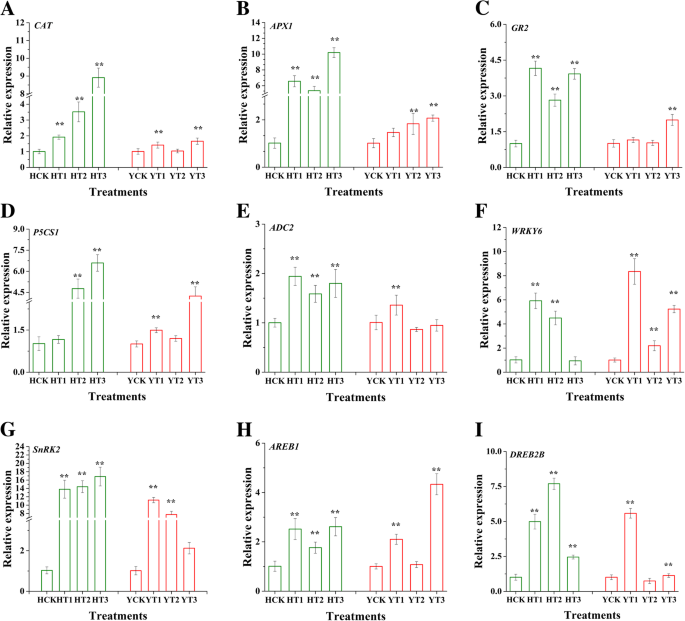
许多基因受干旱胁迫的调控已被广泛报道。为了阐明两个烟草品种抗旱硬化的调控机制,本研究对不同类型基因的表达谱进行了分析,其中包括2个渗透压生物合成相关基因gydF4y2BaP5CS1gydF4y2Ba而且gydF4y2BaADC2gydF4y2Ba,三个抗氧化剂相关基因gydF4y2Ba猫gydF4y2Ba,gydF4y2BaAPX1gydF4y2Ba,gydF4y2BaGR2gydF4y2Ba,一个与ABA信号有关的基因gydF4y2BaSnRK2gydF4y2Ba,以及三个转录相关基因gydF4y2BaAREB1gydF4y2Ba,gydF4y2BaDREB2BgydF4y2Ba,gydF4y2BaWRKY6gydF4y2Ba(无花果。gydF4y2Ba9gydF4y2Ba).结果表明,3个抗氧化防御系统相关基因的转录水平均较高gydF4y2Ba猫gydF4y2Ba,gydF4y2BaAPX1gydF4y2Ba,gydF4y2BaGR2gydF4y2Ba在干旱胁迫下,两个品种均经干旱硬化处理。这些基因在干旱胁迫下的表达量明显高于对照。我们还观察到,这些基因在T3处理中的表达比其他处理更明显(图2)。gydF4y2Ba9gydF4y2Baa - c)。同样,渗透生物合成相关基因gydF4y2BaP5CS1gydF4y2Ba而且gydF4y2BaADC2gydF4y2Ba也在干旱硬化植物中表达,以应对干旱胁迫。的表达式gydF4y2BaP5CS1gydF4y2BaT3处理在两个品种中均显著高于其他处理。表达水平gydF4y2BaADC2gydF4y2BaH品种在干旱硬化处理中表达高于对照,而仅在YT1中表达高于对照(图1)。gydF4y2Ba9gydF4y2Bae).最后,的表达式gydF4y2BaSnRK2gydF4y2Ba,gydF4y2BaAREB1gydF4y2Ba,gydF4y2BaDREB2BgydF4y2Ba,gydF4y2BaWRKY6gydF4y2Ba基因在两个品种的干旱硬化处理中均显著(图2)。gydF4y2Ba9gydF4y2Ba外:我)。的表达式gydF4y2BaWRKY6gydF4y2BaHT3处理低于其他处理。在Y品种中,经过所有干旱硬化处理后,其表达量均高于对照。随后,干旱硬化处理增加了gydF4y2BaSnRK2gydF4y2Ba,gydF4y2BaAREB1,gydF4y2Ba而且gydF4y2BaDREB2BgydF4y2Ba这两个品种都有抗干旱的基因。gydF4y2Ba
干旱硬化对不同基因转录水平响应干旱胁迫的影响。干旱硬化增强了三种抗氧化酶相关基因的表达[gydF4y2Ba猫gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),gydF4y2BaAPX1gydF4y2Ba(gydF4y2BabgydF4y2Ba),gydF4y2BaGR2gydF4y2Ba(gydF4y2BacgydF4y2Ba)]、两个渗透生物合成相关基因[gydF4y2BaP5CS1gydF4y2Ba(gydF4y2BadgydF4y2Ba),gydF4y2BaADC2gydF4y2Ba(gydF4y2BaegydF4y2Ba)],一个ABA信号相关基因(gydF4y2BaSnRK2gydF4y2Ba) (gydF4y2BaggydF4y2Ba),以及三个与转录因子相关的基因[gydF4y2BaAREB1gydF4y2Ba(gydF4y2BahgydF4y2Ba),gydF4y2BaDREB2BgydF4y2Ba(gydF4y2Ba我gydF4y2Ba),gydF4y2BaWRKY6gydF4y2Ba(gydF4y2BafgydF4y2Ba)]对干旱胁迫的反应。HCK为无干旱硬化的红花大金源幼苗;HT1为红花大金源24 h干旱硬化苗;HT2为红花大金源48 h干旱硬化苗;HT3为红花大金源72 h干旱硬化苗;YCK为云岩-100无干旱硬化苗;YT1表示云烟100抗旱24 h;YT2为云烟-100经过48h干旱硬化的幼苗;YT3表示云烟-100抗旱72 hgydF4y2Ba
讨论gydF4y2Ba
立即更好地了解抗旱性是一项具有挑战性的任务;因此,需要在生理、生化和分子水平上进行更多的研究,以了解抗旱性的潜在机制。因此,本研究旨在更好地了解两个烟草品种在干旱胁迫下的干旱硬化效应,考察其耐旱性和适应机制。植物与非干旱硬化植物一起暴露于各种干旱硬化处理,然后暴露于干旱胁迫。在本研究中,干旱硬化提高了两个品种的耐旱性和抗旱性。gydF4y2Ba
干旱是导致作物生长发育下降的主要非生物胁迫之一。一方面,干旱硬化处理降低了H和Y品种对干旱胁迫的响应。这项研究的结果与Makonya等人一致。[gydF4y2Ba31gydF4y2Ba]表明干旱启动降低了鹰嘴豆茎部生物量分配。另一方面,干旱硬化提高了植株的吸水能力。叶片水势是植物水分状况的一个可靠参数,是反映植物耐旱性生理特征的一个指标[gydF4y2Ba16gydF4y2Ba].水势较低的植物组织能吸收较多的水分[gydF4y2Ba32gydF4y2Ba].因此,我们的研究结果表明,干旱硬化提高了水分吸收能力,这与Huang等人的研究结果一致。[gydF4y2Ba16gydF4y2Ba].gydF4y2Ba
干旱胁迫下干旱硬化引起的叶绿素荧光和多色荧光参数的表现gydF4y2Ba
植物在各种胁迫下的基本光合机制也可以通过叶绿素荧光技术进行评估,这是植物生理学中常用的技术[gydF4y2Ba33gydF4y2Ba].QY_Lss是反映PSII光化学效率的一个重要参数[gydF4y2Ba34gydF4y2Ba], qP_Lss表示开放的PSII反应中心数量[gydF4y2Ba35gydF4y2Ba], Rfd_Lss被认为是植物的光合能力,也称为植物活力[gydF4y2Ba36gydF4y2Ba].在本研究中,干旱硬化对qP_Lss、QY_Lss和Rfd_Lss产生了负面影响,在随后的干旱胁迫下,qP_Lss、QY_Lss和Rfd_Lss减少,导致光合速率降低[gydF4y2Ba35gydF4y2Ba].这项研究的结果也与Wang等人一致。[gydF4y2Ba37gydF4y2Ba在干旱启动降低实际光化学效率方面。gydF4y2Ba
叶绿素荧光和MCF图像(图gydF4y2Ba3.gydF4y2Ba),均代表空间异质性。叶绿素荧光参数QY_Lss和qP_Lss在叶尖和叶缘处信号强度降低,表明光合作用受到更大的电位限制,而BF则相反,叶尖和叶缘处信号强度较高。这可能是由于叶绿素分解为中间化合物和酚类化合物的积累[gydF4y2Ba38gydF4y2Ba].因此,酚类化合物在减轻各种非生物胁迫的不利影响方面发挥了作用,并有助于提供对多种胁迫的耐受性[gydF4y2Ba39gydF4y2Ba].gydF4y2Ba
干旱硬化可以缓解干旱胁迫下的氧化损伤gydF4y2Ba
氧化应激有许多生物靶点,但脂类是最具靶向性的一类生物分子[gydF4y2Ba40gydF4y2Ba].植物暴露在非生物胁迫下会产生活性氧(ROS)。ROS攻击细胞内的膜脂质导致脂质过氧化,并由于其细胞毒作用而导致细胞死亡[gydF4y2Ba41gydF4y2Ba].众所周知的胁迫生物标志物丙二醛(MDA)通常用于检测植物的膜脂过氧化[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].先前的研究报告了MDA和H的升高gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba]表明膜损伤。本研究的结果得到[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba因为他们还发现干旱硬化植物的丙二醛水平较低。同样,在本研究中,干旱硬化处理对HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba两个品种对干旱胁迫的响应。这两个品种在H方面的差异gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba其含量可能提示两个品种在相同条件下具有不同的响应机制,可能在两个品种中都具有抗旱性,因为它是具有抗旱性的多种信号通路中的关键分子[gydF4y2Ba45gydF4y2Ba]通过参与气孔关闭[gydF4y2Ba46gydF4y2Ba].gydF4y2Ba
干旱硬化通过增强酶抗氧化防御系统增强抗旱性gydF4y2Ba
活性氧是在正常和应激条件下不可避免产生的物质,而在应激条件下是有毒的。各种研究都强调了抗氧化酶的作用,耐旱性与这些酶的活性有关[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].众所周知,为了确保存活并消除ROS的不利影响,植物会激活抗氧化酶防御系统,以应对ROS含量的升高[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].POD、CAT、APX和GR是酶抗氧化防御系统的主要成分[gydF4y2Ba51gydF4y2Ba]能有效清除活性氧,并在抗旱性方面发挥重要作用[gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba].CAT是第一线抗氧化酶[gydF4y2Ba53gydF4y2Ba], APX和GR是抗坏血酸-谷胱甘肽(AsA-GSH)通路的关键成分,该通路可减轻ROS的有害影响[gydF4y2Ba54gydF4y2Ba].先前的一项研究报道,干旱引发的小麦植株激活了它们的酶抗氧化防御系统,以应对随后的热应激,以减轻氧化损伤[gydF4y2Ba55gydF4y2Ba].本研究的结果得到[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba56gydF4y2Ba因为干旱硬化改善了植物的酶防御系统,从而赋予了抗旱性。综上所述,经干旱硬化处理的H和Y烟草幼苗对MDA和H造成的氧化损伤具有较强的抑制能力gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba从而维持细胞膜的稳定,并有助于减轻干旱胁迫引起的损伤。由此可见,干旱硬化是通过增强植株抗氧化防御系统来提高烟草幼苗抗旱性和抗旱性的有效策略。gydF4y2Ba
干旱硬化对非酶抗氧化防御系统的积极影响导致了耐旱性gydF4y2Ba
非酶抗氧化防御系统在植物生命周期的细胞防御中发挥多种作用。抗坏血酸(AsA)在胁迫和非胁迫条件下对植物生长发育具有多重作用。它有助于植物在应激条件下保持低水平的ROS,因为它被认为是一种通用的非酶抗氧化剂[gydF4y2Ba57gydF4y2Ba].极端不利的环境条件会加剧ROS的产生,从而改变细胞内氧化还原环境;因此,谷胱甘肽保持细胞氧化还原平衡,保护蛋白质不变性,并帮助螯合有毒金属,从而引发适应性反应[gydF4y2Ba58gydF4y2Ba].它也被认为是最强大的非酶抗氧化物质,通过猝灭ROS物种[gydF4y2Ba59gydF4y2Ba].AsA和GSH是一种非酶促抗氧化物质,在预防或降低ROS对作物的危害方面发挥作用。先前的研究记录了AsA和GSH在小麦ROS清除中的作用[gydF4y2Ba60gydF4y2Ba]和马铃薯[gydF4y2Ba61gydF4y2Ba].先前的一项研究表明,干旱启动诱导非抗氧化防御系统(AsA和GSH含量)以减轻ROS的有害影响[gydF4y2Ba62gydF4y2Ba].干旱硬化导致AsA和GSH含量的升高,减轻了ROS的负面影响,这表明干旱硬化在抗旱性和适应干旱胁迫中发挥作用,并且AsA和GSH在植物抗旱性中都发挥作用[gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba].gydF4y2Ba
干旱硬化增加了脯氨酸和可溶性糖的含量,有助于减轻干旱胁迫的不利影响gydF4y2Ba
脯氨酸和可溶性糖(SS)在植物胁迫条件下发挥重要作用。两者都是渗透保护剂、信号分子,保持细胞内氧化还原平衡,清除自由基,稳定细胞结构,最终帮助植物从应激状态中恢复[gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba].脯氨酸积累是植物体内重要的渗透调节因子,在维持膨压和维持渗透平衡中起着关键作用,这是一种与抗旱性有关的适应机制[gydF4y2Ba65gydF4y2Ba,gydF4y2Ba66gydF4y2Ba].可溶性糖在胁迫条件下的植物中也扮演着双重角色,作为信号分子和渗透调节物质[gydF4y2Ba64gydF4y2Ba].多项研究表明,脯氨酸和可溶性糖参与了许多植物的耐旱性和适应性[gydF4y2Ba67gydF4y2Ba,gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba,gydF4y2Ba70gydF4y2Ba].脯氨酸和SS含量随干旱硬化处理时间的不同而不同。脯氨酸含量随着干旱硬化时间的增加而逐渐增加,而SS含量在干旱硬化48 h时达到峰值。本研究结果表明,在干旱胁迫下,两个品种的干旱硬化植株脯氨酸和SS含量均有所增加,与Zhang等的研究结果一致。[gydF4y2Ba19gydF4y2Ba]和杨等人。[gydF4y2Ba20.gydF4y2Ba].渗透调节是植物抗旱性的关键因素和重要策略;脯氨酸和可溶性糖是渗透调节过程中的关键物质[gydF4y2Ba71gydF4y2Ba];因此,由于干旱硬化,脯氨酸和SS含量的升高导致两个烟草品种的渗透调节,这在麻疯树干旱硬化幼苗中也可见到,从而增强了耐旱性[gydF4y2Ba20.gydF4y2Ba].gydF4y2Ba
干旱胁迫下干旱硬化和非干旱硬化幼苗叶片解剖结构的变化gydF4y2Ba
植物的叶片解剖结构会发生一些变化,以改善干旱胁迫的影响。叶肉细胞由栅栏细胞和海绵细胞两层组成;栅栏细胞有助于光合作用过程,提供机械支持,防止水分流失,而海绵组织储存大量的水,并有助于气体交换[gydF4y2Ba19gydF4y2Ba].细胞大小因干旱胁迫而减小[gydF4y2Ba72gydF4y2Ba].在水分胁迫条件下,小细胞是有益的,与先前的研究一样,观察到较低的叶肉细胞密度[gydF4y2Ba73gydF4y2Ba]这可能有助于抗旱性,因为细胞大小减小的植物或组织更能抵抗水分胁迫[gydF4y2Ba74gydF4y2Ba].在随后的干旱胁迫下,干旱硬化导致两个品种的栅栏细胞及其数量减少。结果与Zhang等一致。[gydF4y2Ba19gydF4y2Ba,因为干旱硬化马铃薯发育良好的栅栏组织。gydF4y2Ba
干旱硬化提高了潜在干旱响应基因的表达,以应对干旱胁迫gydF4y2Ba
在本研究中,抗氧化剂相关基因的表达谱,gydF4y2Ba猫gydF4y2Ba,gydF4y2BaAPX1gydF4y2Ba,gydF4y2BaGR2,gydF4y2Ba在干旱胁迫下,两个品种的干旱硬化处理均表现出上调。之前的研究表明gydF4y2Ba猫gydF4y2Ba,gydF4y2BaAPX型,gydF4y2Ba而且gydF4y2BaGRgydF4y2Ba在干旱胁迫下,基因表达上调,从而获得抗旱性[gydF4y2Ba75gydF4y2Ba,gydF4y2Ba76gydF4y2Ba].的上调gydF4y2Ba猫gydF4y2Ba而且gydF4y2BaAPX1gydF4y2Ba基因与两个品种的酶活性一致。干旱诱导的小麦植株表达水平较高gydF4y2BaAPX1gydF4y2Ba[gydF4y2Ba62gydF4y2Ba],从而支持了这项研究的结果。的表达式gydF4y2BaGR2gydF4y2Ba基因和GR酶活性在不同干旱硬化处理中表现不一致。它的不同亚型的存在可能解释了这一点。酶活性的测定导致了不止一种亚型的活性,而在本研究中,只测试了一种亚型的表达水平。这种酶活性与其基因表达之间的矛盾可以用同基因特异性来解释[gydF4y2Ba25gydF4y2Ba],由于基因表达的调控机制复杂,基因表达不能直接与酶活性相关[gydF4y2Ba24gydF4y2Ba].gydF4y2Ba
植物在胁迫条件下脯氨酸积累有助于植物的抗逆性,在胁迫条件下脯氨酸积累起多种作用[gydF4y2Ba77gydF4y2Ba].Dudzaik等人。[gydF4y2Ba78gydF4y2Ba的高表达gydF4y2BaP5CSgydF4y2Ba小麦干旱胁迫下的基因分析。gydF4y2BaP5CS1gydF4y2Ba是在应激条件下参与脯氨酸生物合成的关键基因[gydF4y2Ba79gydF4y2Ba在干旱胁迫下,H和Y品种经干旱硬化处理后,其活性均增强,且与脯氨酸含量测定结果一致。本研究结果由[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba62gydF4y2Ba],以提高脯氨酸含量和表达gydF4y2BaP5CS1gydF4y2Ba基因。同样的,gydF4y2BaADC2gydF4y2Ba调节多胺的生物合成,多胺参与各种非生物胁迫下的应力耐受[gydF4y2Ba80gydF4y2Ba,gydF4y2Ba81gydF4y2Ba].干旱硬化处理增强了基因的表达gydF4y2BaADC2gydF4y2Ba基因。综上所述,在干旱胁迫下,干旱硬化增强了植物的耐旱性,这在一定程度上是由于脯氨酸和多胺生物合成途径的激活。gydF4y2Ba
SnRK2gydF4y2Ba(参与ABA信号转导),gydF4y2BaAREB1gydF4y2Ba,gydF4y2BaDREB2BgydF4y2Ba,gydF4y2BaWRKY6gydF4y2Ba是诱导胁迫相关基因并赋予胁迫耐受性的重要转录因子。不同的遗传途径和这些转录因子的调节参与了各种非生物胁迫耐受和适应[gydF4y2Ba82gydF4y2Ba,gydF4y2Ba83gydF4y2Ba].之前的研究强调了gydF4y2BaSnRK2gydF4y2Ba,gydF4y2BaAREBgydF4y2Ba,gydF4y2Ba含有DREB,gydF4y2Ba而且gydF4y2BaWRKYgydF4y2Ba葡萄抗旱适应性基因研究gydF4y2Ba30.gydF4y2Ba],小麦草[gydF4y2Ba84gydF4y2Ba],及大豆[gydF4y2Ba85gydF4y2Ba].吉田等人。gydF4y2Ba86gydF4y2Ba证明gydF4y2BaAREBgydF4y2Ba下游应激反应转录因子gydF4y2BaSnRK2gydF4y2Ba对渗透胁迫的反应。本研究结果表明,总的来说,不同的干旱硬化处理触发了aba依赖和独立的通路,这些通路可能调节H和Y品种应对干旱胁迫的转录网络,从而导致耐旱性。同样,耐热性gydF4y2Ba拟南芥gydF4y2Ba高羊茅与干旱启动有关gydF4y2BaAREBgydF4y2Ba而且gydF4y2Ba含有DREBgydF4y2Ba基因(gydF4y2Ba87gydF4y2Ba].其他研究也发现aba依赖性和独立通路在干旱胁迫下的调节[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].总的来说,在本研究中,数据显示两个品种在干旱胁迫下的各种干旱硬化处理中所分析基因的表达存在差异,这表明在相同条件下,两个品种利用了不同的分子响应[gydF4y2Ba24gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
综上所述,本研究的结果在生理、生化和基因表达水平上提供了干旱硬化效应的完整框架,其中两个烟草品种在干旱胁迫下分别给予不同的干旱硬化处理和对照。总的来说,干旱硬化处理提高了两个品种的耐旱性和抗旱性。干旱硬化处理,特别是T2和T3,改善了酶和非酶抗氧化防御系统,以减轻氧化损伤的负面影响。T3和T2在两个品种中分别积累了较高水平的脯氨酸和SS,从而有助于实现渗透调节。最后,干旱硬化诱导的耐旱性部分是由于各种胁迫响应基因的表达,通过触发脯氨酸、多胺、aba依赖和独立途径的生物合成途径,以及抗氧化防御相关基因(gydF4y2Ba猫gydF4y2Ba,gydF4y2BaAPX1gydF4y2Ba,gydF4y2BaGR2gydF4y2Ba)对干旱胁迫的反应。gydF4y2Ba
方法gydF4y2Ba
植物材料、生长条件和干旱硬化gydF4y2Ba
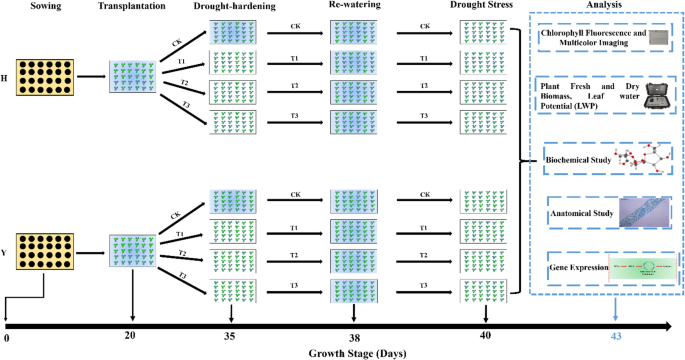
本研究通过对两株水稻进行干旱硬化处理,通过生理、生化和各种基因转录物的表达分析来评价其抗旱性gydF4y2Ba烟草gydF4y2Ba品种为红花大金源(H)和云燕-100 (Y)。红花大金源和云燕-100由云南省烟草农业科学院选育。红花大金源和云烟100经国家烟草品种审定委员会DUS(显著性、均匀性、稳定性)检测和认证,由国家作物种质资源烟草基础设施(中国青岛)保存,国家编号分别为“00000540”和“00004851”。这项研究是在中国青岛中国农业科学院烟草研究所进行的。试验采用浮动养殖系统,在控制条件下进行。漂浮育种是一种将盆栽幼苗或播种在白色泡沫漂浮托盘中的幼苗置于水中或营养液中的系统[gydF4y2Ba88gydF4y2Ba].在26℃、300 μmol m的条件下生长gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba光强度的:光强度的相对湿度为45%,光照和黑暗时间分别为12 h。选择大小一致的植株进行试验。通过抽水(破水)法对两个烟草品种幼苗进行不同程度的干旱硬化处理。将处理植株分为4组,CK(无干旱硬化)、T1(干旱硬化24 h)、T2(干旱硬化48 h)和T3(干旱硬化72 h)。植株经干旱硬化处理后再浇水48 h。最后,再次进行干旱胁迫72 h。样本取自不同处理过的植物,并立即在液氮中冷冻。然后将冷冻样品保存在-80°C下进行进一步分析。整个实验示意图如图所示。gydF4y2Ba10gydF4y2Ba.gydF4y2Ba
测定植物的鲜、干生物量和叶片水势gydF4y2Ba
采集植物样本并立即记录其新鲜重量。测量植株鲜重后,将所有植物样品在80°C的烤箱中干燥48小时并称重。gydF4y2Ba
选取CK、T1、T2和T3烟草品种幼苗中相同位置大小相近的完全展开的幼叶进行LWP的测定。Ψ的gydF4y2Ba叶gydF4y2BaMPa是通过使用PSYPRO水势系统(WESCOR, Logan, UT, USA)将圆形叶盘保存在一个密封的C-52干湿计室中[gydF4y2Ba89gydF4y2Ba].gydF4y2Ba
叶绿素的测定及多色荧光成像gydF4y2Ba
在中国农业科学院青岛烟草研究所实验室室温条件下,采用脉冲调幅叶绿素荧光成像系统(FluorCam FC 800, Photon Systems Instruments, Brno,捷克共和国)。叶片叶绿素荧光参数的测量是在第二次完全展开的离体叶片上进行的。叶片在黑暗中放置20分钟,使叶片的PSII反应中心打开。将叶片置于荧光凸轮下,测定Fo值。Fo后测量Fm,脉冲持续时间为800 ms。然后将叶片置于黑暗中放松17 s。Fm淬火分析在叶片上进行70 s。在70 s时间内,Fp在2 s后测量,Fm_L1在8 s后测量,Fm_L2、Fm_L3、Fm_L4和Fm_Lss分别在恒定100 μmol m下暴露18 s、28 s、48 s和68 s后测量gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba光化性光。光化期结束后,再次暗放松叶片100 s,测量Fm_D1 (28 s)、Fm_D2 (58 s)和Fm_D3 (88 s)。基于这些基本的叶绿素荧光信号,稳态PSII量子产率(ΦPSII_Lss)、qP_Lss(开放反应中心)和Rfd_Lss(荧光衰减比)可以推导为方程[gydF4y2Ba90gydF4y2Ba].gydF4y2Ba
同样,紫外(UV) (320-400 nm) LED面板作为激发源用于多色荧光成像(MFI)。干旱胁迫后,不同处理的干旱硬化幼苗叶片暴露在紫外光下。最后,从整个MFI数据集中获得蓝色荧光(BF)数据及其图像[gydF4y2Ba90gydF4y2Ba].gydF4y2Ba
注:植物生长、叶片水势、叶绿素荧光、多色荧光参数的原始数据均在数据集中gydF4y2Ba1gydF4y2Ba(补充数据)。gydF4y2Ba
生化参数测定gydF4y2Ba
在液氮条件下,从干旱硬化处理的两个烟草品种和对照植物中采集叶片样品。然后将叶片样品保存在-80°C下进行进一步分析。活性氧(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba, MDA),抗氧化酶(POD, CAT, APX, GR)活性,非酶抗氧化物质(AsA, GSH)含量,渗透调节物质(脯氨酸,可溶性糖)含量,采用岛津UV-2600分光光度计(岛津株式会社,京都,日本),按照制造商指南使用商业试剂盒进行分光光度计测定。商业试剂盒购自中国江苏省苏州科敏生物技术有限公司。gydF4y2Ba
注:请参阅在线资源gydF4y2Ba1gydF4y2Ba生化分析中列出试剂细节的文件。请参阅数据集gydF4y2Ba2gydF4y2Ba(补充数据),提供用于生化分析的原始数据。gydF4y2Ba
抗氧化酶的定量gydF4y2Ba
将0.1 g叶片样品在1 mL提取液中接地,然后在4℃下以8000 rpm离心10分钟,测定POD的活性。取50 μL样品上清液和950 μL工作液,充分混合。混合后,在470 nm处记录吸光度。工作溶液由商业试剂盒的试剂1、试剂2和试剂3充分混合制成。1单位POD为2 min和1 min时OD吸光度的变化[gydF4y2Ba91gydF4y2Ba].gydF4y2Ba
H的分解gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba确定CAT活性[gydF4y2Ba91gydF4y2Ba在4°C下,以8000转/分钟的转速将叶片样品置于1 mL萃取液中,离心10分钟,然后在240 nm处读取吸光度1分钟。gydF4y2Ba
分光光度法测定APX活性。取0.1 g叶片样本,在1 mL萃取液中研磨。将叶片样品接地后,匀浆在4°C下以13000 rpm离心20分钟。采集上清液后,取50 μL样品上清液、商业试剂盒700 μL试剂1、100 μL试剂2和100 μL试剂3,充分混合。混合后,记录在290 nm下1 min的OD值。APX活性的一个单位定义为在290 nm催化1 μmol抗坏血酸所需的酶量[gydF4y2Ba92gydF4y2Ba,gydF4y2Ba93gydF4y2Ba].gydF4y2Ba
用0.1 g叶片样品在1 mL萃取液中接地测定GR活性。样品接地后,匀浆在4°C下以8000 rpm离心15分钟。离心后收集上清液。取100 μL样品上清液、750 μL试剂1、100 μL试剂2、50 μL试剂3快速混合,立即在340 nm处读取吸光度。GR活性的一个单位定义为1 μmol NADPH min氧化酶的数量gydF4y2Ba−1gydF4y2Ba[gydF4y2Ba92gydF4y2Ba,gydF4y2Ba93gydF4y2Ba].gydF4y2Ba
非酶抗氧化物质的定量gydF4y2Ba
简单地说,将各种处理的叶片(0.1 g)均质于1 mL提取液中。含样品溶液的离心在4°C下以8000 rpm进行20分钟。采集样品上清液。取200 μL样品上清液,60 μL试剂1、100 μL试剂2、240 μL试剂3、1400 μL dd HgydF4y2Ba2gydF4y2Ba加入O,均匀混合,定量ASA。在420 nm处记录吸光度[gydF4y2Ba94gydF4y2Ba].gydF4y2Ba
测定还原谷胱甘肽(GSH)的方法是称量0.1 g叶片样品,并将其研磨在1 mL萃取液中。研磨后,均匀化溶液在4°C, 8000 rpm下离心10 min。取100 μL样品上清液,与700 μL试剂1、200 μL试剂3混合均匀。OD测量值为412 [gydF4y2Ba94gydF4y2Ba].gydF4y2Ba
脯氨酸和可溶性糖含量的定量gydF4y2Ba
将0.1 g叶片均质于1 mL萃取液中,测定脯氨酸水平。将匀浆置于95°C水浴中10分钟,然后在4°C下以10000 rpm离心10分钟。取500 μL样品上清液,加入500 μL试剂1(醋酸)和500 μL试剂2,充分混合。搅拌完成后,再次放入95°C水浴30分钟。然后将溶液冷却至室温,最后加入1ml试剂3(甲苯)。在520 nm处读取反应混合物的吸光度[gydF4y2Ba95gydF4y2Ba].gydF4y2Ba
用1 mL提取液研磨叶片样品,定量可溶性糖,然后在95°C的水浴中保存10分钟。然后样品在25°C下以8000 rpm离心10 min。收集上清液40 μL ddHgydF4y2Ba2gydF4y2BaO, 20 μL试剂2,200 μL试剂3 (conc。加入硫酸),并在95°C的冰浴中保持溶液混合物10分钟。在620 nm处测定上清液的吸光度[gydF4y2Ba95gydF4y2Ba].gydF4y2Ba
丙二醛(MDA)和过氧化氢(HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba)gydF4y2Ba
综上所述,在1 mL的匀浆提取液中测定0.1 g样品中的MDA含量,并在4°C下以8000 rpm离心10 min。在0.2 mL样品上清液中加入0.6 mL试剂1,95°C水浴30 min。再次将上清液在25°C下以10,000 rpm离心10分钟。在532和600 nm处读取上清液的吸光度[gydF4y2Ba96gydF4y2Ba].gydF4y2Ba
HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba通过加入1 mL提取液(丙酮)将叶片接地,然后在4°C下以8000 rpm离心10分钟来测定含量。收集上清液后,加入100 μL试剂2和200 μL试剂,混合均匀。然后在25°C下,以4000 rpm的转速对溶液混合物进行离心10分钟。离心后,上清被丢弃,沉淀物留在管内。然后加入1ml试剂4。在415 nm处用分光光度法监测反应混合物的吸光度[gydF4y2Ba91gydF4y2Ba].gydF4y2Ba
解剖研究gydF4y2Ba
以2个干旱胁迫烟草品种CK、T1、T2和T3处理的叶片中脉至叶缘中间部位为样本,进行解剖分析。在切除和收集样本后,将这些样本固定在70% FAA(福尔马林:乙酸:酒精)溶液中。样品在不同浓度的乙醇(70-100%)中脱水,并使用不同的二甲苯溶液进行处理。样品用石蜡包埋(60°C) [gydF4y2Ba97gydF4y2Ba].从叶子样本中取出薄片,保存在载玻片上。标本玻片用二甲苯和乙醇溶液复水化并清除,然后用藏红花素O和快速绿色染料染色,然后安装。最后,使用显微镜(徕卡DM 2000, Wetzlar, Germany)对载玻片进行观察,并使用徕卡DMC 2900相机(徕卡,Wetzlar, Germany)进行拍摄。gydF4y2Ba
RNA提取,cDNA合成,qRT-PCRgydF4y2Ba
根据制造商说明书,使用MiniBEST植物RNA提取试剂盒(TaKaRa, Japan)从H和Y品种的干旱硬化和非干旱硬化烟叶的三个生物重复中提取总RNA。RNA浓度由纳米光度计P330 (Implen, Munich, Germany)测定,其质量由琼脂糖凝胶电泳评估。提取RNA后,按照制造商协议,通过PrimeScript 1st Strand cDNA Synthesis kit (TaKaRa, Japan)合成cDNA。qRT-PCR随后在Applied Biosystems QuantStudio3实时PCR仪(Applied Biosystems)上进行,总反应量为20 μL,使用SYBER Green Master Mix (TaKaRa,志贺,日本)。qRT-PCR数据用2gydF4y2Ba-gydF4y2Ba△gydF4y2Ba△gydF4y2BaCTgydF4y2Ba方法(gydF4y2Ba98gydF4y2Ba].基因特异性引物(在线资源gydF4y2Ba2gydF4y2Ba)使用PRIMER3 (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/tools/primer-blast/gydF4y2Ba).的gydF4y2Ba肌动蛋白gydF4y2Ba作为内控基因的参考。qRT-PCR分析的原始数据在数据集中gydF4y2Ba3.gydF4y2Ba(补充数据)。gydF4y2Ba
统计分析gydF4y2Ba
数据采用statistic8.1 (Analytical Software, Tallahassee, FL, USA)中的单向方差分析进行统计分析。两个品种在干旱硬化处理和对照处理之间的平均值差异以三个重复的平均值±SD (Standard deviation)表示。平均值的显著变化显示在gydF4y2BapgydF4y2Ba< 0.05或gydF4y2BapgydF4y2BaLSD检验< 0.01水平(差异不显著)。使用OriginPro 9.1 (OriginLab公司,Northampton, MA, USA)绘制图表。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在本研究过程中产生或分析的所有数据都包含在本文中(及其补充信息文件)。gydF4y2Ba
缩写gydF4y2Ba
- APX型:gydF4y2Ba
-
抗坏血酸盐过氧化物酶gydF4y2Ba
- AsA:gydF4y2Ba
-
抗坏血酸gydF4y2Ba
- 男朋友:gydF4y2Ba
-
蓝色荧光gydF4y2Ba
- 猫:gydF4y2Ba
-
过氧化氢酶gydF4y2Ba
- 互补脱氧核糖核酸:gydF4y2Ba
-
互补脱氧核糖核酸gydF4y2Ba
- CK:gydF4y2Ba
-
控制或不进行干旱硬化gydF4y2Ba
- 女友:gydF4y2Ba
-
绿色荧光gydF4y2Ba
- 谷胱甘肽:gydF4y2Ba
-
减少谷胱甘肽gydF4y2Ba
- H:gydF4y2Ba
-
HongHuaDaJinYuangydF4y2Ba
- 圆荚体:gydF4y2Ba
-
过氧化物酶gydF4y2Ba
- 存在:gydF4y2Ba
-
实时定量聚合酶链反应gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- SOD:gydF4y2Ba
-
超氧化物歧化酶gydF4y2Ba
- T1:gydF4y2Ba
-
干旱硬化24小时gydF4y2Ba
- T2:gydF4y2Ba
-
干旱硬化48小时gydF4y2Ba
- T3:gydF4y2Ba
-
干旱硬化72 hgydF4y2Ba
- Y:gydF4y2Ba
-
Yun yan - 100gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
苏亚雷斯JC,桑托斯CS,卡瓦略SMP,平塔多MM,瓦斯孔塞洛斯MW。在气候变化下保护作物的营养品质:重要性和策略。植物学报。2019;43(1-2):1-26。gydF4y2Ba
- 2.gydF4y2Ba
Raza A, Razzaq A, Mehmood SS,邹X,张旭,吕勇,等。气候变化对作物适应的影响和应对其结果的策略:综述。植物。2019;8(2):34。gydF4y2Ba
- 3.gydF4y2Ba
Xoconostle-Cazares B, Ramirez-Ortega FA。农作物的耐旱性。中国植物学报,2010;5(5):241-56。gydF4y2Ba
- 4.gydF4y2Ba
胡赛恩·哈,胡赛恩·S,哈利克·A,阿什拉夫·U,安朱姆·SA,曼·S,等。作物植物的寒冷和干旱胁迫:影响,交叉对话,和潜在的管理机会。前沿植物科学,2018;9(4):1-21。gydF4y2Ba
- 5.gydF4y2Ba
法哈德,巴杰瓦AA,纳齐尔U, Anjum SA,法鲁克A, Zohaib A,等。干旱和热胁迫下的作物生产:植物反应和管理选择。前沿植物科学,2017;8(6):1-16。gydF4y2Ba
- 6.gydF4y2Ba
Fathi A, Tari DB。干旱胁迫对植物的影响及其机制。中国生物医学工程学报(自然科学版),2016;gydF4y2Ba
- 7.gydF4y2Ba
刘志强,李志强,李志强,等。地中海观赏植物对干旱胁迫的响应。Horticulturae。2019;5(1):1 - 20。gydF4y2Ba
- 8.gydF4y2Ba
Khan A, Pan X, Najeeb U, Tan DKY, Fahad S, Zahoor R,等。应对干旱:胁迫和适应机制,以及通过棉花作为植物胁迫恢复和适应性的重要组成部分的文化和分子替代品进行管理。生物学报,2018;51(1):1 - 17。gydF4y2Ba
- 9.gydF4y2Ba
乌拉A,孙浩,杨霞,张霞。棉花抗旱对策:提高单株产量。中国生物工程学报,2017;15(3):271-84。gydF4y2Ba
- 10.gydF4y2Ba
法鲁克M,瓦希德A,小林N,巴斯拉SM,藤田DB。植物干旱胁迫:影响、机制与管理。农业可持续发展,2009;29(1):185-212。gydF4y2Ba
- 11.gydF4y2Ba
维拉-萨尔瓦多P, Peñuelas JL,雅各布斯DF。氮营养和干旱硬化对小麦抗逆性的影响相反gydF4y2Ba松果体pineagydF4y2Bal .幼苗。树物理学报,2013;33(2):221-32。gydF4y2Ba
- 12.gydF4y2Ba
托马斯DS。生存和生长的干旱硬化gydF4y2Ba桉树pilularisgydF4y2BaSm。幼苗和营养插枝。2009; 38:245-59。gydF4y2Ba
- 13.gydF4y2Ba
可控干旱胁迫对番茄幼苗冷硬能力的影响主要表现在酚代谢、抗氧化酶活性、渗透酶浓度和脱落酸积累等方面。科学通报。2018;229:167-74。gydF4y2Ba
- 14.gydF4y2Ba
Ghanbari F, Kordi S.干旱和低温硬化预处理增强了黄瓜幼苗的冷胁迫耐受性。植物学报,2019;18(2):29-37。gydF4y2Ba
- 15.gydF4y2Ba
kacieng, Juknys R, januuskaitieni .氧化应激在春大麦对不同重金属交叉适应中的作用。土壤科学进展,2017,26(3):344 - 344。gydF4y2Ba
- 16.gydF4y2Ba
黄霞,刘勇,李娟,肖欣,陈勇,殷霞,冯东。三峡库区消落带桑树幼苗硬化后对夏季干旱的响应。环境科学学报,2012;20(10):7103-7111F。gydF4y2Ba
- 17.gydF4y2Ba
Cyriac D, Hofmann RW, Stewart A, Sathish P, Winefield CS, Moot DJ。多年生黑麦草长期耐旱性的种内差异。公共科学图书馆,2018;13(4):1-17。gydF4y2Ba
- 18.gydF4y2Ba
李志强,李志强,杨晓明,等。植物形态生理属性变化的研究进展gydF4y2Ba蓝桉gydF4y2Ba植物对不同干旱硬化处理的反应。电子生物技术,2008;11(2):1-10。gydF4y2Ba
- 19.gydF4y2Ba
张硕,徐小峰,孙玉明,张建林,李长忠。干旱硬化对干旱胁迫下马铃薯幼苗抗性生理的影响综合农业学报,2018;17(2):336-47。gydF4y2Ba
- 20.gydF4y2Ba
杨世林,陈凯,王世生,龚明。渗透调节是干旱硬化诱导植物耐旱性的关键因素gydF4y2Ba麻风树gydF4y2Ba.生物工程学报。2015;59(3):529-36。gydF4y2Ba
- 21.gydF4y2Ba
Marcos FCC, Silveira NM, Mokochinski JB, Sawaya ACHF, Marchiori PER, Machado EC,等。甘蔗的耐旱性因先前的水分亏缺而提高。中国生物医学工程学报。2018;23(2):329 - 329。gydF4y2Ba
- 22.gydF4y2Ba
De Diego N, Saiz-Fernández I, Rodríguez JL, Pérez-Alfocea P, Sampedro MC, Barrio RJ,等。代谢产物和激素参与了辐射松干旱硬化的种内变异。中国植物学报。2015;38(2):344 - 344。gydF4y2Ba
- 23.gydF4y2Ba
可汗R,周平,马X,周林,吴勇,乌拉Z,等。转录组分析、生物化学和生理分析为植物抗旱性研究提供了新的思路gydF4y2Ba烟草gydF4y2BaL.基因学报,2019;10(12):1041。gydF4y2Ba
- 24.gydF4y2Ba
Harb A, Awad D, Samarah N.大麦抗氧化酶基因表达及活性研究(gydF4y2Ba大麦芽gydF4y2Bal)受控制的严重干旱。植物学报。2015;10(1):109-16。gydF4y2Ba
- 25.gydF4y2Ba
Furlan AL, Bianucci E, Tordable MDC, Castro S, Dietz KJ。干旱和复水循环过程中花生结节抗氧化酶活性和基因表达模式植物功能生物学,2014;41(7):704-13。gydF4y2Ba
- 26.gydF4y2Ba
苏霞,魏峰,霍勇,夏政。渐进式干旱胁迫下两种不同烤烟基因型的生理和分子比较分析。中国植物科学,2017;8:1-13。gydF4y2Ba
- 27.gydF4y2Ba
水分亏缺胁迫下两个甘蓝型油菜品种BnSRK2D基因的差异表达。分子生物学杂志,2014;3(4):241-51。gydF4y2Ba
- 28.gydF4y2Ba
张海涛,李志强,李志强,等。干旱胁迫揭示了吉媛桃生理、生化和基因表达的变化(gydF4y2Ba碧桃gydF4y2BaL)品种。植物学报。2018;13(1):83-90。gydF4y2Ba
- 29.gydF4y2Ba
哈桑穆木,马峰,卓汉,李峰,沈辉,陈勇,等。棉花品种抗旱性的分子和生理生化特性研究。中华分子化学杂志,2018;19(9):1-23。gydF4y2Ba
- 30.gydF4y2Ba
Zandkarimi H, Ebadi A, Salami SA, Alizade H, Baisakh N.干旱和盐胁迫下葡萄AREB/ABF和DREB/CBF基因表达谱分析(gydF4y2Ba葡萄gydF4y2Bal .)。科学通报。2015;10(7):e0134288。gydF4y2Ba
- 31.gydF4y2Ba
Makonya GM, Ogola JBO, Muasya AM, Crespo O, Maseko S, Valentine AJ,等。间歇性水分供给诱导一些耐热鹰嘴豆基因型的干旱启动反应。作物科学2020;60:2527-42。gydF4y2Ba
- 32.gydF4y2Ba
施瑞林,冯德克罗内,王志强,张志强。干旱对温带树种叶片水分吸收能力的影响。森林。2019;10(7):1 - 11。gydF4y2Ba
- 33.gydF4y2Ba
Murchie EH, Lawson T.叶绿素荧光分析:良好实践指南和理解一些新的应用。中国机械工程学报,2013;29(3):389 - 397。gydF4y2Ba
- 34.gydF4y2Ba
Maxwell K, Johnson GN。Chl_fluorescence -一个实用指南。中国生物医学工程学报,2000;29(4):529 - 529。gydF4y2Ba
- 35.gydF4y2Ba
杨晓明,张晓明,张晓明。盐胁迫对生菜生长的影响。传感器。2019;19(21):4814。gydF4y2Ba
- 36.gydF4y2Ba
Lichtenthaler HK, Buschmann C, Knapp M.如何用PAM荧光计正确确定叶片的不同叶绿素荧光参数和叶绿素荧光减少比RFd。43 Photosynthetica。2005;(3):379 - 93。gydF4y2Ba
- 37.gydF4y2Ba
王霞,Vignjevic M,刘峰,Jacobsen S,姜东,Wollenwebber B.春小麦营养生育期干旱启动对籽粒灌浆期干旱和热胁迫的耐受力提高。植物学报,2015;gydF4y2Ba
- 38.gydF4y2Ba
朗M,利希滕塞勒HK,索文斯卡M,黑泽尔F, Miehé JA。植物叶片水分和温度胁迫的荧光成像。植物科学进展。1996;29(5):529 - 529。gydF4y2Ba
- 39.gydF4y2Ba
沙尔玛,沙赫扎德,郑波,郑波。非生物胁迫下植物苯丙类途径的响应及多酚的作用。分子。2019;24(13):22页。gydF4y2Ba
- 40.gydF4y2Ba
陈志强,陈志强,陈志强,等。丙二醛作为氧化应激毒性分子和生物标志物的研究进展。中华心血管病杂志,2005;15(4):316-28。gydF4y2Ba
- 41.gydF4y2Ba
阿亚拉A, Muñoz MF, Argüelles S.脂质过氧化:丙二醛和4-羟基-2-壬烯醛的产生、代谢和信号机制。《氧化医学杂志》2014;2014:360438。gydF4y2Ba
- 42.gydF4y2Ba
Yonny ME, Torressi AR, Nazareno MA, Cerutti S.开发了一种新型,灵敏,选择性和快速的方法,通过超高性能液相色谱-串联质谱法测定甜瓜植物叶片中的丙二醛。化学学报。2017;2017:4327954。gydF4y2Ba
- 43.gydF4y2Ba
曹颖,罗强,田勇,孟fgydF4y2Ba菊花米拉gydF4y2Ba(Koehne) Yü等陆根。中国生物医学工程学报,2017;17(1):1 - 16。gydF4y2Ba
- 44.gydF4y2Ba
杨慧,赵玲,赵松,王娟,石慧。烟草LY1306干旱胁迫响应的生化和转录组分析。科学通报2017;7(1):1 - 10。gydF4y2Ba
- 45.gydF4y2Ba
Hossain MA, Fujita M.过氧化氢激发芥末的耐旱性(gydF4y2Ba芸苔属植物junceagydF4y2Bal .)幼苗。植物基因性状。2013;4(20):109-23。gydF4y2Ba
- 46.gydF4y2Ba
李静,李勇,尹忠,姜杰,张敏,郭旭,等。OsASR5通过与ABA和H相关的气孔关闭途径增强抗旱性gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba大米信号。中国生物工程学报,2017;15(2):183-96。gydF4y2Ba
- 47.gydF4y2Ba
任杰,孙丽兰,张启勇,宋晓霞。抗旱性与植物抗氧化酶活性有关gydF4y2Ba子房扁平云gydF4y2Ba幼苗。生物医学学报,2016;2016:9851095。gydF4y2Ba
- 48.gydF4y2Ba
李志刚,李志刚,李志刚,李志刚。植物抗氧化系统在抗旱性中的作用。抗氧化剂。2019;8(4):94。gydF4y2Ba
- 49.gydF4y2Ba
杨晓东,张志刚,张志刚,等。环境胁迫下植物活性氧(ROS)清除剂抗氧化剂的研究进展。环境科学学报,2014;2:1-13。gydF4y2Ba
- 50.gydF4y2Ba
郭晓明,王晓明,王晓明,等。水稻谷胱甘肽还原酶基因的全基因组分析gydF4y2Ba拟南芥gydF4y2Ba.植物信号行为学。2013;8(2):1-7。gydF4y2Ba
- 51.gydF4y2Ba
Ahmad R, Hussain S, Anjum M, Khalid M, Saqib M, Zakir I,等。植物非生物胁迫耐受性。在:Hasanuzzaman M, Hakeem KR, Nahar K, Alharby HF,编辑。植物非生物胁迫耐受性:农艺、分子和生物技术方法。湛:施普林格国际出版;2019.1 - 490页。gydF4y2Ba
- 52.gydF4y2Ba
Khaleghi A, Naderi R, Brunetti C, Maserti BE, Salami SA, Babalar M.对干旱胁迫的形态、理化和抗氧化响应。科学通报2019;9(1):1 - 12。gydF4y2Ba
- 53.gydF4y2Ba
伊戈达罗,阿金罗伊,OA。第一线防御抗氧化剂-超氧化物歧化酶(SOD),过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPX):它们在整个抗氧化防御网格中的基本作用。中华医学杂志2017;54(4):287-93。gydF4y2Ba
- 54.gydF4y2Ba
Hasanuzzaman M, Borhannuddin Bhuyan MHM, Anee TI, Parvin K, Nahar K, Al Mahmud J,等。抗坏血酸-谷胱甘肽通路在减轻非生物胁迫下植物氧化损伤中的调控。抗氧化剂。2019;8(9):384。gydF4y2Ba
- 55.gydF4y2Ba
张旭,王旭,钟娟,朱强,王旭,蔡杰,等。干旱启动诱导冬小麦后代对花后高温的耐温性。环境实验机器人,2016;127:26-36。gydF4y2Ba
- 56.gydF4y2Ba
Abdallah MB, Methenni K, Nouairi I, Zarrouk M, Youssef NB。干旱启动能改善对干旱敏感的橄榄品种后续更严重的干旱。gydF4y2BaChetouigydF4y2Ba.科学通报。2017;221:43-52。gydF4y2Ba
- 57.gydF4y2Ba
抗坏血酸——一种潜在的氧化剂清除剂及其在植物发育和非生物胁迫耐受中的作用。中国植物科学,2017;8:613。gydF4y2Ba
- 58.gydF4y2Ba
王志刚,王志刚,王志刚。谷胱甘肽在植物抗环境胁迫中的生物合成和生理作用。中国生物医学工程学报,2017;23(2):249-68。gydF4y2Ba
- 59.gydF4y2Ba
谷胱甘肽稳态和信号传递控制中生物合成、区室和运输之间的相互作用。中国机械工程学报,2002;29(3):344 - 344。gydF4y2Ba
- 60.gydF4y2Ba
康纳-乔普拉R, Selote DS。对干旱胁迫的适应使抗旱小麦品种在田间条件下具有抗氧化能力。环境科学学报,2007;26(2):366 - 366。gydF4y2Ba
- 61.gydF4y2Ba
王志刚,王志刚,王志刚,王志刚,等。聚乙二醇介导的红薯抗渗透胁迫及活性氧清除机制研究。科学通报2020;10(1):1 - 9。gydF4y2Ba
- 62.gydF4y2Ba
王旭,张旭,陈震,王旭,蔡娟,周强,等。亲本干旱启动增强小麦后代对花后干旱的耐受性。中国植物科学,2018;9:261。gydF4y2Ba
- 63.gydF4y2Ba
脯氨酸:植物抗非生物胁迫的关键因素。生物工程学报。2015;59(4):609-19。gydF4y2Ba
- 64.gydF4y2Ba
Rosa M, Prado C, Podazza G, Interdonato R, González JA, Hilal M,等。可溶性糖-代谢,感应和非生物应激。植物信号行为学。2009;4(5):388-93。gydF4y2Ba
- 65.gydF4y2Ba
鲍刚,唐伟,安强,刘勇,田娟,赵楠,等。冻融、酸雨和除冰盐复合胁迫对紫花苜蓿幼苗的生理影响。中国生物医学工程学报,2020;20(1):1 - 9。gydF4y2Ba
- 66.gydF4y2Ba
Singh M, Kumar J, Singh S, Singh VP, Prasad SM。渗透保护剂在提高植物耐盐性和耐旱性中的作用综述。环境科学与生物技术,2015;14(3):407-26。gydF4y2Ba
- 67.gydF4y2Ba
李伟,王勇,张勇,王锐,郭忠,谢哲。干旱胁迫对兰州百合形态、生理及糖含量的影响(gydF4y2Ba百合davidiigydF4y2Bavar.单色的)。植物物理学报,2020;42(8):1-11。gydF4y2Ba
- 68.gydF4y2Ba
杨丽丽,杨林,杨霞,张涛,兰艳梅,赵颖,等。干旱胁迫诱导柴胡叶片黄酮类化合物和柴胡皂苷的生物合成。植物化学。2020;177:112434。gydF4y2Ba
- 69.gydF4y2Ba
张强,刘宏,吴霞,王伟。基于生理、生化和转录组分析的玉米耐旱突变体耐旱机制鉴定。中国生物医学工程学报。2020;20(1):315。gydF4y2Ba
- 70.gydF4y2Ba
李永平,李永平,李永平,李永平。不同地理位置的植物的耐寒性、相容溶质和多胺的比较gydF4y2BaThellungiellagydF4y2Basp.和gydF4y2Ba拟南芥gydF4y2Ba登记入册。BMC植物生物学2012;12:131。gydF4y2Ba
- 71.gydF4y2Ba
杜军,陈霞,李伟,高强。干旱胁迫渗透调节机制及提高植物抗旱性的基因工程策略。中国种马。2004;6(2):56-62。gydF4y2Ba
- 72.gydF4y2Ba
刘志刚,刘志刚,刘志刚,刘志刚。玉米叶片膨胀速率、细胞分裂速率和细胞大小的空间分布:土壤水分状态、蒸发需求和温度的综合影响。中国生物医学工程学报,2000;26(3):344 - 344。gydF4y2Ba
- 73.gydF4y2Ba
陈志,徐娟,王峰,王玲,徐忠。两个不同烟草品种对水分胁迫的形态生理和蛋白质组学响应。科学通报2019;9(1):1 - 15。gydF4y2Ba
- 74.gydF4y2Ba
Martínez干旱胁迫对6个豇豆品种渗透调节、细胞壁弹性和细胞体积的影响(gydF4y2Ba菜豆gydF4y2Bal .)。农学通报。2007;26(1):30-8。gydF4y2Ba
- 75.gydF4y2Ba
Avashthi H, Pathak RK, Gaur VS, Singh S, Gupta VK, Ramteke PW,等。比较分析了手指小米、水稻、高粱和谷子的ros清除基因家族,揭示了抗氧化活性和抗旱性提高的潜在靶点。网络模型肛门愈合信息生物信息学。2020;9:33。gydF4y2Ba
- 76.gydF4y2Ba
王晓燕,王晓燕,王晓燕,等。干旱和高温胁迫对植物生理生化参数、抗氧化反应和基因表达的影响gydF4y2Ba茄属植物lycopersicumgydF4y2Ba.3生物技术,2020;10(5):1-18。gydF4y2Ba
- 77.gydF4y2Ba
杨晓东,王志强,王志强,王志强,等。脯氨酸在环境变化下的作用。植物信号行为研究。2012;7(11):1456-66。gydF4y2Ba
- 78.gydF4y2Ba
杜ziak K, Zapalska M, Börner A, Szczerba H, Kowalczyk K, Nowak M.短期渗透胁迫下小麦氧化应激反应及信号转导相关基因表达分析。科学通报2019;9(1):1 - 14。gydF4y2Ba
- 79.gydF4y2Ba
沙玛S, Verslues PE。在低水势和胁迫恢复过程中,独立于ABA或脯氨酸反馈的机制在脯氨酸代谢的转录调控中起着主要作用。植物细胞环境学报。2010;33(11):1838-51。gydF4y2Ba
- 80.gydF4y2Ba
杨志强,李志强,李志强,等。植物多胺及其抗逆性研究。植物信号行为学。2010;5(1):26-33。gydF4y2Ba
- 81.gydF4y2Ba
杨洁,张洁,刘凯,王志,刘磊。多胺在水稻抗旱性中的作用。应用物理学报,2007;58(6):1545-55。gydF4y2Ba
- 82.gydF4y2Ba
张志刚,徐平,张志刚,张志刚。植物抗逆性的转录因子及其在作物改良中的应用。基因(巴塞尔)。2019; 10(10): 1。gydF4y2Ba
- 83.gydF4y2Ba
王晓明,王晓明,王晓明,等。DREB/ERF、MYB、NAC和WRKY转录因子在转基因植物非生物和生物胁迫中的应用。植物细胞组织器官,2018;132:1-25。gydF4y2Ba
- 84.gydF4y2Ba
Sheikh-Mohamadi MH, Etemadi N,阿拉伯MM, Aalifar M,阿拉伯M.抗坏血酸-谷胱甘肽通路相关基因在干旱和高温胁迫下的响应。科学通报。2018;242:195-206。gydF4y2Ba
- 85.gydF4y2Ba
Dias LP, de Oliveira-Busatto LA, Bodanese-Zanettini MH.大豆的差异表达[gydF4y2Ba大豆gydF4y2Ba(l)WRKY基因对水分亏缺的反应。植物物理与生物化学,2016;gydF4y2Ba
- 86.gydF4y2Ba
吉田T,藤田Y,丸山K,茂上J, Todaka D, Shinozaki K,等。四种拟南芥AREB/ABF转录因子主要在渗透胁迫下脱落酸信号转导中SnRK2激酶下游基因表达中起作用。植物细胞环境学报。2015;38(1):35-49。gydF4y2Ba
- 87.gydF4y2Ba
张欣,王霞,庄林,高勇,黄斌。脱落酸介导干旱启动对高羊茅耐热性的影响(gydF4y2Ba季gydF4y2Ba),gydF4y2Ba拟南芥gydF4y2Ba.物理植物。2019;167:488-501。gydF4y2Ba
- 88.gydF4y2Ba
王超,赵颖,顾鹏,邹峰,孟l,宋伟,等。生长素参与了干旱胁迫下烟草幼苗侧根的形成。植物生长学报,2018;37(2):539-49。gydF4y2Ba
- 89.gydF4y2Ba
Saruhan Güler N, sa土耳其姆A, Demiralay M, kadio土耳其姆A, Saruhan Güler N, sa土耳其姆A,等。在干旱胁迫下,异体溶质和同质体溶质浓度有助于大豆基因型的渗透调节。中国生物医学杂志,2012;36:151-60。gydF4y2Ba
- 90.gydF4y2Ba
姚洁,孙东,岑辉,徐辉,翁辉,袁峰,等。表现型的gydF4y2Ba拟南芥gydF4y2Ba利用动态叶绿素荧光和多色荧光成像研究干旱胁迫响应。前沿植物科学,2018;9:1-15。gydF4y2Ba
- 91.gydF4y2Ba
岳旭,张刚,赵忠,岳俊,蒲霞,隋敏,等。一种冷冻植物转录因子CbABF1使烟草具有耐寒性和耐旱性。前沿植物学报2019;10:1-14。gydF4y2Ba
- 92.gydF4y2Ba
杨志强,杨志强,李志强,等。大豆的耐旱性(gydF4y2Ba大豆gydF4y2Ba通过改善光合特性和有效的抗氧化酶活性在裂根系统下。前沿物理。2019;10:786。gydF4y2Ba
- 93.gydF4y2Ba
Salah A,詹敏,曹超,韩艳,凌玲,刘忠,等。γ-氨基丁酸对涝渍玉米幼苗叶绿体超微结构、抗氧化能力及生长发育的促进作用。科学通报2019;9(1):1 - 19。gydF4y2Ba
- 94.gydF4y2Ba
张磊,吴敏,滕勇,贾松,于东,魏涛,等。红景天谷胱甘肽过氧化物酶5 (RcGPX5)基因的过表达提高了红景天的耐旱性gydF4y2Ba丹参gydF4y2Ba.前沿植物学报2019;9:1-16。gydF4y2Ba
- 95.gydF4y2Ba
魏涛,王勇,刘建华。比较转录组分析揭示了三叶橙叶片和根的协同和不同的防御途径(gydF4y2Ba枳壳trifoliatagydF4y2Ba)耐盐性增强的同四倍体。Hortic Res. 2020;7:88。gydF4y2Ba
- 96.gydF4y2Ba
于红,景勇,张旭,Qayum A, Gantumur MA, Bilawal A,等。细胞内谷胱甘肽和相关抗氧化酶的比较:两种糖基化乳清水解物的影响。生物化学。2020;97:80-6。gydF4y2Ba
- 97.gydF4y2Ba
王晓燕,王晓燕,王晓燕,等gydF4y2Ba黄芪gombiformisgydF4y2Ba球形顶饰。在干旱胁迫下。中国生物医学杂志,2014;9(12):1215-25。gydF4y2Ba
- 98.gydF4y2Ba
Livak KJ, Schmittgen TD。相关基因表达数据的分析采用实时定量PCR和2gydF4y2Ba——ΔΔCTgydF4y2Ba方法。方法。2001;25(4):402 - 8。gydF4y2Ba
致谢gydF4y2Ba
我们感谢郭永峰博士、徐娜博士和张岩博士就本研究进行的专题和智力讨论。我们也感谢我们实验室的所有同事和技术人员为我们提供了有益的讨论和技术援助。gydF4y2Ba
资金gydF4y2Ba
本工作由中国农业科学院农业科技创新计划项目(astp - tric03)和中央公益性科研单位基础研究基金(1610232017008)资助。资助机构没有在研究的实验设计、结果分析或手稿写作中发挥作用,但为手稿提供了财政支持。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
SW和XM构想、设计并监督实验;RK进行了实验,确定了图形和表格及其解释,并撰写了手稿;XW和LX进行了qRT-PCR研究;YW进行了解剖研究;SS和AS对手稿进行了审阅和编辑。所有作者均已阅读并批准最终稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1gydF4y2Ba
:gydF4y2Ba在线资源1gydF4y2Ba.试剂的列表。gydF4y2Ba在线资源2gydF4y2Ba.qRT-PCR基因特异性引物列表。gydF4y2Ba数据集1gydF4y2Ba.植物生长、叶片水势、叶绿素荧光和多色荧光分析的原始数据。gydF4y2Ba数据集2gydF4y2Ba.生化分析的原始数据。gydF4y2Ba数据集3gydF4y2Ba.qRT-PCR分析原始数据。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
汗,R,马,X,沙,S。gydF4y2Baet al。gydF4y2Ba干旱硬化提高植物的耐旱性gydF4y2Ba烟草gydF4y2Ba在生理、生化和分子水平上。gydF4y2BaBMC植物生物学gydF4y2Ba20.gydF4y2Ba486(2020)。https://doi.org/10.1186/s12870-020-02688-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-020-02688-7gydF4y2Ba
关键字gydF4y2Ba
- 烟草gydF4y2Ba
- 烟草gydF4y2Ba
- Drought-hardeninggydF4y2Ba
- 耐旱gydF4y2Ba
- 品种gydF4y2Ba
- 抗氧化酶gydF4y2Ba
- 基因表达gydF4y2Ba
- SnRK2gydF4y2Ba
- AREBgydF4y2Ba
- 含有DREBgydF4y2Ba