抽象的
背景
表皮蜡质在保护植物免受干旱胁迫方面起着重要作用。在拟南芥WRI4.通过调节脂肪酸和切割蜡的生物合成来改善耐旱性。Cypetus esculentus.(铁荸荠)是在热带和温带地区,以及在较冷的区域发现了一个艰难的杂草。在目前的研究中,我们报告的分子克隆WRI4.- 从中获得基因Cypetus esculentus.及其拟南芥的功能性鉴定。
结果
使用种族PCR,全长WRI.- 从黄色Nutsege扩增。系统发育分析和氨基酸比较表明它是一个WRI4.例如基因。根据组织特异性表达数据,最高表达WRI4.在叶子中发现了基因,然后是根和块茎。表达Nutsedge的转基因拟南芥植物WRI4.- 样基因表现出改善的干旱胁迫耐受性。转基因系显示出显着降低的气孔导率,蒸腾速率,叶绿素浸出,防水和改善的用水效率(WUE)。在没有干旱胁迫的情况下,转基因系和WT之间的脂肪酸生物合成的关键基因的表达在转基因系中没有显着差异,而转基因系的转基因系比wt显着高。PEG模拟的干旱胁迫显着增加了脂肪酸的关键基因的表达以及转基因拟南芥系中的蜡生物合成,但不在WT植物中。与在控制下的WT和干旱胁迫条件下,与基因表达数据一致,在转基因系的茎和叶片中显着高于转基因系的茎和沉积。
结论
WRI4.- 从中获得基因Cypetus esculentus.可能通过促进有切割蜡生物合成和沉积来改善拟南芥中的耐旱性。这反过来降低了叶绿素浸出,气孔电导,蒸腾速率,水分损失,并在干旱胁迫条件下提高了水使用效率。所以,CeWRI4类基因可能是提高作物抗旱性的一个很好的候选基因。
背景
陆生植物的空中表面覆盖一层角质层蜡,保护植物不受病菌感染[1,昆虫攻击[2], 紫外线辐射 [3.,4干旱压力[5,6,7,8,9,10.].切割蜡是一种复杂的混合物,主要由非常长链脂肪酸(VLCFA)及其衍生物组成[11.,12.,13.].第一个C16和C18脂肪酸在塑性中合成,然后水解并出口细胞质。合成的C16和C18辅酶(COA)伸长到VLCFA中,然后通过醇形成途径,通过烷烃,烷烃,仲醇和酮改性为伯醇和蜡酯,通过烷烃形成途径[14.,15.].表皮蜡质生物合成的调控发生在转录[6,14.,16.,17.,18.,19.],后术说明[20.,21.]和后期后期水平[22.].为了提高植物器官的表皮蜡质含量,最终目的是提高对干旱胁迫的耐受性,人们做了许多尝试[6,16.,18.,23.,24.,25.,26.].
AP2(Apetala2)/ ereBP(乙烯响应元结合蛋白)转录因子含有单个或两个AP2 / ERF结构域,并且参与各种生物和非生物应激反应[27.].Cernac和Penning(2004)克隆的拟南芥WRI1基因被置于AP2亚家族中,因为它含有两个AP2 / eREAB结构域[28.].所述WRI1类似基团由四个成员组成,即WRI1(At3g54320),WRI2(At2g41710),WRI3(At1g16060)和WRI4(At1g79700)。先前的WRI1类似基团被认为是ANT状基团的一部分[29.],而其他人认为它是AP2亚家族的单晶组[30.].类wr1组的三个成员,即wr1、wr3和wr4,在激活脂肪酸生物合成中发挥作用[28.,30.],而第四个成员wr4则通过调控茎表皮蜡质生物合成参与拟南芥的耐旱性[10.].
Cypetus esculentus.(黄豆苔)是莎草科的一种作物,广泛分布在全球大部分地区。它被认为是一种原产于非洲和亚洲热带地区的作物[31.,32.,33.].在亚洲、欧洲、非洲和北美洲的热带和亚热带地区也有发现[34.,35.].黄豆的块茎和种子很容易散播,并与农作物种子混在一起。36.,37.,38.].作为其块茎中糖,蛋白质,淀粉,纤维,矿物质,维生素和富含石油,正在努力开发油莎草作为一种新的油料作物[39.,40,41.].在目前的研究中,我们报告了一个克隆和表征WRI4.- 从中获得基因香esculentus (CeWRI4).在拟南芥中引入了基因的功能表征。
结果和讨论
WRI4 nutsedge基因的性质
在这项研究中,首先是490 BP片段对应于NutsEdge的保守区域WRI.利用退化引物,RT-PCR扩增类基因(附文件)1).随后,通过使用5'-和3'-rame PCR获得1423bp全长片段(附加文件1).扩增的基因包含一个1098 bp的ORF, 5'UTR(非翻译区)和3'UTR(附加文件)2).保守域分析表明该WRI样基因包含两个AP2结构域,第二域比第一对准分析(数据未示出的数据)更节约。该序列沉积在NCBI Genbank作为加入MW039149。
AP2 / EREB基因分为五组,即用两个AP2 / ERF结构域,DREB和ERF亚属,具有一个AP2 / ERF结构域,RAV亚类,具有一个AP2 / ERF结构域和B3 DNA绑定主题,以及其他AP2 / ERF结构域,以及其他[42.,43.,44.].在这项研究中,将含AP2含域的基因聚集成三个主要组:AP2,蚁和WRI。在WRI组中,WRI1S与WRI2S,WRI3和WRI4s显然分离,并发现NutsEdge WRI样基因与WRI3S和WRI4S更密切相关(附加文件3.).氨基酸序列比较表明,该莎草WRI样肽显示出31.06 52.03和%的氨基与拟南芥WRI3和WRI4分别因此它被命名为酸序列相似性C. esculentus wri4.(CeWRI4).然后我们确定的表达式CeWRI4在不同的器官。CeWRI4显示叶子中最高表达,其次是根和块茎(附加文件4).
表达CeWRI4改良转基因拟南芥的抗旱性
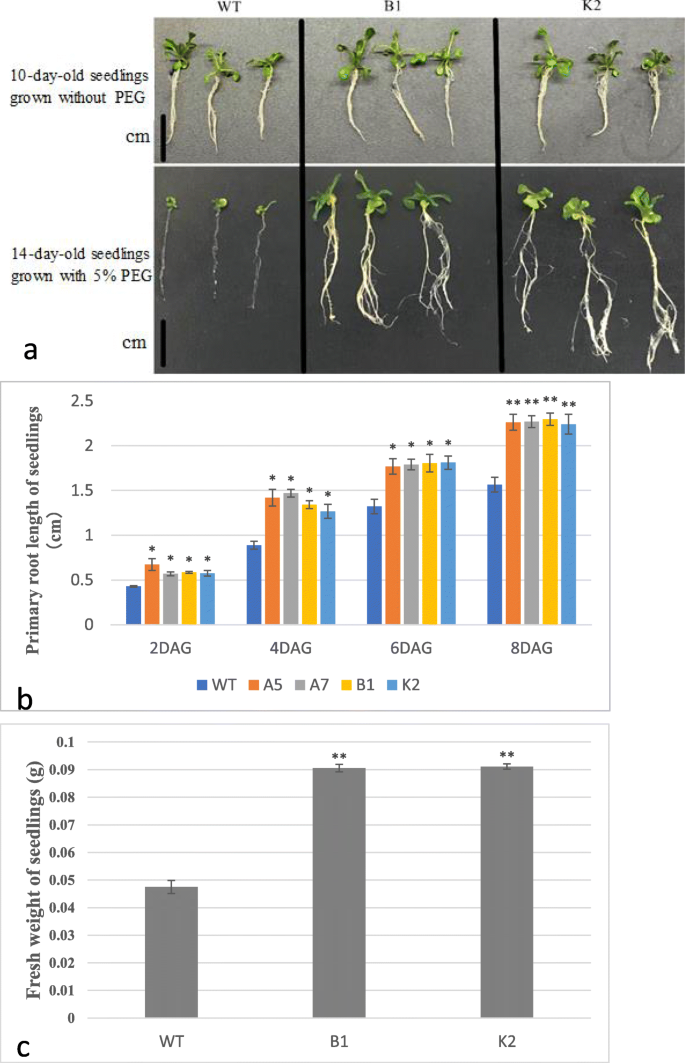
对于克隆基因的功能表征,拟南芥植物与转化CeWRI4通过在PEG补充的生长介质以及施加真正的脱水时,通过生长转基因植物的干旱耐受性。WT和转基因拟南芥的种子萌发在控制和PEG模拟应力条件下高于90%(数据未示出)。我们还确定了苗期的耐旱性。在控制条件下,与转基因系B1和K2没有显着不同的10天龄WT幼苗的生长(图。1一种)。然而,在PEG诱导的干旱胁迫下,WT幼苗表现出严重抑制原发性根生长,与转基因素相比,横向根部的较少少量(图。1一种)。在干旱胁迫下,转基因系的叶片比wt更多。两周历史的转基因植物有4种良好的真实叶子,而同样的WT植物中的两个非常小和黄色的真实叶子(图。1a).根系长度和幼苗鲜重(FW)数据也证实了转基因株系对peg模拟干旱胁迫具有更高的耐受性(图2)。1公元前)。
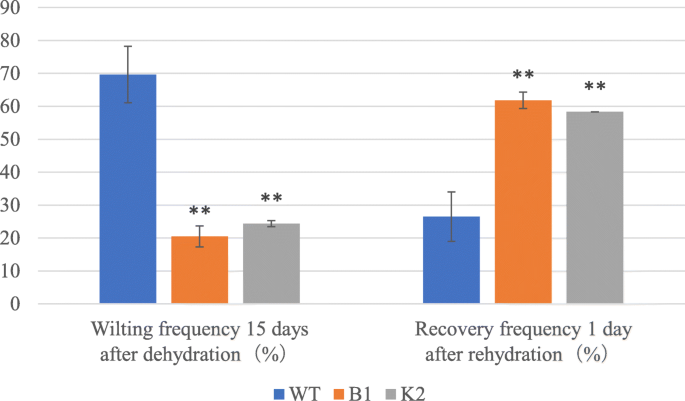
我们还通过真实脱水来测定植物的耐旱性。WT和转基因拟南芥植株在正常生长条件下生长无显著差异(图。2).然而,在脱水15天后,WT的抗频率为63.6-81.8%,而转基因素中的18.2-25%(图。2和3.).脱水22天后,再次浇水,恢复1天后测定恢复程度。转基因株系的恢复频率显著高于野生型,分别为58.3-63.6%和18.1-36.3%(图2和图3)CeWRI4提高拟南芥对干旱胁迫的耐受性
在转基因拟南芥系中改变了煤气交换参数和水关系
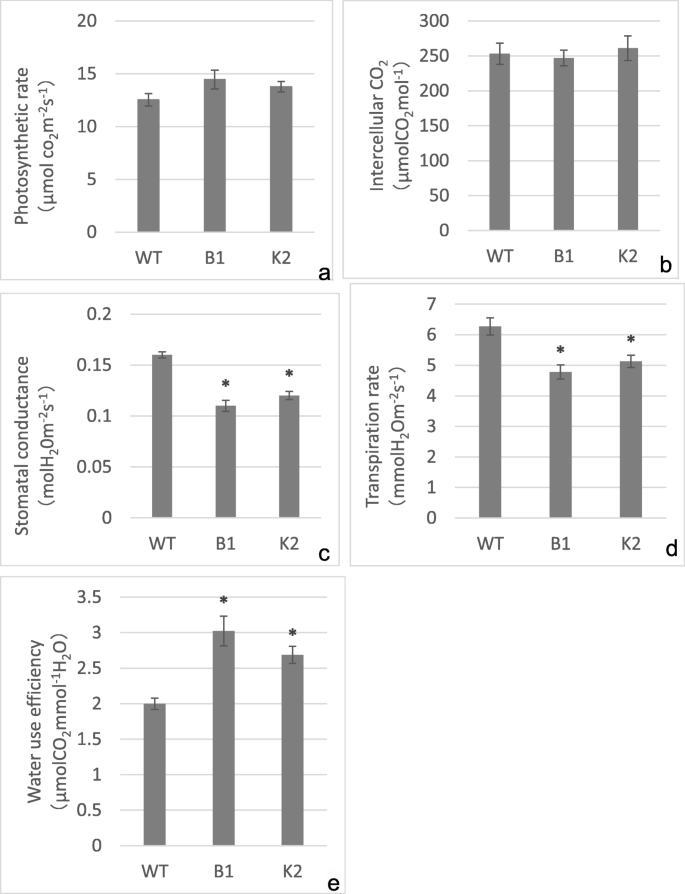
在植物中,超过90%的水分通过蒸腾流失,主要是通过气孔[45.].有充分的记录表明,气孔闭合是植物对干旱的第一反应之一,以避免过度的水分丧失并保护光合机械[46.].干旱条件下气孔导度的调控被认为是一种很有前景的抗旱方法[47.].转基因大豆过表达拟南芥LOS5 / ABA3通过降低气孔孔径和蒸腾速率来表现出降低的水分,从而减轻了叶片萎缩并保持了更高的相对水含量[48.].转基因水稻表达ATEDT1 / HDG11.也通过降低气孔导度和蒸腾作用,提高了水分利用效率和光合作用[49.].在这项研究中发现,净光合作用和细胞间CO2在胁迫时,浓度在WT和转基因株之间没有显着差异(图。4a - b)。在另一方面,转基因品系表现出显著低气孔导度和与WT(图相比蒸腾速率。4C-E)。在干旱胁迫下,转基因B1和K2的气孔导度为69和WT,分别(图的75%。4c),蒸腾速率分别为WT的76和82%(图2)。4d)。转基因系表现出较高的水使用效率,其分别为150%和130%的转基因系B1和K2中的WT(图。4e)。我们研究中报告的数据与以前的报告有关[50.,51.,52.].
转基因拟南芥表现出较慢的叶绿素浸出和水分流失
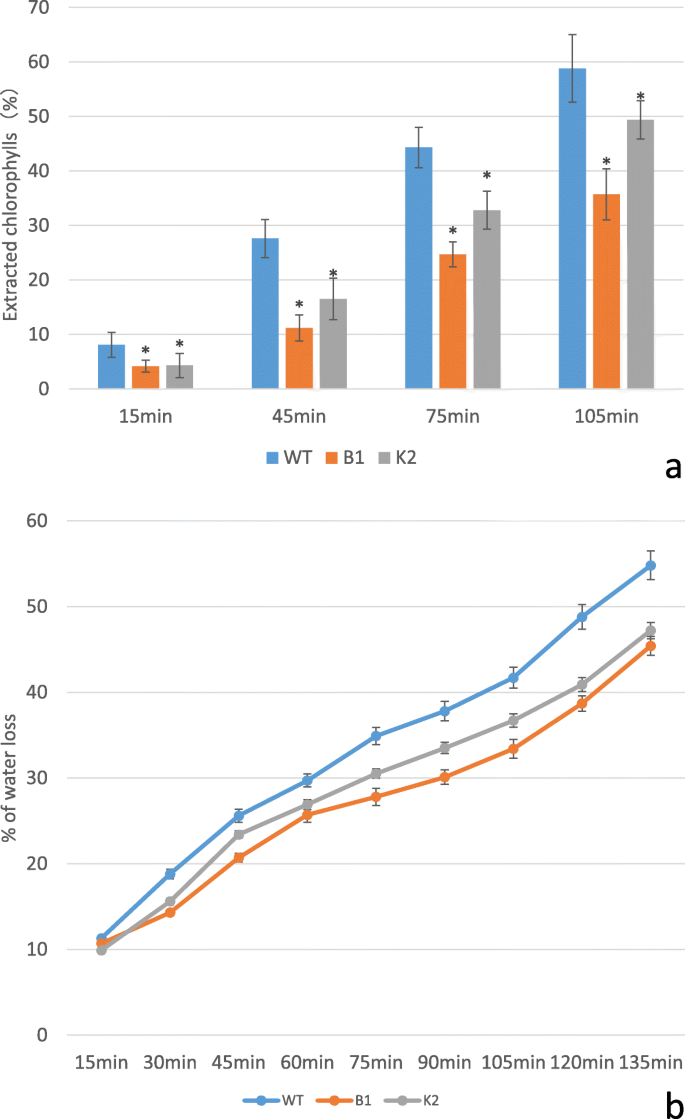
将WT和转基因拟南芥幼苗叶片浸泡在80%乙醇中测定叶绿素浸出。随着时间的推移,越来越多的叶绿素剥离WT和转基因线,然而后者显示明显慢叶绿素浸出与WT。105分钟后,叶绿素浸出B1和K2线低于50和40%,分别在WT高于60%(图。5一种)。除去叶片的水损失在转基因株中低于50%,而在135分钟后,与WT的58%相比(图。5b)。
转基因拟南芥中脂肪酸和表皮蜡质合成关键基因的表达发生了改变
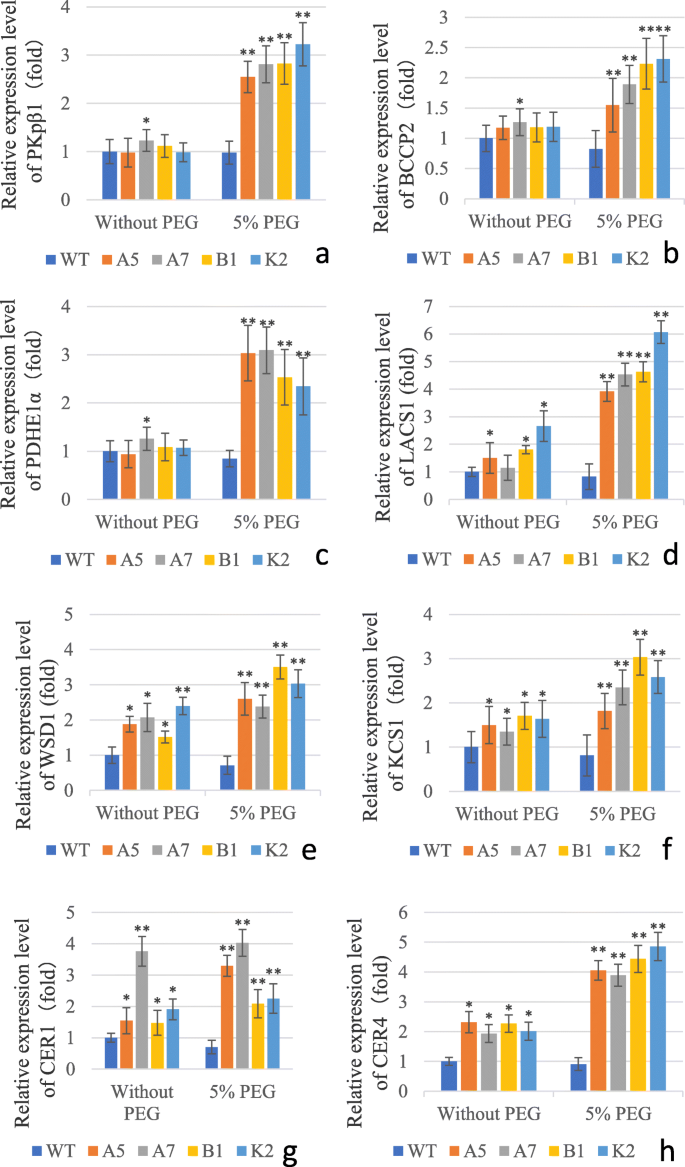
角质层蜡在保护植物免受干旱胁迫中起着重要作用[6,7,8,9,10.,53.,54.].研究表明,wr4通过直接与蜡前体的启动子结合,激活参与蜡前体脂肪酸伸长和蜡酯生产的基因的表达。wr4还通过直接结合基因启动子,在脂肪酸生物合成中发挥作用BCCP1和BCCP2[10.,30.].扰乱WRI4.导致上述基因的下调和其他脂肪酸生物合成基因,如PKP1,PKP2.,PDHE1α和ENR1[10.].
同时考虑中的作用CeWRI4然后,进一步了解转基因株系中耐旱耐受的机制,我们试图探讨参与脂肪酸和内脉蜡生物合成中涉及的关键基因的表达。定量RT-PCR数据表明,在对照生长条件下,脂肪酸生物合成基因如PKp -β1(塑型丙酮酸激酶亚基1,At5g52920),BCCP2(生物素羧基载体蛋白2,AT5G15530)和PDHE1α(丙酮酸脱氢酶E1α,AT1G01090)[28.[WT和转基因拟南芥之间没有显着差异。在WT植物中,与其对照相比,PEG诱导的干旱胁迫不会显着改变上述基因的表达。另一方面,表达PKp -β1,BCCP2和PDHE1α与相应的未经批准的转基因素相比,PEG处理(分别为130-230%,50-100%和130-220%,分别在转基因系中升高)显着诱导(图。6a - c)。
我们还测定了几个关键的表皮蜡生物合成基因的表达,即LACS1(长链酰基-CoA合酶1,AT2G47240),WSD1(蜡酯合成酶/甘油酰酰基转移酶1,At5g37300),KCS1(3-酮酰基辅酶a合酶1,At1g01120),CER1(ECERIFERUM 1, At1g02200)和CER4(ECERIFERUM 4, At4g33790) [30.,31.,32.,33.].在正常生长条件下,所有上述基因表达在转基因系显著高于WT相比较。PEG治疗没有引起这些基因在WT的表达显著变化,然而,在转基因品系的基因表达通过显著PEG诱导(基因表达为130-300%,30-80%,20-80%,10-110%,为80-140%以上LACS1,WSD1,KCS1,CER1和CER4,分别,无花果。6D-H)。我们也确定了表达AtWRI4,转录因子调节蜡生物合成,在转基因拟南芥。下控制,以及干旱胁迫条件下,表达AtWRI4在WT和转基因株系之间没有显著差异(附加文件5).表达DGAT1(AT2G19450),参与标签累积的基因[29.],与未胁迫条件下的WT相比,转基因株系显著降低(下降10-40%)。peg诱导的干旱胁迫没有引起表达的显著变化DGAT1在WT中,与WT和转基因对照相比,在转基因系中观察到该基因表达的显着降低(20-70%)(附加文件6).总的来说,这些数据表明,在表达转基因拟南芥中表达脂肪酸,切口蜡和油合成基因的表达CeWRI4.
转基因拟南芥的表皮蜡质含量较高,但含油量较低
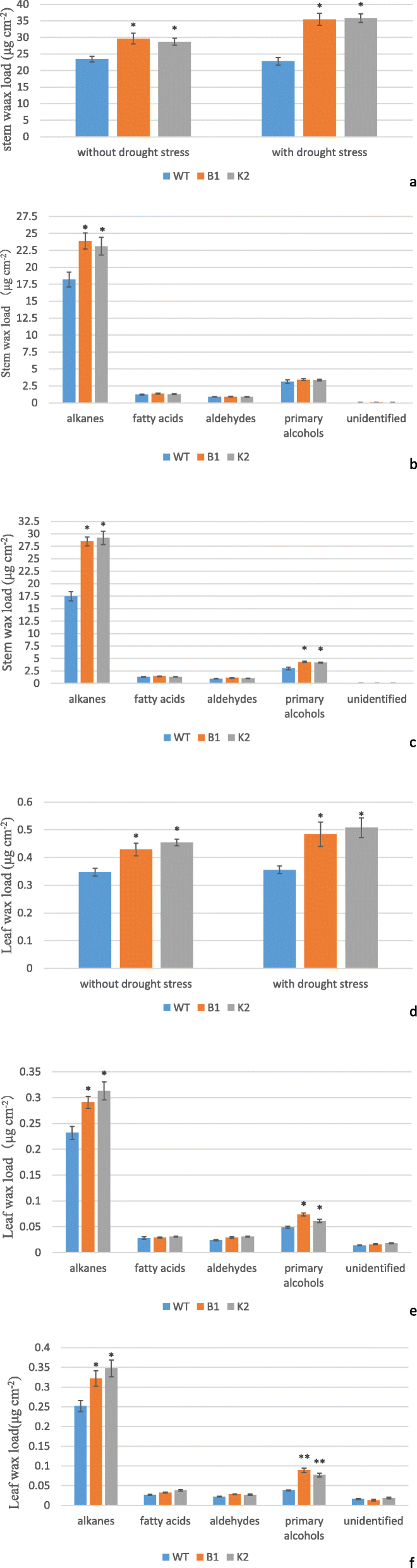
切割蜡对于预防陆地植物的空中部位的非气孔损失是重要的。因此,与植物干旱抵抗密切相关[9,55.].就像基因的过度表达SHN1 / WIN1,Shine1.,MDShine2,WXP1,WXP2,WSD1,MYB96和MYB94通过增加有粘接蜡生物合成和沉积来增加耐旱性[6,7,8,16.,18.,23.,24.,25.,26.,56.].烷烃的生物合成是植物的渗透胁迫条件下的关键反应之一[9].已经提出了具有比VLCFA的水分扩散更大的抗性烷烃[9,16.].Seo等[16.]过度myb96在拟南芥中,与WT相比,转基因叶片和茎的总蜡负荷的总蜡载荷〜1.6倍〜1.6倍。进一步表明,蜡的增加主要是由于锂烷烃升高。类似地,转基因桑椹过度表达AtSHINE1叶片表面蜡负荷的增加主要是由于蜡组分中烷烃的增加[25.].
在本研究中,发现在没有干旱的胁迫下,转基因系B1和K2的茎蜡含量分别比wt分别更高26%和22%(图。7一种)。在蜡组分中,烷烃在转基因系中高于WT(31%和21%的转基因系B1和K 2增加),而转基因系和WT之间的其他切口蜡组分在显着差异(图。7b)。类似地,在转基因系B1和K2中,总叶蜡负荷分别较高24和31%,而不是wt(图。7d)。在叶片蜡中,烷烃分别比wt分别为25℃,母醇分别为转基因系B1和K2的初级醇。其他具有显着不同的其他有切割蜡组分(如脂肪酸)(图。7e)。
随着干旱应激杆蜡负荷在转基因B1和K2中显着增加,而叶蜡载荷在K 2中显着增加,但不在B1中(图。7广告)。发现,随着转基因B1和K2茎中的干旱胁迫总蜡为55%,比wt中的57%高(图。7a),其中烷烃在转基因B1和K2中的63和67%高于WT,而伯醇分别比WT叶中的43%和38%,而其他有切割蜡组分没有显着差异(无花果。7c)。同样,转基因B1和K2叶片的总蜡质负荷比野生型分别高36和43%(图2)。7D),其中烷烃在转基因B1和K2中的28%和38%,而分别比wt分别比wt为134%,分别高于WT叶片,以及其他切割蜡组分如醛和脂肪酸没有显着差异(图。7F)。
拟南芥叶中的油含量也被测定,但在WT和转基因中没有发现显着差异(附加文件7).这与DGAT1表达数据。表达DGAT1在干旱胁迫条件下,转基因株系与野生型相比显著降低(附加文件6).这可能是WT和转基因株系油脂含量没有显著差异的原因,尽管转基因株系中脂肪酸生物合成相关基因的表达量显著高于WT(图2)。6a - c)。
转基因拟南芥叶片表皮蜡晶沉积量较高
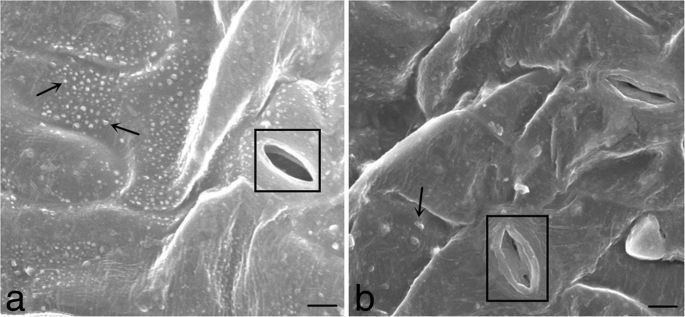
扫描电镜(SEM)分析表明,干旱胁迫条件下,转基因拟南芥叶片表面的蜡质晶体明显多于野生型(图2)。8a - b)。转基因系中的造口保持平滑且正常,同时在WT造口中观察到缩小和变形(图。8a - b)。这些数据表明CeWRI4拟南芥中的表达显着增加了叶片外部蜡晶体沉积。
转基因拟南芥植物在干旱胁迫下显着降低可溶性糖,自由脯氨酸和MDA含量
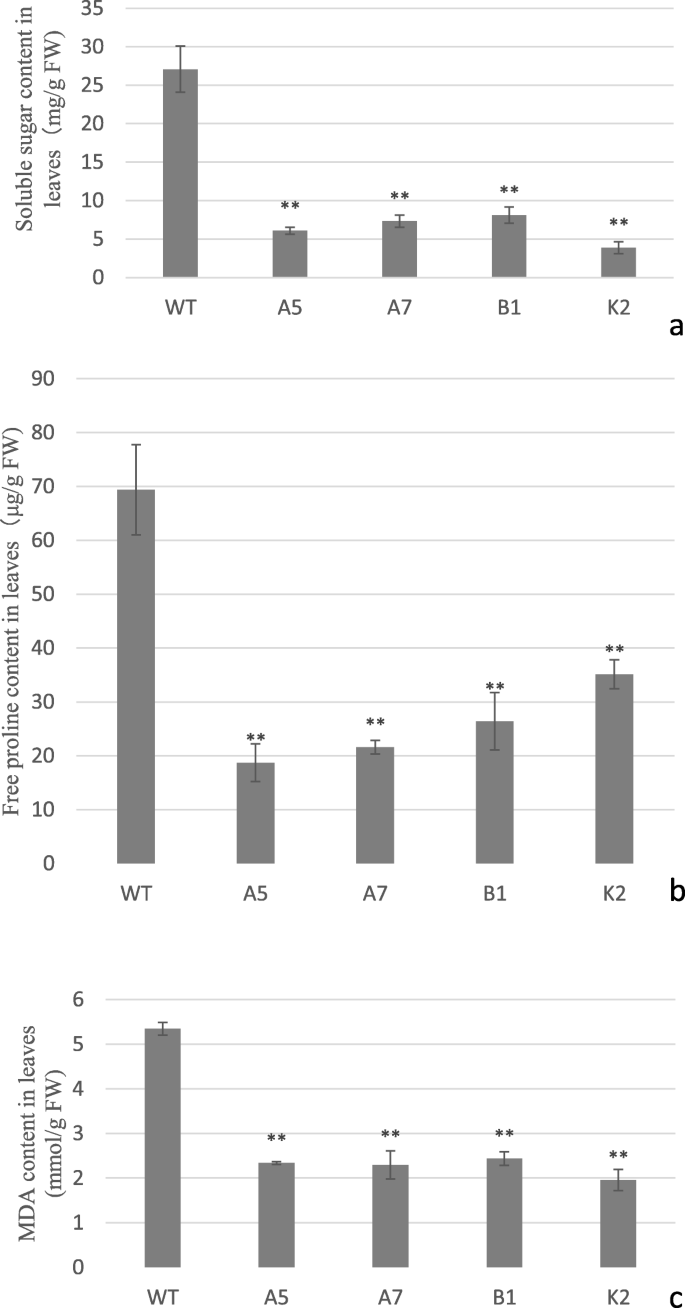
丙二醛(MDA)是膜过氧化的产物,被认为是脂质过氧化和膜损伤的指标[51.,57.,58.].已经观察到植物,当受干旱胁迫时,累积渗透糖和蛋白质,以保持渗透平衡和膜完整性[59.,60.].许多植物通过积累参与渗透保护的脯氨酸和可溶性糖来调节其渗透调节能力以抵抗干旱胁迫[61.,62.].在表达转基因拟南芥的抗旱性表型中获得进一步的见解CeWRI4,测定可溶性糖、游离脯氨酸和丙二醛含量。经过两周的真正脱水后,转基因品系的可溶性糖浓度明显低于野生型(仅为野生型的14.3-29.9%,图。9一种)。观察到脯氨酸和MDA含量的类似趋势。在转基因中,脯氨酸和MDA也显着降低,与WT(分别为26.9-50.6%和36.5-45.5%)。9公元前)。这些结果表明,可能转基因素可能患有较少的脂质过氧化和膜损伤。
结论
在这项研究中,我们克隆了一个WRI4.- 从中获得基因C. esculentus.并通过在拟南芥中表达对其进行功能表征。CeWRI4类基因通过促进角质层蜡质的合成和沉积,从而降低干旱胁迫下的叶绿素浸出、气孔导度、蒸腾速率和水分损失,提高水分利用效率,从而提高拟南芥的抗旱性。CeWRI4这可能是一个有价值的目标,通过基因操作来提高商业作物的耐旱性。
方法
植物材料和治疗
拟南芥生态型哥伦比亚和块茎Cypetus esculentus.(黄nutsedge)简历。Hubu-1由湖北大学生命科学学院生物催化国家重点实验室提供。在22°C光照16 h、暗8 h的条件下,对黄豆块茎进行发芽试验。如Cheng等人所述,RNA从叶、根和新鲜块茎中分离出来[63.].
克隆WRI4.从黄色nutsedge
不同植物的wr1蛋白序列(茄属植物tuberosum,加入编号:AAA66057;尼科尼亚塔哈瓦姆,加入不。: ABD60582;Fragaria x ananassa,加入不。: AAS00541;唐菖蒲杂种,编号。: AHN15416;Triticum Aestivum.,加入编号:AAF61173;Hordeum Vulgare.,登录号:aau06191;https://www.ncbi.nlm.nih.gov/)由ClustalW2 (http://www.ebi.ac.uk/tools/msa/clustalw2/).退化inters(附加文件1)的保守区域扩增CeWRI样基因使用来自叶,根,块茎和作为模板的cDNA。SMART RACE扩增试剂盒(Clontech公司,山景,CA)来克隆的5'和3'的片段CeWRI例如基因。通过使用基于种族结果的引物克隆全长cDNA序列(附加文件1).
序列和系统发育分析
为了找到ORF并推导出氨基酸序列,开放阅读框(ORF) Finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html使用)工具。NCBI CD-搜索工具(http://www.ncbi.nlm.nih.gov/structure/cdd/wpsb.cgi.)用于在推导的CECRI样蛋白中寻找保守的结构域。使用Mega 7.0软件(使用1000个引导复制)生成含两AP2-结构域基因的系统发育树[64.].
的建设CeWRI4过度表达载体和遗传转化拟南芥
1423bp的PCR产物含有完全ORFCeWRI4被消化了PSTI.和SalI位然后置于CaMV 35S (35S)启动子和pCambia 2300-35S-nos终止子之间[65.]构建矢量pcambia 2300-35s-CeWRI4-不。进行测序以确保结构正确。
WT拟南芥种子表面消毒,在含3%蔗糖的1/2 Murashige和Skoog (MS)琼脂平板上生长,生长室光照16 h /黑暗8 h (70-80 lm/m)2/s)。15日龄植株移栽到土壤中,在生长室内光照16小时/黑暗8小时(70-80 lm/m)下生长2/ s)在22°C时。PCAMBIA 2300-35S-CeWRI4-NOS矢量被引入根癌土壤杆菌然后通过花卉浸法用于将拟南芥转化的EHA105 [66.].通过使用的转基因植物(T1,T2,T3)进行PCR确认《不扩散核武器条约》第二和CeWRI4基因特异性引物(附加文件1).
干旱耐受评估
将WT和转基因拟南芥种子分别播种在含/不含5% PEG-6000的1/2 MS琼脂培养基上进行模拟耐旱性评估。播种后6天测定WT和转基因拟南芥的发芽率。分别在种子萌发后2、4、6、8 d记录初生根的长度。每个株系设3个生物重复组,每组10个重复苗。为了进行真正的脱水胁迫,在1/2 MS培养基上发芽的两周幼苗被移植到12 × 12 cm的盆栽中,盆栽中填充了营养土壤和蛭石(1:1)的混合物。花盆保持在22°C, 16小时光照/ 8小时暗光周期。每株系设置3个生物重复盆,每个重复盆10株。在脱水胁迫开始之前,这些植物被定期浇水并拍照。在正常生长条件下对20日龄拟南芥进行脱水胁迫。在脱水应激发作15天后测定萎蔫频率。 Watering was resumed after 22 days of dehydration. Next day, the recovery frequency was scored as the number of surviving plants out of the total plants.
水损失测量
将5周龄幼苗的玫瑰花叶脱落并置于培养皿中,风干,以测量透析水分。在暗暴露期间在不同时间点测量分离的叶片的重量。计算出水分损失的百分比:(W1-W2)/ W1(W1:水损前的初始叶重; W2:在不同时间点的水损失后的叶重)。
叶绿素浸出测定
将5周龄拟南芥幼苗莲座叶片在室温下(在黑暗中轻轻搅拌)浸泡在5ml 80%乙醇中进行叶绿素浸出试验。分别在15、45、75和105 min时取出1 ml溶液,使用美国UNICO 7202B分光光度计在波长为663和645 nm处进行叶绿素定量。
转基因和WT Arabidopis植物的生理分析
采用5% PEG-6000处理5周龄转基因和野生型植株1天,然后采用Li-6400光合系统仪器(LI-COR, Inc.)测定光合相关参数。测定气孔导度(g年代),蒸腾(tr),光合作用(pn),如Wei等人所描述的,不同植物在同一位置的叶片[67.].计算单叶水分利用效率(WUE)为:光合速率/蒸腾速率。
通过扣留水15天,将脱水应力保持在正常生长条件下的20天叙述植物。在治疗结束时,收获转基因系和WT的叶片以测量MDA,游离脯氨酸和可溶性糖。为了测定叶MDA含量,使用Dhindsa和Matowe描述的硫酰碱酸法[68.].叶片游离脯氨酸和可溶性糖含量测定采用Troll和Lindsley方法[69.弗勒和普里斯特利[70], 分别。
蜡提取和GC-MS分析
如Park等人所述,从5 - 6周大的野生拟南芥和转基因拟南芥的叶子和茎中提取油脂和角质层蜡[10.].采用配备火焰离子化检测器的GC-MS-QP2010 (Plus)气相色谱仪(GC-2010, Shimazu, Tokyo, Japan)进行定量。GC的保留时间和温度按照Lee和Suh的描述进行了编程[18.].通过将峰值保留时间与参考标准的峰值进行比较来确定蜡组合物。通过与内标相比,通过量化主要峰的区域来估计蜡载荷。基于用于蜡提取的叶片和茎的面积计算每单位叶面积和茎区域的蜡负荷。
拟南芥叶片沉积沉积的SEM分析
5-week-old WT and transgenic Arabidopsis plants were drought-stressed for 10 days by withholding water. Mature rosette leaves were sliced into 0.5 cm sections and then fixed in 5% glutaraldehyde and coated with gold particles by using an EICO IB.5 ION coater (Tokyo, Japan). Epicuticular wax crystals on adaxial side of leaves were observed by using JEOLJSM-3690LV scanning electron microscope (Tokyo, Japan).
RNA提取和实时定量逆转录QRT-PCR
通过用5%PEG-6000处理10小时,将干旱胁迫应用于24天龄WT和转基因拟南芥植物。控制植物含水而不加入PEG。收集来自对照和处理植物的玫瑰花,在液氮中冷冻,并储存在-80℃。通过使用Biospin植物总RNA提取试剂盒(Bioflux)提取总RNA。为了去除任何污染的DNA,用无RNase的DNase(Bioflux)处理样品。通过使用PrimescriptRT试剂盒(Takara)合成cDNA。使用BioeAsy Master Mix Sybr Green(Bioer)通过QRT-PCR在Stratagene MX3005P定量PCR系统(Agilent Technologies)上测定基因表达。QRT-PCR中使用的引物的序列在附加文件中给出1.选择具有100%效率和单峰的特异性底漆对。ACTIN2(AT3G18780)用作参考基因,用于归一化表达。通过比较阈值循环方法计算相对基因表达。
统计分析
所有实验均用三个重复进行。检测到显着的差异t利用SPSS软件测试(*P< 0.05;Arunachal Pradesh,P< 0.01)。
可用性数据和材料
支持这一研究结果的数据集都包含在手稿和其他支持文件。对于序列C. esculentus wri4.在NCBI Genbank作为加入MW039149,存放和提供。
缩写
- Apetala2 / erebp:
-
乙烯反应元件结合蛋白
- BCCP2:
-
生物素羧基载体蛋白2
- BSTFA:
-
双-N,N三甲基甲硅烷基三氟乙酰胺
- CER1:
-
Eceriferum 1.
- CER4:
-
ECERIFERUM 4
- chl:
-
叶绿素
- COAS:
-
辅酶
- 表演:
-
几天后萌发
- DGAT1:
-
二酰甘油酰基转移酶1
- FW:
-
鲜重
- GC-MS:
-
气相色谱 - 质谱
- KCS1:
-
3-酮酰基CoA合酶1
- LACS1:
-
长链酰基辅酶a合酶1
- MDA:
-
丙二醛
- 女士:
-
Murashige和Skoog.
- PDHE1α:
-
丙酮酸脱氢酶E1α
- PEG:
-
聚乙二醇
- PKp -β1:
-
塑性丙酮酸激酶亚基1
- QRT-PCR:
-
定量逆转录聚合酶链反应
- Q-RT-PCR:
-
定量RT-PCR
- 种族:
-
cDNA结束的快速扩增
- SEM:
-
扫描电子显微镜
- 标签:
-
三酰基甘油
- UTR:
-
未经翻译的地区
- VLCFAs:
-
非常长链脂肪酸
- WSD1:
-
蜡酯合酶/二酰基甘油酰基转移酶1
- WT:
-
野生型
- WUE:
-
用水效率
参考
- 1。
圣莲的纯洁,或从生物表面的污染中逃脱。足底。1997;202(1):1 - 8。
- 2。
egenbrode sd,espelieke。植物弹性脂质对昆虫草食物的影响。annu重新entomol。1995年; 40(1):171-94。
- 3.
莱科斯基,汉诺威JW。表面蜡对云杉生理的影响:I.白霜云杉和非白霜云杉的反射率。植物杂志。1978;62(1):101 - 4。
- 4.
陈志强,陈志强。植物表皮的光学性质及其对紫外线防护的贡献:以苹果果实为实验材料。光化学学报。2003;2(8):861-6。
- 5。
李志强,李志强。植物角质层对土壤水分的保护作用。acta botanica sinica(云南农业大学学报),2001;52(3):423 - 432。
- 6。
在拟南芥中,AP2结构域转录因子SHINE分支激活蜡质生物合成,改变角质层特性,并在过表达时赋予耐旱性。植物细胞。2004;16(9):2463 - 80。
- 7。
张JY,Broeckling CD,Blancaflor EB,斯莱奇MK,萨姆纳LW,王ZY。WXP1,推定的蒺藜苜蓿包含AP2结构域的转录因子基因,在转基因苜蓿的增加角质层蜡积累并提高的干旱耐受性(的过度表达Medicago Sativa.).植物j . 2005; 42(5): 689 - 707。
- 8。
张建勇,Broeckling CD, Sumner LW,王志勇。在拟南芥中异源表达两种被认为是ERF转录因子的基因WXP1和WXP2,增加了叶片蜡质积累,提高了抗旱性,但在抗冻性方面的响应存在差异。植物学报。2007;64(3):265-78。
- 9。
Kosma DK, Bourdenx B, Bernard A, Parsons EP, Lü S, Joubès J, Jenks MA。缺水对拟南芥叶片角质层脂质的影响。植物杂志。2009;151(4):1918 - 29。
- 10。
公园CS,围棋YS,徐MC。角质层蜡生物合成正由WRINKLED4,一个AP2 / ERF-型转录因子调节,在拟南芥茎。植物杂志2016; 88(2):257-70。
- 11.
盆栽后饲料D.植物蜡生产的生物化学和分子生物学。Annu Rev植物植物植物Mol Biol。1996年; 47:405-30。
- 12.
Kunst L,Samuels Al。植物切割蜡的生物合成和分泌。Prog Lipid Res。2003; 42(1):51-80。
- 13。
Samuels L,Kunst L,Jetter R.密封植物表面:表皮细胞的切割蜡形成。Annu Rev植物Biol。2008; 59:683-707。
- 14。
李贝森y,shorrosh b,beisson f,Andersson M,Arondel v,Bates P,Bauds,Bird D,Debon A,Durrett T,Franke RB,Graham Ia,Katayama K,Kelly AA,Larson T,Markham Je,Miqueel M,Molina I,Nishida I,Rowland O,Samuels L,Samuels L,Schmid Km,Wada H,Welti R,Xu C,Zallot R,Ohlrogge J.酰基 - 脂质代谢。拟南芥书。2010; 8:E0133。
- 15.
伯纳德A,Domergue F,Pascal S,Jetter R,Renne C,Faure JD,Haslam RP,Napier Ja,LeSsive R,JoubèsJ.酵母中植物烷烃生物合成的重建证明了拟南芥Eceriferum1和Eceriferum3是非常 - 的核心组分长链烷烃合成复合物。植物细胞。2012; 24(7):3106-18。
- 16。
徐pj, Lee SB, Suh MC, Park MJ, Go YS, Park CM。MYB96转录因子调控干旱条件下拟南芥表皮蜡质生物合成。植物细胞。2011;23(3):1138 - 52。
- 17。
去ys,lee sb,金hj,金jy,suh mc。双官能AP2 / ERF型转录因子抑制了切割蜡生物合成,并在拟南芥中的暗条件下激活暗诱导基因。:第20届植物脂质国际研讨会,西班牙塞维利亚塞维利亚;2012. p。60。
- 18。
李某,Suh Mc。采用拟南芥中的MyB94转录因子上调了切割蜡生物合成。植物细胞生理。2015; 56(1):48-60。
- 19。
吴R,李某,他,瓦斯曼F,yu c,qin g,克里孚岛l,qu lj,gu H. cfl1,ww域蛋白,通过调节HDG1的功能来调节角质层开发,IV类同源域转录因子,在水稻和拟南芥中。植物细胞。2011; 23(9):3392-411。
- 20。
榄P,召L,麦克法兰HE,埃雅男,榄V,胡克TS,孔斯特L. RDR1和SGS3,RNA介导的基因沉默的部件,需要用于角质层蜡生物合成在显影花序调节拟南芥的茎。植物理性。2012; 159(4):1385至1395年。
- 21。
林鹏,赵丽丽,于玉英,陈晓霞,孔斯特。外泌体和反式干扰小rna对拟南芥花序茎发育过程中表皮蜡质合成的调控。植物杂志。2015;167(2):323。
- 22。
Lü S, Zhao H, Des Marais DL, Parsons EP, Wen X, Xu X, Bangarusamy DK, Wang G, Rowland O, Juenger T, Bressan RA, Jenks MA。拟南芥ECERIFERUM9参与植物角质层的形成和水分状态的维持。植物杂志。2012;159(3):930 - 44。
- 23.
Broun P,PoIndexter P,Osborne E,Jiang CZ,Riechmann JL。Win1是拟南芥中表皮蜡积累的转录激活剂。Proc Natl Acad Sci U S A. 2004; 101(13):4706-11。
- 24.
Lee Sb,Kim H,Kim RJ,Suh Mc。拟南芥的过度表达MyB96通过切割蜡积聚在Camelina Sativa中赋予抗旱性。植物细胞批准。2014; 33(9):1535-46。
- 25.
Sajeevan Rs,Nataraja Kn,Shivashankara Ks,Pallavi N,Gurumurthy DS,Shivanna MB。Arabidopsis Shn1在印度桑树的表达(桑属籼L.)增加叶面蜡含量并降低收获后的水损失。正面。植物SCI。2017; 8:418。
- 26.
张YL,张CL,GL王,王YX,齐CH,你CX,李YY,郝YJ。通过调节蜡合成苹果AP2 / EREBP转录因子MdSHINE2赋予耐旱性。Planta。2019; 249(5):1627至1643年。
- 27.
Riechmann JL,Meyerowitz em。AP2 / eREBP植物转录因子系列。Biol Chem。1998年; 379(6):633-46。
- 28.
Cernac A,Phinning C. frinkled1编码参与拟南芥中储存复合生物合成的AP2 / eRERB结构域蛋白。工厂J. 2004; 40(4):575-85。
- 29.
Shigyo M, Hasebe M, Ito M. AP2亚家族的分子进化。基因。2006;366(2):256 - 65。
- 30.
关键词:拟南芥,皱折转录因子,脂肪酸合成,组织特异性调控abstract:植物细胞,2012;24(12):5007 - 23所示。
- 31.
VillaseñorJ,Espinosa-GarcíaF.墨西哥的外星人开花植物。潜水员分销。2004; 10:113-23。
- 32.
Acevedo P,强大的M.西印度群岛种子植物目录。史密森贡献机Bot。2012; 98:1192。
- 33。
DAISIE。为欧洲提供外来入侵物种清单。《欧洲外来入侵物种门户》2014;www.europe-aliens.org/default.do..
- 34。
Govaerts R,Simpson da,Bruhl Jj,egorova T,KL W. Cyperaceae的世界清单。伦敦:皇家植物园,Kew;2007年。http://apps.kew.org/wcsp/.
- 35。
USDA-ARS。种质资源信息网络(GRIN)。在线数据库Beltsville,马里兰州,美国,国家种质资源实验室。2014;https://npgsweb.ars-grin.gov/gringlobal/taxon/taxonomysearch.aspx..
- 36。
Holm Lg,Plucknett DL,Pancho JV,Herberger JP。世界上最糟糕的杂草:他们的分销和生物学;1977. p。XF2006176107。
- 37。
defelice ms。黄雀果实Cypetus esculentus.L.-仙女的食物。杂草技术。2002; 16:901-7。
- 38。
多代,Petit RJ, Gasquez J.侵袭性局部扩散Cypetus esculentus.(Cypetaceae)推断使用分子遗传标记。杂草res。2008; 48(1):19-27。
- 39。
阿拉法特,加阿法,巴苏尼,纳瑟夫Cypetus esculentus.L.):作为一种新的食物来源。世界Appl Sci J. 2009; 7(2):151-6。
- 40。
Bado S,Bazongo P,Son G,Kyaw Mt,Forster BP,Nielen S,Lykke Am,Ouédraogoa,bassoléihn。三种图型的物理化学特征及组成Cypetus esculentus.块茎和块茎油。Ĵ分析方法化学。2015; 2015:1-8。
- 41。
Belewu M,Belewu K.虎螺母,大豆和椰子牛奶来源的比较物理化学评价。int j农业biol。2007; 9(5):788-90。
- 42。
Sakuma Y,Liu Q,Dubouzet JG,Abe H,Shinozaki K,Yamaguchi-Shinozaki K.拟南芥DREBS的ERF / AP2结构域的DNA结合特异性,参与脱水和冷诱导基因表达的转录因子。Biochem Biophys Res Communce。2002年; 290(3):998-1009。
- 43。
NAKANO T,苏祖基,富士菊,夏精,Shinshi H.拟南芥和稻米ERF基因家族的基因组分析。植物理性。2006; 140(2):411-32。
- 44。
Swaminathan K,Peterson K,Jack T.植物B3超家族。趋势植物SCI。2008; 13(12):647-55。
- 45。
Pei ZM, Ghassemian M, Kwak CM, McCourt P, Schroeder JI。法尼基转移酶在ABA调控保卫细胞阴离子通道和植物失水中的作用。科学。1998;282(5387):287 - 90。
- 46。
Vijayalakshmi T,Varalaxmi Y,Singh J. Sushil Yadav,Maddi Vanaja,Jyothilakshmi N,Maheswari Mandapaka。珍珠菌杂交种与父母水缺陷应力耐受性的生理生物学基础。am j植物sci。2012; 3:1730-40。
- 47.
Manavalan LP,Guttikonda SK,Tran LS,Nguyen HT。在大豆中改善抗旱性的生理和分子方法。植物细胞生理。2009; 50(7):1260-76。
- 48.
关键词:拟南芥,钼辅助因子硫酶,大豆,抗旱性,产量植物生态学报;2013;11(6):747-58。
- 49.
于丽,陈新宇,王志强,王绍华,朱强,李松,向春。拟南芥增强抗旱性/HOMEODOMAIN GLABROUS11对转基因水稻抗旱性的影响。植物杂志。2013;162(3):1378 - 91。
- 50。
以色列树木旱生植物的气孔数目和大小与土壤水分的关系。生态。1969;50:263-7。
- 51.
弗兰克斯PJ,多亨尼-亚当斯TW,布列塔尼-哈珀ZJ,格雷JE。通过气孔密度的遗传操作直接提高水分利用效率。新的Phyto1。2015; 207:188 - 95。
- 52.
Doheny-Adams T,Hunt L,Franks PJ,Beerling DJ,Gray Je。气孔密度的遗传操纵影响口腔大小,植物生长和耐受性在生长CO2梯度上的限制供水。Philos Trans R Soc B:Biol Sci。2012; 367:547-55。
- 53.
李志强,李志强,李志强,等。植物表皮中3h标记水和14c标记有机酸的共渗透特性研究。植物杂志。1998;116:117-23。
- 54.
元GF,贾C,李Z,孙B,张立会,刘n,王QM。芸苔类固醇对水胁迫下番茄抗旱性和脱落酸浓度的影响。SCI Hortic。2010; 126(2):103-8。
- 55.
阐明表皮结构和功能的复杂网络。植物学报。2006;9(3):281-7。
- 56.
Patwari P,Salewski V,Gutbrod K,Kreszies T,Dresen-Scholz B,Peisker H,Steiner U,Meyer Aj,Schreiber L,DörmannP。表面蜡酯在拟南芥中有助于耐旱耐受性。植物J. 2019; 98(4):727-44。
- 57。
5-氨基乙酰丙酸对干旱胁迫下油菜光合气体交换、叶绿素荧光和抗氧化系统的影响。植物生理学报。2013;35(9):2747-59。
- 58。
李丽,李军,沈敏,张超,董宇。低温等离子体处理对干旱胁迫下油菜种子萌发的影响。Sci众议员2015;5:13033。
- 59。
ashraf m,诺福德先生。甘氨酸甜菜碱和脯氨酸在提高植物非生物胁迫性中的作用。Environ Exp Bot。2007; 59(2):206-16。
- 60。
Talbi S,Romero-Puertas MC,HernándezA,TerrónL,Ferchichi A,Sandalio LM。在Saharian Plant Oudneya Africana的耐旱宽容:抗氧化防御的作用。Environ Exp Bot。2015; 111:114-26。
- 61。
刘虎,张毅,尹h,王wx,赵xm,杜yg。海藻酸盐寡糖增强了Triticum Aestivum L.对干旱胁迫的耐受性。植物理性生物化学。2013; 62:33-40。
- 62。
万媛媛,陈淑英,黄玉文,李旭,张勇,王学军,白建国。咖啡酸预处理通过提高黄瓜幼苗抗氧化酶活性、脯氨酸和可溶性糖含量,提高了黄瓜幼苗的脱水耐性。Sci Hortic。2014;173:54 - 64。
- 63。
程C,胡锦涛,Zhi Y,Su Jj,张XK,黄宝贝。ADP-葡萄糖焦磷酸化酶小亚基基因的克隆与表征Cypetus esculentus.(黄色nutsedge)。中国海洋大学学报(自然科学版)2015;14(4):18302-14。
- 64。
Altschul SF, Lipman DJ。蛋白质数据库搜索多个比对。美国国立科学学院1990;87:5509-13。
- 65。
王CG,张JH,谢Y,刘YQ,黄BQ。克隆和hpRNAi载体构建甘蓝型油菜焦磷酸依赖性磷酸果糖激酶(PFK)的。分子植物品种。2006; 02:56-61。
- 66。
弯曲af,clough sj。农杆菌种系转化:拟南芥的转化而没有组织培养。在:植物分子生物学手册。由Gelvin Sb,Schilperoort Ra编辑。DONDRECHT:斯普林克荷兰;1998. p。17-30。
- 67。
Wei T,Deng K,Gao Y,Liuy Ym,Zhang L,Zheng X,Wang C,Song W,Chen C,Zhang Y. Arabidopsis Dreb1b在转基因中萨尔维亚米尔蒂希萨在不稳定增长的情况下增加对干旱压力的耐受性。植物理性生物化学。2016; 104:17-28。
- 68。
Dhindsa R,Matowe W.两件苔藓的耐旱性:与酶促过氧化的酶保护相关。J Exp Bot。1981; 32:79-91。
- 69。
林志强,王志强,王志强。一种测定脯氨酸的光度法。中国生物化学杂志。1995;215:655-60。
- 70。
洪水,普里斯特利加州。两种改进的可溶性碳水化合物的方法。J SCI食物农业。1973; 24(8):945-55。
确认
感谢复旦大学林娟博士提供了一些单子叶AP2/EREBP氨基酸序列。
资金
本研究中的基因克隆,拟南芥转化和分子分析是由中国国家重点研究和发展方案的财政支持(2016年FD0100202-23; 2017YFD0101701L);国家自然科学基金(31771829)支持干旱耐受评估和数据分析。融资机构在研究设计,数据收集,分析和解释方面没有作用,对公共决定,或写作稿件。
作者信息
隶属关系
贡献
BH、XZ、JH构思实验并定稿,CC完成大部分实验并准备初稿,SH、YH、DX、B-L H、WW协助材料准备、抗旱性测定、qrt - pcr和数据分析。所有作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1。
用于PCR和QRT-PCR的表S1引物。
附加文件2
图S1编码序列及推测的黄豆蛋白CeWRI4.起始密码子和终止密码子用黑条标记。
额外的文件3。
图S2来自不同植物物种的含两种AP2-结构域基因的系统发育树。
附加文件4.
图S3相对表达CeWRI4在不同的果实组织中。从生长的植物中收集新鲜和嫩叶,根和块茎,用于RNA提取和Q-PCR的植物。
附加文件5.
图S4内部相对表达AtWRI4.用5%PEG-6000处理24天龄WT和转基因拟南芥植物10小时。收获玫瑰花叶,用于RNA提取和Q-PCR。
附加文件6.
图S5 qRT-PCR分析DGAT1在WT和转基因株系A5、A7、B1、K2中,用5% PEG-6000处理24日龄的WT和转基因拟南芥植株10 h。采集莲座叶进行RNA提取和q-PCR。误差条表示±SD, **P < 0.01, *P < 0.05.
附加文件7。
正常条件下,WT和转基因拟南芥叶片的图S6油含量。每个复制的十叶用于测量重量。误差条表示±SD。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
程超,胡松,韩勇。等等。黄莎草WRI4.类基因提高植物的耐旱性拟南芥通过促进皮肤蜡生物合成。BMC植物BIOL.20,498(2020)。https://doi.org/10.1186/s12870-020-02707-7
收到了:
接受:
发表:
关键词
- Cypetus esculentus.
- WRI4.- 麦基基因
- 表皮蜡质的生物合成
- 耐旱
- 基因表达