摘要
背景
随着全球变暖的日益严重,我们迫切需要提高作物的耐热性。我们之前报道过拟南芥磷酸肌醇特异性磷脂酶C9 (AtPLC9)促进耐热性。
结果
在本研究中,我们异位表达AtPLC9在水稻中研究其提高这一重要作物耐热性的潜力。虽然AtPLC9没有提高水稻对盐、干旱或寒冷的耐受性,但转基因水稻表现出比野生型更强的耐热性。高通量RNA-seq揭示了转基因植物在热胁迫后广泛和动态的转录组重分析。此外,热胁迫后转基因水稻部分转录因子和钙离子相关基因的表达出现特异性上调,这可能是耐热性增强的原因之一。
结论
本研究为利用AtPLC9提高谷类作物耐热性提供了初步指导,更广泛地强调了异源转化可以辅助分子育种。
背景
植物必须适应复杂多变的环境。植物面临的主要非生物胁迫包括热、冷、干旱和盐。温度影响植物的生长、发育和地理分布,极端温度会对作物质量和生产力产生不利影响。当温度高于最佳温度时,植物开始经历热应激(HS)。植物通过复杂的途径感知和传递HS信号。热应激最初会增加质膜的流动性,研究人员提出HS通过这些膜流动性的变化激活环核苷酸门控通道家族蛋白[1,2]。虽然目前尚不清楚HS信号转导的组成,但已经确定了一些能够调节植物耐热性的HS信号成分,包括Ca2 +,钙依赖性蛋白激酶(CDPKs), 1,4,5-肌醇三磷酸(1,4,5- ip)3.)、环AMP (cAMP)和丝裂原活化蛋白激酶(MPK) [3.,4]。此外,基因表达的变化对植物适应高温胁迫至关重要。最近的研究报道,转录因子在转录水平上对植物对高温的反应很重要[5]。最新报道表明,高温诱导气孔打开以促进叶片降温需要蓝光,这表明植物中存在额外的细胞内高温响应途径[6]。
磷酸肌醇特异性磷脂酶C (PLC)是磷脂酰肌醇信号系统中的关键酶。许多品种有多个版本的PLC,和拟南芥有九个同工异构体[7]。plc参与植物的发育和应激反应。AtPLC2在拟南芥调节营养和花器官中的生长素水平,以影响雄性和雌性配子体的发育[8]。AtPLC2还通过调节磷脂酸、水杨酸和茉莉酸的生物合成来增强对内质网和干旱胁迫的耐受性[9,10]。的表达式TaPLC1和TaPLC2小麦是由盐或干旱引起的[11]。拟南芥PLC3参与ABA对种子萌发和气孔关闭的响应。种子atplc3突变体发芽缓慢,对ABA不敏感,阻碍了萌发[12]。此外,我们实验室之前的研究表明,过表达AtPLC9和AtPLC3拟南芥大大提高耐热性[13,14]。水稻基因组包括4个PLC基因,OsPLC1,OsPLC2,OsPLC3和OsPLC4,分别位于染色体3、5、7和12上。然而,拟南芥和大米PLC)家族基因没有显示出高度的相似性,这表明基因在进化过程中出现了分化[15]。oplc1提高水稻耐盐性[16]。在对盐胁迫的反应中,OsPLC1从细胞质移动到质膜,在那里它增加细胞质钙2 +,控制叶片中钠的积累,从而提高耐盐性[16]。OsPLC4还能增强渗透胁迫反应[17]。
大米(栽培稻)是一种重要的主粮作物,在种子萌发、生长和繁殖等各个生长阶段,特别是在繁殖和灌浆阶段,对高温胁迫都非常敏感[18,19,20.,21]。高温已被证明对水稻产量和品质有负面影响。极端高温使粮食产量显著下降50%以上,甚至使水稻完全丧失收成[22]。高温对水稻生长的各个阶段都有影响。在花期,热胁迫影响花粉萌发、花药开裂和花粉管伸长,导致授粉失败[23]。此外,高温影响了水稻籽粒中蛋白质的合成、运输、折叠和组装过程,抑制了淀粉生物合成相关基因的表达[j]。24]。提高水稻对高温胁迫的适应能力是十分必要的。然而,包括水稻在内的作物耐热性或热胁迫适应性的遗传基础尚不清楚。
中鉴定的基因的异源转化拟南芥对水稻等单子叶作物物种的研究可以帮助阐明基因功能,并鉴定能够赋予作物适应性性状(如耐热性)的基因。在这项研究中,我们的目的是确定通过PLC在水稻和玉米中传导热休克信号的异同拟南芥为了确定AtPLC9可用于提高栽培水稻的耐热性。我们克隆AtPLC9并在亚洲水稻品种“畅游1号”中异位表达。利用高通量RNA测序技术(RNA-seq),我们分析了基因表达诱导的转录组水平变化AtPLC9在水稻正常和热胁迫条件下。我们观察到水稻的异源性表达AtPLC9热休克因子(OsHSFAs)、钙离子和钙调素相关基因的表达明显高于野生型植物。我们的研究结果表明,AtPLC9可以提高水稻和油菜的耐热性拟南芥通过类似的机制。AtPLC9在单子叶和双子叶中都具有耐热性,这些结果表明HS响应的重要元素在单子叶和双子叶之间是保守的。我们的研究结果增强了对植物热休克反应分子机制的理解,并证明了这一点AtPLC9是分子育种中提高耐热性的重要资源。更广泛地说,这项研究强调了异源转化在分子育种中的潜力。
结果
的异源表达AtPLC9提高水稻耐热性
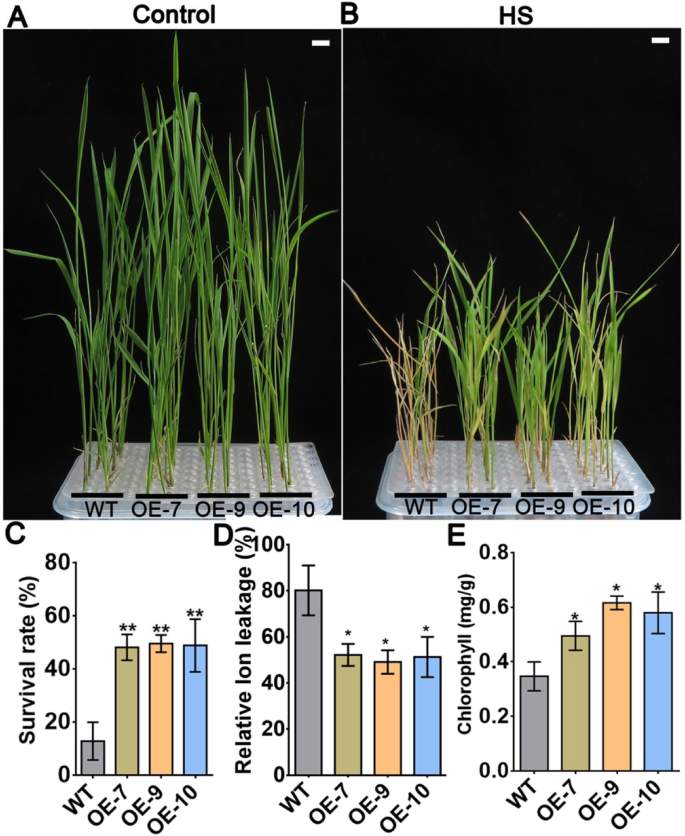
评估的耐热潜力AtPLC9在水稻中,我们异种表达AtPLC9由35S启动子驱动的编码区,如我们之前的研究所述[14],获得3个独立的T4纯合子转基因水稻品系:OE-7、OE-9和OE-10。三条线均表现较高AtPLC9表达水平高于野生型(WT),表明它们表达AtPLC9(补充图。1)。然后,我们对这三个系进行HS处理,以检查它们的表型。在28°C条件下生长的7日龄幼苗在45°C条件下处理15 min,或转移到37°C条件下处理30 min,然后返回正常条件(28°C)处理2 h,然后再次在45°C条件下处理45 min,分别测定基础耐热性和获得性耐热性。然后幼苗在28°C下生长7天,然后我们分析它们的表型,拍照并计算它们的存活率,电解质泄漏和叶绿素含量。更多的幼苗表达AtPLC9在基础耐热性和获得性耐热性试验中,与野生型相比存活(图2)。1a、b及附图2A, B). WT幼苗表现出严重的萎蔫和黄化,少数幼苗存活。相比之下,三种异源表达系的存活率明显超过WT(图2)。1c和补充图。2C)。相应地,hs诱导的电解质渗漏(质膜损伤指标)在AtPLC9在HS条件下,将转基因植株与WT植株进行比较(图2)。1d及补充图。2D)。HS处理后,3个异源表达系的叶绿素含量显著高于WT植株(图2)。1e和补充图。2E).这些结果表明AtPLC9大大提高了水稻的耐热性。
的表达AtPLC9提高水稻的基本耐受性。一个。以正常条件下(28°C)在霍格兰溶液中生长的14日龄水稻(WT和转基因品系OE-7、OE-9和OE-10)为对照。b。在正常条件下(28℃)在Hoagland’s溶液中生长的7日龄水稻(WT、OE-7、OE-9和OE-10)转移到45℃进行HS处理15 min,然后返回正常条件(28℃)再进行7 d。c。WT、OE-7、OE-9、OE-10经HS处理后的存活率。每个值为平均值±SE,n= 3。d。HS处理后植物的相对离子泄漏。每个值为平均值±SE,n= 3。e。HS处理后幼苗叶绿素含量;每次实验用新鲜组织0.1 g。每个值为平均值±SE,n= 3。学生的t采用-test进行计算P值。***p< 0.001, **p< 0.01, *p< 0.05, OE-7/−9/−10与WT比较有统计学意义。一个和b) = 1厘米
检查是否表达AtPLC9由于对其他非生物胁迫具有耐受性,我们对转基因品系进行了盐胁迫、干旱胁迫和冷胁迫试验。在200 mM NaCl处理7 d后,WT和3个转基因品系都出现了叶片枯萎(补充图2)。3.A)。盐处理14天后,所有植株均死亡,我们观察到WT和三种异源表达系对盐胁迫的反应没有差异(补充图2)。3.B).这些结果提示AtPLC9不能增强对盐胁迫的耐受性。
我们用不同浓度的甘露醇来模拟植物的干旱胁迫。在350 mM甘露醇环境下生长2天后,WT和3个转基因品系的叶片都出现了枯萎,并且比暴露于0 mM甘露醇环境下的对照植株要小。4A)。350 mM甘露醇处理10天后,WT和异源表达系均表现出叶片干燥和枯萎(补充图2)。4B). WT与三种转基因系的存活率差异无统计学意义,提示AtPLC9在水稻中不影响耐旱性。
之前的研究表明OsPLDa1通过增加细胞质钙浓度改善水稻对冷胁迫的响应2 +,从而增加冷响应C重复/脱水响应元件结合1 (OsDREB1)的转录活性[25]。因此,我们想知道AtPLC9是否也能提高水稻的耐寒性。为了解决这个问题,我们将WT和三个异源表达系置于冷胁迫下。在28℃下生长7天的幼苗转移到4℃进行7天的冷处理。在4°C条件下,WT和异源表达系在株高方面表现出相似的限制(补充图)。5A和5B),这表明AtPLC9不影响水稻的耐寒性。结论:AtPLC9特别提高水稻对热胁迫的耐受性,而不是其他非生物胁迫。
热应激触发转录组重编程AtPLC9异源表达系
为了确定AtPLC9如何协调水稻对HS的响应,我们评估了HS处理后的异源表达系的转录组。我们首先评估了热休克因子(hsf)的表达水平;Os03g0745000,Os04g0568700,Os08g0546800多蛋白桥接因子1c (MBF1Os06g0592500)和热休克蛋白(HSPs)OS01g0136000和Os03g0266900)。类似的AtPLC9在3个转基因水稻品系(OE-7、OE-9和OE-10)中检测到表达水平,且表现出相同的表型;因此,在后续的实验中只使用了OE-7。在HS之前和之后,这些基因在OE-7和WT之间的表达水平没有显著差异(补充图)。6)。这一结果表明AtPLC9可能通过其他基因调控HS应答,因此我们进行了Illumina高通量测序,寻找其他调控途径。
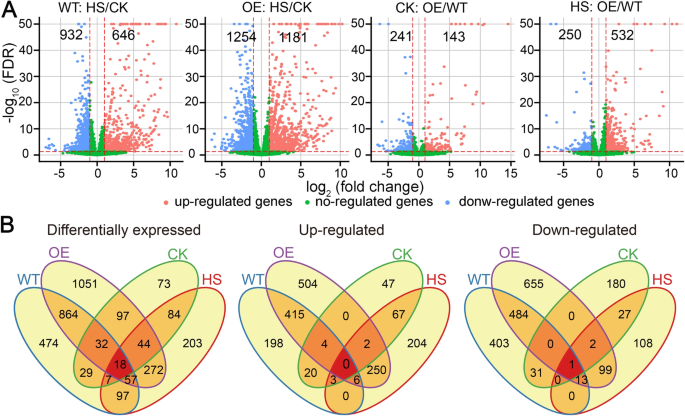
我们比较了四种样品的表达谱,分别是WT-CK(未经过HS的野生型)、WT-HS(经过15分钟HS的野生型)、e -7- ck (AtPCL9-表达不含HS的第7行)和OE-7-HS (AtPCL9-在15分钟HS后表达7号线)。每个样本包含3个生物重复,从中产生约8.798亿个150 bp的成对末端reads(补充表)1)。在丢弃低质量的reads后,保留6360 - 8420万条reads用于后续分析。超过88%包含不超过3个错配的reads被映射到参考基因组,超过73%的reads显示独特的比对(补充表)1)。主成分分析(PCA)(图2)2a)和分层聚类在生物重复中显示出高再现性(图2)。2b)。此外,PCA揭示了正常和HS条件下表达谱的明显差异(图2)。2a).热应激放大了OE-7和WT之间表达谱的差异(图2)。2A),这与我们的表型观察一致。
的表达AtPLC9在水稻中提高获得性耐热性。一个。以正常条件(28℃)下生长的14龄水稻(WT和转基因品系OE-7、OE-9和OE-10)为对照。白色条= 1厘米。b。将正常条件(28℃)下生长的7 d龄水稻(WT、OE-7、OE-9和OE-10)移至37℃处理30 min,然后返回正常条件(28℃)处理2 h, 45℃HS处理45 min。处理后,幼苗返回28°C,再放置7 d。白色条= 1 cm。c。WT、OE-7、OE-9、OE-10经HS处理后的存活率。每个值为平均值±SE,n= 3。d。HS处理后植物相对离子泄漏量定量。每个值为平均值±SE,n= 3。e。HS处理后幼苗叶绿素含量;每次实验用新鲜组织0.1 g。每个值为平均值±SE,n= 3。学生的t-test用于计算P价值。* *表示P< 0.01, *表示P值< 0.05,OE-7/−9/−10与WT比较有统计学意义
然后,我们对两种基因型进行了正常和HS条件下的差异表达分析,命名为WT:HS/CK和OE-7:HS/CK。以fold change≥2和False Discovery Rate (FDR) < 0.05为截断值,我们在WT:HS/CK比较中鉴定出1578个差异表达基因(deg),其中932个基因被HS上调,648个基因被HS下调(图2)。3.一个;补充数据集1)。e -7:HS/CK的deg数量(2435个)、上调基因数量(1181个)和下调基因数量(1254个)均高于WT:HS/CK(图2)。3.一个;补充数据集2),表明HS后OE-7发生了更广泛和动态的转录组重分析。维恩图结果显示,在OE-7:HS/CK比较中特异性存在1464个deg(60.12%)、756个上调基因(64.01%)和756个下调基因(60.29%)(图2)。3.b),被指定为oe -7特异性基因。接下来,我们对HS后WT和OE-7中表达水平改变的基因进行了基因本体(GO)项富集分析。已知的HS GO术语在WT和e -7中受热量上调的基因中都显著富集,包括“对热量的反应”(GO:0009408)、“蛋白质折叠”(GO:0006457)和“对渗透胁迫的反应”(GO:0006970)。7)。在暴露于HS的WT和OE-7中下调的基因中富集的氧化石墨烯术语包括“运输”(GO:0006810)、“油菜素内酯稳态”(GO:0010268)和“磷酸化”(GO:0016310)。7)。一些氧化石墨烯术语仅在oe -7特异性hs上调基因中显著富集,例如“应激反应调节”(GO:0080134)、“代谢过程调节”(GO:0019222)和“基因表达调节”(GO:0010468)。7)。为了进一步评价表达变化的总体趋势,我们计算了WT和OE-7在HS后基因表达水平的倍数变化与非胁迫条件下基因表达水平的倍数变化之间的Pearson相关系数。在OE-7中,“热反应”相关基因(GO:0009408)的表达变化率与WT中相应的比值密切相关(R = 0.97;补充图。8)。而其余基因的表达变化仅为中度正相关(R = 0.58)。8)。这些结果表明,HS在e -7中诱导的转录组重编程与WT中相应的转录组变化相似,但又有区别。综上所述,上述结果表明,在热胁迫后,转基因植物中发生了更广泛和动态的转录组重分析,这种广泛的转录组变化可能解释了异源表达的转录组的耐热性AtPLC9。
水稻异源性表达AtPLC9在HS下,转录因子和Ca的表达显著增加2 +/calmodulin (CaM)信号转导通路基因
我们还比较了正常条件下(CK:OE-7/WT)和HS条件下(HS:OE-7/WT) OE-7和WT的转录组。我们在正常和HS条件下分别检测到384和782度(图2)。3.一个;补充数据集3.和4)。与主成分分析结果一致(图1)。2),高温胁迫下的deg数量是无应力条件下的两倍。有趣的是,HS条件下,有532个基因在OE-7中表达水平上调,显著高于非胁迫条件下对应基因的数量(143个)。3.a)。然而,在HS(250)和CK(241)的比较中,下调基因的数量相似(图2)。3.a).与CK:OE/WT比较,我们鉴定出HS:OE/WT比较中特异性存在629个deg, 460个上调基因和220个下调基因(图2)。3.B),分别代表80.43、86.47和88.00%。这些基因被指定为hs特异性基因。氧化石墨烯术语富集分析显示,在HS:OE-7/WT比较中上调的基因主要富集在“应激反应调节”(GO:0080134)、“代谢过程调节”(GO:0019222)和“基因表达调节”(GO:0010468)等术语中,这些术语也在OE-7 HS诱导的基因集中特异性富集(补充图1)。7)。
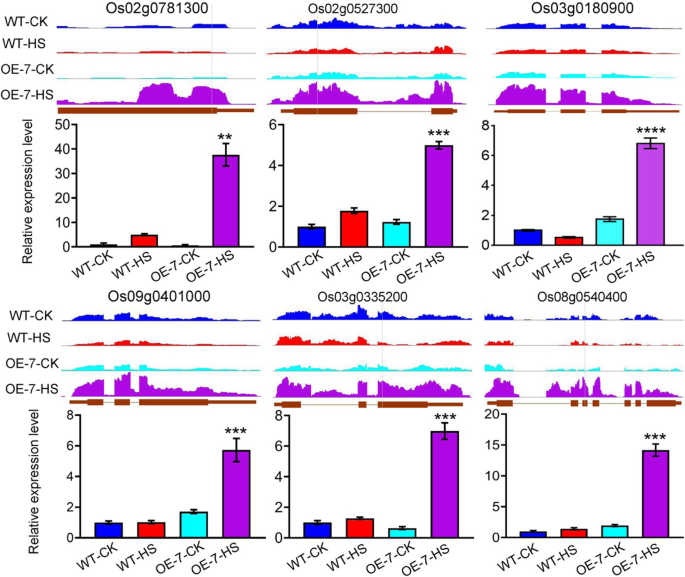
在OE-7-和hs -特异性基因之间,我们检测到272个DEGs, 250个上调基因和99个下调基因重叠(图2)。3.b),我们确定这是水稻HS响应中AtPLC9调控的潜在靶点。我们对这些基因进行了GO项富集分析,以研究AtPLC9在HS过程中可能调控的靶标的功能。在下调的靶基因中没有特异性的氧化石墨烯项富集(图2)。4)。上调的靶基因和deg在相同的氧化石墨烯条件下富集(图2)。4)。由于AtPLC9是HS反应的正向调节因子[14],对250个上调的靶基因进行了更详细的分析(补充数据集)5)。这些上调的靶基因在GO术语“转录调控”(GO:0045449)和“基因表达调控”(GO:0010468)中富集。4),这表明其中一些靶基因可能是转录因子(TFs)或转录调节因子(TRs)。使用iTAK管道[26],我们在这些靶基因中鉴定并分类了来自13个家族的52个推测的TF(51)和TR(1)成员,包括WRKY (11);Os03g0335200), ap2 / erf (9;Os02g0781300), Tify (7;Os03g0180900), myb (6;Os09g0401000)及HSF (1;Os02g0527300)。Ca2 +/calmodulin (CaM)信号转导通路在热应激反应中起重要作用[14]。从这250个上调的靶基因中,我们鉴定出17个基因在这一途径中起作用,如钙依赖性蛋白激酶(CDPKs)。为了检验转录组水平分析的准确性,我们使用定量RT-PCR验证了随机选择的6个上调靶基因的表达水平,包括5个tf和1个CDPK (Os08g0540400)。与RNA-seq数据一致,RT-qPCR显示,与HS后的WT相比,这6个基因在OE-7、OE-9和OE-10中的表达水平显著升高(图2)。5及补充图9)。总之,这些发现表明特定tf和Ca的表达2 +/ CaM通路相关基因被HS特异性上调AtPLC9-表达系,这可能有助于提高这些系的耐热性。
使用实时定量PCR验证六个潜在AtPLC9靶基因的RNA-seq数据。利用集成基因组浏览器(IGB)可视化RNA-seq信号http://www.bioviz.org)和实时定量PCR对野生型(WT)和OE-7植物中6个候选atplc9调控基因的RNA水平进行定量分析。RT-qPCR结果值为平均值±SE (n= 3)。学生的t采用-检验计算P值。* * * *P< 0.0001, ***P< 0.001, **P值< 0.01,OE-7-HS与WT-HS比较有统计学意义
讨论
在这项研究中,我们改造了拟南芥基因AtPLC9对水稻品种‘畅游1号’进行了耐热表型鉴定,并分析了高温胁迫诱导的转录组水平变化AtPLC9在正常和HS条件下。本研究有助于了解AtPLC9在单子叶植物和双子叶植物中的生物学功能、分子机制和耐热机制。我们的结论是AtPLC9是一种宝贵的基因资源,赋予单子房和双子房耐热性,为通过分子育种计划提高作物耐热性奠定了基础。
AtPLC9赋予单子叶植物和双子叶植物耐热性
我们之前的研究表明,AtPLC9和AtPLC3都能增强植物的耐热性拟南芥(13,14,27]。在本研究中,我们观察到了水稻的异源表达AtPLC9也表现出更好的耐热性。的存活率AtPLC9这些结果表明,涉及AtPLC9的HS响应成分在单子叶植物和双子叶植物之间是保守的。
当水稻受到盐胁迫时,OsPLC1从细胞质转移到细胞膜,在那里它调节钙2 +反应(16]。在本研究中,表达OsPLC1和OsPLC2HS处理后增高。然而,OsPLC3和OsPLC4不受热应激的显著上调(补充图2)。10)。需要更多的研究来确定osplc如何响应HS的分子机制。评估内源osplc在高温胁迫后的功能将有助于我们更全面地了解PLC对水稻耐热性的调控。
基于我们之前的研究,我们提出植物对HS的反应是通过钙-钙调素热休克途径进行的。钙-钙调素通路现在被认为是热休克反应的主要通道[2,28,29]。热休克后,信号从细胞膜传递到细胞内目标。热休克增加细胞质钙的浓度,从而增加CALMODULIN 3 (CaM3)的表达。CAM-BINDING PROTEIN KINASE 3 (CBK3)调节热休克因子(HSFs)对热休克因子(HSEs)的磷酸化状态和结合活性,最终通过促进或抑制热休克因子的表达来调节耐热性[j]。3.,4,30.,31,32]。在动物细胞中,IP3.绑定IP3.细胞膜系统上的受体,释放钙2 +源自intracellular stores [33,34]。然而,目前尚不清楚PLC在植物中的作用是否与在动物中的作用相同。初步研究表明,在热休克后1分钟内,IP水平3.迅速增加。3分钟后,IP3.浓度最高可达热休克前浓度的2.5倍[22]。此外,IP3.能诱导表达吗HSP18.2启动子:GUS在没有热休克的情况下[3.]。磷脂酶c特异性抑制剂U73122限制了热休克诱导的IP增加3.和Ca2 +在拟南芥悬浮细胞[3.]。AtPLC9生成IP3.在HS后的细胞中,刺激Ca的释放2 +从细胞内储存和促进热休克信号的传递[14]。
在我们目前的研究中,我们观察到水稻的异源表达AtPLC9暴露于HS时,OsHSFAs、钙离子和钙调素相关基因的表达明显高于WT。这些结果表明,AtPLC9可能提高水稻和油菜的耐热性拟南芥通过类似的机制,这意味着HS反应的重要元素在单子代和双子代之间是保守的。
AtPLC9对热休克具有特异性耐受性,但对其他非生物应激没有耐受性
AtPLC4,5,7在拟南芥都在盐或干旱胁迫下被上调[35]。最近的研究表明,OsPLC1通过增加细胞质钙浓度来调节水稻的耐盐性2 +。在盐胁迫下,OsPLC1从细胞质移动到质膜,在那里它增加细胞质Ca2 +它调节Na+叶片积累,提高耐盐性[16]。我们实验室前期的研究表明,AtPLC9调节细胞质Ca的浓度2 +通过第二个信使IP3.影响HSF和HSP的表达,增强耐热性拟南芥(13,14]。AtPLC4对盐胁迫有反应,其突变体也表现出低敏感性表型[36]。
在我们目前的研究中,我们暴露了水稻的异源表达AtPLC9AtPLC9基因在盐胁迫和干旱胁迫下的生长、表型和存活率与野生型无显著差异。这些结果表明,AtPLC9基因在水稻中的功能与osplc基因不同,前者不影响水稻对盐胁迫和干旱胁迫的敏感性。已有研究表明,ospld α 1对冷胁迫有响应[25]。然而,在冷胁迫处理后,我们观察到WT和水稻异种表达之间的生长没有差异AtPLC9这表明AtPLC9不能提高水稻的耐寒性。我们得出结论,异种表达AtPLC9只对热有更强的耐受性,但对其他非生物压力没有。杂交耐受性是植物适应环境胁迫的重要策略。例如,耐热性也提高了其他应力拟南芥(37]。然而,在本研究中,我们发现AtPLC9转基因水稻对热胁迫有特异性反应(图2)。1和补充图2)。我们推测这可能有两个原因。首先,对交叉适应的产生进行顺序调节。第二,热应激信号转导可能部分独立于其他应激。这一结果也为今后交叉适应机制的研究提供了实验线索。
转录水平的动态变化可能是单子房和双子房应对短期高温胁迫的重要策略
与野生型相比,水稻植株具有异源性表达AtPLC9暴露于高温胁迫下,表现出更多的转录变化,包括TFs的表达水平变化,这表明基因转录调控是植物应对短期高温胁迫的重要策略。
我们还观察到Ca的异常表达2 +相关信号通路基因AtPLC9-表达转基因水稻,表明Ca2 +信号传导可能是植物对短期压力做出相对快速反应的重要途径。选择6个标记基因进行表达分析。这六个基因对环境因素的反应已在植物基因数据库(http://bioinfo.sibs.ac.cn/plant-regulomics/index.php) [38],一个综合在线数据库。转录组学比较结果表明,在以往的研究中,这6个基因的表达水平均可受到生物或非生物胁迫的调控。研究结果(GSE33204)表明Os02g0527300(OsHsfA3),Os03g0335200(OsWRKY44)表现为上调,高温处理6H后水稻30天龄叶片表现为下调[39]。然而,在我们的研究中,这三个基因在热应激诱导的WT中并没有表现出交替的表达水平,这可能与不同的基因型、发育阶段、组织或处理条件有关。其余基因的表达可被其他生物或非生物胁迫诱导或显著抑制。例如,Os08g0540400 (OsCPK21)受盐处理显著诱导,在小穗和发育中的种子中高表达,可以提高水稻的耐盐性[40]。除基因表达调控外,影响高温胁迫反应的因素很多。因此,这也可能是有趣的研究耐热表型诱导AtPLC9组织学检查表达式。
异种转化用于评估基因功能和赋予适应性性状的可行性
异源转化有助于研究基因功能,可用于提高作物产量。该研究表明,AtPLC9也能在单子叶水稻中发挥作用。异源转化在农业生产中有着广泛的应用,包括野生种与栽培种之间以及不同科之间的基因转移。然而,研究异源转化必须考虑物种间的遗传多样性和进化关系。异源基因如果在差异过大的物种之间转移,可能无法保持其功能。
我们展示了与热相关的基因AtPLC9从拟南芥在大米中有很好的抵御热休克的作用。这有助于我们了解植物热休克反应的分子机制。进一步探索AtPLC9在其他植物物种中的表达,可以为我们了解Ca中元素的功能保护提供更多信息2 +/CaM HS信号转导通路。此外,我们的研究结果强调了异源转化在单子房和双子房的分子育种中具有潜在的辅助作用。
方法
植物材料和生长条件
水稻幼苗在光照培养箱中水培,光照16 h(28°C) /光照8 h(28°C)。在45°C的水浴中进行热处理。将在液体培养基中生长7 d的幼苗移入水浴中进行45°C HS处理。同时,对照植株同时放入28℃的水中。在低温培养箱中4°C进行冷处理。在盐处理中,分别处理0 mM、50 mM、100 mM、150 mM和200 mM NaCl。为了模拟干旱,植物分别暴露于0 mM、150 mM、250 mM或350 mM甘露醇中。以未经处理的幼苗为对照。
叶绿素含量和离子泄漏的测量
叶绿素含量的测定方法由[41]。
经HS处理后,在4 ml去离子水中收获0.1 g幼苗。采用电导率计(METTLER TOLEDO FE38)测定溶液的电导率。相对离子泄漏按[25]。
基因表达分析
从14日龄的幼苗中提取总RNA,翻译成cDNA,作为定量PCR的模板。AtPLC9采用RT-PCR技术,利用引物扩增转基因植株的转录本丰度AtPLC9编码区(补充表2)。OsTUBULIN作为对照。采用实时定量PCR技术对WT和OE-7植株中atplc9调控基因的表达量进行定量分析。的表达Os02g0781300,Os02g0527300,Os01g0968800,Os09g0401000,Os03g0335200,Os08g0540400和Os02g0781300用补充表?给出的引物进行分析2。表达水平的定量OsPLC用引物进行实时定量PCR,引物描述为[16]。
RNA测序分析
使用TRIzol试剂盒(Invitrogen)从14日龄的幼苗中分离总RNA。使用TruSeq RNA Sample Preparation Kit version2 (Illumina)制备平均插入长度为200 bp的配对端测序文库,并根据制造商的标准协议在HiSeq Xten上测序。FastQC (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/),以评估所有测序reads的整体质量。使用参数为pe-mode的Sickle过滤掉质量差的读数;−t sanger-q 20 -l 50 (https://github.com/najoshi/sickle)。剩余的高质量读数被映射到粳稻参考基因组(http://plants.ensembl.org/Oryza_sativa/Info/Index),使用TopHat v2.09,参数为“- n3 - read- edit-dist 3-segment-mismatches 1 -p 20 -r 0 -g 20 - microexon-search-b2-D 20 - b2- R3-no-coverage-search”,并且仅保留具有独特比对的reads用于以下分析。使用默认参数的袖扣(2.2.1)的cuffquant和cuffnorm分量归一化和估计基因表达水平。只有在至少一个样本中平均表达水平为每千碱基转录物每百万映射reads (FPKM) 1个reads的基因才被认为是表达基因,并用于计算每个样本重复的Pearson相关系数和PCA。HTseq软件(http://www-huber.embl.de/users/anders/HTSeq/doc/overview.html)被用来计算每个基因的读取计数。使用Bioconductor“edgeR”包进行差异表达分析[42]。在后续分析中,只有FDR < 0.05且log2 (fold change)绝对值≥1.0的基因才被认为是deg。使用AgriGO提供的奇异富集分析分析氧化石墨烯项富集[43]采用超几何检验,以FDR < 0.05为截止。稻米GO条款可从EnsemblPlants下载(http://plants.ensembl.org/index.html)作为背景资料。RNA-seq数据存储在NCBI SRA数据库(http://www.ncbi.nlm.nih.gov/sra),生物计划编号PRJNA597792。
数据和材料的可用性
本研究使用和分析的数据集和资料可应相应作者的合理要求提供。
缩写
- 海关:
-
热休克
- CDPKs:
-
钙依赖性蛋白激酶
- 1, 4, 5-IP3.:
-
1, 4, 5-inositol三磷酸
- 公司:
-
磷酸肌醇特异性磷脂酶C
- 凸轮:
-
钙调蛋白
参考文献
小立小苔CNGCb和CNGCd基因编码响应质膜流动性变化的热感觉钙通道。细胞应激伴侣。2014;19:83-90。
李波,高科,任宏,唐伟。植物高温响应的分子机制。植物学报,2018;36(2):759 - 759。
刘海涛,高峰,崔世杰,韩建林,孙元达,周荣国。IP3参与拟南芥热休克信号转导的初步证据。Cell Res. 2006a;16:394。
刘海涛,高峰,李国良,韩建林,刘德龙,孙元达,等。钙调素结合蛋白激酶3是拟南芥热休克信号转导的一部分。植物学报。2008;22(5):564 - 564。
李波,高震,刘霞,孙东,唐伟。拟南芥中REVEILLE 4/8基因在调控热休克诱导的第一波基因表达中的转录谱分析。植物学报。2019;31:2353-69。
郭志强,郭志强,孙鹏,等。保护细胞整合光和温度信号来控制气孔孔径。植物生理学报。2020;42(2):1404 - 1409。
王晓明,王晓明,王晓明,等。拟南芥中磷酸肌醇酶基因家族的表达与进化。植物生理学报。2008;46(6):627 - 637。
李建军,李建军,李建军,等。拟南芥磷脂酰肌醇磷脂酶C2 (PLC2)是雌性配子体发生和胚胎发育所必需的。足底。2017;245:717-28。
Kanehara K, Yu CY,曹Y,昌WF蛋糕F, G水,等。拟南芥AtPLC2是参与磷酸肌醇代谢和内质网应激反应的主要磷酸肌醇特异性磷脂酶C。科学通报,2015;11:e1005511。
李磊,何勇,王勇,赵松,陈旭,叶涛,等。拟南芥PLC2参与生长素调控的生殖发育。植物学报,2015;34(4):591 - 591。
张凯,金超,吴磊,侯敏,窦生,潘艳。小麦胁迫相关磷酸肌醇特异性磷脂酶C基因的表达分析。PloS one。2014; 9: e105061。
张强,van Wijk R, Shahbaz M, Roels W, Schooten BV, Vermeer JEM,等。拟南芥磷脂酶C3参与种子萌发和气孔关闭过程中侧根形成和ABA响应。植物生理学报,2017;39(5):469 - 469。
高凯,刘玉玲,李斌,周荣国,孙元达,郑思忠。磷酸肌苷特异性磷脂酶C异构体3 (AtPLC3)和AtPLC9在拟南芥的耐热性中相互作用。植物生理学报,2014;55(5):573 - 583。
郑淑贞,刘玉玲,李波,尚志林,周荣国,孙德耀。拟南芥磷酸肌苷特异性磷脂酶C9与耐热性相关。植物科学学报,2012;39(1):391。
Singh A, Kanwar P, Pandey A, Tyagi AK, Sopory SK, Kapoor S等。水稻非生物胁迫和发育过程中磷脂酶C基因家族的综合基因组分析和表达谱分析。科学通报,2013;8:e62494。
李磊,王峰,严鹏,景伟,张超,Kudla J,等。磷酸肌醇特异性磷脂酶C途径引发胁迫诱导的Ca(2+)信号并赋予水稻耐盐性。新植物学报,2017;22(4):1172 - 187。
邓祥,袁生,曹华,林思敏,水光,洪勇,等。磷脂酰肌醇水解磷脂酶C4调节水稻对盐和干旱的响应。植物学报。2019;42(2):536 - 548。
Arshad MS, Farooq M, Asch F, Krishna JSV, Prasad PVV, Siddique KHM。热胁迫影响水稻的生殖发育和产量。植物生理学报,2017;15(5):557 - 572。
刘刚,查忠,蔡辉,秦东,贾华,刘超,等。耐热水稻花期花药对热胁迫响应的动态转录组分析。中国生物医学工程学报,2020;21(1):1155。
Wahab MMS, Akkareddy S, Shanthi P, Latha P.水稻热胁迫条件下差异表达基因的鉴定。中华生物医学杂志,2020;47(1):135 - 135。
周宏,王霞,霍超,王宏,安忠,孙东,等。利用双向凝胶电泳技术对水稻早期热调控蛋白进行了定量蛋白质组学研究,发现OsUBP21是水稻热胁迫反应的负调控蛋白。蛋白质组学。2019;19:e1900153。
冯斌,张超,陈涛,张欣,陶磊,傅刚。水杨酸对水稻热胁迫下花粉败育的逆转作用。植物生态学报,2018;18(2):245。
Jagadish KSV, CP,石伟,Oane R.水稻小孢子发生过程中热胁迫影响的表型标记。植物学报,2013;41(41):48-55。
张春霞,冯保华,陈婷婷,傅文明,李红兵,李国勇,等。水稻开花期热胁迫导致的粒重降低与源库关系和糖分配受损有关。环境科学学报,2017;33(5):718 - 733。
霍超,张斌,王辉,王峰,刘敏,高勇,等。利用双向凝胶电泳技术对水稻早期冷调控蛋白进行比较研究,揭示了磷脂酶d- α1在水稻冷驯化信号通路中的关键作用。生物工程学报。2016;15:1397。
郑艳,焦晨,孙慧,Rosli HG, Pombo MA,张鹏,等。植物转录因子、转录调控因子和蛋白激酶全基因组预测与分类的iTAK软件。植物学报,2016;9(1):1667 - 70。
任宏,高凯,刘勇,孙东,郑松。AtPLC3和AtPLC9基因在拟南芥耐热性中的作用。植物信号学报,2017;12:1162368。
刘建军,刘建军,刘建军,等。植物热感知和信号转导的研究进展[j]。植物学报,2011;19(2):556 - 565。
刘健,冯磊,李军,何忠。植物热响应的遗传与表观遗传调控。植物科学,2015;6:267。
刘海涛,李国良,常红,孙达元,周荣光,李冰。钙调素结合蛋白磷酸酶PP7参与拟南芥的耐热性。植物学报。2007;30(3):556 - 564。
刘海涛,黄卫东,潘庆华,翁凤华,詹锦江,刘勇,等。PIP(2)特异性磷脂酶C和游离水杨酸对热驯化诱导豌豆叶片耐热性的贡献植物生理学报,2006;22(3):559 - 564。
刘海涛,孙达元,周荣国。Ca2+和AtCaM3参与拟南芥热休克蛋白基因的表达。植物学报。2005;28:1276 - 1284。
李建军,李建军,李建军,等。红甜菜根液泡膜钙离子通道的研究进展。大自然。1990;343:567 - 70。
王晓明,王晓明,王晓明,等。钙离子在肌醇- 1,4,5-三磷酸的时空动力学研究。科学。1999;284:1527-30。
Hirayama T, Ohto C, Mizoguchi T, Shinozaki K.一个编码磷脂酰肌醇特异性磷脂酶C的基因在脱水和盐胁迫下的诱导。科学通报,1995;32(2):393 - 397。
夏凯,王斌,张军,李勇,杨华,任东。拟南芥磷酸肌苷特异性磷脂酶c4负调控幼苗耐盐性。植物学报。2017;39(4):557 - 557。
Banti V, Loreti E, Novi G, Santaniello A, Alpi A, Perata P.拟南芥的热驯化和耐缺氧交叉抗性。植物学报。2008;31(1):29 - 37。
冉翔,赵峰,王毅,刘健,庄毅,叶磊,等。植物调节组学:一个数据驱动的接口,用于从植物多组学数据中检索上游调节因子。植物科学学报,2010;31(1):387 - 398。
刘忠,赵军,李勇,张伟,简刚,彭勇,等。转基因水稻花恢1号差异表达基因在不同发育阶段和不同环境下的不均匀分布规律科学通报,2012;7:37078。
浅野T,博多M,中村H,青木N,小松S,市川H,等。OsCPK21的功能特征,一种钙依赖性蛋白激酶,赋予水稻耐盐性。植物化学学报,2011;25(5):591 - 591。
亚迪。分离叶绿体中的铜酶。甜菜中的多酚氧化酶。植物生理学报。1949;24:1-15。
罗宾逊MD,麦卡锡DJ,史密斯GK。edgeR:用于数字基因表达数据的差异表达分析的Bioconductor包。生物信息学,2010,26(1):139 - 40。
田涛,刘勇,闫宏,游强,易晓,杜志,等。agriGO v2.0:面向农业社区的GO分析工具包,2017更新。中国生物医学工程学报,2017;45(5):522 - 522。
致谢
感谢李宜鑫在田里种水稻苗。感谢河北省科协组织的“河北银花计划”。
资金
国家自然科学基金项目(31870243)、河北省自然科学基金项目(C2018205210和C2019205055)、河北师范大学启动基金项目(L042018B01和L2019B20)和中国博士后科研基金项目(2019 M651060)资助。
作者信息
从属关系
贡献
刘永亮和郑思哲做了大部分的实验工作。X.Y. Liu对RNA-seq数据进行分析,并将RNA-seq分析结果写在稿件中。X. Wang进行RNA提取和定量PCR实验。高锟帮助收集大米资料,并提供手稿组织和写作方面的建议。齐伟伟、任宏明和胡宏润帮助进行了盐、甘露醇和冷处理实验。孙德耀为实验提供了建议。郑守正和白建堂设计了所有的实验并撰写了手稿。所有作者已阅读并同意稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明没有利益冲突。
额外的信息
出版商的注意
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1:补充数据集1
: HS处理与对照组WT差异表达基因列表。
附加文件2:补充数据集2
: HS处理与对照OE7的差异表达基因列表。
附加文件3:补充数据集3
:未经HS处理的OE7与WT的差异表达基因列表。
附加文件4:补充数据集4
: HS处理后OE7与WT的差异表达基因列表。
附加文件5:补充数据集5
:推测的靶基因列表及功能注释。
附加文件6:补充数据集6
:从Plant Regulomics数据库中选择6个AtPLC9靶点的转录组学比较结果。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
刘,Y,刘,X,王,X。et al。热应激应答AtPLC9的异源表达使转基因水稻具有耐热性。BMC Plant Biol20.514(2020)。https://doi.org/10.1186/s12870-020-02709-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-020-02709-5
关键字
- AtPLC9
- Ca2 +
- 不同的表达
- 大米
- 耐热性