摘要
背景
在植物发育期间,类黄酮途径在空间和时间上控制,并且结构基因的转录调节主要由三元蛋白质复合物策划,涉及三类转录因子(R2-R3-MYB,BHLH和WDR)。在葡萄(葡萄L.),已经确定了几种MYB转录因子,但与其推定的BHLH合作伙伴的相互作用仍然清楚地理解了本发明的类黄酮途径的特异性分支。
结果
在这项工作中,我们描述了位于VVMYB5B的R2结构域中的单个氨基酸取代(R69L)的效果,并预测蛋白质中的盐桥的形成。突变蛋白的活性(名称VVMYB5Bl这种天然蛋白质被称为VvMYB5bR)被评估为不同在活的有机体内系统:酵母,葡萄细胞悬浮液和烟草。在前两个系统中,VVMYB5Bl表现出改良的反式活化能力。此外,通过酵母双杂交实验,我们证明了修改VvMYB5b的转录特性会损害其与葡萄bHLH蛋白VvMYC1的正确互作能力。进一步证实了上述结果VVMYB5B.R和VVMYB5B.l烟草中的基因。从鲜花35S :: VVMYB5B.l转基因植物与其相比之下表现出明显的表型35S :: VVMYB5B.R和对照植物。最后,观察到类黄酮代谢基因的转录物丰度的显着差异以及颜料积累的变化。
结论
我们的发现结合在一起,表明VVMYB5Bl仍然能够结合DNA,但与突变相关的结构后果影响蛋白质通过与其共同伴侣的相互作用来激活一些类黄酮基因的转录。此外,本研究强调了内盐桥用于蛋白质构象的重要性,从而强调了在MYB和BHLH转录因子之间建立蛋白质 - 蛋白质相互作用。讨论了这些相互作用的基础的机制,提出了一种模型来解释VVMYB5的转录活动l在烟草模型中观察到。
背景
MYB蛋白是一种广泛分布的真核转录因子。在植物中,MYB基因构成一个包含198个成员的大家庭拟南芥蒂利亚纳例如。在米饭中也观察到这种大型家庭(栽培稻L.SSP。籼稻)和葡萄(葡萄L.),成员分别不少于85人和108人[1- - - - - -3.].植物MYB蛋白参与了许多生理过程的调节[4例如,众所周知,它调节苯丙素途径,允许类黄酮、二苯乙烯和木质素化合物的生物合成[4- - - - - -7].
现在已经确定,参与花青素和原霉素(PA)途径调节(PA)途径的MYB蛋白与BHLH合作伙伴(碱性螺旋环螺旋)和WD重复蛋白(WDR或WD40)协同作用,以增强结构基因的表达(审查[8- - - - - -10])。发现此类三方MYB-BHLH-WDR(MBW)复合物在Petonia花中调节花青素生物合成[11- - - - - -13]和PA的积累拟南芥种皮[14].在葡萄树中,一些类黄酮生物合成的分支是对不同MYBS蛋白的转录控制[15- - - - - -21].其中,两种MYB转录因子VvMYB5a和VvMYB5b参与了该通路共同部分的转录调控[20.,21].VVMYB5B.在葡萄浆果中表达在种子的合成和皮肤中的花青素积累期间。在烟草,VVMYB5B.异位表达导致花青素和PAS中的花(雄蕊和花瓣)积聚,植物子宫中没有明显的变化[21].如前所述拟南芥和佩妮,MYB转录因子需要BHLH合作伙伴的类黄酮结构基因的晶体激活[17,21].最近,两个bHLH转录因子(VvMYC1和VvMYCA1)和两个WDR蛋白(WDR1和WDR2)在葡萄中被鉴定[22,23].VVMYB5B在酵母中相互作用在足底与VvMYC1 [22].因此,在葡萄浆果中,提出了MBW复合体的每个组分之间的相互作用以控制每种类类黄酮化合物的时空分布。在这种时空控制中,三个组分必须发挥关键作用:(i)在给定组织中的给定时间的蛋白质存在蛋白质,(ii)每个蛋白质的DNA结合亲和力为其靶基因,以及(III)伴侣之间的特定组合将导致激活特异性结构基因表达。虽然已经研究了MYB和BHLH蛋白之间的蛋白质 - 蛋白质相互作用体外[24- - - - - -26],整个MBW转录复合物形成的机制尚未确定。在这个复合物中,MYB蛋白在测定中起着关键作用CIS.- 因此为靶基因的选择有助于选择靶基因。但是,MYB蛋白质和蛋白质之间的亲和力CIS.-元素可能部分取决于相互作用bHLH伙伴的性质,考虑到相互作用可以修改MYB dna结合域的结构构象这一事实[9,27- - - - - -29].
MyB蛋白质的特征在于存在极良好的保守的N-末端结构域,其含有最多三种缺陷R重复(R1,R2和R3),每种氨基酸残基约为53个氨基酸残基。这些重复包含三个字母螺旋,采用常见的构造,名为Helix-Turn-Helix动机。脊椎动物C-MYB中的三个重复的结构研究表明,R2和R3都是序列特异性结合所需的,而R1不参与序列识别[30.].在每一次重复中,三个α螺旋被一个疏水核心稳定下来,该核心包括三个有规律间隔的色氨酸残基。在R2和R3重复序列中,c端螺旋参与DNA特异性识别过程和蛋白质插入到DNA主槽中。有人认为R3的识别螺旋与myb结合序列(MBS)的核心相互作用。相比之下,R2 c端螺旋与邻近核苷酸的相互作用不那么明确[31- - - - - -33].最后,R3重复序列也被提议为蛋白-蛋白相互作用,特别是与bHLH辅助因子提供一个平台[24].
改变三元复合物的任何成员之间的蛋白质 - 蛋白质相互作用而不影响它们的固有性质(DNA结合活性和/或复合物的稳定化),这在提高了这些蛋白质复合物的基本知识方面,但也可能是显着的价值有助于提出创新的工程策略,以增强植物系统模型中特定次生代谢产物的生物合成。在葡萄树中,与VVMYBA1或VVMYBPA1和2如VVMYBA1或VVMYBPA1和2等更具体的转录因子相比,VVMYB5B的更广泛的监管影响使其成为这种工程战略的潜在候选者[21].在这项研究中,我们研究了位于R2结构域的第三螺旋的单一氨基酸取代的后果对VVMYB5B的转录调节性能[21].根据与C-MYB蛋白结构同源性研究,我们选择以取代从天然蛋白质69位带正电荷的精氨酸(VvMYB5bR),由中性亮氨酸(VvMYB5bl).构象变化对DNA结合的影响和反式- 突变的vvmyb5b的属性l在酵母和葡萄悬浮细胞中研究蛋白质并与天然蛋白质的蛋白质相比。VVMYB5B.R和vvmyb5b.l利用酵母双杂交试验评估bHLH蛋白VvMYC1的物理相互作用能力。最后,vmyb5b过表达l在烟草中进行估计在足底突变的VvMYB5b阵列上影响R目标基因。综上所述,我们的研究结果强调了MYB和bHLH因子二聚作用对靶基因选择性的重要性。
结果
vmyb5b R2R3域结构模型
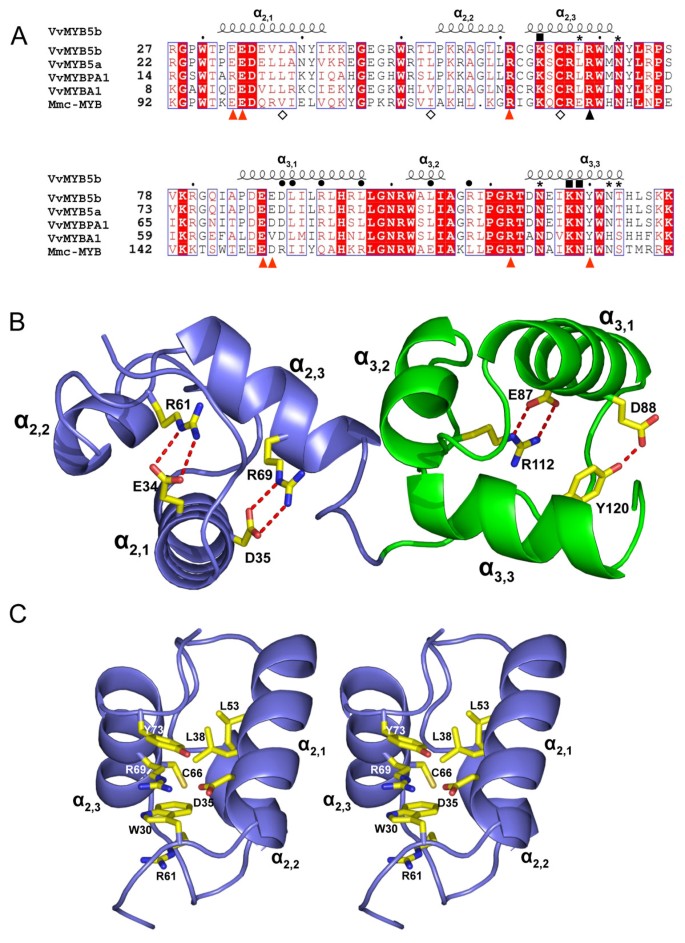
的葡萄MYB5b该基因编码一个myb样蛋白,包含两个不完全重复(R2R3)和一个相互作用域(Lx)2[r / k] x3.LX.6LX.3.r)与bhlh蛋白质合作伙伴[21,24,34](图1).将VvMYB5b序列与葡萄中已知的MYB转录因子(VvMYB5a, VvMYBA1,和VvMYBPA1)进行比对,证实了MYB结构域的高度同源性(图)1).与小鼠c-MYB的R2和R3重复序列相比,序列同源性仍然很高(46%),c-MYB是一种在其自由状态或与DNA复合物中已经具有三维结构特征的蛋白质[30.].在这些蛋白质的结构和功能中,高度保守的残基组被赋予了关键的角色:位于R2和R3结构域c端部分的第一组残基参与了与DNA的相互作用。第二组位于R3结构域的n端,与bHLH蛋白伴侣相互作用,如上文所述[24,30.,35].最后,第三组包括负责蛋白质三元结构的残基:在每个结构域,几个带电残基在α-螺旋之间建立盐桥,保持它们的相对方向,而疏水残基形成一个疏水核埋在三个α-螺旋中[36].
不同MYB蛋白的R2R3结构域的结构.(A)调控类黄酮通路的葡萄MYB转录因子R2R3域与小鼠的蛋白序列比对(亩骶)c-myb。GenBank登录号如下所示:VVMYB5B(AY899404),VVMYB5A(AY555190),VVMYBPA1(AM259485),VVMYBA1(AB097923)和MMC-MYB(NP_034978)。在红色背景上以白色显示相同的残留物,保守的残留物是红色的。r / l突变用暗三角形表示,残留物与DNA碱基相互作用[30.,35,分别用黑色方块或星号表示强相互作用和弱相互作用。黑眼圈表示与bHLH伙伴相互作用的残留物[24].钻石表示涉及域R2的疏水口袋和氨基酸中涉及MMC-MYB中的盐桥相互作用的残留物[30.]用红色箭头突出显示。使用Web Espript [61].(B)从小鼠C-MYB原癌基因R2-R3结构域的X射线衍射结构推导出来的VVMYB5B建模结构的R2和R3结构域(PDB进入码1GV2)。该图用Pymol吸收[62].(C)残基R69的R2域内的环境的立体图。
VvMYB5b的结构模型建(图1 b)使用MMC-MYB R2-R3域(PDB代码:1GV2)的晶形坐标作为起始模型。得到的模型出现非常接近模板模型,其具有0.89埃的叠加Cα的根均方偏差(RMSD),对于100个对准残留物。如图所示1 b,在MMC-MYB中观察到的所有四个盐桥在VVMYB5B中严格保存,并且在相互作用D88-Y120的域R3中具有相同的构象,该域R3在MMC-MYB中的D152-H184相互作用中取代蛋白质。在结构域R2中,残留物R69参与保守的盐桥,并且被选择为单点突变的靶标,原因如下:(i)盐桥似乎在所有MYB序列中严格保守(图1),不与bHLH伙伴相互作用[24];(ⅱ)其在MMC-MYB(R133)的对应显示出相互作用与靶DNA的磷酸基团[30.]以促进DNA结合;(iii) D35,盐桥中R69的伙伴,似乎与R2结构域c端α-螺旋的任何其他残基距离足够远,以避免建立新的稳定相互作用。此外,R69还参与了R61、W30、R69、Y73等侧链的叠加,当然参与了R2域的三维结构布置(图)1 c).在Mmc-MYB的R125, W95, R133和H137残基中也观察到类似的情况。
因此,vmyb5b中69位的精氨酸被亮氨酸中性残基取代。由此产生的突变名为R69L,位于DNA结合域(DBD)附近,可能通过破坏转录因子本身的三元结构来修饰与DNA主链的相互作用和蛋白质活性。
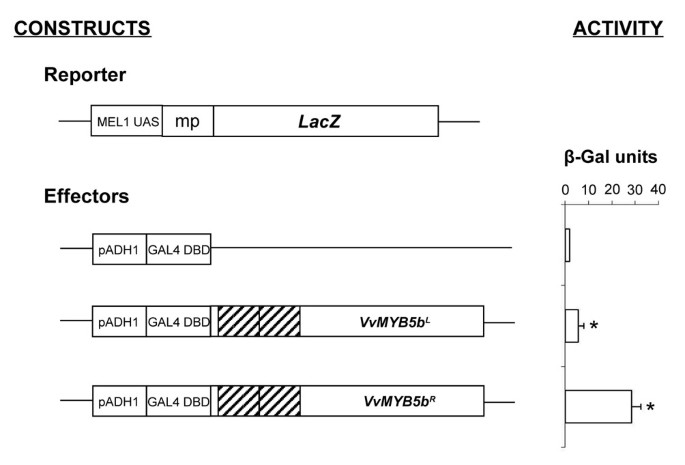
R69L突变在酵母中降低了VVMYB5B逆激活容量
通过实验确定R69L突变是否影响酵母中的VvMYB5b反式激活特性。如图所示2,酵母改变了VVMYB5B.R与表达VVMYB5B的酵母相比,效应构建体表现出β-半乳糖苷酶活性的5倍增加l.然而,VvMYB5bl尽管与VVMYB5B相比,尽管固体选择性培养基(6天)的生长延迟仍然是功能性的R重组酵母在转化后4天内能够生长(数据未显示)。事实上,VvMYB5bl可以激活Lacz.表达3倍超过Gal4-DBD本身。这些结果表明(i)VVMYB5B可以激活酵母中的转录和(ii),R69L取代显着降低了VVMYB5B转录活动。
VVMYB5B.l不再激活葡萄细胞中类黄酮结构基因的转录
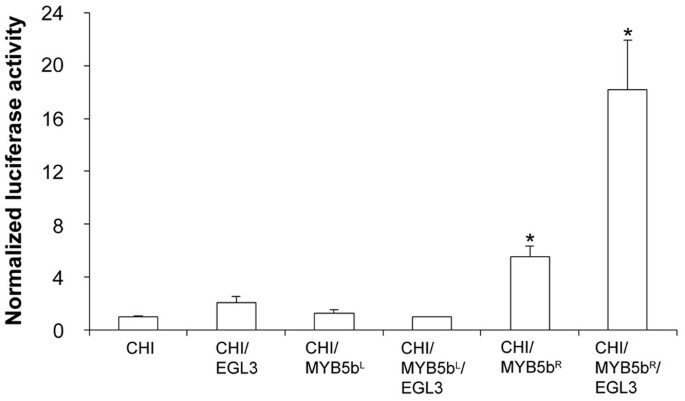
对于许多其他MYB蛋白,VvMYB5b需要bHLH和WDR蛋白伴侣,即GLABRA 3的ENHANCER (ENHANCER of GLABRA 3)和AtTTG1共同表达,才能上调靶基因表达[15,17,21,34].因此,双萤光素酶测定法以评价上VvMYB5b激活能力R69L替代的效果VvCHI在bHLH和WDR蛋白存在或不存在的葡萄细胞启动子中。
如图所示3.,与VvMYB5b共转化R效应性质粒和VvCHI与WD40蛋白AtTTG1一起构建报告基因,导致荧光素酶活性比对照(用AtTTG1构建报告基因)增加5倍。egl3的存在增加了vmyb5b的转录活性R18倍。相比之下,用vmyb5b做同样的实验l展示了VVMYB5B.l无法激活VvCHIatttg1存在的推动者(图3.).以同样的方式,共同转换使用VVMYB5B.l用egl2和AtTTG1构建的荧光素酶活性没有增加。总之,这些结果表明,在葡萄细胞中,vmyb5bl不再显示任何转录激活VvCHI来自拟南芥,Ategl3和Atttg1的两种施用蛋白质存在的启动子。
不像VvMYB5bR,vvmyb5b.l无法激活VvCHI启动子在葡萄细胞.瞬时表达的结果后培养的葡萄细胞用的共轰击萤火虫荧光素酶报告基因融合到VvCHI启动子和组合vmyb5bR或VvMYB5bl与AtEGL3和AtTTG1在一起。归一化的荧光素酶活性计算为之间的比率萤火虫和海肾荧光素酶(用作内部对照)的活性[63].所有轰炸都包括WD40蛋白质ATTTG1(GenBank登录号AJ133743)。值表明相对于活动的活动增加增加VvCHI未转染转录因子的启动子。每一列代表三个独立实验的平均值±SD(学生的T.测试;*P< 0.05 vs。VvCHI单独。
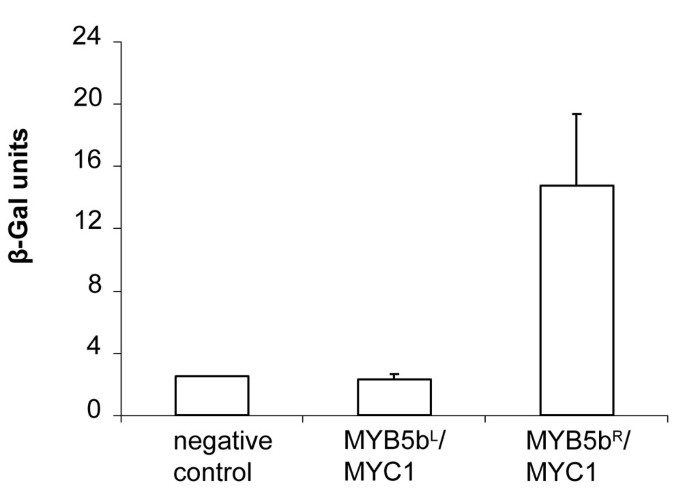
R69L取代可消除VvMYB5b与bHLH伙伴的相互作用
采用酵母菌双杂交试验研究了VvMYB5b的表达能力l用推定的身体互动vitis.的bHLH伙伴。我们的研究结果(图4)确认,vmyb5bR可以与VvMYC1交互,如前所述[22].另一方面,VvMYB5bl无法与VVMYC1形成二维才能激活Lacz.表达。
此外,VVMYB5B的能力R和vvmyb5b.l结合MBS的蛋白(MYB结合位点)CIS.-元素测定采用EMSA(电泳迁移率位移法)。这两种蛋白质都是由体外通过化学发光法检测转录和翻译试验和生物素化蛋白条带(见附加文件)1).结果表明,两种蛋白质以相同的方式积累并且没有降解。但是,既不是本地VVMYB5BR也不是vvmyb5b.l可以结合MBS序列使用EMSA。同样,这两种蛋白质(VvMYB5b)都没有l,vvmyb5b.R)能够把VvCHI酵母单杂交实验中的启动子序列(数据未显示)。
类黄酮生物合成基因在花中有差异表达VVMYB5B.R或者VVMYB5B.l转基因烟草行
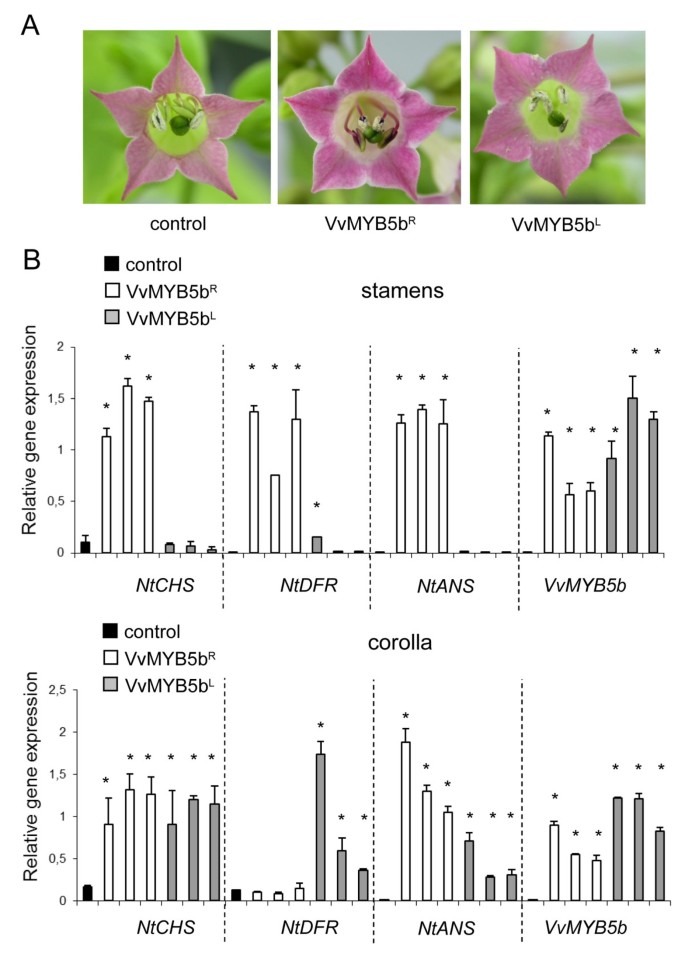
VVMYB5B.R和VVMYB5B.l编码序列在烟草植物中被不同于控制的烟草植物35个年代组成型启动子。用于每种构建体测试的三根T2纯合的独立线用于进一步调查。分析仅在鲜花上进行,因为在营养水平不检测到表型差异。花冠和雄蕊35S :: VVMYB5B.R烟草花表现出强烈的红色和紫色,这与在对照植株中没有观察到的更高的花青素积累有关[21].相比之下,烟草植物的花过度表达VVMYB5B.l在两个花器官花青素没有表现出更大的积累(图5)在花冠和雄蕊中没有观察到花青素含量的显着变化(见附加文件2).为了初步解释这些表型,研究了三种烟草类黄酮生物合成基因(Chalcone合成酶(NtCHS),二氢烷醇4-还原酶(NTDFR.)和花青素合成酶(NtANS),采用定量RT-PCR (qRT-PCR)检测在足底目标VvMYB5b的结构基因与突变对这些相同基因的表达的影响在一起。如图所示5 b,这些基因中的任何一个在对照植物的雄蕊中表达,这与该特定组织通常不合成花青素的事实一致。如前所述[21]过度表达VVMYB5B.R诱导更高的转录NTCHS,NTDFR.和NtANSMRNA在雄蕊中与花青素积累。在花冠细胞中,NTDFR.表情似乎没有受到影响,但增加了CHS.和ANS.观察到转录物丰度并与花青素含量显着高于对照植物。
VVMYB5B的分析R和vvmyb5b.l在烟草植物花中的异位表达效果.(一)之花VVMYB5B.R过表达植株的花瓣和花蕊的强烈的红色着色,相比于控制和VVMYB5B.l转基因花。(B)的实时定量RT-PCR分析NtCHS(查耳酮合成酶),NTDFR.(dihydroflavonol还原酶)和NtANS(花青素合酶)转录丰富的雄蕊和花冠。基因表达是相对的ntubiquitin.每个样本的转录水平。也给出了三个独立的过表达转基因株系的结果VVMYB5B.R或者VVMYB5B.l,并与对照植物进行比较。VVMYB5B.表明转基因转录水平。每个条代表三次重复的平均值±SD(*P根据ANOVA的<0.05 Vs.控制植物)。
相比之下,VVMYB5B.l过度表达没有增强NtCHS,NtANS和NTDFR.雄蕊的转录物丰度虽然两种构建体的转基因表达水平(35S :: VVMYB5B.R和35S :: VVMYB5B.l)都一样。然而,VvMYB5bl似乎保留了一些反式卡罗拉的活动活动在哪里NtCHS和NtANS转录本丰度显著高于野生型植物。此外,表达VvMYB5b的花冠细胞l累计更多NTDFR.对照和35S :: VVMYB5B.R植物。令人惊讶的是,黄酮类基因表达的这种增加不会影响花青素浓度VVMYB5B.l花冠(见附加文件2).总之,这些结果表明(i) vmyb5bl在雄蕊中已严重丧失反式激活能力,而在花冠中仍有活性;(2) VvMYB5bl在花冠细胞中可能有新的调节功能,因为它的过表达诱导了该基因的上调NTDFR.没有观察到的35S :: VVMYB5B.R植物。
讨论
在过去的20年里,越来越多的关于类黄酮通路的转录调控的研究已经发表(综述在[8,10])。大多数研究强调MYB转录因子在控制这一代谢途径中的关键作用。最近,新的发现强调了MYB蛋白与bHLH和WDR蛋白在类黄酮生物合成基因转录调控中的协调的多蛋白复合物的重要性。然而,这种多蛋白复合物是如何根据组织、发育阶段或环境条件专门调节基因表达的,目前尚不完全清楚。
MYB DNA结合域(DBD)与双DNA链相互作用的结构已经在几个模型中进行了研究[37- - - - - -39].这些研究表明,R2和R3的第三螺旋涉及特定DNA共有序列的识别[30.,40].在MMC-MYB,位于R2结构域的K128以及位于R3结构域中的K182和N183一起,被鉴定为特定核苷酸序列AACNG的“识别”中的关键残留物,所谓的“MYB结合位点”[30.,41].随后,同一作者证明了残基R133的亚甲基链与其他三个氨基酸(V103, C130和I118),疏水核心中心的一个空腔,可能在R2结构域的构象稳定性中起作用[36].例如,该腔内内的氨基酸取代(V103L)降低了R2结构域的构象柔韧性,从而显着降低了特异性的MYB-DNA结合活性和反式激活。图中所示的VVMYB5B R2R3域的模型1 b表明R69残基类似于其在MMC-MYB中的对应力R133,参与形成盐桥的形成,该盐桥可以参与蛋白质的稳定[30.].盐桥形成在这种转录因子的活动中形成的影响很差,但少数可用研究表明它们可能会影响转录因子的DNA结合亲和力和反式激活性质。氨基酸取代的盐桥破坏影响CRP(CAMP受体蛋白)蛋白质活性并导致减少虫胶启动子反式激活,不影响其DNA结合亲和力[42,43].这种减少归因于与RNA聚合酶α亚基相互作用的改变。在我们的研究中,R69被一个亮氨酸残基取代,我们证明了R2重复序列第三螺旋的这个单一残基突变可以修改VvMYB5b的蛋白相互作用特性及其DNA结合亲和性。
该R69L替代影响VvMYB5b的反式激活属性
在酵母中,我们发现了VvMYB5bl融合到酵母GAL4-DBD的效应构建体几乎不能增加报告基因的表达。人们可以假设R2内的氨基酸取代在VVMYB5中重复l可能导致该蛋白与RNA polII复合物的酵母一般共激活物之间的相互作用减弱。事实上,转录因子通过蛋白质相互作用以多种方式发挥作用,以增强靶基因的表达。激活因子与染色质重塑因子、RNA polII预起始复合物的一般转录因子(GTFs)相互作用,也可影响转录和延伸的起始[44,45].在酵母中,由于突变引起的VvMYB5b反式激活特性下降,可以解释为其招募酵母gtf的能力下降。
在真核转录因子中,DNA结合结构域和活化/抑制域被认为是空间的。酵母双混合技术基于这一概念[46].根据我们的结果(图2),这两个结构域似乎密切依赖,如先前显示的一些MYB转录因子。例如,在c-MYB蛋白中,c端负调控域可以与R2R3 n端域相互作用,从而改变其固有属性[47].同样地,在C1中,促进玉米中的花青素积累的MYB转录因子,R2R3结构域似乎与C末端区域相互作用以使蛋白质在不存在其BHLH合作伙伴的情况下使蛋白质无活性[25].
虽然VVMYB5B在酵母中适用于强烈的转录活化剂,但它需要葡萄细胞,与VVMYBA一样,至少一个BHLH合作伙伴是完全功能的[15,21,22,现在的工作]。在这项研究中,VVMYB5Bl无法激活VvCHI葡萄细胞的启动子尽管BHLH和WDR都是共同表达。此外,我们展示了,与VVMYB5B不同R,vvmyb5b.l没有在酵母中与VVMYC1相互作用[22].综上所述,这些结果表明,氨基酸取代明显影响蛋白质-蛋白质相互作用的选择性,随后也影响调控复合物的反式激活特性。
R69L突变改变了在活的有机体内VVMYB5B的选择性蛋白质合作伙伴
烟草的过表达实验表明,在雄蕊和花冠中存在不同的调控机制,涉及类黄酮途径基因的表达。首先,没有或很少的表情被观察到NtCHS,NtANS和NTDFR.对照植物雄蕊的基因。这表明该组织中缺乏有效的调控复合体,或该系统中至少缺少一种成分。然而,在对照植物的花冠中,同样的结构基因在同一对照植物上的基线表达支持了一个预先存在的转录网络调节花青素在这些花器官中的积累的观点。
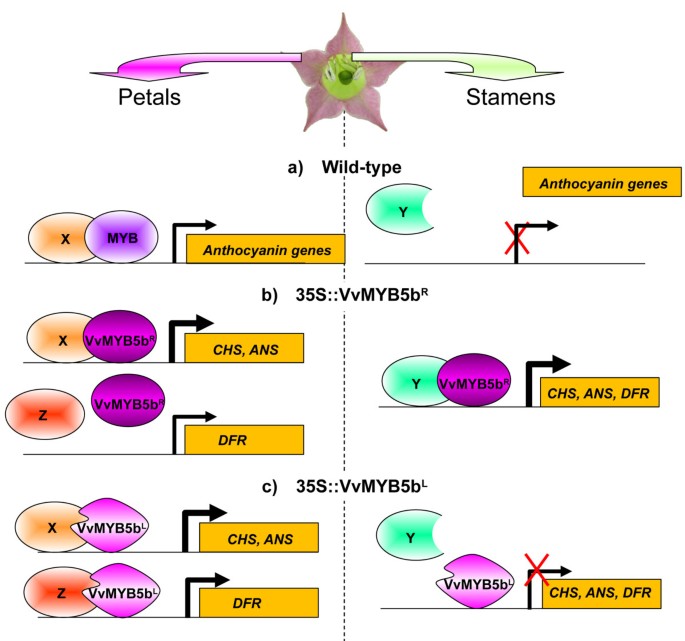
在35S :: VVMYB5B.R在转基因烟草雄蕊中,似乎存在天然的VvMYB5bR蛋白质及其与内源性预先存在的蛋白质合作伙伴的相互作用导致整个花青素生物合成途径的激活([21];figure6).在花冠中,无NTDFR.upregulation中观察到35S :: VVMYB5B.R植物可能会通过VVMYB5B之间的互动缺乏来解释R以及一种与所需蛋白质不同的特定蛋白质伴侣NtANS和NtCHS基因表达(图中称为Z6).另一个假设可能涉及两个不同的存在NTDFR.雄蕊和花冠的基因分别。这种替代解释不能完全排除,但似乎不太可能,考虑到本研究中使用的引物被设计用于放大两个DFR到目前为止在烟草基因组中发现的基因。
提出的R69L取代对蛋白质合作伙伴的相互作用特异性的影响模型,从而对烟草花中VVMYB5B的跨活化性能.X、Y和Z表示烟草花花冠和雄蕊中表达的内源转录因子。MYB是一种烟草内源转录因子,通常在花瓣中表达,并与内源伴侣如bHLH蛋白合作参与花青素合成。在转基因花瓣中,无论是突变的还是正常的VvMYB5b都能够识别内源性伴侣,并激活CHS和ANS编码基因的启动子。在……的特殊情况下NTDFR.启动子,我们的结果表明,R69L突变可能改变了蛋白复合物的DNA结合特异性,因为vmyb5bl激活NTDFR.转录,与VVMYB5相反R.在野生型雄蕊中,花青素生物合成途径不活跃,但应存在参与其他过程的转录因子(Y)。在转基因雄蕊中,VVMYB5BR可能能够识别这些(ese)伙伴来激活启动子,而vmyb5bl可能不会。已经在众多模型中显示的推定的WDR因子未在图中显示。
当35S :: VVMYB5B.l植物,VVMYB5B的明显不同行为l在雄蕊和花冠细胞关于基因活化能力的情况下,支持这些组织中各种蛋白质合作伙伴存在的假设。此外,归纳NtCHS,NtANS和NTDFR.在花冠中观察到的基因表达表明,vmyb5bl能有效地结合组织中的DNA。因此,在雄蕊中,vmyb5bl可能无法与内源合作伙伴互动,因此不会引起表达NtCHS,NtANS和NTDFR.基因(图6).Corollas的情况明显不同,在那里存在VVMYB5Bl导致所有被研究的基因的诱导,表明突变蛋白可以与激活所需的内源性伴侣阵列相互作用NtCHS,NtANS和NTDFR.基因的表达。此外,归纳NTDFR.在花冠细胞中表达,在vmyb5b存在时未观察到R,表明与突变相关的结构变化现在允许与所需的特定合作伙伴互动NTDFR.基因表达(图6).因此,总之,这些结果表明R69L取代改变VVMYB5B与其推定的蛋白质合作伙伴的相互作用能力,随后对靶基因表达的调节影响。
在玉米中,MyB转录因子ZMP1的DNA结合结构域内的氨基酸取代也对ZMP1与其合作伙伴的合作效应产生了强烈影响[25].实际上,ZMP1不需要与BHLH蛋白r的相互作用来反析出来DFR基因但未能反式激活bz1基因编码UDP-葡萄糖:黄酮3-O葡糖基转移酶(24,25].DBD内的ZMP1的突变有助于ZMP1与R的相互作用,这反过来允许复合物的结合到启动子区bz1基因。
需要进一步的研究来确定图中所示的模型6,例如在烟草花冠和雄蕊中鉴定不同的bHLH或WDR伴侣。两种不同的共同表达的bHLH基因已经在矮牵牛花,在哪里AN1和Jaf13优先于花冠和雄蕊中表达[11,48])。同样,在Snapdragon Flowers中,MyB转录因子Rosea1,Rosea2和venosa通过差异与不同的花卉器官中的BHLH Partners Mut和Delila差异相互作用来控制花青素生物合成[49].以同样的方式,格伯拉·亨格纳BHLH蛋白质GMYC1被认为控制了表达GHDFR.Corolla和Carpel组织中的基因,而Pappus和雄蕊中可能存在交替Gmyc1独立的调节机制[50].这些研究表明,不同的BHLH转录因子可以在烟草花的不同组织中共同表达。然而,对于这种植物物种,迄今为止,仅调节一种调节黄酮型途径因子的一种MYB转录[51].
结论
69位的氨基酸替换预计会对vmyb5b的dna结合活性产生影响l,如前用于C-MYB蛋白的描述[30.,52].根据我们的结果,既不是本地VVMYB5BR也不是vvmyb5b.l在EMSA实验中均能结合MBS序列。然而,VvMYB5bR确实激活了这一点VvCHI启动子与辅助因子AtEGL3 (bHLH)和AtTTG1 (WDR)共同表达(图)3.),但不能在酵母单杂交实验中结合相同的序列。这些结果表明,VVMYB5B需要其蛋白质伴侣来结合DNA,并且EMSA和酵母单杂化方法不适合调查VVMYB5B的能力r / l.结合目标序列。最后,上调了NtCHS,NtANS和NTDFR.35S中观察到的基因:VVMYB5B.l烟草植物中存在一种功能性的VvMYB5bl蛋白质。因此,VVMYB5B.l似乎仍然能够识别和结合DNA,即使需要进一步的研究来确定残留R69在vmyb5b的DNA结合特性中的直接或间接作用。
总之,这项工作描述了葡萄葡萄球菌的二聚化和DNA结合特性的单一氨基酸变化的结构和生物学后果。对于调节DNA亲和力和结合的R2R3结构域的构象,这两种功能出现相关,可以在与蛋白质合作伙伴相互作用后进行修饰。结果,给定的MYB因子的靶基因阵列可能根据所涉及的蛋白质伴侣而变化。
方法
植物材料
种子来自野生型和纯合T2代转基因烟草植物(尼科尼亚塔哈瓦姆用2.5%次氯酸钾、0.02% Triton X-100灭菌10 min,用无菌水洗涤5次。种子在4℃低温处理48 h后,在MS培养基上发芽[53]含有3%(w / v)蔗糖,其补充有200μg/ ml的转基因植物,在25/20℃下,在16小时光/ 8 H暗状态下。发芽后八周,体外将生长的小植物转移到土壤中成单独的盆,并在相同的环境条件下在生长室中培养。Grapevine Chardonnay的悬浮培养物(葡萄(L.)叶柄愈伤组织在葡萄科米尔培养基中生长,如[54],在轨道振动器的25°C时,在90rpm的轨道振动器上。
vmyb5b R2R3域建模
VVMYB5B.建模从小鼠的c-MYB R2R3结构域的晶体结构使用SWISS-MODEL服务器[(PDB代码1GV2,Tahirov等人,未发表的结果)开始55].使用分子图形程序牡丹进一步检查所获得的模型[56].使用Phenix软件实现的标准协议,通过分子动力学模拟退火,人工修正了一些侧链的方向错误,并使整个模型正规化[57].
生成VVMYB5Bl替代和烟草稳定的转换
的VVMYB5B.本研究使用的cDNA序列(gene accession AY899404)之前已插入pGEM-T-Easy克隆载体(Promega, Madison, WI) [21].该R69L置换引入克隆VVMYB5B.使用QuickChange站点定向诱变套件(Stratagene)。使用以下引物对进行反应:5'-caagagctgtcgcctcctctgatgaactacctc-3'(意义)和5'-gaggtagttcatcAcagaggggcgcagctctg-3'(反义)。通过DNA测序证实cDNA中引入的突变的存在。本土VVMYB5B.R和VVMYB5B.l全长cdna然后在Xba我/囊我之间的PGIBIN19二元载体的限制网站35个年代花椰菜花叶病毒的启动子和胭脂氨酸合成酶(n)聚(A)加成位点,如[21].这两种结构都被引入农杆菌肿瘤术LB4404主体应变。根据叶片方法改变和再生烟草[58].在含有200μg/ ml卡那霉素的MS培养基上进行初级转化体的选择。根据制造商说明书(DNEasy植物迷你试剂盒,QIAGEN),通过PCR对从初级转化叶中提取的基因组DNA进行基因组DNA的存在。收集自施用T1和T2系的种子,基于孟德尔分离比选择单拷贝插入T2线。
RNA提取及基因表达分析
从野生型和转基因烟草花组织中分离得到总RNA。59].每株植物随机收集至少三朵花,并为每条线选择两种植物:控制(未转化的植物),35S :: VVMYB5B.R和35S :: VVMYB5B.l.根据制造商说明书(Promega, Madison, WI),使用Moloney鼠白血病病毒(M-MuLV)逆转录酶(RT),在20 μl反应混合物中,用寡核苷酸(dT)12-18逆转录1 μg总rna。转录水平的NtCHS,NtF3H和NTDFR.内源性基因与转基因VVMYB5B.r / l.采用实时定量RT-PCR检测,SYBR Green在iCycler智商®(Bio-Rad)根据供应商描述的程序。引物0.2 μM, SYBR Green mix (Bio-Rad) 5 μl, DNAse 0.8 μl处理cDNA 10 μl,共3个重复进行PCR反应。阴性对照包括在每次试验中。PCR条件为:95°C初始变性90 s, 95°C 30 s, 60°C 1 min, 40个循环,扩增后进行熔化曲线分析,检测各反应的特异性。数据归一化根据ntubiquitin.基因表达水平并用从[中概述的算法衍生的方法计算60].通过使用Sigma-Plot软件分析方差(ANOVA)测试来执行数据的统计分析。用于定量RT-PCR的引物的序列显示在表中1.利用编码DFR的两条高度同源序列设计引物,在烟草中进行实时定量RT-PCR实验(登录号为EF421430和EF421429)。
共转染实验和双荧光素酶实验
VVMYB5B.R和VVMYB5B.l通过使用寡核苷酸的Phusion TM高保真DNA聚合酶(FinNzymes)通过PCR扩增全长CDNA。用寡核苷酸引入Bam嗨(5'-taatGGATCCATGAGGAATGCATCCTCA-3”)和萨尔我(5'-taatGTCGACTCAGAACCGCTTATCAGGTTG-3' )的限制位点(斜体表示),并将其克隆在pDH5载体(由镨M. Hernould,波尔多,法国)中,从pUC18载体的衍生物,其允许转基因的组成型瞬时表达麻烦给出。每个编码序列的完整性通过使用pDH5F(5'-CCCACTATCCTTCGCAAG-3 ')和pDH5R(5'-CTAATTCCCTTATCTGGGAA-3')引物测序(MWG,法国)验证。葡萄悬浮细胞和双萤光素酶测定的瞬时共转染实验如先前在[所述进行17].
β-半乳糖苷酶测定在酵母中
VVMYB5B.R和VVMYB5B.l通过使用寡核苷酸的PHUSUST TM高保真DNA聚合酶(FINNZYMES)通过PCR扩增CDNA,使用寡核苷酸引入Bamh.我在5'(5'-taat)的限制性网站(在斜体上表示)GGATCCAGATGAGGAATGCATCCTCA-3 ')和3'(5'-TAATGGATC.TcagaAccGCTTATCAGGTTG-3')结束。在酶消化后,将PCR片段引入PGBKT7载体(CLONTECH,BD BIOSCOCE)中,融合在含有GAL4 DNA结合结构域(DBD)编码区下,在控制下ADH1启动子。PGBKT7矢量携带KANR选择选择大肠杆菌和TRP1营养标记用于酵母的选择。酵母菌株AH109是独立与pGBKT7中转化,pGBKT7-VVMYB5B.R,或pgbkt7-VVMYB5B.l采用PEG /醋酸锂法,根据制造商的说明。选择上合成的降转化体(SD)培养基中不含色氨酸(SD-色氨酸-)或组氨酸、腺嘌呤和色氨酸(SD-His-ade.-Trp-).已经进行了由制造商提供的并行,对互动的正面和阴性控制(BD Matchmaker™图书馆建设和筛选套件,Clontech,BD Bioscience)。as.Lacz.β-半乳糖苷酶是该系统的第4个报告基因,在选择培养基上培养的重组酵母中检测其活性。使用ONPG (o -硝基苯基-β- d -半乳糖苷)底物进行β-半乳糖苷酶测定。相对β-半乳糖苷酶活性在600 nm光密度归一化后得到。
酵母双杂交测定
VVMYB5B.R或者VVMYB5B.l编码区域融合到GAL4激活域(AD),编码序列VVMYC1.与GAL4-DBD融合。因为它有内在的能力激活酵母的转录,vmyb5bR尚未融合到Gal 4-DBD,因此互易组合被排除在双杂交测定中。VVMYB5B.R和VVMYB5B.l通过PCR使用Phusion TM高保真DNA聚合酶扩增CDNA,所述PCR具有锚固锚的特异性引物:F,5'-TTCCACCAGCAGTGGTATCAACGCAGGTGG-3'和R,5'-GTATCGATGCCCCCGCGCA-3',其允许在线性质粒PGADT7-REC中的重组在酵母中引入。携带放大器的结果构造R和鲁选择性特征允许GAL4激活域(AD)-VvMYB5b融合蛋白的表达。的VVMYC1.编码序列(基因登录EU447172)克隆到pGBKT7载体之间生态RI和PST.我限制网站[22].双杂交实验使用Clontech公司的BD红娘™图书馆建设及根据制造商的说明筛查试剂盒(BD生物科学)进行。酵母菌株AH109用pGBKT7-转化VVMYC1.构造,VVMYB5B.R和VVMYB5B.lPCR产物和效应质粒pGAdt7-REC,如[22].利用SD-色氨酸筛选转化子-鲁-培养基,以确保两个效应质粒确实融合到酵母上。报告基因的转录激活Lacz.通过监测β-半乳糖苷酶活性评估。
作者的信息
IH现住址:阳狮德RECHERCHE EN Physiologievégétale(GRPV),地球和生命研究所(ELI),鲁汶天主教大学(UCL),B-1348鲁汶-LA-Neuve的,比利时。
参考资料
- 1。
蒋春华,顾晓东,陈建平,等:家蚕MYB基因家族保守结构和羧基端基序的鉴定拟南芥和栽培稻L. ssp.indica。基因组Biol。2004,5(7):R46-10.1186 / GB-2004-5-7-R46。
- 2.
Yanhui C,小袁Y, Ku H,美华L,济钢L,兆丰G,志强L,云飞Z,晓晓W,小明问,Yunping年代,李Z,晓惠D,荆楚文化L, Xing-Wang D, Zhangliang C,弘亚G,李绩问:拟南芥的MYB转录因子超科:表达分析和系统发育与大米MYB家庭。植物学报。2006,60:107-124。10.1007 / s11103 - 005 - 2910 - y。
- 3.
Matus JT, aqua F, Arce-Johnson P:葡萄的分析MYB R2R3.亚家族揭示了与众不同的葡萄酒质量相关的碎片和保守基因结构组织vitis.和拟南芥基因组。植物营养与肥料学报。2008,28(4):514 - 514。
- 4.
杜博斯,李晓东,李晓东:拟南芥MYB转录因子的研究进展。植物科学进展,2010,15:573-581。10.1016 / j.tplants.2010.06.005。
- 5.
Bomal C,Bedon女,卡隆S,曼斯菲尔德SD,莱维塞尔C,库克JEK,布莱S,特伦布莱L,Morency M-Ĵ,Pavy N,格里马-PettenatiĴ,Seguin的A,麦凯Y:的参与松果体taedaMYB1和MYB8在苯丙代谢和次生细胞壁生物发生中的作用:植物分析的比较。中国生物医学工程学报,2008,29(5):591 - 598。10.1093 / jxb / ern234。
- 6.
Mellway RD, Tran LT, Prouse MB, Campbell MM, Constabel CP:伤口、病原体和紫外线b反应myb134基因编码调节杨树的原霉素合成的R2R3 MyB转录因子。植物理性。2009,150:924-941。10.1104 / pp.109.139071。
- 7.
MYB58和MYB63是拟南芥次生细胞壁形成过程中木质素生物合成途径的转录激活因子。acta botanica sinica, 2009, 31(4): 457 - 461。10.1105 / tpc.108.063321。
- 8.
MYB转录因子与水果颜色的关系。植物科学进展,2008,13:99-102。10.1016 / j.tplants.2007.11.012。
- 9.
Nakatsuka T,Haruta Ks,Pitaksuteeepong C,Abe Y,Kakizaki Y,Yamamoto K,Shimada N,Yamamura S,Nishihara M:R2R3-MYB和BHLH转录因子调节龙胆鲜花中的花青素生物合成的鉴定与表征。植物细胞生理。2008,49:1818-1829。10.1093 / PCP / PCN163。
- 10。
Hichri I, Barrieu F, Bogs J, Kappel C, Delrot S, Lauvergeat V:类黄酮生物合成途径转录调控的最新进展。J Exp Bot, 2011。
- 11.
拼写C,Quattrocchio F,Mol JNM,Koes R:花青素1矮牵牛花编码一种基本的螺旋-环-螺旋蛋白,直接激活结构花青素基因的转录。植物营养学报。2000,12(4):531 - 534。
- 12.
拼写C,Quattrocchio F,Mol J,Koes R:Petonia的花青素1通过基因上独特的机制控制色素合成,真空pH和种子涂层。植物细胞。2002,14:2121-2135。10.1105 / TPC.003772。
- 13.
Quattrocchio楼VERWEIJ W,克朗A,斯佩尔特C,分子Ĵ,Koes R:矮牵牛的PH4是R2R3 MYB蛋白激活通过与花色素苷途径的碱性螺旋 - 环 - 螺旋转录因子相互作用液泡酸化。植物细胞。2006年,18:1274年至1291年。10.1105 / tpc.105.034041。
- 14.
赵敏:TTG1/bHLH/Myb转录复合物对拟南芥花青素合成途径的调控。植物学报,2008,53:814-827。10.1111 / j.1365 - 313 x.2007.03373.x。
- 15.
Walker AR, Lee E, Bogs J, McDavid DAJ, Thomas MR, Robinson SP:白葡萄是通过两个相似且相邻的调控基因的突变而产生的。植物学报,2007,49:772-785。10.1111 / j.1365 - 313 x.2006.02997.x。
- 16.
Cutanda-Perez的M-C,Ageorges A,Gomez的C,Vialet S,梗N,Romieu C,Torregrosa L:异位表达VlmybA1在葡萄藤中激活一组参与花青素合成和运输的基因。植物生态学报。2009,29(6):643 -648。10.1007 / s11103 - 008 - 9446 - x。
- 17.
Bogs J,JafféFW,Takos Am,Walker Ar,Robinson SP:葡萄转录因子VVVMYBPA1在水果开发期间调节原花青素合成。植物理性。2007,143:1347-1361。10.1104 / pp.106.093203。
- 18.
Terrier N, Torregrosa L, Ageorges A, Vialet S, Verriès C, Cheynier V, Romieu C:异位表达促进原花青素的生物合成葡萄L.并提出途径中的其他目标。植物理性。2009,149:1028-1041。
- 19.
Czemmel S, Stracke R, Weisshaar B, Cordon N, Harris NN, Walker AR, Robinson SP, Bogs J:葡萄R2R3-MYB转录因子VvMYBF1调控发育中的葡萄浆果中的黄酮醇合成。植物营养与肥料学报。2009,31(3):429 - 434。10.1104 / pp.109.142059。
- 20。
Deluc L,Barrieu F,Marchive C,Lauvergeat V,Decendit A,Richard T,Carde JP,Merillon JM,HAMDI S:调节苯丙烷途径的葡萄R2R3-MYB转录因子的表征。植物理性。2006,140:499-511。10.1104 / pp.105.067231。
- 21。
Deluc L,Bogs J,Walker Ar,Ferrier T,Decendit A,Merillon J-M,Robinson SP,Barrieu F:转录因子VVMYB5B在开发葡萄浆果中有助于调节花青素和原霉素生物合成。植物理性。2008,147:2041-2053。10.1104 / pp.108.118919。
- 22。
Hichri I, Heppel SC, Pillet J, Léon C, Czemmel S, Delrot S, Lauvergeat V, Bogs J:基本的螺旋-环-螺旋转录因子MYC1参与调控葡萄藤中类黄酮生物合成途径。植物科学学报,2010,33(3):559 -523。10.1093 / mp / ssp118。
- 23。
Matus JT,CañónP,Bordeu E,Alcalde Ja,Arce-Johnson P:葡萄葡萄葡萄酒中黄酮类化合物与黄酮合成相关的胃肠和BHLH基因的分离(葡萄l .)。植物生态学报,2010,32(6):691 - 698。10.1007 / s11103 - 010 - 9597 - 4。
- 24。
Grotewold E, Sainz MB, Tagliani L, Hernandez JM, Bowen B, Chandler VL:玉米C1 Myb结构域与bHLH辅助因子r相互作用的残基鉴定。2000年,97:13579 - 13584。10.1073 / pnas.250379897。
- 25。
Hernandez JM, Heine GF, Irani NG, Feller A, Kim M-G, Matulnik T, Chandler VL, Grotewold E:不同的机制参与了R2R3 MYB转录因子C1的r依赖性活性。中国生物医学工程学报。2004,27(3):495 - 498。10.1074 / jbc.M407845200。
- 26。
谢春华,袁磊:植物Myc-like bHLH转录因子的相互作用域可以调控反式激活强度。植物营养学报。2008,27(6):741 - 746。10.1007 / s00425 - 007 - 0676 - y。
- 27。
Payne CT, Zhang F, Lloyd AM:GL3编码调节毛毛细血管的BHLH蛋白质拟南芥通过互动GL1和TTG1..遗传学。2000,156:1349-1362。
- 28。
在TTG1-dependent pathway中,bHLH蛋白是一个冗余蛋白网络拟南芥.发展。2003,130:4859-4869。10.1242 / dev.00681。
- 29。
Yoshida K,Iwasaka R,Kaneko T,Sato S,Tabata S,Sakuta M:功能分化Lotus对虾TT2S,R2R3-MYB转录因子包含多烯家族。植物细胞生理。2008,49:157-169。
- 30.
Ogata K, Morikawa S, Nakamura H, Sekikawa A, Inoue T, Kanai H, Sarai A, Ishii S, Nishimura Y: Myb DNA结合域与合作识别螺旋的特定DNA复合物的溶液结构。Cell. 1994,79: 639-648。10.1016 / 0092 - 8674(94) 90549 - 5。
- 31。
Ogata K,Morikawa S,Nakamura H,Hojo H,Yoshimura S,Zhang R,Aimoto S,Ametani Y,Hirata Z,Sarai A等,Sipr:DNA结合域的自由和DNA复合形式的比较C-myb。NAT STRUCT BIOL。1995年,2:309-320。10.1038 / NSB0495-309。
- 32。
Jin H, Martin C:多功能和多样性的工厂MYB- ene家庭。植物mol biol。1999年,41:577-585。10.1023 /答:1006319732410。
- 33。
Aravind L, Anantharaman V, Balaji S, Babu MM, Iyer LM:螺旋-turn-helix结构域的许多面:转录调控和其他。微生物学报,2005,29(4):441 - 446。
- 34。
Zimmermann Im,Heim Ma,Weisshaar B,Uhrig JF:全面识别拟南芥蒂利亚纳MYB转录因子与R/ b样BHLH蛋白相互作用。植物学报2004,40:22-34。10.1111 / j.1365 - 313 x.2004.02183.x。
- 35。
一个单一的残基替换导致了植物转录因子MYB的双DNA结合特异性的转换。Ph3对动物c-MYB的特异性。J临床生物化学。1997年,272:2889 - 2895。10.1074 / jbc.272.5.2889。
- 36.
Ogata K, kaneii -Ishii C, Sasaki M, Hatanaka H, Nagadoi A, Enari M, Nakamura H, Nishimura Y, Ishii S, Sarai A: Myb DNA结合域疏水核心的空腔为DNA识别保留反式-Activation。NAT STRUCT BIOL。1996年,3:178-187。10.1038 / NSB0296-178。
- 37.
Ness SA, Marknell A, Graf T: v-myb癌基因产物与早幼粒细胞特异性结合并激活假正经的-1基因。细胞。1989年,59:1115-1125。10.1016 / 0092-8674(89)90767-8。
- 38.
Introna M, Golay J, Frampton J, Nakano T, Ness SA, Graf T: v-myb突变改变癌基因转化的骨髓单核细胞的分化。细胞。1990,63:1289-1297。
- 39.
同源盒基因GBX2, myb癌基因的靶点,介导自分泌生长和单核细胞分化。Cell. 1997,91: 185-195。10.1016 / s0092 - 8674(00) 80401 - 8。
- 40.
Tahirov TH,佐藤K,市川-岩田E,佐佐木男,井上-丰后T,椎名男,木村K,高田S,藤川A,森井H,Kumasaka T,山本男,石井S,绪方K:C-机理MYB-C /从一个子站点分离EBP测试合作。细胞。2002年,108:57-70。10.1016 / S0092-8674(01)00636-5。
- 41.
Tanikawa J,Yasukawa T,ENARI M,OGATA K,Nishimura Y,ISHII S,Sarai A:C-Myb Protooncogene产品识别特定的DNA序列:三种重复单元在DNA结合结构域中的作用。Proc Natl Acad Sci USA。1993,90:9320-9324。10.1073 / pnas.90.20.9320。
- 42.
Belduz Ao,Lee Ej,Harman JG:大肠杆菌的环状AMP受体蛋白的诱变:循环核苷酸结合口袋的靶向位置72和82。核酸RES。1993年,21:1827-1835。10.1093 / NAR / 21.8.1827。
- 43.
TUTAR Y,HARMAN JG:盐桥对CRPD依赖性乳糖操纵子转录激活的影响大肠杆菌.拱生物学生生物糖。2006,453:217-223。10.1016 / j.abbb2006.06.019。
- 44。
Triezenberg SJ:转录激活域的结构和功能。《中国科学:地球科学》1995年第5期。10.1016 / 0959 - 437 x(95) 80007 - 7。
- 45。
Blau J,Xiao H,McCracken S,O'Hare P,GreenBlatt J,Bentley D:三个功能类转录激活域。Mol细胞Biol。1996,16:2044-2055。
- 46。
Fields S,Song O:一种检测蛋白质 - 蛋白质相互作用的新型遗传系统。科学。1989,340:245-246。
- 47。
Myb结合蛋白:转化中的调控因子和队列。中国肿瘤杂志,1999,18:3039-3046。10.1038 / sj.onc.1202726。
- 48。
bHLH和MYB结构域蛋白的分析:物种特异性调控差异是由靶花青素基因的不同进化引起的。植物学报,1998,13:475-488。10.1046 / j.1365 - 313 x.1998.00046.x。
- 49。
Schwinn K,Venail J,Shang Y,Mackay S,Alm V,Butelli E,Oyama R,Bailey P,Davies K,Martin C:一小家族的MYB-Charmatory基因系列控制花卉色素沉着强度和在属的典范金鱼草属植物.植物细胞。2006年,18:831-851。10.1105 / tpc.105.039255。
- 50.
Elomaa P,Mehto M,Kotilainen M,Helariutta Y,Nevalainen L,Teeri Th:BHLH转录因子在二氢烷醇-4-还原酶上介导器官,区域和花型特异性信号(DFR)在花序中的基因表达格伯拉·亨格纳(菊科)。植物学报1998,16:93-99。10.1046 / j.1365 - 313 x.1998.00273.x。
- 51.
王志强,王志强,王志强,袁玲:烟草R2R3 MYB调控子的分离和功能鉴定。植物生态学报。2010,31(4):491 - 497。10.1007 / s00425 - 010 - 1108 - y。
- 52.
Gabrielsen OS, Sentenac A, Fromageot P: c-Myb特异性DNA结合:双螺旋-旋-螺旋相关基序的证据。中国科学:地球科学。10.1126 / science.1887237。
- 53.
Murashige T,Skoog F:一种修正媒介,用于快速生长和烟草组织培养的生物测量。physiol植物。1962,15:473-477。10.1111 / J.1399-3054.1962.TB08052.x。
- 54。
Takos Am,JafféF,雅各布SR,Bogs J,Robinson SP,Walker Ar:光诱导的MYB基因的表达调节红苹果中的花青素生物合成。植物理性。2006,142:1216-1232。10.1104 / pp.106.088104。
- 55。
Kopp J,Guex N,PEITSCH MC:Swiss-Model:自动蛋白质同源性建模服务器。核酸RES。2003,31:3381-3385。10.1093 / nar / gkg520。
- 56。
Emsley P,Cowtan K:Coot:用于分子图形的模型 - 建筑工具。Acta Crystallogr D Biol Crystalogr。2004,60:2126-2132。10.1107 / S09074444904019158。
- 57。
Adams PD,Afonine PV,BunkócziG,陈·冯·戴维斯IW,Echols N,Headd JJ,Hung LW,Kapral GJ,Gross-Kunstleve RW,McCoy AJ,Moriarty NW,Oeffner R,阅读RJ,Richardson DC,Richardson JS,Terwilliger TC,Zwart pH:Phenix:基于综合的基于Python的大分子结构解决方案系统。Acta Crystallogr D Biol Crystalogr。2010,66:213-221。10.1107 / S0907444909052925。
- 58。
Horsch RB, Fry JE, Eichlotz D, Rogers SG, Frakey RT:一种简单而通用的基因转移到植物中的方法。中国科学:地球科学。
- 59。
陈志强,陈志强,陈志强:葡萄果实实时RT-PCR内参基因的统计分析。植物学报。2006,6:1-11。10.1186 / 1471-2229-6-1。
- 60。
Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F:通过多个内控基因的几何平均实现实时定量RT-PCR数据的精确归一化。中国生物医学工程学报。2002,3:research0034.1-research0034.11。10.1186 / gb - 2002 - 3 - 7 - research0034。
- 61。
Gouet P, Courcelle E, Stuart DI, Metoz F: ESPript: PostScript中的多序列比对。生物信息学。1999,15:305-308。10.1093 /生物信息学/ 15.4.305。
- 62。
Delano WL:聚合物分子图形系统。2002年,[http://www.pymol.org.]
- 63。
Horstmann V, Huether CM, Jost W, Reski R, Decker EL:定量启动子分析Physcomitrella patens.:一组激活3个数量级基因表达的植物载体。生物技术。2004,4:1-13。10.1186 / 1472-6750-4-1。
致谢
我们非常感谢Pr。Serge Delrot用于批判读取手稿。
作者信息
隶属关系
通讯作者
附加信息
竞争利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
IH在本文中进行了大多数实验,并写了初始稿件草案。LD克隆VVMYB5BR和VVMYB5BL序列和变换烟草。JB,AM,FR和CTM参与了实验(双荧光素酶测定,烟草转化,凝胶移位测定和QRT-PCR)。BG和TG有助于分析和解释结构数据。VL,FB和LD构思了该研究,参与了稿件的准备和最终确定。例如,批判性地修改了稿件以用于智力内容。所有作者均阅读并批准最终手稿。
电子辅料
检测到
附加文件1:体外合成VvMYB5br / l.蛋白质.这两种蛋白质都是由体外用TnT T7快速系统进行PCR DNA系统(Promega, Charbonnières,法国)的转录和翻译方法,根据制造商的说明。用Turbo-扩增编码序列PFU.(Stratagene)中使用下列引物对:F,5'-AGATCCTAATACGACTCACTATAGGGAGCCACCATGAGGAATGCATCCTCAGCA和R,5' - (T)32TCAGAACCGCTTATCAGGTTG。以PCR产物为模板。取5 μl的试剂进行SDS-PAGE分析。将分离的蛋白质转移到硝化纤维素膜上,使用Transcend非放射性翻译检测系统(Promega, Charbonnières,法国)进行检测。分子量在kDa对应于Page标尺预先着色#SM0671蛋白阶梯(发酵)。(TIFF 560 KB)
对照和转基因植株花中花青素含量
附加文件2:。在黑暗中用1%HCl萃取花青素颜料。花青素浓度表示为每克新鲜组织重量为530nm的吸光度单位。数据是三个重复的平均值,并指示两个独立转基因线的结果。nd:未检测到。星号表示与控制有显着不同的值(P< 0.05;学生的T.测试)。(TIFF 56 KB)
作者为图像提交的原始文件
权利和权限
开放获取本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
Hichri,I.,Deluc,L.,Barrieu,F.等等。在VVMYB5B转录因子的R2结构域内的单个氨基酸变化调节对蛋白质合作伙伴的亲和力和靶促进剂的选择性。BMC植物杂志11,117(2011)。https://doi.org/10.1186/1471-2229-11-117
收到:
接受:
发表:
关键词
- 盐桥
- bHLH蛋白质
- 类黄酮途径
- 葡萄细胞
- 类黄酮生物合成基因