摘要
背景
虽然现代大豆品种具有黄色种子涂层,但在希拉发现唯一的颜色变异,祖先的条件是黑色种子涂层。种子涂层和HILA着色都是由于苯丙二醇途径衍生物的存在,主要是花青素。在孟德尔的工作重新发现之后,首先在20世纪20年代的遗传复苏期间研究了大豆种子涂层和Hilum着色的遗传学。尽管将这种表型标志物包含在过去的二十年内为大豆开发的广泛遗传图中,但棕色种子涂层现象背后的遗传基础()R至今仍未确定。
结果
为了找出导致r基因效应(棕色种脐或种皮颜色),我们利用大量分离分析,从一个群体分离出两个表型不同的等位基因的重组系R轨迹。通过使用一套新的、生物信息学上确定的简单序列重复(SSR)标记,可以加速精细定位,使我们能够划定包含该基因的基因组区域r尽管使用仅100 f的映射群体,但基因少于200 kbp6线条。候选基因分析鉴定了影响种子涂层特异性表达的R2R3 MYB转录因子基因(Glyma09G36990)作为棕色Hilum表型的强候选的功能突变的丧失。我们观察到功能的mRNA表达水平之间的接近完美相关性R候选基因和UDP-葡萄糖:黄酮3-O-葡糖基转移酶(UF3GT)基因,负责花青素生物合成的最后一步。相反,当Glyma09g36990的null等位基因表达时,则不上调UF3GT.基因被发现。
结论
我们发现了一个四种功能突变缺失的等位基因序列R亲和基因的候选。这些突变中的任何一个的存在下完全与在大豆品种的宽分布的调查棕色种皮/种脐的表型相关联,除非所述上位主导的存在我等位基因或灰色的阴毛,两者都可以掩盖效果r等位基因,导致黄色或浅黄色希拉。这些发现有力地表明,大豆种皮/种门棕色表型是由于一种特殊的种皮表达R2R3 MYB基因功能缺失所致。
背景
大豆的驯化
大豆[大豆(l)稳定。]是一种非凡的植物,生产高品质的油和蛋白质,是美国的主要行作物之一。虽然大豆对西方农业来说相对较新,但它已经种植了3000年[1,2].从野生到野生的转变甘氨酸大豆要培养大豆是古代植物育种家/农民对大量驯化特有性状(光周期不敏感、不打落、不倒伏、种子大小增大、结实率增大等)进行选择的结果。在驯化过程中,籽油/蛋白质含量和脂肪酸组成的显著变化也被直接或间接地选择[3.,4].
大豆种子着色的遗传学研究
大豆种子本身的视觉外观也被归化的结果改变:所有甘氨酸大豆在美国农业部的GRIN种质收集拥有黑色的种皮,而大多数大豆种质(12880/18585 Soybean entries,访问日期06/07/2011)具有黄色种皮。虽然黑大豆的市场很小,但所有现代高产品种的种皮都是黄色的,有一系列的hila颜色(棕色、黑色、不完全黑色、浅黄色、黄色)。品种与白希拉是高度重视纳豆和豆腐生产[5].因为Hilum着色由少数基因控制[6],这一性状常被育种家用作一种易于检测的可见标记,以确定大豆种子区是否存在“非型”。种皮和种脐颜色是相对简单的上位性多基因性状,种脐和种皮颜色的变化似乎是由于四个独立位点的相互作用:抑制剂(我),茶色(T),未命名的基因座称为R,以及花的颜色位点W1[6- - - - - -8](桌子1)。有轻微影响其它场所进行了说明,但这些都没有被映射和遗传学已经完全看出端倪[6- - - - - -8].
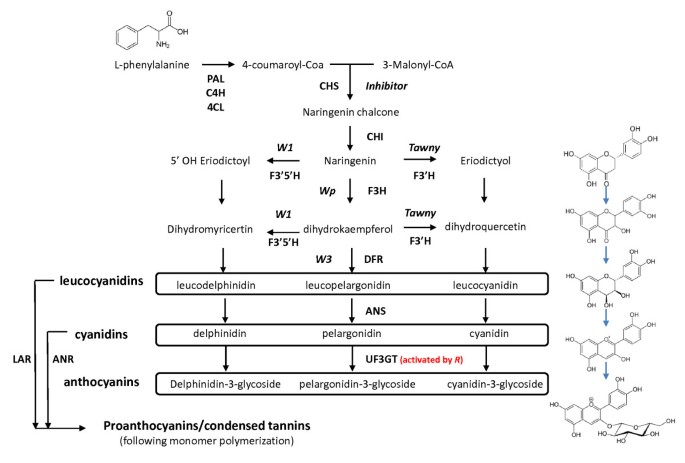
负责大豆种皮和脐色大豆的化合物是苯丙素途径的衍生物〔9- - - - - -11)(图1)。黑色种皮的野生型条件主要是由于两种花青素苷(花青素):cyanidin-3- single - lucoside和delphinidin-3- single - lucoside [10,11].在特征棕色种子涂层的线中,只有Cyanidin显然存在于成熟时[10].除了颜色的美容和美学方面,花青素被认为有多种促进人类健康的能力[12].
udp -葡萄糖:类黄酮3- o -葡萄糖基转移酶的作用是花青素积累的关键步骤
两种花青素糖苷在黑色种子涂层中形成主要的彩色化合物:Cyanidin-3-单葡糖苷和德尔菲啶-3-单氟葡糖苷[10].这些通过UDP-葡萄糖的作用形成,所述黄酮类化合物3-O-葡糖基转移酶(UF3GT)酶特异性将葡萄糖部分与UTP转移到Cyanidin和Delphinidin的3'位置(最近在[13),图1)。这种糖基化被认为可以增加花青素分子的稳定性和溶解度[14].与棕色种皮(r),Cyanidin积累,虽然也存在高水平的原花青素[10].最近,两种高度相似的基因共同表达UF3GT.基因(Glyma07g30180和Glyma08g07130)在黑种大豆品系种皮中表达,这些基因已被证明能特异性地将一个葡萄糖片段转移到3'-羟基的花青素分子上,从而形成花青素-3-葡萄糖苷[15].
的抑制剂轨迹
种皮颜色主要是下的控制抑制剂轨迹,其具有至少四个经典确定的遗传等位基因[8,这里从最主要的到最次要的依次列出:我(大部分无色种子)>我我(颜色局限于门部)>我k(“鞍”;在脐色及以后肺门稍开展)>我(种子全黑)。抑制剂具有母效遗传的显性功能获得方式,并导致种皮由于缺乏花青素而呈现淡黄色[10].无论是占主导地位抑制剂等位基因(我)和我我已经证明了等位基因是由于天然存在的基因 - 沉默效应来自链接但独立的氨基酮合成酶(CHS)基因簇(染色体8,LG A2),其产生靶向细菌内的CHS基因转录物的siRNA,用于降解16- - - - - -22].
大豆Hilum着色的遗传学
它有优势航线我等位基因仍然可以在门部显示出一些颜色的痕迹,特定的门部颜色是由于在其他三个基因位点的等位基因地位:茶色,R, 和W1[6,8)(表1)。种脐的组织不母系衍生的,而相比之下,种皮[23].与隐性的线条(我)等位基因,种皮颜色为棕色、不完全黑色、浅黄色或黑色,取决于等位基因的地位黄褐色,R和W1位点(表1)。
的茶色基因座具有两种多效性:灰质纯合性(t等位基因在成熟时导致灰色短柔毛,在系中携带的组合我我等位基因的抑制剂轨迹,功能R基因,和紫色的花朵(W1),种子,其特征“不完善黑”肺门(表1)。或者,灰色短柔毛(t)线携带我我等位基因的抑制剂位点,功能性或非功能性R,以及白色的花(w1)产生以浅黄色为特征的种子[8)(表1)。的隐性等位基因的表型效应茶色已被发现是由于功能突变的损失影响类黄酮3 ' -羟化酶基因(Glyma06g21920) (24].在化学水平上,这是由于脐内花青素积累减少和天竺葵苷的存在(图)1),它不会在携带野型版本的行中累积茶色轨迹(10].
的隐性等位基因R位点负责棕色种脐/种皮
另一个轨迹,典型称为R,也与上位性交互茶色和抑制剂位置(以及W1位点)来控制种脐和种皮颜色[8)(表1)。与功能线茶色基因和纯合的隐性等位基因R位点具有棕色种皮或棕色种脐,这取决于等位基因的地位抑制剂轨迹(我或者我我分别)。虽然这种特质背后的遗传学被很好孟德尔的工作,在20世纪20年代重新发现[不久后解决6],其分子遗传学基础尚未确定。尽管如此,表型的容易已经导致在大豆遗传图谱的发展中包含了这个位点[25- - - - - -27].
大豆着色相关基因的上位性
上位性和多效性相互作用是大豆着色相关基因的规范(见表)1)。例如,功能突变的丧失影响类黄酮3',5'-羟化酶基因(w1,F3’5是什么,图1)已被证明可导致两种表型:白色花和在胚轴紫色颜料的损失[28].等位基因的地位W1位点,当与黄褐色位点的隐性灰色等位基因结合时,决定种皮或种脐是“不完全黑色”或“浅黄色”(表1) [8].
识别R基因座的方法,从而导致棕色Hilum /种子涂层
花青素生物合成途径末端影响基因功能突变的缺失被认为是导致隐性棕色种皮/种脐表型的原因(图)1)。可能的候选人已经包括在内UF3GT.,花青素合成酶(ANS.)和/或Dihydroxyflavone还原酶(DFR)基因。然而,没有发现任何基因位置之间的相关性UF3GT.,DFR或者ANS.基因的位置R基因[29].或者,转录因子或其他调节因素可能对棕色HILUM /种子涂层现象负责。这项工作的目的是鉴定棕色Hilum /种子着色现象背后的特定基因和致病基础,历史地定义为大豆的R基因座。
方法
瑞来斯人口发展
F6RIL mapping population,源自于Jake X PI 283327之间的杂交,之前已描述[30.].杰克(PI 643912)有黄褐色的阴毛,紫色的花朵,和黑色HILA的闪亮的黄色种子(我我T R W1)[31].棕色希拉线,PI 283327具有黄褐色的阴毛,紫色的花朵和黄色种子与棕色HILA(我我,T,R,W1)(USDA Grin Germplasm Collection,Accessed 06/22/2011(http://www.ars-grin.gov/npgs/)。确定基因组序列的参考品种乳酸82 [32],有黄褐色的短柔毛,白色的花,黄色的种子,黑色的希拉(我我T, R, w1) [33].
对选定的RIL系进行整体分离分析
总共100华氏度6从发生门部颜色分离的Jake X PI 283327杂种(50个为黑色门部,50个为棕色门部)中选择RIL系,并将每个系的种子汇集成2个块体。只有确定为黑色或棕色的ril被批量使用,不包括模糊或混合的ril。种子(每粒1粒)用咖啡研磨机研磨成细粉。磨床在两次研磨之间被彻底清洗。根据制造商的建议,使用DNeasy Plant Maxi试剂盒(Qiagen, Inc., Valencia, CA)分离DNA。采用标准乙醇沉淀法浓缩DNA,最终浓度为3.52微克mL-1(黑色体积)或2.40微克毫升-1(棕色散装)。散装DNA用通用大豆联动面板(USLP)中使用如先前所描述[34].
简单重复序列(SSR)标记
所有SSR引物对均来自新划定的范围内R从生物信息定义的列表中汲取的轨迹区也被检查用于微映射中的潜在实用程序[35].精细定位PCR在20微升反应中进行,如前所述[36, PCR产物在2%琼脂糖凝胶上分离。基因型分类通过目视比较和使用亲本DNA的PCR反应来确定。只有两个亲本(PI 283327和Jake)之间存在明显且易于评分的大小多态性的SSR引物对被用于后续分析。SSR引物对在新确定的范围内表现出多态性R区域,理论上可以用来选择该特征,在附加文件中列出1.
DNA分离,PCR和从纯系的种子候选基因的测序
用DNeasy植物迷你试剂盒(Qiagen)分离DNA,用Ex taq (Takara)对5-50 ng DNA进行PCR,并使用基因特异性引物(附加文件)1),在以下条件下:95°C 5分钟,接着是40个循环,95°C 30秒,59°C 30秒,和在72°C 1分钟每1kbp的预测产品尺寸。PCR之后,产品在1%琼脂糖凝胶上进行电泳检查,并送到密苏里大学DNA核心设施进行测序。下载序列轨迹,导入VectorNTI Advance 11软件(Invitrogen, Carlsbad, CA, USA)的Contig Express模型中,组装并手工评估多态性。假定的多态性通过第二个独立的PCR和测序反应得到验证。
从种质资源库多样化的选线
选择136个株系进行测序R基因,从以前建立的不同种质的清单[37或从美国农业部收集的GRIN种质(http://www.ars-grin.gov/npgs/),以确保种脐和种皮颜色分布广泛。由于上位性相互作用,某些颜色类别只被最低限度地研究了,这排除了新的信息(例如,黄色种皮与浅黄色种皮,见表)1)。一个完整的清单的136行检查的等位基因状态Rgene/Glyma09g36990在附加文件中列出2.对于10线的子集,所有三个外显子通过测序(包括5'UTR,3'UTR,1检查圣内含子和大部分2n内含子,虽然部分2n内含子是高度重复的AT丰富且顽抗PCR和测序)。这些线为:PI 84970(北海道黑,黑种皮),PI 518671(威廉姆斯82,黄色种皮,黑色肺门),PI 643912(杰克,黄色种皮,黑色肺门),PI 548461(改进鹈鹕,黄色种子外套,棕色肺门),PI 548389(Minsoy,黄色种皮,棕色肺门),PI 438477(Fiskeby 840-7-3,黄色种皮,棕色肺门),PI 180501(菌株#18,黄种皮,棕色肺门),PI 283327(屏东珍珠,黄色种皮,棕色肺门),PI 240664(Bilomia第3号,黄色种皮,棕色肺门),PI 567115 B(MARIF 2782,黑种皮)。由于确定的所有突变被发现影响1圣或2n我们选择只对第1外显子和第2外显子(以及5' UTR, 1圣内含子和2n内含子)。
中存在
上种皮表达分析,如所描述的进行子叶或叶的总RNA(使用的Turbo DNA酶(Ambion公司,奥斯汀,TX,USA)DNA酶处理的)[38稍作修改。RT-PCR混合物中添加0.2X Titanium Taq聚合酶(BD Biosciences, Palo Alto, CA)以提高引物效率。逆转录酶反应后,扩增95°C 15 min,然后95°C 20秒,60°C 20秒,72°C 20秒35个循环。本工作中使用的引物在附加文件中列出1.用于归一化数据的内参基因为con6 [39]和原始Ct值首先应用于利用Williams 82基因组DNA为每个引物建立的效率曲线,然后归一化到内参基因的表达,并以占con6的百分比表达。
许多研究人员报道了利用成熟黄色种皮组织RNA进行qRT-PCR的可靠数据。然而,利用来自棕色种皮组织的RNA进行RT-PCR具有挑战性,这可能是由于原花青素的干扰效应[10].使用简单的PCR抑制剂去除柱(Zymo, Irvine, CA, USA)解决了这一难题,从成熟的棕色种皮组织分离的mRNA中获得了可接受的qRT-PCR数据。
我们还使用前面描述的引物对研究了CHS7/8 [18];然而,在棕色和黑色种子涂层样品(数据未示出)之间没有显着表达水平差异,结果在阴囊和种子涂层组织中具有显着表达水平差异的结果。
结果
批量分析分析
为了找出导致r位点效应(种脐或种皮颜色为棕色),我们最初利用了bulk separation analysis (BSA) [40]上从群体中重组自交系方法从大豆的横品种杰克与曾用于隔离的PI 283327衍生R基因等位基因与USLP阵列[34].尽管这项技术证实了先前确定的位置R轨迹(25,26],所识别的极宽窗口(数据未显示,根据Williams 82层序,约4.2 Mbp)未能进一步划定地层边界R轨迹。
然后我们分析了一组新的SSR [35的全基因组猎枪序列(WGSS)的生物信息学分析R轨迹。利用两批带有多态标记的DNA,我们可以改进R区域至〜1.35 Mbps的作为紧密连锁的负责棕色肺门轨迹(表2)。
标识分隔区域内具有重组事件特征的行R地区
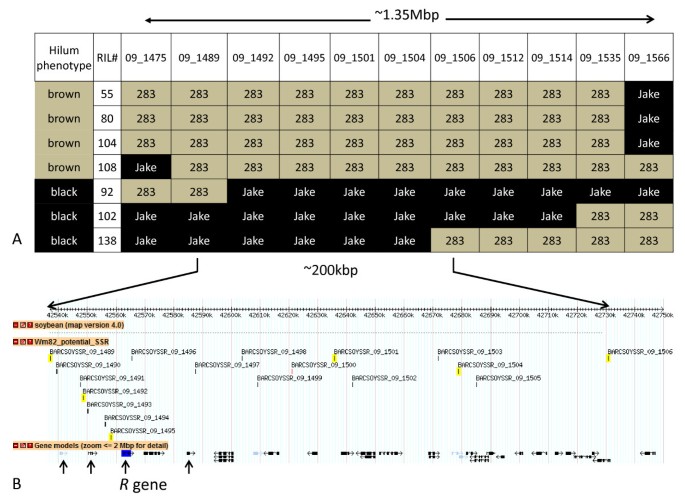
从BARCSOYSSR 09_1475、09_1501和09_1566 3对SSR引物对100个RIL系进行检测。大多数情况下,门部颜色表型与预期亲本多态带相关。在染色体Gm09/LG K的区域内,我们还观察到7个具有重组事件的个体ril(图)2)。我们使用该区域内所有新的多态SSRs标记检测了这7个RIL,并将标记基因型与RIL表型进行了比较(表)2数字2)。我们的方法使我们能够精确地绘制出R用100个RIL株系,将基因扩增到不到200 kbp的预测区域。Williams 82的这个区域包含23个预测的开放阅读框架,另外3个基因被注释为伪基因(图)2 b)。
PI 283327褐门基因的遗传作图.2:描述F内SSR标记的表型和等位基因地位的图表6利用RIL系精细定位大豆品种PI 283327褐门颜色的基因座。2 b:大豆品种PI 283327中含有棕色门部颜色的基因座的基因组屏幕捕获浏览器版本1.71 (http://www.soybase.org,访问2011年3月15日)。箭头指示四个候选R2R3 MYB转录因子基因的位置。在褐色脐线(PI 283327)在种皮中表达的只有R2R3 MYB基因,其特点是从缺失的外显子2(C377-)内的基因组位置中指示。
四个R2R3 MYB基因鉴定为候选人R轨迹
使用26个候选基因进行BLAST搜索对NCBI进行(http://www.ncbi.nlm.nih.gov/)及TAIR (http://www.arabidopsis.org)数据库以搜寻候选基因。BLAST搜索发现了4个与R2R3 MYB转录因子家族同源的串联基因:Glyma09g36970、Glyma09g36980、09g36990和Glyma09g37010。R2R3 MYB基因已经被证明可以通过苯基丙酸途径控制通量,并且多个物种中的突变与果实、花朵和/或种子颜色的变化相关(最近在[41])。这四个串联的R2R3 MYB基因高度相似(约80-90%的核苷酸相同,不包括推测的内含子序列),可能是由于串联基因扩增事件而产生的。令人惊讶的是,在最近使用RNAseq方法进行的以种子为重点的研究中,似乎没有发现这些基因[42,43].
R2R3候选基因表达分析
由于大豆门部组织非常小,很难准确地从非着色阶段的种子中分离出来,我们使用了棕色种皮的大种系(PI 567115b)和黑色种皮的大种系(PI 84970)来检测mRNA的表达。为了评估这四个串联基因中是否有一个子集是伪基因和/或在种皮组织中表达(Glyma09g36970在当前全基因组猎枪序列构建中被注释为伪基因),我们使用了qRT-PCR。这些R2R3 MYB候选基因中只有一个Glyma09g36990在任何被检测的组织(叶、种子子叶和种皮)中表达。Glyma09g36990的基因转录本存在于棕色种子和黑色种子的种皮中。然而,该基因在两个子叶组织中均未表达3)或叶片(未示出数据)。如果集群中的其他三个R2R3 MYB基因在其他组织中表达,目前尚不清楚。也不是这些基因在大豆生理众所周知的作用,如果有的话。
奇怪的是,Williams 82 Glyma09g36990基因模型被预测拥有4个外显子,而与R2R3 MYB转录因子基因鉴定的标准3个外显子相反[44,45].为了鉴定真实表达序列,采用RT-PCR方法分析全长cDNA,并与参考的Williams 82基因模型进行比较。真实基因比预测的Glyma09g36690基因模型略大,有三个外显子(Additional File)3.),与其他R2R3 MYB基因的研究结果一致[44,45].
Glyma09g36990潜在致病多态性分析
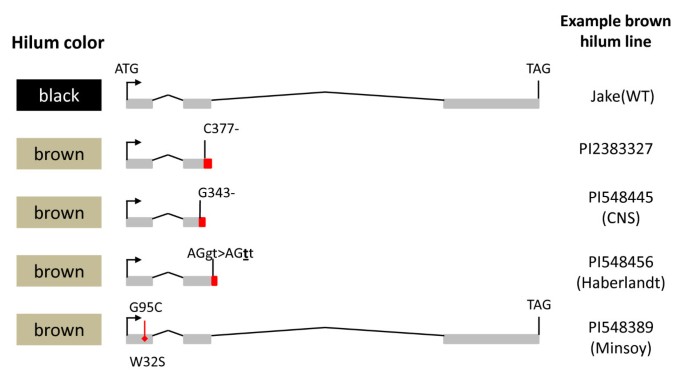
采用PCR和Sanger测序方法对Glyma09g36990基因的外显子(和部分内含子序列)进行了多态性分析,并对黑色种皮(Jake)、棕色种皮(PI 283327)、黑色种皮(Williams 82)、黑色种皮(PI 84970)和棕色种皮(PI 567115b)进行了分析。我们发现PI 283327和PI 567115b的外显子2中有一个单基缺失,导致一个移码突变(相对于起始密码子C377-)(图)4,详情见附加文件3.)。Glyma09g36990的开放阅读框是Williams 82、Jake和PI 84970之间的等位基因。
遗传等位基因R轨迹/ Glyma09g36990基因.综述了从136个大豆品种中鉴定到的4个功能缺失等位基因,并列举了一个常用大豆品种的例子。所检测的品种和等位基因的完整清单列在附加文件中2.
然后我们选择检查行的广泛地理分布(总共136行,附加文件2)从已知的所有种皮和种脐颜色类的可用大豆种质资源中提取。从这个库中,我们确定了另外三个假定的功能突变丢失:G343-,导致帧移;G95C TGG > TCG (W32S)保守残基错义;AGgt > AGtt (g404t)破坏保守的mRNA剪接识别位点(图4,详情请参阅附加文件3.)。
在所有观察到完整开放阅读框的病例中,我们注意到不完全黑色门的表型(我我r t w1.), buff hilum (我我R t w1)、黑门(我我R T)或黑色种皮(我R T),取决于等位基因的地位抑制剂和茶色位点(附加文件2)。这四种功能等位基因的任何一种缺失都会导致棕色门(我我r T),棕色种皮(i r T)或浅黄色(我我r t)。在所有情况下,我们观察到在四种功能等位基因和棕色辣椒或棕色种子涂层中的四种丧失之一之间的完美关联,禁止了本质优势的存在我等位基因或灰色的阴毛,两者都可以掩盖效果r等位基因,导致黄色或浅黄色希拉(附加文件2)。这些上位相互作用(并且在的情况下,掩蔽抑制剂)是由于受R2R3 MYB基因影响的步骤位于花青素生物合成途径的末端(图1)。任何一种影响R基因是种皮和(或)种脐褐变的必要和充分条件。然而,表型效应可以被抑制因子和茶色位点的某些等位基因掩盖或调节(见表)1额外的文件2)。
mRNA表达的时间 - 过程Glyma09g36990和两个苯丙生物合成酶
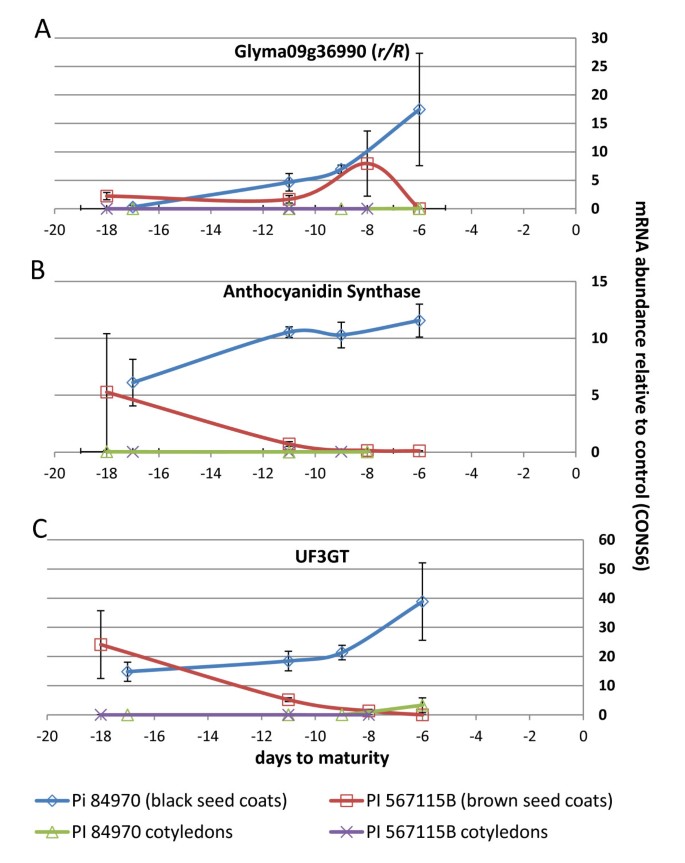
如果候选R在花青素生产过程中,基因控制着一个基因的表达,形成了一个速率有限的步骤,我们假设1)R基因表达水平,2)颜色化合物的出现,3)表达ANS.和/或UF3GT.种皮发育的基因。我们通过qRT-PCR检测了种皮和种子子叶的时间进程(图3.)对于表达三种基因:R基因的候选人,ANS., 和UF3GT..研究了棕色种皮大种系(PI 567115 B)和黑色种皮大种系(PI 84970)的种皮稳态转录本的定量。我们选择了PI 84970(黑色种皮)和PI 567115b(棕色种皮)在种子生长和成熟过程中色素沉着发育的4个时间点(附加文件)4)。
虽然有明显2UF3GT.在大豆种皮中表达的基因(Glyma07g30180和Glyma08g07130)中,只有一个基因(Glyma08g07130)在子叶组织中不表达[15].我们选择聚焦该基因进行qRT-PCR,因为我们注意到实际上没有ANS.或者R子叶的基因表达(图3和3 b)。
我们观察到一个近乎完美的相关系数(R2= 0.96)之间的表达水平(相对于一个内部控制的con6)推定R基因和UF3GT.基因(Glyma08g07130)(图3和3 c)。相反,我们观察到表达之间的弱相关性R基因和ANS.基因表达(右2= 0.66)在黑种皮线路(图3和3 b)。褐种系PI 567115b与褐种系间无显著相关R基因表达水平和ANS.或者UF3GT.表达水平(图3得了)。在早期和中期发展阶段R然而,黑色和棕色种皮系的基因表达是相似的R在褐色播种线的发展的最后阶段的基因表达下降,相比于高表达的黑种皮线指出(图3)。与之形成鲜明对比的是ANS.和UF3GT.在种皮成熟的黑色种皮线,只有微不足道ANS.和UF3GT.当种子接近成熟时,在棕色种皮线观察到表达(图)3 b和3 c)。
这些发现证实了我们的假设,即R2R3 MYB基因Glyma09g36690功能突变的丢失与aUF3GT.基因和ANS.基因和与棕色脐/种皮表型。它仍然是今后的工作,以确定由大豆R2R3 MYB针对特定的DNA序列RbHLH转录因子和WD40蛋白复合物的基因产物及其特异性相互作用。目前尚不清楚R基因产物是否能促进两者的转录激活ANS.和UF3GT.基因,或者如果激活ANS.基因的表达是由于间接的影响。
讨论
了解控制不同颜色、易于分类的外部色素(包括植物和动物产生的)积累的遗传因素,成为确认和扩展孟德尔遗传定律的最早模型之一。事实上,现代遗传学很大程度上归功于豌豆的白色特征,这是孟德尔在基础遗传学理论的最初确定中所利用的[46].豌豆白花表型的具体遗传原因已被确定为bHLH转录因子中的一个剪接位点的点突变[47].近一个世纪以来,对许多植物种皮颜色变异的研究一直是一个活跃的研究领域。随着时间的推移,对色素形成、色素化学以及通过转录激活剂的协同作用调控这些酶和途径的酶的机制理解已经在很大程度上得到了解决。
已经出现的植物色素积累的特征之一是R2R3 MYB转录因子在bHLH转录因子和WD40蛋白复合物中对关键结构基因的调控[48].R2R3 MYB基因倾向于显示有限的同源性(除了高度保守的DNA结合区域),并且R2R3 MYB基因与特定序列结合的密码尚未被很好地阐明[45,48].这些困难会使系统发育分析和基因的副功能分配复杂化。然而,大豆R基因候选Glyma09G36990显示对R2R3 MyB基因的同源性(附加文件3.)。在过去的几年里,已经发现了一种直接影响的R2R3基因的过多的R2R3基因UF3GT.和/或苯丙烷丙醇途径衍生的种子涂层中的颜色复合积累[49], 水果 [41,50- - - - - -52)、花(50,53,54和其他组织[55- - - - - -57].除了有色化合物的审美情趣,许多这些颜色的化合物可能有角色营养品[12].R2R3基因功能突变的缺失也被认为是其他植物中花青素积累缺失的原因[57,58].虽然R2R3 MYB基因将是合乎逻辑先天的候选人的潜在基础RMYB基因的总体同源性较低,大豆基因组中至少存在448个MYB基因[59和相对定义不甚明确的基因图谱位置R轨迹(25- - - - - -27排除了候选基因分析,然后我们进行精细定位。
在这里,我们使用遗传作图和候选基因关联的RIL群体和一组着色明确的大豆品系(种皮和门,短柔毛和花)来确定R控制大豆黑色或棕色种皮的基因是R2R3 MYB基因Glyma09g36990。间接证据支持一个模型,其中一个功能R基因的作用,促进后期花青素途径的结构基因的转录U3FGT以及ANS..这些结果与花青素途径中基因转录调控激活控制点的许多其他实例一致[41,49- - - - - -58].
全部甘氨酸大豆美国农业部种质收集的材料具有黑色的种皮,因此具有R基因的功能版本,而大豆具有的功能和突变等位基因R基因。三个无效等位基因R基因和一个等位基因与推定严重有害的错义突变存在于我们的大豆种质的子集,它们都与在我们的调查棕色脐或种皮颜色相关的调查。含有突变受体基因的线的,三个无效等位基因具有〜53%的频率,〜21%和〜19%,而错义突变等位基因在我们的有限的136条发散线调查具有〜6%的频率。这一结果表明,从自然突变的多个独立出现R来r是在大豆驯化后,但在作物在亚洲完全分散之前选择的,因为没有明确的地理关联可以为任何特定的等位基因。种皮或种脐颜色没有选择压力可能使不同等位基因得以广泛传播。最近在大豆中发现的决定生长习性的基因,DT1.是拟南芥的同源物终端花1基因[37].巧合,巧合DT1.基因也有一个确定的功能等位基因以及四个突变等位基因与一个确定的生长表型。突变DT1.等位基因只存在于大豆,但这些等位基因似乎在大豆地方品种辐射的早期阶段经历了选择压力[37].
未来的工作可能涉及在各种子叶,种子涂层和大豆中的其他组织中靶向过表达R2R3 MYB基因。因为r基因似乎是精致的表达到种子涂层的限制,所以该基因在其他组织中的过度表达可能导致花青素在组织中积累缺乏可见颜料,例如种子子叶。在控制种子储存蛋白启动子的控制下表达该R2R3 MyB基因可以增加大豆种子的花青素含量,与花青素对种子涂层的野生型限制相反。虽然假设,这可以代表可行的替代手段,以便在视觉上选择用于转基因积分和/或视觉手段以帮助遏制转基因素。
结论
我们进行了大量分离分析(BSA) [40[不及格6这已经为脐色分离-RIL人口[30.,由一个与黑希拉(Jake)的商业品种和与棕色希拉(PI 283327)的植物引种系杂交而来。我们利用了一套新的生物信息学衍生的SSR标记[35精细的地图R基因至小于200个kilobasepairs,尽管使用小于100各F一个RIL群体6线条。威廉姆斯82全基因组鸟枪序列的分析[32]对应于该区域揭示了真实的候选人的四个串联R2R3 MYB基因R基因。R2R3 MYB转录因子是植物最大的转录因子家族之一[41,44]并且已经在许多物种中鉴定了特异性的R2R3基因,其激活苯基丙醇生物合成基因的许多物种[13,29,41,50,54,56,60,61].仅含有在基因组区中的四个候选R2R3 MYB转录因子基因(Glyma09g36990)中的一个R证明在任何我们所研究的组织中表达。的该基因的功能版本的种衣特异性表达与一的表达水平相关的UF3GT.基因(Glyma08g07130),它编码完成花青素生物合成最后一步的基因产物[15].我们发现一个等位基因的一系列损失函数影响我们的R2R3基因的变异的候选人,和四损失函数的任何突变与褐色种子外套/门完全相关表型在种子分布广泛的大豆品种不同外套,门和花的颜色。这些发现有力地表明,这种特殊的R2R3 MYB基因的功能缺失是导致大豆棕色种皮/种门表型的原因。多个独立等位基因的存在表明,该基因在驯化过程中要么直接被选择为棕色,要么间接地被选择为苍白的门部颜色(由于其上位性效应抑制剂和茶色)。
缩写
- 4 cl:
-
4-coumarate:辅酶a连接酶
- ANR:
-
花青素还原酶
- BSA:
-
批量分析分析
- CHS:
-
Chalcone合成酶
- CHI:
-
查耳酮异构酶
- C4H:
-
肉桂酸4-hydroxylase
- DFR:
-
Dihydroxyflavone还原酶
- F3H:
-
黄烷酮3-羟化酶
- F3’5是什么:
-
类黄酮5' 3'羟化酶
- F3'H:
-
类黄酮3 ' -羟化酶
- 政治:
-
Leucoanthocyanidin还原酶
- 朋友:
-
苯丙氨酸氨 - 裂解酶
- PI:
-
植物引入线
- 瑞来斯:
-
重组自交系
- 苏维埃社会主义共和国:
-
简单序列重复
- USLP:
-
通用大豆连锁面板。
参考
- 1.
关于大豆的驯化。中国农业科学,2017,29(4):457 - 461。10.1007 / BF02860745。
- 2.
陈志强,陈志强:植物的分类、物种形成、驯化、传播、种质资源和变异甘氨酸.进展豆科植物科学。萨默RJ,彩旗AH:主编。基尤,英格兰:皇家植物园;1980:251-264。
- 3.
黄志强,王志强,王志强,等。野生大豆亚麻酸含量的遗传调控甘氨酸大豆加入。J AM Oil Chem SoC。1997年,74(2):159-163。10.1007 / s11746-997-0162-5。
- 4.
Pantalone V,Rebetzke G,Wilson R,Burton J:种子质量与亚麻酸在栽培和野生大豆之间的后代关系。J AM Oil Chem SoC。1997,74(5):563-568。10.1007 / s11746-997-0181-2。
- 5.
刘凯:食用全大豆。大豆:化学、生产、加工和利用。编辑:Johnson LA, White PJ, Galloway R.Urbana, IL: AOCS出版社;2008:441 - 481。
- 6.
Owen FV:大豆的遗传研究。3种皮颜色及迄今为止所有其它孟德尔性状的综述。遗传学报。1928,13(1):50-79。
- 7.
Williams LF:大豆中某些黑色和棕色色素的遗传。遗传学报,1952,37(2):208-215。
- 8.
Palmer RG, Pfeiffer TW, Buss GR, Kilen TC:定性遗传学。大豆:改良、生产和使用…3版。编辑:Boerma HR, SpechtJE。威斯康星州麦迪逊市:ASA、CSSA和SSSA;2004:137 - 214。
- 9.
植物花青素和棕色色素形成的遗传生理学研究。东京大学农学院学报。1921,8(1):1-92。
- 10。
Todd JJ, Vodkin LO:色素大豆(大豆种皮在发育过程中积累原花青素。植物生理学报,1993,102(2):663-670。
- 11.
Buzzell Ri,Buttery Br,Mactivish DC:大豆种子黑色色素沉着的生化遗传学。遗传杂志。1987,78(1):53-54。
- 12.
花青素:具有健康促进作用的天然色素。食品科学与技术,2010,1(1):163-187。10.1146 / annurev.food.080708.100754。
- 13.
Kovinich N, Arnason JT, Luca V, Miki B:用花青素给大豆着色?植物化学物质的生物活性。卷41。编辑:Gang DR.施普林格New York;2011:47-57。
- 14.
女招待所:植物生物化学。卷7。编辑:Stumpf W,Conn PM。学术出版社;1981:725 - 753。
- 15.
B:黑豆种皮中udp -葡萄糖:类黄酮3- o -葡萄糖基转移酶的功能表征(大豆(l)稳定)。植物化学学报。2010,71(11-12):1253-1263。10.1016 / j.phytochem.2010.05.009。
- 16.
Clough SJ,Tuteja JH,Li M,MAREK LF,Shoemaker RC,Vodkin Lo:大豆中富含103 kB基因的区域的特征包括倒置完美的重复集群CHS组成I位点的基因。基因组学杂志。2004,47(5):819-831。10.1139 / g04 - 049。
- 17.
图teja JH, Clough SJ, Chan WC, Vodkin LO:由自然发生的查尔酮合成酶基因簇介导的组织特异性基因沉默大豆.植物学报。2004,16(4):819-835。10.1105 / tpc.021352。
- 18.
Tuteja JH,萨瓦拉G,Varala K,哈德森男,Vodkin LO:内源性的,组织特异性短干扰RNA沉默的查耳酮合成酶基因家族中大豆种子涂层。植物细胞中。2009,21(10):3063-3077。10.1105 / TPC.109.069856。
- 19.
Senda M,Masuta C,Ohnishi S,Goto K,Kasai A,Sano T,Hong J-S,MacFarlane S:Patterning病毒感染大豆种皮与抑制种子的内源沉默有关查耳酮合酶基因。植物细胞中。2004,16(4):807-818。10.1105 / TPC.019885。
- 20.
Kasai A, Kasai K, Yumoto S, Senda M:结构特征GmIRCHS,抑制大豆抑制种子涂层色素沉着的候选者:对诱导内源性RNA沉默的影响查耳酮合酶基因。植物营养与肥料学报。2007,29(4):489 - 498。10.1007 / s11103 - 007 - 9169 - 4。
- 21.
Eckardt NA:沉默的组织特异性sirnaCHS基因大豆。植物学报,2009,21(10):2983-2984。10.1105 / tpc.109.072421。
- 22.
Kasai A, Ohnishi S, Yamazaki H, Funatsuki H, Kurauchi T, Matsumoto T, Yumoto S, Senda M:低温诱导黄豆种皮变色的分子机制。植物营养与肥料学报。2009,50(6):1090-1098。10.1093 /卡式肺囊虫肺炎/ pcp061。
- 23.
大豆母体种子组织的形态和超微结构与光合产物进口的关系。植物生理学。1981,67(5):1016-1025。10.1104 / pp.67.5.1016。
- 24.
ZabaLa G,Vodkin L:在大豆和两个隐性等位基因中克隆了含有差异影响结构和编码的表达的两个隐性等位基因类黄酮3 ' -羟化酶.遗传学报。2003,16(1):97 - 101。
- 25.
宋强,马立克,杨志刚,杨志刚,杨志刚:一种新的大豆遗传连锁图谱。acta photonica sinica, 2004, 40(1): 122-128。10.1007 / s00122 - 004 - 1602 - 3。
- 26.
Cregan PB,亚尔维克T,布什AL,舒梅克RC,云雀KG,卡勒AL,卡亚N,VanToai TT,Lohnes DG,仲J,等:一种集成的大豆基因组的遗传连锁图。作物科学。1999年,39(5):1464至1490年。10.2135 / cropsci1999.3951464x。
- 27.
Lark KG, Weisemann JM, Matthews BF, Palmer RG, Chase K, Macalma T:大豆遗传图谱(大豆利用两个品种的种内杂交:‘Minsoy’和‘Noir 1’。遗传学报。1993,86(8):901-906。
- 28.
Zabala G, Vodkin LO:导致小串重复的重排F3’5是什么白花基因型与大豆W1位点相关。作物科学。2007,47 (S2): S-113-S-124。
- 29.
Yang K, Jeong N, Moon J-K, Lee Y-H, Lee S-H, Kim HM, Hwang CH, Back K, Palmer RG, Jeong S-C:大豆种皮和花色自然变异控制基因的遗传分析。遗传学报。2010,101(6):757-768。10.1093 / jhered / esq078。
- 30.
PHAM A-T,Lee J-D,Shannon JG,B内苏K:突变等位基因FAD2-1A.和FAD2-1B.结合生产具有高油酸籽油性状的大豆。acta botanica sinica, 2010, 31(1): 1- 4。
- 31。
香农JG,Wrather Ja,Slepper Da,Robbins RT,Nguyen HT,Anand SC:'Jake'yobean的注册。J工厂注册。2007,1(1):29-30。10.3198 / JPR2006.05.0347CRC。
- 32。
Schmutz J,Cannon SB,Schlueter J,Ma J,MA j,Mitros T,Nelson W,Hyten DL,Song Q,Thelen Jj,Cheng J,等:古代聚宝蛋白大豆的基因组序列。自然。2010年,463:178-183。10.1038 / Nature08670。
- 33。
Bernard RL, Cremeens CR:“Williams 82”大豆的注册。作物科学。1988,28(6):1027-1028。
- 34。
Hyten DL, Choi I-Y, Song Q, Specht JE, Carter TE, Shoemaker RC, Hwang E-Y, Matukumalli LK, Cregan PB: A high density integrated genetic linkage map of soybean and the development of a 1536 universal soy linkage panel for quantitative trait locus mapping. Crop Science. 2010, 50 (3): 960-968. 10.2135/cropsci2009.06.0360.
- 35。
宋Q,贾克,朱y,授予D,纳尔逊RT,Hwang E-Y,Hyten DL,Cregan PB:大豆候选多态性SSR标记(Barcsoyssr_1.0)的丰富SSR主题和发展。作物科学。2010年,50(5):1950-1960。10.2135 / cropsci2009.10.0607。
- 36.
大豆cx1834低植酸表型是由于玉米低植酸基因的两个同源基因发生突变。植物学报。2009,2(2):179-190。10.3835 / plantgenome2008.03.0013。
- 37.
田志,王旭,李锐,李勇,Specht JE, Nelson RL, McClean PE,邱林,马军:大豆生长习性测定的人工选择。中国科学:地球科学,2010,27(6):531 - 534。10.1073 / pnas.1000088107。
- 38.
大豆棉子糖合酶基因与低棉子糖和水苏糖种子表型的关联。植物遗传资源学报。2008,1(2):135-145。10.3835 / plantgenome2008.06.0321。
- 39.
Libault M,Thibivilliers S,Bilgin DD,Radwan O,Benitez M,Clough SJ,Stacey G:鉴定四种大豆参考基因的基因表达标准化。植物基因组。2008,1(1):44-54。10.3835 / plantgenome2008.02.0091。
- 40.
Michelmore RW,Paran I,Kesseli RV:通过膨胀的偏析分析鉴定与抗病基因相关的标记:通过使用隔离群体检测特定基因组区域中标记物的快速方法。国家科学院的诉讼程序。1991,88(21):9828-9832。10.1073 / pnas.88.21.9828。
- 41.
MYB转录因子对水果颜色的影响。植物科学进展,2008,13(3):99-102。10.1016 / j.tplants.2007.11.012。
- 42.
Severin A, Woody J, Bolon Y-T, Joseph B, Diers B, Farmer A, Muehlbauer G, Nelson R, Grant D, Specht J, et al: RNA-Seq图谱大豆:大豆转录组指南。acta botanica sinica, 2010, 31(1): 1- 4。
- 43.
Bolon Y-T, Joseph B, Cannon S, Graham M, Diers B, Farmer A, May G, Muehlbauer G, Specht J, Tu Z,等:互补遗传和基因组方法有助于分析大豆连锁组I种子蛋白QTL。acta botanica sinica, 2010, 31(1): 1- 4。
- 44.
Stracke R, Werber M, Weisshaar B: R2R3-MYB基因家族拟南芥蒂利亚纳.植物生态学报,2001,4(5):447-456。10.1016 / s1369 - 5266(00) 00199 - 0。
- 45.
Feller A,Machemer K,Braun El,Grotewold E:对MYB和BHLH植物转录因子的进化和比较分析。植物杂志。2011,66(1):94-116。10.1111 / J.1365-313x.2010.04459.x。
- 46.
孟德尔:Versuche über Pflanzen-Hybriden。申德联盟自然基金会,Abhandlungen, Brünn。4: 3-47。布隆;1866.
- 47.
Hellens RP, Moreau C, Lin-Wang K, Schwinn KE, Thomson SJ, Fiers MWEJ, Frew TJ, Murray SR, Hofer JMI, Jacobs JME,等:孟德尔白花性状的鉴定。PloS one。acta photonica sinica, 2010, 40(5): 693 - 698。
- 48.
Hichri I, Barrieu F, Bogs J, Kappel C, Delrot S, Lauvergeat V:类黄酮生物合成途径转录调控的最新进展。植物学报,2011,62(8):2465-2483。10.1093 / jxb / erq442。
- 49.
奈西N,琼德C,德博洪I,卡波切M,莱平依克L:拟南芥TT2.基因编码一个R2R3 MYB结构域蛋白,该蛋白在种子发育过程中对原花青素积累起关键决定作用。acta botanica sinica(云南植物学报). 2001,13(9):2099-2114。
- 50。
Lin-Wang K, Bolitho K, Grafton K, Kortstee A, Karunairetnam S, McGhie T, Espley R, Hellens R, Allan A: R2R3 MYB转录因子与蔷薇科花青素生物合成途径调控相关。acta botanica sinica(云南植物学报),2010,31(1):1- 5。
- 51。
埃斯普利河,地狱r,putterill j,Stevenson d,kutty-amma s,allan答:苹果果实的红色着色是由于Myb转录因子的活动,mdmyb10.植物杂志。2007年,49(3):414-427。10.1111 / j.1365-313X.2006.02964.x。
- 52。
Bogs J, Jaffe F, Takos A, Walker A, Robinson S:葡萄藤转录因子VvMYBPA1调节果实发育过程中原花青素的合成。植物生理学报。2007,143(3):1347-1361。10.1104 / pp.106.093203。
- 53。
Quattrocchio F, Wing J, Woude K, Souer E, de Vetten N, Mol J, Koes R:分子分析anthocyanin2矮牵牛的基因及其花色的进化作用。植物细胞中。1999年,11(8):1433-1444。
- 54。
Nakatsuka T, Haruta K, Pitaksutheepong C, Abe Y, Kakizaki Y, Yamamoto K, Shimada N, Yamamura S, Nishihara M: R2R3-MYB和bHLH转录因子在龙胆草花中调控花青素合成的研究。植物营养与肥料学报。2008,29(12):1818-1829。10.1093 /卡式肺囊虫肺炎/ pcn163。
- 55。
Mano H,Ogasawara F,Sato K,Higo H,Minobe Y:分离紫红色甘薯结节根系中的花青素生物合成。植物生理学。2007,143(3):1252-1268。10.1104 / pp.106.094425。
- 56。
Matsui K, Umemura Y, Ohme-Takagi: AtMYBL2是一种具有单一MYB结构域的蛋白,在拟南芥花青素生物合成中起负调控作用。植物学报。2008,55(6):954-967。10.1111 / j.1365 - 313 x.2008.03565.x。
- 57。
赵立伟,周旭,吴晓霞,Prior RL,李莉:紫菜花是MYB转录因子激活的产物。植物生理学报,2010,54(3):1470-1480。10.1104 / pp.110.164160。
- 58。
Kobayashi S, Goto-Yamamoto N, Hirochika H:葡萄表皮颜色的反转录转座子诱导突变。中国科学(d辑):地球科学(d辑)。
- 59。
王Z,Libault M,Joshi T,Valliyodan B,Nguyen H,Xu D,Stacey G,Cheng J:Soydb:大豆转录因子的知识数据库。BMC植物生物学。2010,10(1):14-10.1186 / 1471-2229-10-14。
- 60.
Palapol Y,Ketsa S,林王K,弗格森我,艾伦答:MYB转录因子调控对花青素合成的山竹(藤黄属植物mangostanaL.)果实成熟时。植物学报。2009,229(6):1323-1334。10.1007 / s00425 - 009 - 0917 - 3。
- 61.
Schwinn K, Venail J, Shang Y, Mackay S, Alm V, Butelli E, Oyama R, Bailey P, Davies K, Martin C: myb调控基因的一个小家族控制着myb属植物花色素的强度和模式金鱼草属植物.植物细胞中。2006年,18(4):831-851。10.1105 / tpc.105.039255。
确认
作者要感谢David Hyten (USDA-ARS, Beltsville, Maryland)对棕色和黑色Jake X PI 283327大块进行了Golden Gate Illumina 1536 USLP分析。虽然这种方法不允许映射,但它确实证实了先前已知的位置R / R基因在Jake X PI 283327群体的大豆基因组中。我们还要感谢Paul Little的专业技术贡献。
提及商标、供应商或专有产品并不构成美国农业部对该产品的保证或保证,也不意味着美国农业部批准排除其他可能适用的产品或供应商。
美国农业部门,农业研究服务,中西部地区,是一个机会均等,积极行动的雇主和所有代理服务都可以不受歧视。
作者信息
从属关系
通讯作者
额外的信息
作者的贡献
JDG构思实验,撰写研究稿,选择分析品系,从品系中分离DNA,进行PCR、RT-PCR、克隆、批量分离分析、SSR分型、测序反应和数据分析。AT进行了DNA分离、SSR基因分型、植株生长和维持、种皮和种脐颜色分型。KB还构思了实验,进行了qRT-PCR,进行了数据分析,并撰写了手稿。JDL和JGS开发了F6用于批量分离分析RIL群体。所有作者审查并批准了稿件。
电子辅料
12870 _2011_942_moesm1_esm.xls
附件1:在这项工作中使用的引物列表。含有克隆将R基因座中使用的所有引物Excel格式文件。(XLS 38 KB)
12870 _2011_942_moesm2_esm.xls
附加文件2:136份大豆品种Glyma09g36990的表型数据和等位基因状态摘要。Excel格式的文件,包含136份大豆选育材料的种皮、种脐和花的表型信息和R基因等位基因状态。(XLS 121 KB)
r位点Glyma09g36990基因的详细序列
附加文件3:。包含克隆基因模型的Word文件,详细的突变识别和比对R基因候选Glyma09g36990,已知有4个R2R3 MYB基因控制UF3GT.在其他物种中的表达和/或花青素积累。(医生298 KB)
12870 _2011_942_moesm4_esm.ppt
附加文件4:选择用于定量RT-PCR的种子图像。利用完整种子图像对褐种(PI 567115b)和黑种(PI 84970)的qRT-PCR时间过程进行分析。(PPT 830 KB)
作者为图像提交的原始文件
权利和权限
本文由BioMed Central Ltd授权发表。这是一篇基于知识共享署名许可协议(http://creativeCommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
吉尔曼博士,泰特洛博士,李博士。et al。影响特定的功能损失突变大豆R2R3 MYB转录因子导致褐脐和棕色种皮。BMC植物杂志11,155(2011)。https://doi.org/10.1186/1471-2229-11-155
已收到:
接受:
发表:
关键字
- 种皮
- 种子涂色颜色
- 黄色的种皮
- 黑色种皮
- 黑色的门