摘要
背景
亚麻、Linum Usitatissimum.L.,是一种重要的作物,其种子油和干纤维具有多个工业应用。亚麻种子也可用于它们的营养属性公知的,即,在从种皮油和木酚素和粘液的ω-3脂肪酸。尽管这种作物的重要性,有可能对改善种子性状可以利用几个分子的资源。在这里,我们描述了亚麻籽亚麻籽胚胎和种子发育和生成的综合基因组资源。
结果
我们描述了各种组织中表达序列的大规模生成和分析。统称,我们使用的13个文库提供了在开发胚胎(球状,心脏,鱼雷,子叶和成熟阶段)种子涂层(球状和鱼雷阶段)和胚乳(汇集到鱼雷阶段)和基因表达的基因中的广泛表示在鲜花,紫酸幼苗,叶子和茎组织。生成了总共261,272个表达的序列标签(EST)(GenBank Rescessions Libest_026995到Libest_027011)。这些EST文库包括通常在低水平下表达的转录因子基因,表明深度足以在Silico.表达分析。经est序列组装,共获得30640个unigenes,其中82%的unigenes与其他植物已知或假想的基因具有同源性。与完全测序的植物基因组相比,亚麻的单基因更像杨树和蓖麻,而不是葡萄、高粱、水稻或拟南芥。其中近五分之一(5152个)在任何生物体的序列中都没有同源基因,这表明这一类别可能是亚麻特有的基因。数字分析揭示了种子发育过程中许多重要种子成分生物合成的基因表达动态。
结论
我们已经开发的表达序列和包含即使是低表达的基因的质粒克隆的集合的基础数据库,诸如编码转录因子。这使我们以描绘基因表达的一些在亚麻重要种子组分的生物合成所依据的时空方面。亚麻属不同植物的分类群和大序列数据库将允许进化研究,以及。
背景
亚麻(Linum Usitatissimum.玉米(L. L.)是全球重要的农业作物,因其种子油和茎纤维而被种植。亚麻籽是一种食物来源,具有许多宝贵的营养品质。这种种子油也有多种工业应用,如制造油毡和油漆,以及保存木材和混凝土。亚麻茎中的纤维在亚麻等纺织品、纸币等特种纸张以及环保绝缘材料中具有很高的价值。1].亚麻属于家庭亚麻科而在属约200种一个Linum.[2].这是用30条染色体(2N = 30),和用于高等植物相对小的基因组大小的自花授粉年度二倍体植物,估计为〜700 Mbp的[3.,4].虽然亚麻演示典型的双子叶种子发育,有比种属特异性差异,例如,拟南芥蒂利亚纳种子发展。然而,关于亚麻籽发育期间表达的基因很少。推进这些知识和基因表达谱和基因序列的比较将为亚麻籽发育提供新的见解。
在营养方面,亚麻籽具有多种可取的特性。它含有丰富的膳食纤维和高含量的必需脂肪酸、维生素和矿物质。种子由45%的油脂、30%的膳食纤维和25%的蛋白质组成。亚麻籽中约73%的脂肪酸是多不饱和脂肪酸。大约50%的脂肪酸由α-亚麻酸(ALA)组成,它是人类饮食中许多必需脂肪酸的前体[5].亚麻籽也是Lignan组分SecoIsolariciresinol Diglucoside(SDG)的丰富来源。SDG在亚麻籽中以75-800倍的水平呈现比目前已知的任何其他作物或蔬菜的水平[6,7].除了具有抗癌特性外,可持续发展目标还具有抗氧化剂和植物雌激素特性[8].亚麻籽含有约400克/千克的总膳食纤维。这个种子纤维富含戊聚糖和船体部分含有2-7%的粘液[9].亚麻籽的另一个主要成分是贮藏蛋白质,其含量从10-30%不等[10.].球蛋白是亚麻籽的主要贮藏蛋白,形成关于总种子蛋白的58-66%[11.,12.].
通过育种各种特征的育种改善亚麻体变量可以通过理解这些特征的遗传和生化基础来促进各种特征的促进[13.,14.].该研究的目标是开发一个综合基因组学的数据集,用于亚麻,以推进亚麻胚胎,胚乳和种子涂层的理解。我们报告了13个cDNA文库的构建,每个组织组织阶段源自特定的亚麻籽组织阶段,以及其他植物组织以及来自这些文库的EST的产生以及相关组装的unigenes。我们挖掘了由此产生的数据库,目的是揭示进入发展种子的基因表达的新见解与营养组织和其他植物物种相比。我们向该数据库作为一种工具来展示该数据库的有用性,以识别亚麻籽中生物学上重要途径中发挥关键作用的推定候选者。具体地,我们分析了与脂肪酸,类黄酮,粘膜和储存蛋白质合成和转录因子相关的胚胎发生期间的基因表达。
结果和讨论
亚麻籽中的种子发展特征
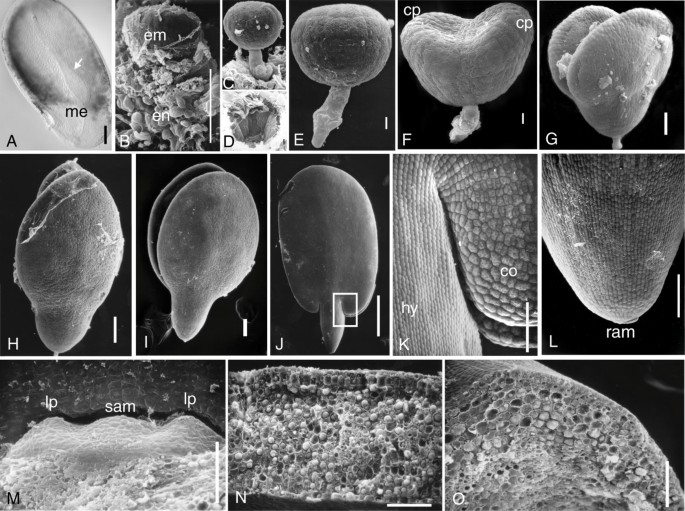
尽管亚麻种子在经济上很重要,但有关亚麻种子开发的信息有限。在本研究中,我们对亚麻的胚胎发生和种子发育进行了详细的分析。亚麻种子由3个主要组织组成:双受精产生的二倍体胚和三倍体胚乳以及母体种皮组织。受精后不久,种子是半透明的,胚囊在珠被内直立(图1A).发育中的胚被锚定在胚囊的珠孔端。在种子发育过程中,受精卵的厚、透明、脆弱的珠被分化为薄、暗、有保护作用的种皮。在解剖过程中观察发现,受精时形成的胚乳首字母在球状胚时期发生分裂,形成细胞化的胚乳(图1B.和图2h).胚乳逐渐增加到鱼雷阶段的尺寸增加,之后逐步逐步增加,大概是为迅速伸长的子叶制造空间并为发育胚胎提供营养支持。通过晚期子叶阶段,已经消耗了大多数胚乳细胞,在成熟的种子的种子涂层的内壁上留下薄薄的胚乳。
亚麻胚胎发育.(a)施肥后很快清除种子。胚囊囊(箭头)包围胚胎和胚乳,并锚定在厚种子涂层的微囊端(Me)中。(B-O)扫描亚麻胚胎显微镜的电子显微镜。(b)解剖的种子微囊末端显示围绕显影球状胚胎(EN)的胚乳细胞(EN)。(c)球状胚胎,悬挂器锚定在微囊端。(D)留下去除球状胚胎悬浮体后的微囊套管。(e)球状胚胎。(f)心脏胚胎。子叶原序联由“CP”表示。 (G) Early torpedo embryo. (H) Late torpedo embryos with pointed cotyledon tips. (I) Cotyledon stage embryo with rounded cotyledon tips. (J) Mature embryo with elongated cotyledons and a short embryonic axis. (K) Higher magnification of the cotyledon (co) and hypocotyl (hy) as indicated by the inset rectangle shown in (J). (L) The radicle tip showing the embryonic root apical meristem (ram). (M) The embryonic shoot apical meristem (sam) and leaf primordia (lp). Mature embryonic (N) cotyledon and (O) hypocotyl in cross-section to show cellular differentiation and storage deposits. Bar = 1 mm (J), 0.1 mm (A, B, G-I, K-O) and 10 μm (C-F).
球形胚(图1C,1E)具有短的柄由只有四个细胞坐落到珠孔套筒(图1D).胚胎从球状体发育而来(图1E)的心(图1F.)和鱼雷(图1G)阶段,胚胎大小的增加主要是由于子叶的生长。这与拟南芥胚胎形成对比,拟南芥胚胎的大小增加是由于子叶和胚胎轴的增加[15.].胚胎轴由在心脏阶段形成的胚源和胚根缩写组成,并且最终区分为成熟胚胎中的短PEG样结构。虽然奇丝瓜的尖端指向后期的鱼雷阶段(图1小时)它们在子叶阶段的顶部圆润(图1I.).成熟的胚胎(图1J.,1K.)主要由两个大的子叶和相对短的胚胎轴组成。子叶在发芽和早期幼苗生长期间营养起双重作用。它们持有大部分种子储备,并在发芽后成为光合作用。成熟的胚胎含有休眠叶片原序,初始和芽和根顶部分泌物,其在吸收后和种子的发芽期间将被激活(图1L.,1M).子叶的横截面显示皮质细胞的分化为拨型细胞层和紧凑的培蛋白细胞。子叶的叶片细胞和胚囊的实质细胞填充储存沉积物(图1N.,1o)类似于先前报道的[16.].虽然亚麻籽开发遵循其他模型DiCot物种的种子描述的一般趋势,但有一些不同的特征。例如,与拟南芥胚胎不同,其中成熟胚胎弯曲在脱赤锭内,亚麻胚胎在种子内直立地定位[15.].在亚麻种子中,子叶占据了大部分的种子空间,成熟时只剩下很薄的胚乳和种皮。这与蓖麻种子相反,蓖麻种子的胚乳很厚,胚乳中的子叶很薄[17.].
cDNA文库的测序提供了对亚麻转录组的深入了解
本研究中构建的cDNA文库提供了种子发育(8个文库)的广泛表示以及营养组织的5个文库。8个种子库均从最广泛种植加拿大亚麻籽品种CDC白求恩和由球形胚,心脏胚,鱼雷胚,子叶胚胎,成熟胚,从球形期种皮,种皮从鱼雷期和汇集的胚乳(球形到鱼雷阶段)(图2 A-H);剩下的四种cDNA文库中的四种由全硫化幼苗,茎,叶和花制备(图2 I,J,L和2M)的简历。CDC白求恩和最后一个图书馆的茎皮是从简历。Norlin(图2K).
从质粒克隆中的3'末端CDNA的3'末端测序的EST集合具有613个核苷酸(NT)的中值。这些克隆中的每一个已被编目并储存在-80°C以允许进一步的研究。还通过额外的5'结束测序已经为某些克隆鉴定出全长CDNA。桌子1概述了从13个图书馆获得的无害环境技术的分布、数量和质量。去除载体序列、rRNA序列、<80 nt序列、细胞器序列和重复序列后,仍保留261,272个序列。最终的单基因集的组装分两步完成。首先,使用EGassembler对每个库中的est进行组装[18.],在27,168个Contigs和51,041个单例中共产生。将78,209个Contigs和Singletons的收集与Egassembler重新组装。因此,获得了每个组织源的UNIGENE设置,并且获得包括所有组织的统一的unigenes。该第二组装过程导致15,784个葡萄片和14,856名单身,总计30,640人。这里鉴定的30,640个unigenes可能代表亚麻籽转录组的主要部分。桌子2示出了在各个库中的集群,重叠群,单身和个Unigenes的分布。重叠群的长度从102到3027个核苷酸与778个nt的中值长度变化(数据未显示)。重叠群加单身的长度之和为21.6兆碱基,其表示所预测的700MB亚麻基因组的3%[3.].13个组织中为每个单基因的EST分布其预测或推定的拟南芥同源物中的其他文件呈现1.可以使用查询的亚麻Unigene数据库http://bioinfo.pbi.nrc.ca/portal/flax/所有EST序列也沉积在Genbank(表3.).在30,640个unigenes中,将23,418%(76.4%)鉴定为具有拟南芥基因序列的显着同源性。拟南芥基因组是〜157 mbp [19.]并且具有〜27000个基因的转录[20.]和亚麻可能具有比拟南芥较大的转录我们的分析提示。虽然我们的图书馆不给亚麻营养组织的全覆盖,它们可以被用来作为最低数量估计亚麻转录的大小。
GO注释和功能分类
使用BLASTX算法对Uniprot-Plants和Tair数据库进行分析的30,640个Contigs和Singletons的Unigene集合。被选择用于基因本体论(GO)的GO术语至TAIR数据库,其是手动的且计算上的正在进行的策划的注释和进一步映射来显示显著同源性的已知基因(E-值≤E-10)对的UniProt-植物个Unigenes基础 [21.].为不同的GO类生成的值用于基于分子函数,生物过程和细胞组分产生分类(图3.).基于在TAIR的BLAST分析,23,418个Unigenes表现出显著的同源性拟南芥基因和它们在电子表格(上市额外的文件1;http://bioinfo.pbi.nrc.ca/portal/flax/),以及13个组织库中每个基因的est分布。我们的分析表明,不同的氧化石墨烯类别在我们的非基因数据集中得到了很好的代表,这表明亚麻基因组中广泛的表达基因。
亚麻基于组织EST集合的聚类分析
为了比较不同组织中的基因表达谱,使用软件HCE3.5对整个261,272个EST序列进行分级簇分析[22.)(见方法)。在层次聚类分析所需的参数中,我们选择了平均连锁法和Pearson相关系数作为相似性/距离度量,该技术在微阵列分析中已被广泛应用[23.].结果如图所示4.分析表明,在一般基因表达中,在发育和连接的组织中最密切相关。例如,球状(GE)和心脏(HE)胚胎阶段最密切相关,紧随鱼雷阶段(TE)。成熟的胚胎,viz,子叶(ce)和成熟(me)阶段聚集在一起,但远远地从早期胚胎胚胎中放置。两种种子涂层阶段(GC和TC)也与彼此分享相对高的相似性。来自早期开发种子阶段的合并的胚乳组织(EN)中的基因表达与早期胚胎阶段共享一些相似性,但与种子涂层和成熟的胚胎更远。值得注意的是,CE和ME阶段远离早期种子组织(GE,HE,TE,GC,TC和EN)以及与其他非种子组织的较小程度,(ES,LE,FL,ST)表示在胚胎发育的后期发生的明显种子成熟程序。由于茎剥离(PS)没有含有通常存在于整个茎(ST)中的所有组织,并富含韧皮和韧皮纤维细胞[24.], PS基因表达谱不与ST聚类,且如预期的那样远离其他营养组织和种子组织。全茎(ST)和黄化苗(ES)表现出高度的相似性,可能与它们的多糖组成有关。整个茎和黄化幼苗都可能在木质部组织中特别富集,木质部组织的次生壁产生的多糖不同于(PS)、种皮(GC、TC)或发育中的胚胎初生壁中富含果胶的韧皮部纤维中发现的多糖[25.].在一起,该分析显示了13个组织中基因表达的三种不同模式:早期种子阶段,早期种子阶段,成熟的胚胎阶段和幼年营养组织(ES,ST和LF)。
几乎被识别的转录组的五分之一显然是唯一的亚麻
为了确定亚麻单基因与其他植物的潜在同源性,我们对拟南芥的6个全序列和注释基因组的蛋白质组进行了BLASTX分析。水稻(白饭),高粱双色(高粱)vitis Vinifera(葡萄),Populus Trichocarpa.(白杨)和里纳斯市政府(蓖麻)(参见方法)。通常,推导的亚麻多肽与杨树和蓖麻豆类更相似,而不是葡萄,拟南芥,高粱或米饭(表4).这与马氏目亚麻、杨树和蓖麻的分类分组一致[26.].令人生畏的命令是一种大型多样化的42个家庭,其中42个家庭含有几种经济上重要的物种,是假设在相对较短的时间范围内分歧,这个命令内的家庭的分类和分类关系差异很差。但是,Poplar的基因组测序[27.],蓖麻[28.],木薯[29.]和来自包括亚麻在内的该目其他物种的大型EST文库(本研究)可能有助于分子系统研究,以解决这些科之间更广泛的系统发育关系。66%的unigenes(20251个)在所有6个物种中都有命中,16.8%(5152个)的unigenes在任何物种中都没有命中,这表明它们可能是亚麻特有的基因。
关键胚胎发生调节剂存在于EST系列中
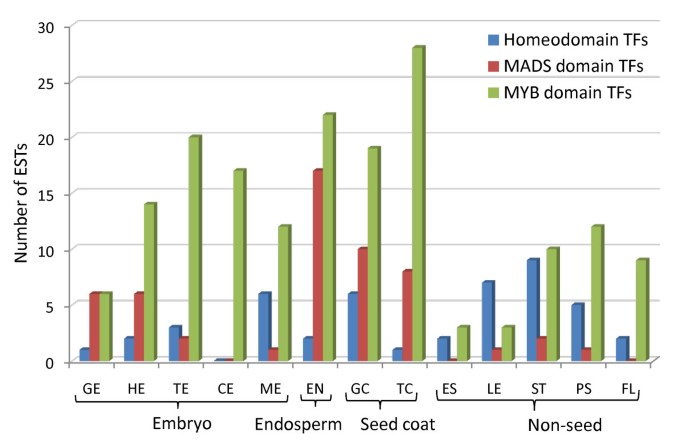
转录因子(转录因子)通常以低水平表达,它们在ESTs中的存在表明EST覆盖的深度。我们分析了所有亚麻库中存在的转录因子。在TF家族中,调节植物生长发育的三个重要基序是同源结构域(HD)、MADS和MYB结构域[30.].包含这些结构域的转录因子在13个文库中都有很好的代表性,表明在EST数据集中低表达基因的覆盖率很高(见图)5;附加文件2).总的来说,在30640个亚麻单基因中至少存在783个转录因子。
调整亚麻植物的分布编码疯子,同型域和MYB域转录因子.这些转录因子家族预计将具有广泛的分布,并且在大多数亚麻Ett文库中发现。用于编译此图表的亚麻未完成的亚麻未完成的分布在附加文件中2.
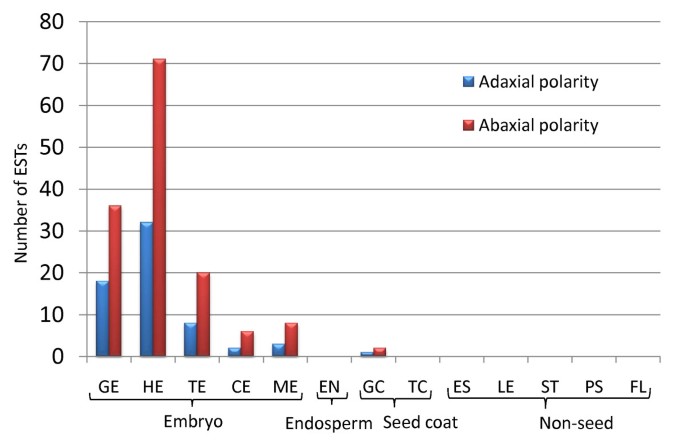
本研究的主要目的之一是更好地了解亚麻种子发育过程中发生了什么,我们进一步分析了在亚麻种子和胚发育中具有特定作用的转录因子的EST文库(Additional File)2).在胚发育的心脏阶段子叶原基分化过程中,正面和背面极性的建立是由HD-ZIPIII家族指定的,不对称LEAVES1(AS1)(adaxial)和Yabby,Kanadi.家庭(亚基)分别[31.].对应于近轴和远轴极性指定转录因子的EST从球形期表示起与在指定了子叶原基当心脏阶段的EST的最大数量(图6;附加文件2).
推定的亚麻表示器官极性转录因子个Unigenes.器官性转录因子的EST心脏阶段的胚胎的子叶原基分化过程中最丰富的。正面的(HD-ZIPIII家庭和AS1)和背面(淡水螯虾和Kanadi.家庭)基因表达建立了器官极性。用于编译此图表的亚麻未完成的亚麻未完成的分布在附加文件中2.
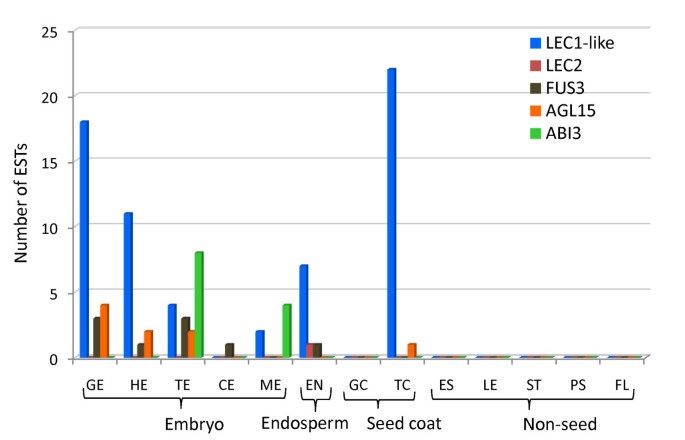
叶状子叶(LEC.)基因LEC1,LEC1样(L1L),LEC2和FUSCA3(FUS3)是胚胎发生的主要调控因子,主要在种子发育过程中表达,这些TFs的异位表达导致体细胞胚胎发生或胚胎特征覆盖在营养器官上[32.- - - - - -35.].ABI3唯一的种子成熟期间表达,并且是种子成熟的关键调节剂处理,如种子的休眠和存储储备积累[36.].静态似的15.(AGL15),一个包含TF的MADS域主要在拟南芥种子发育过程中表达,其异位表达增加了细胞对体细胞胚胎发生诱导条件的响应能力[37.,38.].在拟南芥中,AGL15是直接上调的LEC2[39.].此外,LEC2,FUS3和ABI3所有人都被证明是AGL15的直接目标[40].对亚麻造成的检查显示种子特异性富集的表达L1L,LEC2,FUS3,ABI3和AGL15(图7;附加文件2).只有一个EST与相似LEC2被确认。缺席的情况下LEC1和存在密切相关的L1L在红花菜豆的种子组织中也被观察到[33.].的EST的在那些相关的种子成熟程序借给种子特异性文库中鉴定到这些库的质量支持。
推定的亚麻未成肢编码已知胚胎发生调节剂的转录因子.亚麻种子组织库中存在与胚胎发生重要调控因子相似的est编码基因,而非非种子库中则不存在。用于编译此图表的亚麻未完成的亚麻未完成的分布在附加文件中2.
开采生化途径特有的EST,使亚麻籽营养丰富
亚麻籽含有许多营养重要的化合物,如蛋白质,脂肪酸,木质素,黄酮类和粘液。为了确定本研究中产生的EST资源的有用性,我们针对参与上述种子成分的合成中涉及的基因。为了识别许多亚麻unigenes之间的潜在候选酶,附加文件3.和4通过检查不同组织中EST的时间和分布,提供第一步缩小推定的亚麻候选者。
种子贮藏蛋白
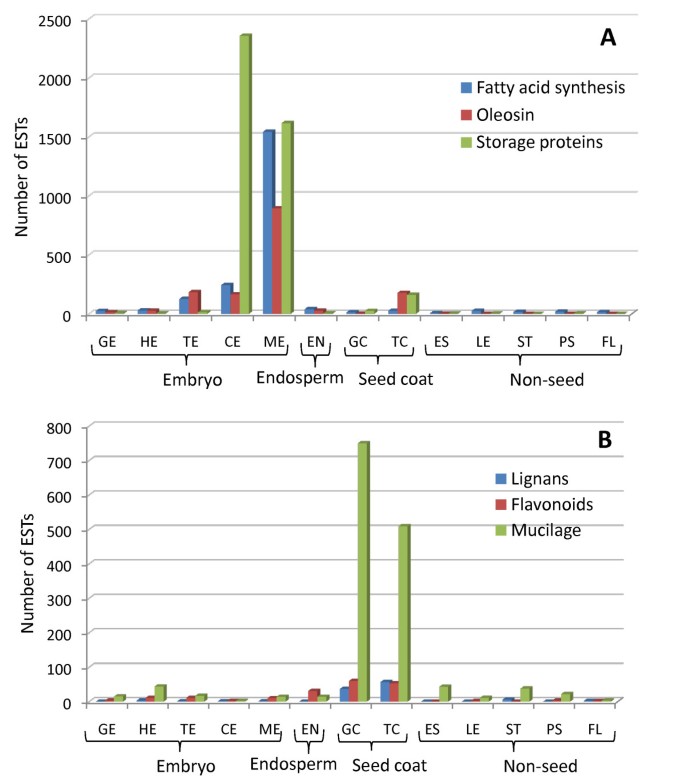
多在亚麻种子的蛋白质是存在蛋白质贮藏液泡内的贮存蛋白和这些蛋白质构成了整个亚麻籽的23%[41.].亚麻籽中的储存蛋白质由〜65%球蛋白组成,〜35%白蛋白[11.].Conlinin为2S白蛋白,cupin和十字花科素分别为11S和12S球蛋白。我们的EST数据将编码贮藏蛋白的基因表达与亚麻种子中已报道的蛋白质水平相关联(图)8A;附加文件3.).在胚发育的后期子叶(CE)和成熟期(ME)中,球蛋白编码基因的表达量明显高于白蛋白编码基因。有趣的是,所有贮藏蛋白的少量ESTs都在幼嫩种皮中被鉴定出来,主要是在鱼雷阶段(图)8A;附加文件3.).这一致于观察结果,依氯霉素基因启动子在种皮涂层的早期阶段中活跃[42.].从相应的种皮阶段汇集胚乳没有发现任何贮藏蛋白的EST。这些观察结果表明,种皮确实有存储蛋白质合成的作用。鉴于该种皮是在发育中的种子总质量的一个重要组成部分,种皮可能是蛋白质对发育中的胚胎瞬时源。
脂肪酸和油体形成
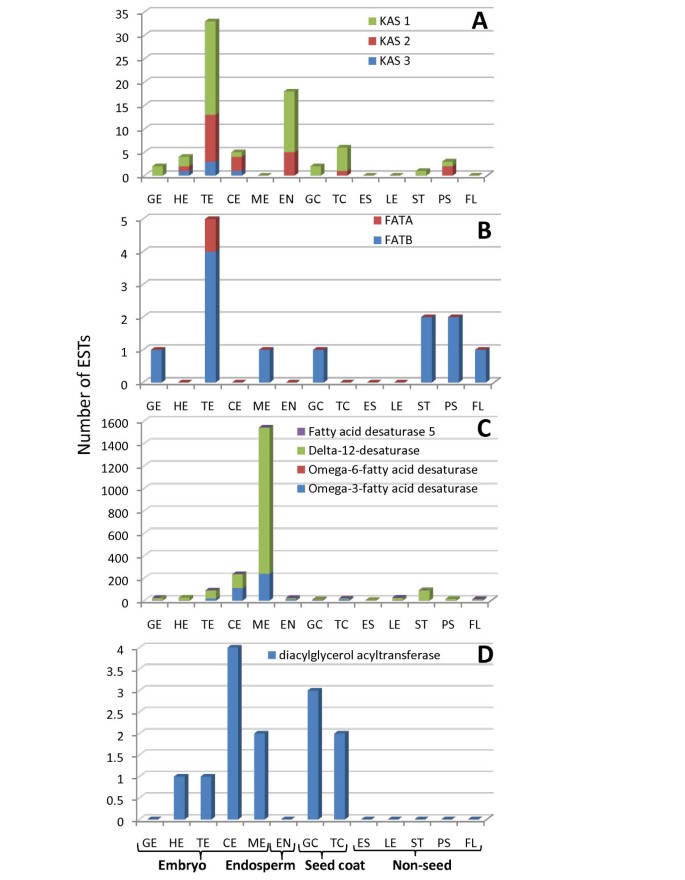
成熟亚麻种子包含约43%的油,大部分在位于胚油体中的三酰基甘油(TAG中)的形式[11.].为了研究发育中的种子中的定时和脂质合成的源,占脂肪酸合成的四个关键步骤的酶进行了研究:酰基链延长,终止去饱和酶和TAG合成[43.,44.] (数字8A, 数字9;附加文件3.).基于est序列代表的优势3-ketoacyl-acyl载体蛋白质合成酶(KAS1, KAS2和KAS3)在各种组织中,似乎酰基链延伸活动增加在鱼雷阶段胚胎,胚乳和种皮种子(图中所有为这个活动9A).虽然代表脂肪酰基- acp硫酯酶(FATA和FATB)延伸终止的ESTs数量低于KAS ESTs,但这种活性似乎也在鱼雷阶段达到峰值(图)9B.).在显影胚胎中,通过二酰基甘油酰基转移酶(DGAT)的活性转移到甘油骨架上以形成三酰基甘油。标签储存在油体中,其外膜是球形磷脂单层与蛋白质油蛋白相互作用[44.].代表DGAT的EST被发现与类似的数量法达和FATB无害环境技术,即非常低的数量。关键的区别是,这种活动似乎在较晚的时候达到高峰,在子叶胚胎阶段而不是鱼雷阶段(图)9 d).此外,虽然在种子组织和一些营养组织中似乎发生伸长和释放的自由FAS的终止,但在一些营养组织中,营养组织中的DGAT表达太低,无法与EST计数检测。去饱和是导致理想的ω-3和ω-6脂肪酸的关键步骤[44.].这似乎发生在种子开发期间作为代表的EST数量的尖峰脂肪酸去饱和酶(FAD)2,3,5和8发生在成熟胚胎内(图9C.).一个的ω-3脂肪酸在亚麻发现,α-亚麻酸(ALA,18:3N-3),构成高达总种子油的55%[41.].ALA是人类饮食中的一种必需脂肪酸,它可以转化为二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),并与膜磷脂结合。一些脂肪酸被用于植物膜的合成、成蜡和色素沉着。在茎、茎皮和花中发现的脂质合成序列为研究这些组织中的脂质合成过程提供了基础(图)8A和9).
脂肪酸生物合成基因在种子发育和成熟过程中的EST分布.(a)酰基链伸长(酮酰基合酶);(b)酰基链终止(脂肪酰基硫酸酯酶);(c)去饱和(去饱和酶);(d)三酰基甘油(标签)生物合成。用于编译这些图形的Flax Unigenes的分布在附加文件中3..
oleysins,与油性相关的蛋白质,通过防止种子萌发期间脂质颗粒的聚结稳定它们[45.].在我们的数据集中,表达拟定的拟订同源物Oleosin 1,2和3.在鱼雷阶段(TE)开始的胚胎中观察到基因,成熟阶段(ME)中具有更大水平的水平(图8A;附加文件3.).这也与CE和ME阶段的表达相吻合f所涉及到的ω-3和ω-6脂肪酸的形成去饱和酶。Oleosin拟南芥的基因表达已被证明部分由ABI3调控[46.].也存在相关的相关性ABI3与oleosin.鱼雷和成熟胚胎阶段的ests(图7和8A;附加文件2和3.),表明EST数据反映了其潜在的遗传和生化程序。
木质人
亚麻是Secoisolariciresinol Diglycoside(SDG)的丰富来源。SDG被肠道细菌转化为所谓的哺乳动物木质肠肠和肠内酮。SDG具有植物雌激素,抗氧化和抗癌活动[8].木脂素存在于亚麻种皮中,由产生松脂醇的氧化酶和分解蛋白的初始作用而从针叶树醇中提取[47.].顺序还原松脂醇的由松脂醇-落叶松还原酶(PLR)的结果在SDG [形成48.].我们的亚麻单基因集的分析鉴定对应dirigent蛋白质和PLR了在球形和鱼雷期种皮中表达几个候选人(图8B.;附加文件4).小型蛋白质在球状阶段种子涂层中具有较高的EST次数,其对应于其在Lignan生物合成途径中的早期作用,而Pinoresinol-Laricirsinol还原酶在途径后面作用,在鱼雷阶段的种子涂层中表达。
黄酮类化合物
黄酮类化合物是一类主要的植物酚类物质。亚麻籽富含类黄酮,包括类黄酮醇和花青素[49.].的类黄酮合成的分支开始与形成查耳酮,查耳酮由合成酶(CHS)催化的反应,然后通过查耳酮异构酶(CHI)合成黄酮。二氢黄酮醇还原酶(DFR)的活性为无色花色素合成和原花色素,花色素和花青素合成的提交步骤如下这一步骤[50.].在类黄酮合成途径的关键酶,即,CHS,CHI和DFR被亚麻种子发育特别是在如图的EST的数目种皮组织中表达(图8B.;附加文件4).班义(禁止拟南芥的基因编码了花青素植物中的花青素还原酶,其产生了人类的CIS-3-氟烷-3-OL,其具有已知的人类健康益处[51.].ests代表禁止表明亚麻种子可能是顺-3-黄烷-3-醇的来源(图8B.;附加文件4).
粘液合成和分泌
在亚麻种子发育过程中,胚珠被膜分化并形成特殊的细胞类型,其中包括种皮表皮,它储存着粘液化合物。亚麻籽胶浆对人体健康有益,对其化学成分进行了研究。果胶鼠李胶半乳糖酸盐I (RG I)是拟南芥和其他几种植物种子黏液的主要成分,而亚麻种子黏液含有中性阿拉伯木聚糖(75%)和RG I(25%)的混合物[52.- - - - - -54.].在成熟种子,种皮的外表皮层的细胞被转化为粘液分泌细胞(MSC)在种子水合该释放粘液。在拟南芥中,粘液,MODIFIED4(MUM4)基因编码鼠李糖合成酶2,一种催化RG I的合成的酶[55.),而MUM2编码β-半乳糖苷通过修改RG我侧链[使粘液水合性质56.].此外,AtBXL1基因编码-木糖苷酶/ -阿拉伯葡萄糖苷酶,通过降解粘液和/或粘液分泌细胞的细胞壁中的阿拉伯糖苷侧链来释放粘液[57.].编码鼠李糖合成酶和β -木糖苷酶的基因在GC和TC组织特异性ESTs中均有表达,表明拟南芥中观察到的粘液合成和分泌途径在亚麻中有表达,相应基因在种皮组织中特异性富集表达(图)8B.;附加文件4).然而,与鼠李糖合酶相对应的ESTs不包括拟南芥的同源基因MUM4基因,表明亚麻中存在一些粘液合成途径的可能性。涉及半乳糖醛酸的聚合的半乳糖核糖基转移酶[58.]形成果胶RG I在GC和TC组织中也有很好的表现,表明它们在种皮粘液合成中的保守作用(图)8B.;附加文件4).有趣的是,对应于推定的同源物的ESTAtBXL2基因,包括的小基因家族的成员AtBXL1[57.],物在非常高的水平在种皮组织暗示在粘液的吸胀时的快速和均匀地释放从亚麻籽涂层它们的作用(表示图8B.;附加文件4).推定的亚麻惯性AtBXL1也是由纤维轴承亚麻组织[在cDNA的以往报告中发现的最丰富的EST中的一个59.].
结论
我们开发了一种综合的亚峰,用于代表特定种子组织的发育阶段,一些营养和生殖组织。这些资源包括Genbank的公共可用序列(表3.),一个可查询的亚麻单基因数据库(http://bioinfo.pbi.nrc.ca/portal/flax/)和整个库的Unigene分配(附加文件1).在这项研究中开发的数据集,加强对亚麻的基因组资源基础,一个重要的作物。这些资源可以促进基因的发现和扩大的分子标记开发集养殖。此外,在这项研究中开发的单基因组将有助于注释和组装完整的亚麻基因组序列。
最近发表的基于EST序列的亚麻特异性微阵列从纤维聚焦研究中获得,而目前的手稿正在准备中,为亚麻基因表达分析提供了一个免费的基因组工具[60.].然而,在我们研究中,具有分配到胚胎,胚乳和种子涂层隔室中的显影种子的资源允许进一步改进在时间和空间上特异性代谢途径中确定基因的累积。我们的数据集分析表明了与种子发展有关的生物过程的良好代表性。7,222个亚麻未成蛋白没有同源物种拟南芥的基因的同源物,并且存在5,152个未在Uniprot中对植物物种的任何同源性。因此,这5,152个ungenes可能代表特异性基因。这些未识别的许多基因均广泛分布,而一些未识别的基因是特异于单个组织的。对这些的进一步研究将为特定亚麻计划提供新的见解。
材料和方法
植物生长条件和组织收集
育种种子(F11)Linum Usitatissimum.CV CDC Bethune在萨斯喀彻温省大学的植物植物中自行为7代(F18)。使用由16小时的光(23℃)和8小时的黑暗(16℃)组成的每日循环,在生长室中萌发并生长在生长室中。收集组织样品并立即在液氮中冷冻。叶,茎和花样从10个以上的个体植物中收集。进行5,000种亚麻籽的解剖,以分离足够的胚乳,胚胎和种子涂层组织来产生cDNA文库。从显影种子中分离出球形,心脏,鱼雷,子叶和成熟阶段的五个胚胎胚胎。从球状和鱼雷胚胎阶段收集种子涂层样品。从含有球状的种子中汇集胚乳组织到鱼雷胚胎阶段。通过在黑暗中在MS培养基板上孵育四天并在收获之前,除去种子涂层,产生硫酸盐幼苗。由表皮,皮质组织,韧皮,显影纤维和椎骨组织组成的茎剥离组织由四周龄的茎制备Linum Usitatissimum.L. CV诺林发芽并如先前所述生长[24.].
RNA分离及cDNA文库构建
阀杆剥离库(PS)中的溶液使用Superscript质粒系统构造有网关技术用于cDNA合成和克隆(Invitrogen公司,卡尔斯巴德,CA)[24.].CDNA在PCMV-Sport6(Invitrogen)中定向克隆,并在化学竞争力DH5α-FT中转化大肠杆菌.其余12个文库的总RNA用RNeasy Plant Mini Kit (Qiagen, Cat。74904号)。使用RNase-free DNase试剂盒(Qiagen, Cat。79254号)。从组织中提取约2 μg总RNA构建cDNA文库。使用Creator SMART cDNA文库构建试剂盒(Clontech, Cat. net, Cat. net, Cat. net, Cat. net, Cat. net)构建12个文库。n . 634903)。8个种子组织(球形,心脏,鱼雷,子叶和成熟胚胎,以及胚乳和球形和鱼雷阶段的种皮)的库是按照说明书的说明准备的,并在pDNR-lib载体(克隆技术)。
在构建叶片、茎、花和黄化苗的cDNA文库过程中,对手册进行了两次修改。首先,用琼脂糖凝胶而不是试剂盒提供的CHROMA SPIN-400色谱柱进行cDNA大小分离。将SfiI消化的cdna装入1% TAE琼脂糖凝胶中,并运行约2 cm。从琼脂糖凝胶中提取cDNA样本,使用QIAquick凝胶提取试剂盒(Qiagen, Cat。28704号)。其次,使用改进的pBluescript II SK(+)向量。一个ccdb基因,在两端的SfiI位点,插入的pBluescript II SK的EcoRI和XhoI(+)之间。这种修饰的载体,然后用SfiI位消化,琼脂糖凝胶纯化,并用于结扎用SfiI位消化的cDNA样品。结扎以构建文库根据创建者SMART手册进行。
EST测序与分析
将文库涂于LB培养基板上,37℃培养过夜。个体克隆被人工或自动选择到96或384个板Colony Picker (CP-7200, Norgren Systems)。在国家研究委员会-植物生物技术研究所(NRC-PBI, Saskatoon, SK, Canada)的DNA测序设备上,使用ABI 3730xl DNA分析仪(应用生物系统)对ESTs进行测序。HE、TE和ME文库分两批测序3.).共得到274,278条序列。读者可参考表格1用于组织分布。使用EGAssembler的组装过程。EGASSEMBLER教程中给出了详细信息[18.](http://egassembler.hgc.jp/cgi-bin/eassembler4.cgi?pmode=help&i_param=tutorial).在第一步中,清洁序列,除去少于100个碱基的序列。以下步骤包括掩蔽重复,载体和细胞器序列。除去掩蔽的核苷酸,还除去少于80个碱基的所得序列。为每个单独的库执行第一群集过程。然后将得到的78,209个序列(27,168个葡萄片和51,041个单身)合并并重新组装,导致30,640个unigenes(15,784个Contigs和14,856个单身)。这些unigenes重新分配到各自的个体图书馆中。所有EST序列和unigenes都已存入http://bioinfo.pbi.nrc.ca/portal/flax/使用层次聚类Explorer 3.5软件对ESTs进行聚类(http://www.cs.umd.edu/hcil/hce/power/power.html.)[22.].EST读取次数而每13个不同的组织中的每个单基因被用作与用于相似性/距离度量和用于分级聚类平均连锁方法Pearson相关系数设定参数HCE3.5软件的输入数据。
使用来自各种物种的蛋白质蛋白酶进行亚麻泛损伤对六种植物基因组的裂缝分析:拟南芥蒂利亚纳'ftp://ftp.arabidopsis.org/home/tair/Genes/TAIR9_genome_release/TAIR9_sequences/';水稻'ftp://ftp.plantbiology.msu.edu/pub/data/eukaryotic_projects/o_sativa/annotation_dbs/pseudomolecules/version_6.1/all.dir/';Populus Trichocarpa.'http://genomeportal.jgi-psf.org/Poptr1_1/Poptr1_1.download.ftp.html';vitis Vinifera'http://www.uniprot.org/uniprot/?query=taxonomy:29760&format=*';高粱双色'ftp://ftp.jgi-psf.org/pub/JGI_data/phytozome/v5.0/Sbicolor/annotation/Sbi1.4/Sbi1.4.pep.fa.gz';和里纳斯市政府来自Swissprot。
显微镜
清算
受精胚珠被清除2天在水合氯醛溶液(8:1:2的水合氯醛 - 甘油 - 水w / V / V),并使用诺马斯基光学化合物显微镜(Leica DMR)观察。
扫描电子显微镜
将样品固定在3%戊二醛,在十六氧化物1%锇氧化锇中固定,并如上所述在梯度丙酮系列中脱水[61.].在爱德华兹S150B溅射镀膜机中,将样品安装在铝桩上,并涂上金。用philips 505扫描电子显微镜在30 kV下观察,记录在富士胶片FP-100b专业胶片上。图像在Adobe Photoshop CS (Adobe Systems, San Jose, California)中进行扫描和处理,以提高对比度和放置比例条。
参考
- 1。
Vaisey-Gener M,Morris DH:亚麻籽栽培史和用途。亚麻,Linum属。编辑:Muir A,Westcott N. Amsterdam:硬木学术出版商,2001,1-21。
- 2。
Diederichsen A,理查兹K:栽培亚麻和亚麻属湖:分类和种质保存。亚麻,Linum属。A.男,Westscott N.阿姆斯特丹:硬木学术出版社,2001年,22-54主编。
- 3.
Bennett MD, Leitch IJ:植物DNA c值数据库(3.0版)。2004年,(http://www.rbgkew.org.uk/cval/homepage.html]
- 4.
Cullis Ca:亚麻基因组中的DNA序列组织。Biochimica et Biophysica Acta(BBA) - 核酸和蛋白质合成。1981,652:1-15。10.1016 / 0005-2787(81)90203-3。
- 5。
道恩JK,德克勒克DR:60年加拿大在晶研究实验室亚麻籽质量surveus。美国亚麻研究所的进程。法戈,美国的ND:亚麻研究所,1994年,192-200。
- 6。
Thompson Lu,Rickard Se,Cheung F,Kenaschuk EO,Obermeyer WR:亚麻籽抗癌水平的变异性。营养和癌症。1997年,27:26-30。10.1080 / 01635589709514497
- 7。
Westcott ND,Muir AD:亚麻籽木征浓度的变化,各种,位置和年份。美国亚麻研究所的进程。Fargo,ND:美国的亚麻学院,1996,56:77-80。
- 8。
图雷A,李学明X:亚麻籽木脂素:源,生物合成,代谢,抗氧化活性,生物活性成分,以及健康福利。全面审查在食品科学和食品安全。2010年,9:261-269。10.1111 / j.1541-4337.2009.00105.x。
- 9。
Vaisy-Gener M,Morris DH:亚麻籽:健康,营养和功能。1997年,温尼伯,MB:加拿大的亚麻委员会
- 10。
Oomah BD,马扎G:亚麻籽蛋白质 - 进行审查。食品化学。1993年,48:109-114。10.1016 / 0308-8146(93)90043-F。
- 11.
王志强,王志强,王志强。亚麻属植物的化学成分研究。2001,阿姆斯特丹:硬木学术出版社
- 12.
钟麦,林婵,林婵·欧度:Norman Flaxseed主要蛋白质分数的分离和结构表征(Linum Usitatissimum L.)。食品化学。2005,90:271-279。10.1016 / J.Foodchem.2003.07.038。
- 13。
Cloutier联系S,钮Z,Datla R,杜吉德S:开发和EST-SSR标记为亚麻的分析(亚麻L.)。Al Appl Genet。2009年,119:53-63。10.1007 / s00122-009-1016-3。
- 14。
cullis ca:亚麻。基因组测绘与植物中的分子育种 - 油籽。编辑:Kolle C. 2007,柏林海德堡:Springer-Verlag,2:
- 15.
陈志强,陈志强,陈志强,等:胚胎发生:单细胞模式形成。《拟南芥丛书》,2008,美国植物生物学学会,1-28。
- 16。
Ellis PR, Kendall CW, Ren Y, Parker C, Pacy JF, Waldron KW, Jenkins DJ:细胞壁在杏仁籽脂质生物可及性中的作用。《美国临床营养学杂志》2004年第8期。
- 17。
高盛记者:Vorlesungen尤伯杯pflanzen-physiologie,出版社Wilhem英格曼,莱比锡。1887年,[http://www.seedbiology.de/structure.asp#ricinus]
- 18。
Masoudi-Nejad A, Tonomura K, Kawashima S, Moriya Y, Suzuki M, Itoh M, Kanehisa M, Endo T, Goto S: EGassembler:在线生物信息学服务,用于大规模加工、聚类和组装est和基因组DNA片段。研究进展。2006,34:W459-W462。10.1093 / nar / gkl066。
- 19。
Bennett MD,Leitch IJ,价格HJ,Johnston JS:使用流式细胞术的Caenorhabditis(〜100 MB)和果蝇(〜175 MB)的比较显示拟南芥的基因组大小为约157 MB,从而大于拟南芥基因组大约25%倡议估计〜125 MB。植物学的年。2003,91:547-557。10.1093 / AOB / MCG057。
- 20。
TAIR: 2009,http://www.arabidopsis.org/portals/genAnnotation/gene_structural_annotation/annotation_data.jsp]
- 21。
Berardini TZ,Mundodi S,赖泽L,划拉E,加西亚-Hernandez的男,张P,穆勒LA,尹Ĵ,道尔A,兰德G,等人:拟南芥基因组的功能注释使用受控词汇。植物理性。2004年,135:745-755。10.1104 / pp.104.040071。
- 22。
SEO J,Gordish-Cressman H,Hoffman EP:用于微阵列假设检测和一代的交互式电力分析工具。生物信息学。2006,22:808-814。10.1093 / Bioinformatics / BTK052。
- 23。
郑旭,曾正清,曾正清:微阵列分析中基因聚类方法的评价与比较。生物信息学。2006,22:2405-2412。10.1093 /生物信息学/ btl406。
- 24。
Roach MJ, Deyholos MK:亚麻(Linum usitatissimum L.)茎的微阵列分析鉴定了富含纤维的韧皮部组织的转录本。中国生物医学工程学报。10.1007 / s00438 - 007 - 0241 - 1。
- 25。
Gorshkova Ta,Wyatt Se,Salnikov VV,Gibeaut DM,Ibraagimov Mr,Lozovaya VV,Carpita NC:开发亚麻植物的细胞壁多糖。植物理性。1996,110:721-729。
- 26。
Wurdack KJ,Davis CC:Malpighiales Phyloonsetics:在AgeniSperm生活树中最顽固的植物之一获得地面。我是J机器人。2009,96:1551-1570。10.3732 / AJB.0800207。
- 27。
Tuskan GA,DiFazio S,Jansson的S,BohlmannĴ,格里戈里耶夫I,赫尔斯滕U,帕特南N,拉尔夫S,Rombauts S,Salamov A,等人:黑三角叶杨,毛果杨基因组(乇&灰色)。科学。2006年,313:1596至1604年。10.1126 / science.1128691。
- 28。
陈AP,克拉布特里Ĵ,召Q,洛仑H,奥维斯Ĵ,Puiu d,Melake-百瀚A,琼斯KM,雷德曼Ĵ,陈G,等人:油籽物种蓖麻的草案基因组序列。NAT BIOTECH。2010,28:951-956。10.1038 / nbt.1674。
- 29。
木薯基因组计划。2010年,[http://www.phytozome.net/cassava]
- 30.
Riechmann JL,Ratcliffe OJ:植物转录因子的基因组视角。植物生物学目前的意见。2000,3:423-434。10.1016 / s1369-5266(00)00107-2。
- 31。
王志强,王志强,王志强:被子植物侧器官极性的建立。遗传学报。2002,18:134-141。10.1016 / s0168 - 9525(01) 02601 - 4。
- 32。
Lotan T,Ohto Ma,Yee Km,West Mal,Lo R,Kwong Rw,Yamagishi K,Fischer RL,Goldberg RB,Harada JJ:Arabidopsis Geafy Cotyledon1足以诱导植物细胞中的胚胎发育。细胞。1998,93:1195-1205。10.1016 / s0092-8674(00)81463-4。
- 33。
广RW,裴AQ,李H,广LW,费RL,戈德堡RB,原田JJ:LEAFY COTYLEDON1-LIKE定义稳压器的基本为胚胎发育的一类。植物细胞。2003年,15:5-18。10.1105 / tpc.006973。
- 34。
石材SL,KWONG LW,Yee Km,Pelletier J,Lepiniec L,Fischer RL,Goldberg RB,Harada JJ:叶茂Cotyledon2编码了诱导胚胎发育的B3域转录因子。美国国家科学院的诉讼程序。2001,98:11806-11811。10.1073 / pnas.201413498。
- 35。
GAZZARINI S,TSUCHIYA Y,Lumba S,Okamoto M,McCourt P:转录因子Fusca3通过激素嗜酸盐和脱钙酸控制拟南芥的发育时间。发育细胞。2004,7:373-385。10.1016 / j.devcel.2004.06.017。
- 36。
Parcy楼瓦伦C,雷纳尔男,Gaubier-科梅利亚P,Delseny男,Giraudat记者:拟南芥种子发育过程中基因表达程序的调节:ABI3轨迹和内源性脱落酸的作用。植物细胞。1994年,6:1567-1582。
- 37。
Heck Gr,Perry Se,Nichols Kw,Fernandez de:Agl15,在发育胚胎中表达的疯子域蛋白。植物细胞。1995年,7:1271-1282。
- 38。
HARDING EW,TANG W,NICHOLS KW,FERNANDEZ DE,PERRY SE:通过静静成15的组成型表达来增强胚胎源性潜力的表达和维持。植物理性。2003,133:653-663。10.1104 / pp.103.023499。
- 39。
Braybrook SA,石SL,公园S,裴AQ,乐BH,费RL,戈德堡RB,原田JJ:基因通过LEAFY COTYLEDON2直接调节洞察胚成熟和体细胞胚发生的控制。美国国家科学院的诉讼程序。2006年,103:3468-3473。10.1073 / pnas.0511331103。
- 40。
郑Y,仁,王H,Stromberg Aj,Perry Se:全球鉴定拟南芥的目标致域蛋白静脉静脉蛋白蛋白静脉蛋白蛋白蛋白静脉曲张。植物细胞。2009,21:2563-2577。10.1105 / TPC.109.068890。
- 41。
加拿大西部亚麻籽的质量。加拿大粮食委员会。2002,[http://www.grainscanada.gc.ca/flax-lin/trend-tendance/qfc-qlc-eng.htm]
- 42。
Truksa M,Mackenzie Samuel L,齐X:亚麻2S贮藏蛋白萼片和其启动子种子特异性活性的分子分析。植物生理学和生物化学。2003,41:141-147。10.1016 / s0981-9428(02)00022-0。
- 43。
OHLROGGE JB,Jaworski JG:对脂肪酸合成的调节。植物生理学和植物分子生物学年度综述。1997年,48:109-136。10.1146 / annurev.arplant.48.1.109。
- 44。
沃尔克T,Kinney的AJ:VARIATIONS IN SEED-贮存脂质的生物合成。植物生理学和植物分子生物学年度综述。2001年,52:335-361。10.1146 / annurev.arplant.52.1.335。
- 45。
黄A:种子和其他器官的油脂和油体。植物理性。1996,110:1055-1061。10.1104 / pp.110.4.1055。
- 46。
克洛AJ,Abenes男,植物A,莫洛尼MM:种子特异性反式激活,ABI3,诱导油质蛋白基因的表达。植物科学。2000,151:171-181。10.1016 / S0168-9452(99)00214-9。
- 47。
达林磅,刘易斯NG:恶劣的蛋白质和恶劣的部位解释了木纸和木质素生物合成的根治性前体偶联特异性的神秘性。植物理性。2000,123:453-462。10.1104 / pp.123.2.453。
- 48。
福特JD,Huang Ks,Wang Hb,Davin Lb,Lewis Ng:生物合成途径到癌症化学预防秒硅藻喹啉葡萄氨酰胺 - 羟甲基的氟氨酰氨基甲醇酯 - 连接的亚麻(Linum Usitatisimum)种子†。自然产品杂志。2001,64:1388-1397。10.1021 / np010367x。
- 49。
Oomah Bd,Giuseppe M,Kenaschuk EO:亚麻籽的类黄酮含量。品种和环境的影响。Euphytica。1996,90:163-167。10.1007 / bf00023854。
- 50.
Lepiniec L,Debeaujon I,Retaboul JM,Baudry A,Pourcel L,Nesi N,Caboche M:种子类黄酮的遗传学和生物化学。植物生物学年度综述。2006,57:405-430。10.1146 / annurev.arplant.57.032905.105252。
- 51.
谢斯,沙姆达SB,Paiva NL,Ferreira D,Dixon Ra:花青素还原酶的作用,由植物类黄酮生物合成中的胰腺脉冲编码。科学。2003,299:396-399。10.1126 / Science1078540。
- 52。
Fedeniuk RW,Biliaderis CG:组成和亚麻籽的物化性质(亚麻L.)胶浆。农业和食品化学杂志。1994年,42:240-247。10.1021 / jf00038a003。
- 53。
陈国平,陈国平。亚麻籽胶浆多糖的研究进展。植物营养与肥料学报,2008,29(4):429 - 434。10.1104 / pp.108.123513。
- 54。
崔W,马扎G,Biliaderis CG:化学结构,分子大小分布及亚麻籽胶的流变性能。农业和食品化学杂志。1994年,42:1891至1895年。10.1021 / jf00045a012。
- 55。
西方TL,年轻的DS,院长GH,谭WL,塞缪尔AL,Haughn GW:粘液-MODIFIED4编码一个果胶生物合成酶从发育受APETALA2,透明种皮GLABRA1,并GLABRA2在拟南芥种子大衣调控。植物理性。2004年,134:296-306。10.1104 / pp.103.035519。
- 56。
Dean GH, Zheng H, Tewari J, Huang J, Young DS, Hwang YT, Western TL, Carpita NC, McCann MC, Mansfield SD, et al .:拟南芥MUM2基因编码生成具有正确水化性质的种皮黏液所需的{β}-半乳糖苷酶。acta botanica sinica, 2017, 36(5): 772 - 772。10.1105 / tpc.107.050609。
- 57。
Arsovski AA, Popma TM, Haughn GW, Carpita NC, McCann MC, Western TL: AtBXL1编码双功能{β}- d -木糖苷酶/{α}- l -阿拉伯糠苷酶在拟南芥粘液分泌细胞中需要果胶修饰。植物营养与肥料学报。2009,30(4):429 - 434。10.1104 / pp.109.138388。
- 58。
果胶的生物合成。植物营养与肥料学报,2010,29(4):531 - 534。10.1104 / pp.110.156588。
- 59。
A Day, Addi M, Kim W, David H, Bert F, messnage P, Rolando C, Chabbert B, Neutelings G, Hawkins S:亚麻(Linum usitatissimum L.)含纤维茎组织的est:细胞壁发育相关序列的表达分析。植物生态学报。2005,7:23-32。10.1055 / s - 2004 - 830462。
- 60。
关键词:亚麻(Linum usitatissimum L.)基因表达寡核苷酸芯片(oligo microarray)中国生物医学工程学报。2010,11:592-10.1186/1471-2164-11-592。
- 61.
Venglat SP,Sawhney VK:苄基氨基嘌呤在野生型中诱导花卉营销和器官身份突变体的斑点拟南芥植物。Planta。1996年,198:480-487。10.1007 / BF00620066。
致谢
这项工作得到了国家研究委员会Cehh / Napgen和PPH,萨斯喀彻温省农业发展基金,基因组加拿大和基因组草原图案。Rong Li提供了改进的pbluescript II SK(+)载体。这是加拿大公布号50184的国家研究委员会。
作者信息
隶属关系
通讯作者
附加信息
作者的贡献
PV,DQ,SQ和RD:概念,设计,实验,数据分析,解释和写作的稿件;SLS和MAM:稿件的分析,解释和写作;CT,DC,JN和EW:数据集的生物信息分析;MD:干剥皮cDNA文库和分析;FB,AS和SC:协调和解释;GR和GS:解释,重要的智力贡献和稿件的写作。所有作者都阅读,评论并批准了稿件。
普拉卡什冯鹏拉特,道泉翔,蜀清邱贡献了这项工作。
电子补充材料
12870_2011_858_moesm1_esm.xls.
附加文件1:代表跨13个图书馆分布的亚麻未成年人的EST数。这些unigenes的注释是基于拟南芥基因组。(XLS 7 MB)
12870_2011_858_moesm2_esm.xls.
附加文件2:分布在13个文库中与转录因子相关的est的数量。(XLS 60 KB)
12870_2011_858_MOESM3_ESM.XLS
附加文件3:与种子储备途径相关的亚麻元数分布在13个图书馆中。除了基于Uniprot数据库的Conlinin外,基于拟南芥基因注释选择unigenes。(XLS 96 KB)
12870 _2011_858_moesm4_esm.xls
附加档案4:与亚麻木尾,分布在13个库的亚麻,黄酮类和粘膜途径相关的EST数量(XLS 47 KB)
作者的原始提交的图像文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放访问本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
Venglat,P.,Xiang,D.,邱,S。et al。亚麻籽发育的基因表达分析。BMC植物BIOL.11,74(2011)。https://doi.org/10.1186/1471-2229-11-74
已收到:
接受:
发表:
关键字
- 种子外套
- 种子发育
- 蓖麻子
- 亚麻籽
- Dirigent蛋白