- 研究文章
- 开放访问
- 发布:
BAC-END序列衍生SSRS的开发和表征,及其掺入新的栽培花生的新密度遗传图中(arachis hypogaea.L.)
BMC植物生物学卷12.文章编号:10.(2012年)
摘要
背景
栽培花生(arachis hypogaea.L.)是全球的重要作物,估值为其食用油和可消化蛋白质。它具有非常狭窄的遗传基础,可能从相对近期的单一多倍化事件中获得。因此,分子标记具有低水平的多态性,可用于栽培花生的多态性分子标记的数量仍然是限制性的。
结果
本文报道了大量的BAC-end序列(BES),并将其用于开发SSR (BES-SSR)标记,并用于遗传连锁定位。大部分BESs与已知基因无同源性(49.5%),其次是与已知基因相似的序列(44.3%),以及转座元件、反转录元件和细胞器序列等杂序列(6.2%)。从36435个BESs中共鉴定出1424个SSRs。其中以二核苷酸(47.4%)和三核苷酸(37.1%)SSRs为主。对一个作图群体的2个亲本进行了1152个新SSRs和4000个已发表或未发表的SSRs的筛选,产生了385个多态位点。构建遗传连锁图谱,共包含318个位点,位于21个连锁群上,共覆盖1 674.4 cM,相邻位点间的平均距离为5.3 cM。两个与抗性基因同源物(RGH)相关的标记被定位到两个不同的类群,从而锚定了1个RGH- bac联系体和1个单体。
结论
从BESs中提取的SSRs将用于花生基因组的进一步分子分析,提供一套新的标记,在遗传上锚定BAC克隆,并将基因序列纳入连锁图谱。这将有助于识别与感兴趣的基因相关的标记和基于图谱的克隆。
背景
栽培花生(arachis hypogaea.L.)原产于南美洲,生长于北纬40°至南纬40°之间六大洲100个国家的热带和亚热带地区[1].种子干物质是可消化蛋白质(25至34%)的重要来源,食用油(44至56%)和维生素,如硫胺素,核黄素和烟酸,这对于许多发展中国家的人类营养尤为重要[2].作为一种豆类作物,花生通过固定氮来改善土壤肥力,每公顷可向土壤提供高达60公斤的氮,从而使随后种植在同一块土地上的作物受益[3.].
栽培花生是一种四倍体(2n = 4×= 40),自粉化物种,DNA含量为约2813mbp / 1c [4].利用限制性片段长度多态性(RFLPs)、同工酶和随机扩增多态性DNA (rapd)等分子标记检测到花生的遗传变异非常有限[5- - - - - -10.].栽培品种间的低遗传多样性可能是由于四倍体花生在一个单一的、相对较近的异源多倍体事件中起源,该事件被认为涉及野生二倍体物种的基因型arachis duranensis.和arachis ipaensis.[11.- - - - - -15.].由于在DNA水平上缺乏多态性,作物尚未进行标记辅助选择或抗性基因克隆。因此,有必要在花生栽培中追求基因组策略,以增加有用分子工具的可用性为具体目标。
重要的是,虽然遗传多样性低,但多态性确实存在于可能足以用于分子育种策略的数态。识别这种多态性的挑战涉及尺度和数据挖掘:我们如何调查足够量的花生基因组以识别大量多态性?一种可能性是使用简单的序列重复(SSR)标记,该标记现在存在于一个超过5,000个分级基因座中,其中许多是发表的,并且作为花生研究的工具(SSR)发表并显示承诺[16.- - - - - -25.].
由SSR标记组成的遗传联系地图已为野生二倍体基因组构建(AA [21.,24.,26.]及BB [27.]),以及衍生自栽培和野生倍双相物质之间的交叉的四倍体合成AABB基因组[28.].对于这些遗传图谱,多态标记的鉴定相对容易,因为对应的群体包含了野生典型的高多态性率arachis.物种。最近,一些低分辨率的连锁图谱已经被用于纯培养的四倍体AABB基因组杂交,其多态性要低得多[29.- - - - - -33.].对于这些后一种联系地图,多晶型标记限制,含有少于200的SSR标记。然而,这些遗传图的构建证明了产生更高分辨率的培养的遗传联系地图的可能性。
虽然单个SSR标记对于标记辅助选择对于它们与感兴趣的特征相关的情况来说是非常有价值的,但通常,花生的多态性SSR标记的数量仍然不足以作为常规遗传分析的工具。理想情况下,植物遗传学家和育种者应该有足够数量的多态性遗传标记,以确保鉴定与感兴趣的特征紧密相关的高价值标记,包括疾病抵抗表型。因此,需要扩大花生遗传多态性的密度和可用性,并调查花生种质中多态性等位基因的状态。
已经为许多植物物种构建了细菌人工染色体(BAC)文库,因为它们是物理映射,基于地图的克隆,基因结构和功能分析的有用工具。从BAC克隆(BAC衍生的SSR标记)开采的SSR标记具有与没有靶向序列的其他标记的优势[34.,35.].BAC衍生的SSR标记已被用于促进遗传和物理地图的合并[36.,37.],并简化了高分辨率的基因定位和基于图谱的基因克隆和感兴趣的qtl [35.].
本文报道了花生BAC末端序列(BES)衍生的SSRs的鉴定和特性分析。所得到的SSR很可能是花生基因组中SSR的一个很好的代表,因为它们来自一组随机选择的BAC序列。将这些SSR标记与其他公开的花生SSR标记结合,构建了一个新的、密度更高的栽培花生遗传连锁图谱,开启了花生物理和遗传图谱资源整合的进程。
结果
Bac克隆结束的测序和注释
3,784抗性基因同源物(RGH) - 统一的BAC克隆A. hypogaea.通过与一套花生抗病基因探针杂交,鉴定了Tifrunner cv,这些探针代表了约580个独特的核苷酸结合(NB)域(Rosen, He和Cook未发表的数据)。对这些BAC克隆进行末端测序,得到3,905个BAC末端序列(BES),相当于3.5 Mbp的Tifrunner基因组序列。从一个二倍体文库中随机选择另外25000个BAC克隆进行测序A. Duranensis.[38.]产生32,530个BAC结束序列,代表29.3 MBPA. Duranensis.基因组(表1).基于序列同源性的组合使用BLAST和与Interpro Database比较来注释BAC结束序列[39.].根据序列相似性,将BES序列分为5类:(1)含有基因的序列,(2)含有DNA转座元件的序列,(3)含有反转录元件的序列,(4)含有细胞器或核糖体rdna的序列,以及(5)无相似性的序列,如表所示2.最后一类是最大的,分别占野生和栽培BACs的48.5%和58.0%。类似的结果也出现在鸽子豆[37.],其中53.6%BES缺乏已知基因或蛋白质的类似比赛。含有推定基因的类别中的序列占总人物的44.9%A. Duranensis.和38.7%A. hypogaea..然而,我们强调许多BES作为“含基因”的归因于事实上,由于逆变序列的宽多样性,并且在注释词汇表中频繁重叠。在序列中明确地注释的序列有4倍,而不是BAC文库中的DNA转换元素。
BES-SSRS的识别与表征
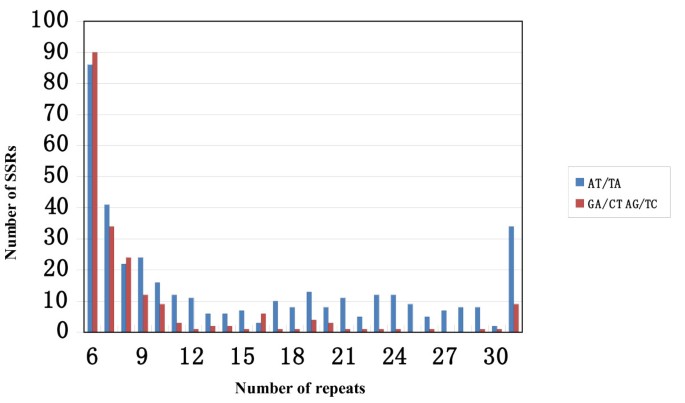
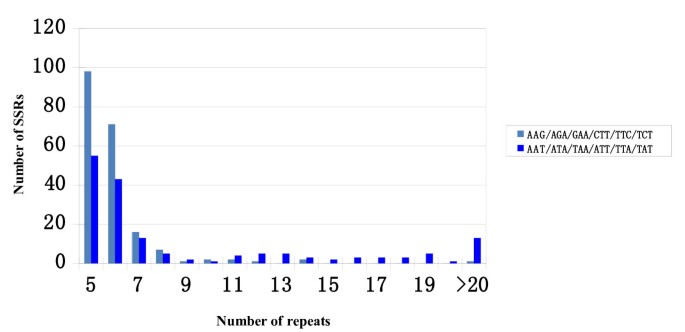
为了扩大PEANUT中的SSR池,BES序列用于采矿SSRS。从培养的BES序列中鉴定了一百二十八和1,296个SSR(四倍体A. hypogaea.)和野生(二倍体A. Duranensis.) BAC克隆,分别为2).对于野生和栽培的物种,SSR在BES的非注释分数中更频繁。正如预期的那样,在这些SSR二核苷酸中(47.4%)和三核苷酸(37.1%)SSR是主要的(表3.).对花生的EST-SSRS调查[40]揭示了类似的趋势,59.5%二核苷酸和33.7%的三核苷酸SSR。由重复组成的二核苷酸SSRS占所有SSR的27.4%,其次是具有AG重复的SSR(15.0%)。对于三核苷酸SSRS,AAG SSR频率略高(15.2%)比AAT SSR(12.0%)(表4).Moretzsohn等人[21.]也报道了在EST序列中存在大量AAT SSRs,只有AAG SSRs频率较高。由于在BES数据集中,AT、AG、AAG和AAT SSRs占所有SSRs的67%,因此对这4个基序SSRs的多态性数量和频率进行了比较。为了进行分析,SSRs根据长度进一步细分为两类(在Temnykh等人的意义上[41.]),I类SSR≥20bp和II类SSR的长度≤19bp。对于二核苷酸SSRS,我在课堂上的SSR数量高于II类的SSR,而AG主题的SSR在I类中频繁频繁(图1、表5).对于三核苷酸SSRS,II类的AAT和AAG主题的SSR都比在I类中更频繁(图2、表6).
共有1,152个底漆对与含有含有BAC克隆的RGH相关的128个SSRS设计A. hypogaea.和1,296个SSRS从随机选择的BAC克隆开采A. Duranensis..在八个培养基因型中比较时,这1152个SSR扩增子中的这1152个SSR扩增子中的一百四十八(12.8%)是多态性的(附加档案1).在该分析中,我们观察了来自的SSR的多态性的类似速率A. Duranensis.以及从A. hypogaea.(分别为12.9%和12.4%),表明SSR多态性的速率在基因组的RGH和非RGH区域之间没有区别。这些多态性频率与公开的SSRS(10-13%)一致[16.,17.,19.,23.,25.,29.,30.].BAC衍生的多晶型SSR标记检测到每个基因座的平均3.2等位基因,多态性信息含量(PIC)值范围为0.21至0.87,平均值为0.45(附加文件1).通过对I类和II类SSRs的比较,Fisher精确检验显示,无论是二核苷酸还是三核苷酸SSRs, I类的多态性频率都显著高于II类P.<0.0001(表5和6),这与之前的观察结果一致,即越长的SSRs越多态[41.].母题类型与多态性频率也有密切关系。其中,带有AAT基序的SSRs产生的长度多态性频率最高(17.5%),其次是带有AT基序(14.5%)、AG基序(10.9%)和AAG基序(4.5%)。大豆衍生的SSRs也获得了类似的结果,与其他基序相比,AT、AG和AAT基序产生的长度多态性率更高[42.].在这组新的花生贝斯-SSRs中,多态性率最高的是长SSRs (I类),AG-SSRs的多态性率为33.3%,AAT-SSRs的多态性率为32.4%,AT-SSRs的多态性率为18.2%(表1)5和6),使之成为栽培材料中最适合开发新的SSR标记的目标。
本研究中识别的BES-SSRS与公开的花生SSRS的比较透露,48.7%的BES-SSRS与以前通过其他方式识别的SSRS相同(请参阅附加文件中的列I&J1).不足为奇的是,23%的PCR引物序列重叠较少(附加文件中的K和L列)1因此,当前数据集提供了用于先前发现的SSR的一部分的新型SSR和新颖的引物集。
BES-SSRS的映射
本研究开发的bse -SSRs和约4000个公开的SSRs在两个亲本基因型Tifrunner和GT-C20之间的遗传多态性进行了评估。共鉴定347个多态性DNA标记,包括68个BES-SSR标记、7个靶区扩增多态性(TRAP)标记和1个序列标记(STS)标记,用于检测385个分离位点。SSR引物序列和基序的详细信息在附加文件中给出2.在347个多晶型标记中,35个鉴定的2个独立隔离基因座,1个产生的3个独立隔离基因座。这些多基因座SSRS分别使用轨迹名称后的后缀“-1”和“-2”分别指定为2和3个独立基因座。Chi-Square(χ2)分析确定了128(32.3%)基因座,其偏离预期的1:2:1或3:1分离率P.> 0.05的水平。利用JoinMap4软件进行LOD评分为4分,共绘制333个位点。21个位点包含318个位点,覆盖总地图距离1,674.4 cM(图)3.),而另外的7个连杆基团含有3个或更少的基因座,总共18个标记。21最大连杆组的尺寸范围为40.2cm(12个锁上)至124cm(26个基因座),相邻基因座之间的平均距离为5.3cm。在映射的基因座中,71(22.3%)是分布在21个连杆基团的所有除5中的BAC衍生的SSR,即LG2,LG13,LG14,LG16和LG17(图3.).将BAC衍生的与RGH相关的ssr标记GNB1076和GNB1112分别定位到LG10和lg18两个不同的类群上,并将1个包含7个BAC克隆和1个单体的RGH-BAC联系体定位到该遗传连锁图谱上。
讨论
BAC末端序列已被证明是开发分子标记的有力工具。bac衍生的标记可用于整合物理图与遗传图[36.,43.]并且还促进基于地图的克隆[44,45].从BAC结束序列获得的约32.8MBp的花生基因组序列用于该研究中的SSR标记的开采。我们还报告了对这些BAC衍生的SSR的详细分析。令人惊讶的是,大部分BES与基因序列具有相似之处(野生44.9%A. Duranensis.BES和38.7%的栽培品种A. hypogaea.尽管我们注意到这些包含BES的基因中有相当一部分可能来自反转录因子。野生无性系和栽培无性系的SSR/Mbp分别为44.2和36.6。这些差异可能反映了栽培四倍体基因组和野生二倍体基因组基因组之间的差异,但更可能反映了BAC克隆本质上的差异(即在BAC克隆中富含抗病基因)A. hypogaea.随机选择的克隆A. Duranensis.)两个BAC文库的施工方法的差异(随机剪切和部分欣分别为DIII裂解)。
估计148BES衍生的SSR多晶型标记物的等位基因多样性平均每位基因座的3.2个等位基因,并且基于八个基因型测试的每个基因座在每个基因座上的2至8个等位基因。这一级别的等级多样性低于先前研究中报告的等级,包括3至19(平均6.9)的等位基因,对于48例valencia基因型,2至27(平均8.4)为60巴西基因型[20.来自美国迷你核心收集和野生物种的141个基因型中,2至20(平均10.1)。但是,Cuc等人。(2008)报告的等位基因数在2至5的范围内,平均值为2.44,在32种基因型中[23.].尽管等位基因多样性可以用作遗传变异的指标,但这些值是相对的并且取决于多态位置的数量和分析基因型的相关性。在该研究中,仅使用了8个基因型,所有代表培养材料,其中两者都设定了可以识别的多态基因座的数量的上部范围。
使用涉及杂交的富集方法与SSR探针杂交的富集方法来自AG重复基序序列,源自众多公开的SSR数据[17.,19.,23.].在这些过程中通常避免使用AT序列,因为探针可能会形成发夹结构,从而无法有效地发挥作用。有趣的是,目前对BES衍生的SSRs的分析发现,带有AT基元的SSRs是最常见的。用于开发SSR标记的随机选择的BAC无性系很可能是花生二倍体基因组的良好代表,因此本研究所鉴定的SSR的分布和频率很可能是其全基因组频率的良好反映。比较AT SSRs和AG SSRs的多态率,前者的多态率略高于后者(见表)5).对于三核苷酸SSRs, AAT SSRs的多态性比AAG SSRs的多态性率高3.2倍(见表)6).该结果表明,富含富有的SSR基因座可能在花生中具有相对高的变化。几项研究报道,具有较大数量的重复的SSR具有相应的多态性率更高的速率[21.,36.,46].Temnykh等人。[41.]建议SSRS可以分为两类:I类是长期且过度的标记,而II类是短的,通常不那么可变的标记。SSRS的突变率随重复数而增加,但真核基因组中的LONG SSR具有突变偏置以变短SSR [47].我们的数据还表明,I类中的二核苷酸和三核苷酸SSRs检测到比II类的多态性。该发现建议,值得基于长期富有的SSR开发标志,以提供花生的新信息SSR标记。
在花生育种中,已在构建遗传连锁图谱、满足育种标记辅助选择和图位克隆所需条件方面做了一些努力。花生的第一个遗传连锁图谱由Halward等人构建[48]在来自两个二倍体野生物种之间的交叉的F2群体中A. Stenosperma.和A. Cardenasii.使用RFLP标记。从合成的Amphidiploid的BC1四倍细性群体开发了另一种基于RFLP的地图答:batizocoix (A. Cardenasii.X.A. Diogoi.)与cv交叉。弗洛纳[49].但是,RFLP或RAPDS检测到不足的可变性A. hypogaea.种质已经阻碍了直接在栽培花生中建造遗传联系地图[48].随着在过去十年中开发的更多SSRS,已经构建了几种基于SSR的地图,包括野生X野生物种种群中的AA基因组和BB基因组图[21.,24.,26.,27.],栽培X种植种群的一些遗传图谱[29.- - - - - -33.].这些培养的地图仅包含〜200秒的SSR基因座,因此如果它们有用用于花生育种,则需要额外的标记。由洪等人构建的遗传图谱。(2010)由175个SSR基因座组成,总覆盖率为885.4厘米[50]这张地图是使用三种栽培的X种栽培群构建的共识。在这项研究中,将大量的BES-SSR掺入培养的遗传图中,将映射标记物的数量增加到318中的单一培养的映射群中,将覆盖范围扩大到1,674cm,并降低两个相邻标记之间的平均距离5.3厘米。但是,七组含有只有3个或更少的基因座,49个基因座无法映射,表明链接地图仍然不完整。
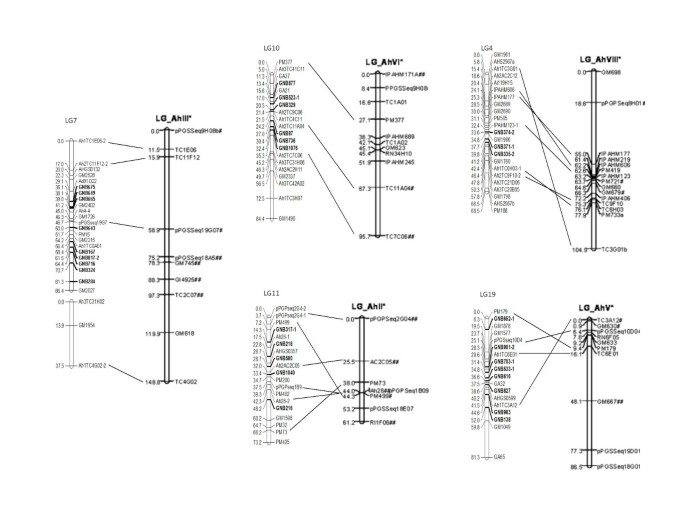
本地图和先前地图之间的使用常见标记允许比较绘制群体中的重组频率和标记顺序。选择目前地图中的五个连锁组以与第一个基于SSR的花生地图进行比较[30.,因为在两张地图之间有几个相同的标记(图4).这两张地图的比较显示了标记秩序的保护,并重新排列了两个人群之间的顺序。例如,当前地图中的LG7和LG10在以前的地图中具有与LG_AHIII和LG_AHVI相同的标记顺序。然而,三个其他连锁基团在两个映射群之间的标记顺序中显示出重排(图4).
10%的多态SSRs调查了一个以上的遗传位点。这种情况之前已经被其他作者注意到了[30.,32.]被推测从四倍体的两个子组的高相似性得出A. hypogaea..在本研究中,大多数(82%)扩增多于一个基因座的SSR是长SSR(> 30bp)或复合SSR。Strachan和Read(1999)报道,在人类的有丝分裂和减数分裂时,具有高重复数量的SSR是不稳定的[51,其结果是高度可变的。通过类比,长SSRs更有可能揭示异源四倍体花生的两个亚基因组中不同的多态性。
与分析BAC衍生的SSR标记分析,我们还使用了陷阱标记技术来确定花生中的潜在应用。400个捕集物引物对中仅有七(〜2%)是多态的,并置于连杆地图上。这表明陷阱标记,其产生涉及使用任意引物,仅具有低机会检测花生狭窄遗传基碱中的多态性。
利用bac衍生标记构建遗传连锁图谱的一个优点是,通过绘制bac衍生标记,可以将物理contigs锚定在遗传图谱上[37.].当BAC衍生标志物存在于这些基因时,集成图在标记辅助选择中对精英品种的初始选择,并促进基于地图的基因和QTL的克隆。在本研究中,开发了与基于RGH的物理折叠和单身相关的105个衍生的SSR。这些SSR中只有三个父母之间是多态性的;这些SSR中的两个被映射,从而将1个CONTIG和1个单例锚定到当前的遗传图中。与一个由三个克隆组成的一个RGH Contig有关的其他标记未取消。候选基因Bac Contig与表型的遗传联系应增强目标标志性发育的机会。特别地,BAC克隆的序列可以为新的标记发育提供底物。虽然我们在这项工作中只映射了少量的含RGH的BAC克隆,但我们已经确定了含有绝大多数〜580花生NBS-LRR RGH序列(Rosen,He和Cook,未发表的数据)的Bac Contigs。来自这些BAC克隆的有针对性的标记开发具有增强当前花生SSR框架的潜力,具有大量高价值疾病抗性候选基因,因此定义了花生基因组中R-基因的景观。
结论
在本研究中,从随机选择的克隆和含有含有克隆的克隆的SSRS扩大了花生中的信息性SSR标记池。这些新的SSR标记提供了用于花生基因组的分子分析的有用的遗传和基因组工具,并促进高密度遗传联系地图的构建。此外,与RGH相关的SSR标记提供了一种有价值的资源,可以将RGH Contigs和Singletons掺入遗传地图中,这将最终增加我们对花生基因组中抗病性基因的分布和组织的理解。这些信息将促进标记辅助选择抗性育种和基于地图的抗性基因的克隆。
方法
BAC克隆端序列
为了鉴定Harbored RGHs的BAC克隆,我们使用了一个估计的花生CV基因组的BAC库。Tifrunner一起与589个独特的RGH序列与Tifrunner的基因组(未发表的结果)分离。基于与测序基因组的比较Medicago Truncatula.和甘氨酸最大,这589 rghs代表了花生基因组中绝大多数抗性基因同源物。具有代表性的RGH序列探针的BAC文库的杂交产生了一套3,784个BAC克隆。使用高信息含量指纹(HICF)组装这些RGH含有BAC克隆[52,共获得344个contigs位点和334个单例位点,共678个抗性基因区。共3784个含BAC克隆的RGH进行末端测序。此外,从野生物种的BAC文库中随机选择25000个克隆A. Duranensis.[38.进行末端测序。对BESs进行同源性搜索,并用BLAST进行注释。
BES中SSRs的鉴定及引物设计
去除短路或冗余序列后,使用MISA搜索模块用于挖掘SSR的BES序列[53,54].利用6个二核苷酸重复序列、5个三核苷酸重复序列和4个四核苷酸重复序列的截断值对ssr进行了鉴定。根据SSRs的长度及其作为信息DNA标记的潜力,将所鉴定的SSRs分为两类:一类为≥20 bp的SSRs,二类为≥12 bp < 20 bp的SSRs [37.,41.].设计引物侧翼于SSR序列,扩增出150 ~ 300 bp的PCR片段。引物采用Primer3软件设计[55].利用所设计的引物对Tifrunner、GT-C20、SunOlic 97R、NC94022、D99、H22、越优92和新辉小李8个栽培基因型(前4个为美国花生品种,后4个为中国花生品种或选育系)进行多态性筛选。信息性ssr由PIC值测量[56].
构建映射人口
F.2使用简历的佐治亚州的Tifton沿海平原实验站USDA-ARS建造了映射人口。Tifrunner和GT-C20作为父母。Tifrunner是一种跑步者市场型品种,具有高水平的耐药性,以及早期抵抗力(尾孢属arachidicola)和晚叶点(Cercosporidium personatum),但属晚熟品种[57].GT-C20是西班牙型育种线,高易受TSWV和叶斑的影响,但抗黄曲霉毒素污染[58].年轻的叶子是从父母和94 f2使用改性的CTAB方法进行DNA分离的个体植物[59].
BES-SSRS的映射
从BAC结束序列中鉴定的多态SSR用于构建遗传联系地图。在含有25ng基因组DNA的10μl反应混合物的总体积中进行PCR,每种DNTP,0.1μM每种正向引物,0.1μM,与M13尾和反向引物,0.1μmm13引物,标记为700-或800-IR染料(Li-Cor Biosciences,Ne),1×反应缓冲液(10 mm KCl,10mm(NH)4)2所以4,20 mm tris-hcl,2 mm mgso4,0.1%triton x-100),和0.25 uTaqDNA聚合酶(Biolabs,Beverly,MA)。使用DNA发动机二元(BiORAD,CA)热循环仪进行扩增,具有以下循环条件:初始5分钟在95°C;35循环在94°C,30秒的55℃,30°C,30秒,72°C为30秒;最后3分钟72°C。通过Li-Cor DNA分析仪(Li-Cor Biosciences,Ne)分析扩增子。此外,我们已经评估了陷阱的可行性[60]使用序列相关的扩增多态性(SRAP)的标记[61]与RGH引物配对以检测花生中的多态性。筛选了四百个这样的底漆对。PCR反应混合物包括25ng基因组DNA,每次DNTP200μm,每次引物,1×反应缓冲液,0.2μm,0.375μmTaqDNA聚合酶(Biolabs,Beverly,MA)在10μl中。PCR条件是遵循胡和vick的协议[60].使用来自其他公共资源的多态SSR与来自其他公共资源的多态SSR的多晶型BAC衍生的SSR标记物和捕集标记用于映射。标记顺序和地图距离由JoinMap4软件(Kyazma,Netherlands)与Kosambi Map函数决定[62].
参考资料
- 1。
Naidu Ra,Kimmins Fm,Deom Cm,Subrahmanyam P,Chiyembekeza Aj,Van der Merwe PJA:Groundnut玫瑰花:一种影响撒哈拉以南非洲地生生产的病毒疾病。植物DIS。1999年,83:700-709。10.1094 / PDIS.1999.83.8.700。
- 2。
吉基南:花生仁的成分和营养价值。花生作物:改良的科学依据。编辑:Smartt J. London: Chapman & Hall;1994:173 - 213。
- 3.
Sprent J:固氮。花生作物改良的科学依据。编辑:Smartt J. London: Chapman & Hall 1994。
- 4。
Earle Arumuganatham:一些重要植物物种的核DNA含量。中国农业大学学报,1999,21(4):457 - 461。
- 5.
Kochert G,Halward T,Branch Wd,Simpson CE:花生的RFLP变异性(arachis hypogaea.品种和野生种。中国科学(d辑:地球科学),1991,11:565-570。
- 6.
利用分子标记检测花生栽培种质资源和相关野生种质资源的遗传变异。基因组学。1991,34:1013-1020。10.1139 / g91 - 156。
- 7.
HALWART TM,Stalker HT,Larue E,Kochert G:使用单引物DNA扩增在花生的基因研究中(arachis hypogaea.l .)。植物mol biol。1992,18:315-325。10.1007 / bf00034958。
- 8。
pak - ro OG, Smith RL, Knauft DA:限制性片段长度多态性评价arachis.部分。Al Appl Genet。1992年,84:201-208。
- 9。
花生种间同工酶谱的变异。《中国科学院院刊》1994年第1期。
- 10。
Subramanian V,Gurtu S,Rao Rcn,Nigam Sn:使用随机扩增多晶晶晶型在培养的基因中的DNA多态性鉴定使用随机扩增的多晶晶态DNA(RAPD)测定。基因组。2000,43(4):656-660。10.1139 / g00-034。
- 11.
Kochert G, Stalker HT, Gimenes M, Galgaro L, Lopes CR, Moore K:异源四倍体驯化花生起源和进化的RFLP和细胞遗传学证据,arachis hypogaea.(豆科)。中国海洋大学学报(自然科学版)。10.2307 / 2446112。
- 12.
Seijo JG,Lavia GL,Fernandez A,Krapovickas A,Ducasse D,Moscone EA:5S和18S-25s的物理映射,鱼作为证据表明arachis duranensis.和A. iPaensis.野生二倍体的祖先是A. hypogaea.(豆科)。我是J机器人。2004,9:1294-1303。
- 13。
Seijo GJ,Lavia Gi,Fernandez A,Krapovickas A,Ducasse D,Bertioli DJ,Moscone DEA:栽培花生之间的基因组关系(arachis hypogaea.- Leguminosae)及其近亲的双重透露。我是J机器人。2007,94:1963-1971。10.3732 / AJB.94.12.1963。
- 14。
Favero AP,SIMPSON CE,Valls JFM,Vello Na:通过可与可磁性研究的可联合性研究研究培养花生的演变Arachis iPaensis,A. Duranensis,和A. hypogaea..农作物科学。2006,46:1546-1552。10.2135 / cropsci2005.09-0331。
- 15.
Burow Md,Simpson Ce,Faries MW,Starr JL,Paterson啊:最近描述的B-和A-基因组种植物种的分子生物地理研究,还为栽培花生的起源提供了新的见解。基因组。2009,52:107-119。10.1139 / g08-094。
- 16.
Hopkins Ms,Casa Am,Wang T,Mitchell Se,Dean Re,Kochert Gd,Kresovich S:在花生中发现和表征多态简单序列重复(SSR)。农作物科学。1999年,39:1243-1247。10.2135 / cropsci19999.0011183x003900040047x。
- 17.
He GH,孟RH, Newman M, Gao GQ, Pittman RN, Prakash CS:微卫星作为栽培花生的DNA标记arachis hypogaea.l .)。BMC植物BIOL。2003,3:3-10.1186 / 1471-2229-3-3。
- 18。
他GH,MENG RH,GAO H,GUO B,GAO G,Newman M,Pittman RN,PRAKASH CS:植物植物品种的简单序列重复标记(arachis hypogaea.l .)。中国科学:地球科学。10.1007 / s10681 - 005 - 1043 - 3。
- 19。
Ferguson Me,Burow Md,Schulze SR,Bramel PJ,Paterson啊,Kresovich S,Mitchell S:PicroTellite识别和花生特征(A. hypogaea.l .)。中国科学:地球科学,2004,30(4):591 - 598。10.1007 / s00122 - 003 - 1535 - 2。
- 20。
Moretzsohn Mc,Hopkins Ms,Mitchell Se,Kresovich S,Valls JFM,Ferreira Me:花生的遗传多样性(arachis hypogaea.在基因组高变区分析的基础上,对其和野生近缘种进行了研究。植物学报。2004,4:11-10.1186/1471-2229-4-11。
- 21。
Moretzsohn MC,Leoi L,Proite K,Guimaraes PM,Leal-Bertioli Scm,Gimenes Ma,Martins Ws,Valls JFM,Grattapaglia D,Bertioli DJ:AA基因组的微卫星基因富含的基于基因的联系地图arachis.(Fabaceae)。Al Appl Genet。2005,111(6):1060-1071。10.1007 / s00122-005-0028-x。
- 22。
Proite K, Leal-Bertioli SCM, Bertioli DJ, Moretzsohn MC, da Silva FR, Martins NF, Guimaraes PM:来自野生动物的estarachis.用于基因发现和标记发展的物种。生物谷bioon . 2007, 7: 7-10.1186/1471-2229-7-7。
- 23。
Cuc LM, Mace ES, Crouch JH, Quang VD, Long TD, Varshney RK:新型微卫星标记的分离、鉴定及其在栽培花生多样性评价中的应用(英文)arachis hypogaea.l .)。BMC植物BIOL。2008,8:55-10.1186 / 1471-2229-8-55。
- 24。
Leal-Bertioli SCM, Jose Ana CVF, Freitas Dione MTA, Moretzsohn MC, Guimaraes PM, Nielen S, Vidigal BS, Pereira RW, Pike J, Favero AP, Parniske M, Varshney RK, Bertioli DJ:控制疾病抗性的候选基因组区域的鉴定arachis..BMC植物BIOL。2009,9:112-10.1186 / 1471-2229-9-112。
- 25。
基于遗传多样性和种间可转移性的花生SSRs。中华流行病学杂志。2009,7:100-106。
- 26。
Bertioli D,Moretzsohn M,Madsen LH,Sandal N,Leal-Bertioli S,GuimarãesP,Hougaard BK,Fredslund J,Schauser L,Nielsen Am,Sato S,Tabata S,Cannon S,Stougaard J:Syngaard Jarachis.借莲花和Medicago.阐明了豆类基因组结构,稳定性和演化的新光。BMC基因组学。2009,10:45-10.1186 / 1471-2164-10-45。
- 27.
Moretzsohn MC, Barbosa AVG, Alves-freitas DMT, Teizeira C, Leal-Bertioli SCM, Guimaraes PM, Pereira RW, Lopes CR, Cavallari MM, Valls JFM, Bertioli DJ, Gimenes MA: A连锁图谱arachis.(豆科)及其与a基因组的同位性。植物营养与肥料学报。2009,9:40-10.1186/1471-2229-9-40。
- 28.
Fonceka D,Hodo-Abalo T,Rivallan R,Faye I,Ndoye M,Ndoye O,Favero AP,Bertioli DJ,Glaszmann JC,Courtois B,Rami JF:野生血栓竞争的遗传映射到栽培花生中的遗传映射:扩大遗传的一种方式最近的同种异体一体化的基础。BMC植物BIOL。2009,9:103-10.1186 / 1471-2229-9-103。
- 29.
洪烨,梁XQ,陈XP,刘海,周GY,李SX,WES SJ:基于SSR标记在花生中的遗传联系地图(arachis hypogaea.l .)。中国农业科学,2008,7(8):915-921。10.1016 / s1671 - 2927(08) 60130 - 3。
- 30.
Varshney RK,Bertioli DJ,Moretzsohn Mc,Vadez V,Krishramurthy L,Aruma R,Nigam Sn,Moss Bj,Seetha K,Ravi K,He Gh,Knapp SJ,Hoiseton da:培养地生的第一个基于SSR的遗传联系地图(arachis hypogaea.l .)。Al Appl Genet。2009,118(4):729-39。10.1007 / s00122-008-0933-x。
- 31。
关键词:花生,晚叶斑病,锈病,QTL,分子育种arachis hypogaea.l .)。中国科学(d辑),2010,31(4):591 - 594。10.1007 / s00122 - 010 - 1366 - x。
- 32。
Ravi K,Vadez V,Isobe S,Mir Rr,Guo Y,Nigam Sn,Gowda MVC,Radhakrishnan T,Bertioli DJ,Knapp SJ,Varshney RK:鉴定几个小型主要效果QTL和大量的干旱外观QTLS耐受与地生中的相关性状(arachis hypogaea.l .)。中国科学(d辑),2011,32(11):1182 - 1182。10.1007 / s00122 - 010 - 1517 - 0。
- 33。
花生(Arachis hypogaea L.)蛋白质含量、含油量和油质数量性状位点的鉴定。农业工程学报。2011,doi:10.1016/j.fcr.2011.02.010
- 34。
Yu Jz,Kohel RJ,Dong J:从TM-1 BACS开发综合SSR标记。系列棉花改善会议进行。亚特兰大:由美国国家棉花委员会出版的CD-ROM; 2002年1月8日至12日
- 35。
郭勇,苏库玛,于建忠,詹健,Kohel RJ, Scheffler BE, Stelly DM:棉花bac衍生SSR标记的染色体定位。中国科学(d辑):地球科学(英文版)。10.1007 / s10681 - 007 - 9585 - 1。
- 36。
Mun Jh,Kim DJ,Choi HK,Gish J,Debelle F,Mudge J,Denny R,Endre G,Saurat O,Dudez Am,Kiss GB,Roe B,Young Nd,Cook Dr:在基因组中分布微卫星的分布Medicago Truncatula.:遗传标记的资源整合遗传和物理地图。遗传学。2006,172:2541-2555。
- 37。
Bohra, Dubey, Saxena RK, Penmetsa房车,(Poornima KN, Kumar N,筹划者广告,Srivani G, Upadhyaya高清,Gothalwal R,拉梅什年代,辛格D, Saxena K, Kavikishor PB,辛格NK, CD, GD,库克博士,Varshney RK: BAC-end序列分析(贝丝)和发展BES-SSR标记基因映射和杂种纯度评估在木豆(Cajanus.spp)。植物营养与肥料学报。2011,11:56-10.1186/1471-2229-11-56。
- 38。
Guimarães PM, Garsmeur O, Proite K, Leal-Bertioli SCM, Seijo G, Chaine C, Bertioli DJ, D’hont A:从异源四倍体栽培花生的祖先二倍体基因组构建BAC文库。植物生态学报。2008,8:14-10.1186/1471-2229-8-14。
- 39.
猎人,Apweiler R, Attwood TK, Bairoch,贝特曼,宾斯D,博克P, Das U,多尔蒂L, Duquenne L,芬恩RD,高夫J,把手D, Hulo N,卡恩D,凯利E, Laugraud, Letunic我,朗斯代尔D,洛佩兹R,ㄧM,套装J, McAnulla C, McDowall J, Mistry J,米切尔,穆德N,纳塔尔D, Orengo C,奎因房颤,Delengut JD, Sigrist CJA, Thimma M,Thomas PD, Valentin F, Wilson D, Wu CH, Yeats C: InterPro:整合蛋白特征数据库。acta physica sinica, 2009, 37(增刊1):D211-D215。
- 40。
郭BZ,陈XP,洪YB,梁XQ,Dang P,Brenneman T,Holbrook C,Culbreath A:栽培花生叶组织中基因表达谱的分析及EST-SSR标记和基因发现的发展。INTL J植物基因组学。2009年,DOI:10.1155 / 2009/715605
- 41。
Temnykh S,Declerck G,Lukashova A,Lipovich L,Cartinhour S,McCouch S:稻米微卫星的计算与实验分析(Oryza Sativa L.):频率,长度变化,转座子关联和遗传标记势。Genome Res。2001,11:1441-1452。10.1101 / GR.184001。
- 42。
Shoemaker RC,Grant D,Olson T,Warren Wc,Wing R等:从Bac结束序列和遗传映射的微卫星发现,以锚定大豆物理和遗传地图。基因组。2008,51:294-302。10.1139 / g08-010。
- 43。
Ohyama A, Asamizu E, Negoro S, Miyatake K, Yamaguchi H, Tabata S, Fukuoka H:利用基因组数据库的bac端和cDNA序列开发的番茄SSR标记的特性。中国生物医学工程学报。2009,23:685-691。10.1007 / s11032 - 009 - 9265 - z。
- 44。
麦克尼尔MD,Kota R,Paux E,Dunn D,McLean R,Feuillet C,Li D,Kong X,Lagudah E,Zhang Jc,Jia Jz,Spielmeyer W,Bellgard M,Apples R:Bac衍生的标记用于测定茎铁锈基因,老2、在小麦育种项目中。生物育种。2008,22:15-24。10.1007 / s11032 - 007 - 9152 - 4。
- 45。
David P,Sevignac M,Thareau V,Catillon Y,Kami J,Gepts P,Langin T,Geffroy V:Bac结束序列对应于共同豆类中的B4抗性基因簇:标记和同时性分析的资源。Mol Genet基因组学。2008,280:521-533。10.1007 / s00438-008-0384-8。
- 46。
Burstin J, Deniot G, Potier J, Weinachter C, Aubert G, Baranger A:微卫星多态性Pisum sativum..植物育种。2001,10:311-317。10.1046 / J.1439-0523.2001.00608.x。
- 47。
洪春平,朴志勇,康大伟,Batley J, Yang TJ, Hur YK, Bhak J, Park BS, Edwards D, Lim YP:基因组中简单序列重复序列的分布芸苔属植物拉伯.中国生物化学学报。2007,23(3):349-356。
- 48。
花生二倍体RFLP连锁图谱的建立。《中国科学院院刊》1993年第4期。10.1007 / BF01184927。
- 49。
埋葬MD,辛普森CE,STARR JL,Paterson啊:从合成的阳性吡啶素到栽培花生的染色质的传播遗传学(arachis hypogaea.L.)拓宽单味多倍体物种的基因库。遗传学。2001,159:823-837。
- 50。
康烨,陈XP,梁XQ,刘海,周GY,李SX,Wen SJ,霍尔布鲁克CC,Guo Bz:栽培花生(Arachis Hypogaea L.)基因组的SSR基复合遗传联系地图。BMC植物BIOL。2010,10:17-10.1186 / 1471-2229-10-17。
- 51。
Strachan T,阅读AP:人权分子遗传学II 2牛津:BIOS Scientific Publishers Ltd; 1999年。
- 52。
Luo MC, Thomas C, You FM, Hsiao J, Ouyang S, Buell CR, Malandro M, McGuire PE, Anderson OD, Dvorak J:基于SNaPshot标记试剂盒的细菌人工染色体高通量指纹图谱及其毛细管电泳限制性片段大小。基因组学杂志,2003,22(4):429 - 434。10.1016 / s0888 - 7543(03) 00128 - 9。
- 53。
Varshney Rk,Thiel T,Stein N,Langridge P,Graner A:在一些谷物种类中微卫星频率和分布的硅分析。细胞摩尔Biol Lett。2002,7:537-546。
- 54。
Thiel T,Michalek W,Varshney RK,Graner A:利用EST数据库,用于大麦中基因的发展和表征(Hordeum Vulgare.l .)。中国科学(d辑),2003,26(6):417 -422。
- 55。
Rozen S, Skaletsky HJ:为一般用户和生物学家程序员的WWW入门3。生物信息学方法与协议:分子生物学方法。编辑:Krawetz S, Misener S. Totowa: Humana出版社;2000:365 - 386。
- 56。
BOTSTEIN D,WHITE RL,SKOLNICK M,DAVIS RW:使用限制片段长度多态性的人遗传联系地图的构建。我是j嗡嗡声的遗传。1980,32:314-331。
- 57。
Holbrook CC,Culbleath AK:'Tifrunner'花生的注册。J Plant Reg。2007,1:124-10.3198 / JPR2006.09.0575CRC。
- 58。
Liang X, Holbrook CC, Lynch RE, Guo BZ:花生种子β -1,3-葡聚糖酶活性(arachis hypogaea.)是由接种引起的黄曲霉并与类似粘连蛋白结合。植物病理学杂志,2005,29(6):591 - 598。10.1094 /发朵- 95 - 0506。
- 59。
Murray Mg,Thompson WF:高分子量植物DNA的快速分离。核酸RES。1980,8:4321-4325。10.1093 / nar / 8.19.4321。
- 60。
胡锦涛,Vick BA:目标区域扩增多态性:一种新型植物基因分型的标志技术。植物mol Biol记者。2003,21:289-294。10.1007 / BF02772804。
- 61。
Li G, Quiros CF: SRAP (Sequence-related amplified polymorphism, SRAP),一种基于简单PCR反应的新的标记系统:它在基因定位和标记中的应用芸苔.应用电子学报。2001,103:455-461。10.1007 / s001220100570。
- 62。
Kosambi DD:从重组值估计地图距离。Ann Eugen。1944,12:172-175。
确认
作者感谢国家科学基金会(NSF,DBI-0605251)和USDA / CSREES /容量建设计划(#2006-38814-17489),用于支持这项研究。
作者信息
隶属关系
通讯作者
附加信息
作者的贡献
HW,LG,YM和YZ进行了基因分型和遗传联系方式。YM和JG对BAC探针的BAC文库进行了杂交,由BDR提供。RVP,ADF和GH对BES-SSRS进行了SSR采矿,底漆设计,序列注释和数据分析。BZ,SI,DJB和RKV提供了开发的SSR。BZ建立了绘图人口和提供了植物材料。DRC构思了研究,设计实验并协调了这项研究。RVP,DJB,RKV,DRC和GH参与起草手稿。GH最终确定了稿件。所有作者都阅读稿件。
作者为图像提交的原始文件
权利和权限
开放访问本文由BioMed Central Ltd授权发表。这是一篇开放获取的文章,是根据知识共享署名许可协议(https://creativecommons.org/licenses/by/2.0)提供任何介质中的不受限制使用,分发和再现,所以提供了正确的工作。
关于这篇文章
引用这篇文章
王,H.,Penmetsa,R.V.,元,M。等等。BAC-END序列衍生SSRS的开发和表征,及其掺入新的栽培花生的新密度遗传图中(arachis hypogaea.l .)。BMC植物杂志12,10(2012)。https://doi.org/10.1186/1471-2229-12-10
收到:
接受:
发表:
关键词
- 细菌人工染色体
- 简单序列重复标记
- 细菌人工染色体克隆
- 细菌人工染色体图书馆
- 靶区扩增多态性