摘要
背景
松树枯萎病是由松材线虫引起的,Bursaphelenchus xylophilus,威胁着世界各地的松林和森林生态系统,并造成严重的经济损失。自病原体被发现以来的40年里,随着疾病进展所发生的生理变化已通过解剖和生化方法进行了表征,并通过育种计划选择了抗性树木。然而,尚未有研究评估耐药或易感树中与感染诱导生理变化相关的分子遗传学,如转录变化。
结果
采用时间过程采样法,对易感树接种后1、3、7天的松木线虫和抗性树接种后1、3、7、14天的松木线虫的松木线虫构建了7个减法抑制杂交(SSH) cDNA文库。从这些cDNA文库中共获得3299个序列,其中易感SSH文库中非冗余序列为138 ~ 315个,抗性SSH文库中非冗余序列为351 ~ 435个。利用基因本体层次结构,将非冗余序列分为生物过程基因本体类的15个子类和分子功能类的17个子类。基因本体论分类揭示的转录成分在抗性文库和易感文库之间有明显差异。一些转录本具有鉴别性:在每个时间点,抗菌素肽和推测的致病相关基因(如PR-1b、2,3,4,5,6)在易感树中的表达量都远远高于耐药树,而在7和14 dpi时,耐药树中PR-9、PR-10和细胞壁相关基因(如富含羟脯氨酸的糖蛋白前体和扩展蛋白)的表达量高于易感树。
结论
接种松材线虫后,抗性和易感树种在转录本多样性、共有转录本表达的时间和水平上存在显著差异;特别是应激反应和防御基因的表达差异较大。本研究为在解剖和生化研究中观察到的抗性和易感树之间生理变化的差异提供了新的认识。
背景
松树枯萎病是由松木线虫(PWN)引起的,Bursaphelenchus xylophilus,并由德重和清原最先报道[1];这种疾病威胁着世界各地的松林和森林生态系统,并造成重大经济损失[2].松材枯萎病是松林的一个长期问题(松果体thunbergii而且赤松在日本,大约有4000万人口3.大量的松林遭到了PWN的破坏[3.].在过去的40年里,公共行政部门和中央、地方和城市政府试图通过控制松树锯叶甲虫(Monochamussp.)是PWN的媒介,使用杀虫剂和砍伐受感染的树木。此外,国家和地方林业研究所已经建立了培育抗松品种的育种计划。1978年,在日本西部开始了抗松材枯萎病的松树品种培育工程,随着病害的扩散,除北海道以外的日本全境都在推进相关工程。在这个育种项目中,使用一种严格遵循协议的人工接种试验来筛选树木的抗性;在1978年至1984年的第一个育种项目中,有92个抗性菌株p . densiflora从1.1万株候选树中选出的个体中,只有16株具有抗性p . thunbergii个体是从14000棵候选树中挑选出来的。育种项目继续进行,获得了204个抗性基因p . densiflora和90年抗p . thunbergii个人生成。耐药p . densiflora(n = 92)和耐药p . thunbergii(n = 16)根据接种后公开授粉后代的存活率进行抗性排序(1-5级);较高的存活率被认为意味着更强的抵抗力。从所选松树(即抗性树)中公开授粉后代的平均存活率为64%p . densiflora53%,p . thunbergii,分别比未选择人群高16%和40% [4].
自从病原体被确定后[1],许多研究人员已经描述了与松树枯萎病进展相关的生理变化,到20世纪90年代中期,已有两千多篇关于该疾病的论文发表[5].许多与PWN感染相关的症状,包括光合作用降低、木质部和皮层薄壁组织细胞变性、创伤性树脂管形成、形成层破坏、植物毒性物质和乙烯的产生、叶片水势和蒸腾作用降低以及热脉冲速度,已经得到了研究(综述,见参考文献[6])。根据这40年来收集的解剖学和生化证据,症状的发展被认为发生在两个阶段,早期和晚期[6].早期,少量线虫迁移,在接种部位附近发生皮层和韧皮部组织和形成层坏死破坏、皮层树脂管破坏、树脂管周围皮层薄壁创面周皮形成、乙烯释放等症状。在晚期,乙烯的产生增强,并与皮层薄壁组织的广泛破坏、形成层的破坏和木质部管胞的空化诱导栓塞相一致。空化栓塞导致叶片水势下降,光合作用停止。光合作用停止后,严重症状迅速出现,线虫数量激增;这种数量的增加导致树木枯萎并最终死亡。对PWN感染的耐药性取决于在早期阶段停止症状或防止感染进展到晚期。虽然已经从解剖学和生物化学的角度对松树枯萎病发展过程中发生的生理变化进行了表征,但分子遗传事件,如转录本谱的变化,可能与抗病或易感树木的生理变化有关,仍然知之甚少。
近年来,对小麦抗性品种的基因表达谱进行了研究p . thunbergii“仙台- 290”;抗性等级1)和非抗性日本黑松(p . thunbergii)对PWN接种后3天收集的茎进行LongSAGE技术评估[7].研究人员发现,过氧化氢酶和二烯内酯水解酶家族中的蛋白质在抗性树中高度表达,但在非抗性树中不表达,而致病相关(PR)- 1,2,3、白花色素双加氧酶和细胞壁相关基因在非抗性树中表达较高。虽然该研究评估了抗性和非抗性的防御反应在一个时间点上的差异p . thunbergiiPWN接种后,防御反应是连续的,抗性和敏感性的差异不仅取决于激活防御基因的质量差异,还取决于它们表达的时间和大小的差异[8].为了描述随着松树枯萎病症状发展,抗性和易感树木转录谱的差异,有必要在确定的时间过程中对抗性和易感个体进行取样。
减法抑制杂交(SSH)是一种强大的基因表达谱分析工具,可有效识别在不同条件下或不同组织中差异表达的基因[9].这种方法相对简单易行,可以用于基因组信息很少或没有的物种,分离的cdna通常长于100 bp,可以通过比较基因组学(如BLAST分析)有效注释。这种方法常用于分离专门表达对病原体感染反应的植物基因,并鉴定受感染的耐药和易感植物的转录谱的差异[10- - - - - -14].SSH选择减少了大量表达的管家基因或在“测试者”和“驱动者”样本中共同表达的基因的克隆,因此在文库构建过程中规范化了表达的cDNA谱。因此,SSH选择显著提高了克隆差异表达基因的机会。
本研究的目的是确定pwn接种后转录谱的差异p . thunbergii了解抵抗者和易感者防御反应的差异。三个重要的实验设计元素增强了我们研究结果的清晰性和相关性:1)我们使用了抗p . thunbergii“namikata - 73”;抗性等级5。2)在任何宏观变化通常发生前1、3和7 dpi采样接种的树木(包括抗性和易感);当宏观变化通常很明显时,抗药树也采样14 dpi。3)我们使用SSH,一种强大的方法来识别差异表达的基因,不管它们的丰度如何。
结果
SSH库中的序列分析
6个减法文库构建于三个时间点,分别为每日1天、3天和7天的样本,用于识别在PWN接种后疾病症状发展时,抗性和易感树中差异表达的基因。此外,第7个文库包含的基因主要在抗病树14 dpi表达,而在易感树7 dpi表达(见方法)。我们对7个文库中3,299个cDNA插入的5'端核苷酸进行了测序1).插入长度从100到780 bp不等;中位长度在366 - 429 bp之间,取决于库。每个文库的冗余度在抗性树的3.9% - 27.2%之间,在易感树的28.4% - 72.8%之间。获得的非冗余表达序列标签(est)在抗性树库中为351 ~ 435个,在易感树库中为138 ~ 315个。重要的是,两个库在每个时间点的重叠非常低;例如,从1 dpi采样的抗感树和易感树的文库中共享了0.4%的cDNA插入。同样,从14 dpi的抗性树和7 dpi的易感树中,只有3.7%的cDNA插入被文库共享。这种高度的专一性是高效的SSH过程所期望的。
对每个SSH文库中表达的基因进行功能分类和差异积累基因的鉴定
为了为每个SSH文库的转录本注释假定的基因和功能基因本体(GO)类别,我们使用搜索程序blastx、tblastx和blastn使用Blast2GO程序[15)(附加文件1).BLAST分析的过渡命中率和每个库的注释率如表所示1.在使用国家生物技术信息中心(NCBI)的nr和EST数据库的BLAST搜索中,每个库98%或更多的克隆被匹配。类似地,每个库中97%或更多的克隆在Dana-Farber癌症研究所的BLAST搜索(blastn)中被匹配松果体taeda基因指数(DFCI PGI, 8.0版本)。每个库自动和人工注释GO术语的注释率在75.45%到91.00%之间。
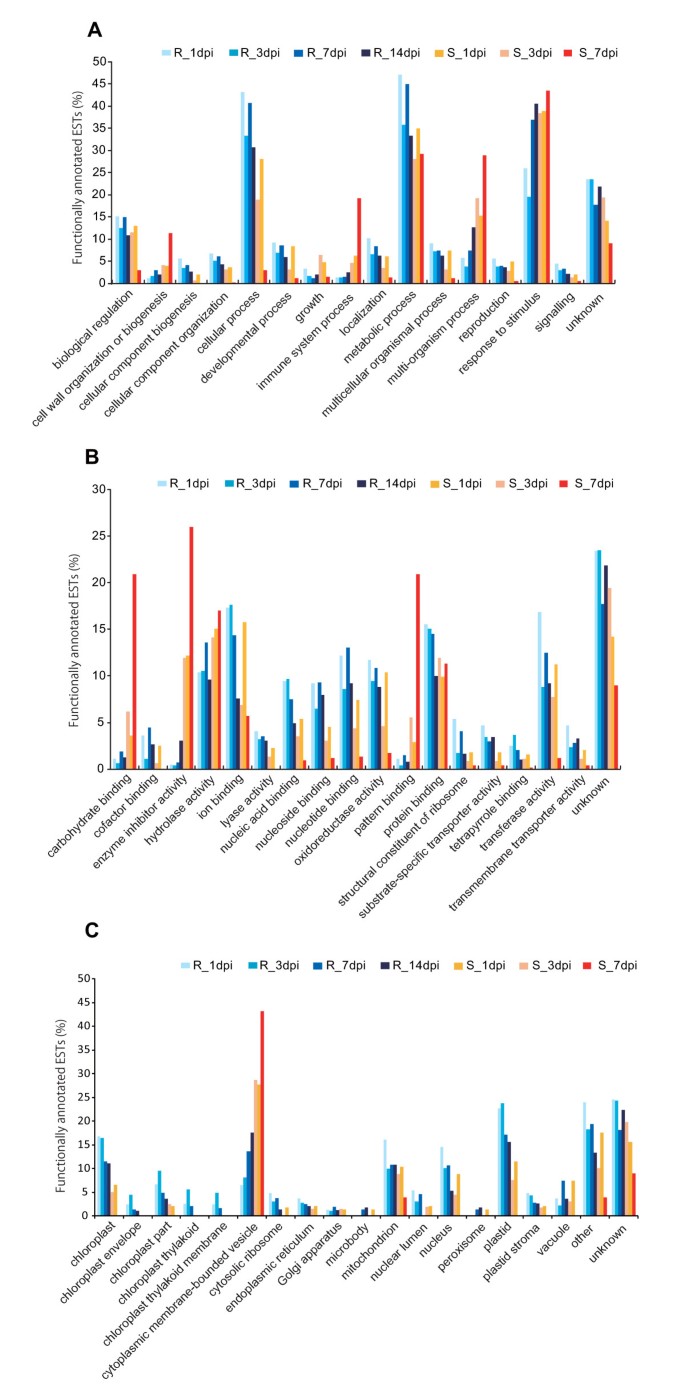
七个文库中回收的非冗余ESTs按功能分为三个主要的一级氧化核糖核酸类别:生物过程、分子功能和细胞成分。此外,生物过程分类在第2级被划分为24个亚类,分子功能分类在第3级被划分为61个亚类,细胞成分分类在第7级被划分为39个亚类。这里给出的级别对应于每个主要GO类别中层次类别的深度,更高的级别代表更一般的分类。生物过程的分类,分为15个大类和24个小类,如图所示1.在生物过程下的15个亚类中,刺激反应亚类在各时间点易感文库中所占比例均高于抗性文库,细胞壁组织或生物发生、免疫系统过程、多生物过程3个亚类在各时间点易感文库中所占比例均高于抗性文库。而与细胞过程和代谢过程相关的转录本在抗性文库中所占比例较高。此外,即使在7 dpi和14 dpi的抗性文库中,对刺激的反应类别也有较高的比例。分子功能的分类,分为17个大类和61个小类,如图所示1 b.在每个时间点,易感树在碳水化合物结合、酶抑制剂活性、水解酶活性和模式结合四个亚类转录本的表达量高于抗性树,而与离子结合和蛋白质结合等几个分子结合类以及氧化还原酶活性和转移酶活性等几个分子活性类相关的转录本在抗性文库中表达率较高。细胞成分的分类,分为18个大类和39个小类,如图所示1 c.在每个时间点上,易感树的胞质膜囊泡类转录本表达量高于抗性树。而与叶绿体、质体和线粒体等细胞器类相关的转录本在各时间点抗性文库中均以较高的比例存在。
为了评估在一段时间内从感染抗性和易感树中特异性转录本的特异性和多样性,从每个SSH文库中选择ESTs(表2额外的文件2).易感感染树文库转录物多样性非常有限,主要由PR蛋白组成,如基本PR-1、PR-2 (β -1,3-葡聚糖酶)、PR-3 (I、IV类几丁质酶)、PR-4 (I、II类几丁质酶)、PR-5 (thaumatin-like蛋白)、PR-6 (II类蛋白酶抑制剂家族蛋白)和抗菌肽。相比之下,来自抗性树的ESTs则更加多样化。抗性文库在1 dpi和3 dpi时可识别编码金属硫蛋白样蛋白、热休克蛋白70 (HSP70)、木葡聚糖内转糖基酶(XET)和细胞色素P450 (CYP450)的转录物。从7 dpi和14 dpi采样的抗性树文库中,有编码PR-5、PR-9(过氧化物酶)、PR-10(核糖核酸酶样)、富羟脯氨酸糖蛋白(HRGP)前体和扩展素的转录本。
选择SSH克隆和实时定量PCR (qRT-PCR)验证差异表达
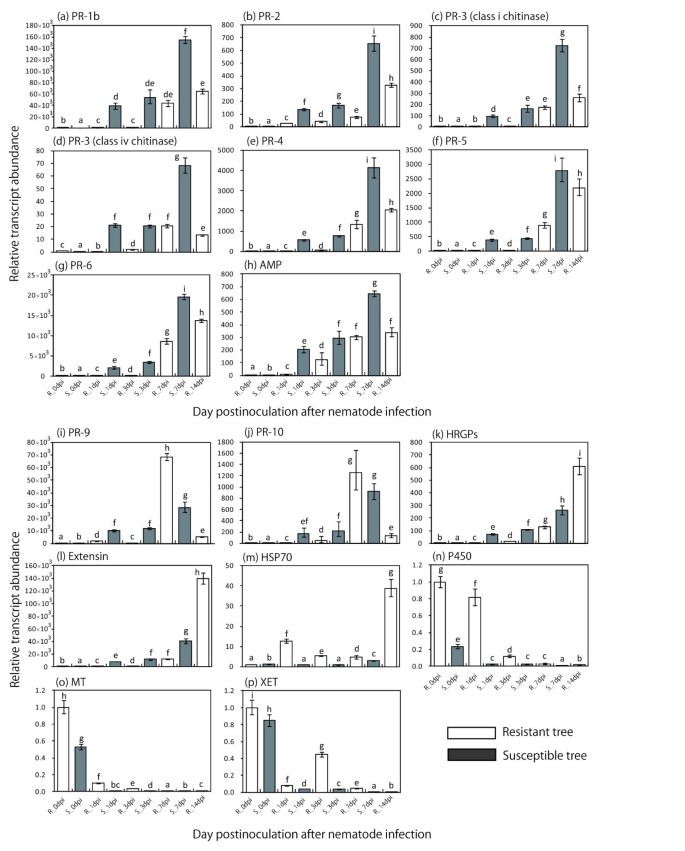
为了验证SSH过程的结果,使用qRT-PCR检测了七个文库中一个或多个检索到的16个est的表达;用于qRT-PCR分析的样品分别采集于抗性和易感树的0、1、3、7和14 dpi。(图2).此外,还使用qRT-PCR检测模拟样本在每个时间点的16个ESTs的表达,以监测PWN感染或切割诱导的表达变化(附加文件3.).qRT-PCR与SSH分析结果一致。
接种PWN后,16种ESTs中有12种表达明显上调。在上调的ESTs中,各时间点易感树中PR-1b、PR-2、PR-3 (I、IV类几丁质酶)、PR-4、PR-5、PR-6和抗菌肽的表达量均显著高于耐药树。这些ESTs在易感树中表达量在1 dpi时显著增加,在7 dpi时表达量进一步增加。在抗性树中,这些ESTs在1 dpi和3 dpi时表达量相对较低,而在7 dpi和14 dpi时表达量较高。编码PR-9、PR-10、HRSP和extensin的est在抗性SSH库中可见。在1 dpi和3 dpi时,易感树中PR-9和PR-10的表达量较高;然而,在抗性树中,这两种转录本的水平在7 dpi时要高得多,但在14 dpi时要低于7 dpi。抗性树中HRGP和扩展蛋白转录本在14 dpi时积累较高,但在1 dpi、3 dpi和7 dpi时,这两种est在易感树中的表达高于抗性树。
根据qRT-PCR分析,PWN接种后,抗感树和易感树中CYP450、金属硫蛋白样蛋白和XET 3种est均下调,其中易感树下调幅度更大。在易感树中,这三种est的转录水平在1 dpi内下降,在3和7 dpi时甚至更低。抗性树在7和14 dpi时的est水平与易感树在7 dpi时的水平相似。HSP70的转录水平低于其他下调基因,且在抗性树中下降较为温和,表达模式与模拟样本相似。
讨论
我们对七个SSH文库中的cdna进行测序,以表征耐药和易感之间的转录差异p . thunbergii树木对接种PWN的反应。在共同检测的1,3,7 dpi三个时间点上,易感树的转录本多样性在统计学上低于抗性树。在易感树中,几个编码致病相关蛋白的转录本的本构水平高于抗性树。在14 dpi的抗性树中,发现了几个编码细胞壁蛋白的转录本。SSH方法的结果通过qRT-PCR进行验证。我们清楚地证明,在抗株和易感株中,PWN接种胁迫/防御反应相关的转录物组成、时间变化和基因表达水平是不同的。
PWN侵染后,抗性和易感树的转录本多样性存在显著差异。易感文库中独特序列所占比例为71.59 ~ 27.17%,抗性文库中独特序列所占比例为72.82 ~ 96.11%。PWN感染后,3 dpi时易感文库的转录物多样性高于1和7 dpi时的易感文库,抗性文库的转录物多样性在各时间点均高于易感文库。根据差异表达转录本的GO分类,在易感树中,很大比例涉及应激/防御反应类别,如生物过程类别中的对刺激的反应、多有机体过程和免疫系统过程,以及分子功能类别中的酶抑制剂活性、碳水化合物结合、模式结合和水解酶活性。此外,很大比例的细胞成分类转录本属于细胞质膜有界囊泡亚类。另一方面,耐药SSH文库中很大比例的转录本被归类为生物过程类的细胞过程、代谢过程和对刺激的响应子类,以及分子功能类的配体结合和转移酶活性子类。许多从抗药树中恢复的转录本被归入细胞成分亚类,并进一步归类为细胞器亚类质体、叶绿体和线粒体。GO分类揭示的耐药树和易感树文库转录本多样性差异表明,耐药树和易感树对PWN感染的应激/防御反应存在质的差异。
抗性和易感性不仅取决于激活防御基因的质量差异,还取决于它们表达的时间和幅度的差异[8].致病相关防御蛋白PR-1b、PR-2、PR-3、PR-4、PR-5、PR-6和抗菌肽的基因调控模式显示耐药树和易感树对PWN感染反应的时间和数量差异。在调节植物防御反应中,大多数致病相关蛋白都是通过信号化合物水杨酸(SA)、茉莉酸(JA)或乙烯的作用诱导的[16].PR-1b、PR-2和PR-5基因是sa反应基因,也是系统性获得性耐药的指标;此外,PR-6基因是一个JA和乙烯响应基因[17].虽然本研究还不清楚植物激素与pwn -线虫相互作用中防御反应之间的关系,但有趣的是,与SA、JA/乙烯等植物激素和抗菌活性相关的致病相关基因的表达在易感树中比在耐药树中诱导得更快且水平更高。
同样的三种植物激素,SA, JA和乙烯,在基础基因和r基因介导的对叶面病原体和昆虫的防御反应中都很重要。JA和乙烯信号通路似乎具有协同作用,而SA和JA/乙烯信号通路相互抑制,SA和JA/乙烯信号通路之间存在负串扰[18].之间的相互作用一个英雄对SA响应基因PR-1和PR-5的表达是抗性品种的标志,而依赖于JA的PR-6在易感品种中表达较高,说明SA在抗性线虫中起一定作用,易感番茄中JA和乙烯有可能干扰SA诱导的抗性途径[19,20.].在其他植物与线虫的相互作用中(如线虫),SA参与了抗性和SA响应基因的表达拟南芥突变体(21和一种抗根结线虫的花生[13])。在我们的研究中,在易感树中,sa响应基因PR-1b、PR-2、PR-5和JA/乙烯响应基因PR-6的较高诱导表明,这些植物激素介导的防御反应对控制PWN的侵害不是很有效。
我们检测到抗性树在7 dpi和14 dpi时HRGPs、扩展素和过氧化物酶(PR-9)的显著水平,但在1 dpi和3 dpi时,易感树的表达高于抗性树。细胞壁介导抗性是植物抵御病原体的第一道防线,植物细胞壁的组成部分通过产生活性氧(ROS)如H2O2在受到病原体攻击时[22].细胞壁结构蛋白伸展蛋白和HRGPs由于氧化交联作用在生物和非生物应激反应中发挥重要作用,氧化交联有助于细胞壁的强度,并由基于过氧化物酶和H2O2[23- - - - - -25].HRGPs和扩展素的交联参与细胞壁介导的耐药性,并在阻止病原体进入部位发挥重要作用[23];这些蛋白质在与微生物相互作用时积累在许多植物的细胞壁中[26].许多报道描述了植物细胞壁HRGPs和扩展蛋白对病毒、细菌和真菌等病原体的反应(综述见参考文献[27])。在植物与线虫的相互作用中,烟草接种根结线虫后的第7天和第14天,在皮质区发现了高表达的扩展素基因[28].在rhg1抗性大豆扩展素被鉴定为接种大豆囊线虫后合胞体中特征性表达的基因之一,表明改变细胞壁组成在防御反应中很重要[29].另外,在心肌梗死抗性番茄、扩展素和糖基转移酶可能在细胞壁合成中发挥作用,这是对抗根结线虫的必要防御[30.,31].在PWN感染的解剖研究中,Ishida等人[32]接种的毒线虫(b . xylophilus)分离出S6-1和无毒线虫(b . mucronatus)分离到日本黑松,观察到在7 dpi时,两株线虫在皮质树脂管周围木质素和亚蛋白样物质的积累。Kusumoto等人[33]亦接种了一种有毒的线虫(b . xylophilus结果发现,在接种PWN (PWN)后的7dpi和14dpi,抗性树皮质树脂管周围酚类化合物的积累更为频繁。b . xylophilus),并认为这种积累是一种非常有效的防御感染的手段,因为它限制了PWN的迁移。虽然本研究没有研究HRGPs或扩展素与细胞壁其他物质之间的关系,但有可能是通过过氧化物酶上调HRGPs或扩展素等细胞壁相关基因的表达以及这些蛋白的氧化交联,在7 dpi和14 dpi抗PWN感染的树木的有效防御反应中发挥了作用。
PR-10也是抗性树7 dpi减法文库中文库显著上调的基因之一。虽然PR-10的生物学功能尚不清楚,但在植物受到非生物胁迫时,许多PR-10基因表达上调,如SA、CuCl2H2O2、寒冷、黑暗、伤人[34],以及生物压力,如病毒[35)、细菌(34,36)、真菌(37- - - - - -40和昆虫[41,42].我们在抗性树中观察到PR10与过氧化物酶同步表达,这表明该基因可能受到活性氧(如H2O2.然而,PR10 (CpPRI)作用于根结线虫的一种消化蛋白酶有隐姓埋名的女人[43].因此,PR10可能是一种蛋白酶,对抗PWN分泌的纤维素酶、-1,3-葡聚糖酶和果胶酸裂解酶[44- - - - - -46].
热休克蛋白(HSP) est从抗性树的文库中获得。通过qRT-PCR验证了HSP70在受感染抗性树中的稳定表达。HSP家族成员包括HSP70、HSP60和HSP90,除了应激反应外,还需要新生蛋白质的折叠和细胞内运输,统称为分子伴侣[47].在大豆与大豆囊线虫的相互作用中,Klink等[48]观察到HSP70和ROS响应基因的诱导,如脂氧合酶和超氧化物酶歧化酶分离自3 dpi合胞细胞,这些合胞细胞对大豆囊肿线虫感染表现出不相容的反应,并提示HSP70可能参与维持其他防御反应的正常功能环境。在目前的研究中,尚不清楚HSP70是如何参与PWN感染的防御反应的。
在抗性的SSH文库中,在1 dpi和3 dpi检测到编码CYP450、金属硫蛋白样蛋白和XET的三种est,它们依赖于在1 dpi和3 dpi时在易感树中显著下调的基因。在植物中,CYP450单加氧酶在木质素中间体、甾醇、萜烯、类黄酮、异类黄酮、呋喃香豆素和其他多种植物次生产物的合成中起着至关重要的作用[49].在针叶树中,二萜树脂酸是针叶树中对抗害虫和病原体的重要防御化合物[50- - - - - -52], CYP450s参与了针叶树油树脂的一套二萜树脂酸的形成;它们在体外和体内将枞二烯醇和枞二烯醛氧化为枞酸[53,54].基林和波尔曼[50,51]表明,油树脂可能含有特定的成分,这些成分可能对昆虫食草动物有毒性或威慑作用,或可能影响成虫或幼蜂的生理机能,从而阻止其成功定植或繁殖。本研究观察到的CYP450的下调可能导致PWN侵染松树中二萜树脂酸的减少。因此,PWN可能会扩大其入侵和栖息地,而在易感树中CYP450表达的快速降低可能会引发PWN的扩张。
金属硫蛋白参与ROS清除,在水稻中,在诱导物处理的细胞氧化爆发期观察到金属硫蛋白表达下调,而金属硫蛋白表达对防御信号传导很重要[55,56].金属硫蛋白的表达表明,在感染PWN的易感树中,ROS的积累和防御信号通路可能在1 dpi后就被诱导,而在3 dpi后的耐药树中则可能没有被诱导太多;这为在易感树中快速诱导防御反应基因(如编码致病相关蛋白的基因)提供了证据。
XET的作用被认为是通过重新排列纤维素微原纤维之间的承重木葡聚糖交联来调节膨胀驱动膨胀过程中的壁松动,其活性和表达已在生长组织中被检测到[57- - - - - -64].我们发现,PWN感染后,抗感树和易感树都下调了XET,且其调控诱导时间较早,约1 dpi。这些结果表明,在PWN感染过程中,XET的下调抑制了木质部、韧皮部或两者的细胞壁的扩张;或者,细胞壁可以通过HRGPs或扩展素的交联而固定。
在松树-线虫相互作用中,Myers [65和Futai [66的研究结果表明,少数活动寄生虫通过树木组织的入侵和快速迁移引起了一种先天的高度敏感反应,如薄壁组织死亡、毒素产生、油树脂和其他物质泄漏到管胞内。此外,PWN的种群分布遍及全身,一系列的过敏反应最终导致易感树种的树木死亡。在本研究中,防御反应基因、抗菌肽、sa响应基因如PR-1b、PR-2、PR-5和JA/ et响应基因如PR-6在易感树中诱导较快且水平较高。易感树木的这些防御反应不会有效地控制PWN线虫的侵袭,树木内部诱导的防御信号可能会通过细胞间的相互作用诱导一系列高度敏感的反应,从而导致死亡,如Myers [65和Futai [66建议。相比之下,适度的高敏感反应以及发病相关基因的上调,以及促进细胞壁强度的细胞壁相关基因的上调,将是一种非常有效的防御PWN感染的方法,因为这些事件可能会限制PWN的迁移。
方法
植物材料与线虫接种
一株耐药树“Namikata 73”,它是1990年至1998年从15,000个个体中选出的16个耐药品种中最耐药的品种[4],被种植在日本茨城市林产研究所,林木育种中心(FFPRI-FTBC)。在FFPRI-FTBC中也有一株“Kataura 1”品种的易感树,被选为生长性状的加株树。这两个无性系都是2005年在FFPRI-FTBC从原树中移植获得的。本研究使用的PWN是Ka-4分离株,自2003年以来一直用于松树枯萎病抗性育种项目。
2007年7月1日接种PWN。4个易感无性系和4个抗感无性系在主茎尖处剪去2cm,用钳子迅速压碎切缘,将1万条悬于100 μl无菌水中的线虫注入切缘。作为模拟样本,将无菌水(无线虫)注入另外4个易感无性系和4个抗感无性系的主茎切边。接种样品和模拟样品的茎组织在接种后1、3、7和14 dpi时在茎尖以下5 cm处采集。切下一段2厘米长的茎,立即在液氮中冷冻,并在-80°C保存。
RNA隔离
使用RNeasy植物小试剂盒(QIAGEN)按照制造商提供的协议从1.5 g茎(包括树皮和木材组织)中分离总RNA。使用GeneQuant pro分光光度计(Amersham Biosciences)测定RNA浓度。使用安捷伦2100生物分析仪(Agilent Technologies)检测RNA的完整性。
SSH文库构建,DNA测序,数据分析和dbEST提交
从三个时间点采集的样本构建了六个减法库;具体来说,两个库——一个来自抗药树,一个来自易感树——从每周采集1、3或7天的样本中构建。从抗性树的检测RNA中减去敏感树的驱动RNA构建了含有抗性树主要表达基因的正向文库,从敏感树的检测RNA中减去抗性树的驱动RNA构建了含有敏感树主要表达基因的反向文库。将抗性树14 dpi的检测RNA与易感树7 dpi的驱动RNA相减,构建了第7个文库;驱动RNA样本在7 dpi时采集,因为易感树在第14天死亡。使用SuperSMART cDNA Synthesis kit (Clontech)和Clontech PCR-Select cDNA Subtraction kit (Clontech)构建SSH文库。SSH产物使用QIAquick PCR纯化试剂盒(QIAGEN)进行纯化,并连接到pT7Blue载体(Merck4Biosciences)。蓝/白选择在含有氨苄西林、异丙基- d -硫代半乳糖苷和X-gal的平板上进行。随机选择克隆,使用从插入物的5'端识别矢量序列的引物进行单次测序。平均每个文库使用ABI 3130xl DNA分析仪(Applied Biosystems)对500个克隆进行测序。 The resulting sequences were trimmed and edited manually to identify the cloning vector sequences, adaptor sequences used in the SSH procedure, and regions of low-quality sequence using Sequencher 4.10.1 software (Gene Codes Corp.). Quality sequences greater than 100 bp were selected for further analysis. A total of 3,299 sequences were at least 100 bp and these sequences were submitted to the GenBank EST database with the GenBank accession numbers FY841122 to FY844420. To determine the number of contigs and EST singletons in each library, the ESTs were assembled using Sequencher 4.10.1 by the requirement for at least 98% identity over each 20 bp continuous sequence.
EST相似性搜索和功能分配
使用BLAST2GO程序的在线版本(BLAST2GO 2006;[15])。BLAST算法使用的阈值如下:(1)与NCBI非冗余蛋白数据库的blastx比较,阈值为e-6;(2)与NCBI核苷酸数据库的tblastx比较,阈值为e-6;(3)与NCBI EST数据库的tblastx比较,阈值为e-6;(4)与NCBI EST数据库的blast比较,阈值为e-10。此外,每个文库中的EST与DFCI Pinus Gene index release 8.0中的69,968个EST序列进行了比较,E值截断值为E -10。使用Blast2GO程序将ESTs分配到功能类别,并根据使用PGI数据库的BLAST分析结果进行人工注释。Blast2GO程序提取与NCBI的QBLAST识别的同源性相关的GO术语,并返回一个GO注释列表,表示为越来越专一的层次类别。因此,本研究提出的“层次”对应于每个主要氧化石墨烯类别的层次分类深度,最上面的一级代表生物过程、分子功能和细胞成分的最一般分类(主要氧化石墨烯类别)。
实时的存在
使用Primer Express软件v3.0 (Applied Biosystems)设计每个序列的引物对,并遵循制造商的引物设计指南(表2)3.).在SYBR Green实时RT-PCR检测中,使用StepOnePlus实时PCR系统(Applied Biosystems),利用抗性和易感树木的基因组DNA优化所有引物对的扩增效率。
RT-PCR使用用于制作SSH库的总RNA进行。对于每个时间点的模拟样本和参考样本(无线虫和水),从茎组织中提取总RNA,用于RT-PCR。使用PrimeScript II第1链cDNA合成试剂盒(TaKaRa)按照制造商的协议反转录总RNA(最终体积为20 μL, 500 ng)。实时定量PCR使用权力StepOnePlus实时PCR系统(应用生物系统)上的SYBR绿色PCR主混合(应用生物系统)。按说明书配制PCR混合物,包含300 nM的基因特异性正、反引物和4 μL的20倍稀释反转录反应(共5 ng),最终体积为20 μL。所有反应加热至95°C 10分钟;在95°C, 15 s, 60°C, 1 min的条件下进行40个循环。对PCR产物进行熔融曲线分析;培养条件为60 ~ 95℃,温升0.3℃s-1.延伸因子1- α被用作内参基因来规范转录谱。在接触线虫前,根据抗性树茎样本的转录水平对实时PCR数据进行校准;2——ΔΔCt方法用于量化相对转录本丰度[67].所有试验均采用三次重复进行,数据以三次重复的均值±标准差表示。通过熔融分析和琼脂糖凝胶电泳检测各扩增产物的特异性。
参考文献
- 1.
德摄Y,清原T:Bursaphelenchus在死松树的树林里。中国林业学报,2003,21(3):366 - 366。
- 2.
王铮,王春林,方志明,张德龙,刘亮,李锐,李铮,李建军,宋昌江:松树枯萎病致病机制的研究进展。中华微生物学杂志,2010,4:437-442。
- 3.
日本农林水产省林业厅:2009财政年度森林和林业趋势年度报告。东京,2010,(日语)
- 4.
东田田:我国松材枯萎病抗性育种的研究赤松而且p . thunbergii.大牛林林木育种中心,2004,20:83-217。(日语,英文摘要)
- 5.
Kishi Y:松木线虫和日本松Sawyer。东京:Thomas Co. Ltd;1995.
- 6.
福田K:松材枯萎病症状发展的生理过程和抗性机制。林业学报,1997,2:171-181。10.1007 / BF02348216。
- 7.
Nose M, Shiraishi S:用改良的LongSAGE技术接种松材线虫的抗性和非抗性日本黑松基因表达谱的比较。林病杂志,2010,41:143-155。
- 8.
Thompson GA, Goggin FL:韧皮食性昆虫诱导植物防御的转录组学和功能基因组学。中国生物医学工程学报,2006,29(5):555 - 566。10.1093 / jxb / erj135。
- 9.
Diatchenko L, Lau YF, Campbell AP, Chenchik A, Moqadam F, Huang B, Lukyanov S, Lukyanov K, Gurskaya N, Sverdlov ED, Siebert PD:抑制消减杂交:一种生成差异调控或组织特异性cDNA探针和文库的方法。美国国家科学研究院。1996年,93:6025 - 6030。10.1073 / pnas.93.12.6025。
- 10.
Gibly A, Bonshtien A, Balaji V, Debbie P, Martin GB, Sessa G:番茄抗性反应中差异调控基因的鉴定和表达谱分析黄定pv。实验.植物生态学报,2004,26(4):369 - 369。10.1094 / MPMI.2004.17.11.1212。
- 11.
Degenhardt J, Al-Masri AN, Kurkcuoglu S, Szankowski I, Gau AE:用抑制消减杂交的方法对苹果抗性和易感品种叶片中差异表达的转录本进行鉴定马吕斯有明显.中国生物医学工程学报,2005,29(3):326- 326。10.1007 / s00438 - 005 - 1136 - 7。
- 12.
Lin H, Doddapaneni H, Takahasi Y, Walker MA:葡萄对Xylella fastidiosa感染。植物生物学杂志,2007,7:8-10.1186/1471-2229-7-8。
- 13.
Tirumalaraju SV, Jain M, Gallo M:抗线虫和易感花生根系差异基因表达(英文)落花生hypogaea)品种对花生根结线虫(有arenaria休眠期。植物生理学报,2011,32(4):489 -492。10.1016 / j.jplph.2010.08.006。
- 14.
申宏,李宏,吴凯士,卢文华,顾耀斌,李凯杰:松木线虫接种上调基因的鉴定。植物学报,2009,29:411-421。10.1093 / treephys / tpn034。
- 15.
Conesa A, Gotz S,加西亚-戈梅斯JM, Terol J, Talon M, Robles M: Blast2GO:功能基因组学研究中用于注释、可视化和分析的通用工具。生物信息学,2005,21:3674-3676。10.1093 /生物信息学/ bti610。
- 16.
van Loon LC, Rep M, Pieterse CMJ:诱导防御相关蛋白在感染植物中的意义。植物酚学报,2006,44:135-162。10.1146 / annurev.phyto.44.070505.143425。
- 17.
大坪N, Mitsuhara I, Koga M, Seo S, Ohashi Y:乙烯促进tmv感染烟草坏死病变的形成和基本PR基因的表达。植物生理学报,1999,29(4):381 - 381。10.1093 / oxfordjournals.pcp.a029609。
- 18.
Glazebrook J:对生物营养性和坏死性病原体防御机制的对比。植物病理学报,2003,43:205-227。10.1146 / annurev.phyto.43.040204.135923。
- 19.
张丽娟,张丽娟,张丽娟,张丽娟。马铃薯包囊线虫的抗性和敏感性(英文)(Globodera在无广谱线虫抗性和存在广谱线虫抗性的情况下,对番茄品系的侵染效果明显英雄基因。植物与微生物的相互作用。2005,18:158-168。10.1094 / mpmi - 18 - 0158。
- 20.
Uehara T, Sugiyama S, Matsuura H, Arie T, Masuta C:水杨酸对番茄对包囊线虫的抗性和敏感反应有差异调控作用。植物生理学报,2010,29(4):359 - 359。10.1093 /卡式肺囊虫肺炎/ pcq109。
- 21.
吴本军,金军,鲍忠军,等拟南芥被水杨酸(SA)抑制,并诱导根系中SA独立的非耦合致病相关基因表达。植物生态学报,2008,29(4):424-432。10.1094 / mpmi - 21 - 4 - 0424。
- 22.
Hückelhoven R:细胞壁相关的疾病抗性和易感性机制。植物病理学报,2007,45:101-127。10.1146 / annurev.phyto.45.062806.094325。
- 23.
Deepak S, Shailasree S, Kini RK, Muck A, Mithöfer A, Shetty SH:富含羟脯氨酸的糖蛋白与植物防御。植物病理学杂志,2010,29(5):593 -593。
- 24.
Pereira CS, Ribeiro JML, Vatulescu AD, Findley K, MacDougall AJ, Jackson PAP:网络形成的扩展葡萄愈伤组织细胞在快速H2O2-诱导的初代细胞壁水合作用减少。植物生物学杂志,2011,11:106-10.1186/1471-2229-11-106。
- 25.
Barceló AR, Gómez Ros LV:植物细胞壁中的活性氧。植物信号传导中的活性氧种类。编辑:Del里约热内卢LA, Puppo A. Verlag Berlin海德堡:施普林格;2009;73-93。
- 26.
Dixon RA, Harrison MJ:植物中微生物防御基因的激活、结构和组织。王文杰,1990,28:165-234。
- 27.
Esquerré-Tugayé Marie-Thérèse, Campargue C, Mazau D:植物细胞壁富含羟脯氨酸的糖蛋白对微生物病原体及其激发子的响应。植物中致病相关蛋白。编辑:Datta SK, Muthukrishnan S. 1999, Boca Raton,伦敦,纽约:CRC Press LLC, 157-170。
- 28.
nebel A, De Almeida Engler J, Tire C, Engler G, Van Montagu M, Gheysen G:烟草伸长素基因对线虫侵染的诱导模式。植物生态学报,1998,19(5):369 - 371。
- 29.
Matsye PD, Kumar R, Hosseini P, Jones CM, Tremblay A, Alkharouf NW, Matthews BF, Klink VP:绘制在大豆防御反应中发生的细胞命运决定。植物生物学杂志,2011,32(4):513-528。10.1007 / s11103 - 011 - 9828 - 3。
- 30.
Lambert KN, Ferrie BJ, Nombela G, Brenner ED, Williamson VM:番茄根结线虫侵染后转录本快速积累基因的鉴定。植物病理学杂志,1999,30(4):341-348。10.1006 / pmpp.1999.0239。
- 31.
Schaff JE, Nielsen DM, Smith CP, Scholl EH, Bird DM:番茄的综合转录组分析揭示了糖醛基转移酶在番茄中的作用心肌梗死介导的抗线虫。植物生理学报,2004,24(3):379 - 379。10.1104 / pp.106.090241。
- 32.
石田田,贺吉津,福田,铃木,日本黑松对松材线虫侵袭的皮质反应。中国机械工程学报,2004,21(3):369 - 369。10.1139 / b93 - 168。
- 33.
草本D,杨美道T,村田M,渡边A, Isoda K,平尾T,山田T:松材线虫侵染抗性松树宿主反应和线虫分布的组织学观察,Bursaphelenchus xylophilus.林木健康。2010,14:98-100。(在日本)
- 34.
谢昱,陈振英,Brown RL, Bhatnagar D:两种致病相关蛋白10基因的表达和功能表征玉米.植物生理学报,2010,37(4):371 - 371。10.1016 / j.jplph.2009.07.004。
- 35.
徐平,Blancaflor EB, Roossinck MJ:尽管诱导了多种防御反应,番茄植株感染黄瓜花叶病毒D卫星RNA屈服于系统性坏死。植物生态学报,2003,26(4):366 - 366。10.1094 / MPMI.2003.16.6.467。
- 36.
Robert N, Ferran J, Breda C, Coutos-Thevenot P, Boulay M, Buffard D, Esnault R:不相容相互作用的分子表征葡萄树叶两pv。pisi:二苯乙烯合成酶和10类PR蛋白编码基因的表达。植物病理学杂志,2001,26(4):369 - 371。10.1023 /: 1011241001383。
- 37.
Jwa NS, Agrawal GK, Rakwal R, Park CH, Agrawal VP:一种新的茉莉酸诱导致病相关class10蛋白基因的克隆与表征,JIOsPR10,源自rice (栽培稻l .)幼苗的叶子。生物化学学报,2001,26(3):394 - 394。10.1006 / bbrc.2001.5507。
- 38.
Steiner-Lange S, Fischer A, Boettcher A, Rouhara I, Liedgens H, Schmelzer E, Knogge W:青稞叶片组织对侵染的不同防御反应Rhynchosporium secalis用真菌的致病基因产物进行治疗。植物生态学报,2003,26(3):394 - 394。10.1094 / MPMI.2003.16.10.893。
- 39.
MJ, Xu T, Barbara M, Iscove NN, Heath MC:从单个表皮细胞中产生的cdna表明,预测随后对锈病真菌感染的耐药性或易感性的差异基因表达发生在真菌进入细胞腔之前。植物生态学报,2003,26(4):356 - 361。10.1094 / MPMI.2003.16.9.835。
- 40.
陈振英,Brown RL, Damann KE, Cleveland TE: PR10在玉米中的表达及其对宿主抗性的影响黄曲霉感染和黄曲霉毒素的产生。植物病理学杂志,2010,11:69-81。10.1111 / j.1364-3703.2009.00574.x。
- 41.
Divol F, Vilaine F, Thibivilliers S, Amselem J, Palauqui JC, Kusiak C, Dinant S:植物对蚜虫侵袭的系统反应Myzus persicae的韧皮部芹菜graveolens.植物生物学杂志,2004,25(5):527 - 527。10.1007 / s11103 - 005 - 0338 - z。
- 42.
朱-萨尔兹曼K,萨尔兹曼RA,安杰,Koiwa H:高粱对韧皮部蚜虫防御决定因子的转录调控。植物生理学报,2004,24(4):347 - 347。10.1104 / pp.103.028324。
- 43.
Andrade LB, Oliveria AS, Ribeiro JK, Kiyota S, Vasconcelos IM, de Oliveria JT, de Sales MP:一种新的致病相关10类(PR-10)蛋白的作用Crotalaria pallida具有木瓜蛋白酶抑制根结线虫活性的根系有隐姓埋名的女人.农业食品学报,2010,58:4145-4152。10.1021 / jf9044556。
- 44.
Kikuchi T, Jones JT, Aikawa T, Kosaka H, Ogura N:松木线虫的糖基水解酶家族45个纤维素酶Bursaphelenchus xylophilus.中国科学(d辑),2004,38(2):361 - 361。10.1016 / j.febslet.2004.07.039。
- 45.
菊池,田谷,琼斯JT:松木线虫内生- β -1,3-葡聚糖酶的分子和生化特性研究Bursaphelenchus xylophilus通过细菌的基因横向转移获得。中国生物医学工程学报,2005,38(4):369 - 371。10.1042 / BJ20042042。
- 46.
菊池,田秀珍,田秀珍,陈晓燕,陈晓燕。松木线虫食道腺果胶酸裂解酶的克隆及鉴定Bursaphelenchus xylophilus.植物生态学报,2006,29(4):359 - 361。10.1094 / mpmi - 19 - 0280。
- 47.
Kanzaki H, Saitoh H, Ito A, Fujisawa S, Kamoun S, Katou S, Yoshioka H, Terauchi R:细胞质HSP90和HSP70是inf1介导的过敏性反应和非宿主耐药性的重要组成部分假单胞菌cichorii在烟草benthamiana.植物病理学杂志,2003,4:383-391。10.1046 / j.1364-3703.2003.00186.x。
- 48.
Klink VP, Overall CC, Alkharouf NW, MacDonald MH, Matthews BF:不亲和和亲和大豆合胞细胞的激光捕获显微解剖(LCM)和比较微阵列表达分析(大豆)被大豆囊肿线虫(异皮线虫属甘氨酸).植物学报,2007,26(4):359 - 359。10.1007 / s00425 - 007 - 0578 - z。
- 49.
植物细胞色素P450单加氧酶。植物生态学报,1998,16(3):354 - 354。
- 50.
Keeling CJ, Bohlmann J:萜类多样性的基因、酶和化学成分在针叶树对昆虫和病原体的构成和诱导防御中的作用。新植物学报,2006,30(4):657-675。10.1111 / j.1469-8137.2006.01716.x。
- 51.
Keeling CJ, Bohlmann J:针叶树中的二萜树脂酸。植物化学学报,2006,29(4):366 - 366。10.1016 / j.phytochem.2006.08.019。
- 52.
罗德明,李志明,李志明:火炬松二萜树脂酸的生物合成(松果体taeda):阿比二烯/左旋咪二烯合酶的功能表征(PtTPS-LAS) PtTPS-LAS和abietadienol/abietadienal氧化酶(PtAO, CYP720B1)的cDNA和亚细胞靶向性。植物化学学报,2006,29(4):359 - 359。10.1016 / j.phytochem.2006.01.011。
- 53.
松柏类植物二萜树脂酸生物合成:两种依赖于细胞色素p450的单加氧酶和一种参与松香酸生物合成的醛脱氢酶的表征。生物化学学报,1994,38(4):359 - 364。10.1006 / abbi.1994.1036。
- 54.
Ro DK, Arimura GI, Lau SYW, Piers E, Bohlmann J:火炬松枞二烯醇/枞二烯氧化酶PtAO (CYP702B1)是一种多功能、多底物的细胞色素P450单加氧酶。美国国家科学研究院。2005年,102:8060 - 8065。10.1073 / pnas.0500825102。
- 55.
黄海林,坂本T,川崎T, Umemura K, Shimamoto K:水稻小GTPase OsRac1对活性氧清除剂金属硫蛋白的下调作用。植物生理学报,2004,25(4):447- 456。10.1104 / pp.103.036384。
- 56.
秋本富山C、坂田K、Yazaki J、中村K、藤井F、Shimbo K、山本K、佐佐木T、岸本N、菊池S、涉谷N、南美E:水稻基因对N-乙酰壳寡糖激发子的响应:DNA微阵列综合分析,随机选择ESTs。植物生理学报,2004,24(3):366 - 366。10.1023 /: 1024890601888。
- 57.
Fry SC, Smith RC, Renwick KF, Martin DJ, Hodge SK, Matthews KJ:木糖葡聚糖内转糖基化酶,一种新的植物壁松酶活性。生物化学与工程学报,1998,21(3):369 - 369。
- 58.
Pritchard J, Hetherington PR, Fry SC, Tomos AD:木糖葡聚糖内转糖基化酶活性、微纤维取向和玉米根系生长区域细胞壁特性的概况。中国科学(d辑),1994,19(3):369 - 369。10.1093 / jxb / 44.8.1281。
- 59.
Palmer SJ, Davies WJ:相对元素生长速率、表皮细胞大小和木糖葡聚糖内转糖基化酶活性通过衰老玉米叶片生长区的分析。中国机械工程学报,1996,29(4):339-347。10.1093 / jxb / 47.3.339。
- 60.
大麦胚芽生长过程中两个xet相关基因的差异表达。实验学报,2000,51:847-852。10.1093 / jexbot / 51.346.847。
- 61.
Uozu S, Tanaka-Ueguchi M, Kitano H, Hattori K, Matsuoka M:水稻xet相关基因的鉴定。植物生理学报,2004,24(3):366 - 366。10.1104 / pp.122.3.853。
- 62.
Vissenberg K, Martinex-Vilchez IM, Verbelen J-P, Miller JG, Fry SC:木糖葡聚糖内转糖基化酶活性及其供体底物在延伸区的体内共域拟南芥的根源。植物学报,2000,12:1229-1237。
- 63.
Vissenberg K, Fry SC, Verbelen JP:根毛的起始与木糖葡聚糖内转糖基化酶作用的高度局部性增加相耦合拟南芥的根源。植物生理学报,2001,27(4):366 - 366。10.1104 / pp.010295。
- 64.
Lee J, Burns TH, Light G, Sun Y, Fokar M, Kasukabe Y, Fujisawa K, Maekawa Y, Allen RD:棉花木糖葡聚糖内转糖基化酶/水解酶基因及其在纤维伸长中的作用。植物生态学报,2010,32(4):371 - 371。10.1007 / s00425 - 010 - 1246 - 2。
- 65.
迈尔斯RF:松材线虫引起的松材枯萎病的发病机制,Bursaphelenchus xylophilus.中华寄生虫学杂志,1988,20:236-244。
- 66.
傅泰K:松材枯萎病是森林的一种流行病:森林微生物相互关系的注释(作者译)。2003年,东京:buni -ichi sogo shyuppan
- 67.
Livak KJ, Schmittgen TD:利用实时荧光定量PCR分析相关基因表达数据——ΔΔCt方法。方法,2001,25:402-408。10.1006 / meth.2001.1262。
确认
我们感谢东京大学的Dai Kusumoto博士和Toshihiro Yamada博士对我们研究的有益讨论、评论和建议;我们也感谢FTBC现场管理部门的同事们为植物材料的生产和培育所做的努力。这项研究得到了日本科学促进会(No. 20380085)的资助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
TH制备了RNA制剂,EST测序,EST数据分析,并起草了手稿。EF帮助对ESTs进行数据分析,并准备了DDBJ GenBank的提交。AW构思了这个项目,进行了PWN的接种和取样,并帮助起草了手稿。所有作者都参与了稿件的准备工作,并阅读并批准了最终稿。
平尾友典、富胜荣太郎和渡边淳都对这项工作做出了贡献。
电子辅料
实时荧光定量PCR检测未感染耐药和易感克隆中差异表达的转录本
附加文件3:。推测的功能基因(a)到(h)在易感文库中是清晰可识别的ESTs。推测的功能基因从(i)到(p)在抗性树中是清晰可辨的ESTs。伸长因子1- α (EF1a)作为内参基因,并相对于线虫感染前(0 dpi)抗性树的转录水平进行校准。数据以三次重复的平均值±标准差表示。同一字母设计的方法在PTukey s HSD检验< 0.05。(PDF 124 KB)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于这篇文章
引用这篇文章
王晓燕,王晓燕,王晓燕。松木线虫侵染抗性的研究进展松果体thunbergii使用抑制减法杂交。BMC植物杂志12,13(2012)。https://doi.org/10.1186/1471-2229-12-13
收到了:
接受:
发表:
关键字
- 基因本体论
- 减去抑制杂交
- 耐药树
- 大豆囊肿线虫
- 树脂道