摘要
背景
果实成熟是一个复杂的发育过程,受多种内外因素的影响。众所周知,钙处理延缓了果实的成熟和衰老。然而,潜在的分子机制仍不清楚。
结果
既往研究表明,钙/钙调素调控的SR/CAMTAs在调节营养组织的抗病性、冷敏感性和损伤反应方面具有重要作用。为了研究该基因家族在果实发育和成熟中的可能作用,我们克隆了7个SR / CAMTAs,指定为SlSRs,来自番茄,一种典型的果实作物。所有7个基因都编码具有保守的dna结合域和钙调蛋白结合位点的多肽。钙调蛋白以钙依赖的方式特异性结合到假定的靶点上。所有SlSRs在果实发育和成熟过程中均有高表达但差异表达。最明显的是,的表达SlSR2在果实发育和成熟的两个关键阶段——青熟期和败熟期几乎没有发现;而且SlSR3L而且SlSR4仅在果实组织中表达。在花后10 ~ 50天的发育过程中,7个基因的表达谱均为阴性SlSRS在成熟突变体中发生显著变化rin与野生型水果相比。相比之下,成熟突变体只有微小的变化也不而且Nr水果。此外,乙烯处理成熟的绿色野生型果实可以瞬时刺激所有基因的表达SlSR在一到两个小时内。
结论
这项研究表明SlSR表达受到两者的影响Rin-介导的发育网络和乙烯信号通路。结果表明,钙信号通过钙/钙调蛋白/SlSR相互作用参与了果实发育和成熟的调控。
背景
肉质水果是人类饮食的重要组成部分,提供纤维、矿物质和各种营养物质,促进人体健康。果实品质和采后货架期取决于对成熟的控制。水果的成熟是一个复杂的基因程序过程。传统上,果实可分为两种成熟类型:成熟期和非成熟期。番茄和苹果等更年期果实的成熟通常是由气体激素乙烯的生物合成引起的。相比之下,草莓和葡萄等非更年期水果的成熟是由呼吸速率变化不大的乙烯独立过程介导的(见[1- - - - - -3.])。这两种水果的成熟过程都受到环境因素的影响,如温度变化、伤害和病原体感染。钙已被证明是重要的控制果实成熟和品质延迟成熟和保持硬度。通过采前喷剂和采后钙处理(如浸渍和真空浸渍)增加果实的钙浓度,可保持果实的紧实性,防止非采后果实的腐烂[4- - - - - -10].钙被认为是通过与果胶交联而硬化细胞壁的关键元素[11,12].然而,钙阻碍果实成熟的分子机制仍不清楚。
介导植物对环境和激素信号的信号级联反应通常涉及钙作为第二信使(综述在[13- - - - - -19])。细胞钙的变化可以被作为信号传感器的钙结合蛋白感知和解释[20.].钙调蛋白是一种特征最明确的钙传感器,其功能是作为其他靶蛋白的调制器(综述在[21- - - - - -23])。这些蛋白在代谢、离子转运、转录调节、蛋白质磷酸化等关键功能中发挥作用。近年来,钙/钙调素调控的SR/CAMTA转录因子家族已被证明在植物对非生物和生物胁迫的响应中发挥重要作用。首次在植物中发现[24),SR / CAMTAS存在于迄今调查的所有植物和动物物种中。在植物中,SR / CAMTAs表现出对发育信号和各种环境信号的不同反应。例如,烟草的同类NtER1是乙烯响应基因,在衰老的花和叶中高度表达[24].番茄同源基因的表达ER66受乙烯刺激,红熟期果实组织中含量高于绿熟期[25].在拟南芥、6AtSR它们对各种外界信号的不同反应,如寒冷、受伤和干旱,以及乙烯和ABA等激素信号[26- - - - - -28].淘汰AtSR1导致水杨酸积累增加,增强抗病能力[29].水杨酸可降低ACC合成酶的表达,影响乙烯的生物合成[30.,31].AtSR1 / CAMTA3而且AtSR2 / CAMTA1对植物耐低温也很重要[32].敲除这些基因显著降低了耐寒性。受AtSR1 / CAMTA3包括PR基因、膨胀蛋白、β -1,3-葡聚糖酶、磷脂酶A2、加速细胞死亡蛋白6和衰老相关基因21 [33].的SR / CAMTA是CGCG的主要目标独联体-元素被认为是主要的钙调节元素独联体元(34和快速杀伤响应元件[35].因此SR / CAMTAS可能位于钙信号转导通路与乙烯、水杨酸、损伤和寒冷信号转导通路交叉的十字路口。所有这些信号通路都对水果的成熟和品质有重要影响。
为了研究钙调控的SR/CAMTA在果实成熟中的作用,我们选择了番茄这一典型果实作物,因为它具有成熟的分子基础特征和其经济重要性。番茄(茄属植物lycopersicum)是最重要的园艺作物之一。它已经成为研究肉质果实发育和成熟的一个极好的模型,因为高度发达的遗传和分子工具包是可用的[3.,36].代表成熟相关表型的单基因突变体已被很好地表征(综述在[37])。其中包括隐性成熟突变体rin(成熟抑制剂)和显性成熟突变体也不(non-ripening),Nr(never-ripe),中国北车(无色不成熟)和Gr(green-ripe) [38- - - - - -41].其中,Rin,也不基因分别编码一个MADS-box和一个nac域转录因子,并在关键的成熟活动(包括乙烯生产)上游起作用,这表明它们调节乙烯独立的成熟过程[39].相比之下,Nr直接参与乙烯依赖性成熟是因为Nr编码一个乙烯受体[38].在这里我们报告7个分离SlSR年代,SR / CAMTA番茄的同源基因及其在野生型果实和成熟突变体果实发育过程中的表达模式及其对乙烯处理的响应。
结果
七个SR / CAMTAS在番茄中表达
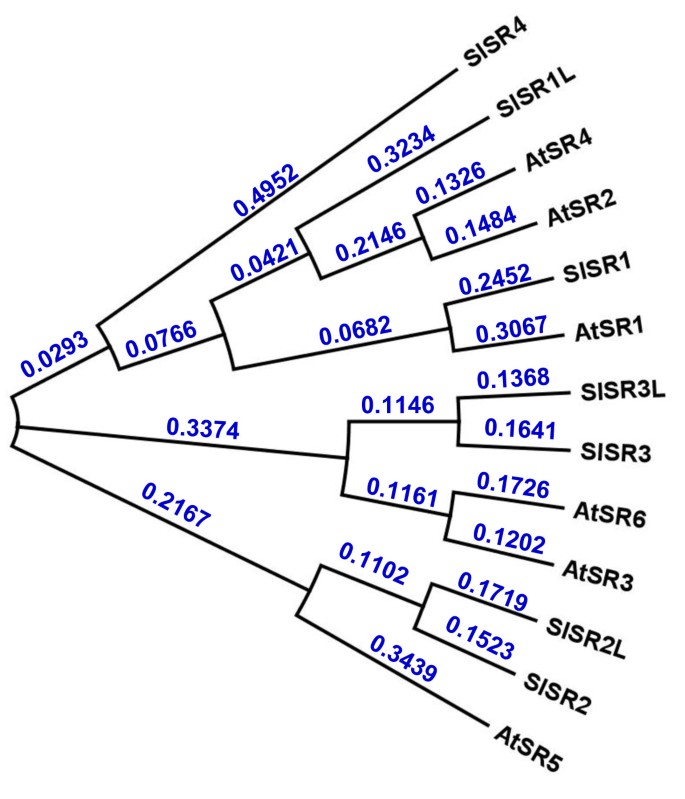
有六个SR / CAMTAs (AtSR1-6)在拟南芥基因组,它们都在组织中表达[26].要克隆番茄对应的氨基酸序列,6拟南芥采用SR/ camta检索GenBankhttp://www.ncbi.nlm.nih.gov以及SOL基因组网络上的番茄数据库http://solgenomics.net.有大约50个EST克隆和16个Unigenes具有线性同源性AtSR1-6但没有一个包含完整的编码区。对ESTs和Unigenes的分析表明,有7种推测SR / CAMTAs,指定为SlSRS,用番茄表示。为了获得全长cdna,从不同组织和水果果皮在几个发育阶段的总rna的混合物用于反转录和基因特异性引物扩增(表1).克隆其中三个的引物,SlSR1, SlSR2而且SlSR3的氨基酸序列比对,直接从现有的Unigenes/ESTs中设计拟南芥AtSRs在n端和c端区域。其余4个基因缺失的5'和3'端通过5'和/或3' RACE获得。进一步利用基因特异性引物对扩增其全长编码区。四个中的三个SlSR被命名为SlSR1L, SlSR2L而且SlSR3L因为它们表现出高度的同源性SlSR1, SlSR2而且SlSR3,分别。然而,SlSR4和其他六个人都没有亲密关系。所有SlSR编码的多肽具有SR/CAMTA结构特征:n端为保守的dna结合域,c端为钙调蛋白结合域,中间为锚氨酸重复序列SlSRS是真正交线SR / CAMTA转录因子家族。如附加文件所示1,推导出的7个氨基酸序列SlSRS的整体相似度和一致性分别为45-76%和30-65%。然而,在n端dna结合域和c端钙调蛋白结合域的氨基酸序列有超过80-93%的相似性和63-88%的一致性。的系统发育关系SlSR编码多肽和拟南芥进一步分析atsr(图1).SlSR1与AtSR1关系密切,SlSR2和SlSR2L与AtSR5同属一个枝系,SlSR3和SlSR3L与AtSR3和AtSR6非常相似。相比之下,SlSR1L与AtSR2、AtSR4和SlSR1的同源性较弱,而SlSR4与AtSR2、AtSR4和SlSR1都没有密切的亲缘关系SlSR4是番茄中相对较新的成员吗SR / CAMTA基因家族。
7种番茄编码氨基酸序列的系统发育分析SlSR年代和SR / CAMTA直接同源的拟南芥.对应的GenBank cDNA登录号或基因识别号如下:SlSR1, GU170838;SlSR1L JN558810;SlSR2 JN566047;SlSR2L JN566048;SlSR3 JN566049;SlSR3L JN566051;SlSR4 JN566050;AtSR1 AT2G22300;AtSR2 At5G09410; AtSR3, At3G16940; AtSR4, At5G64220; AtSR5, At1G67310; AtSR6, At4G16150. Numbers at tree nodes indicate the genetic distances in substitutions per site.
所有SlSRS编码钙/钙调蛋白结合蛋白
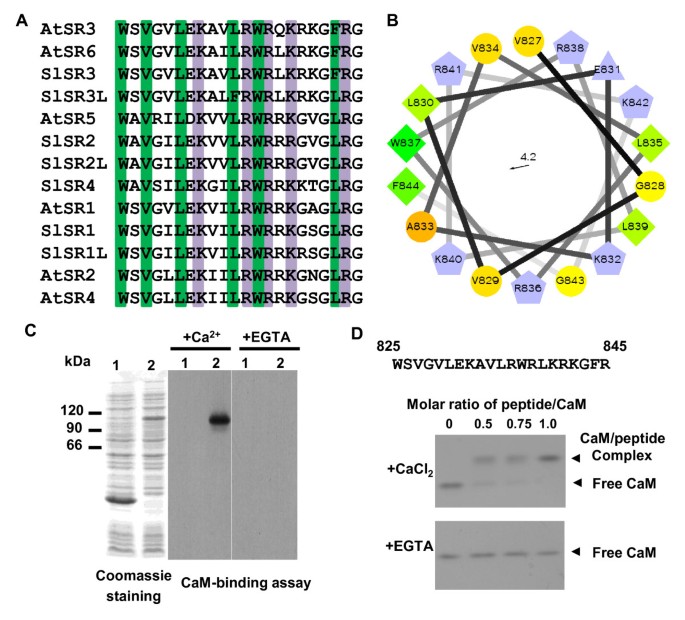
迄今为止报道的所有SR/CAMTA蛋白都是钙/钙调蛋白结合蛋白。以确定番茄是否SlSRS编码钙/钙调蛋白结合蛋白,其推测的钙调蛋白结合区域与蛋白中的相应区域对齐拟南芥AtSRs(图2).atsr中的对应位点是钙/钙调素结合区域,与slsr中的对应位点具有非常高的同源性(总体> 90%的氨基酸序列相同)。在该区域内,SlSR1、SlSR1L、SlSR2、SlSR2L和SlSR4与AtSR1的氨基酸序列几乎相同,而SlSR3和SlSR3L与AtSR3的氨基酸序列高度相似。它们都能形成基本的两亲α-螺旋结构[42,可被钙调素识别。我们以SlSR3为例,展示了基本的两亲性α-螺旋结构投影,其中疏水的一半在左边,基本的亲水的一半在右边(图2 b).此外,iptg诱导细菌表达的全长编码区SlSR3与His融合在一起6-tag产生了一个重组SlSR3带,通过SDS-PAGE测定其分子质量约为105 kDa(图5)2摄氏度).钙调蛋白叠加试验表明,在钙存在的情况下,钙调蛋白结合SlSR3,但在钙螯合剂EGTA存在的情况下,钙调蛋白不结合SlSR3。最后,使用凝胶迁移率移位法确认钙调蛋白与SlSR3中已知的钙调蛋白结合位点的特异性结合(图二维).合成一个与SlSR3的21个氨基酸钙调蛋白结合区相对应的肽,在钙或EGTA存在下与钙调蛋白孵育。用天然PAGE分离后,在钙的存在下观察到钙调肽复合物。随着肽钙调素比的增加,复带的强度增加。相比之下,在EGTA的存在下,只有游离钙调素条带出现。为了研究这7个slsr是否都是钙/钙调蛋白结合蛋白,我们合成并测定了SlSR1、SlSR2/SlSR2L和SlSR4中与钙调蛋白结合区域相对应的另外3个多肽。凝胶迁移率测定显示,只有在钙存在的情况下,钙调素才会与三种多肽结合2).由于SlSR1和SlSR3L与SlSR1L和SlSR3的对应区域分别只包含一个或两个保守的氨基酸取代,结果表明所有的slsr都是钙/钙调蛋白结合蛋白。
slsr是钙/钙调蛋白结合蛋白.(一个)对已知的slsr钙调素结合区域与atsr的对齐。保守氨基酸用绿色(疏水残基)或紫色(带正电荷残基)突出显示。(B)螺旋轮投影显示SlSR3的钙/钙调蛋白结合域的基本两亲性α-螺旋结构。(C)钙调素结合叠加试验表明,只有在钙存在的情况下,钙调素才能结合SlSR3。蛋白质总量大肠杆菌携带pETSlSR3的细胞通过SDS-PAGE分析,转移到PVDF膜上,与生物素化钙调素孵育。1、无IPTG诱导;2、IPTG的添加。(D)凝胶迁移率转移试验显示,负载钙的钙调蛋白与合成肽结合,该肽对应于SlSR3中假设的钙调蛋白结合区域(肽氨基酸序列显示在面板D顶部)。箭头表示游离钙调蛋白(CaM)和肽-钙调蛋白复合体的位置。
SlSRS在番茄组织和果实发育过程中存在差异表达
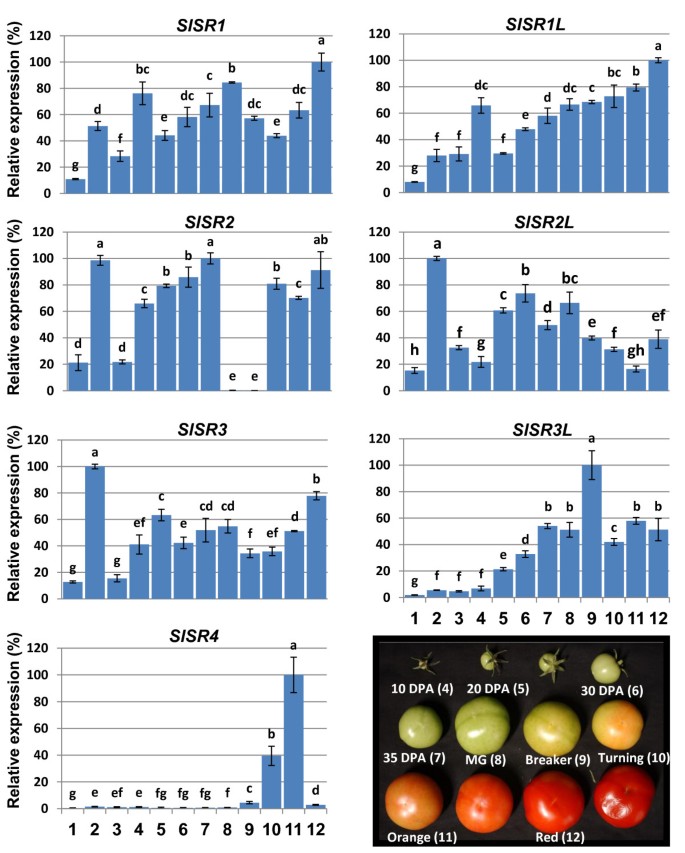
我们克隆了7个SlSRs从一系列番茄组织中提取,表明有7个表达的番茄SR / CAMTAs.研究这些基因的时空表达谱SlSRs,用RT-qPCR方法测定其转录本在不同发育阶段和不同组织中的相对含量。的所有表达水平与的表达有关肌动蛋白基因如图所示3..总的来说,所有的表达水平SlSR叶、花含量较低,果实含量较高。有些基因,比如SlSR2, SlSR2L而且SlSR3,在根中高表达。所有的SlSRS在不同组织和果实发育阶段表现出不同的表达模式。
在果实发育和成熟过程中,SlSR1表达峰分别出现在10 DPA、青熟期和红熟期。SlSR1L25dpa后,在果实膨大和成熟过程中,转录本逐渐增加SlSR2L呈钟形曲线表达模式,在成熟青期前后达到峰值。SlSR3表达量在不同时期差异最小(差异小于2倍),红熟期表达量最高。的表达SlSR3L而且SlSR4被证明是水果特异性的。此外,SlSR4只表达在果实中,而SlSR3L转录水平在打破阶段达到峰值。最有趣的表达模式是SlSR2.它在果实的所有发育阶段都有高表达,除了成熟初期的成熟青果和破果果,这两个阶段的表达是检测不到的。要排除独一无二的可能性SlSR2表达模式是罗格斯品种特有的,我们对Moneymaker和Alisa Craig的果实进行了检测,发现SlSR2在成熟的绿色阶段也几乎检测不到转录(数据未显示)。总的来说,这些结果表明SlSRS在果实发育和成熟过程中表达差异。
的表达SlSR番茄成熟突变体果实中的S含量
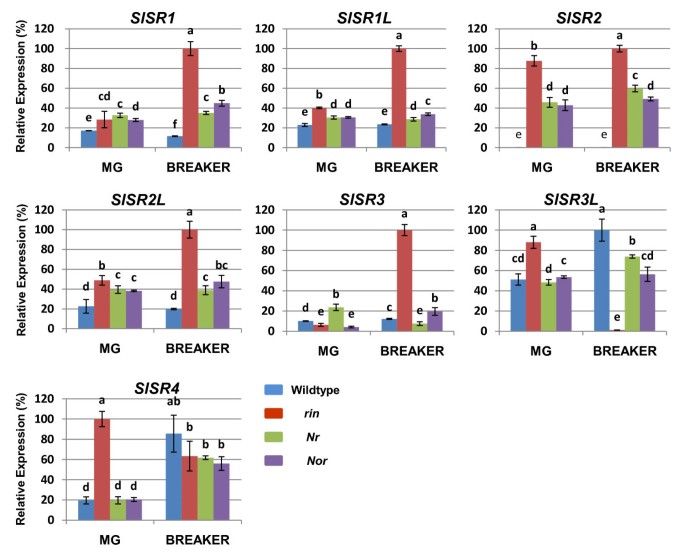
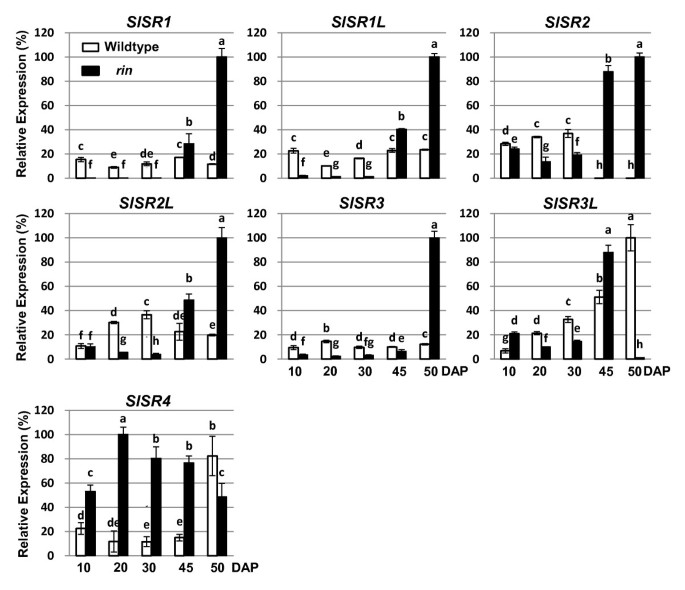
在成熟的最初阶段,番茄果实从成熟的绿色(达到最大尺寸但果皮和果肉仍是绿色)过渡到破绿色(颜色变化和成熟的其他方面最初明显)。几种番茄自发成熟突变体,包括rin身上也而且Nr,果实大小正常,但不成熟。以确定是否SlSRS与这些突变体中缺失的果实成熟基因是否有关系,我们比较了这7个突变体的表达水平SlSR野生型果实在成熟绿期和破裂期的s与突变型果实在45 DPA和50 DPA的等时期的s(图4).
在成熟绿期/ 45dpa,表达水平SlSR1, SlSR1L而且SlSR2L与野生型果实相比,突变型果实的含量一贯较高。具体地说,SlSR1L而且SlSR2L表达水平大约高出两倍rin,和高50%左右也不而且Nr,而对于SlSR1这三种突变体的转录量都高出了大约50%。对于这两个SlSR3L而且SlSR4,相对于wildtype增加的表达只在rin突变体。相比之下,表达SlSR3更低rin而且也不,而在Nr它是野生型水果的两倍。最显著的变化发生在SlSR2而且SlSR4.SlSR2在野生型果实中不表达,但在rin,以及在Nr而且也不(大约40%相对于rin).SlSR4表达水平是对照组的五倍rin与野生型水果相比。
在破发阶段/50 DPA,最明显的趋势是,除SlSR4的表达水平SlSRS显著改变rin与野生型水果相比(图4).SlSR3L完全被抑制了rin而其他5个基因的表达水平至少比野生型高5倍。相比之下,除了SlSR2,差异SlSR相对于野生型果实的表达水平则不明显也不而且Nr水果。与成熟绿期的表达谱相似,SlSR2野生型果实中未检测到转录本,但3个突变体果实中均有丰富的转录本,以野生型果实中转录本含量最高rin.相比之下,SlSR4野生型与成熟突变体果实的表达差异不显著。因此,总的来说rin到目前为止,变异对SlSR在果实发育的成熟青、破等阶段的基因表达。
我们进一步调查表达是否SlSR基因的差异rin与野生型果实成熟前的绿色阶段进行比较SlSR10、20和30 DPA时的mRNA水平(图5).所有的SlSR年代除了SlSR4表达较低rin果实在45dpa前成熟,相当于野生型果实的成熟绿期。相比之下,SlSR4表达明显增高rin在10dpa、20dpa、30dpa和45dpa时,野生型果实的含量高于野生型,然后在50dpa(相当于破裂期)时下降到野生型水平以下,部分原因是由于野生型果实的含量增加了5倍SlSR4wildtype的文本。因此,SlSR表达模式在rin突变体果实在发育过程中,与野生型果实在成熟青果和破果果等同阶段发生的模式相比有显著变化。这些差异SlSR表达最可能与果实成熟而不是膨胀生长有关rin产出正常大小的果实。
SlSRS是早期乙烯反应基因
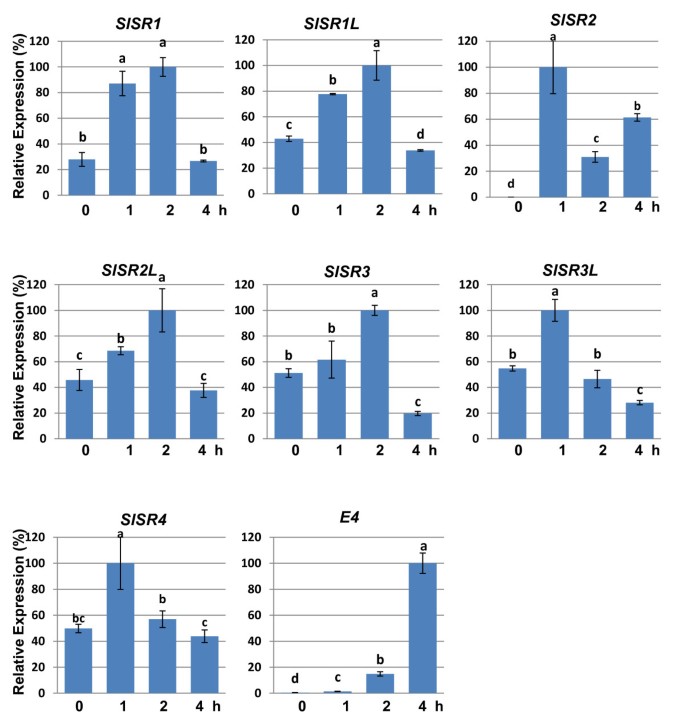
乙烯是控制番茄果实成熟和衰老的主要植物激素。在烟草和拟南芥,SR / CAMTAS对乙烯处理有反应[24,26,28].以确定是否所有SlSR番茄果实的基因对乙烯有反应,我们选择成熟的青期果实进行乙烯处理,因为这个阶段内源性乙烯很少产生。如图所示6,所有的表达SlSRS经外源乙烯处理后瞬时上调。乙烯对所有基因的刺激或诱导都非常迅速,通常在处理后1小时内。特别是,SlSR2,在成熟绿期不表达,100ppm乙烯处理后1小时内诱导。SlSR1被乙烯刺激约四倍,乙烯处理两小时后达到峰值。剩下的基因在一小时内被乙烯刺激了大约两倍,在处理后一两个小时达到峰值。对于每一个SlSR的例外SlSR2乙烯对表达的刺激是短暂的,即4小时后转录水平与0小时相同或更低。相比之下,SlSR2从1到2小时,转录下降了约3倍,但从2到4小时,增加了2倍。E4,一个特征良好的乙烯响应基因[43],表明乙烯处理是有效的。这些结果表明SlSRS是早期乙烯反应基因。
讨论
在这项研究中,我们分离出了7个SR / CAMTA番茄的正交物,指定为SlSRS,均在果皮组织中表达。分析SlSR在果实发育和成熟过程中的表达模式表明,这些基因的表达水平受到发育调控。此外,乙烯还能刺激它们的表达。果实成熟是一个复杂的发育过程,在番茄等更年期果实中,成熟是由发育信号和气体激素乙烯的组合控制的。对番茄自发成熟突变体的特性分析有助于阐明这种有用的模式果实中涉及更年期成熟的控制元素和调控途径。Nr是第一个克隆的成熟基因,并被证明编码乙烯受体[38].的突变Nr影响乙烯的感知,从而阻碍果实成熟。Gr是另一种与乙烯信号传递相关的基因[41].另一方面,Rin身上也而且中国北车它们都编码了转录因子或调节转录的蛋白质[39,40].的rin变异是特别有趣的,因为它已经被用来培育许多商业番茄杂交品种,表现出果实成熟缓慢和长保质期。RIN编码SEPALLATA分支的MADS-box蛋白[39].同系物的RIN已被发现在葡萄中表达44和草莓[45因此,这表明它可能参与了果实的发育和成熟在换气和非换气的果实。在番茄中,两者都是rin而且也不通过对乙烯诱导基因表达的监测显示,水果对乙烯有反应。然而,两个突变体在乙烯处理后都不会成熟,这表明这两个基因都位于关键成熟活动(包括乙烯生产)的上游,并以乙烯独立的方式发挥作用[3.,39].目前还不清楚这些转录网络之间的层次结构,以及依赖乙烯和不依赖乙烯的途径如何协调控制成熟过程。我们的结果表明SlSRS的变化rin身上也而且Nr突变体与野生型果实比较,最显著的变化发生在rin水果。这就提出了一种可能性SlSR的下游目标RIN.然而,由于乙烯处理会刺激SlSR表达式,SlSRS既受乙烯独立发育网络的调控,也受乙烯介导的信号传导的调控。
钙被认为是一种通用的第二信使,它通过钙调素等钙传感器介导植物对外界刺激的反应和激素变化[14,16,18- - - - - -23].钙处理已用于延缓果实成熟和衰老,并维持果实品质[5- - - - - -7,9,46].像所有其他事情一样SR / CAMTAS的特征,七个SlSRS编码一种钙/钙调素结合转录因子。据报道钙/钙调蛋白结合于SR / CAMTA年代拟南芥而且果蝇是至关重要的在活的有机体内函数(29,47,48].因此,可以合理推测,钙通过形成钙/钙调蛋白复合物激活slsr,进而调节下游基因的表达,从而调节果实发育和成熟。slsr可能是调控果实发育和成熟的多种信号通路的协调者。类似于RIN身上SR / CAMTA在非更年期果实和更年期果实中都存在,因此在非更年期果实的发育和成熟过程中也有作用。
根据它们的表达模式,SlSR两者有一些相似之处,也有很大的不同。相似之处包括它们对乙烯处理的积极响应和它们在rin与野生型果实的突变体比较。然而,这七个SlSRS在果实发育和成熟过程中表现出不同的表达模式,这表明虽然它们有一些冗余,但单个基因可能具有特定的功能。有趣的是,SlSR3L,一个水果特异性基因,被抑制在破碎当量阶段(50 DPA)rin突变体果实。相反,其他SlSR年代,除了SlSR4,在破断阶段表达显著增加rin与野生型水果相比,表明SlSR表达是由积极和消极的RIN-介导的果实成熟网络。值得注意的是SlSR2与其他6种相比,在发育果实中表现出独特的表达模式SlSRS,即果实膨大期表达量高,成熟青期和破果期完全抑制,破果后成熟迅速诱导。番茄β-半乳糖苷酶基因也有类似的表达模式TBG5[49].β-半乳糖苷酶对发生在细胞分裂、细胞生长和果实成熟过程中的半纤维素修饰很重要。调查两者之间是否有任何关系将是很有趣的SlSR2细胞壁改造。
之前的一项研究表明SR/CAMTAs能够识别CGCG-box独联体元(26].例如AtSR1, an拟南芥SR/CAMTA同源谱,靶向于启动子中的CGCG-boxEDS1,是水杨酸生物合成的关键基因[29].水杨酸已被证明可以下调ACC合成酶的表达,从而减少乙烯的生物合成[30.,31],也会延迟果实成熟[50,51].根据微阵列分析,其他可能的目标AtSR1包括编码扩张蛋白、β-1,3-葡聚糖酶、磷脂酶A2、加速细胞死亡蛋白6和衰老相关蛋白21的基因[33].假设slsr同样通过与CGCG-box结合来调控基因表达独联体-元素,可以通过搜索在启动子区域携带CGCG-box(s)的番茄基因来识别slsr靶点。
结论
我们分离出了7个SlSR基因,番茄SR / CAMTA直接同源。的表达水平SlSRS的差异主要由发育信号和乙烯调节。重要的是,SlSR果实发育过程中的表达模式发生改变rin它是一种番茄成熟突变体SlSR位于下游的Rin监管网络。SlSRS编码钙/camodulin调控的转录因子。我们的数据表明SlSRS作为信号节点候选节点,连接发育信号、乙烯介导信号和钙介导信号,从而调节果实发育和成熟。进一步的功能研究SlSRS将有助于阐明这些过程中涉及的信号网络。
方法
植物材料和处理
番茄植物(茄属植物lycopersicumcv Rutgers)在温室中生长,温度28°C,光周期16 h/8 h(明暗)。成熟的突变体rin身上也而且Nr都有罗格斯大学的背景花朵在开花时被标记并人工授粉,根据DPA(开花后的天数)或根据其表面颜色(美国农业部设定的成熟阶段)收获果实。3个成熟突变体到青熟和破绿的等效阶段分别为45 DPA和50 DPA [49].
乙烯处理实验用的果实在成熟青熟阶段采收,并在常温下孵育过夜,以减少采收冲击。之后,这些水果被密封在一个装有100ppm乙烯的罐子里,在不同的时间段内保存。从果实中切除的果皮组织被冷冻在液氮中,并储存在-80°C。
番茄的克隆SR / CAMTA基因
六个拟南芥SR / CAMTA利用正交法对番茄EST克隆集合和Unigene数据库进行检索http://solgenomics.net/tools/blast/index.pl.用于克隆的引物SlSRS分别从假定编码区的5'端和3'端根据对的线性对齐进行设计拟南芥基因。对于缺少5'和/或3'编码区末端的cDNA片段,使用5'和/或3' RACE试剂盒(Invitrogen, USA)进行5'-RACE和/或3'-RACE检测,按照制造商说明获取缺失的区域。SlSRs基因经PCR扩增可以DNA聚合酶(Invitrogen, USA)从不同番茄组织和果实不同阶段的cdna混合中提取,使用基因特异性引物(表2)1).PCR片段加入腺嘌呤后在TA克隆试剂盒(Invitrogen, USA)中克隆,并从两端测序。
RNA提取和RT-qPCR
按照制造商的说明(Qiagen, USA),使用RNeasy Plant Mini Kit从冷冻组织中分离总RNA。在dna酶切后,用纳米滴分光光度计测量260 nm处的吸光度,以确保在样品之间的cDNA合成反应中使用等量的RNA。用1 μg总RNA与寡核苷酸(dT)合成cDNA18引物按照Superscript III试剂盒(Invitrogen, USA)的说明进行。利用SYBR Green检测化学试剂在CFX96实时系统(Bio-RAD, USA)上对cDNA进行实时定量PCR (RT-qPCR)分析。利用Primer3软件设计基因特异性引物http://frodo.wi.mit.edu/primer3/.这些引物列于表中1.通过绘制Ct值(阈值周期)与log[cDNA]的关系,分别计算所有引物对的效率系数E。使用以下热循环条件:95°C 2分钟,然后进行45个循环,95°C 5秒,60°C 20秒。所有的反应都在三个独立的样品中重复进行。PCR后进行熔融曲线分析。使用循环阈值(Ct) 2分析特异性mRNA水平的相对定量ΔΔCt方法。相对表达量使用管家基因actin(登录号:X55749)归一化,并以百分比表示(最高值= 100%)。学生的t测试(P0.05)用于测定不同组织和果实发育阶段、野生型和突变型果实或乙烯处理之间个体基因相对表达的显著差异(Microsoft Excel 2007)。
系统发育分析
利用genous软件对编码的SR/CAMTA全长蛋白进行多重序列比对http://www.geneious.com/.采用邻接法进行系统发育重建。利用Jukes-Cantor模型计算遗传距离为每个位点的替换。
钙调素叠加试验
通过PCR扩增得到SlSR3基因的模板SlSR3 -含有适当限制位点的特定寡核苷酸(濒死经历我在5英尺的尽头和BamHI在3'端)克隆到下游的His6标记在pET-30b表达载体中(Novagen, USA)。将PCR扩增得到的克隆片段克隆到pET-30b载体中,从pET-30b克隆位点两侧进行测序,确定其核苷酸序列。重组蛋白SlSR3在大肠杆菌菌株BL21(DE3) pLysS。蛋白质通过sds -聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,电转移到聚偏二氟乙烯膜(Millipore)上,用生物素化钙调素与1 mM CaCl处理2或先前所述的2mm EGTA [24].
肽结合钙调素
合成肽是在Genemed Synthesis Inc.制备的。含有240 pmol (4 μg)牛钙调素(Sigma)和不同数量的纯化合成肽的100 mm Tris-HCl (pH 7.2)和1 mm CaCl的样品22 mM EGTA总体积为30 μl,室温孵育1 h。样品采用非变性PAGE进行分析,如所述[24].
SlSRs加入数据
番茄入库数量SlSR基因库中的基因:SlSR1GU170838;SlSR1LJN558810;SlSR2JN566047;SlSR2LJN566048;SlSR3JN566049;SlSR3LJN566051;SlSR4, JN566050。
缩写
- 凸轮:
-
钙调蛋白
- 分区:
-
花后天数
- EGTA:
-
乙烯glycol-bis (2-aminoethylether)N, N, N', N'-tetraacetic酸
- IPTG:
-
异丙基β-D-1-thiogalactopyranoside
- 也不:
-
番茄不成熟突变体
- Nr:
-
番茄不成熟突变体
- 种族:
-
cDNA末端的快速扩增
- rin:
-
番茄成熟抑制突变体
- sds - page:
-
十二烷基硫酸钠聚丙烯酰胺凝胶电泳。
参考文献
- 1.
Matas AJ, Gapper NE, Chung MY, Giovannoni JJ, Rose JKC:提高果实品质和保质期的生物和基因工程。生物技术学报,2009,20(2):197-203。10.1016 / j.copbio.2009.02.015。
- 2.
Gillaspy G, Bendavid H, Gruissem W:水果的发展视角。植物生态学报,2004,25(4):369 - 369。
- 3.
乔凡诺尼JJ:果实发育和成熟的基因调控。植物学报,2004,16:S170-S180。10.1105 / tpc.019158。
- 4.
Abbott JA, Conway WS, Sams CE:采后氯化钙浸润对苹果质地属性的影响。中国地质大学学报(自然科学版),2004,25(6):369 - 369。
- 5.
Conway WS, Sams CE:采后钙、镁或锶渗入对苹果腐烂、硬度、呼吸和乙烯产生的影响。中国地质大学学报(自然科学版),1998,25(2):369 - 369。
- 6.
Martin-Diana AB, Rico D, Frias JM, Barat JM, Henehan GTM, Barry-Ryan C:钙对延长新鲜完整和最低限度加工水果和蔬菜的保质期的研究进展食品科技,2007,18(4):210-218。10.1016 / j.tifs.2006.11.027。
- 7.
Park S, Cheng NH, Pittman JK, Yoo KS, Park J, Smith RH, Hirschi KD:表达拟南芥H+/Ca2+转运体的番茄钙含量增加,保质期延长。植物生理学报,2004,25(3):366 - 366。10.1104 / pp.105.066266。
- 8.
Poovaiah BW:钙在延长水果和蔬菜贮藏期中的作用。Technol-Chicago食物。1986,40(5): 86-89。
- 9.
Raese JT, Drake SR:采前喷钙对苹果和梨品质的影响。植物营养学报,1998,16(9):1807-1819。10.1080 / 01904169309364651。
- 10.
Saftner RA, Bai JH, Abbott JA, Lee YS:含有丙酸钙、氯化钙或氨基酸钙螯合物的卫生浸渍剂可以保持鲜切蜜瓜块的质量和货架稳定性。采后生物技术,2003,29(3):257-269。10.1016 / s0925 - 5214(03) 00041 - 3。
- 11.
M:钙与细胞壁。植物细胞环境学报,1998,7(6):441-448。10.1111 / j.1365-3040.1984.tb01434.x。
- 12.
刘辉,陈福生,杨海生,姚永忠,龚晓忠,辛燕,丁春春:钙处理对杏果实螯合可溶性果胶纳米结构及理化性质的影响。中国食品科学,2009,42(8):1131-1140。10.1016 / j.foodres.2009.05.014。
- 13.
普瓦雅BW, Reddy ASN:植物钙信使系统。植物生态学报,1998,6(1):47-103。10.1080 / 07352688709382247。
- 14.
钙:信号传导中的银弹。植物生态学报,2001,20(3):381- 394。10.1016 / s0168 - 9452(00) 00386 - 1。
- 15.
Sanders D, Pelloux J, Brownlee C, Harper JF:钙在信号交叉口。植物生物学杂志,2004,14(增刊):S401-S417。
- 16.
植物细胞中的Ca2+信号:一个大网络!植物生态学报,1998,1(5):428-433。10.1016 / s1369 - 5266(98) 80268 - 9。
- 17.
熊亮,朱建军,熊林,等:低温、干旱和盐胁迫下的细胞信号转导。植物生物学杂志,2002,14(增刊):S165-S183。
- 18.
钙调素是植物中一种多功能钙信号转导因子。新生理学家,2001,151:35-66。10.1046 / j.1469-8137.2001.00154.x。
- 19.
雷迪·爱生,阿里·GS, Celesnik H, Day IS:钙-和钙/钙调蛋白调节基因表达的作用。植物细胞学报,2011,23(6):2010-2032。10.1105 / tpc.111.084988。
- 20.
Luan S, Kudla J, Rodriguez-Concepcion M, Yalovsky S, Gruissem W:钙调素和钙调神经磷酸酶b样蛋白:植物中特定信号响应耦合的钙传感器。植物工程学报,2004,15(4):369 - 369。
- 21.
Bouche N, Yellin A, sneden WA, Fromm H:植物特异性钙调素结合蛋白。植物学报,2005,36(4):356 - 366。10.1146 / annurev.arplant.56.032604.144224。
- 22.
杨涛,普瓦雅。植物钙/钙调素介导的信号网络。植物科学进展,2003,8(10):505-512。10.1016 / j.tplants.2003.09.004。
- 23.
Zielinski RE:植物中的钙调素和钙调素结合蛋白。植物生理学报,1998,19(4):369 - 371。10.1146 / annurev.arplant.49.1.697。
- 24.
杨晓峰,杨晓峰,普维雅BW:一种早期乙烯上调基因,编码一种与植物衰老和死亡有关的钙调素结合蛋白。中国生物医学工程学报,2000,29(4):369 - 369。
- 25.
Zegzouti H, Jones B, Frasse P, Marty C, Maitre B, Latche A, Pech JC, Bouzayen M:番茄果实中乙烯调控基因的表达:通过差异显示分离的乙烯响应和成熟相关新基因的表征。植物学报,1999,18(6):589-600。10.1046 / j.1365 - 313 x.1999.00483.x。
- 26.
杨涛,Poovaiah BW:植物钙调素结合/CGCG盒子dna结合蛋白家族参与多种信号通路。中国生物医学工程学报,2002,27(4):369 - 369。10.1074 / jbc.M207941200。
- 27.
Bouche N, Scharlat A, sneden W, Bouchez D, Fromm H:多细胞生物中钙调素结合转录激活子的新家族。中国生物医学工程学报,2002,27(4):369 - 369。10.1074 / jbc.M200268200。
- 28.
Reddy ASN, Reddy VS, Golovkin M:一种来自拟南芥的钙调蛋白结合蛋白,由乙烯诱导,含有dna结合基序。中国生物医学工程学报,2000,29(3):369 - 369。10.1006 / bbrc.2000.4032。
- 29.
杜丽,Ali GS, Simons KA,侯杰,杨涛,Reddy AS, Poovaiah BW: Ca(2+)/钙调素调节水杨酸介导的植物免疫。自然学报,2009,457(7233):1154-1158。10.1038 / nature07612。
- 30.
Lee S, Hong JC, Jeon WB, Chung YS, Sung S, Choi D, jog YH, Oh BJ:水杨酸诱导的非成熟期辣椒生果实对炭菌的保护作用与成熟果实的抗性相似。植物细胞学报,2009,28(10):1573-1580。10.1007 / s00299 - 009 - 0756 - 5。
- 31.
王丽娟,陈世杰,孔伟峰,李世盛,Archbold DD:水杨酸预处理减轻了桃子冷藏过程中的冷害,影响了桃子的抗氧化系统和热休克蛋白。采后生物技术,2006,41(3):244-251。10.1016 / j.postharvbio.2006.04.010。
- 32.
Doherty CJ, Van Buskirk HA, Myers SJ, Thomashow MF:拟南芥CAMTA转录因子在冷调节基因表达和耐寒性中的作用。植物细胞学报,2009,21(3):972-984。10.1105 / tpc.108.063958。
- 33.
Galon Y, naave R, Boyce JM, Nachmias D, Knight MR, Fromm H:钙调素结合转录激活因子(CAMTA) 3介导拟南芥生物防御反应。中国生物医学工程学报,2008,32(6):943-948。10.1016 / j.febslet.2008.02.037。
- 34.
Kaplan B, Davydov O, Knight H, Galon Y, Knight MR, Fluhr R, Fromm H:在拟南芥中,由胞质Ca2+瞬变引起的快速转录组变化揭示了abre相关序列作为Ca2+响应顺式元素。植物学报,2006,18(10):2733-2748。10.1105 / tpc.106.042713。
- 35.
Walley JW, Coughlan S, Hudson ME, Covington MF, Kaspi R, Banu G, Harmer SL, Dehesh K:机械应力通过一种新型顺式元件诱导生物和非生物应激反应。科学通报,2007,3(10):1800-1812。
- 36.
Fernandez AI, Viron N, Alhagdow M, Karimi M, Jones M, Amsellem Z, Sicard A, Czerednik A, Angenent G, Grierson D,等:番茄基因表达和沉默的灵活工具。植物生理学报,2009,29(4):369 - 369。10.1104 / pp.109.147546。
- 37.
京晶:水果成熟突变体提供了成熟控制的见解。植物生物学杂志,2007,10(3):283-289。10.1016 / j.pbi.2007.04.008。
- 38.
Wilkinson JQ, Lanahan MB, Yen HC, Giovannoni JJ, Klee HJ:永不成熟编码的信号转导的乙烯诱导组件。科学通报,1995,27(5):527 - 527。10.1126 / science.270.5243.1807。
- 39.
Vrebalov J, Ruezinsky D, Padmanabhan V, White R, Medrano D, Drake R, Schuch W, Giovannoni J:在番茄成熟抑制因子(Rin)位点上,一个与果实成熟相关的MADS-box基因。科学通报,2002,29(5):356 - 356。10.1126 / science.1068181。
- 40.
Seymour GB, Manning K, Tor M, Poole M, Hong Y, Thompson AJ, King GJ, Giovannoni JJ:编码SBP-box转录因子的基因中自然发生的表观遗传突变会抑制番茄果实成熟。植物学报,2006,38(8):948-952。10.1038 / ng1841。
- 41.
Barry CS, Giovannoni JJ:番茄绿熟突变体的成熟受到一种蛋白质的异位表达的抑制,该蛋白破坏乙烯信号。美国国家科学院。中国农业科学,2006,29(6):633 - 636。10.1073 / pnas.0602319103。
- 42.
王晓燕,王晓燕,王晓燕。植物谷氨酸脱羧酶钙调蛋白与植物谷氨酸脱羧酶钙调蛋白结合域相互作用的分子和生化分析。植物生理学报,2003,21(2):381 - 381。10.1104 / pp.108.2.551。
- 43.
高曼,张志强,张志强,等。果实成熟基因启动子中乙烯响应区的鉴定。美国国家科学院。中国科学:地球科学,2004,25(3):359 - 359。10.1073 / pnas.90.13.5939。
- 44.
Boss PK, Vivier M, Matsumoto S, Dry IB, Dry MR:一种来自葡萄(Vitis vinifera L.)的cDNA,与AGAMOUS和SHATTERPROOF同源,不仅在花中表达,而且在浆果发育过程中也有表达。植物生物学杂志,2001,25(5):541-553。10.1023 /: 1010634132156。
- 45.
Seymour GB, Ryder CD, Cevik V, Hammond JP, Popovich A, King GJ, Vrebalov J, Giovannoni JJ, Manning K:一个SEPALLATA基因参与草莓(FragariaXananassa Duch.)果实的发育和成熟,草莓是一种非更年期组织。实验学报,2011,62(3):1179-1188。10.1093 / jxb / erq360。
- 46.
povaiah BW:钙在成熟和衰老中的作用。土壤科学进展,1998,10(1-2):83-88。10.1080 / 00103627909366880。
- 47.
龚萍,韩娟,Reddig K,李海生:dCAMTA潜在的二聚区域是终止苍蝇视觉反应的关键。中国生物医学工程学报,2007,29(4):359 - 359。10.1074 / jbc.M701223200。
- 48.
韩建华,龚萍,Reddig K, Mitra MY,郭萍,李海生:果蝇CAMTA转录因子增强了G蛋白偶联光受体视紫红质的失活。中国生物医学工程学报,2006,29(4):449 - 457。10.1016 / j.cell.2006.09.030。
- 49.
Smith DL, Gross KC:在番茄果实发育过程中,至少有7个-半乳糖苷酶基因家族被表达。植物生理学报,2004,25(3):369 - 369。10.1104 / pp.123.3.1173。
- 50.
Valero D, Diaz-Mula HM, Zapata PJ, Castillo S, Guillen F, Martinez-Romero D, Serrano M:采后水杨酸、乙酰水杨酸或草酸处理延缓甜樱桃成熟,增强其生物活性化合物和抗氧化能力。农业化学学报,2011,59(10):5483-5489。
- 51.
水杨酸对园艺作物采后生理的影响。食品科学与技术,2010,21(10):502-509。10.1016 / j.tifs.2010.07.009。
确认
我们要感谢加州大学戴维斯分校番茄遗传资源中心提供的种子rin身上也而且Nr变种人和艾丽莎·克雷格我们还感谢诺曼·利夫西提供的出色技术援助。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
TY构思了这项研究,设计了所有的实验并进行了实验在硅还有生化分析。HP进行了所有的基因表达研究和统计分析。TY、BDW和WSC对实验数据进行解读并参与撰写手稿。所有的作者都阅读并认可了最终的手稿。
电子补充材料
12870 _2011_977_moesm1_esm.pdf
附加文件1:slsr的氨基酸序列比对拟南芥直接同源。n端附近的保守dna结合区、中间的锚结蛋白重复位点和c端附近的钙/钙调蛋白结合位点被标记出来。对应的GenBank cDNA登录号或基因识别号如下:SlSR1, GU170838;SlSR1L JN558810;SlSR2 JN566047;SlSR2L JN566048;SlSR3 JN566049;SlSR3L JN566051;SlSR4 JN566050;AtSR1 AT2G22300; AtSR2, At5G09410; AtSR3, At3G16940; AtSR4, At5G64220; AtSR5, At1G67310; AtSR6, At4G16150. (PDF 2 MB)
12870 _2011_977_moesm2_esm.pdf
附加文件2:钙/钙调蛋白与来自SlSR1、SlSR2/SlSR2L和SlSR4的多肽结合。合成了三个多肽,对应于SlSR1、SlSR2/SlSR2L和SlSR4的钙调蛋白结合域。凝胶迁移率测定显示,钙负载钙调蛋白在钙存在的情况下与所有三种多肽结合。箭头表示游离钙调素(CaM)和肽-钙调素复合物的位置。(pdf 81kb)
权利与权限
本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(http://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于本文
引用本文
杨涛,彭H,惠特克,B.D.et al。钙/钙调素调控的SR/CAMTA基因家族在番茄果实发育和成熟过程中的特性研究。植物生物学12日,19(2012)。https://doi.org/10.1186/1471-2229-12-19
收到了:
接受:
发表:
关键字
- 水杨酸
- 水果发展
- 番茄果实
- 棒曲霉素
- 乙烯处理