摘要
背景
在开花植物中,雄性生殖器官的发展被控制恰恰是成功的施肥和繁殖。尽管对趋势促进了贡献的基因知识,但控制该过程的监管机制仍然不清楚。
结果
在这项研究中,我们分析了无菌突变体早期花药的转录组谱中流动孢子(自动对盘及成交系统),发现有1368个基因表达差异自动对盘及成交系统与野生型花药相比,影响其代谢、转运、泛素化和胁迫反应。此外,在差异表达基因的启动子中缺乏显著富集的潜在AMS结合位点(E-box),表明AMS依赖于其他转录因子的花药转录组的调控既有直接的也有间接的。结合自动对盘及成交系统与其他两个不育突变体的转录组图谱,spl /出处和ems1 /练习在美国,至少有一个突变体改变了3058个基因的表达。我们的研究主要转录因子家族的表达模式,如Bhlh,MyB.和麦斯,提示一些已知的花药发育基因的紧密同源物也可能具有类似的功能。此外,不同器官基因表达水平的比较表明,花药偏好基因在花药发育中起重要作用。
结论
分析自动对盘及成交系统花药转录组及其与spl /出处和ems1 /练习花药发现了重叠和不同的调控基因,包括那些编码转录因子和其他蛋白质的基因。这些结果支持了一个扩大的调控网络早期花药发展,为未来的实验提供了一系列的假设。
背景
在开花植物中,雄性生殖器官称为雄蕊,每个雄蕊由花丝和花药组成。1].花药细胞减数分裂产生小孢子,小孢子进一步发育成成熟的花粉粒[2].因此,花药发育是实现花粉形成和受精成功的关键[3.-6.].根据形态特征,花药发育可分为两个阶段,再进一步分为14个花药阶段[5.那7.那8.].在第1期(花药第1至8期)开始时,雄蕊原基有3层,从表面到内部L1-L3。L1细胞随后形成表皮,L3细胞形成血管和结缔组织。一些L2细胞发育成原始孢子细胞,然后分裂成壁细胞和初级孢子生细胞。在l2谱系中,额外的细胞分裂和分化在花药5期建立了一个独特的四裂结构。每个裂片由中央的花粉母细胞组成,外层内膜、中层和内绒毡层包围。花粉母细胞在第5-6期进行减数分裂,在第7期产生四分体。在第8阶段四分体胼胝质壁溶解释放小孢子。在第2阶段,小孢子在第9-12阶段进行有丝分裂并发育成成熟的花粉粒。同时,小孢子和绒毡层都沉积了花粉壁物质。 After the degeneration of tapetum, the mature pollen is released and is able to start pollination.
以往的研究表明,花药早期发育依赖于转录调控和细胞-细胞间的通讯[5.那7.-9.].这SPOROCYTELESS(SPL) /喷嘴(唠叨)基因是最早调控花药细胞命运决定的基因之一。10那11].SPL /出处被激活的AG, ABC模型中的C功能基因[12-14].SPL /出处早在花药2-5期就表达,在SPL /出处导致壁细胞和产孢细胞分化失败,从而阻碍花药壁和小孢子细胞的形成[15那16].
男性过剩SPOROCYTES1(EMS1) 和毯DETERMINANT1(TPD1)也是男性生育所必需的,其表达高峰较晚出现在第5阶段[17].EMS1是一种富含亮氨酸重复受体样蛋白激酶(LRR-RLKs),而TPD1可能是其配体[15那18那19].在这两个EMS1和TPD1.突变体,花药以绒毡层为基础产生更多的小孢子细胞,表明相邻细胞层之间的通讯决定了原孢子细胞子代的细胞命运,以形成正常的花药壁[17].除了EMS1和TPD1,其他细胞-细胞通讯相关基因也参与花药发育,如体细胞胚胎发生受体样激酶1/2 (SERK1/2),RECEPTORLIKE蛋白质KINASE2(RPK2.)[20.那21].
在花药裂片形成时,功能失调的TAPETUM1(DYT1) 和自动对盘及成交系统,编码两个BHLH转录因子,是随后阶段的Tapetal函数所必需的[22那23].在dyt1,Tapetum细胞含有扩大的液泡和减少细胞质。这dyt1减数细胞有较薄的胼胝质壁,不能完成细胞质分裂并最终解体。核糖核酸原位杂交实验表明DYT1在花药第5至6期达到表达高峰[22].自动对盘及成交系统在减数分裂时的功能,略高于DYT1.在里面自动对盘及成交系统突变体,小孢子细胞可以完成减数分裂,但绒毡层细胞提前坍塌,小孢子在花粉第一次有丝分裂前降解[23].除这些调控因子外,花药中也有大量其他基因的表达,其中一些基因的突变通过影响花药细胞的早期形成、绒毡层的形成、减数分裂或花粉成熟而导致雄性不育[5.那7.那16那24-28].
然而,由于许多基因家族成员的功能冗余,单基因突变表型的微妙性,以及可能掩盖花药功能的早期表型,正向遗传学在揭示花药基因功能方面存在局限性[29].表达谱已经变得越来越有用,并可能绕过正向遗传学的限制。近年来,微阵列的全球基因表达谱已被用于检测花的基因表达,并为了解生殖发育提供线索。然而,大多数研究雄蕊表达谱是通过分析雄性不育突变体整个花序的转录本进行的[30.-35,而不是花药本身[32].目前关于特定器官的转录组信息很少,特别是对于拟南芥谁的男性生殖器官很小[32那33那36].因此,微阵列技术的检测灵敏度较低,可能会阻碍混合花组织中花药特异或优先基因的检测。正如上面提到的,SPL, EMS1和自动对盘及成交系统在花药发育的不同阶段具有重要的功能,尽管它们的表达在时间上有重叠[10那17那22那23].因此,分析它们对花药转录组的共同和不同影响,可以为基因调控网络的研究提供一些思路[37-39].
要获得关于MeIosis阶段附近的转录om的更多信息,我们将在4到7阶段收集了波特自动对盘及成交系统突变体和野生型拟南芥尽管解剖正在发育的花药耗时且技术上困难,因为我们想要鉴定受其影响的基因自动对盘及成交系统可能太稀释的突变以检测使用全部花序的RNA。这自动对盘及成交系统转录组数据和与之前数据的比较spl和EMS1条件下(32]提供有关早期开发的详细信息。另外,具有其他花动器官的已知信息拟南芥,我们鉴定了在减数分裂前后花药早期发挥作用的基因。我们发现许多转录因子基因在花药发育早期优先表达,如Bhlh,MyB.,麦斯.根据系统发育研究,密切相关的同源物被假设具有冗余或发散的功能[40-42].此外,进一步调查器官特异性转录组的研究表明,早期制剂发育中有特异性和非特异性转录因子的重要性。我们提出了一种扩展的基因监管网络,有助于在早期制剂发育期间进行时间和空间事件的精确调节。
结果与讨论
鉴定AMS调节的基因
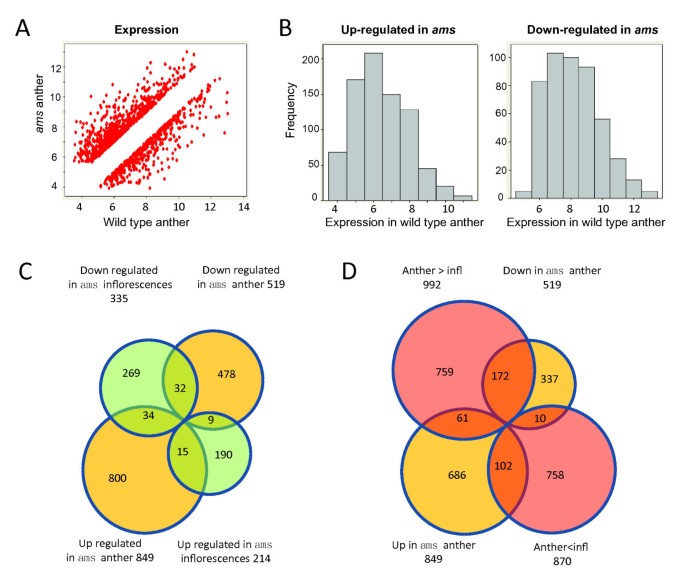
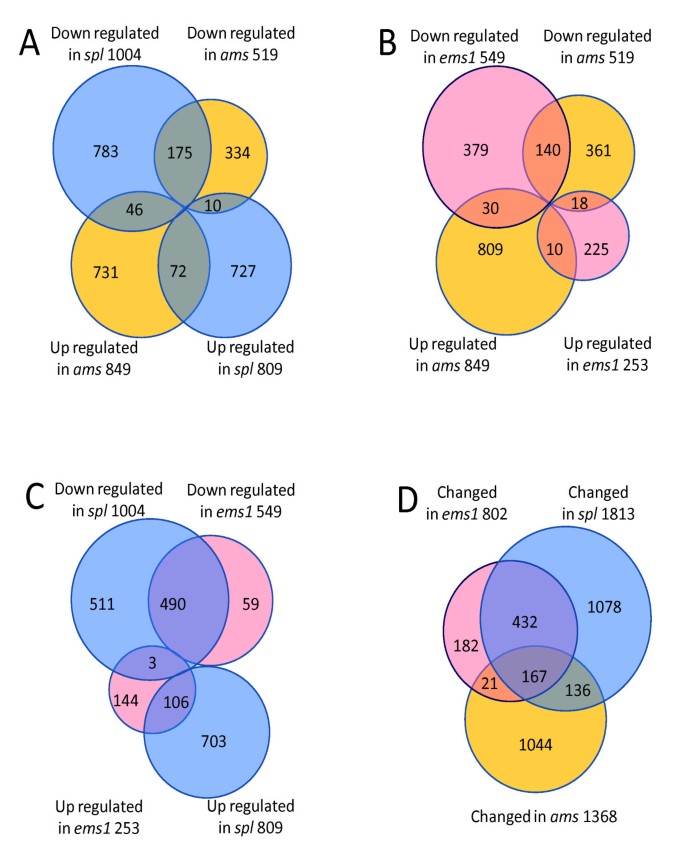
为了研究减数分裂前后绒毡层发育和功能的相关基因,我们从野生型和花药中分离出4 ~ 7期花药的总RNA自动对盘及成交系统琥珀植物亚马逊ATH1微阵列分析。我们包括每种基因型的三种生物重复,结果是高度可重复的(具有高于0.96的相关系数,附加文件中的补充图11).我们发现了1368个基因在自动对盘及成交系统与野生型花药相比,差异至少为2倍(P < 0.05)2)[32那43].1368个基因的散点图显示,它们包括不同水平表达的基因(图)1 a, B, 1圣附加文件2);此外,具有更高表达的基因自动对盘及成交系统比野生型往往具有低野生型表达,而那些低于正常表达的人自动对盘及成交系统倾向于以更高的水平表达(图1 b).
最近,Xu等报道了549个基因的差异表达自动对盘及成交系统花蕾与野生型芽相比,在四种不同阶段使用两种颜色阵列,包括在减数分裂时差异表达的134个基因(附加文件2)[35].在我们研究中发现的1,368个基因中,Xu等人也识别了90个。在花蕾(图1 c).因为自动对盘及成交系统是在近花药6期(减数分裂)通过小孢子形成表达的,我们的早期花药样品允许检测早期AMS在转录组调控中的功能,并在没有其他花组织稀释的情况下敏感地检测表达变化,结果发现了额外的1278个基因(478个下调基因和800个上调基因自动对盘及成交系统花药),与野生型有差异表达自动对盘及成交系统花药(图1 c).
尽管如此,我们的结果和前一项研究都检测到受到显着影响的90个基因自动对盘及成交系统突变(附加文件2;数字1 c)[35].其中一些基因在两项研究之间表达换档方向显示了相同的方向;但是,其他人有相反的方向(图1 c).其中34个基因在自动对盘及成交系统花药比野生型花药在表达水平降低自动对盘及成交系统花序与野生型花序相比(附加文件2);9基因表现出相反的趋势。这些差异可能是由于稍后包括后阶段的抽样花药与花蕾的差异,尽管其他可能性无法排除。我们观察到我们在细胞阶段的花药转录组和发表的花芽转录组之间更类似的表达模式(附加档案2).519个基因中有172个下调自动对盘及成交系统在野生型花药中表达明显高于花序,而849个上调基因的102则显示出这种模式(p值<0.05,图1 d,附加文件2),提示花药优先表达是导致两项研究差异的原因之一。也有可能是损失自动对盘及成交系统功能可能影响花发育的其他方面而不是花药的发育,虽然没有表型变化显示。
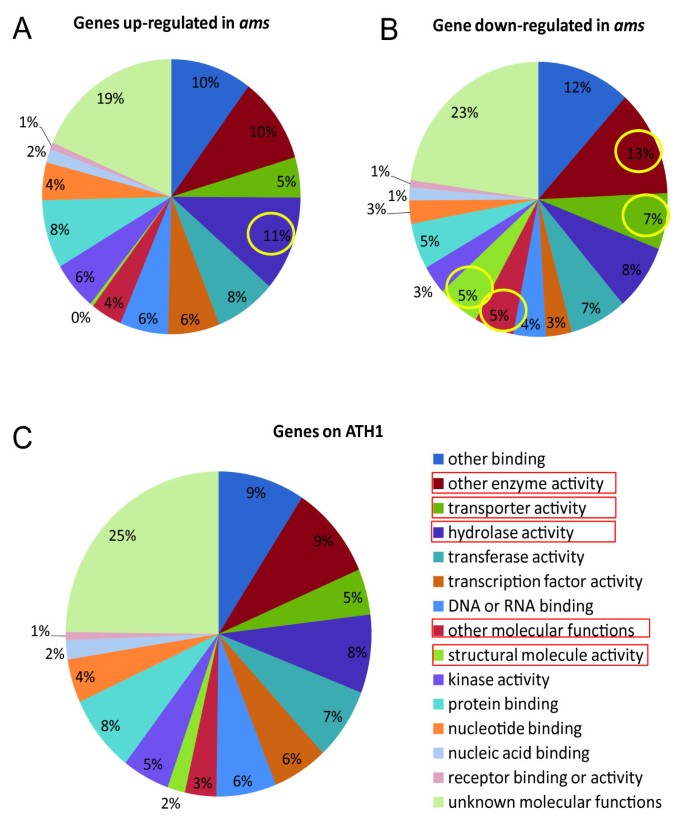
我们的花药转录组结果的GO分类分析表明,酶类别,转运蛋白,结构和其他分子蛋白在具有升高的表达水平的那些中的基因中过于表示的基因中自动对盘及成交系统与野生型相比(图2A-C.,附加文件3.).为进一步研究不同表达模式基因的推定功能自动对盘及成交系统从花序中排出,然后我们将GO分类应用于所有新发现的差异表达基因自动对盘及成交系统花药。我们发现,在那些表达水平降低的人群中,某些类别被富集自动对盘及成交系统如结构分子,转运体,氧化还原酶(补充图2和3在附加文件1).这些分类与绒毡层中非常活跃的代谢活动有关,提示AMS在绒毡层中调节代谢功能方面发挥积极作用。同时,被激活的基因中富集了具有离子结合、糖基转移酶和水解酶活性的基因自动对盘及成交系统.
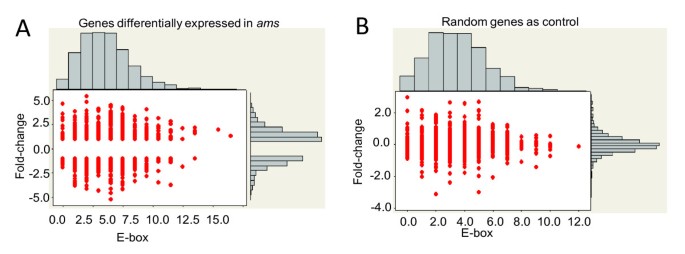
AMS作为一个公认的bHLH转录因子,具有与bHLH结合位点结合的能力(E-box: CANNTG)。体外和在活的有机体内[35].为了找到候选AMS靶基因,我们在1 kB上游序列内搜索了在基因的1 kB上游序列中的E型盒元素,在具有统计上显着的差异表达自动对盘及成交系统野生型花药(图3&3 b).与芯片上随机选择的基因相比,我们没有发现假定启动子区域的e -box数量与基因表达的倍数变化之间具有统计学意义的交互作用。AMS的活性结合位点可能不仅位于被分析的1 kb区域,还可能位于编码区域的进一步上游甚至下游。也有可能是一些基因在自动对盘及成交系统花药是由AMS间接调控的,因此在其启动子中不包含AMS结合位点。
在男性生殖过程中,AMS影响磷酸化、胞外分泌、应激反应和泛素-蛋白酶体途径推定功能的基因
体细胞和生殖细胞均受到明显的影响自动对盘及成交系统突变花药,形态学和转录组学[23那35].具体来说,这自动对盘及成交系统花序显示预测参与代谢的基因表达减少,如脂质合成相关基因[35].我们的花药转录组数据为代谢相关基因的表达模式提供了空间上更具体的信息(在附加文件中补充图41)并且表明,参与细胞壁形成,脂质合成和次生代谢的基因的表达水平明显改变自动对盘及成交系统花药,与形态缺陷一致。
有趣的是,32个位于叶绿体DNA上的基因表达减少自动对盘及成交系统而淀粉和蔗糖相关基因增加4.,附录图41).此外,更多代谢相关基因的表达发生了转移,尤其是糖基转移酶(P.< 0.01,补充附录图51,)。此外,具有调控功能的基因如激酶和转录因子的表达水平也发生了变化(supplementary fig 6-8,见附加文件)1).有趣的是,在中间编码具有表达偏移的激酶的大多数基因被激活自动对盘及成交系统突变体,提示AMS可能具有负调控作用(补充文件中的补充图4)1).
此外,我们发现可能参与囊泡运输的基因在自动对盘及成交系统,包括编码两个陷阱蛋白的基因和与该过程相关的其他有关的其他组织:3个语法,3个肌球蛋白重链和2个Clathrin蛋白(附加文件4.,附录图91).细胞内贩运机械如圈套复合物在动物和植物开发中是重要的[44那45];例如,一个SNARE蛋白SEC22在花中优先表达,对配子体发育至关重要[46].其他囊泡转运基因,如AtVAM3编码与阳果相关的蛋白质,显示在真空组件中起作用拟南芥[47].对于凹形转运基因的正常表达可能有助于在观察到的异常真空的胶质细胞自动对盘及成交系统花药(23].
我们还发现,应激反应基因的表达水平在自动对盘及成交系统(附加文件4.,补充图10在附加文件中1),特别是增加了10个抗病基因的表达和编码呼吸爆发氧化酶的两个基因。这些发现与最近的研究一致,表明多个非生物胁迫会导致雄性不育,如极端温度和干旱[48-50].此外,还发现了一些应激诱导和/或激素相关基因,表达改变,包括RD22, aba诱导的对脱水反应的基因;VSP1,一个ja诱导基因;EPS1.,一个可能作用于SA上游的基因;CCR1.,一种冷的诱导基因;编码TIR-NBS-LRR类蛋白的四种抗病基因;和三种热冲击基因,建议内部和外部信号之间的复杂相互作用调节花药开发和/或职能[51].
另一个调控途径被激活自动对盘及成交系统是泛素 - 蛋白酶体途径(附加文件4.),编码E3泛素连接酶亚基的基因表达增加(附加文件补充图111)[52].以往的研究表明,泛素-蛋白酶体途径在胚胎发生、激素信号、光响应、花发育、自交不亲和和衰老等方面发挥重要作用[48那52那53].我们的研究结果表明,该通路也可能受到AMS的调控。AMS可能直接调控泛素-蛋白酶体途径中某些基因的表达;另外,AMS可能通过AMS靶基因或可能通过受损蛋白的积累间接影响这些基因的表达,然后诱导泛素-蛋白酶体途径[54].需要进一步的实验来检验这些假设。
特异性或优先基因在差异表达的基因中过于代表自动对盘及成交系统突变体
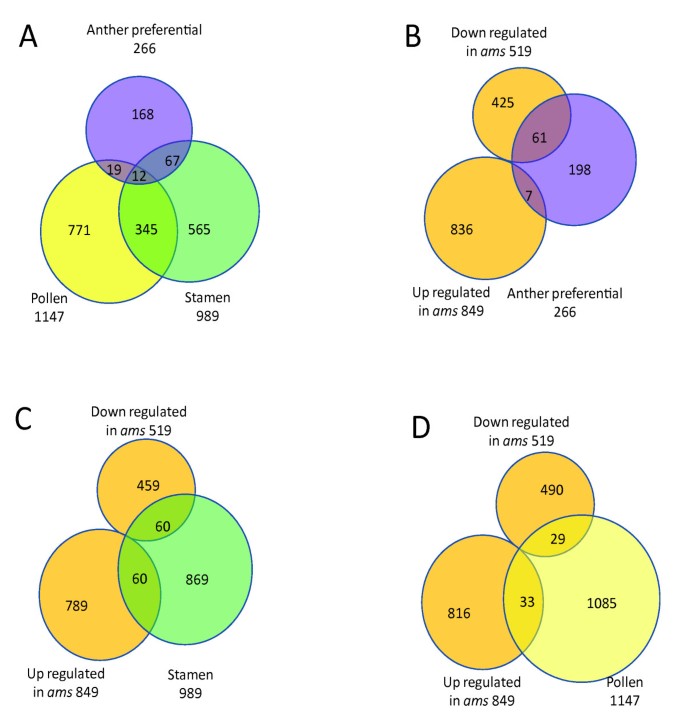
营养器官和花器官的不同表达模式可以为基因功能提供线索[43].目的:探讨基因表达变化与自动对盘及成交系统突变体及其在不同器官中的表达偏好,我们将野生型花药的数据与之前来自根、茎、叶、幼苗、角果和花序的微阵列数据进行了比较。两项研究均采用相同的RNA提取方法和ATH1平台,因此数据集应具有可比性[43].我们使用这些标准定义为特定于特定的(A-S):1)花药中的表达明显高于任何其他组织(FDR <0.05);2)表达在花药中但不根据两种替代方法的任何其他组织(有关详细信息和解释的材料和方法)[43].利用MAS5存在调用算法鉴定了124个A-S基因,其中76个存在至少2倍差异;以表达量50为阈值,鉴定出172个A-S基因,其中有146个差异至少为2倍(差异至少为2倍的在附加文件第二列用“*”标记)5.).由于两种称为“存在”的方法都有局限性,因此只有两种方法检测到的43个基因被讨论为A-S基因(这一规则也适用于下面描述的两组)。
如果基因在花药中的表达量显著高于其他FDR < 0.05的组织(变化超过2倍的基因在附加文件中用“*”标记),则定义为花药优先(A-P)基因5.和额外的文件3.)根据MAS5算法或表达水平的表达水平至少为50.因此,A-P基因包括A-S基因。此外,在花药中具有统计学上显着更高的表达水平的那些表达在非花动器官中称为生殖优先(R-P)基因(附加文件5.,详见材料和方法)。我们对其中6个基因进行了实时PCR,结果一致(补充图12见补充文件)1).在我们的结果中,检测到涉及男性生殖发育的24种基因(表1).与以前的研究一致,SPL在A-P组和EMS1在R-P组,而在自动对盘及成交系统作为A-S基因[10那17].
最近,还进行了其他研究,以确定男性生殖发育相关基因。Wellmer等人通过比较缺乏雄蕊的花同源性突变体的花序转录组与野生型的花序转录组来间接识别雄蕊中表达的基因[30.].在另一项研究中,Honys等人分析了不同时期的小孢子/花粉,并定义了雄性配子体转录组[33].将我们的A- p基因与之前的两个基因列表(定义为雄蕊和花粉,附加文件)进行比较6.)揭示了在三个雄性生殖数据集之间只有少量的基因重叠(图4,附加文件6.).所鉴定基因的差异可以通过不同研究中使用的样品的差异来解释:我们的样品仅包括早期阶段的野生型白皮药物(第4-7阶段),而花粉转录组数据来自幼儿孢子和不同阶段的花粉;通过从野生型转录组免除来自野生型和该列表中的基因的突变体转录组间接地获得雄蕊特异性基因可能在器官规范期间更早起作用。不同样品之间的显着差异表明,基因活性在雄性生殖器官的不同发育阶段之间发生了显着改变[33].
我们分析了GO分类在差异表达基因组中可能富集的特定类别(附加文件)3.),并发现在266个A-P基因中,氧化石墨烯种类最多的是水解酶、具有其他结合活性的蛋白质和其他酶。在以前发现的花粉特异或雄蕊特异数据集中,没有检测到其他酶活性的富集[33],暗示早期花药开发的特定表达谱。
在具有差异表达的基因中自动对盘及成交系统, A-P基因的百分比(5%)明显高于其在整个基因组中的百分比(1%)(图)4 b,附加文件2和额外的文件3.).雄蕊特异基因也在那些有差异表达的基因中富集自动对盘及成交系统(9%)与全基因组数据(5%)相比(图4摄氏度&4 d,附加文件2).结果与我们的假设一致,AMS调节具有重要功能在雄性生殖器官中的基因,它们具有更高的表达水平[1那8.].
通过比较雄性不育突变体的花药转录组对花药发育早期基因表达的全基因组分析Spl, ems1和ams
先前的研究揭示了SPL和EMS1收集并分析了这些突变体4-6期花药的ATH1基因芯片数据[32].为了更好地了解花药早期发育情况,我们将本研究的花药转录组数据与本研究的花药转录组数据进行了分析spl和EMS1(应用于所有微阵列数据的详细方法在实验程序中描述)。1813个和802个基因被鉴定为差异表达spl和EMS1,分别对3058个基因有贡献,这些基因在野生型花药和其中一个或多个花药之间差异表达2倍或更多spl, ems1和自动对盘及成交系统突变花药(附加文件7.).使用日志2值的差异表达基因的表达比例,进行分层聚类得到热图(图5).的模式spl和EMS1相似,而过自动对盘及成交系统有不同的图案,是否符合两种动物都没有绒毡层的事实spl和EMS1但是形成在自动对盘及成交系统花药。
此外,我们通过不同突变体之间的两两比较,比较了差异基因表达的方向,如维恩图(图6模拟),发现在所有三个突变体中,相同方向变化的基因比相反方向变化的基因多得多,表明这三个转录因子对一些靶基因具有相似的作用。我们还发现,差异表达基因的非重叠(在一个突变体中有差异表达,但在其他两个突变体中都没有)百分比自动对盘及成交系统(76%)大于spl和EMS1(59%和23%,图6 d),在转录组水平上提供了强有力的证据,证明AMS功能不同于SPL和EMS1,可能调控花药发育的晚期基因表达,这与其他研究一致[23].
由于这三个突变体表现出相关但不同的表型,我们推测这些突变体中差异表达的基因的功能可能彼此不同。因此,我们将GO分子功能分类应用于每个突变体中上调或下调的基因(见附加文件)3.).首先,被注释为具有“其他结合活性”和“其他酶活性”的基因在每个突变体中表达减少的类别中显著富集(P.-Value <0.05),与先前的Tapetum细胞中的动态代谢知识一致。此外,编码转录因子和DNA结合蛋白的基因以上下调节基因的类别富集spl突变体,建议通过调节编码转录因子的基因来至少部分地进行SPL控制制剂。此外,这是自动对盘及成交系统突变体中许多编码结构蛋白的基因表达减少,这些基因主要参与细胞结构完整,提示AMS可能激活这些基因促进绒毡层细胞的成熟。
SPL和EMS1可能通过激活ams依赖的基因表达来控制绒毡层的发育
为了更好地了解可能共同作用于花药发育的基因,我们根据表达模式将3058个基因分为不同的簇。在这三种突变体中,总共有136个基因表达被抑制(附加文件)7.).由于突突细胞缺乏或功能障碍,因此我们预计绦虫相关基因的表达会显着减少。以前的研究表明,Tapetal细胞主要参与花粉成熟的营养和材料提供[2].与此观点一致的是,与ATH1芯片上的所有基因(10.1%)相比,该组编码酶的基因(21.8%)明显过多。此外,属于其他结合类别的基因也在该组中富集(16.4% vs 9.9%,附加文件3.).
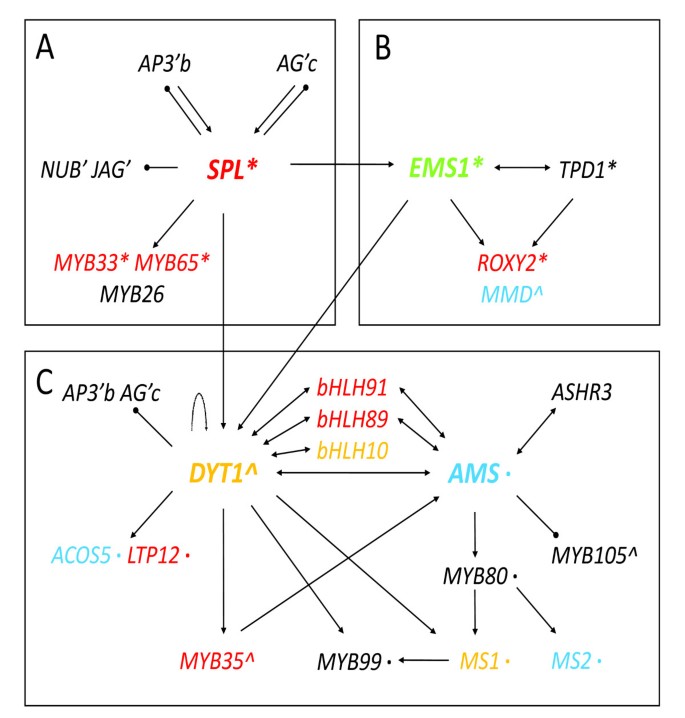
在这些基因中,许多基因参与花粉壁相关化合物的生物合成,如脂类、木质素和类黄酮。最近的一项研究表明,可能参与脂类生物合成和转移的酰基辅酶A合成酶GhACS1的缺失可能导致棉花雄性不育[55].表达水平为8拟南芥三个突变体中涉及脂质代谢途径的基因显着降低,表明其在塔皮特细胞中代谢的潜在作用(表2).此外,我们发现,所有突变体中,参与子宫内膜系统的30个基因的表达水平降低(表3.).最近的植物研究表明,许多内膜蛋白可能参与了转运,从而影响信号转导和发育[56-58].基于对这三种突变体绒毡层缺陷的观察[10那17那22,我们推测具有相似表达模式的基因可能对维持绒毡层的特性很重要。
此外,在该分类中还发现了5个潜在转录因子的基因(表)4.).其中,AT5G58610和AGL25./ AT5G10140是A-P基因。AT5G58610具有病原体防御反应的推定功能,揭示了种植开发和外部生物应激应激途径的可能因素[59那60].AGL25.,也被称为FLC.,是开花抑制因子,其表达受表观遗传调控[61].但其在花药发育中的作用尚不清楚。三个人AGL40./ At4g36590,MYB80/ At5g56110和HAT9/ AT2G22800。AGL40.在增殖性胚乳转录组中发现MYB80/At5g56110在绒毡层发育中[27].这些结果表明,绒毡层的正常功能可能需要在AMS花药下游优先表达多种转录因子。
SPL和EMS1可以通过IMS的途径调节早期花药开发
此外,354个基因表明表达减少spl和EMS1但不是在自动对盘及成交系统(附加文件7.),包括水解酶活性(15.5% vs. 8.4%)、其他结合酶活性(19.5% vs. 9.9%)和其他酶活性(18.0% vs. 10.1%)的富集。在这组基因中,有四个基因:MS2,ACOS5,CYP703A2和A7,参与孢粉素单体的生物合成,其缺乏导致雄性不育(表1)1)[62那63].因为这些基因在自动对盘及成交系统突变时,部分脂质代谢基因可能独立于AMS而激活,并可能比AMS更早或平行于AMS发挥功能[63那64].
此外,在该子集中发现了编码推定转录因子的几个基因(表4.).具有已知功能的A-P基因,例如TDF1/ AT3G28470(或myb35) 和bHLH89/At1g06170,也属于这一类[24那32那35].TDF1对Tapetum功能控制调用溶解并在AMS和MYB103的上游的下游作用(表4.)[24].我们的数据也支持spll - tdf1 - ams的调控层次。
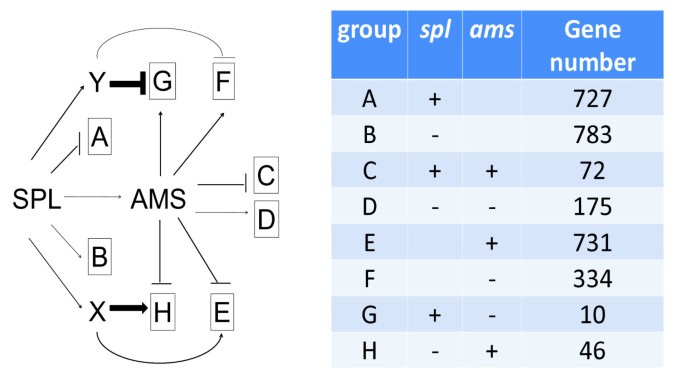
的表达自动对盘及成交系统显著减少了spl因此,我们假设基因下调自动对盘及成交系统应该有类似的减少吗spl.有趣的是,我们发现56个基因表现出相反的表达变化spl而在自动对盘及成交系统与野生型花药相比,比例更大(1065个基因)自动对盘及成交系统(数字6).另一个基因在spl和EMS1突变体是DYT1,它编码类似于AMS的BHLH蛋白质[22].SPL可能还可以通过独立于AMS的途径调节花药开发,例如需要DYT1功能的途径[22].我们推测SPL可能激活其他转录因子,其与AMS的功能相比(由图中的因素×和Y表示)相反影响AMS调节基因7.).AMS减少的影响spl可能被×或Y的损失抵消;这种调控相互作用可以解释相反的表达变化spl和自动对盘及成交系统.对拟议因素的识别和理解将需要进一步调查。
ams依赖和独立的花药表达的基因编码转录因子
bHLH基因在花药发育中的表达
由于已经发现许多转录因子在调控花药发育中发挥关键作用,我们通过聚焦转录因子基因家族分析了我们的花药转录组谱[5.那28那65].为了确定花药发育的其他候选基因,我们分析了所有已知的147个bHLH基因拟南芥(附加文件8.)[40].根据BHLH家族的最新系统发育树的几枝[40那66那67],包括包含AMS的支,同一支的全部或大部分成员在花药中表达相似(附加文件8.),表明在花药发育中具有保守的功能作用。例如,bHLH91和bHLH89在所有三个突变体中都有类似的减少,这表明花药中可能存在冗余功能(图)5 b).
在其他情况下,突变型和野生型花药中密切相关的同源基因没有相同的表达模式(附加文件8.).例如,bHLH93和的相似吗自动对盘及成交系统;但不像自动对盘及成交系统,与花药相比,优先于花序中表达。同样不像自动对盘及成交系统,它的表达在spl.有些补偿机制可能会采取行动增加转录bHLH93什么时候自动对盘及成交系统是突变的(图5 b).
另外,一些在其他器官中功能已知的bHLH基因在肾组织中表达增加spl突变体,暗示SPL通过减少其他器官所需的基因的表达来维持雄性生殖器官的身份。例如,ZCW32.(bHLH31)控制花瓣的形成,并被激活spl花药(68那69,表明SPL通过抑制邻近轮状花序中正常表达的某些基因,在早期促进了花药的正常发育。
MADS-box基因在花药发育中的可能作用
疯狂箱子家族的基因已被广泛研究拟南芥,因为它们首先被识别为Flower Homent基因,用于确定花卉器官和公司的身份[70那71].到目前为止,已识别出超过一百个疯狂箱基因,其中79个被发现存在于我们的花药微阵列数据中,但大多数是非兼容特定的(附加文件7.和附加文件8.)[70].除了Apetala2.(AP2), ABCDE模型中涉及的大部分基因都属于MADS家族[71].从上述微阵列数据的比较来看,它们大多是花序优先基因,而不是花药特异基因。Apetala1.(AP1)是控制第一和第二螺纹的函数基因,没有观察到表达偏移[72].Apetala3.(AP3) 和激动人心(π)B是B功能基因,对花瓣和雄蕊的形成是必不可少的[72-74].有趣的是,他们的表达模式是不同的。π是一种优于优先基因,但其表达水平在任何突变体中都没有变化AP3显然是上调的spl,建议AP3受到更紧密的规定π在花药发育.AG,C类基因控制雄蕊和卡皮尔标识,在花药中共享类似的表达模式AP3[13],支持一个角色AG在花药发育过程中,在雄蕊鉴定后(图5度).
此外,D类基因包括st/ AT4g09960,SHP1 /At3g58780和SHP2./At2g42830,对胚珠发育很重要[75那76].虽然D类基因的表达相对较低,但我们观察到增加表达SHP1.在自动对盘及成交系统突变体,提示AMS可能在胚珠发育中起负调控作用。另一方面,E类基因,Sep1,Sep2,Sep3和SEP4,是具有冗余功能的同源基因,在花药中有不同的表达模式。SEP1和SEP2被激活了spl和自动对盘及成交系统,而SEP3和SEP4变化不大(图5度).
除ABCDE基因外,其他一些MADS基因也在花药中表达(附加文件)8.).已知开花时间相关基因的表达水平(FLM,AGL15,AGL18和AGL20.)[77-79]在spl和EMS1轻微地。富尔语参与水果发育[80]被上调了spl和EMS1突变体,表明SPL和EMS1在螺纹4中的负角色。AGL80,对于女性配子体中的中央细胞和胚乳形成重要[81,在所有三个突变体中也降低了,表明可能在雄性配子体中发挥作用(附加文件8.).
MYB基因在三种突变体中的差异表达
除了BHLH和Mads-Box家庭外,其他基因家族也也参与了花药的发展。作为最大的拟南芥转录因子家族my基因在控制许多细胞过程中起重要作用,例如二次新陈代谢,形态发生和信号转换(附加文件8.)[82].以前的研究揭示了MyB基因在早期制剂发育中的许多作用(图5 d).例如,GAMYB在水稻花药发育中通过GA信号通路发挥作用[83].在拟南芥, GAMYB同源物myb33和MYB65还共享冗余功能调节Tapetum差异[22那27那84那85].我们的微阵列结果表明myb33和MYB65仅在spl,不是在另外两个突变体中,暗示了这样的功能myb33和MYB65独立于EMS1或AMS。
此外,myb35/TDF1和MYB80/myb103控制胼胝质溶解和外皮形成[27]在spl和EMS1,MYB80也在下调自动对盘及成交系统,表明它作用于自动对盘及成交系统.此外,MYB99和myb101调节苯丙醇丙烷代谢的基因[31的表达模式与的相似myb35/TDF1。myb26/MS35和myb105是密切相关的同源物;两者都被下调spl但上调自动对盘及成交系统.以前的研究表明myb26内皮加厚和花药裂开需要[86].核糖核酸原位杂交透露,myb105以及myb101表达于晚绒毡层[86那87],与我们在突变花药中表达的变化的结果一致。
WRKY、bZIP、AP2/ERF和NAC基因的表达
这WRKY家庭包含至少72名成员拟南芥[42],具有多种功能,如非生物和生物应激反应、激素信号通路、免疫反应和植物发育[88].但是,它不知道是否WRKY基因对于花卉发展很重要。在这里,我们比较了所有的表达WRKY在ATH1芯片上的基因发现,其中29个在花药中表达(附加文件8.),与高度相似WRKY2./ At5g56270和WRKY32/ At4g30935 [88anther-preferential]。此外,WRKY2.被抑制在spl,表明它可能作用于SPL在花药发育。
我们还分析了bZIP、ERF和NAC家族的转录因子。像WRKY家族一样,这些家族中的大多数基因在生殖发育中没有已知的功能(附加文件)8.).然而,我们发现其中一些基因在雄性不育突变体的花药中有差异表达,表明它们是调控花药发育的复杂转录网络的组成部分。
用于制定的转录监管网络
遗传学研究和我们在此报告的转录组分析支持一个新兴的转录网络(图8.).既往分子遗传学研究表明SPL上调表达EMS1和DYT1,上游自动对盘及成交系统[22那23以及其他在花药发育中起重要作用的转录因子编码基因[8.].SPL还负面调节在花药中B和C函数基因的表达,以及通常以花瓣和腕骨表达的一些基因,可能是预防其他花动器官的特性。另外,关键位置SPL在花药监管层次中,如遗传学研究所表明的是其对花药转录组的影响(图8).
EMS1还正向调控DYT1[32].EMS1被证明与其假定的配体TPD1相互作用[18因此,调节绦虫细胞分化必需的基因。此外,一些对减数分裂重要的基因也受到影响EMS1突变体。例如,在花药裂片形成和减数分裂中分别重要的MMD和ROXY2基因显著减少EMS1(数字8 b).
自动对盘及成交系统被抑制在spl和EMS1根据微阵列数据。因为Dyt1和AMS是相关的BHLH蛋白,已知与其他BHLH蛋白形成同偶二聚体或异二聚体,我们提出通过与其他蛋白质形成不同的络合物来调节不同基因的表达。Dyt1也是一种推定的候选候选者,其通过与不同蛋白质相互作用(图8 c).该拟议的制表开发的转录调节网络基于来自遗传学,转录组织和系统发育学研究的信息(图8 a - c).假设的相互作用,包括一些功能冗余基因的作用,可以通过进一步的实验来测试。
结论
在这项研究中,我们鉴定了表达改变的基因spl, ems1和自动对盘及成交系统在花药第4-7期,根据表达模式进一步对这些基因进行分类。这些基因可能直接调控花药发育过程中的一些基本生物学过程。此外,花药发育过程中还发现了花药特异性基因和非花药特异性基因。转录组分析也显示了ams依赖和非依赖的途径。转录组结合遗传和系统发育信息的详细分析揭示了花药发育早期复杂的调控网络,拓展了我们对花药发育相关基因,特别是转录因子的层次结构的理解。
方法
植物材料
本研究的所有植物在恒定的22℃下在恒长条件下(16小时光/ 8小时暗)在土壤中生长。本文中的野生型是指陆地山脉erecta(左呃).突变体的spl, ems1是我的呃如图所描述的[22那32],虽然自动对盘及成交系统突变体具有哥伦比亚背景。我们选择21-28天的植株在4-7期采集花药,如前所述[32].
微阵列实验
遵循“亚胺仪的GeneChip表达式分析”概述“网站上描述的[35,合成cRNA进行杂交,如所述[32].在宾夕法尼亚州立大学,大学公园的基因组学核心设施进行杂交,洗涤,染色,扫描和数据收集。
微阵列分析鉴定突变体花药中的差异表达基因
使用RMA中的r中的Biocuconductor包应用归一化[43,所有表达式值均转换为以2为底的对数。然后利用LIMMA库比较突变型和野生型花药的信号。只有具有两倍以上变化的基因被选择。为了获得更可靠的结果,我们筛选出q值(FDR)大于0.05的基因,因为q值比p值更严格T.-基于以往研究的测试[89].
使用不同器官的微阵列结果进行了类似的数据处理。来自野生类型的所有器官的微阵列数据拟南芥一起归一化并转换为以2为底的对数值。如果这些基因满足以下条件,我们将其定义为花药特异性基因:1)在花药中的表达显著高于其他任何组织,FDR < 0.05;2)基因存在于花药中,而不存在于其他组织中。我们使用了两种方法来确定一个基因是否存在于组织中。其中一种方法是使用Affymetrix' MAS5算法。该方法比较了野生型寡集与不匹配寡集的杂交强度;有时,两个集合的杂交级别相似,实际上可能是真实的表达式,但这样的结果将导致“缺席”调用。因此,我们也使用了第二种方法来定义“存在”,通过使用表达值的阈值50,这是之前在分析相同组织样本之间的差异的基础上确定的[32那43].两个结果都显示在附加文件中5..
对于花药偏好基因,我们采用以下标准:1)在花药中同时表达MAS和/或50切断;2)显著高于其他组织,FDR < 0.05;3)至少是其他组织的2倍。生殖优先基因需要在花药中表达,且在花药中表达量显著高于营养器官,FDR < 0.05和2倍变化。
通过MEV 4.6进行共表达基因的分层聚类[86].我们使用欧几里得距离度量来进行分析。为了鉴定差异表达基因的功能,我们从Affymetrix网站下载ATH1微阵列芯片上的基因注释,并使用TAIR网站上的GO分类功能[71].为了验证某一类别相对于整个基因组是否富集,我们采用超几何检验,只有p值小于0.05的类别称为统计富集组[90].
顺式元件分析
从TAIR网站获得了芯片上所有基因(起始密码子上游1 kb)可能的启动子序列。然后统计bHLH常用结合位点(E-box)的数量。然后我们绘制了基因表达的折叠变化自动对盘及成交系统使用Minitab对其推定的AMS绑定站点的数量[47].的识别CIS.-调控结合位点由perl进行[46].结合基元由Gene Regulation和PlantCARE [70].
实时PCR实验
为了测试微阵列杂交的可靠性,使用定量实时PCR研究了六种基因和一个参考(ACT2,AT3G18780)。RNA提取和实时实验遵循先前描述的方案[91].对所有组织进行三份反应,用“无逆转录”为阴性对照。所有入门信息都在附加文件中提供5..使用ΔΔCT方法计算相对转录量[92].
缩写
- 自动对盘及成交系统:
-
夭折的小孢子
- AG:
-
无性生殖的
- AP2 / ERF:
-
APETALA2/乙烯响应因子结构域转录因子
- bHLH:
-
基本helix-loop-helix
- bZIP:
-
Basic-leucine拉链
- CCR1:
-
肉桂酰辅酶a reductase1
- DYT1:
-
功能失调的tapetum1
- EMS1:
-
多余的雄性孢子囊肿1
- EPS1:
-
增强的假单胞菌易患性
- 的,
-
胞外分泌
- 去:
-
基因本体组织联盟
- 疯狂:
-
MCM1-agamous-deficiens-SRF
- MYB:
-
Myeloblastosis-like基因
- 南京:
-
NAM / ATAF1 / 2 / CUC2
- RD22:
-
响应Dessication22.
- PI:
-
激动人心
- RPK2:
-
受体蛋白质kinase2
- 证券交易委员会:
-
分泌
- SERK1/2:
-
体细胞胚胎发生受体样激酶1/2
- 陷阱:
-
可溶性NSF附着蛋白受体
- SPL / NZZ:
-
Sporocyteless /喷嘴
- TAIR:
-
rabidopsis信息资源网站
- TIR-NBS-LRR:
-
Toll Interleukine 1receptor-核苷酸结合位点 - 亮氨酸富重复域
- TPD1:
-
毯determinant1
- VAM3:
-
空泡的形态
- VSP1:
-
营养贮藏蛋白质。
参考文献
- 1.
葛晓霞,常峰,马海峰:水稻生殖发育的信号转导和转录调控拟南芥.生物谷学报。2010,20:R988-997。10.1016 / j.cub.2010.09.040。
- 2.
Scott RJ,Spielman M,Dickinson HG:Stamen结构和功能。植物细胞。2004,16(SUP):46-60。10.1105 / TPC.017012。
- 3.
McCormick S:男性配子化的开发。植物细胞。1993年,5:1265-1275。
- 4.
Goldberg RB,Beals TP,桑德斯PM:撒母动因开发:基本原则和实际应用。植物细胞。1993年,5:1217-1229。
- 5.
马洪:开花植物小孢子发生和配子发生的分子遗传分析。植物营养与肥料学报,2005,26(3):434 -434。10.1146 / annurev.arplant.55.031903.141717。
- 6.
马浩,孙达生V:开花植物配子体的发育。[j] .计算机科学与技术,2010,31(4):417 - 418。
- 7.
Sanders P, Bui A, Weterings K, McIntire K, Hsu Y, Lee P, Truong M, Beals T, Goldberg R:花药发育缺陷拟南芥败突变体。植物学报,1999,11:297-322。10.1007 / s004970050158。
- 8.
常飞,王勇,王树华,马华:小孢子发生的分子调控拟南芥.植物生态学报。2011,14:66-73。10.1016 / j.pbi.2010.11.001。
- 9.
歌德与花卉发展的ABC模式。C R academy Sci III。2001年,324:523 - 530。10.1016 / s0764 - 4469 (01) 01321 - x。
- 10.
杨卫文,叶东,徐静,孙达生V:无孢子细胞基因拟南芥是孢子发生起始所必需的,并编码一种新的核蛋白。基因工程学报,1999,13:2108-2117。10.1101 / gad.13.16.2108。
- 11.
Schiefthaler U,Balasubramanian S,Sieber P,Chevalier D,Wisman E,Schneitz K:分子分析NOZZL,是一种参与性器官发育过程中模式形成和早期孢子发生的基因拟南芥芥。美国国家科学院学报。1999,96:11664-11669。10.1073 / pnas.96.20.11664。
- 12.
杰克T:花卉控制的分子和遗传机制。植物细胞。2004,16(SUP):S1-17。10.1105 / TPC.017038。
- 13.
Yanofsky Mf,Ma H,Bowman JL,Drews Gn,Feldmann Ka,Meyerowitz em:由此编码的蛋白质拟南芥同源性基因类似于转录因子。自然。1990,346:35-39。10.1038 / 346035 a0。
- 14.
ITO T,Wellmer F,Yu H,Das P,ITO N,Alves-Ferreira M,Riechmann JL,Meyerowitz Em:通过调节孢子粥来控制宿主孢子菌。自然。2004,430:356-360。10.1038 / Nature02733。
- 15.
杨少林,谢丽芳,毛洪志,普春生,杨伟文,姜玲,孙达三V,叶丹:Tapetum Compentinant.是细胞专业化所必需的拟南芥花药。植物细胞。2003,15:2792-2804。10.1105 / TPC.016618。
- 16.
陈志强,陈志强,马洪涛:BAM1/BAM2受体样激酶是重要的调节因子拟南芥早期的花药开发。植物细胞。2006,18:1667-1680。10.1105 / TPC.105.036871。
- 17.
赵德志,王光发,Speal B,马辉:中国多余的婴儿皮卵细胞基因编码调用的富含亮氨酸的重复受体蛋白激酶,其控制体细胞和生殖细胞命名拟南芥花药。基因发展,2002,16:2021-2031。10.1101 / gad.997902。
- 18.
Jia G ., Liu X ., Owen HA ., Zhao D .: TPD1小蛋白和EMS1受体激酶决定细胞命运的信号通路。美国国家科学院学报。2008年,105:2220 - 2225。10.1073 / pnas.0708795105。
- 19.
杨少林,姜丽霞,普春生,谢丽芳,张晓强,陈立强,杨伟伟,叶东:过度表达Tapetum Compentinant.改变了细胞命名拟南芥通过与过量小孢子细胞1/额外孢子生细胞的遗传相互作用,心皮和绒毡层。植物营养与肥料学报。2005,32(4):457 - 461。10.1104 / pp.105.063529。
- 20.
Mizuno S,Osakabe Y,Maruyama K,Ito T,Osakabe K,Sato T,Shinozaki K,Yamaguchi-Shinozaki K:受体样蛋白激酶2(RPK 2)是一种控制特性发展的新因素拟南芥芥。工厂J. 2007,50:751-766。10.1111 / J.1365-313x.2007.03083.x。
- 21.
Colcombet J, boison - dernier A, Ros-Palau R, Vera CE, Schroeder JI:拟南芥体细胞胚胎发生受体激酶1和2对于绦虫发育和微孔成熟至关重要。植物细胞。2005,17:3350-3361。10.1105 / TPC.105.036731。
- 22.
张伟,孙勇,季莫费耶瓦,陈超,马华拟南芥绒毡层的发育和功能功能障碍Tapetum.(ydt.)编码bHLH转录因子。发展。2006,133:3085-3095。10.1242 / dev.02463。
- 23。
Sorensen AM, Krober S, Unte US, Huijser P, Dekker K, Saedler H: The拟南芥夭折的小孢子(是)基因编码MYC类转录因子。植物学报,2003,33:413-423。10.1046 / j.1365 - 313 x.2003.01644.x。
- 24。
朱茹,陈H,李H,高JF,姜H,王C,关益,杨泽:塔伯式发育缺陷和功能1对于微孔成熟的种植和Tapetal功能至关重要拟南芥.工厂J. 2008,55:266-277。10.1111 / J.1365-313x.2008.03500.x。
- 25。
Boavida LC, Becker JD, Feijo JA:高等植物配子的形成。国家自然科学基金青年项目,2005。10.1387 / ijdb.052019lb。
- 26。
李志刚,李志刚,李志刚:拟南芥雄性无菌液1(女士)基因是雄性配子发生的转录调节剂,具有与Phd-Finger系列转录因子的同源性。工厂J. 2001,28:27-39。10.1046 / J.1365-313x.2001.01125.x。
- 27。
Zhang ZB, Zhu J, Gao JF, Wang C, Li H, Zhang HQ, Zhang S, Wang DM, Wang QX, Huang H, et al .:转录因子AtMYB103通过调控绒毡层发育、胼胝体溶解和外壁形成调控花药发育拟南芥.植物学报,2007,52:528-538。10.1111 / j.1365 - 313 x.2007.03254.x。
- 28。
Wilson ZA, Zhang DB:来自拟南芥对米饭:花粉发育的途径。J Exp Bot。2009,60:1479-1492。10.1093 / JXB / ERP095。
- 29。
Cutler S,McCourt P:Dude,我的表型在哪里?处理信令网络中的冗余。植物理性。2005,138:558-559。10.1104 / pp.104.900152。
- 30.
李志刚,李志刚,李志刚,等:水稻空间基因表达的全基因组分析拟南芥花。acta botanica sinica(云南植物研究),2004,16(4):427 - 434。10.1105 / tpc.021741。
- 31.
alvers - ferreira M, Wellmer F, Banhara A, Kumar V, Riechmann JL, Meyerowitz EM:全球表达谱应用于分析拟南芥雄蕊发展。植物理性。2007,145:747-762。10.1104 / pp.107.104422。
- 32.
Wijeratne Aj,张W,Sun Y,Liu W,Albert R,Zheng Z,Oppenheimer DG,Zhao D,MA H:差异基因表达拟南芥野生型和突变花药:洞悉花药细胞分化和调控网络。植物学报2007,52:14-29。10.1111 / j.1365 - 313 x.2007.03217.x。
- 33.
D:比较分析拟南芥花粉转录组。植物生理学报。2003,32(6):643 - 648。10.1104 / pp.103.020925。
- 34.
香港紫花,刘麦克,刘麦克,杨麦,王CS:鉴定百合花植物在百合花植物期间由吉布林素调节的特异性/主要基因。J植物理性。2008,165:553-563。10.1016 / J.JPLPH.2007.01.008。
- 35.
徐静,杨春英,袁智,张东升,巩伟明,丁志伟,梁文清,张db, Wilson ZA:败育的小孢子调控网络是雄性减数分裂后生殖发育的必要条件拟南芥芥。acta botanica sinica(云南植物研究),2010,22(1):91-107。10.1105 / tpc.109.071803。
- 36.
Hirano K,Aya K,Hobo T,Sakakibara H,Kojima M,Shim Ra,Hasegawa Y,Ueguchi-Tanaka M,Matsuoka M:微孔/花粉中的植物激素生物合成和信号基因的综合转录组分析。植物细胞生理。2008,49:1429-1450。10.1093 / PCP / PCN123。
- 37.
Khandelwal A, Elvitigala T, Ghosh B, Quatrano R:拟南芥转录组揭示了调节氧化还原性稳态的控制电路和AP2转录因子的作用。植物理性。2008,148:2050-2058。10.1104 / pp.108.128488。
- 38.
Mentzen WI, Wurtele ES:法规组织拟南芥.生物技术学报。2008,8:99-10.1186/1471-2229-8-99。
- 39.
陈志强,陈志强,陈志强:基于基因共表达网络的植物遗传信息提取方法。植物营养与肥料学报。2007,31(4):491 - 498。10.1093 /卡式肺囊虫肺炎/ pcm013。
- 40.
李晓霞,段晓霞,姜浩,孙玉英,唐玉英,袁志,郭军,梁伟,陈丽,尹建,等:水稻碱性/螺旋-环-螺旋转录因子家族的全基因组分析拟南芥.植物营养与肥料学报。2006,31(4):497 - 498。10.1104 / pp.106.080580。
- 41.
Matus JT, Aquea F, Arce-Johnson P:对葡萄MYB R2R3亚家族的分析揭示了扩大的葡萄酒品质相关分支和保守的基因结构组织vitis.和拟南芥基因组。植物营养与肥料学报。2008,28(4):514 - 514。
- 42.
吴姬,郭ZJ,王浩,李杰:稻米和水稻转录因子系列拟南芥和他们的起源。DNA资源学报,2005,12:9-26。10.1093 / dnares / 12.1.9。
- 43.
张晓霞,冯波,张强,张德华,马洪:花早期发育的全基因组表达谱分析和基因活性鉴定拟南芥.植物mol biol。2005,58:401-419。10.1007 / s11103-005-5434-6。
- 44.
Mohrmann R,De Wit H,Verhage M,Neher E,Sorensen JB:活细胞的快速囊泡融合需要至少三个圈套复合物。科学。2010,330:502-505。10.1126 / Science.1193134。
- 45.
植物先天免疫中的模式识别受体。免疫学报。2008,20:10-16。10.1016 / j.coi.2007.11.003。
- 46.
Jurgens G, El-Kasmi F, Pacher T, Strompen G, Stierhof YD, Muller LM, Koncz C, Mayer U:拟南芥圈套蛋白SEC22对于配子体的开发和维护Golgi堆栈完整性是必不可少的。植物J 2011,66:268-279。10.1111 / J.1365-313x.2011.04487.x。
- 47。
Sato MH, Nakamura N, Ohsumi Y, Kouchi H, Kondo M, HaraNishimura I, Nishimura M, Wada Y: TheAtVAM编码一个涉及液泡组装的syntaxin相关分子拟南芥芥。中国生物化学杂志。1997,27(4):453 - 457。10.1074 / jbc.272.39.24530。
- 48。
Chow B,McCourt P:植物激素受体:感知是一切。基因开发。2006年,20:1998-2008。10.1101 / gad.1432806。
- 49。
陈静:人物塑造拟南芥热敏的突变atts02揭示了热橡胶在热能的重要作用。植物细胞环境。2006,29:1671-1671。
- 50.
杨克志,夏超,刘小玲,窦晓燕,王伟,陈丽琴,张晓琴,谢丽芬,何磊,马旭,等:一种突变体热敏的雄性不育1,用DNAJ和PDI结构域编码热休克蛋白,导致拟南芥的热敏配子雄性不育性。工厂J. 2009,57:870-882。10.1111 / J.1365-313x.2008.03732.x。
- 51.
Peng J: Gibberellin和jasmonate crosstalk在雄蕊发育中的作用。acta botanica sinica(云南植物学报),2009,51(4):593 - 598。10.1111 / j.1744-7909.2009.00881.x。
- 52.
Moon J,Parry G,Estelle M:泛素 - 蛋白酶体途径和植物发育。植物细胞。2004,16:3181-3195。10.1105 / TPC.104.161220。
- 53.
孟X, Sun P, Kao TH:基于s - rnase的自不亲和矮牵牛inflata。《中国科学院院刊》2010年第4期。
- 54.
泛素结合酶家族(E2s):决定蛋白质的生死。王志强,王志强。10.1096 / fj.09 - 136259。
- 55.
王小龙,李晓b:中国GhACS1基因编码酰基-CoA合成酶,这对于棉花早期制剂发育中的正常微孢子发生至关重要。工厂J. 2009,57:473-486。10.1111 / J.1365-313x.2008.03700.x。
- 56.
Surpin M,Raikhel N:交通拥堵影响植物开发和信号转导。NAT Rev Mol Cell Biol。2004,5:100-109。10.1038 / NRM1311。
- 57.
卡特CJ,Bednarek Sy,Raikhel NV:贩运植物的贩运:新发现和方法。CurrOp植物BIOL。2004,7:701-707。10.1016 / J.PBI.2004.09.016。
- 58.
植物的膜运输。中国生物医学工程学报。2004,20:481-504。10.1146 / annurev.cellbio.20.082503.103057。
- 59.
李志强,王志强,王志强:植物防御诱导子几丁质诱导的118个拟南芥转录因子和30个泛素连接酶基因的鉴定。植物营养与肥料学报。2007,20(4):489 - 494。10.1094 / mpmi - 20 - 8 - 0900。
- 60。
Ascencio-Ibanez JT, Sozzani R, Lee TJ, Chu TM, Wolfinger RD, Cella R, Hanley-Bowdoin L:全球分析拟南芥基因表达揭示了在双生病毒感染期间影响病原体反应和细胞周期的一系列复杂的变化。植物营养与肥料学报。2008,29(4):436- 442。10.1104 / pp.108.121038。
- 61。
Pien S, Fleury D, Mylne JS, Crevillen P, Inze D, Avramova Z, Dean C, Grossniklaus U:拟南芥TRITHORAX1通过组蛋白3赖氨酸4三甲基化动态调控开花位点C的激活。acta botanica sinica, 2017, 36(5): 569 - 572。10.1105 / tpc.108.058172。
- 62。
胡颖,马洪:花药特异基因的鉴定、序列分析和表达研究拟南芥芥。植物生态学报。1998,37(6):593 - 598。10.1023 /: 1005964431302。
- 63.
de Azevedo Souza C, Kim SS, Koch S, Kienow L, Schneider K, McKim SM,豪n GW, Kombrink E, Douglas CJ:一种新的脂肪酰基辅酶A合成酶是花粉发育和孢粉素生物合成所必需的拟南芥.acta botanica sinica, 2009, 31(4): 457 - 461。10.1105 / tpc.108.062513。
- 64.
Aarts MG, Hodge R, Kalantidis K, Florack D, Wilson ZA, Mulligan BJ, Stiekema WJ, Scott R, Pereira拟南芥雄性不育2蛋白质与伸长/缩合复合物中的还原酶分享相似性。工厂J. 1997,12:615-623。10.1046 / J.1365-313x.1997.d01-8.x。
- 65.
冯晓峰,丁金生。细胞与细胞间的相互作用拟南芥花药。Biochem Soc Trans。2010,38:571-576。10.1042 / BST0380571。
- 66.
托莱多 - 奥蒂斯克,乌克e,鹌鹑ph:拟南芥碱性/螺旋-环-螺旋转录因子家族。acta botanica sinica(云南植物学报),2003,27(5):457 - 461。10.1105 / tpc.013839。
- 67.
Bailey PC,Martin C,Toledo-Ortiz G,鹌鹑PH,Huq E,Heim Ma,Jakoby M,Werber M,Weisshaar B:关于基本Helix-Loop-Helix转录因子基因家族的更新拟南芥芥。植物细胞。2003,15:2497-2502。10.1105 / TPC.151140。
- 68.
Brioudes F,Joly C,Szecsi J,Varaud E,Leroux J,Bellvert F,Bertrand C,Bendahmane M:jasmonate控制了花瓣生长的后期开发阶段拟南芥.植物杂志。2009,60:1070-1080。10.1111 / J.1365-313x.2009.04023.x。
- 69.
Szecsi J, Joly C, Bordji K, Varaud E, Cock JM, Dumas C, Bendahmane M: BIGPETALp, bHLH转录因子参与调控拟南芥花瓣大小。中国海洋大学学报(自然科学版),2006,25:3912-3920。10.1038 / sj.emboj.7601270。
- 70.
Parenicova L,De Folter S,Kieffer M,Horner DS,Favalli C,Busscher J,Cook He,Ingram RM,Kater MM,Davies B等:拟南芥完全疯狂箱转录因子家庭的分子和系统发育分析:新的疯子世界的新开口。植物细胞。2003,15:1538-1551。10.1105 / TPC.011544。
- 71.
MA H:植物开发中的监管基因:MADS。生命科学的百科全书。2009年,奇切斯特:John Wiley&Sons,Ltd,2.0
- 72.
无瓣体-1基因的功能拟南芥植物的发展。acta botanica sinica(云南植物研究),2010,29(2):441 - 453。
- 73.
Meyerowitz, Goto K, EM:功能和调节拟南芥植物同源转化基因PISTILLAT.基因工程学报,1994,8:1548-1560。10.1101 / gad.8.13.1548。
- 74.
Jack T, Brockman LL, Meyerowitz EM:同源基因APETALA的拟南芥拟南芥编码一个MADS盒,并在花瓣和雄蕊中表达。细胞。1992,68:683-697。10.1016 / 0092 - 8674(92) 90144 - 2。
- 75.
Pinyopich A, Ditta GS, Savidge B, liljgren SJ, Baumann E, Wisman E, Yanofsky MF:心皮和胚珠发育过程中MADS-box基因冗余性的评估。自然杂志。2003,424:85-88。10.1038 / nature01741。
- 76.
fadaro, Pinyopich A, Battaglia R, Kooiker M, Borghi L, Ditta G, Yanofsky MF, Kater MM, Colombo L: MADS-box蛋白复合物控制心皮和胚珠的发育拟南芥.植物细胞。2003,15:2603-2611。10.1105 / TPC.015123。
- 77.
Werner JD, Borevitz JO, Warthmann N, Trainer GT, Ecker JR, Chory J, Weigel D: Quantitative trait locus mapping and DNA array hybridization鉴定出一个FLM缺失是自然开花时间变异的原因。美国国家科学院学报。2005年,102:2460 - 2465。10.1073 / pnas.0409474102。
- 78.
Liu C, Chen H, Er HL, Soo HM, Kumar PP, Han JH, Liu YC, Yu H: AGL24和SOC1的直接相互作用整合了开花信号拟南芥.发展。2008,135:1481-1491。10.1242 / dev.020255。
- 79.
adczyk BJ, Lehti-Shiu MD, Fernandez DE: MADS结构域因子AGL15和AGL18作为花过渡的抑制子冗余作用拟南芥.工厂J. 2007, 50: 1007-1019。10.1111 / j.1365 - 313 x.2007.03105.x。
- 80。
GU Q,Ferrandiz C,Yanofsky MF,Martienssen R:The富有成果的Mads-Box基因介导细胞分化期间拟南芥水果开发。发展。1998,125:1509-1517。
- 81。
Portereiko MF,Lloyd A,Steffen JG,Punwani Ja,Otsuga D,Drews GN:中央电池和胚乳开发所需的AGL80拟南芥.植物细胞。2006,18:1862-1872。10.1105 / TPC.106.040824。
- 82。
基于基因组学视角的植物转录因子研究。植物营养与肥料学报。2000,3:423-434。10.1016 / s1369 - 5266(00) 00107 - 2。
- 83。
Aya K, Ueguchi-Tanaka M, Kondo M, Hamada K, Yano K, Nishimura M, Matsuoka M: Gibberellin通过GAMYB的转录调控调控水稻花药发育。acta botanica sinica, 2009, 31(4): 457 - 461。10.1105 / tpc.108.062935。
- 84。
Millar AA Gubler F: The拟南芥GAMYB-like基因,MYB3和MYB6,是microrna调控的基因,冗余地促进花药的发育。acta botanica sinica, 2017, 36(5): 762 - 762。10.1105 / tpc.104.027920。
- 85。
Zhongardson Ea,Ye Zh:MyB46转录因子是SND1的直接目标,并调节二级墙体生物合成拟南芥.植物营养与肥料学报。2007,19(4):489 - 498。10.1105 / tpc.107.053678。
- 86。
Yang C, Xu Z, Song J, Conner K, Vizcay Barrena G, Wilson ZA:拟南芥MyB26 /雄性灭菌35调节内皮中的二次增稠,对于花药裂开至关重要。植物细胞。2007,19:534-548。10.1105 / TPC.106.046391。
- 87.
施泰纳-兰格S, Unte US, Eckstein L, Yang C, Wilson ZA, Schmelzer E, Dekker K, Saedler H:中断拟南芥由于非解除阴茎,拟南芥MYB26导致雄性不育。工厂J. 2003,44:519-528。10.1046 / J.1365-313x.2003.01745.x。
- 88.
Eulgem T,Rushton PJ,Robatzek S,SomssiCh IE:植物转录因子的腕骨副家族。趋势植物SCI。2000,5:199-206。10.1016 / s1360-1385(00)01600-9。
- 89.
Storey JD,Tibshirani R:基因组研究的统计学意义。美国国家科学院学报。2003,100:9440-9445。10.1073 / pnas.1530509100
- 90。
周旭,苏智:EasyGO:基于基因本体论的农艺物种注释与功能富集分析工具。基因组学杂志。2007,8:246-10.1186/1471-2164-8-246。
- 91。
Zahn LM, Ma X, Altman NS, Zhang Q, Wall PK, Tian D, Gibas CJ, Gharaibeh R, Leebens-Mack JH, Depamphilis CW, et al:加利福尼亚Eschscholzia california花器官的转录组学比较及其在植物进化发育研究中的参考价值。基因组学杂志。2010,11:R101-10.1186/gb-2010-11-10-r101。
- 92。
Livak KJ,Schmittgen Td:使用实时定量PCR和2( - Delta Delta C)方法分析相对基因表达数据。方法。2001,25:402-408。10.1006 / meth.2001.1262。
致谢
我们非常感谢Craig Proul博士在执行微阵列杂交中的帮助。我们感谢Naomi Altman博士讨论统计分析。我们还感谢Jiong Wang女士进行植物护理。我们赞赏博士的建议。小飞周,镇海张,赵苏在微阵列数据分析。这项工作得到了美国能源部授予H.M的支持。来自部门生物学和哈克生命科学院,宾夕法尼亚州立大学和复旦大学的逃离垃圾学院的资金。
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
HM设计并监督了这项研究;BF进行组织收集和RNA分离;XM执行数据分析;XM和HM写了稿件草稿;XM,BF和HM编辑了稿件;所有作者均批准了稿件。
电子辅料
图S1。信号强度与野生型的相关系数
额外的文件1:自动对盘及成交系统花药复制.两组生物重复间的Pearson相关系数均大于0.96自动对盘及成交系统和野生型花药,结果重复性好。图S2和S3。GO注释中基因的上调和下调自动对盘及成交系统.GO分类在差异上表达的基因自动对盘及成交系统与野生型相比突变体。富集的组以不同的颜色显示,具有P值。数字S4-S11。参与不同代谢途径的基因被激活或抑制自动对盘及成交系统与野生型相比.红颜色表示激活的基因,而绿色代表压抑的基因自动对盘及成交系统与野生型相比。代谢活动的概述见补充图4。数字5.那6.那7.那8.-11显示次级代谢、调控途径、受体样激酶途径、转录调控、蛋白转运、应激反应、泛素和自噬依赖降解途径相关基因表达发生变化。图S12。实时PCR结果与芯片数据一致.6个基因通过real-time PCR得到验证。蓝色条柱代表实时RT-PCR结果,红色条柱代表微阵列结果。图中所示的数字均为其它组织表达强度与花药表达强度的倍数变化。“infl”是花序的缩写。(XLSX 12 MB)
在花药和花序中差异表达的基因
额外的文件2:自动对盘及成交系统突变体.此附加文件包含有关差别表达的基因的信息自动对盘及成交系统花药和花序与野生类型相比。列序列,缩写和注释版本如表中使用的那样1和所有其他的补充表。所有的表达式值都是log2比率。(XLSX 15 KB)
12870_2011_986_moesm3_esm.xlsx.
附加文件3:基于表达式模式的不同集群的GO分类。这个附加文件包含关于每个GO类别中的基因数量的信息。丰富的类别用红色突出显示。(XLSX 28 KB)
基因差异表达
额外的文件4:自动对盘及成交系统突变体具有引发功能的外毒性,运输,泛素化和应力反应.这个附加文件包含了在不同途径中表达水平升高的基因的信息自动对盘及成交系统.(XLSX 1 MB)
12870_2011_986_moesm5_esm.xlsx.
附加文件5:被定义为在早期花药中特别或优先表达或优先在生殖组织中表达的基因。这个附加文件包含了与根、茎、叶、角果相比,只在花药或生殖组织中优先表达的基因信息。(55 XLSX KB)
基因表达的
额外的文件6:雄蕊,早期花药和花粉.这个附加文件包含了不同器官中基因表达水平的信息。(XLSX 2 MB)
基因表达差异
额外的文件7:spl那EMS1或/和自动对盘及成交系统突变体.这个附加文件包含了关于三种突变体中差异表达的基因表达水平的信息。(XLS 166 KB)
表达式模式
额外的文件8:麦斯那my那Bhlh.那WRKY那bZIP那AP2 /小块土地和南汽家庭.这个附加文件包含了关于不同基因家族表达水平的信息。(PPTX 2 MB)
作者为图像提交的原始文件
以下是与作者的原始提交的图像的链接。
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
马晓霞,冯斌,马晓霞,等。花药转录组的转录调控及其与其他转录组的比较拟南芥花药基因。BMC植物杂志12,23(2012)。https://doi.org/10.1186/1471-2229-12-23
收到了:
公认:
发表:
关键词
- 绒毡层细胞
- WRKY基因
- 花药发育
- bhlh基因
- 基因编码转录因子