摘要
背景
豆科植物与根瘤菌的共生相互作用涉及两个过程:细菌侵染,导致细菌渗透到表皮和皮层细胞,以及根结节器官发生。根结节共生由根瘤菌信号分子激活,称为结节因子(NFs)。NF感知诱导了几种称为早期结节素的基因的表达。N5的早期结节Medicago truncatula脂质转移蛋白是否已被证明对结节有积极的调节作用在体外抑制活性Sinorhizobium meliloti.这项工作的目的是调查的作用MtN5通过研究其在共生相互作用期间的时空表达模式,以及与共生信号通路的已知成分的关系,并通过分析接种根瘤菌所显示的表型改变MtN5沉默的根源。
结果
我们在这里展示了MtN5是一种在表皮细胞和根毛共生的非常早期阶段表达的nf反应基因。MtN5表达被诱导在体外根瘤菌效应分子和生长素、细胞分裂素、植物激素参与根瘤器官发生。此外,脂质信号通路涉及的反应MtN5对于根瘤菌,由于磷脂酶D的活性是必需的MtN5感应的美国meliloti接种根。MtN5与野生型根相比,接种根瘤菌的-沉默型根的根毛卷曲增加,入侵原基数量减少,但对结节原基的形成没有损害。这种表型与刺激有关ENOD11表达,感染的早期标志,并随着Flotillin 4(FLOT4),一种参与根瘤菌进入的蛋白质。
结论
这些数据表明MtN5作用于NF知觉的下游和FLOT4调节感染前事件。MtN5对结节原基侵袭的积极作用与表皮水平的细菌扩散限制有关。此外,MtN5对于结节原基的形成似乎是可有可无的。这些发现为研究根表皮细胞抵抗根瘤菌入侵的复杂机制提供了新的信息。
背景
属于豆科家族有能力与根瘤菌相互作用,产生一个固氮器官,根结节。这种共生关系始于两个伙伴之间的分子交叉对话。宿主植物来源的分子被根瘤菌感知并激活Nod因子(NFs)的合成,进而在根毛中引起各种生化反应,包括离子通量的变化、膜去极化、细胞质钙的振荡和细胞骨架的修饰[1- - - - - -4]导致根毛变形,形成感染线(IT),最终导致细菌渗透到表皮[5].
NF感知依赖于一对属于lysm -家族受体样激酶(LysM-RLK)的同源基因,NFP和LYK3m . truncatulaNFR1和NFR5l .对虾[6- - - - - -8].在其他豆科植物如豌豆和大豆中也发现了与NF感知密切相关的基因[9].通过LysM-RLKs对NF的感知激活了一条信号通路,称为共同共生通路[5],构成在m . truncatula通过DMI1(离子通道编码),DMI2(编码富含亮氨酸重复受体样激酶),参与产生钙振荡[10- - - - - -12),而DMI3(编码钙钙调蛋白激酶),负责解码钙峰值振幅和频率[5].nf诱导的早期感染事件还涉及磷脂酶C和D的活性[13,14].NF感知和信号级联的激活发生在根表皮。与此同时,中柱鞘细胞和皮层细胞重新进入细胞周期,并形成一个原基,从中产生结节分生组织[15,16].根毛感染后48 ~ 96小时,原基被感染线内的根瘤菌入侵。
细胞分裂主要由两种重要的植物激素控制,生长素和细胞分裂素,它们在细胞周期中调节细胞的进程[17].浓度和生长素与细胞分裂素的比例在决定植物中细胞是否以及在哪里进入有丝分裂期方面都起着关键作用[18- - - - - -20.].根瘤菌接种后生长素转运的减少[18,21- - - - - -23]根不仅改变了生长素的通量,而且还改变了结节起始部位生长素与细胞分裂素的比例。其中之一l .对虾自发结瘤突变体的基因突变莲花组氨酸激酶1(LHK1)作为细胞分裂素受体的基因[24],而LHK1功能缺失突变体显示原基和成熟结节数量显著减少[25].在m . truncatulaRNA干扰(RNAi)介导的细胞分裂素反应1下调(CRE1),LHK1,导致皮质细胞分裂显著减少,并在根毛水平阻断了大部分ITs [26].因此,细胞分裂素似乎参与了结节形成的表皮和皮层通路的协调结节《盗梦空间》(外祖母)基因[27,28].直到现在,外祖母一直被认为是协调NFs信号和进入途径的关键基因[27,28].
最近的研究表明,膜微结构域和相关蛋白如Flotillin2 (FLOT2),FLOT4而且M. truncatula共生䲟鱼1(MtSYMREM1),参与表皮对根瘤菌的反应,并在IT的形成中发挥作用[29,30.].
广泛的分析m . truncatula转录组显示,一组富含半胱氨酸的小肽在共生建立过程中被上调[31].MtN5是一种结节素基因,通过差异筛选方法鉴定,在成熟结节中表达[32- - - - - -34].序列同源性表明MtN5属于以8个半胱氨酸基序为特征的植物非特异性脂质转移蛋白(nsLTP)超家族,系统发育分析表明MtN5与植物非特异性脂质转移蛋白(nsLTP)具有较高的同源性拟南芥DIR1和植物nsltp样蛋白的基团[34,35].像其他属于植物ns-LTP超家族的蛋白质一样,MtN5能够结合脂质在体外并抑制病原体和共生体的生长[34].的RNAi-mediatedMtN5抑制导致在转基因毛状根上生长的结节数量显著减少,这表明MtN5是结瘤所必需的[34].然而,不同阶段的结瘤途径表明MtN5可能涉及的活动仍然未知。
这项研究的目的是进一步了解的功能MtN5在m . truncatula-美国meliloti交互。我们的数据表明MtN5是一种在豆科植物根毛和表皮细胞中相互作用的早期阶段表达的nf反应基因。的表型分析MtN5-沉默的根显示MtN5与限制根毛卷曲有关,这一作用对于结节原基的有效定殖是必要的。MtN5对根瘤菌的反应依赖于磷脂酶D (PLD)活性,似乎不需要DMI1.此外,FLOT4感应大大减少MtN5沉默的根源。这项研究表明MtN5通过两种明显相反的方式参与根瘤菌感染的控制:首先通过限制根表皮的入侵,其次通过促进根皮层的感染。
结果
调控基序的预测MtN5启动子
之前的数据表明MtN5早熟诱发在美国meliloti-接种的根,在根结节中表达,其功能是植物之间成功共生相互作用所必需的美国meliloti而且m . truncatula[32- - - - - -35].的目的是获得更深入的了解的监管MtN5表达,假定MtN5对启动子进行了分析在网上保守响应元件的检测方法。
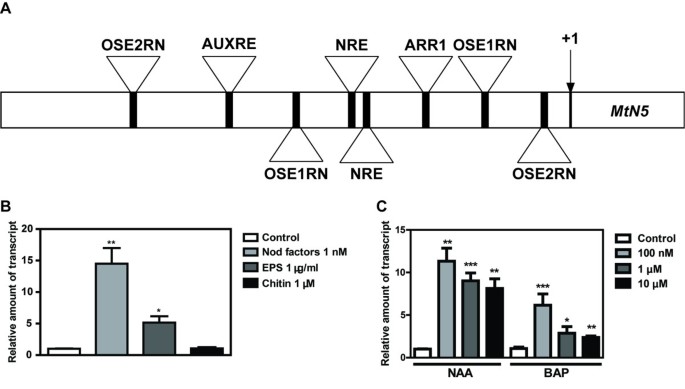
该序列横跨1.54 kb上游的ATG翻译的开始密码子MtN5基因(图1一个;额外的文件1)采用PLACE算法进行分析[36,37].除了在启动子序列如TATA和CAAT盒中发现的共同元件外,器官特异性元件(OSE) OSE1ROOTNODULE和OSE2ROOTNODULE(分别为AAAGAT和CTCTT)的一致序列是根结节感染细胞中活跃的启动子的特征[38,39],在MtN5启动子,虽然不是规范的间隔(图1一个;额外的文件1).此外,核苷酸序列AATTT,称为结瘤响应元件(NRE),被发现在ATG起始密码子上游590 bp重复出现两次。这种响应元件被证明存在于特征良好的结瘤蛋白基因的启动子序列中,如MtENOD11, MtNIN而且ERN1作为一个独联体-由GRAS型NSP1转录因子靶向的作用元件[40].的在网上分析MtN5启动子还强调了参与基因表达激素控制的motif的存在,如ARR1AT和AUXREPSIAA4,分别对细胞分裂素和生长素有反应[41,42].有趣的是,生长素反应元件AUXREPSIAA4先前已被证明是豌豆植物根尖分生组织中表达的基因的组织特异性和特征[42].
生物信息学分析MtN5启动子及表达MtN5在m . truncatula用细菌衍生分子和植物激素处理后的根。一个.假定的原理图MtN5启动子和MtN5打开阅读框。ORF的开头用+1标识。被分析为假定启动子的区域位于起始密码子上游1.54 kb处。指示了以下调控基序:OSE1RN (OSE1ROOTNODULE;AAAGAT出现在反义方向),OSE2RN (OSE2ROOTNODULE;AAGAG同时出现在正义和反义方向),NRE (AATTT), ARR1 (ARR1AT;GATT)和AUXRE (AUXREPSIAA4;GTCCCAT出现在反义方向)。B.m . truncatula根用纯化的NFs (1 nM)处理24 h;EPS (1 μg/ml)和几丁质(0.1 μM)分别作用48 h。C.m . truncatula分别用α-萘基乙酸(NAA)和苄基氨基嘌呤(BAP)在100 nM、1 μM和10 μM的浓度下处理根48 h。数据归一化为内部肌动蛋白控制。以未处理的根作为校准样品计算相对表达率。报告的数值为平均值±标准差(n=至少3)t应用测试。*, p < 0.05;**, p < 0.01;*** p < 0.001。
MtN5根瘤菌源性分子和植物激素共同诱导表达
基于PLACE算法预测的motif [36],MtN5用微生物激发子分子和植物激素处理根系,分析其表达情况。MtN5处理后表达上调美国melilotiNFs[32和这项工作],表明与未处理的根相比,NF处理的根增加了大约15倍(图1B).然而,瞬态感应MtN5接种a后,观察转录本水平美国melilotiNF生产中的缺陷应变[32].测试其他根瘤菌衍生的信号是否可能导致MtN5归纳,我们测试了MtN5从植物中提取的胞外多糖(EPS)处理过的根中的表达美国meliloti[43].根也用几丁质低聚物(N,N ',N ' ',N ' ' -四乙酰壳聚糖)等分子处理,这些分子可能源于真菌细胞壁的降解[44].在1 μg/ml EPS处理的根系中MtN5与未处理的根相比,转录水平增加了约5倍MtN50.1 μM甲壳素处理不影响其表达(图1B)。
考虑到生物信息学分析MtN5启动子预测对生长素和细胞分裂素有反应的元素的存在,参与调节根结节起始和生长的植物激素,生长素和细胞分裂素处理对根的影响MtN5对表达进行评价。如图所示1C、α-萘基乙酸(NAA)和苄基氨基嘌呤(BAP)均可诱导MtN5在广泛浓度范围内的表达(即。100 nM ~ 10 μM)。生长素也表现出类似的刺激能力MtN5细胞分裂素的作用在最低浓度(100 nM)时更为明显(图2)1C).有趣的是,生长素和细胞分裂素的刺激作用MtN5表达被检测到m . truncatulaJemalong在体外NAA和BAP联合处理后的-培养叶片外植体[45,46].
的在网上分析MtN5启动子序列和实验证据表明MtN5主要对根瘤菌来源的信号作出反应,并可由参与表皮和皮层反应协调和结节形成的激素调节。
MtN5根瘤菌侵染和结瘤发育过程中的表达模式
的时空格局MtN5组织和细胞水平的表达,MtN5启动子活性监测MtN5p:格斯接种和不接种根瘤菌的转基因根。在未接种的根中,MtN5p:格斯表示在根尖(附加文件2).β-葡萄糖醛酸酶(GUS)活性在侧根萌发部位和幼嫩侧根全长均有检测;随着侧根年龄的增长,GUS活性限制在根尖(附加文件)2).
MtN5p:格斯转基因根表现出局部的GUS活性诱导美国meliloti接种。接种3小时后(hpi), GUS活性在表皮的局部斑点和根毛中可见(图2A -2C)在感染的较晚期阶段(即。24 hpi), theMtN5在靠近中柱的根皮层检测到启动子活性(2D)。
在结节发展的早期阶段,相当多的活动MtN5在根皮层和中柱(结节原基)之间的边界处可以观察到启动子(图2E).随着原基的生长和从根中出现,GUS报告基因的表达在整个结节中均可检测到(图2F -2H)。在发育完全的根结节中,启动子活性主要集中在远端区(图2我和2J).分析MtN5启动子活动突出了存在MtN5根瘤菌感染期间发生结构变化和膜重排的细胞的表达(即。根毛)和在根分生组织和结节原基等组织中表现出较高的细胞分裂活性。
的时间和空间格局MtN5启动子活性表明MtN5可以被认为是早期的标志m . truncatula而且美国meliloti与其他表皮结节素相互作用,如RIP1而且ENOD11,在感染线形成之前,它们被认为参与了细胞壁的修饰[47,48].
MtN5影响ENOD11对根瘤菌有反应,不是必需的外祖母感应
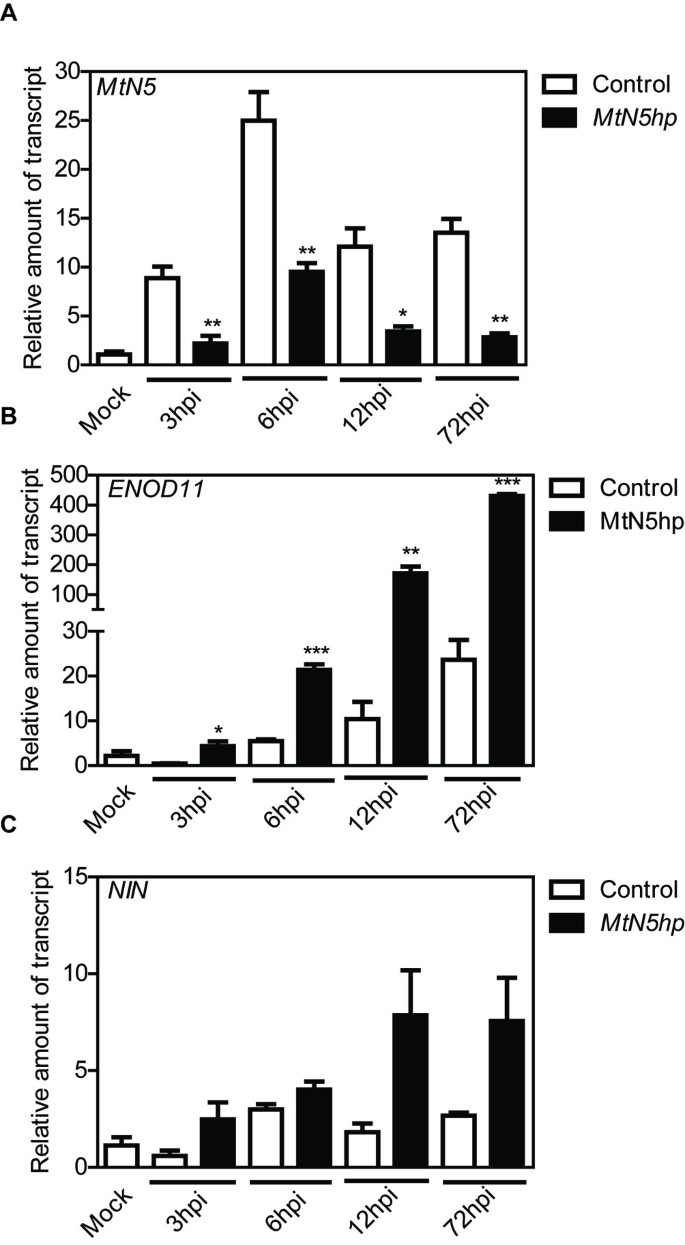
为了理解它们之间的关系MtN5和早期NFs信号通路的其他成分,两种早期结节蛋白的表达,ENOD11而且外祖母对携带发夹结构的转基因不定根进行了分析(MtN5hp)MtN5沉默(34].复合植株微洪水接种美国meliloti在感染后的不同时间(3、6、12和72 hpi)收集根系。本实验中考虑的根系是根据T-DNA中存在的DsRED标记基因的荧光信号预先选择转基因状态的。MtN5表达诱导非常快美国meliloti接种(图3.A)在不定根对照中,由侵染产生农杆菌属rhizogenes携带一个空的pRedRoot向量。在接种MtN5hp转基因的根,MtN5在每一个考虑的时间点,与对照根相比,表达显著降低(图3.A).的稳态水平MtN5转录水平平均下降70%,范围约为62% (6 hpi)至80% (72 hpi)。
的表达式ENOD11,根瘤菌共生感染前和感染阶段的早期标记物显示,对照不定根从6 hpi开始逐步增加。在MtN5-沉默的根组织,ENOD11在3 hpi处已经强烈上调,在接下来的侵染阶段,与对照根相比,其表达显著增强(图3.B)。
MtNIN是结节原基启动所必需的,在表皮和皮层反应的协调中起作用[28].的表达式MtNIN从6 hpi开始上调。MtN5沉默没有显著改变外祖母在分析中检测每个时间点的mRNA稳态水平(图3.C)。
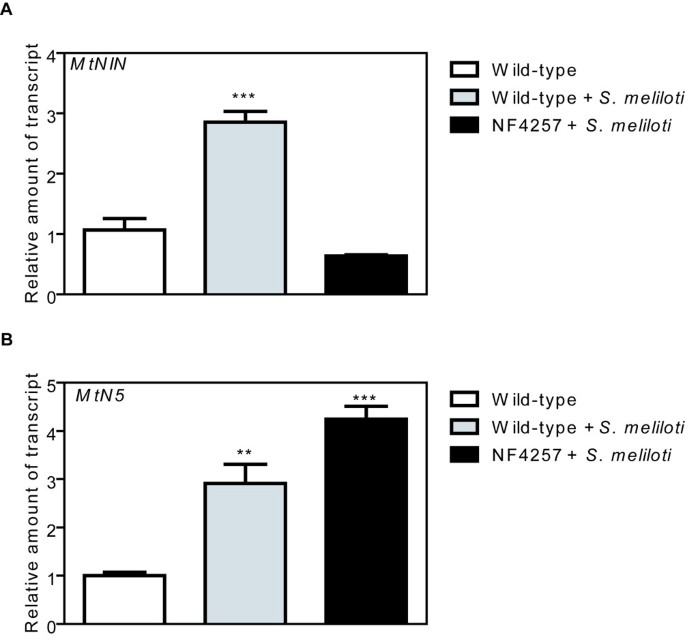
到目前为止,关于结节蛋白基因参与NFs信号通路的现有数据表明两者都存在ENOD11而且MtNIN钙峰值下游[13,28].来分析两者之间的关系MtN5表达和钙振荡我们用的是最近建立的Tnt1转座子突变集合m . truncatulaR108 [49,并在DMI1基因,该基因是钙峰值产生所必需的[10,50].我们鉴定了NF4257,它携带转座子插入155个核苷酸下游的翻译起始位点DMI1基因。植物进行繁殖,随后通过聚合酶链反应(PCR)筛选纯合子后代(附加文件)3.).在NF4257纯合系中,DMI1表达几乎完全被废除(DMI1与野生型植物相比,稳态水平为20%)(附加文件3.).在美国meliloti-接种的NF4257突变体MtNIN排除诱导(图4A及[28),而MtN5显示出野生型行为(图4B).这个发现表明MtN5活化可能发生在钙峰值的上游,尽管我们不能排除其他的先验Tnt1插入,可能存在于DMI1纯合突变苗,可影响MtN5表达反式.
的响应需要PLD活动MtN5来美国meliloti
几项研究表明,NFs激活的信号级联在早期阶段涉及异三聚体g蛋白和小gtpase的中介作用[51- - - - - -54],进而刺激磷脂酶C (PLC)和D (PLD)的功能[51,53,55,56].根据目前的模型,PLC水解产生的产物(三磷酸肌醇和甘油二酰基)刺激配体门控钙泵的活性,导致胞质Ca增加2 +而PLD产物(磷脂酸,PA)似乎是激酶/磷酸酶信号级联的开始所必需的,该信号级联最终导致结节蛋白基因的激活和细胞骨架的重组,为根毛向内生长做准备[57].
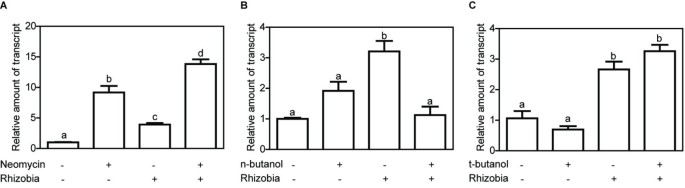
目的是研究的依赖性MtN5对脂质信号的两条平行通路的诱导,采用药理学方法,使用PLC和PLD的特定抑制剂(分别为新霉素和正丁醇)。如前所述,100 μM新霉素和68 mM正丁醇的施用均不会导致根毛细胞活力的显著丧失[13].m . truncatula用新霉素预处理的幼苗,随后接种美国meliloti的水平上调了13倍MtN5(图5A)与未处理对照根相比,而在没有药物处理的情况下,接种根显示4倍MtN5诱导提示新霉素无抑制作用MtN5归纳。同样,单独使用PLC抑制剂的治疗可导致约9倍的MtN5表达式。据报道,在PLC抑制剂处理后,其他结节蛋白基因也有类似的刺激作用,并被解释为膜运输改变或微管重组的结果[14,58].这些数据表明MtN5根瘤菌接种诱导和新霉素处理诱导最有可能是独立作用(图5A).正丁醇竞争磷脂酰作为PLD酶活性产生PA的拮抗剂[59].有趣的是,美国meliloti用PLD抑制剂处理的-接种根没有显示显著的变化MtN5与对照根相比,正丁醇处理可以防止MtN5感应(图5B).叔丁醇是丁醇的一种异构体,它不作为磷脂酰基团的受体,用叔丁醇处理没有阻碍MtN5感应(图5C)总体而言,这些结果表明MtN5反应依赖于PA的产生。
特异性抑制剂PLC和PLD(分别为新霉素和正丁醇)对MtN5表达式。一个.的相对mRNA水平MtN5qRT-PCR检测野生型m . truncatula根或未处理或处理与PLC激动剂新霉素和接种美国meliloti.B.qRT-PCR检测野生型m . truncatula未处理或用PLD激动剂正丁醇处理并接种的根美国meliloti.C.在野生型上进行qRT-PCRm . truncatula根未处理或用正丁醇异构体t丁醇处理和接种美国meliloti.表达数据归一化为内部肌动蛋白控制。以未处理、模拟接种的根作为校准样品计算相对表达率。报告的数据为均数±标准差(n =至少3)。根据Bonferroni后验的单向方差分析,常见字母表示无显著差异。
MtN5影响根毛卷曲和原基侵入
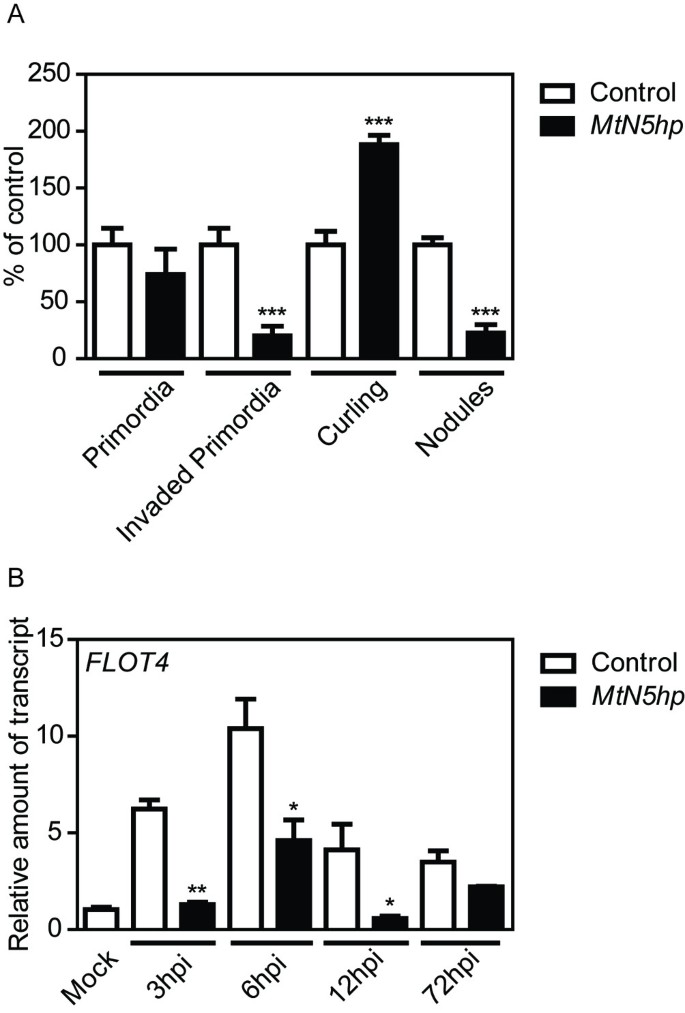
显微观察MtN5hp毛状根用一种根瘤菌菌种接种-:: LacZ报告基因显示发根卷曲事件的数量显著增加-大约是对照根的两倍(图6然而,根瘤菌的5-溴-4-氯-3-吲哚基- d -半乳糖吡喃苷(X-Gal)染色显示,在根瘤菌中细菌定殖原基的数量显著减少(约80%)MtN5hp与对照样品的根相比(图6A)和,如前所述,复合植物轴承MtN5hp沉默的根也显示完全发育的结节数量减少(约80%)。然而,两者间的结节原基总数没有显著差异MtN5-静音和控制根(图6A)卷曲的根毛中也没有观察到任何表型改变,如过度卷曲或根毛变形(附加文件)4).结节原基和成熟结节也很明显MtN5hp植株在形态上与对照根中产生的植株没有不同(附加文件)4).在这些数据的基础上,转录水平M. truncatula Flotillin(FLOT4),一种参与细菌进入途径的基因MtN5 -沉默根和控制根。FLOT4接种根瘤菌3 hpi后,在对照根中易于诱导,6 hpi时表达量最高,之后表达量下降。在MtN5hp根部感染共生体后,数量急剧减少FLOT4在3 ~ 12 hpi之间检测到70% ~ 90%的表达6B)。
接种后表型分析MtN5hp根和FLOT4表达式。一个.根毛卷曲事件的数量,总数和侵入原基及成熟结节中MtN5hp根接种美国meliloti.报告的数据为相对于对照接种根的平均值±标准差(n=40)。学生的t应用测试。*** p < 0.001。B.表达水平FLOT4用qRT-PCR方法对经基因转化获得的不定根毛状根进行检测答:rhizogenes的pRedRoot二进制向量MtN5hp构造或空T-DNA(对照)。表达数据归一化为内部肌动蛋白控制。以对照模拟接种根作为校准样品,计算相对表达率。报告的值为平均值±标准差(n=3)。学生的t应用测试。*, p < 0.05;**, p < 0.01。
讨论
早期结节MtN5通过减法杂交方法鉴定[32],根据序列同源性,注释为推定的脂质转移蛋白[32,33].的在体外MtN5重组蛋白的表征强调其具有结合脂质和抑制微生物生长的能力[34表明可能与限制根瘤菌入侵有关。然而,基于沉默和过表达方法的功能研究表明MtN5功能是成功建立共生关系所必需的[34].
的分子作用MtN5在m . truncatula-S。meliloti共生,我们最初关注的是调控MtN5表达式。在本工作中提供的数据证实了诱导MtN5是一个nf响应事件,但也表明MtN5表达可能受几种附加信号控制,要么是根瘤菌衍生的效应物,要么是植物激素、生长素和细胞分裂素。这些观察结果与发现相一致MtN5从感染前到成熟结节的共生相互作用的不同阶段诱导,也与主根和侧根根尖的本构表达有关。根瘤菌感染没有改变MtN5在根尖水平表达,但它很早就触发诱导MtN5在表皮组织(3 hpi)和根皮层(24 hpi)。因此我们提出MtN5可以看作是早期的分子标记m . truncatula而且美国meliloti交互。
检测MtN5在根毛和表皮的局部斑点中的启动子活性支持这一观点MtN5可能涉及感染前或/和感染事件。感染前对根瘤菌的反应伴随着标记基因的诱导ENOD11在根表皮,而在后期,其表达局限于根的侵入区[48].转录因子MtNIN似乎在调节ENOD11活动促成了对其表达的限制美国meliloti-根的响应区[28].在接种MtN5-沉默的根,ENOD11诱导不被阻止。的确,ENOD11表达受到强烈的刺激MtN5-沉默根与对照根相比,表明MtN5控制需要函数ENOD11表达式。此外,MtN5下调调控不会抑制外祖母转录表明错误的调控ENOD11在MtN5-沉默的根是独立的外祖母影响ENOD11转录。刺激ENOD11表达MtN5-沉默的根也可以解释为受损根瘤菌感染的间接后果。
的表型分析MtN5-沉默的根证实了该结节素在共生感染前阶段的作用;事实上,虽然没有观察到根毛卷曲的异常,但与对照根相比,卷曲的根毛数量显著增加。在几种感染缺陷豆科植物中观察到根毛对根瘤菌的反应增强[28,60- - - - - -62],这可能表明存在一种抑制野生型植物根细胞能力的机制[61].从我们的数据中我们可以推断出这一点MtN5可能与限制发根卷曲的机制有关。
寄主植物用不同的策略控制根瘤菌的入侵[63,64].例如,病原体防御基因的诱导是共生过程中检测到的早期事件之一,它已被指出是涉及it流产的机制之一[33,65,66].在后期,这些防御基因的表达通常下降,这可能是宿主植物识别细菌的结果,也可能是由分子信号介导的,例如根瘤菌产生的胞外多糖[33,65,67].此外,寄主植物通过一种称为结瘤自动调节的机制来限制结瘤的数量,这涉及到芽受体激酶的干预[63,64].MtN5属于非特异性LTP家族,包括对病原体具有抑制活性的外质体蛋白,本身具有限制能力美国meliloti增长在体外[34].也有人认为MtN5可能属于一组ltp,在植物-微生物相互作用信号传递中起作用[35].MtN5可能通过限制根瘤菌在表皮细胞/根毛表面的稳定附着和/或增殖起作用,例如,通过调节根瘤菌衍生的信号分子的感知或活性。除了越来越多的卷发,MtN5-沉默根显示侵入根结节数量减少,表明MtN5也可直接或间接参与调节细菌入侵。如果是这样的话,冰壶比赛的限制可能有利于细菌在有限数量的感染点渗透。
一些实验观察结果与存在一种平行的nf介导的信号通路相一致,该通路在根毛卷曲和细菌进入中与共同的共生通路协同作用[25,68].此外,药理学研究表明,脂质信号与根毛变形和IT启动都有关系[14].回应MtN5对根瘤菌的作用依赖于PLD活性,我们首次获得了PLD活性可能独立于PLD活性的迹象DMI1,是共同共生途径的组成部分。需要进一步的调查来证明的独立性MtN5钙诱导2 +并确定是否MtN5是平行的nf介导通路的一个组成部分,控制根毛卷曲和/或根瘤菌进入。最近人们发现小船队家族的一名成员,FLOT4,它在早期共生事件中上调,并定位于感染根尖的膜微域,在IT启动和延伸中发挥作用[29].我们的观察表明MtN5对上游行为FLOT4,支持这一观点MtN5参与资讯科技发展前的活动。
发生在表皮水平的细菌感染与促进结节形成和发展的皮层过程相协调[19].结节原基的形成需要Ca的感知2 +钙活化激酶CCaMK (DMI3)的振荡和细胞分裂素信号的激活。此外,植物激素生长素局部和系统地参与结节器官发生的调节[22,69].生长素和细胞分裂素均可诱导MtN5表达式在体外.此外,在美国meliloti接种根MtN5转录本位于细胞分裂形成结节原基的内皮层。这些发现暗示了一种可能性MtN5参与结节器官发生。然而,我们观察到的结节原基总数MtN5-沉默型根与野生型根的测量结果没有差异。因此,MtN5似乎不是结节原基启动所必需的。这与我们的发现是一致的MtN5下游函数或者更可能独立于MtNIN(图3.C)。
即使结节起始似乎没有受损,但入侵原基的数量明显减少MtN5沉默的根源。因此,成熟结节的数量减少MtN5-沉默的根可能是根瘤菌入侵原基能力减弱的结果。事实上,据报道,细菌入侵对维持结节发育过程至关重要[70].另一方面,我们也不能排除这一点MtN5可能对促进结节原基的维持有直接作用。需要进一步的调查来澄清这一点。
结论
这里提供的数据证明了这一点MtN5参与在NF感知和PLD激活后以及根毛侵入前发生在表皮的分子事件,其功能对于结节的发生是可有可无的,但对于结节的入侵是必需的。植物脂质转移蛋白通常是小而分泌的碱性蛋白,其特征是存在疏水腔,使其能够与脂质分子相互作用。植物LTP超家族成员表现出广泛的生物活性,如对病原体的防御作用、角质层蜡的沉积、细胞壁的修饰和花粉管的引导[71,72].基于序列相似性,MtN5和答:芥DIR1,一个涉及病原体防御系统信号的nsLTP [73]已被分配到ns-LTP的一个亚组,推测参与脂质介导的信号传导[35].百合LTP SCA和答:芥与花粉管生长有关的SCA也被认为是信号转导器[72,74].
我们认为MtN5在调节表皮细胞对根瘤菌感染的能力的过程中发挥了作用。因此,MtN5可能是让宿主控制互惠伙伴以保持植物适应性的机制的一部分。为了探索MtN5在这些过程中作为信号换能器的假设,有必要鉴定MtN5相互作用的蛋白质或配体。
方法
菌株
Sinorhizobium meliloti1021年(75]在28℃的LBMC培养基(10 g/l色氨酸,5 g/l酵母膏,10 g/l NaCl, 2.6 mM MgSO)中培养4, 2.6 mM CaCl2),添加链霉素200 μg/ml。农杆菌属rhizogenesARqua1 [76]在28℃的TY培养基(5 g/l色氨酸,3 g/l酵母膏,6 mM氯化钙2, pH 7.2),添加链霉素100 μg/ml。
植物生长与根瘤菌接种
Medicago truncatula简历。Jemalong种子经灭菌和发芽,如前所述[77].对于时间过程分析和GUS检测实验,m . truncatula将幼苗置于含有倾斜BMN琼脂培养基的方形培养皿中[78]添加0.1 μ L-α-2-氨基乙氧基甘氨酸(AVG)。将培养皿垂直放置在25°C的生长室中,光照10小时/暗光照14小时。经过7天的氮饥饿后,如前所述,对幼苗进行微洪水接种[34].简单地说,细菌生长了一夜,并悬浮在10毫米MgSO中4.将5滴(0.5 μl)菌悬液滴于根表面进行微洪水接种。qRT-PCR实验中,对照样品(模拟接种)用相同体积的10 mM MgSO处理4.
GUS构造和组织化学染色
报告构造是通过将MtN5的启动子和无内含子编码区大肠杆菌β葡萄糖醛酸酶(uidA),如上文所述[79].简单地说,我们从野生型植物中扩增了转录起始位点上游1.5 km长的序列,引物如下”-GAATTCCACAATCTCTTTCTTTCTCG-3”和5”-GGATCCCTGGTTCTAGTTTACTATAT-3”.将PCR片段进行亚克隆和测序。的MtN5启动子被克隆到GUS编码区上游的1.812 kb序列中,克隆到pBIN19衍生载体中nptII基因,编码卡那霉素抗性,在转录控制下号启动子(80].两个转录卡带(MtN5promoter:格斯和卡那霉素耐药)都放在一起。由此产生的嵌合基因被动员成答:rhizogenesARquaI,用于获得具有转基因沉默根的植物。组织化学GUS染色如前所述[81].图像由配备DFC420C数码相机的徕卡DM2500显微镜拍摄(徕卡微系统,Wetzlar,德国)。GUS染色的结节,固定和脱水后,按照制造商的说明置入Technovit 7100 (HeraeusKulzer, Wehrheim, Germany)。制备6 μm厚切片,用0.05%甲苯胺蓝染色。用蔡司Axiophot D1显微镜观察载玻片(http://www.zeiss.com/),并使用Axiovision程序(4.1版)使用Axiocam MRc5相机(蔡司)记录图像。
植物接种美国meliloti所述pXLGD4质粒,包含所述本构-:: LacZ基因,如前所述进行染色[82].将整根样品安装在带盖玻片的载玻片上,用配备DFC420C数码相机的徕卡DM2500显微镜观察(徕卡微系统公司,Wetzlar,德国)。
植物转化
的根变换答:rhizogenesARqua1的执行如前所述[83].感染ARqua1的植物在含有Fåhraeus改良培养基(FMM)的方形培养皿中保存约三周。当变换中使用的二进制向量为pBIN19 (MtN5p:格斯在FMM中添加卡那霉素50 μg/ml进行转化子的筛选。为MtN5沉默,MtN5hp构造被克隆到pRedRoot二进制向量中,如前所述[34].使用徕卡MZ16F荧光显微镜检查转化后的根,并设置以下用于DsRED1检测的滤波器:541-551 nm带通激发滤波器和590 nm长通发射滤波器。复合植物在培养皿中进行微洪水接种,如前所述,在25°C和10小时光照/14小时暗的条件下垂直保存在生长室中[34].
胞外提取
从。中提取胞外多糖(EPS)美国meliloti1021的执行如前所述[43].多糖在10% NaCl中溶解,用苯酚- h检查制备的浓度2所以4方法(84].
植物治疗
测试植物激素对MtN5基因表达,m . truncatula种子按上述方法进行剔除和杀菌,然后在固态FMM培养基上发芽。将7天大的幼苗移至含有倾斜FMM琼脂培养基的方形培养皿中,培养皿中添加不同浓度的α-萘乙酸(NAA)或苄基氨基嘌呤(BAP)。将植物垂直放置在25°C的生长室中,光照10小时,黑暗14小时,持续48小时。收集根器具,在液氮中冷冻,-80°C保存,直到RNA提取。
对于Nod因子(NFs)、几丁质四聚体(N,N ',N ' ',N ' ' -四乙酰壳聚糖)(Carbosynth, UK)和胞外多糖(EPS)的处理,将7天大的幼苗转移到含有添加了所选效应剂浓度的FMM液体的50 ml试管中,并在25°C的生长室中保存,光照10小时,黑暗14小时。NFs处理24小时,EPS和几丁质四聚物处理48小时。
7天大的药物治疗m . truncatula将幼苗置于含有含有0.1 μM AVG和药理效应剂的BMN培养基的培养皿中,处理24 h。新霉素(Sigma)制备为10mm水溶液,使用前将正丁醇和叔丁醇稀释于无菌水中[13].然后将植株转移到仅添加AVG和微量洪水接种的新鲜BMN培养基上美国meliloti,如前所述。收集4 hpi的根组织MtN5采用定量RT-PCR (qRT-PCR)检测表达。
定量rt - pcr
qRT-PCR分析如上文所述[85].用于qRT-PCR的引物的核苷酸序列在附加文件中报道5.用于分析基因表达的引物对MtN5在毛状根中特别选择了3种”转录结束时避免了扩增序列的衍生惠普构造本身。
基因组DNA提取和插入突变体特征
的m . truncatula基因组DNA如前所述从100毫克叶子中制备(http://medicago.org/documents/Protocols/dna.html).
的遗传特征m . truncatulaR108 NF4257突变系,除其他插入外,在DMI1基因,采用基于pcr的方法进行。以基因组DNA为模板,采用两种引物进行PCR反应DMI1编码序列(DMI1_for: 5)”-ATCCTTGGCTGGAGTGACAAATTG-3”;DMI1_rev: 5”-CTGATCTGCATTTTCGTCCGCAGC-3”)和与。互补的第三引物Tnt1序列(Tntail1: 5”-TATGCAAAGAACTTGTCGGCATGC-3”) [49](附加文件3.).区分杂合子和纯合子植物的插入DMI1根据PCR反应后扩增子的数量和大小进行基因扩增。
统计分析
图中报告了平均值±SE。统计分析使用学生的t进行Bonferroni后验或单因素方差分析。
参考文献
- 1.
Timmers ACJ, Auriac MC, Truchet G:根瘤菌-紫花苜蓿相互作用早期共生步骤与微管细胞骨架重排关系的精细分析。发展。1999,126:3617-3628。
- 2.
王晓明,张晓明,张晓明,等:植物根毛中Nod因子的表达与根毛定位的关系。植物与微生物的相互作用,2005,18:1195-1204。10.1094 / mpmi - 18 - 1195。
- 3.
Cárdenas L, Thomas-Oates JE, Nava N, López-Lara IM, Hepler PK, Quinto C: nod因子取代基在菜豆肌动蛋白细胞骨架重排中的作用。植物与微生物相互作用,2003,16:326-334。10.1094 / MPMI.2003.16.4.326。
- 4.
de Ruijter NCA, Bisseling T, Emons AMC:根瘤菌Nod因子在几分钟内诱导蚕豆根毛中肌动蛋白细丝的亚根尖细束增加。植物与微生物的相互作用。1999,12:829-832。10.1094 / MPMI.1999.12.9.829。
- 5.
Oldroyd GE, Downie AJ:协调豆科植物根瘤菌感染的结节形态发生。植物学报,2008,29(4):519-546。10.1146 / annurev.arplant.59.032607.092839。
- 6.
李鹏飞,李志刚,李志刚,李志刚,李志刚,李志刚。根瘤菌Nod因子诱导感染的LysM结构域受体激酶研究。科学通报,2003,32(3):344 - 344。10.1126 / science.1090074。
- 7.
Radutoiu S, Madsen LH, Madsen EB, Felle HH, Umehara Y, Grønlund M, Sato S, Nakamura Y, Tabata S, Sandal N, Stougaard J:共生细菌的植物识别需要两个LysM受体样激酶。自然科学,2003,29(4):349 - 349。10.1038 / nature02039。
- 8.
Madsen EB, Madsen LH, Radutoiu S, Olbryt M, Rakwalska M, Szczyglowski K, Sato S, Kaneko T, Tabata S, Sandal N, Stougaard J:一种LysM型受体激酶基因参与豆科植物对根瘤菌信号的感知。自然科学学报,2003,29(4):344 - 344。10.1038 / nature02045。
- 9.
李志刚,李志刚,李志刚。植物-微生物相互作用中的脂质-壳寡糖信号通路。植物与微生物相互作用,2011,24:867-878。10.1094 / mpmi - 01 - 11 - 0019。
- 10.
Ané JM, Kiss GB, Riely BK, Penmetsa RV, Oldroyd GE, Ayax C, Lévy J, Debellé F, Baek JM, Kalo P, Rosenberg C, Roe BA, Long SR, Dénarié J, Cook DR:豆科植物中细菌和真菌共生所需的Medicago truncatula DMI1。科学通报,2004,30(3):344 - 344。10.1126 / science.1092986。
- 11.
Esseling JJ, Lhuissier FG, Emons AM: nork突变豆科植物的非共生根毛尖生长表型:对结瘤因子诱导的信号传导和细菌多面体根毛袋的形成的影响。植物学报,2004,16:433 - 444。10.1105 / tpc.019653。
- 12.
Riely BK, Lougnon G, Ané JM, Cook DR:共生离子通道同源物DMI1定位于Medicago truncatula根核膜。植物学报,2007,29(4):344 - 344。10.1111 / j.1365 - 313 x.2006.02957.x。
- 13.
Charron D, Pingret JL, Chabaud M, Journet EP, Barker DG:药理学证据表明,根瘤菌根毛结瘤因子感知与细胞内反应(包括Ca2+尖峰和特异性ENOD基因表达)之间存在多种磷脂信号通路。植物科学学报,2004,26(3):366 - 366。10.1104 / pp.104.051110。
- 14.
Peleg-Grossman S, Volpin H, Levine A:截叶苜蓿根毛卷曲和根瘤菌侵染是由磷脂酰苷调控的内吞作用和活性氧介导的。应用物理学报,2007,38(3):357 - 357。10.1093 / jxb / erm013。
- 15.
富彻F,康多洛西E:紫花苜蓿结节器官发生过程中的细胞周期调节。植物化学学报,2000,43:773-786。10.1023 /: 1006405029600。
- 16.
Roudier F, Fedorova E, Lebris M, Lecomte P, Györgyey J, Vaubert D, Horvath G, Abad P, Kondorosi A, Kondorosi E:苜蓿种a2型周期蛋白是生长素调控的,参与分生组织形成,但对于核内重复相关的发育程序是必不可少的。中国生物医学工程学报,2003,31(3):344 - 344。10.1104 / pp.102.011122。
- 17.
Kondorosi E, Redondo-Nieto M, Kondorosi A:泛素介导的蛋白水解。在结节发育过程中,在正确的时间出现在正确的位置。植物科学进展,2005,27(3):344 - 344。10.1104 / pp.105.060004。
- 18.
Mathesius U, Schlaman HR, Spaink HP, Sautter C, Rolfe BG, Djordjevic MA:白三叶草根瘤形成前生长素转运抑制是由黄酮类化合物和几丁质寡糖衍生物调控的。植物学报,1998,14(3):344 - 344。10.1046 / j.1365 - 313 x.1998.00090.x。
- 19.
葛德华,陈建平,陈志伟,陈志伟。豆科-根瘤菌共生关系的研究进展。植物科学学报,2011,45:119-144。10.1146 / annurev -麝猫- 110410 - 132549。
- 20.
傅瑞杰,郭苏田,王志刚,李志刚,李志刚:细胞分裂素:共生的秘密因子。植物科学进展,2008,13:115-120。10.1016 / j.tplants.2008.01.003。
- 21.
Boot kkjm, van Brussel AAN, Tak T, Spaink HP, Kijne JW:豆科根瘤菌脂甲壳素寡糖的研究。豇豆降低了豇豆的生长素运输能力。黑人的根源。植物与微生物的相互作用。1999,12:839-844。10.1094 / MPMI.1999.12.10.839。
- 22.
van Noorden GE, Ross JJ, Reid JB, Rolfe BG, Mathesius U:截花苜蓿超数字结节突变体生长素长距离转运调控缺陷。植物科学进展,2006,30(4):344 - 344。10.1104 / pp.105.075879。
- 23.
Wasson AP, Pellerone FI, Mathesius U:阻断截叶苜蓿黄酮通路抑制根瘤菌对生长素运输的调控。植物学报,2006,18:1617-1629。10.1105 / tpc.105.038232。
- 24.
Tirichine L, Sandal N, Madsen LH, Radutoiu S, Albrektsen AS, Sato S, Asamizu E, Tabata S, Stougaard J:细胞分裂素受体的功能获得性突变引发自发的根结节器官发生。科学通报,2007,30(3):344 - 344。10.1126 / science.1132397。
- 25.
穆雷,张志刚,张志刚,张志刚,张志刚。根瘤菌对细胞分裂素感知突变体的研究进展。科学通报,2007,30(3):344 - 344。10.1126 / science.1132514。
- 26.
Gonzalez-Rizzo S, Crespi M, Frugier F:截叶紫花苜蓿CRE1细胞分裂素受体调控侧根发育和与黑根菌的早期共生相互作用。植物科学学报,2006,18:2680-2693。10.1105 / tpc.106.043778。
- 27.
穆雷JD:邀请入侵:豆科植物的根瘤菌感染。植物与微生物相互作用,2011,24:631-639。10.1094 / mpmi - 08 - 10 - 0181。
- 28.
Marsh JF, Rakocevic A, Mitra RM, Brocard L, Sun J, Eschstruth A, Long SR, Schultze M, Ratet P, Oldroyd GE:紫花苜蓿NIN在自活性钙/钙调素依赖蛋白激酶诱导的根瘤菌不依赖根瘤菌的结节器官发生中至关重要。植物科学进展,2007,29(3):344 - 344。10.1104 / pp.106.093021。
- 29.
Haney CH, Long SR:植物小舰队是被固氮细菌感染所必需的。美国国家科学研究院。2010, 27(4): 344 - 344。10.1073 / pnas.0910081107。
- 30.
Lefebvre B, Timmers T, Mbengue M, Moreau S, Hervé C, Tóth K, Bittencourt-Silvestre J, Klaus D, Deslandes L, Godiard L, Murray JD, Udvardi MK, Raffaele S, Mongrand S, Cullimore J, Gamas P, Niebel A, Ott T:一种与共生受体相互作用并调节细菌感染的蛋白质。美国国家科学研究院。2010, 27(3): 344 - 344。10.1073 / pnas.0913320107。
- 31.
Mergaert P, Nikovics K, Kelemen Z, Maunoury N, Vaubert D, Kondorosi A, Kondorosi E:截断紫花苜蓿的一个新家族,由300多个结节特异性基因组成,编码具有保守半胱氨酸基元的小分泌多肽。植物科学学报,2003,32(3):344 - 344。10.1104 / pp.102.018192。
- 32.
王志强,王志强,王志强。植物微生物相互作用研究进展。2006,26(3):344 - 344。10.1094 / mpmi - 9 - 0233。
- 33.
El Yahyaoui F, Küster H, Amor BB, Hohnjec N, Pühler A, Becker A, Gouzy J, Vernié T, Gough C, Niebel A, Godiard L, Gamas P:在Medicago truncatula中表达谱鉴定了超过750个在结瘤过程中差异表达的基因,包括许多共生程序的潜在调控因子。植物科学学报,2004,26(3):366 - 366。10.1104 / pp.104.043612。
- 34.
Pii Y, astrgno A, Peroni E, Zaccardelli M, Pandolfini T, Crimi M:截叶紫花苜蓿N5基因编码一种根特异性脂质转移蛋白,是与中华根瘤菌(Sinorhizobium meliloti)共生作用所必需的。植物与微生物的相互作用,2009,22:1577-1587。10.1094 / mpmi - 22 - 12 - 1577。
- 35.
Pii Y, Pandolfini T, Crimi M:信号LTPs:植物LTPs亚家族?植物生态学报,2010,30(4):594-597。
- 36.
高志刚,黄志刚,黄志刚,黄志刚:植物顺式作用调控DNA元件(PLACE)数据库。中国生物医学工程学报,1999,27(4):457 - 457。10.1093 / nar / 27.1.297。
- 37.
boison - dernier A, Andriankaja A, Chabaud M, Niebel A, Journet EP, Barker DG, de Carvalho-Niebel F:根瘤菌侵染和菌根丛枝发育过程中MtENOD11基因激活需要一个共同的含at -rich的调控序列。植物与微生物的相互作用,2005,18:1269-1276。10.1094 / mpmi - 18 - 1269。
- 38.
Vieweg MF, Fruhling M, Quandt HJ, Heim U, Baumlein H, Puhler A, Kuster H, Andreas MP:蚕豆豆红蛋白基因VfLb29启动子在不同豆科和非豆科植物的根结节感染细胞和含丛丛的菌根细胞中被特异性激活。植物微生物相互作用,2004,17:62-69。10.1094 / MPMI.2004.17.1.62。
- 39.
Fehlberg V, Vieweg MF, Dohmann EM, Hohnjec N, Puhler A, Perlick AM, Kuster H: eleghaemglobingenevflb29启动子:其在根结节感染细胞和菌根含丛枝细胞中激活所必需的模块的功能分析和鉴定。应用物理学报,2005,29(3):349 - 349。10.1093 / jxb / eri074。
- 40.
Hirsch S, Kim J, Muñoz A, Heckmann AB, Downie JA, Oldroyd GE:在截叶苜蓿结瘤信号过程中,GRAS蛋白形成DNA结合复合物诱导基因表达。植物学报,2009,21:545-557。10.1105 / tpc.108.064501。
- 41.
Ross EJ, Stone JM, Elowsky CG, Arredondo-Peter R, Klucas RV, Sarath G:细胞分裂素调控转录因子ARR1对水稻非共生血红蛋白-2启动子的激活。应用物理学报,2004,29(3):344 - 344。10.1093 / jxb / erh211。
- 42.
黄丽丽,王丽丽,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明。豌豆(Pisum sativum)吲哚乙酸诱导基因ps - ia4 /5中生长素响应元件AuxRE的鉴定。中华分子生物学杂志,1993,23(3):349 - 349。10.1006 / jmbi.1993.1537。
- 43.
Doherty D, Leigh JA, Glazebrook J, Walker GC:过度生产黑毛根瘤菌酸性钙氟结合胞外多糖的突变体。中华微生物学杂志,1998,17(4):489 - 497。
- 44.
Charon C, Sousa C, Crespi M, Kondorosi A: enod40表达的改变改变了中华根瘤菌(Sinorhizobium meliloti)诱导的截花苜蓿根瘤发育。《植物科学》,1999,11:1953-1966。
- 45.
黄志刚,李志刚,李志刚,李志刚,黄志刚:超胚性紫花苜蓿外植体的转录分析。中国生物医学工程学报,2008,8:110-10.1186/1471-2229-8-110。
- 46.
何杰,Benedito VA,王敏,Murray JD,赵px,唐勇,Udvardi MK:紫花苜蓿基因表达图谱web服务器。生物医学工程学报,2009,10:441-10.1186/1471-2105- 441。
- 47.
郭文杰,郭文杰,王文杰,王文杰,王文杰,王文杰,王文杰:过氧化物酶基因在根瘤菌侵染前的瞬时诱导作用。植物学报,1995,7:43-55。
- 48.
Journet EP, El-Gachtouli N, Vernoud V, de Billy F, Pichon M, Dedieu A, Arnould C, Morandi D, Barker DG, Gianinazzi-Pearson V: Medicago truncatula ENOD11:一种新的rprp编码早期结瘤蛋白基因,在含丛枝细胞菌根化中表达。植物与微生物的相互作用,2001,14:737-748。10.1094 / MPMI.2001.14.6.737。
- 49.
Tadege M, Wen J, He J, Tu H, Kwak Y, Eschstruth A, Cayrel A, Endre G, Zhao PX, Chabaud M, Ratet P, Mysore K:利用Tnt1逆转录转座子对豆科苜蓿进行大规模插入诱变。植物学报,2008,54:335- 344。10.1111 / j.1365 - 313 x.2008.03418.x。
- 50.
Wais RJ, Galera C, Oldroyd GE, Catoira R, Penmetsa RV, Cook D, Gough C, Denarié J, Long SR:截叶苜蓿结瘤突变体钙尖峰反应的遗传分析。美国国家科学研究院。2000, 37(4): 457 - 457。10.1073 / pnas.230439797。
- 51.
张志刚,张志刚,张志刚,等。磷脂酶C和D在植物根毛变形中的作用。植物学报,2001,25(4):344 - 344。10.1046 / j.1365 - 313 x.2001.00931.x。
- 52.
Kelly MN, Irving HR: Nod因子同时激活Vigna unguiculata的异三聚体和单体g蛋白(L.)Walp。植物学报,2003,26(3):344 - 344。
- 53.
陈晓明,杨晓明,陈晓明,等。根瘤菌Nod因子信号转导的研究进展。植物学报,1998,10:659-671。
- 54.
柯东,方强,陈超,朱红,陈涛,常鑫,袁松,康宏,马玲,洪志,张震:小GTPase ROP6与NFR5互作并参与莲叶结的形成。中国生物医学工程学报,2012,29(3):344 - 344。10.1104 / pp.112.197269。
- 55.
李文杰,李文杰,李文杰,李文杰:植物根毛共生发育的节点因子研究。根毛:细胞与分子生物学。编辑:Ridge RW, Emons AM。2000年,东京:斯普林格出版社,241-265。
- 56.
Kelly MN, Irving HR: Nod因子在体外刺激质膜定界磷脂酶C活性。中国生物医学工程学报,2001,29(3):344 - 344。10.1034 / j.1399-3054.2001.1130404.x。
- 57.
Kelly-Skupek MN, Irving HR: Nod因子激活磷脂和小GTP结合蛋白信号级联的药理学证据。植物化学学报,2006,29(4):344 - 344。10.1016 / j.plaphy.2006.03.004。
- 58.
杜晓霞,王晓明,王晓明,王晓明。磷脂酶D活化与植物细胞微管重组的关系。植物学报,2003,29(3):366 - 366。10.1105 / tpc.014977。
- 59.
穆尼克,李志刚,李志刚,马志刚,马志刚:G蛋白活化对植物磷脂酶D信号通路的影响。植物科学学报,2004,27(3):379 - 379。
- 60.
Stracke S, Kistner C, Yoshida S, Mulder L, Sato S, Kaneko T, Tabata S, Sandal N, Stougaard J, Szczyglowski K, Parniske M:细菌和真菌共生所需的植物受体样激酶。自然科学,2002,29(4):344 - 344。10.1038 / nature00841。
- 61.
张志刚,张志刚,张志刚,张志刚,等。一种控制共生根瘤发育的植物调控因子。自然科学,1999,29(4):344 - 344。10.1038/46058。
- 62.
Zanetti ME, Blanco FA, Beker MP, Battaglia M, Aguilar OM:根瘤菌侵染和结瘤发育所需的植物核因子NF-Y的C亚单位影响普通豆类- etli根瘤菌共生的伴侣选择。中国生物医学工程学报,2010,22:4142-4157。10.1105 / tpc.110.079137。
- 63.
Soto MJ, Domínguez-Ferreras A, Pérez-Mendoza D, Sanjuán J, Olivares J:互惠主义与发病机制:植物-细菌相互作用中的给予和接受。中国生物医学工程学报,2009,27(3):381-388。10.1111 / j.1462-5822.2009.01282.x。
- 64.
莫蒂埃V,皮套M,古马提格S:永远不会太多?豆科植物如何控制结节数量。植物生态学报,2012,34(3):344 - 344。10.1111 / j.1365-3040.2011.02406.x。
- 65.
Brechenmacher L, Kim MY, Benitez M, Li M, Joshi T, Calla B, Lee MP, Libault M, Vodkin LO, Xu D, Lee SH, Clough SJ, Stacey G:大豆慢生根瘤菌结瘤的转录谱分析。植物与微生物相互作用,2008,21:631-645。10.1094 / mpmi - 21 - 5 - 0631。
- 66.
范志刚,张志刚,张志刚:草甘膦根瘤菌与紫花苜蓿共生互作过程中感染败育伴随高敏感反应。植物学报,1993,4:555-566。10.1046 / j.1365 - 313 x.1993.04030555.x。
- 67.
Tellstrom V, Usadel B, Thimm O, Stitt M, Kuster H, Niehaus K:中华根瘤菌脂多糖抑制寄主植物截叶苜蓿细胞培养中防御相关基因的表达。植物科学学报,2007,29(3):344 - 344。
- 68.
Popp C, Ott T:根结节共生过程中信号转导和细菌感染的调控。植物学报,2011,14:458-467。10.1016 / j.pbi.2011.03.016。
- 69.
赫希AM, Bhuvaneswari TV, Torrey JG, Bisseling T:生长素运输抑制剂诱导紫花苜蓿根外生长的早期结节蛋白基因。美国国家科学研究院。1989, 86: 1244-1248。10.1073 / pnas.86.4.1244。
- 70.
孙文杰,王志刚,王志刚,王志刚,等。败育根瘤原基异位根的发育。植物与微生物的相互作用,2004,17:1043-1050。10.1094 / MPMI.2004.17.10.1043。
- 71.
叶芝TH,罗斯JKC:植物细胞外脂质转移蛋白(LTPs)的生物化学和生物学。蛋白质学报,2008,17:191-198。10.1110 / ps.073300108。
- 72.
蔡k, Lord EM:花粉管生长和引导:小的,分泌蛋白的作用。学报学报,2011,38(3):344 - 344。10.1093 / aob / mcr015。
- 73.
Maldonado AM, Dixon PA, Lamb CJ, Cameron RK:拟南芥系统性抗性信号的脂质转移蛋白。自然科学,2002,29(3):349 - 349。10.1038 / nature00962。
- 74.
Chae K, Kieslich CA, Morikis D, Kim SC, Lord EM:拟南芥脂质转移蛋白5的功能获得性突变干扰花粉管尖的生长和受精。植物学报,2009,21:3902-3914。10.1105 / tpc.109.070854。
- 75.
Meade HM, Long SR, Ruvkun GB, Brown SE, Ausubel FM:转座子Tn5诱变诱导的草尖根瘤菌共生和营养不良突变体的物理和遗传特性。中华微生物学杂志,2002,23(4):344 - 344。
- 76.
Quandt HJ, Pühler A, Broer I:转基因大毛豆根瘤:一种快速高效的不确定型根瘤基因表达研究系统。植物与微生物的相互作用,1993,6:699-706。10.1094 / mpmi - 6 - 699。
- 77.
Pii Y, Crimi M, Cremonese G, Spena A, Pandolfini T:生长素和一氧化氮控制不确定结节的形成。中国生物医学工程学报,2007,7:21-10.1186/1471-2229-7-21。
- 78.
杨晓明,王晓明,王晓明,王晓明:紫花苜蓿中钙含量的研究进展。IIA型钙泵和磷酸肌醇信号通路需要的证据。植物科学学报,2002,28(3):379 - 379。10.1104 / pp.010691。
- 79.
Molesini B, Pandolfini T, Pii Y, Korte A, Spena A:拟南芥AUCSIA-1调节生长素生物学,并与一种运动蛋白相关蛋白相互作用。公共科学学报,2012,7:e41327-10.1371/journal.pone.0041327。
- 80.
植物转化的二元农杆菌载体。中国生物医学工程学报,2004,27(4):344 - 344。10.1093 / nar / 12.22.8711。
- 81.
Oldroyd GE, Long SR: Medicago truncatula结节信号通路2基因的鉴定与鉴定。植物科学学报,2003,31(4):344 - 344。10.1104 / pp.102.010710。
- 82.
Veereshlingam H, Haynes JG, Penmetsa RV, Cook DR, Sherrier DJ, Dickstein R: nip,一种共生突变体,形成具有异常感染线和植物防御反应的根结节。中国生物医学工程学报,2004,26(3):366 - 366。10.1104 / pp.104.049064。
- 83.
杨晓明,陈志明,陈志明,陈志明,陈志明,陈志明,陈志明:根际农杆菌对截叶苜蓿根系固氮和内生菌根共生关系的研究。植物与微生物的相互作用,2001,14:695-700。10.1094 / MPMI.2001.14.6.695。
- 84.
DuBois M, Gilles KA, Hamilton JK, Rebers PA, Smith F:糖及其相关物质的比色测定方法。化学学报,2004,29(3):357 - 357。10.1021 / ac60111a017。
- 85.
Molesini B, Pandolfini T, Rotino GL, Dani V, Spena A: Aucsia基因沉默导致番茄孤雌果实发育。植物科学学报,2009,29(3):344 - 344。10.1104 / pp.108.131367。
确认
我们感谢Sharon R. Long慷慨地赠予净化的Nod因子和Pascal Gamas的善意提供美国meliloti内含pXLGD4质粒。我们感谢托马斯·奥特对手稿的批判性阅读。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
YP进行结瘤实验并撰写稿件;YP、BM进行分子分析;SM对根结节进行显微分析;TP负责协调研究并撰写稿件。所有作者都阅读并批准了最终的手稿。
电子辅助材料
核苷酸序列的假定
附加文件1:MtN5启动子和MtN5打开阅读框。ORF的开头用+1标识。被分析为假定启动子的区域位于起始密码子上游1.54 kb处。TATA框和CAAT框分别用双划线和虚线划线。其他突出显示的基序如下:OSE1ROOTNODULE (AAAGAT出现在反义方向),OSE2ROOTNODULE (AAGAG出现在正义和反义方向),NRE (AATTT), ARR1AT (AGATT)和AUXREPSIAA4 (GTCCCAT出现在反义方向)。(tiff 1013kb)
启动子活性在未接种
附加文件2:MtN5启动子活性在未接种m . truncatula根组织。A.有代表性的GUS染色图m . truncatula转基因不定根MtN5:格斯构造。插图分别显示侧根顶端(B)和侧根外露处(C)有代表性的GUS染色模式。(tiff格式1mb)
NF4257插入突变体描述及检测
附加文件3:DMI1突变背景下的表达。A.结构示意图Tnt1插入和表示用于插入系的遗传特征的寡核苷酸。B. qRT-PCR分析DMI1表达m . truncatulaR108野生型和NF4257根接种美国meliloti.表达数据归一化为内部肌动蛋白控制。以接种野生型根为定标样品,计算相对表达率。报告的值为平均值±标准差(n=3)。应用学生t检验。**, p < 0.01。(tiff格式231kb)
根毛变形和根瘤原基
附加文件4:MtN5 -沉默和控制根。a - b。根毛卷曲的代表性显微照片m . truncatula根接种美国meliloti。A.转基因不定根MtN5hp基因构造。B.含空T-DNA的转基因不定根(对照样品)。c - d。根结节原基的代表性显微图m . truncatula根接种美国meliloti携带pXLGD4质粒.通过对β-半乳糖苷酶活性的染色,表明原基内存在根瘤菌。C.结原基在转基因不定根上产生MtN5hp基因构造。D.含有空T-DNA的转基因不定根上产生的结节原基(对照样品)。(tiff 9mb)
12870 _2012_1216_moesm5_esm.doc
附加文件5:用于RT-PCR的引物。qRT-PCR实验中用作引物的寡核苷酸列表。(doc 32kb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Pii, Y., Molesini, B., Masiero, S.。et al。非特异性脂质转移蛋白N5Medicago truncatula与根瘤菌与宿主相互作用的表皮阶段有关。BMC植物生物学12日,233(2012)。https://doi.org/10.1186/1471-2229-12-233
收到了:
接受:
发表:
关键字
- Medicago truncatula
- MtN5
- 共生
- Sinorhizobium meliloti
- Pre-infection阶段
- 卷发