摘要
背景
在有丝分裂和减数分裂过程中,姐妹染色单体内聚的建立以及在中期到后期的受控释放是染色体忠实分离的必要条件。在DNA复制过程中,Scc2-Scc4复合体将内聚物加载到染色质上,通过Ctf7/Eco1对内聚物复合体的作用建立内聚。在DNA双链断裂修复过程中,姐妹染色单体的聚合也需要Ctf7。Ctf7含有一个乙酰转移酶结构域和一个锌指基序,并使内聚蛋白Smc3亚基中的保守赖氨酸残基乙酰化。在拟南芥中,CTF7是由一个单基因编码的AtCTF7导致胚胎致死说明该基因是必不可少的。
结果
为了研究Ctf7在植物中的功能,并确定其在姐妹染色单体聚合中的作用,我们构建了Ctf7的条件等位基因AtCTF7在拟南芥中采用诱导RNA干扰(RNAi)策略,以避免基因突变引起的胚胎致死AtCTF7.我们发现RNAi的诱导对抗AtCTF7在营养和生殖阶段造成严重的生长抑制和缺陷以及不育。AtCTF7-RNAi植株在减数分裂过程中表现出染色体碎裂和姐妹染色单体凝聚力的丧失。免疫染色显示,在减数分裂过程中,内聚亚基AtSCC3与染色质的结合明显减少AtCTF7rnai植物。
结论
我们发现AtCTF7是拟南芥减数分裂过程中姐妹染色单体凝聚所必需的,也是减数分裂前期内聚蛋白与染色质结合所必需的。
背景
在细胞分裂过程中,适当的染色体分离要求由DNA复制产生的姐妹染色单体保持在一起,直到它们在分裂后期被控制分离。这一功能是由内聚蛋白复合体完成的,其保守的核心亚基包括染色体结构维持(SMC)蛋白Smc1和Smc3,姐妹染色单体内聚(SCC)蛋白Scc3和α-kleisin蛋白Scc1 [1].根据内聚作用的环模型,Smc1和Smc3相互作用形成V型异质二聚体,在Scc3的帮助下被Scc1闭合,形成环,被认为是诱捕姐妹染色单体并将其物理连接在一起[2,3.].Scc1在后期被分离酶(一种被后期促进复合体/环体(APC/C)激活的蛋白酶)裂解而释放内聚性[3.].
在酿酒酵母,在Scc2-Scc4复合体将内聚蛋白加载到染色质上后,Ctf7/Eco1建立内聚[4- - - - - -6].Ctf7在S期建立内聚力,并与DNA复制机制的组成部分(包括PCNA和RFC)相互作用[5- - - - - -7].这些结果导致了一个模型,在该模型中,姐妹染色单体内聚与DNA复制同时建立[8].Ctf7编码一种具有活性乙酰转移酶结构域的锌指蛋白,研究发现Ctf7在保守赖氨酸上的Smc3乙酰化对内聚的建立至关重要,它可以中和Wpl1-Pds5复合体,阻止内聚的建立[9- - - - - -14].内聚力的建立被认为与滞后链合成同时发生[15],而导致功能内聚的Smc3乙酰化只发生在与复制相关的过程中[16].在Scc1被分离酶裂解后,Hos1的脱乙酰作用有助于Smc3亚基的循环利用,从而在中期到后期的转变中释放内聚力,这对内聚力的建立很重要[17- - - - - -19].的eso1-H17突变体中粟酒裂殖酵母由于纺锤体检查点激活,有丝分裂延迟,有丝分裂中染色体分离缺陷[20.].在果蝇, Deco突变导致中期内聚蛋白分布改变,提前进入后期[21].在人类中,突变在ESCO2导致罗伯茨综合征,其原因是着丝粒周围缺乏凝聚力,包括许多发育异常、智力迟钝、肾功能和心脏功能障碍[22].
在拟南芥中,建立凝聚力的机制是保守的,Scc2和Ctf7的同源物已经被发现并进行了功能鉴定。突变AtSCC2而且AtCTF7但会导致胚胎死亡AtCTF7对于胚乳的生长是不可缺少的[23,24].有趣的是,AtCTF7被发现具有乙酰转移酶活性在体外可以补充酵母ctf7 - 203突变,表明与酵母对应物具有保守的生化功能[23].通过使用条件RNA干扰(RNAi)方法,已经证明AtSCC2在减数分裂过程中姐妹染色单体的凝聚、染色体轴的形成和同源体之间的突触[24].的功能AtCTF7姐妹染色单体凝聚力的建立在足底还有待展示。
在这里,我们使用条件RNAi方法来检查的作用AtCTF7在姐妹染色单体内聚,并分析损失的影响AtCTF7在营养和生殖发育过程中。我们发现下调AtCTF7在营养和生殖阶段严重抑制生长,导致雄性和雌性不育。在减数分裂过程中,AtCTF7-RNAi系表现出典型的内聚缺失表型,包括染色体组织异常、染色体突触受损和DNA碎片化。符合预期的参与AtCTF7在凝聚力方面,我们发现姐妹染色单体在染色体臂和着丝粒上都失去了凝聚力AtCTF7rnai植物。最后,我们发现AtSCC3在减数分裂过程中染色质定位受损AtCTF7-RNAi植物,表明AtCTF7在拟南芥中,内聚蛋白与染色体的结合需要Deco,这一特征似乎与果蝇相似,在M期Scc1与染色体的结合需要Deco [21].总的来说,我们的研究结果为AtCTF7在减数分裂期间的营养发育和姐妹染色单体的凝聚中。
结果
AtCTF7在营养和生殖阶段都是生长所必需的
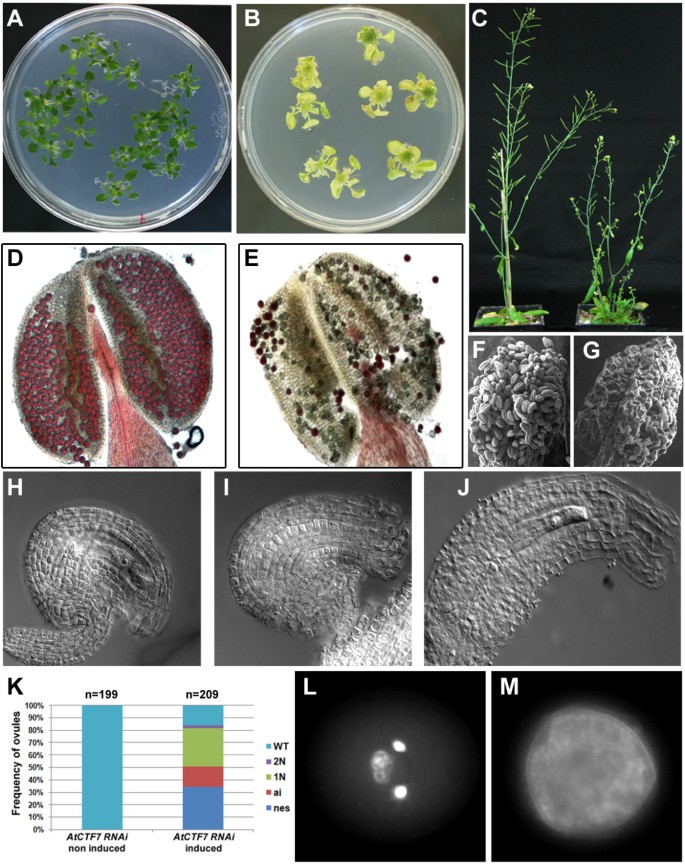
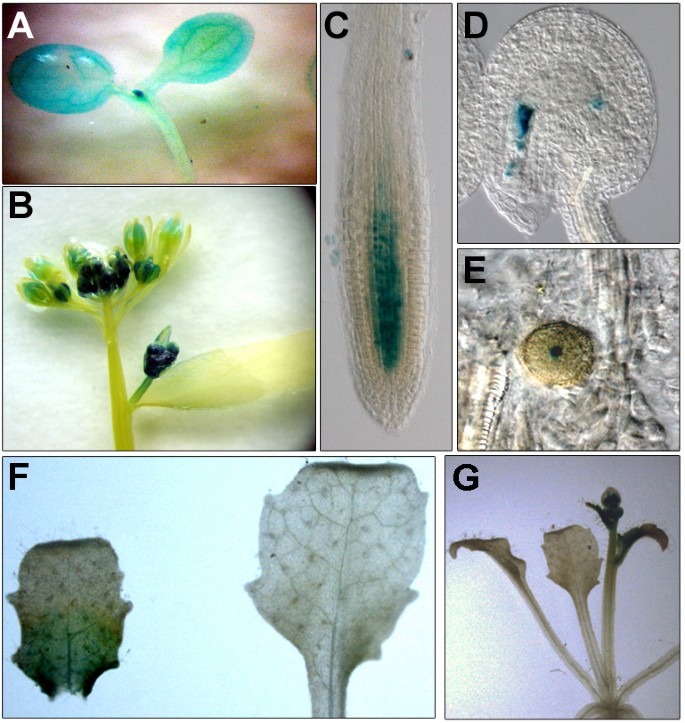
为了研究AtCTF7在不同发育阶段的需求,我们使用诱导RNAi方法构建了一个条件等位基因来耗尽AtCTF7 mRNA。一个发夹型RNAi结构AtCTF7制成并置于地塞米松诱导物LhGR的控制之下[25].培育T1转化体并收集种子。T2植株在营养期或抽苔后进行地塞米松处理。在营养阶段的处理导致气相和根组织的生长缺陷,并伴随着绿色的丧失(图1A和B,附加文件1:图S1),表明在营养生长阶段植物生长需要AtCTF7。抽苔后用地塞米松处理会导致花序生长受到强烈抑制和不育(图1C).地塞米松处理后花粉基本无菌且无法存活(图)1D-G),缺乏清晰的精子和营养核(图1L和M,附加文件1:图S2)。处理过的植株的胚珠在早期阶段就表现出雌配子体发育受阻(1n),并且缺少胚囊(图)1H-K)。部分胚珠在胚珠发育过程中也表现出缺陷1J).共检测了29个独立转化株,其中5个系在地塞米松处理后表现出强烈的生长缺陷和不育。AtCTF7表达的定量比较表明,与未处理对照植株相比,处理植株的AtCTF7表达减少1:图S3),与生长缺陷是由于损耗AtCTF7.检查AtCTF7启动子活性使用PAtCTF7nlsGUS记者指出,AtCTF7启动子在芽和根分生组织区域都有活性(图2一个和2C),以及幼芽和叶片(图2一个和2B).在老叶和花中表达减少(图2B).在生殖细胞内,在花粉和雌性配子体中观察到表达(图2D和2E),与上述配子发生缺陷一致AtCTF7rnai植物。
atctf7基因敲低导致生长缺陷和不育。RNAi介导的AtCTF7基因下调导致生长抑制、雌雄配子体缺陷和不育。(A, B)经处理后色泽下降,生长受到抑制(B)与未经处理的(一)AtCTF7 -RNAi幼苗。(C)与未处理组(左)相比,处理组(右)生长受损和角果不育AtCTF7 -RNAi成年植物。(D, E)成熟花药的亚历山大染色显示,处理后花粉活力下降(绿色颗粒取代紫色颗粒)(E)与未经处理的(D)AtCTF7 -RNAi成熟花药。(F, G)未处理花药的扫描电子显微图(F)和治疗(G)AtCTF7 -RNAi植株在处理后花粉粒减少。(H-J)处理后雌性配子体和胚珠发育受损(我,我)与未经处理的(H)AtCTF7 -RNAi植物。(我)缺少一个雌配子体的胚珠。(J)胚珠具有异常的被皮发育。(K)雌配子体和胚珠缺陷的定量显示(我)而且(J)胚珠期3-4至3-6 [26].配子体包含大于2个核的可分为单核(1N)、双核(2N)、缺失(nes)或野生型(WT)。Ai:胚珠显示异常的被皮发育。(L, M)成熟花粉粒DAPI染色显示,处理后的雄配子体染色质缺失(M)与未经处理的(左)AtCTF7 -含有两个精子细胞和一个营养细胞的RNAi植物。
这些结果表明,AtCTF7在分裂细胞中表达,是营养和生殖阶段正常发育和生长所必需的。
在减数分裂过程中,AtCTF7的表达下调会导致姐妹染色单体内聚和染色体组织的缺陷
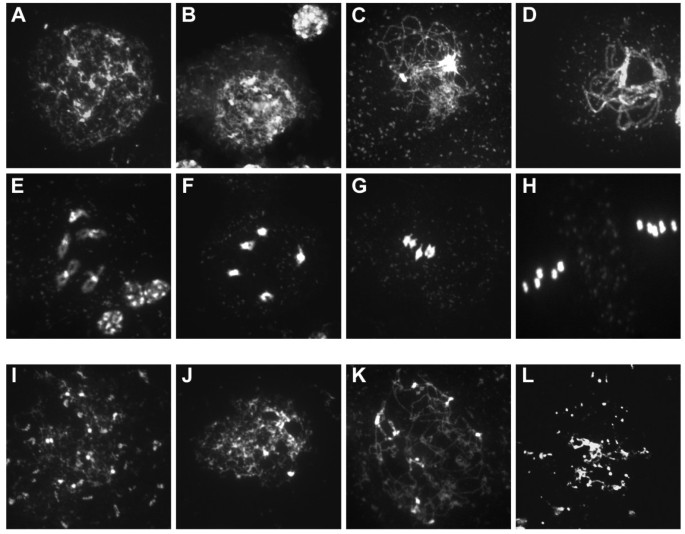
为了研究AtCTF7在减数分裂中是否需要,我们在来自的雄性减数细胞上进行了染色体扩增AtCTF7rnai植物(图3.).未经地塞米松处理的植株表现出正常的配对和突触,减数分裂染色体的组织也正常3.a)。早期前期表现为细线期出现细染色体线,随后是接合线期和粗线期,显示染色体正常配对和突触(图3.模拟)。随后的前期晚期和减数分裂I和II阶段,在未处理的植株中也能正常发生(图3.情况)。相比之下,使用地塞米松处理的植物在减数分裂染色体组织中出现了严重的缺陷3.我)。早期I期染色体缺陷较明显,但无法明确区分特征分期。染色体排列紊乱,呈斑块状,带有不连续。合胞结没有形成,前期中后期的染色体表现为团块和高度碎片化(图3.i (k)。晚期前期的特征是存在染色体浓缩片段,其数量可能超过20个,表明发生了片段化(图3.L)。
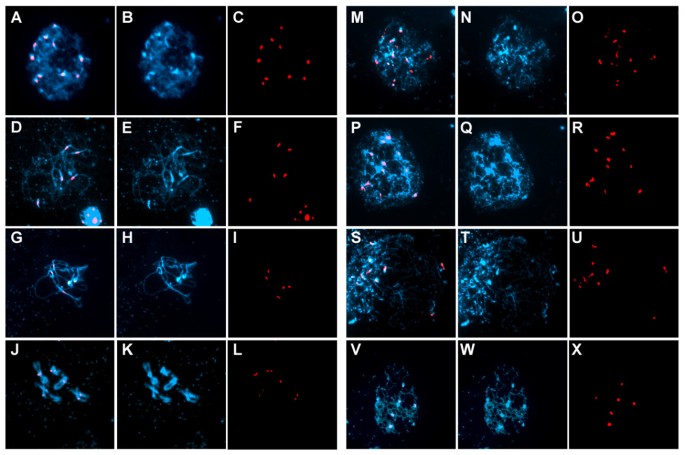
为了检测AtCTF7在姐妹染色单体内聚和着丝粒区配对中的作用,我们使用与所有着丝粒杂交的着丝粒重复探针进行了荧光原位杂交(FISH) [24].在未处理的对照植株中,8-10个着丝粒信号(平均= 9.5;N = 33)在减数细胞早期前期(细线期)可明显检测到,而在接合线期和粗线期,3-5个信号(平均= 3.1;n = 72)4l)。地塞米松处理的植株,早期前期信号数在9 ~ 20之间(平均= 12.0;n = 64)。在前期I有超过10个信号的存在,表明在细胞中着丝粒内聚缺失AtCTF7rnai植物(图4m x)。此外,信号的形状也有可变性AtCTF7-RNAi植株与未处理对照植株相比,提示着丝粒组织存在缺陷。这些结果表明,AtCTF7是配对、内聚和中心区正确组织所必需的。为了检查手臂内聚性,我们使用了针对4号染色体的BAC探针5).在未经处理的植物中,我们在前期早期观察到两个信号,在前期中期染色体完全联结的减数细胞中观察到一个信号5A-F),而在地塞米松处理的植物中,我们观察到两种以上的信号(图5G-L)。总的来说,结果表明AtCTF7对着丝粒和臂内聚都是必需的。
中中心粒配对和内聚的丧失AtCTF7rnai男性性母细胞。雄性减数分裂染色体的FISH与着丝探针杂交,显示DAPI(蓝色)和探针(红色)。(1)未经处理的转基因AtCTF7 -RNAi线,(mx)转基因AtCTF7 -用地塞米松处理的RNAi系。对于每个面板,左列显示DAPI和探针的合并图像,中列显示DAPI,右列单独显示探针。(两者)显示10个着丝粒的早期细线细胞。(D-F)晚接合线显示5个着丝粒信号作为着丝粒突触的结果。(胃肠道)粗线显示5个中心点信号作为染色体的突触是完整的。(J-L)双线期。(M-O P-R)早期减数分裂前期,显示10多个着丝粒信号。(苏堤,v x)减数分裂中期前期,显示10多个着丝粒信号(苏堤)还有6个中心点信号(v x).
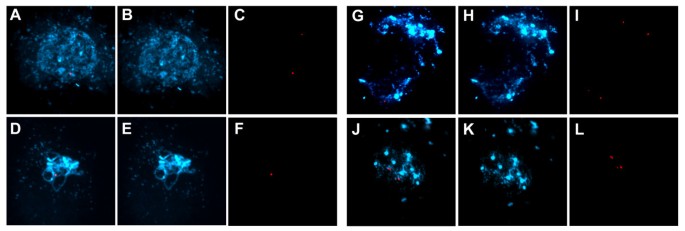
内聚物与染色质的联系减少AtCTF7rnai植物
为了研究AtCTF7在姐妹染色单体内聚和染色体组织中的作用,我们研究了亚基AtSCC3内聚的定位[27],轴向元件蛋白ASY1 [28)在雄性减数分裂期间(图6额外的文件1:图S4)。在未处理的对照植物中,AtSSC3免疫染色在早期前期扩展到整个染色质,并在接合线和粗线期标记染色体轴(图6p)。相比之下,AtSCC3免疫染色水平在雄性减数细胞中显著降低AtCTF7-RNAi植物从早期前期开始(图6Q-AF)。对照植物的ASY1免疫染色在早期前期可见,标记在细线染色体轴(图6C, G, K, O),染色模式与AtSCC3重叠(图6D, H, L, P)AtCTF7-RNAi植物中,ASY1与染色质的结合与对照植物相当(图6S, w, aa, ae)。因此,尽管染色质的ASY1染色显示出与AtSCC3染色的显著重叠,但其与染色质的联系似乎独立于已知的先于ASY1的AtSCC3,也与分析相一致Atscc3-1突变体(27].
讨论
Ctf7/Eco1蛋白已被证明可以控制酵母内聚力的建立,果蝇,以及哺乳动物[5,6,20.,21,29].就植物而言,Ctf7的拟南芥同源物(AtCTF7)已被证明是胚胎发育所必需的,但不是胚乳发育所必需的[23],为减数分裂中姐妹染色单体分离的独立于ctf7的机制提供了可能性。酵母中姐妹染色单体分离的独立于ctf7的机制的证据是基于酵母的活性eco1∆wpl1∆应变(30.].基于产孢过程中的单倍体不足,有人提出Ctf7在酵母减数分裂中的剂量依赖作用[15].因此,与有丝分裂相比,在酵母减数分裂中姐妹染色单体凝聚力的建立可能对降低Ctf7剂量更敏感。或者,在减数分裂过程中,Ctf7对其他蛋白质的乙酰化作用也可能参与其中[31].通过对小鼠ESCO2定位和调控的研究,也提示Ctf7在减数分裂中的作用[32],但在姐妹染色单体的凝聚中,特别是在减数分裂期间,Ctf7的需求仍有待确定。在本研究中,我们以拟南芥为模型,证明了减数分裂中姐妹染色单体内聚也需要AtCTF7。
条件RNAi方法检测AtCTF7在植物中的功能,发现在减数分裂中姐妹染色单体内聚缺陷。在减数分裂过程中,手臂区和中心点区姐妹染色单体内聚的建立依赖于AtCTF7。减数分裂表型包括前期早期的缺陷,表现为细线期和接合线期线状外观特征的不连续。在最严重的病例中,丝状结构基本缺失,染色质高度碎片化。在后期的前期阶段,通过大量分离和浓缩的染色质片段的存在,碎片化表型进一步明显。结果与(在减数分裂中)修复已知需要Ctf7的双链断裂的失败一致[33].碎裂表型与观察到的相似Atrec8而且Atmnd1在减数分裂双链断裂修复中存在缺陷的突变体[34,35].然而,由于采用的RNAi策略并不是专属于减数分裂,因此不排除在减数细胞的祖细胞有丝分裂过程中早期AtCTF7的缺失也可能影响碎裂表型。拟南芥突变体在减数分裂双链断裂形成和内聚力方面都存在缺陷,但不显示这种片段化表型[27,36].
我们观察到在营养和生殖生长和发育的严重缺陷,指出了一个作用AtCTF7在整个植物生命周期中,并扩展了以前的工作,显示了一个必要的要求AtCTF7在胚胎发育中[23].一个PAtCTF7nlsGUSReporter在根和茎分生组织、幼芽和叶片中均有强表达。在发育的幼叶中,GUS染色观察到表达极性仅限于叶的基部,远端部分不存在。表达梯度与细胞分裂标记CycB1相似;1::GUS [37].在较老的芽中表达下降,在扩大的莲座叶中没有观察到。由此可见,AtCTF7的表达发生在细胞分裂活跃的组织中,这与已知的Ctf7与DNA复制共同促进凝聚力建立的作用相一致[8].在生殖细胞内,在花粉和雌性配子体中观察到表达。我们观察到的不育表型可能主要是由于减数分裂中的缺陷以及配子体成分的可能贡献。
Ctf7内聚的建立涉及到内聚Smc3亚基中保守赖氨酸残基的乙酰化,这抑制了Wpl1-Pds5复合体阻止内聚的作用[9,10,12- - - - - -14].在酵母中,果蝇,在人类细胞中,Ctf7/Eco1是内聚物建立所必需的,而不是内聚物与间期染色质结合所必需的[5,21,29].在果蝇,一个德科突变体显示有丝分裂前中期内聚蛋白亚基Scc1染色减少[21].免疫染色显示,在减数分裂早期,AtSCC3与染色质的联系强烈减少AtCTF7-RNAi植物类似于已经观察到的德科这表明Ctf7/Eco1功能在植物中是守恒的。
结论
综上所述,我们的研究结果表明,在拟南芥减数分裂过程中,姐妹染色单体凝聚力的建立需要AtCTF7,而在减数分裂过程中,内聚蛋白与染色质的持续结合依赖于AtCTF7。
方法
植物材料和生长条件
的拟南芥使用的菌株是哥伦比亚生态型(Col-0)。植物按[38].为了生成转基因拟南芥,构建物被动员到根癌土壤杆菌AGL-1菌株采用三亲本交配,转化为拟南芥采用真空渗滤方法,详见[39].PAtCTF7nlsGUS被转化为野生型Col,而AtCTF7-RNAi转化为一条携带PCaMV35SLhGR-N转基因(25].在含有120 μg/ml庆大霉素(Sigma-Aldrich)的MS培养基上选择转基因植株AtCTF7-RNAi转化子,50 μg/ml卡那霉素PAtCTF7nlsGUS经PCR进一步证实。
克隆的过程
的AtCTF7启动子,由ATG上游646 bp和ATG上游45 bp组成AtCTF7用引物fctf7gushinii和Rctf7gusnlsBamH1对其进行PCR扩增,克隆为bamh1 - hinii片段nlsGUS标记在pBI101.2二进制向量中。RNAi构建中,用引物对F1rnaiXba1和R1rnaiBamH1、F1rnaiXho1和R1rnaiEcoR1 PCR扩增658 bp片段,克隆为pKANNiBAL中相反方向的Xba1-BamH1和Xho1-EcoR1片段[40].将RNAi盒式磁带体作为XhoI-BamH1片段切除,并克隆到二进制载体pZP222-6xPOP中[25].
地塞米松治疗
转基因种子在MS板上萌发,生长7 d后转移到含有20 μM地塞米松(Sigma)的MS板上。幼苗转移到地塞米松平板后7天进行表型分析。抽苔后的成株处理,用20 μM地塞米松掺入分灌的溶液中。在地塞米松处理开始后5天,收集减数分裂分析样本进行分析。
RNA分离和定量RT-PCR
使用Trizol (Invitrogen)按照制造商的协议分离总RNA。利用逆转录系统(Invitrogen SuperScript II)和寡聚(dT)引物进行cDNA合成。实时PCR反应使用SYBR绿色PCR主混合物(应用生物系统公司)进行。采用GAPC作为内部归一化控制。根据制造商的建议,在ABI Prism 7900 HT序列检测系统(应用生物系统)384孔反应板上进行PCR。引物为Ctf7qRTF和Ctf7qRTRAtCTF7和GAPRTF和GAPRTR用于GAPC(附加文件1:表S1)。循环参数包括50°C孵育2分钟,95°C孵育10分钟,95°C孵育15秒,57°C孵育30秒,67°C孵育30秒,循环40次。对每个RNA样本进行三次PCR反应,实验在代表同一RNAi系的两个不同生物样本上进行。在每次PCR结束时,使用ABI棱镜解离曲线分析软件验证扩增的特异性。使用Microsoft Excel对ABI Prism 7900 HT序列检测系统的结果进行了进一步分析。使用2-ΔCt方法,从实时PCR扩增图的对数线性范围内的阈值点(Ct值)计算mRNA的相对量。附加文件中的标准偏差1:图S1表示生物样本间的变异。
细胞学过程
如前所述,在苯甲酸甲酯中固定和清除花序后,对胚珠进行全装分析[38].用日立3400n型扫描电子显微镜对花粉进行扫描电镜分析。http://www.hitachi-hitec.com).用Alexander染色法检测花粉活力[41].对花粉进行DAPI分析时,将花药压扁,用DAPI (1 μg/ml)染色。减数分裂染色体扩展如[42],稍加修改[43].在蔡司Axioplan 2成像显微镜上,使用Plan Apochromat 63 ×油浸物镜进行观察。组织PAtCTF7nlsGUS对转基因植物进行GUS活性染色,如[38].
FISH按照上述方法进行染色体扩增,FISH分析方法参照[44],稍加修改[35].180 bp的着丝粒pAL1重复用于检测着丝粒序列[45].在Cy3-dATP (GE Healthcare)存在的情况下,使用PAL正向和反向引物对含有两个pAL1重复副本的质粒进行PCR(附加文件)1:表S1)。4号染色体上的BAC克隆T19F6和T22A6被Cy3-dATP (Roche)标记后作为探针监测手臂内聚。在配有Plan Apochromat 63×油浸物镜的蔡司Axioplan 2成像显微镜下观察玻片,使用激发(Cy3, 550 nm)和长通发射(Cy3, 570 nm)滤光片。
免疫染色时,花序按[46].取幼芽,用pH4.5 (1× CB) 10 mM柠檬酸缓冲液(Citrate Buffer)洗涤,1× CB中含有0.3%纤维素酶、0.3%果胶水解酶、0.4%细胞解旋酶(all Sigma)的细胞壁消化酶混合物消化,37℃孵育30 min。用1× PBS代替酶混合液,在载玻片上从花蕾中分离出花药,用22×22 mm盖玻片压扁。滑梯用液氮浸渍速冻,盖滑梯立即取出。然后将载玻片干燥,在1%明胶、1%琼脂糖溶液中短暂浸泡,在细胞上覆盖一层薄薄的明胶-琼脂糖,然后晾干。玻片在1× PBS中再水化,用上述酶混合物在37℃下消化30分钟。然后在含1% Triton-X100的1× PBS中渗透30min,在含0.1% Triton-X100的1× PBS中洗涤2-3次。免疫染色如[24],使用1:1000稀释的ASY1抗体和1:20 00稀释的AtSCC3抗体。所有二抗均以1:100稀释使用。载玻片在Vectashield (VectorLabs)中以1ug/ml的DAPI安装。使用蔡司Axio成像仪对细胞进行成像。Z1显微镜,配有一个apome模块,使用Plan-Apochromat 63×油浸物镜。
尽管这篇手稿正在审阅中,Bolanos-Villegas等人在网上发表了一项有关AtCTF7在DNA修复、有丝分裂和减数分裂中的作用的相关研究[47].
参考文献
内聚素:它的作用和机制。科学通报,2009,43:525-558。10.1146 / annurev -麝猫- 102108 - 134233。
Rudra S, Skibbens RV:内聚蛋白编码-解释染色质结构和内聚蛋白功能的多个方面。中国生物医学工程学报,2013,29(6):381 - 381。10.1242 / jcs.116566。
内聚蛋白:一种有独立入口和出口的连环酶。细胞生物学杂志,2011,13:1170-1177。10.1038 / ncb2349。
Ciosk R, Shirayama M, Shevchenko A, Tanaka T, Toth A, Shevchenko A, Nasmyth K:内聚蛋白与染色体的结合依赖于由scc2和scc4蛋白组成的单独复合体。分子生物学杂志,2000,5:243-254。10.1016 / s1097 - 2765(00) 80420 - 7。
Tóth A, Ciosk R, Uhlmann F, Galova M, Schleiffer A, Nasmyth K:酵母内聚复合体在DNA复制过程中需要一种保守蛋白Eco1p(Ctf7)在姐妹染色单体之间建立内聚。基因工程学报,1999,29(4):369 - 369。10.1101 / gad.13.3.320。
Skibbens RV, Corson LB, Koshland D, Hieter P: Ctf7p对于姐妹染色单体的凝聚和连接有丝分裂染色体结构到DNA复制机制是必不可少的。基因学报1999,13:307-319。10.1101 / gad.13.3.307。
Moldovan G-L, Pfander B, Jentsch S: PCNA控制S期姐妹染色单体内聚的建立。分子生物学杂志,2006,23:723-732。10.1016 / j.molcel.2006.07.007。
Sherwood R, Takahashi TS, Jallepalli PV:姐妹行为:协调DNA复制和凝聚力的建立。基因学报2010,24:2723-2731。10.1101 / gad.1976710。
Sutani T, Kawaguchi T, Kanno R, Itoh T, Shirahige K:芽殖酵母wpl1(rad61)-pds5复合体对抗姐妹染色单体建立内聚反应。中华微生物学杂志,2009,19:492-497。10.1016 / j.cub.2009.01.062。
Ben-Shahar TR, Heeger S, Lehane C, East P, Flynn H, Skehel M, Uhlmann F:姐妹染色单体内聚过程中乙酰化过程中eco1依赖性内聚。科学通报,2008,31(4):563-566。10.1126 / science.1157774。
Heidinger-Pauli JM, Ünal E, Koshland D: eco1乙酰转移酶的不同靶点调节S期内聚和对DNA损伤的反应。分子生物学杂志,2009,34:311-321。10.1016 / j.molcel.2009.04.008。
Rowland BD, Roig MB, nisino T, Kurze A, Uluocak P, Mishra A, Beckouët F, Underwood P, Metson J, Imre R, Mechtler K, Katis VL, Nasmyth K:建立姐妹染色单体内聚:Smc3乙酰化抵消反建立活性。分子生物学杂志,2009,33:763-774。10.1016 / j.molcel.2009.02.028。
Ünal E, Heidinger-Pauli JM, Kim W, Guacci V, Onn I, Gygi SP, Koshland DE:建立姐妹染色单体凝聚力的分子决定因素。科学通报,2008,31(4):566-569。10.1126 / science.1157880。
张静,史鑫,李勇,金宝杰,贾静,黄震,杨涛,付鑫,荣玉玉,王莹,张萍,金世涛,潘鑫,秦静:人和酵母中Smc3经Eco1乙酰化后S相姐妹染色单体的聚合是必要的。细胞学报,2008,31:143-151。10.1016 / j.molcel.2008.06.006。
Rudra S, Skibbens RV:姐妹染色单体内聚的建立与滞后链的合成是一致的。细胞周期。2012,11:2114-2121。10.4161 / cc.20547。
宋娟,Lafont A,陈娟,吴凤梅,Shirahige K, Rankin S:内聚蛋白乙酰化只与复制机制相关,促进姐妹染色单体的内聚。中国生物医学工程学报,2012,29(3):394 - 394。10.1074 / jbc.M112.400192。
Rivera T, Losada A:去乙酰化回收内聚环。分子生物学杂志,2010,39:657-659。10.1016 / j.molcel.2010.08.032。
Beckouët F, Hu B, Roig MB, Sutani T, Komata M, Uluocak P, Katis VL, Shirahige K, Nasmyth K: Smc3乙酰化循环是建立姐妹染色单体凝聚力的必要条件。分子生物学杂志,2010,39:689-699。10.1016 / j.molcel.2010.08.008。
Borges V, Lehane C, Lopez-Serra L, Flynn H, Skehel M, Ben-Shahar TR, Uhlmann F: Hos1使Smc3脱乙酰,关闭乙酰化循环中的内聚物。分子生物学杂志,2010,39:677-688。10.1016 / j.molcel.2010.08.009。
Tanaka K, Yonekawa T, Kawasaki Y, Kai M, Furuya K, Iwasaki M,村上H,柳田M,冈山H: S期建立姐妹染色单体聚合需要裂变酵母eso1p。细胞生物学杂志,2000,20:3459-3469。10.1128 / mcb.20.10.3459 - 3469.2000。
Williams BC, gartt - engele CM, Li Z, Williams EV, Rosenman ED, Goldberg ML:两种假定的乙酰转移酶San和Deco在果蝇姐妹染色单体内聚过程中是必需的。中华微生物学杂志,2003,13:2025-2036。10.1016 / j.cub.2003.11.018。
Vega H, Waisfisz Q, Gordillo M, Sakai N, Yanagihara I, Yamada M, van Gosliga D, Kayserili H, Xu C, Ozono K, Jabs EW, Inui K, Joenje H: Roberts综合征是由Esco2的突变引起的,Esco2是酵母Eco1的人类同源物,对建立姐妹染色单细胞凝聚力至关重要。科学通报,2005,37:468-470。10.1038 / ng1548。
蒋亮,袁亮,夏明,Makaroff CA:适当水平的拟南芥凝聚力建立因子Ctf7对胚和大孢子体的发育是必要的,而对胚乳的发育则不是。植物生理学报,2010,32(4):366 - 366。10.1104 / pp.110.157560。
Sebastian J, Ravi M, Andreuzza S, Panoli AP, Marimuthu MPA, Siddiqi I:拟南芥减数分裂过程中植物粘附蛋白AtSCC2在胚胎发生和姐妹染色单体聚合中起重要作用。植物学报,2009,29(4):371 - 371。10.1111 / j.1365 - 313 x.2009.03845.x。
Craft J, Samalova M, Baroux C, Townley H, Martinez A, Jepson I, Tsiantis M, Moore I:拟南芥糖皮质激素依赖转基因表达的新pOp/LhG4载体。植物学报,2005,29(4):369 - 371。10.1111 / j.1365 - 313 x.2005.02342.x。
作者:王晓东,王晓东,王晓东。拟南芥野生型胚珠发育的光学显微镜研究。植物学报,2003,23(4):449 - 449。10.1046 / j.1365 - 313 x.1995.07050731.x。
Chelysheva L, Diallo S, Vezon D, Gendrot G, Vrielynck N, Belcram K, Rocques N, Márquez-Lema A, Bhatt AM, Horlow C, Mercier R, Mézard C, Grelon M: AtREC8和AtSCC3对减数分裂中着丝点的单极取向至关重要。中国生物医学工程学报,2004,24(3):366 - 366。10.1242 / jcs.02583。
Armstrong SJ, Caryl AP, Jones GH, Franklin FCH: Asy1是减数分裂染色体突触所需的蛋白质,定位于拟南芥和芸苔属植物的轴相关染色质。中国生物医学工程学报,2002,29(3):366 - 366。10.1242 / jcs.00048。
Hou F, Zou H: Eco1/Ctf7乙酰转移酶的两个人类同源物都是正确的姐妹染色单体聚合所必需的。细胞生物学杂志,2005,16:3908-3918。10.1091 / mbc.e04 - 12 - 1063。
Guacci V, Koshland D:芽殖酵母姐妹染色单体的内聚独立分离。中华分子生物学杂志,2012,23:729-739。10.1091 / mbc.e11 - 08 - 0696。
Ghosh S, Gardner JM, Smoyer CJ, Friederichs JM, Unruh JR, Slaughter BD, Alexander R, Chisholm RD, Lee KK, Workman JL, Jaspersen SL: Eco1对SUN蛋白mp3的Acetylation调节其在核组织中的功能。中国生物医学杂志,2012,23:2546-2559。10.1091 / mbc.e11 - 07 - 0600。
Evans EB, Hogarth C, Evanoff RM, Mitchell D, Small C, Griswold MD:小鼠Esco2在雄性和雌性减数分裂过程中的定位和调节。中国生物工程学报,2012,31(5):369 - 369。
Lu S, Goering M, Gard S, Xiong B, McNairn AJ, Jaspersen SL, Gerton JL: Eco1在酿酒酵母DNA损伤修复中的作用。细胞周期。2010,9:3315-3327。10.4161 / cc.9.16.12673。
白X, Peirson BN,董峰,薛晨,Makaroff CA:拟南芥减数分裂必需基因SYN1的分离与鉴定。植物学报,1999,29(4):347 - 347。
Panoli AP, Ravi M, Sebastian J, Nishal B, Reddy TV, Marimuthu MP, Subbiah V, Vijaybhaskar V, Siddiqi I:拟南芥减数分裂过程中同源配对需要AtMND1。分子生物学杂志,2006,7:24-10.1186/1471-2199-7-24。
Mercier R, Armstrong SJ, Horlow C, Jackson NP, Makaroff CA, Vezon D, Pelletier G, Jones GH, Franklin FCH:拟南芥中减数分裂蛋白SWI1是轴向元素形成和重组启动所必需的。发展,2003,130:3309-3318。10.1242 / dev.00550。
唐nelly PM, Bonetta D, Tsukaya H, Dengler RE, Dengler NG:拟南芥叶片发育过程中的细胞周期和细胞增大。生物技术学报,1999,29(4):347 - 347。10.1006 / dbio.1999.9443。
Siddiqi I, Ganesh G, Grossniklaus U, Subbiah V:在拟南芥中,通过雌性减数分裂的过程中需要dyad基因。《发展》2000,127:197-207。
Bechtold N, Pelletier G:在植物中,农杆菌介导的拟南芥成体植株真空浸润转化。方法中华分子生物学杂志1998,32(4):359 - 366。
Wesley SV, Helliwell CA, Smith NA, Wang M, Rouse DT, Liu Q, Gooding PS, Singh SP, Abbott D, Stoutjesdijk PA, Robinson SP, Gleave AP, Green AG, Waterhouse PM:植物中高效、有效和高通量基因沉默的构建设计。植物学报,2001,27:581- 589。10.1046 / j.1365 - 313 x.2001.01105.x。
Alexander MP:败花粉和未败花粉的差异染色。染色技术,1996,44:117-122。
Ross KJ, Fransz P, Jones GH:拟南芥减数分裂的光镜图谱。染色体研究,1996,4:507-516。10.1007 / BF02261778。
agashi B, Prasad CK, Siddiqi I:拟南芥减数分裂染色体组织和雌性减数分裂进程所需基因DYAD的鉴定与分析。《科学进展》,2002,29:3935-3943。
Fransz P, Armstrong S, Alonso-Blanco C, Fischer TC, Torres-Ruiz RA, Jones G:拟南芥模型系统的细胞遗传学研究。植物学报,1998,13:867-876。10.1046 / j.1365 - 313 x.1998.00086.x。
Martinez-Zapater JM, Estelle MA, Somerville CR:拟南芥的高度重复DNA序列。中国生物医学工程学报,2004,25(4):426 - 426。10.1007 / BF00331018。
蔡鑫,董芳,Edelmann RE, Makaroff CA:拟南芥SYN1内聚蛋白是姐妹染色单体臂内聚和同源染色体配对所必需的。中国生物医学工程学报,2003,29(3):369 - 369。10.1242 / jcs.00601。
Bolaños-Villegas P,杨欣,王海军,Juan CT, Chuang MH, Makaroff CA, Jauh GY:拟南芥染色体传输保真度7 (AtCTF7/ECO1)在DNA修复、有丝分裂和减数分裂中是必需的。植物学报,2013,11(4):391 - 391。
确认
我们感谢Christopher Franklin和Raphael Mercier的抗体礼物。DS感谢S. Prabha的协助。这项工作得到了印度政府科学和工业研究委员会(CSIR)的资金支持,以及生物技术系向IS提供的卓越中心赠款。DS得到了印度医学研究委员会(ICMR)的奖学金支持,SA得到了CSIR国际奖学金支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们在本研究中没有竞争利益。
作者的贡献
IS、DS和AP设计了实验。DS在SA的帮助下完成了实验。DS, IS和SA准备了手稿。所有作者阅读并批准了最终稿件。
Sebastien Andreuzza、Aneesh P Panoli对这项工作也做出了同样的贡献。
电子辅料
12870 _2013_1331_moesm1_esm.docx
附加文件1:图S1:地塞米松治疗对野生型的影响。图S2。花粉的显微分析AtCTF7 -RNAi。图S3。AtCTF7的定量反转录PCR (q-RT-PCR)AtCTF7rnai。图S4。未处理组和处理组AtSCC3和ASY1免疫染色原图AtCTF7rnai线。表S1。所用引物清单。(多克斯2 MB)
权利和权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于这篇文章
引用这篇文章
辛格,安德鲁扎,帕诺里,A.P.et al。AtCTF7拟南芥减数分裂过程中姐妹染色单体内聚和内聚蛋白与染色质结合的建立是必需的。BMC植物杂志13日,117(2013)。https://doi.org/10.1186/1471-2229-13-117
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1471-2229-13-117
关键字
- 植物减数分裂
- 染色体组织
- 突触
- 有条件的RNAi
- 配子形成
- DNA修复