摘要
背景
在所有真核生物中,RNA沉默影响着从染色质结构维持到转录和翻译调控以及mrna寿命等广泛的调控过程。特别是在植物中,它是对抗病毒的主要防御机制。为了对抗这种防御,植物病毒产生RNA沉默抑制因子(病毒RNA沉默抑制因子,VSRSs),这对病毒入侵特定的宿主植物至关重要。这些vsrs与宿主沉默途径的相互作用,以及它们直接或间接干扰不同的细胞调控网络,构成了病毒-宿主分子相互作用的主要途径之一。在这里,我们使用了微阵列的方法来研究马铃薯病毒X马铃薯病毒(PVX) - 当在这些植物中表示为转基因时,在烟草植物的转录物轮廓上特异性P25 VSRS蛋白。
结果
PVX-specific P25沉默抑制因子的表达在转基因烟草植物造成显著上调1350记录,但下调只有五个成绩单的叶子,和51和——和下调13成绩单,分别在这些植物的花朵,与野生型相比,控制植物。大部分的变化发生在生物和非生物胁迫、转录调控、信号转导、代谢途径和细胞壁修饰等相关转录本上,其中很多可能是通过上调乙烯、茉莉酸和水杨酸调控的信号通路而引起的。分析了这些变化与蛋白质谱和相关生物学功能的相关性。令人惊讶的是,它们并没有引起蛋白质谱的显著改变,只引起表达p25的转基因植物表型的非常轻微的改变。
结论
pvx特异性P25 VSRS蛋白的表达导致转基因烟草叶片转录组的主要变化,但对相同植物的幼花几乎没有影响。叶片中相当稳定的蛋白质谱和植株表型没有任何重大变化,表明不同调控水平之间复杂的相互作用和相互作用能够维持植株内稳态。
背景
RNA沉默是一种高度保守和多功能的遗传监测和调节机制,发生在所有较高的真核生物中。它由大型相互作用效应分子的网络介导,并连接到几个平行的调节和信号通路。它直接和间接地影响,从细胞周期调节和染色质结构维持不同,对转录和后术治疗的细胞过程,对应力和激素信号传导以及发育分化[1-5.].因此,RNA沉默在不同真核生物的遗传信息表现中起着核心作用。许多沉默过程的效应分子本身也受到特定的沉默机制的调控,许多与沉默相关的调控途径在多维网络中相互关联[6.那7.].
该沉默过程是由双链RNA (dsRNA)结构诱导的。动物的RNase III型内切酶Dicer或植物中的Dicer-like (DCL)同源物识别并将其切割成20-24个核苷酸的小片段。根据诱导dsRNA分子的来源和形式,这些产物被称为microRNAs (miRNAs)或小干扰rna (sirna): miRNAs是从内源性pre-miRNA转录本的发夹结构中剪切出来的,它们靶向于特定靶转录本中的特定互补位点。sirna从任何非特异性双链RNA分子中分离出来,从而靶向与诱导双链RNA具有同源性的DNA或RNA序列。在所有情况下,小RNA片段作为沉默机制的引导序列:它们被装载到含Argonaute (AGO)的效应复合物中,即进入RNA诱导沉默复合物(RISC),或进入RNA诱导转录沉默复合物(RITS),并引导这些复合物到同源RNA或DNA序列中,分别介导它们的降解或翻译抑制,或甲基化(综述于[2那4.那8.-10.])。
沉默网络对于维持细胞的健康和完整也是必不可少的。在动物中,它们在抑制肿瘤发生中起主要作用[11.那12.[植物中,它们参与了对某些细菌病原体的激素信号传导和防御反应[5.那13.-16.].在植物中,RNA沉默特别用作对病毒疾病的主要防御机制([17.-21])。各种病毒特异性DSRNA结构(例如复制中间体,双向转录物或本地发夹环)用作有效的沉默诱导剂。将它们通过DCl4酶处理至21nt siRNA,或任选地通过DCl 2,然后通过沉默机械介导同源病毒RNA的降解。
病毒编码的RNA沉默抑制子(VSRSs)的产生使病毒与宿主的相互作用进一步复杂化。大多数(如果不是全部的话)植物病毒至少编码一种起vsrs作用的基因产物。许多vsrs还介导了其他一些重要的病毒功能,例如,它们中的一些作为病毒细胞间或长距离移动蛋白、外壳蛋白、复制酶、病毒传播的辅助成分、蛋白酶或转录调控因子。因此,不同病毒科产生的VSRS是不同的,具有非常不同的功能机制[22-26].对于大多数vsrs来说,其确切的作用模式尚不清楚,但很明显,通过与宿主沉默机制(如小rna、dcl或AGO蛋白)的相互作用,它们可以强烈干预宿主植物的调控途径和网络。
几种VSRS已在不同宿主工厂中表达为转基因,以研究它们与沉默机制的相互作用,以及植物内转酶调节。这些转基因中的一些严重扰乱植物表型和miRNA或mRNA表达谱,并影响其对进一步的病毒感染的敏感性,而其他转基因对植物表型对植物表型具有最小或没有影响[27-31].这些差异显然依赖于特定的VSRS,并且可能还涉及这些研究中已经使用的特定主机/ VSRS组合。
编码的P25蛋白马铃薯X病毒(PVX)是一种多功能蛋白,可作为VSRS和细胞间运动蛋白[32那33].我们以前报道过表达VSRS基因的转基因烟草株系的生产和特性[34[这里,我们报告了这些植物的叶片和花的转录组的微阵列分析(烟草4×44k,安捷伦)。结果表明了叶片的转录物轮廓的主要变化,但仅在这些转基因植物的花的成绩单中进行了微小的改变。
结果
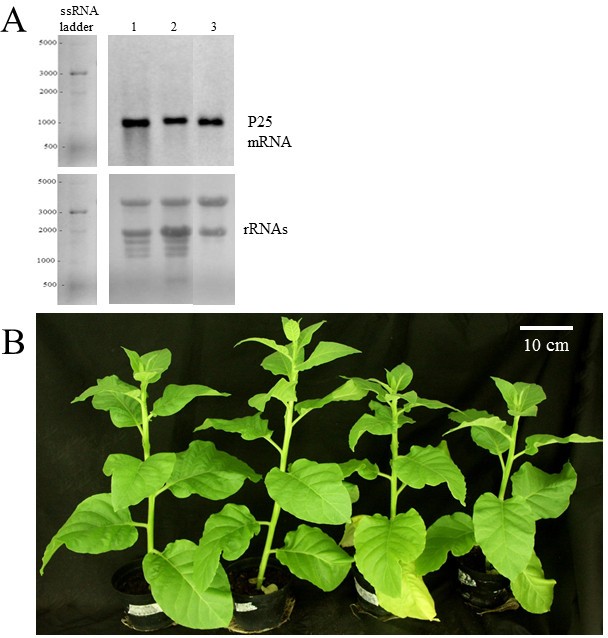
P25 VSRS-一种转基因烟草植物(尼科尼亚塔哈瓦姆nn),以及表达各种其他VSRS(例如:马铃薯病毒Y potyvirus具体HC-Pro和非洲木薯马赛克双生病毒特异性AC2)已在本实验室生产并鉴定[34].我们早先描述了一种具有非常低的转基因表达水平的P25表达线,这在植物中没有导致可检测的表型改变,但对于该研究,我们选择了在更高水平上累积P25 mRNA的T3线。由Northern印迹和通过定量RT-QPCR检测到的同一植物的叶子和花的表达水平相等,并且通过定量RT-QPCR检测到(图1a和附加文件1),但同一t3株系的兄弟株之间略有差异(图1A).与野生型植物相比,这些植物作为一个改变的表型,表现出生长减少,完全生长的植株的高度大约比野生型植物低10%,并且较低的叶片衰老稍强(图)1b)。
在萌发后大约一个半月,植物高度约为20厘米,从转基因和野生型对照植物收集叶样品(三种生物重复)。这些转基因植物之间的p25-转录水平相等(附加文件1).我们之前的微阵列分析显示,用空pBin61转化载体转化的对照植物的转录谱与野生型健康植物的转录谱大致相同[35],因此这里只使用野生型植物作为对照。在同一种植物开花前一天采集花朵样本。在RNA分离和质量控制之后,进行了微阵列分析,获得的数据如方法中所述进行了分析,由Soitamo等人[35那36].
许多烟草微阵列探针仅通过制造商规范中的EST代码进行识别。额外的基因鉴定,许多阳性的微阵列检测从http://mapman.gabipd.org/web/guest/mapman-annotationexperts网页上。对于在此数据库中未找到的探测器,从TAIR数据库(http://www.plantta.jcvi.org/)和BLASTN-和BLASTX程序(NCBI)。从MapMan数据库中获得了所有已识别的、明显改变的转录本的初始功能分组。然而,许多尝试性功能可能与若干生物学角色相关,例如,与疾病反应相关的基因也可能作为转录因子在信号转导中发挥作用,或与细胞壁修饰有关[37].因此,人工调整功能分组,以对应假设的基因诱导植物病毒感染。一些相关的组也被合并,以减少总组数,以更清晰的视觉呈现。
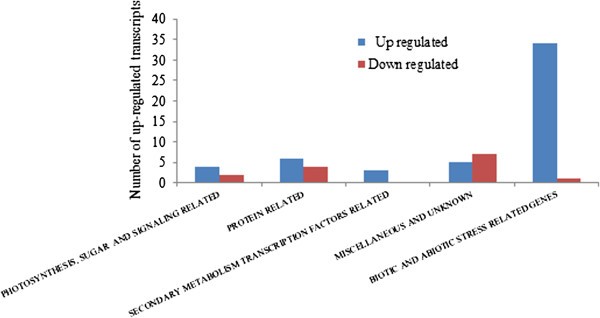
利用向下调节基因的双折截止值和BH假发现率的严格选择标准5%,阵列数据显示,总共1350(非冗余)斑点产生了一个显着(调整后p值< 0,05)叶片总RNA的上调信号(图2).所有检测到的上调基因的完整列表在附加文件中2.在每个功能组中检测到的上调基因的主要类型,以及其放大水平的范围也在附加文件中列出3..使用相同的严格标准,仅发现叶片的5个转录物减少到0.5倍或更低的水平。与野生型植物相比,在P25表达植物的花朵中,发现51和13转录物显着上调和下调。(图3.,其他文件4.和5.).
通过定量实时PCR(RT-QPCR)分析所选的上调基因,以验证转基因与野生型植物的叶子和花样的阵列数据。RT-QPCR结果大致对应于这些基因获得的微阵列结果(表1).
作为烟草基因组尚未测序,显著的注释,或抑制基因大多是基于已知基因的相似性或在其他物种已知功能域,因此名字,无法准确确定等位基因或生物功能的检测记录。在许多情况下,也有不止一个探针,对相同的rna有不同的est -code。因此,在给定的44000个探针中,阵列数据仅显示了改变的杂交事件的数量,而没有提供实际向上或向下移动的基因的准确数字。尽管如此,重复检测相同的基因,它们的多个等位基因,基因家族的多个成员,或属于相同途径的基因,证实了这些基因在转基因植物中的表达水平的改变。
叶片中与生物和非生物胁迫相关的转录本上调
注释和功能分类的微阵列数据显示,对表达植物的P25-蛋白表达植物初始致力于致病性状况[37]:共有138名上调的转录物属于各种生物和非特异性应力诱导的基因(图2和4.,其他文件2和3.).例如,这组基因包括30个编码各种致病相关蛋白(1a、b、c、4b、R、PX)的基因。其中许多是非常强烈的诱导,甚至高达3000倍,这一比率也可以解释为它们在健康对照植物中非常低或无法检测的表达水平。此外,各种抗病基因(共21个)、Avr9/Cf-9和发卡蛋白编码基因(21个)、各种几丁质酶和几丁质内酯酶(17个)、全身获得性抗性(SAR)相关蛋白(19个)和超敏细胞死亡(HR)相关蛋白(10个)也被强烈诱导。有趣的是,该分析还检测到tmv反应的表达增强(N-基因)相关转录本,尽管这种烟草品种是NN.类型,不包含功能N基因。因此,非功能性等位基因(n)通过疾病应力以类似的方式诱导功能性抗性基因N.
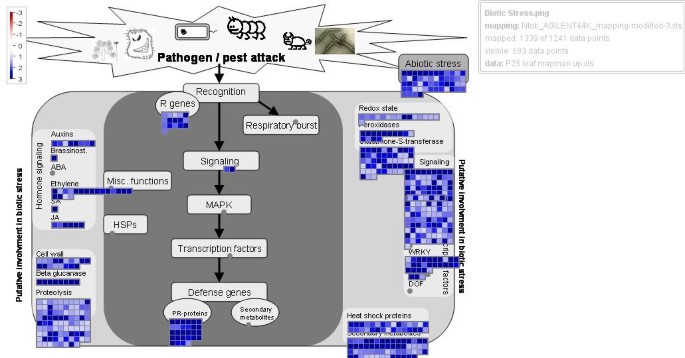
MapMan软件显示生物胁迫相关基因上调(log2值>1)。蓝色方块表示参与生物应激反应的上调转录本的数量。相关基因的路径描述和视觉呈现见[38].
与次级代谢物生物合成相关的各种转录本(共50个)的强增强也表明应激和抗病状态增强,最大增强约200倍于表马齿酚合酶。植物抗毒素和各种类黄酮、肉桂和萜类化合物的转录本编码,它们可作为各种病原体的构成性或诱导性化学抑制剂[39]也得到了增强。特别有趣的是,类似REF/ srpp的异戊二烯的表达增强,因为这些是miRNA功能所需的,并影响AGO1的膜关联[40].
除对生物胁迫的反应增强外,还诱导了各种非生物胁迫指标(共41次检测),尽管不如生物胁迫的强。这类基因中诱导水平最高的是金属结合蛋白基因(77倍)和氧化应激基因(11倍增强)。此外,共有26个不同热休克蛋白和伴侣的转录本被提高了2 - 7倍。其他应激基因的上调与脱水/脱水、渗透应激和衰老有关。
与蛋白质合成、修饰和代谢网络相关的转录本上调
在表达p25的植物中,许多编码蛋白质合成机制、蛋白质运输和加工、能量代谢、脂质代谢、膜相关蛋白和分子转运蛋白的转录本也发生了强烈的改变(图)2额外的文件3.).2-33尺寸提高了与转录或翻译引发或翻译机组相关或翻译机关相关的9种转录物,表明,除了各种转录水平的增加,还提高了蛋白质合成。也许为了平衡这种干扰,也是与泛素介导的蛋白质降解相关的大量(总共110个),或者编码各种蛋白酶,内肽,羧肽酶,水解酶和许多AAA型ATP酶转录物(通过2 - 180-折叠)(在蛋白质合成,靶向,修饰和降解相关“和”核苷酸结合和处理蛋白“中的额外文件中的蛋白质合成2和3.;另请参阅附加文件6.).
在糖和氨基酸代谢相关转录物中检测到多种变化:通过强烈诱导两种对转录物和三种乙烯诱导基因的强烈诱导来改变光化学相关的信号。另外,对于各种糖代谢相关基因的总共133种转录物编码,编码用于线粒体电子转移链的组分编码的5种转录物在4-39-折叠的范围内提高。
膜和脂质代谢的上调和叶片分子易位
15个不同膜蛋白的转录本被提高了2 ~ 12倍。此外,与各种膜或脂质修饰活性相关的26个转录本被增强,有的可达94倍(附加文件)3.).还提高了27种与各种细胞壁改性活性相关的转录物,包括细胞壁降解酶的转录物木瓜葡聚糖内甘油酶 - 水解酶(9转录物)和葡聚糖肠胃1,3-β-葡糖苷酶(6转录物)。特殊兴趣是增强果胶甲酯酶(PME)抑制剂型蛋白的转录物,其通过对PME的作用可能有助于沉默抑制[41].
各种代谢物的运输和易位似乎在这些转基因植物中被扰乱,因为近一百个与分泌相关的转录物提高了:19与蛋白质分泌有关的转录物与各种膜隔室(ER,囊泡,过氧化物,细胞核)的分泌有关33倍。17还增强了针对各种氨基酸和寡肽转运蛋白编码的转录物,以及编码用于各种磷酸盐,硫酸盐,铵离子,金属和硝酸盐的转运蛋白的转录物,如离子通道的8个转录物和糖转运蛋白的七个转录物,以及总计15个杂项运输相关的转录物。增强的非生物应激似乎与诱导不同多药抗性蛋白或ABC转运蛋白的13种转录物的诱导相关。
在这些植物中,除了上述功能基团外,还诱导了11个与DNA结合相关的转录本,6个与细胞骨架相关的转录本,其诱导倍数高达10倍。还有13个含有duf结构域的蛋白质转录本编码,即具有未知功能的结构域[42],大量未明确功能鉴定的转录本(共39个),以及未鉴定编码序列的转录本(256个)在转基因叶片中显著增强(图)2,其他文件2和3.).
增强叶片基因表达的调控因子
大量防御相关基因的诱导显然与作为防御途径主要调节器的信号因子的强烈诱导有关。通常,植物防御反应是由水杨酸(SA)、乙烯(ET)和茉莉酸(JA)诱导的[43].这些调控途径的诱导(图4.)在表达p25的植物中发现,sa诱导途径中一个关键信号因子的两个转录本的强烈增强(高达8倍),即疾病易感性增强(Enhanced disease susceptibility, EDS1)因子[44].同样,对于1-氨基环丙烷-1-羧酸盐(ACC)合成酶,氧化酶和脱氨基酶的五种转录物,以及两种转录物编码用于2-氧代戊二酸依赖性二恶英酶,所有这些都参与了乙烯生物合成[45强烈增强,甚至高达95倍。用于乙烯诱导的信号传导或转录因子(例如ER4,ER2)的几个转录物高达40倍。八种转录物编码膜降解脂氧基酶,导致JA合成[46]增强多达5倍。还诱导了几种乙烯响应(9),生长素响应(6),诱导赤霉素相关(共5个)转录物。乙烯反应转录因子1(ERF1),即集成来自ET和JA信令路径的信号的关键信令因子[47[ERFS 3和5(未知功能)增强5-25 - 折叠。
进一步,不同转录因子的大量转录本(共79个),其中一些已知受ERF1或JA调控[47],在表达P25的植物中得到增强。这些包括用于Wrky结构域蛋白的29个转录物,以及用于PTI5,Rav,NAC和MyB样转录因子的多程序,其中一些已知是各种疾病反应的转录调节因素[48-50].
The enhanced transcription factors included also several that function as developmental regulators and are typical targets for silencing-mediated regulation, i.e. the SCARECROW, AP2 and GRAS –type transcription factor with the DELLA domain, WAF related cluster (a hypothetical protein belonging in the Auxin response factor family), the floral identity gene LEAFY [51]以及含有Nam(无顶端分泌)或NAC结构域的多种转录因子,已知涉及许多发育过程以及防御反应[52].还有染色质甲基化相关的组蛋白脱乙酰化(HD2)基因和高迁移率组B 3转录因子基因被调节(图2和额外的文件2).增强四种微卫星DNA转录物(在“DNA结合蛋白”下列出)以及五种复古元素相关序列(按“生物应激”)的提出,表明基因组DNA的甲基化水平降低。
在诱导的RNA相关的调节机制中的特殊兴趣是DCL2酶的诱导,已知用作DCL4的替代效应分子,在病毒RNA的沉默中[53],已知在病毒防御相关沉默中起作用[54[RNA依赖性RNA聚合酶1,可用作内源性沉默抑制剂的RNA依赖性RNA聚合酶1 [55].
钙和磷酸化介导的信号传导和监管网络也被改变(图2额外的文件7.).增强了与蛋白质磷酸化和Ca介导的信号传导相关的115种转录物,包括各种Ca结合蛋白和钙调蛋白(35转录物),例如,RGS-钙调蛋白,内源性沉默抑制剂蛋白[56].增强的信令相关基因还包括各种激酶(30)和受体激酶(32),以及一些磷酸酶。特殊兴趣是诱导几种(7)MK1和MAP3激酶,并映射Kinase激酶(2),已知用于介导的信号传导级联,导致各种防御基因的转录激活,例如,一些腕词转录因子[43].
在这些转基因植物中,将各种谷胱甘肽-S-转移酶的44种转录物增强了高达80倍,并且总共编码了各种细胞色素P450或密切相关酶的总共21种转录物,高达63-折叠。已知这些酶在细胞中作为抗氧化剂起作用,并解毒和降解内源化合物,例如过氧化脂质和各种有害的代谢中间体和毒素[57].
叶片转录下调
如前所述,应用BH假发现率5%的严格选择标准,仅发现5个转录本(heparan - -glucosaminide N-acetyltransferase, hydrolase, two component response regulatory like APRR5, and two unknown transcripts)显著减少。通过忽略这一严格的测试,也发现与野生型植物相比,325个转录本减少到0.5倍或更低的水平,但这些减少比各种转录本的上调更为温和和不一致(数据未显示)。在这些轻度下调的转录本中,最有趣的是与光合作用相关的转录本,包括与光合作用相关的卡尔文循环转酮醇酶、与光反应相关的atp合酶和光照后叶绿素荧光增加蛋白(与循环电子流相关),光系统I组装和稳定因子,和光致敏NPH3家族蛋白在光信号中起作用的几个转录本[58].
在P25表达植物的花中改变了基因表达
从未开放的花中提取的样本中,只有51个转录本在微阵列分析中被检测到显著上调,14个转录本被检测到显著下调。与叶片一样,上调最显著的功能组是与各种生物胁迫相关的转录本,包括15个编码不同致病相关蛋白的转录本,9个编码各种几丁质酶和几丁质内酯酶的转录本,4个编码sar相关蛋白的转录本。上调的转录本还包括光系统II 10kda蛋白和Rubisco小亚基蛋白,分别上调4倍和3倍。上调的基因还包括一个谷胱甘肽转移酶,两个vetispiradiene合成酶和三个环氧化物水解酶转录本(图)3.,其他文件4.和5.).
发现在花中被抑制的转录物包括三个转录物用于甲基噻吩核苷酸核苷酸,富含甘氨酸富含蛋白的三个转录物,以及用于照相I反应中心亚峰的转录物(图3.,其他文件4.和5.).
表达P25的植物叶片蛋白谱的改变
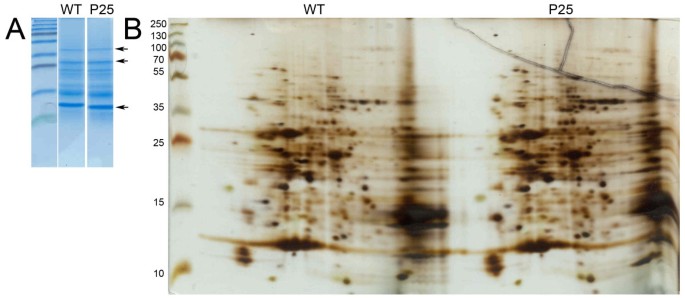
在表达P25表达植物中的各种MRNA积累中观察到的重大变化,包括用于翻译机械的某些关键部件的MRNA(特别是对于不同的翻译引发因子)和蛋白质退化机械(见附加文件6.),表明植物的总蛋白质含量或蛋白质谱可能发生显著改变。然而,P25表达植株的总蛋白含量与野生型植株相同,以每新鲜重量单位叶片的可溶性蛋白含量来衡量。此外,苯酚提取样品的蛋白质图谱与野生型植物非常相似(图)5.).在重复分析从不同植物第三叶中提取的蛋白样品(共5个)时,我们有时会观察到几个蛋白点的增加(图)5.和额外的文件8.),有时多个点明显减少,但这些变化在所有凝胶中并不一致,因此我们得出结论,与野生型植物相比,p25表达植物的蛋白谱没有显著变化。
1D-SDS-PAGE凝胶(A)和2d -聚丙烯酰胺凝胶电泳(2D-PAGE) (B)分别显示样品的相同装载量和不同个体蛋白的水平。用Coomassie蓝色染色1D凝胶,使用银染色试剂盒染色2D-GEL。其他几个蓝色染色的2D-GEL显示在附加文件中8..
光合作用的活动
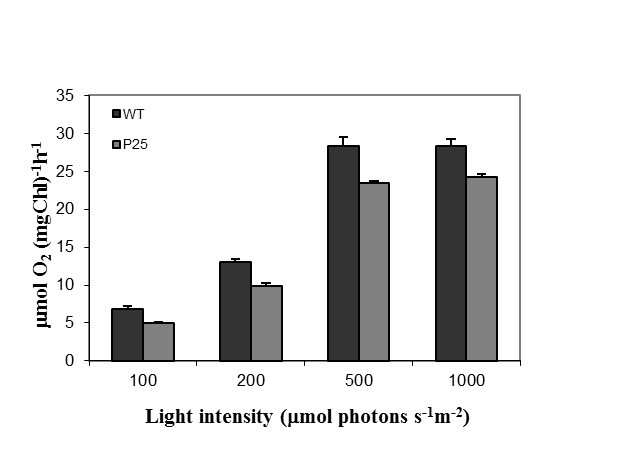
分析转基因植物的整体生理状况,如其光合活性所示,他们的o2从新鲜分离的类囊体膜中测定了不同光强下的进化活性。测量结果表明,转基因叶片的光合活性降低了约20%,而不受光强的影响(图)6.).有趣的是,这种减少与早些时候报道的感染PVX病毒的烟草植株相同[59].这里,这显然与p25表达的叶片中几种光合作用相关转录本(ATP合酶蛋白I、转酮醇酶、光系统I组装和稳定因子)的轻度下调有关。
对生物和非生物胁迫的反应
巨大诱导与各种植物疾病的主动防御有关的各种转录物(AVR9 / CF-9引发的转录物,PR-蛋白,几丁质酶,内奇素酶,抗病基因,HR相关蛋白,SAR相关蛋白质)表明植物应该被灌注以增强对各种病原体的抗性[43].通过用悬浮液渗透叶子来测试这一点两pv。番茄DC 3000细胞。这些细胞在野生型烟叶中是无毒的,在渗透叶区没有或只有非常轻微的超敏反应。当渗透到表达p25的植物中,它们在渗透后6天内产生了明显的hr反应(图)7.一种)。
各种过氧化物酶、氧化酶、还原酶和氧化还原酶的转录本编码水平高,表明这些因子可能与叶片的高氧化应激有关。用DAB和ntb染色检测叶片是否存在这种胁迫[60].表达P25的叶片基本上与野生型叶片产生的染色图案具有基本相同的染色图案,只有轻微的背景变暗,表明植物不含任何额外的氧化化合物(图7.b)。
常规诱导HC-Pro和AC2沉默抑制器的基因表达植物
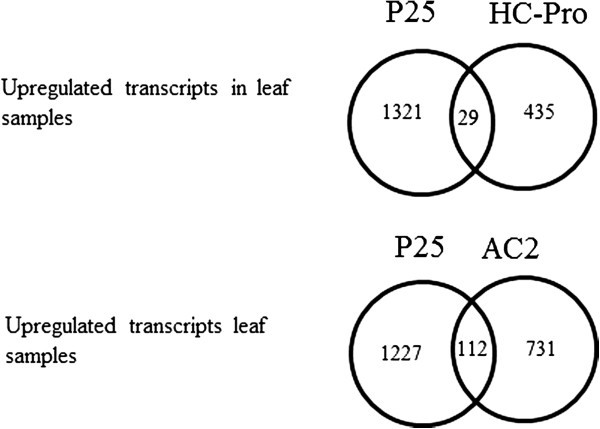
研究人员将p25表达植株中增强的转录本与在其他转基因烟草株系中发现的增强基因进行了比较,这些烟草株系要么表达pvy衍生的VSRS HC-Pro,要么表达acmv衍生的VSRS AC2。虽然在HC-Pro和AC2表达的叶片中也观察到大量的基因表达改变(分别为748和1118),但这三种植物之间的改变模式明显不同,在所有这些转基因植物中只有137个常见转录本被增强(图)8.,其他文件9.那10.那11.).The commonly induced transcripts included transcripts related to plant defense against biotic and abiotic stresses (e.g. EFE enzymes for ET production, Ethylene-responsive transcription factor 1, MAP3 kinase, Glutathione S-transferase, Cytochrome P450, some SAR-related genes, WRKY transcription factors, chitinases and endochitinases, Calmodulin-like protein, and several transcripts related to oxidative stress). Also some transcripts associated with cell wall modifications (xyloglucan endotransglucosylase-hydrolase) and transcripts related to transport, senescence and ripening, secondary metabolite biosynthesis and oxidative stress were induced in all these transgenic plants (Additional files9.那10.那11.).
讨论
在这里,我们报道了微阵列(Tobacco 4 × 44k, Agilent)介导的表达PVX病毒P25 RNA沉默抑制基因的转基因烟草植株的转录组谱分析。根据微阵列的结果,该转基因引起了大量(共1354个)转录本的显著上调,诱导水平可达3000倍。这种上调效应,与少量显著下调基因(总共5个,根据同样严格的选择标准)相比,表明该转基因在烟草植株中引起了主动沉默抑制。这些基因表达变化的一个特点是它们主要在叶片样品中被检测到。在花中,只有少量转录本(总共64个)的水平略有改变。
基因表达谱的改变仅与轻微的生长减缓和偶尔的下叶早黄有关,这明显与这些植物的光合活性轻微降低和乙烯表达增强有关。这一表型与之前发表的表达p25烟草植株的表型很好地一致[61].观察到的光合速率的降低与烟草植物的感染PVX病毒的销量的缩短相同[59],说明P25 vsrs蛋白的表达也是病毒感染植株产量下降的主要原因。
令人惊讶的是,尽管上调的转录本包括了一些发育中重要的转录因子,如稻草人、叶1、AP2和GRAS/DELLA型,或包含转录因子NAC、Nam (No Apical Meristem)、MYB和MADS域的转录因子,但这些转录因子没有表现出任何主要的表型改变。或者生长素反应因子家族的wafa蛋白。此外,胚胎丰富蛋白、衰老相关蛋白、成熟反应蛋白或贮藏蛋白的几个发育相关基因的编码也被强烈增强。
最显著的上调基因群是那些与各种生物和非生物胁迫相关的基因,包括多种抗病、病原菌诱导和系统抗性(SAR)相关转录本,以及重金属、干旱和渗透胁迫耐受转录本。这些似乎是通过对其关键信号因子,即SA、ET和JA的生物合成的强烈诱导,以一种协调的方式诱导的[44那45].通过沉默抑制函数诱导这些调节途径表明它们通过RNA沉默调节,如先前所示的JA [62].与野生型植物相比,这些植物中多种疾病防御基因对这些植物中的多种疾病防御基因的激活与侵袭细菌的显着增强的HR反应相关。
P25蛋白的一个重要效果是众多信号相关转录物的强大增强,这在基因表达和各种酶活性中,这一切都在发挥着重要作用。这些的重要实例是MAP3,MK1和MAP激酶激酶,其在初级防御响应因子的下游介导信号级联(图4.)[43].对该组的特殊兴趣是增强RGS-CAM基因的转录物,其本身在烟草中作为RNA沉默的抑制剂[56].其上调在这些转基因植物中提出了其参与P25 VSRS的沉默抑制机制的可能性。
令人惊讶的是,多重转录本的强烈诱导并没有影响总可溶性蛋白含量的水平,与野生型植物相比,转基因植物的蛋白谱没有显著或一致的变化(图)5.和额外的文件8.).显然,通过增加的蛋白质降解,通过增加蛋白质降解的蛋白质降解有效地平衡了转录物积累的一般性增强,如不同蛋白水解途径相关的多个转录物的强劲增加(附加文件6.).缺乏P25表达植物中的任何明显的表型与植物的(公平)稳定的蛋白质曲线一致,这些都表明植物中的稳态通过不同调节水平之间的复杂相互作用和相互作用。相关泛素相关的转录物的增强水平表明调节网络涉及增强蛋白质的蛋白质转化(参见附加文件6.).已显示适当的蛋白质体功能对于维持植物健康和稳态化至关重要[63].
与表达p25的植物的稳定表型相反,其他两个vsr -转基因(HC-Pro和AC2)导致转基因烟草植株的表型严重改变[34-36].有趣的是,在表达P25的植物的转录组中观察到的变化与在HC-Pro或AC2 VSRS转基因植物中观察到的变化非常不同,因为P25主要导致转录组的上调,并影响更多的转录组,这三种vsr之间只有138个转录本的重叠。这一对比表明,HC-Pro和AC2表达系中受不同影响的一些基因是造成严重发育障碍和表型的原因。
P25诱导效应的作用机制
已知P25 VSRS干扰前1个,RISC复合物的中央分量,并通过蛋白质体途径介导其降解[64].已知函数或表达式的缺陷会危及所有DCL1,DCL2和DCL4介导的沉默活动,并取决于类型前1突变等位基因可能严重扰乱植物的发展[65].在我们的转基因植物中,P25的表达-假设干扰了AGO1蛋白-具有很强的转录组效应,但对植物表型几乎没有影响。这可能与之前报道的现象有关ago1突变体影响某些mirna靶基因的沉默,但不是所有的mirna靶基因[66].此外,在我们的表达p25的转基因植物中,一些沉默的靶向基因,如防御、信号传导和代谢相关的靶转录本,以及许多具有NAC、Nam、叶状结构域、MYB或稻草人结构域的转录因子的转录本,都被观察到强烈的上调。而其他典型的沉默靶点,如各种生长素应答因子DCL1或AGO1,或其他调节发育分化的转录因子,则没有发生改变[51].
以往1本身被沉默介导的途径调节,特别是通过MIR168的功能来调节。该效应分子以及AgO1衍生的siRNA及其介导的DCL2,DCL4,RDR6,SDE5和SGS3介导的SIRNA及其放大回路将维持前蛋白的稳态[67.].另一种VSRS,即P38衍生萝卜皱纹病毒,也会干扰AGO1 [29].与P25同样,当在转基因中表达时,该VSR不会诱导任何特定表型改变拟南芥植物,虽然它 - 与P25不同 - 通过强大的DCL1和随后的(DCL1介导)抑制DCL 3和DCL4对沉默机械产生重大扰动。29].在这种情况下,调节相互作用揭示了一个密集的调节网络,以维持沉默机制的内稳态[68.那69.].在P25转基因植株中,DCL1、DCL3和DCL 4的表达水平没有发生变化,没有诱导出这种网络,无法解释这种稳定机制。
一个有趣的特征是ago1介导的沉默通路的组织特异性调节,这是Voinnet广泛讨论的[2].据报道了ago1突变体不引起顶端分生组织缺陷[70],因此通过抑制AGO1介导的p25特异性沉默抑制作用可能在该组织中无效。Faivre-Rampant及其同事的工作[71.表明PVX-P25蛋白具有器官特异性的功能,在叶片和块茎中具有不同的沉默抑制作用。在我们的研究中,p25转基因对叶片的转录组有巨大的影响,但对花的影响很小,尽管该基因在两个器官中表达水平相同。特别强的沉默介导的调控和监视机制已知在植物分生组织中起作用[72.],可能是组织特异性机制阻止了该组织中AGO1功能的干扰,从而维持了植物发育的完整性。调节AGO1功能和维持不同器官细胞内稳态的平衡机制有待进一步研究。在表达p25的植物中,负责植物内环境平衡和维持稳定蛋白谱的调控机制仍然是一个问题。
结论
该研究的结果表明,在转基因烟草植物中PVX衍生的P25 VSR的表达导致叶片中大量转录物(总数1354)的积累,但在这些植物的花中改变了几个成绩单的水平.尽管转录组中的巨大变化,叶片的蛋白质曲线仍然相当稳定,并且在植物的表型中没有观察到的重大变化,除了略微降低生长和生物和非生物胁迫指示剂的强烈诱导。基于不同转录物中观察到的改变,我们得出结论,这些植物中稳态的维持涉及增强蛋白质的蛋白质转化。缺乏表型改变还可以涉及P25 VSRS的器官特异性效果,其在叶子中发生但不在花中。发展敏感的共同组织可能对这些效果不是尊重。
方法
植物材料
转基因尼科尼亚塔哈瓦姆表达VSRS P25, HC-Pro和AC2的细胞系之前已经在我们的实验室生产和表征[34-36].植物在正常生长条件下生长,其中150μmol光子-2年代-1,在60%RH下,具有16 h / 8h光/暗循环,在22°C时。在发芽后6-7周,从野生型和P25中收集叶样品(来自顶部的整个第三叶)。在芽开口之前,也从同一植物中收集花芽样品。将叶子和花样在液氮中冷冻并储存在-80℃下进行进一步分析。
RNA提取,cDNA标记,微阵列杂交和分析方法
根据制造商说明,使用TRIsure试剂(Bio line, UK)从野生型和表达p25转基因烟草植株中提取总RNA。然后提取总RNA,用Nucleospin RNA纯化试剂盒纯化,然后按照说明书进行dnei处理(Promega RQ1 RNase free- dnei)。采用Amicon Ultra-0.5离心过滤装置浓缩总RNA。RNA分离后,RNA质量控制、cDNA标记和微阵列杂交按照安捷伦的标准程序进行,如Soitamo等人2011 [35].获得的微阵列数据在三个生物重复中归一化。利用Chipster (CSC, Espoo, Finland)软件对基因表达数据进行分析,通过比较野生型和p25表达植物的3个生物重复的方法,使用Student’s t检验,Benjamini和Hochberg (BH)的错误发现率为5%,确定它们的表达水平是否有显著差异(调整后的p值< 0.05)。
重新注释差异调节的基因元素
安捷伦微阵列芯片的探针信息仅基于EST和cDNA序列,因此非常有限。此外,许多探针的完整描述性注释信息可从MapMan网站[73.那74.].对于在本数据库中未发现的探针,在JCVI网站上搜索了附加的注释信息http://plantta.jcvi.org/.首先根据MapMan网站上的功能分组对阳性转录本进行功能分组,但分组时需要人工进行一定程度的调整,将不同代谢相关的分组结合起来,并将应激相关的基因分配到各自特定的分组中。
核查差异表达基因
采用实时定量PCR (RT-qPCR)方法根据MIQE指南验证微阵列结果[75.](附加文件12.).通过使用来自叶子和花样的1ug纯化的总RNA与再转移助剂逆转录酶(产品#epo441,Fermentas)来完成cDNA合成。将产生的cDNA样品用无菌MQ-水稀释1:15。根据制造商的建议,RT-QPCR样品用10ng(3μl)稀释的cDNA样品,基因特异性引物和最大碱基组合蛋白RT-QPCR主混合物(2x)(产品#KO242,FERMENSAS)。为了最小化移液误差,对每个生物复制进行3-4个技术复制。RT-QPCR通过在96孔板中使用Bio-Rad Iq5机器进行。结果基于定量循环(CQ)方法(Delta Delta CQ)计算。通过检查其DNA熔化曲线中的单峰来控制引物特异性。平均值的标准误差也从三个生物学复制计算。
蛋白质分离,2D-PAGE
蛋白质样本从RNA提取的相同样本中分离出来,或者,对于额外的样本,样本以同样的方式收集,从顶部的第三片叶子,使用整个叶子。首先使用TRIsure试剂(英国Bio line)提取野生型和P25转基因植物的样本,采用trisol (Invitrogen公司)的方法。至于RNA的分离。简而言之,首先用100%乙醇(0.3 ml乙醇/ 1ml苯酚)洗涤苯酚相,然后用异丙醇(异丙醇以1.5 ml异丙醇/ 1ml苯酚的比例加入)沉淀总蛋白。10分钟后离心(12000克),球被洗了三次4毫升0.3盐酸胍,95% EtOH制造,通过孵化RT 10分钟,在7500 g和离心5分钟。颗粒100% EtOH洗两次,晒干,并随着在10毫米8 M尿素三羟甲基氨基甲烷/盐酸,液pH值7,5。采用Bradford法(Bio-Rad protein assay kit)测定蛋白浓度,并分别从野生型和P25转基因植株中提取250 μg叶片蛋白进行蛋白谱分析。首先使用Bio-Rad 7 cm IPG, pH 3-10条等电聚焦分离蛋白,然后使用Bio-Rad蛋白II仪(protein II)在PAGE凝胶中进行二次分离。将得到的蛋白凝胶固定,考马斯蓝染色(Page blue staining kit, Fermentas)过夜,染色并拍照。随后,根据厂家说明,用银染色试剂盒(PAGE银染色试剂盒,Fermentas)再次对凝胶进行染色,并拍照。
光合作用的测量
采用野生型和P25表达转基因植物的等量的叶片样品(从顶部的第三叶中取出的1.0g),并在4ml类囊体隔离缓冲液中研磨(0.3M山梨糖醇,50mm Hepes / Koh pH值7.4,5mm mgcl2, 1mM EDTA, 1%BSA)。悬浮液经miracle loth过滤,所得滤液2 ml, 12000 × g离心成球,离心2分钟。去除上清,将剩余颗粒重悬于氧电极缓冲液(0.3 M山梨醇,50mM HEPES/KOH pH 7.4, 5mM MgCl)中2KH和1毫米2宝4.).以0.5mM DCBQ为电子供体的Clark型电极进行析氧实验。叶绿素浓度的测量是根据[35].
叶片HR反应与氧自由基检测
以6 ~ 7周龄的P25转基因植株和野生型植株为材料,研究其对番茄红素的超敏反应(HR)两pv。番茄DC3000感染。新鲜种植的细菌细胞,悬浮在10mm mgcl中2溶液,用注射器从叶片下部轻轻渗入细胞内(约50 μl/点)。植物在正常生长条件下培养,一周后拍照。
通过在3,3'-二氨基苯肼(DAB)溶液中(MQH中的0.1mg / ml dab达到0.1mg / ml dab)来检测过氧化氢和超氧化物自由基。2由NaOH)和NaOH调节的o,pH 3.8)和在硝基唑(NBT)染色溶液(25mm Hepes / Koh pH 7.4中0.1mg / ml NBT)[60].收集叶样品并浸没在染色溶液中,并在黑暗孵育中保持过夜。第二天早上,用96%乙醇处理叶样品一天以除去叶绿素并拍摄。
参考文献
- 1。
吴晓丽,侯卫文,王明敏,朱雪萍,李峰,张建东,李学珍,郭晓强:RNA沉默介导的烟草抗性与生物/非生物胁迫及细胞RdRp表达有关。农业工程学报,2008,41(5):376-381。
- 2.
植物microrna的起源、生物发生和活性。中国生物医学工程学报,2009,36(4):669-687。
- 3.
陈X:小RNA - 基因组的秘密和惊喜。工厂J.2010,61(6):941-958。
- 4.
内源性小RNA通路的专门化和进化。中国科学(d辑):地球科学(英文版),2007,18(11):884-896。
- 5.
Rubio-Somoza I,Weigel D:MicroRNA网络和植物的发育可塑性。趋势植物SCI。2011,16(5):258-264。
- 6.
Maclane D,Elina N,Havecker Er,Heimstaedt SB,Studholme DJ,Baulcombe DC:大型复杂网络的植物短沉默RNA的证据。Plos一个。2010,5(3):E9901。
- 7。
李志刚,李志刚,李志刚:拟南芥microRNA功能分析的靶点模拟。中国科学:地球科学,2010,27(6):691 - 698。
- 8。
植物转录后小RNA通路:机制和调控。基因工程学报,2006,20(7):759-771。
- 9.
mr . Jones-Rhoades MW, Bartel DP, Bartel B: MicroRNAS及其在植物中的调控作用。植物学报,2006,57:19-53。
- 10。
Wang Y, Wang Y, Wang Y, Wang F, Alioua A, Himber C, Voinnet O:一种内源性的、系统的RNAi途径。中国海洋大学学报(自然科学版),2010,29(10):1699-1712。
- 11.
病毒、微rna和癌症。中华肿瘤杂志。2006,25(46):6211-6219。
- 12.
Sumazin P,Yang x,Chiu Hs,Chung Wj,Iyer A,Llobet-Navas D,Rajbhandari P,Bansal M,Guarnieri P,Silva J,Calva j,Califano A:一个广泛的MicroRNA介导的RNA-RNA相互作用网络调节了致癌途径在胶质母细胞瘤中。细胞。2011,147(2):370-381。
- 13.
植物病原调控小rna的发现。方法:酶法。2007,427:215-227。
- 14.
Navarro L,Dunoyer P,Jay F,Arnold B,Dharmasiri N,Estelle M,Voinnet O,Jones JD:植物miRNA通过抑制植物素信号传导来促进抗菌性。科学。2006,312(5772):436-439。
- 15.
作者认为,细菌效应蛋白对microRNA通路的抑制作用是一种有效的途径。中国科学:地球科学。
- 16.
Jay F,瑞士jp,voinnet o,Navarro L:生物应激相关的microRNA:鉴定,检测,调节和功能分析。方法Mol Biol。2010年,592:183-202。
- 17。
RNA沉默的诱导和抑制:来自病毒感染的见解。中国生物医学工程学报。2005,6(3):206-220。
- 18。
植物病毒与宿主rna沉默途径的复杂相互作用。植物营养与肥料学报。2005,8(4):415-423。
- 19。
植物小rna在生物胁迫反应中的作用。植物生态学报。2009,60:485-510。
- 20。
丁斯文:基于rna的抗病毒免疫。中国免疫学杂志。2010,10(9):632-644。
- 21。
Wadsworth SDP:植物rna沉默免疫和病毒防御策略。植物与微生物的分子相互作用,2009,35。
- 22。
宋林,高胜,姜伟,陈胜,刘永强,周磊,黄伟:沉默抑制基因:病毒对抗宿主细胞防御的武器。中国生物医学工程学报。2011,2(4):273-281。
- 23。
吴强,王旭,丁斯文:基于rna的病毒免疫抑制子:宿主靶标。细胞宿主微生物。2010,8(1):12-15。
- 24。
roigo G, Carrera J, Jaramillo A, Elena SF:绕过RNA沉默的最佳病毒策略。Soc接口,2011,8(55):257-268。
- 25.
RNA沉默的病毒抑制子。植物科学进展,2011,16(5):265-272。
- 26.
Diaz-Pendon Ja,Ding SW:RNA沉默病毒抑制病毒抑制在发病机制中的直接和间接作用。Annu Rev phytopathol。2008,46:303-326。
- 27.
PRUSS GJ,Lawrence CB,Bass T,Li QQ,Bowman LH,Vance V:RNA沉默的PotViral抑制赋予多种病原体的抗性增强。病毒学。2004,320(1):107-120。
- 28.
Lewsey M,Surethe M,Robertson Fc,Ziebell H,Choi Sh,Ryu Kh,Canto T,Palukaitis P,Payne T,Walsh Ja,Carr JP:黄瓜马赛克病毒2B蛋白在病毒运动和症状诱导中的作用。Mol植物微生物相互作用。2009,22(6):642-654。
- 29。
Dunoyer P,Lecellier Ch,Parizotto EA,Heatber C,Voinnet O:探测MicroRNA和小干扰RNA途径与RNA沉默的病毒编码抑制器。植物细胞。2004,16(5):1235-1250。
- 30.
Siddiqui Sa,Sarmiento C,Kiisma M,Koivumaki S,Lemmetty A,Truve E,Lehto K:病毒沉默抑制剂对两种烟草种类的烟草狂暴病毒感染的影响。J Gen Virol。2008,89(PT 6):1502-1508。
- 31。
Chapman EJ, Prokhnevsky AI, Gopinath K, Dolja VV, Carrington JC:病毒RNA沉默抑制子在中间步骤抑制microRNA途径。基因工程学报,2004,18(10):1179-1186。
- 32。
Angell Sm,Davies C,Baulcombe DC:马铃薯病毒X的细胞 - 细胞运动与尼古利亚纳Clevelandii滴毛瘤细胞中Plasmodesmata的大小排除极限的变化相关。病毒学。1996,216(1):197-201。
- 33。
Verchot-Lubicz J,Torrance L,Solovyev AG,Morozov Sy,Jackson AO,Gilmer D:三重基因块编码病毒采用的各种运动策略。Mol植物微生物相互作用。2010,23(10):1231-1247。
- 34。
Siddiqui SA,Sarmientio C,Truve E,Lehto H,Lehto K:在转基因尼古特氏植物和N.Babacum中的各种病毒RNA沉默抑制剂引起的表型和功能效果。Mol植物微生物相互作用。2008,21(2):178-187。
- 35。
Soitamo AJ, Jada B, Lehto K: HC-Pro沉默抑制基因显著改变烟草叶片和花的基因表达谱。植物营养学报。2011,11:68。
- 36。
Soitamo AJ, Jada B, Lehto K:双生病毒AC2 RNA沉默抑制基因的表达改变了转基因烟草植株中糖和茉莉酸响应基因的表达。华北农学报。2012,12(1):204。
- 37.
在受感染植物中诱导的防御相关蛋白的意义。植物病理学杂志。2006,44:135-162。
- 38.
Rotter A, Usadel B, Baebler S, Stitt M, Gruden K: MapMan本体论对生物胁迫反应的适应:在茄科物种中的应用。植物学报。2007,3:10。
- 39.
PRATS E,Martinez F,Rojas-Molina mm,Rubiales D:苯丙氨酸氨裂解酶,糖醇脱氢酶和能量代谢抑制对适当宿主的抗性和非形式谷物锈相互作用的差异影响。植物病理学。2007,97(12):1578-1583。
- 40。
Brodersen P,Sakvarelidze-Achard L,Schaller H,Khafif M,Schott G,Bendahmane A,Voinnet O:MiroNA功能需要异戊二烯生物合成,并影响拟南芥中Argonaute 1的膜关联。Proc Natl Acad Sci U S A. 2012,109(5):1778-1783。
- 41.
Dorokhov YL, Frolova OY, Skurat EV, Ivanov PA, Gasanova TV, Sheveleva AA, Ravin NV, Makinen KM, Klimyuk VI, Skryabin KG, Gleba YY, Atabekov JG:一种普遍存在的植物酶果胶甲基酯酶的新功能:RNA沉默增强剂。中国科学(d辑),2006,33(6):514 - 514。
- 42.
Jaroszewski L,Li Z,Krishna SS,Bakolitsa C,Wooley J,Deacon Am,Wilson Ia,Godzik A:探索蛋白质宇宙的未知区域。Plos Biol。2009,7(9):E1000205。
- 43。
Conrath U:防御引发的分子方面。趋势植物SCI。2011,16(10):524-531。
- 44。
黄Z,Yeakley JM,Garcia Ew,Holdridge JD,风扇JB,Whitham SA:宿主基因的水杨酸依赖性表达在兼容拟南芥 - 病毒相互作用中。植物理性。2005,137(3):1147-1159。
- 45。
林泽,钟S,格尔特森D:乙烯研究的最新进展。J Exp Bot。2009,60(12):3311-3336。
- 46。
Wang L,Allmann S,Wu J,Baldwin It:脂氧氧酶3-和茉莉酸乙酯的比较揭示茉莉酸和茉莉酸 - 氨基酸缀合物在尼古利氏植物抗衰减症中发挥着不同的作用。植物理性。2008,146(3):904-915。
- 47。
在植物防御中,乙烯响应因子1整合了来自乙烯和茉莉酸途径的信号。植物学报。2003,15(1):165-178。
- 48。
Nakano T,Suzuki K,Ohtsuki N,Tsujimoto Y,Fujimura T,Shinshi H:鉴定由乙烯和己酸盐拟南芥的植物特异性转录因子家族基因的鉴定。j植物res。2006,119(4):407-413。
- 49.
eulgem t:调节拟南芥防御转录组。趋势植物SCI。2005,10(2):71-78。
- 50。
解剖植物防御调节因子的WRKY网络。中国科学:地球科学,2006,32(11):1126。
- 51。
Yamaguchi A, Wu MF, Yang L, Wu G, Poethig RS, Wagner D: microrna调控的SBP-Box转录因子SPL3是一个直接的上游激活因子。系统工程理论与实践,2016,35(2):457 - 461。
- 52。
胡河,齐克,孔子,孔子D,高Q,周G:NAC域转录因子基因族综合分析杨树幼虫。BMC植物BIOL。2010,10:145。
- 53.
丁斯威,voinnet o:由小rnas指挥的抗病毒免疫。细胞。2007,130(3):413-426。
- 54.
Scholthof HB,Alvarado Vy,Vega-Arrecuin JC,Ciomperlik J,Odokonyero D,Brorseau C,Jaubert M,Zamora A,Moffett P:鉴定Nicotiana Benthamiana的抗病毒RNA沉默的Argonaute。植物理性。2011,156(3):1548-1555。
- 55。
Yang SJ, Carter SA, Cole AB, Cheng NH, Nelson RS:宿主RNA依赖RNA聚合酶的自然变异与本氏烟草对病毒的易感性增加有关。中国科学(d辑:地球科学),2004,31(6):593 - 598。
- 56。
Anandalakshmi R,Marathe R,Ge X,Herr JM,Mau C,Mallory A,Pruss G,Bowman L,Vance VB:一种抑制在植物中沉默的后剖析基因的相关蛋白。科学。2000,290(5489):142-144。
- 57。
Guengerich FP:细胞色素P450和化学毒理学。Chem Res毒品。2008,21(1):70-83。
- 58。
拟南芥促光蛋白1相互作用蛋白NPH3磷酸化状态的变化对拟南芥促光信号的调控。中国生物医学工程学报。2007,32(4):591 - 598。
- 59。
陈志强,陈志强,陈志强,等。烟草花叶病毒侵染烟草和马铃薯病毒侵染烟草的光合作用和呼吸速率。应用生态学报,2003,19(2):429 - 434。
- 60.
Fryer MJ,Oxborough K,Mullineaux PM,Baker NR:叶片中光氧化应激反应的成像。J Exp Bot。2002,53(372):1249-1254。
- 61.
Kobayashi K, Sarrobert C, Ares X, Rivero MM, Maldonado S, Robaglia C, Mentaberry A:马铃薯病毒X TGBp1运动蛋白在转基因烟草植株中过表达导致发育和代谢改变。植物生理与生物化学。2004,42(9):731-738。
- 62。
Schommer C,Palatnik JF,Aggarwal P,Chetelat A,Cubas P,Farmer EE,Nath U,Weigel D:MiR319目标控制茉莉酸盐生物合成和衰老。Plos Biol。2008,6(9):E230。
- 63。
paleco R, Garcia-Marcos A, Manzano A, de Lacoba MG, Camanes G, Garcia-Agustin P, Diaz-Ruiz JR, Tenllado F:对导致细胞死亡的兼容和不兼容植物病毒相互作用的转录组和激素反应的比较分析。植物营养与肥料学报。2012,25(5):709-723。
- 64。
Chen IH, Baulcombe DC, Tsai CH:马铃薯病毒X沉默抑制基因P25与Argonaute1相互作用并通过蛋白酶体介导其降解。植物营养与肥料学报。2010,11(5):641-649。
- 65.
Baumberger N,BaulCombe DC:Arabidopsis Argonaute1是一个有选择地招募MicroRNA和短暂干扰RNA的RNA切片机。Proc Natl Acad SCI U S A. 2005,102(33):11928-11933。
- 66.
Brodersen P,Sakvarelidze-Achard L,Bruun-Rasmussen M,Dunoyer P,Yamamoto YY,Sieburth L,Voinnet O:植物MiRNA和SIRNA的广泛翻译抑制。科学。2008,320(5880):1185-1190。
- 67。
Mallory AC,VAUCHERET H:Argonaute 1宿舍调用MicroRNA和SiRNA路径的坐标行动。Embo Rep。2009,10(5):521-526。
- 68。
拟南芥DRB4、AGO1、AGO7和RDR6参与由DCL1负调控的dcl4启动的抗病毒RNA沉默通路。中国科学(d辑:地球科学),2008,31(4):531 - 534。
- 69。
Azevedo J,Garcia D,Pontier D,Ohnesorge S,Yu A,Garcia S,Braun L,Bergdoll M,Hakimi MA,拉格朗日T,Voinnet O:argonaute淬火和由病原体编码的GW重复蛋白引起的Dicer Soiosostasis的全局变化.基因开发。2010,24(9):904-915。
- 70.
Lynn K,Fernandez A,Aida M,Sedbrook J,Tasaka M,Masson P,Barton MK:Pinhead / Zwille基因在拟南芥开发中徘徊并具有与Argonaute1基因的重叠功能。发展。1999年,126(3):469-481。
- 71.
马铃薯病毒x基因在马铃薯叶片和块茎中的沉默研究。植物营养与肥料学报。2004,29(4):441 - 446。
- 72.
Foster TM,Lough TJ,Emerson SJ,Lee Rh,Bowman JL,Forster RL,Lucas WJ:监测系统调节RNA的选择性进入射击顶点。植物细胞。2002,14(7):1497-1508。
- 73.
Usadel B,内格尔,Thimm O, Redestig H, Blaesing OE, Palacios-Rojas N, Selbig J, Hannemann J,引起MC, steinhaus指出D, Scheible WR, Gibon Y, Morcuende R, Weicht D,迈耶,施迪M:可视化工具的延伸MapMan允许数组的统计分析,显示相应的基因,与已知的反应。植物营养与肥料学报。2005,32(3):429 - 434。
- 74。
USADEL B,Nagel A,Steinhauser D,Gibon Y,Blasing Oe,Redestig H,Sreenivasulu N,Krall L,Hannah Ma,Poree F,Fernie Ar,Stitt M:Pageman:一个用于生成,显示和注释概述的交互式本体工具分析实验的图表。BMC生物信息学。2006,7:535。
- 75。
Bustin Sa,Benes V,Garson Ja,Hellemans J,Huggett J,Kubista M,Mueller R,Nolan T,Pfaffl MW,Shipley GL,Vandesompele J,Wittwer CT:MIQE指南:公布定量实时PCR的最低信息实验。Clin Chem。2009,55(4):611-622。
确认
Turku Biotechnology的芬兰微阵列和测序中心(FMSC)被确认为标记CDNA,杂交,扫描芯片并产生原始微阵列数据。MikaKeränen博士承认帮助夏普斯语计划的数据分析和科学计算中心(CSC,ESPOO,芬兰)。研究得到了芬兰学院的支持,授予数字127203和128943。
作者信息
隶属关系
通讯作者
附加信息
利益争夺
作者没有非金融、金融或专利相关的竞争利益。
作者的贡献
BJ成长并收集了实验的植物材料。这项工作由KL计划。通过BJ和AJS在一起进行了实验性工作,数据分析和重新注算显着改变的转录物。BJ和KL写了稿件。所有作者都读过并批准了稿件。
电子辅料
12870 _2012_1212_moesm1_esm.docx
附加文件1:表S1。RT-QPCR结果表明来自叶子的P25转录物的平等检测,以及微阵列分析中使用的三种转基因植物的花朵。(DOCX 15 KB)
12870 _2012_1212_moesm2_esm.xlsx
附加文件2:表S2。标准化的微阵列数据显示表达植物的P25叶片上调的转录物。(XLSX 455 KB)
12870 _2012_1212_moesm3_esm.docx
附加文件3:表S3。在P25表达植物的叶片中检测到上调转录物的概述。(DOCX 24 KB)
12870 _2012_1212_moesm4_esm.xlsx
附加文件4:表S4。归一化微阵列数据显示P25表达植物花中转录本的上调和下调。(XLSX 15 KB)
12870_2012_1212_moesm5_esm.docx.
附加文件5:表S5。P25表达植物花中检测到的上下调控转录本综述。(多克斯17 KB)
12870_2012_1212_moesm6_esm.xls.
附加文件6:表S6。与表达P25叶片中的蛋白质合成和蛋白分解有关的上调转录物。(XLS 72 KB)
12870 _2012_1212_moesm7_esm.png
附加文件7:图S1。通过使用Mapman软件显示信令相关基因的上调(LOG2值> 1)。蓝色方块表示在涉及信号传导的不同途径中上调的基因数。(PNG 107 KB)
12870_2012_1212_moesm8_esm.png
附加文件8:图S2。通过2d -聚丙烯酰胺凝胶电泳(2D-PAGE)分析从四组独立的野生型(左面板)和表达p25的转基因植物(右面板)分离出来的蛋白质,以可视化不同个体的蛋白质水平。凝胶用考马斯蓝染色。分子量标记(装载在凝胶的右边的两个上面板,和在凝胶的左边的两个下面板)代表重量250,130,100,70,55,35,25,15和10 kDa。等量(250 μg)的可溶性叶片蛋白样品被初始加载到每一次等电聚焦运行中。通过1D-SDS-PAGE凝胶(数据未显示)证实了相同的负载。(PNG 434 KB)
12870_2012_1212_moesm11_esm.png.
附加文件11:图S3。对表达P25、HC-Pro或AC2的叶片进行PageMan超表达分析。采用Fisher精确检验,包括FDR <0.05。(PNG 302 KB)
12870 _2012_1212_moesm12_esm.docx
附加文件12:表S9。RT-qPCR条件和用于验证微阵列数据的引物序列。(多克斯18 KB)
作者为图像提交的原始文件
以下是与作者的原始提交的图像的链接。
权利和权限
开放访问本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
研究表明,pvx衍生的P25沉默抑制基因在烟草转录组中的作用与烟草器官特异性的改变有关。BMC植物杂志13,8(2013)。https://doi.org/10.1186/1471-2229-13-8
已收到:
公认:
发表:
关键字
- 转基因植物
- 野生型植物
- 转基因烟草植物
- 沉默抑制器
- 细胞壁改性