摘要
背景
公路、铁路、农田、建筑物和其他人类活动造成的栖息地碎片化会影响种群规模、授粉成功、有性和无性繁殖,特别是在传粉者受限的植物中,如地中海兰花。在本研究中,我们评估了9个片断化亚居群的花粉流、自交率、营养繁殖和雌性繁殖成功及其与生境性状的关系Serapias通用.
为了进一步了解居群结构对植物生物学的影响,我们利用核微卫星标记检测了居群间的遗传分化、花粉流、自交率和无性系繁殖。
结果
小群体的5个核微卫星位点均存在显著的杂合子缺失,群体间遗传分化系数为0.053英石与种群间地理距离显著相关。种子亲本分析表明,花粉流主要发生在居群内,居群间的距离与收到花粉的百分比呈正相关。
果实产量在5.10% ~ 20.30%之间,随群体大小的增加而增加,而活籽率(78 ~ 85%)在群体间差异不显著。9个居群的无性系程度、无性系繁殖策略和有性繁殖策略差异很大,并与它们所处的生境相关。小的、隔离的种群倾向于高克隆多样性和低产量,而小干扰的大种群则倾向于减少克隆生长和增加有性繁殖。
结论
我们发现克隆品在小和孤立的人群中提供了优势S. Lingua.在那里,无性繁殖可能比有性繁殖的个体具有更强的生存能力。
背景
植物种群的破碎化,以前连续种群变成不同尺寸的斑块的过程,彼此分离出来,可能对群体具有独特的影响:(1)影响生殖成功,(2)改变花粉介导的基因流动模式(花粉流量)和(3)影响自授粉和营养繁殖。虽然许多植物种群天然被隔离,但小,众多植物种群的群体由于道路,铁路,领域,建筑物和其他人类活动最近的栖息地的人为碎片而变得更加孤立[1那2].
植物物种的碎片化和丰富度会对其传粉者的访问率和花的稳定性产生惊人的影响,这可能会对植物的繁殖成功产生重大影响,减少传粉者的数量和物种丰富度,改变它们的觅食行为,限制传粉者在种群中的移动[3.那4.].因此,受花粉限制和繁殖成功率降低的影响,植物的开花次数更少。对当地种群密度和规模的研究清楚地表明,在稀疏和小的种群中,授粉和繁殖成功会下降[5.].由于昆虫移动的减少,生殖成功的降低对那些高度依赖传粉者互惠共生(即传粉者限制)的果实生产的植物来说尤其严重[6.],例如地中海欺骗性兰花[7.].
性繁殖主要是依赖于授粉者,即使有时可以通过无性繁殖或自我授粉成功保证。自我授粉的人群更有可能建立在栖息地的栖息地,其中粉尘器似乎是稀缺的,其中人口规模很小[8.]以及在带有有限机会的环境中[9.].
兰花复杂的花结构和授粉策略是开花植物为了避免近亲繁殖而选择异交的最好例子。然而,自动授粉兰花在地理上孤立和/或传粉者稀少的环境中较为常见,如高纬度/海拔、沿海地区和岛屿[10.那11.,支持“繁殖保证”假说,该假说认为,在传粉者服务严重限制繁殖的情况下,选择倾向于增加自花授粉,以确保种群的持续[12.].在研究过授粉系统的陆生兰花中,约有20%能够自动授粉[11.那13.],表明自动液体中是否常见于兰科(Orchidaceae)14.].
在植物王国繁殖中可以通过营养繁殖来确保典型的无性繁殖,在没有种子的情况下形成新的人,包括形成新植物,从根茎,灯泡或块茎中形成。营养繁殖导致克隆结构,其中一个克隆(遗传)可以由几个个体(ramets)组成。群体中营养繁殖的最明显的遗传特征是存在重复的多点基因型(MLG),因此,每个基因座的杂合子和等位基因预期增加[15.].许多兰科植物具有营养繁殖能力,这代表了种群维持的普遍模式。兰花的营养繁殖有几种模式,不同的物种拥有不同的生命形式[16.].在兰花中,最普遍的营养增殖模式是在轴向器官如根茎、匍匐枝和茎块茎上形成和萌发两个或多个芽,包括休眠芽[17.].子代芽与母系芽之间存在着长期的联系。子代生在带有茎根状茎或球茎的兰花中(Anacamptis那Dactylorhiza那兰花那Ophrys.那Serapias等)分离最快,在1-2年后[18.].在兰花中,我们可以区分有专性营养繁殖的兰花,有兼性营养繁殖的兰花,包括短根状茎和大多数块茎状兰花,以及有例外情况的营养繁殖的兰花[16.].
一个显式的方法来明确和量化的方向花粉之间流动人口和验证存在自发的自我授粉或营养繁殖是植物的分子分析和亲子鉴定分析收集的种子从已知的母亲决定的起源花粉受精胚珠。
在本研究中,我们评估了一种兰花的9个片段化亚居群的花粉流、自交率、营养生殖和雌性生殖成功。Serapias通用.本种依赖昆虫传粉者以确保其繁殖,自我兼容并能营养繁殖[19.,适用于研究群体片段化对基因流动、自交/克隆率和繁殖成功率的影响。
更具体地说,我们针对(1)确定遗传群结构以量化克隆性率;(2)在研究中检查水果生产率,以获得女性生殖成功的估计;(3)检查从植物收集的种子的亲子态分析。
方法
研究物种
属SerapiasL.分布在整个地中海地区,其多样性的中心在意大利南部和希腊群岛[20.].
Serapias通用(舌兰花)是一种短暂的肺结核兰花和四倍体物种[21.].dull-coloured鲜花的统一结构:所有三个萼片和下唇(唇)的近端部分形成一个罩(管状花冠),一个独特的光泽,或多或少的硬结,出席葉的底部,epichile(唇)的远端部分通常是斜向下的。花瓣和唇的特征是锥形的表皮乳头和两种具有分泌的顶端细胞的毛状体[22.].它是一个广泛的物种,主要分布在地中海-大西洋国家(葡萄牙,西班牙,法国,意大利,巴尔干半岛,希腊),但到达北非西部(摩洛哥,突尼斯)。它生长在干旱或潮湿的草地,废弃的农业土壤,garigue和灌木丛生的环境高达1200米a.s.l。23.].最近的分子分析强烈支持自然分裂S. Lingua.进入严格相关的亚组美国gregaria和美国olbia的两种罕见的地方性疾病[24.].
在过去的几年里,授粉策略S. Lingua.得到了更多的关注,初步观察表明Ceratina cucurbitina男性是主要的粉碎机[14.那25.].而其他的Serapias物种为昆虫提供一个花管,在里面休息或睡觉(庇护所模仿策略),S. Lingua.似乎已经进化到性欺骗的粉丝师,类似于观察到的东西Ophrys.兰花[26.,在其花香提取物中发现大量的烷烃和烯烃,也支持了这一现象[27.那28.].
研究区域和人口规模和密度的度量
该研究地点位于意大利南部(卡拉布里亚地区)。它占地约700公顷,由石灰质、干燥的草原(Festuco-Brometalia)组成;Spartium junceumlCytisus sessilifolius土地岩蔷薇incanus L。是常见的灌木和羊茅属circummediterraneaPatzke叶片直立人huds。和Dactylis glomerataL.是主要的草药.
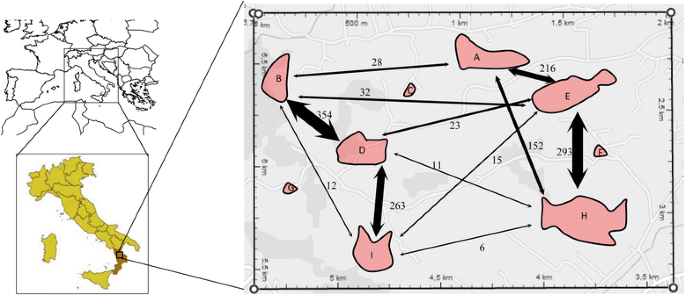
Serapias通用生长在整个地区,形成了数到数千个个体的种群。我们在这里把“人口”定义为一组S. Lingua.每个种群与邻近种群之间至少间隔300米(图3)。1).共识别出9个种群;在繁忙的道路及其交叉口包围的高度迎际景观语境中发现了三(c,f,g),而其余六(a,b,d,e,h,i)是非人类(天然)群体。研究区内或周围没有其他人口,研究区以外的最近人口约为人口北约5公里。
2014年春季人口大小(即特定领域中的个体总数)和人口密度(即由总面积除以总面积的人口规模)。对于人口规模,我们在三个较小的人口(C,F,G)中单独标记并计算所有(开花和植物)个人的数量(C,F,G),而在我们标记的彼此的群体中,并计算了五个选定的方形网格中的个人数量(10×10米)分开30-50米。由每种群体的五个图产生的测量分组并用于计算群体大小。对于人口密度,我们计算了识别每种人口的界限的人口(平方米)使用最外面的人口(表1).代金券标本保存在卡拉布里亚大学(CLU)的植物标本室。
生殖成功措施
测试自然繁殖成功率,在三个小种群和五个方格网的其余六个人口,鲜花,水果的数量统计和水果组确定的平均比率(数量的水果/生产数量的可用鲜花)在研究植物。为了确定是否存在活胚,从每个果实的蒴果中心取出至少1000颗种子,并在光学显微镜(100倍)下观察。根据有效胚的存在与否,将种子分为两类(有效和无效种子)。计算每个果实的种子集[(采样果实中填充的种子数量/观测到的种子数量)× 100]。
此外,每个种群中有5个未开花的个体,用细网布将传粉者排除在外,进行自花受精试验。6月统计结果,确定果实数/花数的比值。
DNA提取和微卫星基因分型
3个小群体的每个个体和6个小群体5个选定区域的每个个体的叶片采样,并保存在硅胶中,用于后续的DNA提取和微卫星(Short Sequence Repeat, SSR)基因分型。利用对Doyle和Doyle的CTAB(十六烷基三甲基溴化铵)方法进行轻微修改提取基因组DNA [29.].约0.5克每片叶子分别杵在一个2 ml-Eppendorf瓶使用500μL标准CTAB的缓冲区,孵化为30分钟60°C,提取两次通过添加500μL chloroform-isoamyl酒精(24:1)和异丙醇沉淀,洗250μL乙醇70%。将DNA重新悬浮于50 μL蒸馏水中。
为了分析各群体和基因型的遗传结构,我们利用5个核微卫星位点对所有成虫进行了微卫星基因分型Serapiassp。[19.那30.].最终体积为100 μl的PCR反应包含40 ng基因组DNA,每个dNTP 100 μM,每个引物0.3 μM, 2个单位Taq聚合酶,2 μM MgCl2和10 μl反应缓冲液。扩增条件为:1个94°C 3 min循环;30个循环,94°C 30 s,位点特定退火温度(55或58°C) 45 s, 72°C使用Perkin Elmer热循环器30 s。每个位点的PCR引物均用荧光染料(FAM, TET)标记。标记PCR产物与内部尺寸标准GeneScan ROX400在ABI 3110 (Perkin Elmer, Biosystems)上运行,并使用gene escan Analysis软件和gene typer软件(Perkin Elmer, Biosystems)对个体进行基因分型。
单克隆利率
多位点基因型(MLGs)是手工分配的。由于在有性生殖和营养生殖群体中发现的具有相同MLG的个体可能是同一基因的分株,也可能是由不同有性生殖事件的偶然衍生而来,我们使用GIMLET 1.3.2程序[31.来估计从一个群体中随机抽样的两个个体偶然共享同一MLG的概率(身份概率:PI)。
计算了两种不同的基因型多样性指标。第一个测量是G/N,即群体中mlg数量与总个体数量的比值[32.].该指数的值因零(严格的克隆)而异,所有个人共享相同的MLG,每个人具有不同MLG的一种(性繁殖)。第二个措施是MLG多样性(D.G)[33.[衡量从N个体群体随机选择的两个人的可能性会产生不同的MLG。类似于第一尺度,dG范围从0表示只有一个显性克隆到1表示每个个体都有不同的基因型。
遗传变异性
群体遗传分析基于“校正”的数据集,其中具有相同MLG的所有个体被认为是单一基因的分株。对于nsssrs,等位基因的数量,每个位点的等位基因数量(N一种)和人均(NAP)[34.,观察到杂合度(HO.)、基因多样性(HE.)[35.],固定指数(F是 = 1 – HO./小时E.)使用FSTAT版本2.9.3.2计算每个轨迹和每种遗迹计算[36.].每个位点偏离Hardy-Weinberg平衡和位点之间的连锁不平衡通过使用GENEPOP 4.0版本中实现的Markov链方法进行精确检测[37.,并用Bonferroni更正。HT.和HS.[35.),和F英石[38.]用FSTAT进行估计。HT.总群体的基因多样性,HS.是种群内的平均基因多样性,F英石是无限等位基因模型下群体的遗传分化系数。成对F.英石通过在群体中排列基因型来检验值的显著性。为了通过距离检验隔离的存在,在种群成对地理距离和F之间进行Mantel检验英石/ (1 - F英石)被应用[37.].无效等位基因(没有给出聚合酶链反应产物的等位基因)频率使用基于EM算法的最大似然(ML)估计器估计,并在GENEPOP 4.0中默认实现[37.].基于微卫星等位基因频率,瓶颈检测了最近的种群瓶颈[39.[采用两相突变模型(TPM),具有95%逐步突变模型(SMM)和5%多步突变。使用Wilcoxon测试评估意义。瓶颈计划[40]作为一种替代的遗传瓶颈措施,用于检测相对于突变漂变平衡下预期的过量基因多样性。杂合度过剩法利用了在瓶颈期等位基因多样性比杂合度减少得更快这一事实,因为稀有等位基因会迅速丢失,对杂合度影响很小,从而产生相对于具有相同等位基因数量的恒定大小的群体中所期望的暂态杂合度过剩[39.].
父级分配
每个果实的微卫星图谱也被确定,以确定每个种群的植物发育的果实是否可能是由同一种群或不同供体的个体传递的花粉产生的。6月采集蒴果,中心部分种子进行分子分析。种子在双筒显微镜下观察。从每个蒴果中收集50颗可存活的种子(这意味着带有胚胎的种子),并转移到单个2ml的eppendorfs中提取它们的DNA。核微卫星位点的扩增和分析遵循上述协议。采用基于多位点基因型的可能性方法对所有成年基因和后代进行父系分析,使用CERVUS版本2.0 [41].在本研究中,程序所需的模拟参数设置为:10000个循环,4956个候选亲本(=整个研究群体采集的所有果实),0.99为候选亲本采样比例,1.00和0.001为分型和错型位点比例。
根据指定的亲本数据,我们将果实分为自交、研究区域内的异交和与研究区域内不存在的亲本异交。我们将自交率定义为自交果实的数量除以每个群体的检验果实的数量。
结果
人口规模和密度
种群大小不一,种群密度为0.70 ~ 5.75只/m,从284 ~3200只不等2)(表1)和隔离程度(之间的距离)S. Lingua.人口从3亿到2.5公里不等)。3个种群(C、F、G)的人口规模值显著低于其他6个种群,人口密度值显著高于其他6个种群,如人口面积较小(见表)1).
繁殖成功率
各居群间果实产量存在显著差异。结果表明,9个居群的坐果率差异显著,平均为5.10% ~ 20.30%,平均为14.53%。具体来说,种群规模最小的三个种群(C、F、G)的值低于其他种群,而其他种群的值则高出4倍(见表)1).相比之下,群体的可行性种子百分比没有显着差异,该种子从78.55(±2.13)变化,群体C至85.35(±3.83),用于群体E(表1).水果生产率变化的最佳解释是水果集和种群尺寸之间的正相关性。实际上,人口规模的估计参数是积极的,这表明较大的人群具有更高的速度率。
为了排除传粉者,用细网布袋装的45个个体(每个种群5个)没有一个表现出自发性的自花受精。
克隆传播的存在和程度
所有人口都受到不同款项的影响。最低G / N比的群体为C(0.067),另外两个(F和G)小群体显示稍高的值略高(表2).其他居群的G/N值较高,为0.812(居群A) ~ 0.892(居群H)G),范围从接近零(人口C)到0.794(人口H),平均值为0.215(表2).
群体间遗传多样性和分化
PCR产物从所有检查的个体成功获得,它们的片段长度适合于预测的尺寸范围,并且所有检查的基因座在九个种群中都是多态性的。对于任何群体,观察到基因座之间没有显着的联系不平衡,因此所有基因座都用于进一步分析。
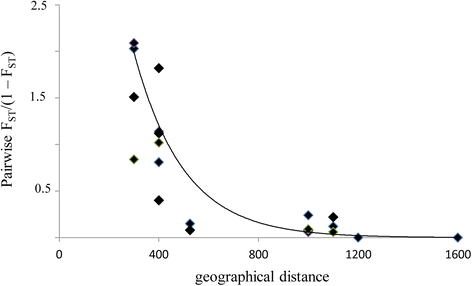
每种群体的总和在4到15个(平均9.6等位基因)之间的总额和每个基因座的等位基因数在8到20之间(未显示数据)。3个种群(C,F,G)每人的平均等位基因较低,而不是其他群体,并拥有自然群体表现出的所有等位基因。此外,在人类群体中,观察到的杂合子远小于预期(H.O. = 0.38-0.42;HE.= 0.52 ~ 0.60),其他群体杂合度较高(HO.范围从0.77到0.80),接近期望值(HE.范围从0.75到0.79)(表3.).近亲繁殖系数(F是(45个值在不同群体间存在差异。6个居群表现出低杂合子过剩,范围从F是 = −0.02 (pop E) to F是=−0.12 (pop A)是= 0.22-0.28)3.).在每个群体中发现的私人等位基因很少。群体间遗传分化系数(F英石)估计为0.053。成对F.英石/ (1 - F英石)与nsssrs群体间地理距离显著相关(P < 0.05,图。2).
瓶颈分析显示,在95%逐步突变模型下,三种群体观察到的基因多样性明显高于预期,同时发现任何其他人群没有偏离突变漂移均衡。在突变漂移平衡(即,最近的有效尺寸仍然存在的有效尺寸)中,轨迹显示基因多样性过量或基因多样性赤字的近似相同的概率。经历了近期其有效人口大小的群体表现出多态基因座的等位基因和基因多样性的相关性。但等位基因数量比基因多样性更快。因此,在最近的瓶颈群中,观察到的基因多样性高于从观察到的等位基因数计算的预期平衡基因多样性,在恒定大小(平衡)人群中[42].
种子的父权分配
在父项分配实验中,从九个种群的5176株植物中获得4967个果实(表1).21个样本的DNA提取失败,但其余4956个样本的父系被检查并以95%的置信水平确定。有明显区别的亲子鉴定中人口的移民率的比例,不同的人口(G)的7.14%降至32.02%(人口B)。实际上,在六个人口(A、B、D、E、H和I)花粉的父母大约30%的水果以外每个人,在3个居群(C、F、G)中,约90%和10%的花粉亲本分别位于居群内和居群外。种群A、B、D、E、H和I的母体植物广泛地接受了其他种群的花粉。整个种群的花粉传播距离最大为1100 m。有趣的是,花粉接收率与种群间距离呈正相关(图2)。1).事实上,在距离最近的种群之间存在着更大的基因流动,而在距离最远的种群之间,基因流动几乎为零。自交不结果实。
讨论
人口遗传结构
在本研究分析微卫星DNA变异的研究Serapias种群间遗传分化明显,表明种群间存在不同程度的基因流动。
在我们的调查中,每个位点的等位基因数(8-18)和每个群体的平均等位基因数(9.6)高于Pellegrino等人检测的每个位点(4-10)和每个群体的等位基因数(3.6-5.6)[19.那43[其他人的人口Serapias物种(美国parviflora那S. polityii.和美国vomeracea).但这些值类似于或略低于迄今为止其他地中海兰花属的人数略低,Dactylorhiza[44],Gymnadenia[45那46),而Ophrys.[47那48].
本研究中包括的5个标记显示中等水平的遗传变异(HE.范围为0.69 - 0.79,平均0.694),而其他关于兰花的微卫星研究[47].
群体间遗传分化值低(F英石=0.053)是由于该地区的地理范围小S. Lingua.人口研究。实际上,在其他小兰花种群中报道了基于微卫星的类似遗传分化值Caladenia Huegelii.[49),天麻[50,分别显示150公里和250公里的地理距离。
由于许多可能的变量,群体遗传多样性和生存能力的模式在不同群体之间可能存在很大差异[51].如果它们变得非常小和孤立,人群可能会失去大部分遗传多样性[52].因此,我们发现了两个不同的组;第一组由三个最小的组成S. Lingua.群体(C、F、G)的遗传多样性明显不足,杂合度与预期差异最大,近交系系数(F是),而由其他群体组成的第二组观察到的杂合度接近预期的杂合度值,近交系系数较低(表3.).较小群体的遗传差往往源于与其他人群的有限相关[53].
亲子鉴定和基因流动
种子亲态试验的数据表明,长距离花粉分散事件的短距离和低频频率高。在研究群体中,在最近的人群(距离300至500μm的距离之间发生更多的基因流量,而基因流量在彼此远的群体中降低(距离1000至1500米),并且很少或根本没有- 在三种最小和最孤立的群体之间的基因流动(图。2).此外,这三种群体表明,花粉在90%的病例中授粉了相同人群的花粉,其他群体的花粉仅为10%,其相反显示了花粉投入的较大流动。人群之间的授粉事件随着人群的地理分离而增加,表明大多数粉刷者运动发生在人口中。这可能是对小群体的粉碎机访问不充分的结果,导致强大的基因流量限制[2那54].最近群体之间的花粉流量与粉丝器的行为一致。实际上,基于捕获昆虫的捕获和重新捕获的最近的工作表明,粉丝簇行进的平均距离为300米,只有几种昆虫在约1000μm的距离下重新获得55].但是,与较大的人口相比,这并未解释从较小种群外部的较小群体的较低花粉流量独立于群体之间的距离。可能,还有其他因素确定这种减少。例如,一个因素可能是群体尺寸,因为所检查的群体表明,绘制局部花粉流量的比例与人群中的成年植物的数量正相关。较大的植物种群可能对粉丝器更具吸引力,导致较高的探索率,而小的碎片群体可能不那么吸引人[56].此外,一个长周长的种群可能会有更多的昆虫(即传粉者)遇到它,从而增加授粉。此外,种群密度越高,同一种群中个体之间的传粉量越高,或自交率越高[57].在我们的情况下,随着物种自兼容,但不能通过自发的自动自动制造水果,检测到的模式只能是通过粉粉的活动花粉转移的结果,因此授粉成功S. Lingua.与种群大小呈显著正相关。这与几项兰花研究的结果是一致的,这些研究已经表明,不断增长的种群规模往往会对基因流动产生积极的影响[58].除种群大小外,开花植物的种群密度也影响了传粉昆虫的迁移,随着种群密度的降低,传粉昆虫的迁移增加。这一数据与之前许多关于食物诱骗兰花的论文有明显的对比,也与性诱骗兰花的研究一致。的确,Vandewoestijne等人[59结果表明,3个种群中,传粉昆虫活动总体上随种群密度的降低而增加Ophrys.物种,表明传粉者的可获得性,而不是传粉者的学习,是对有性欺骗的兰花成功传粉的最大限制因素。此外,在有性欺骗的兰花中,昆虫很少在第一次尝试交配后立即从一个个体切换到另一个亲密的个体,而倾向于在离第一个个体较远的地方飞走[60],暗示在小人口内表观避免了多种交配将在更大的距离上促进花粉流动[61].
性生殖成功和克隆性率
结果表明,无性繁殖是所有分析群体的共同繁殖策略,但无性繁殖对不同群体没有影响S. Lingua.一样。六个更大的S. Lingua.群体显示出更高水平的克隆(DG = 0.71-0.79),例如,类似于濒危物种中的那些凤仙花calceolus(dg = 0.97; [62]),而克隆多样性最低(G / N指数)和降低的杂合性(HO.= 0.38-0.42),与波兰相似Epipactis atrorubens[63),Cephalantera rubra人口(64是特别密集的营养繁殖的结果。根据我们的数据,C、F和G种群表现出更高的无性繁殖率,而在其他种群中,性策略似乎更有助于繁殖。我们在小种群中发现的无性繁殖模式的一个假设是,由于传粉者的限制,这些种群的有性繁殖很低,这可以从果实的数量很少得到证明。性别和克隆生长之间的平衡在物种之间和物种内部是不同的,主要是由生物和环境因素驱动的[65].虽然植物繁殖具有与更高的资源摄取,降低花粉分散或增加的地瘤授粉(Geitonogamous Polinmin)有关的生态成本66,表现出较高无性繁殖率的物种具有一些潜在的生态和进化优势。在我们的例子中,S. Lingua.可以持续存在于小型,孤立的群体,条件不利于性繁殖,通过保证在有限的粉刷服务的情况下,通过保证物种的存活来提供一种生殖保障形式[15.].因此,授粉者的可得性和果实的结实率与每个种群的大小和邻近种群之间的距离有关S. Lingua.可以解释我们在不同群体中发现的不同程度的无性系繁殖。特别是C、F和G种群的无性繁殖率高于其他种群,前者由几百个个体组成,分布在一个限制区域(约70 m)2),后者由1000只个体组成,面积更大(约0.5公顷)。遭受更多环境压力和道路、铁路、田地、建筑物和其他人类活动的碎片化的群体表现出更高水平的克隆[15.那67].
结论
该研究代表了人口结构对欺骗性地中海兰花的花粉流量和克隆生长的少数分析之一。由于人口尺寸的减少,人口碎片可能会降低生殖成功,并且人口之间的地理距离增加。我们发现克隆品在小和孤立的人群中提供了优势S. Lingua.因此,克隆可能比有性繁殖的个体具有更强的持久能力[61].由于克隆的生长与基因型多样性的逐步降低有关,因此性繁殖可能对某种物种的长期成功可能是必不可少的,并且克隆的成功可能在延长性行为减少或缺席时延长灭绝时发挥重要作用。
缩写
- CTAB:
-
Cetyltrimethyl溴化铵
- D.G:
-
茎基因型多样性
- F是:
-
固定指数
- F英石:
-
人群中的遗传分化系数
- HE.:
-
基因多样性
- HO.:
-
观察到的杂合性
- HS.:
-
种群内平均基因多样性
- HT.:
-
总群体的基因多样性
- ML:
-
最大似然
- MLG:
-
多点基因型
- N一种:
-
每个位点的等位基因数
- NAP:
-
每个群体的等位基因数
- PI:
-
身份的概率
- SMM:
-
逐步突变模型
- 苏维埃社会主义共和国:
-
短序列重复
- TPM:
-
两相突变
参考
- 1。
王志强,王志强,王志强。生境破碎化对植物繁殖成功和种群生存能力的影响。Conserv杂志。2013;159:16-23。
- 2。
Pellegrino G,Bellusci F.人类扰动对人口统计和生殖成功的影响Serapias cordigera(兰科)。Bot J Linn Soc. 2014;176:408-20。
- 3。
陈志刚,陈志刚,陈志刚。墨西哥热带森林中一种丰富的林下棕榈对传粉昆虫丰度和结果的影响。Conserv杂志。2008;141:375 - 84。
- 4.
Öckinger E, Dannestam Å, Smith HG.城市草地破碎化和生境质量对蝴蝶多样性的重要性。《城市规划》,2009;93:31-7。
- 5.
Vranckx G,Jacquemyn H,Mergeay J,Cox K,Janssens P,Gielen Bas等。干旱胁迫对Pedurnulate橡木杂合性健身相关性的影响(Quercus栎树).安Bot-London。2014;113:1057 - 69。
- 6.
林志强,王志强,王志强,等。传粉者限制和繁殖系统对森林碎片区植物繁殖的影响。Acta Oecol。2010;36:191-6。
- 7.
Tremblay R, Ackerman JD, Zimmerman JK, Calvo RN。兰花有性繁殖的变异及其进化结果:一次向多样化转变的痉挛性旅程。生物谷学报2005;84:1-54。
- 8.
BUSCH JW。地理外围人群中自我兼容性的演变leadvorthia alabamica(十字花科)。Am J Bot. 2005;92:1503-12。
- 9.
高志强,王志强,王志强,等。城市生态系统中传粉过程和Allee效应的研究。新植醇。2006;172:774 - 83。
- 10.
Gamish A,Fischer Ga来自HP。马达加斯坦的经常性多态性交配型变异Bulbophyllum物种(兰科)举例说明了热带兰花中自动授粉的高发病率。Bot J Linn Soc. 2014;175:242-58。
- 11.
周X,林H,风扇X-L,GAO J-Y。一种嗜胞胎兰花的自主自治和昆虫探视,Epipogium罗森(d.don)lindl。Aust J Bot。2012;60:154-9。
- 12.
TheologIDIS I,Chelo Im,Goy C,Teotònioh。生殖保证驱动在实验性Caenorhabdise秀丽隐患中的自我施肥转变。BMC BIOL。2014;12:93。
- 13。
彼得CI,约翰逊SD。生殖生物学acroolophia cochlearis.(兰科):估算蛇纹兰果岭中的交叉授粉率。安Bot-London。2009;104:573-81。
- 14。
范德辛格尔纳。兰花授粉图谱:欧洲兰花。英国伦敦:CRC出版社;2001.
- 15.
马雷罗Á, Fernández-Palacios JM,马雷罗等。无性系对稀有岛屿物种遗传变异的影响:以太阳之microcarpa来自加那利群岛。ECOL EVOL。2013;3:1569-79。
- 16.
Tatarenko IV, Vakhrameeva MG。兰花的营养繁殖(俄语)。植物通报Sada imeni i.s Kosenko Kubanskogo Gosagrouniversiteta. 1998;7:155-8。
- 17.
王志强,王志强。维管植物的形态与进化。植物学报。旧金山:W.H. Freeman & Co.;1989.
- 18.
兰科植物的生物学特性。植物学研究进展:学术出版社,伦敦;1979.
- 19.
Pellegrino G,Musacchio A,Noce Me,Palermo Am,Widmer A.繁殖与形态学相似的花卉孤立Serapiasl .物种(兰科)。J在这里。2005;96:15-23。
- 20.
Baumann H, Künkele S. Die GattungSerapiasL. eine taxonomische übersicht。Mitteilungsblatt Beiträge zur Erhaltung Erforschung heimischer。Orchideen。1989;21:701 - 946。
- 21.
D’emerico S, Pignone D, Scrugli A. Giemsa c -带核型SerapiasL.(兰科西)。Bot J Linn Soc。2000;133:485-92。
- 22.
巴隆卢马加先生,佩雷格里诺G,贝鲁西F, Perrotta E, Perrotta I, Musacchio A.四同域种的花微形态比较Serapias(兰科)。acta optica sinica, 2012;169:714-24。
- 23。
欧洲的德尔福吉兰。北非和中东:美国俄勒冈州波特兰市木材出版社;2006.
- 24。
Bellusci F,Pellegrino G,Palermo Am,Musacchio A.兰花属中的系统发育关系Serapias基于叶绿体基因组的非编码区。分子系统学进展。2008;47:986 - 91。
- 25。
Vereecken NJ,Dafni A,Cozzolino S.授粉综合征在地中海兰花的思考,对品种,分类和保护的影响。BOT Rev.2010;76:220-40。
- 26。
Jersáková J ., J . d ., J . Kindlmann P.兰花欺骗授粉的机制和进化。启杂志2006;81:219-35。
- 27.
兰科植物性拟态的进化:在吸引雄蜂作为传粉者的过程中预适应的作用。BMC Evol Biol. 2008;8时。
- 28.
花楸属四种同域植物花香味的比较分析SerapiasL.(Orchidaceae):授粉策略的线索。植物系统中的Evol。2012;298:1837-43。
- 29.
Doyle JJ,Doyle JL。少量新鲜叶组织的快速DNA隔离程序。Phytochem Buart。1987年;19:11-5。
- 30.
王志强,王志强,王志强,等。兰科植物微卫星基因座的分离与鉴定Serapias vomeracea(兰科)和交叉灌注到其他Serapias物种。Mol Ecol Notes。2001;1:279-80。
- 31.
Valièr N. GIMLET:分析遗传个体鉴定数据的计算机程序。Mol Ecol Notes, 2002;2:377-9。
- 32.
Halkett F,Simon JC,Balloux F.解决克隆和部分克隆生物的人口遗传学。趋势ECOL EVOL。2005;20:194-201。
- 33.
Pielou EC。数学生态学导论。纽约:Wiley-Interscience;1969.
- 34.
计数稀疏等位基因:私人等位基因和层次抽样设计。Conserv麝猫。2004;5:539-43。
- 35。
Nei M.突变驱动的演化。牛津:牛津大学出版社;2013年。
- 36。
Goudet J. FSTAT (Version 1.2):计算F-Statistics的计算机程序。J在这里。1995;86:485-6。
- 37。
空间群体遗传学的推论。在:秃头DJ,主教M,坎宁斯C,编辑。统计遗传学手册。英国奇切斯特:威利;2007.p . 945 - 79。
- 38。
Weir BS,Cockerham CC。估计人口结构分析的F统计。进化。1984年;38:1358-70。
- 39.
Cornuet JM,Luikart G.检测等位基因频率数据的近期种群瓶颈的两次测试的描述和功率分析。遗传学。1997年;144:2001-14。
- 40。
piy S, lukart G, Cornuet JM。瓶颈:利用等位基因频率数据检测有效种群大小最近减少的计算机程序。J在这里。1999;90:502-3。
- 41。
Marshall TC, Slate J, Kruuk LEB, Pemberton JM。自然群体中基于可能性的父子关系推断的统计置信度。摩尔生态。1998;7:639-55。
- 42。
lukart G, Sherwin WB, Steele BM, Allendorf FW。分子标记在通过监测遗传变化检测群体瓶颈方面的有用性。摩尔生态。1998;7:963 - 74。
- 43.
佩莱grino G, Palermo AM, Noce ME, Bellusci F, Musacchio A.地中海地区遗传群体结构Serapias vomeracea,一种无回报的兰花组。授粉策略与随机力的相互作用?植物系统进化。2007;263:145-57。
- 44.
刘志刚,刘志刚,刘志刚。四倍体沼泽兰的地理变异及其系统学研究Dactylorhiza马贾利无性系种群。Sphagnicola.(兰科)及其近缘类群。acta optica sinica, 2012;168:174 - 93。
- 45.
Gustafsson S,LönnM.遗传分化与开花时变种的栖息地偏好gymnadenia conopsea.遗传。2003;91:284 - 92。
- 46.
Stark C, Michalski SG, Babik W, Winterfeld G, Durka Wgymnadenia conopsea和g . densiflora尽管形态相似。植物系统进化。2011;293:213-26。
- 47。
Soliva M,Widmer A.基因流过SympaTric的物种界限,性欺骗性Ophrys.(兰科)物种。进化。2003;57:2252 - 61。
- 48。
Mant J,Peakall R,Schiestl FP。在花香气味的选择会促进性欺骗兰花属的种群和种类的分化Ophrys.还是进化。2005;59:1449-63。
- 49。
Swarts Nd,Sinclair EA,Krauss S1,Dixon KW。批判性蜘蛛兰花分散群体的遗传多样性Caladenia Huegelii.:对环境保护的启示。Conserv麝猫。2009;10:1199 - 208。
- 50.
陈媛媛,鲍志新,曲艳,李伟,李志忠。药用兰花的遗传多样性与群体结构天麻通过微卫星分析透露。生物学习系统系统。2014; 54:182-9。
- 51.
王志强,王志强,王志强,等。边缘度对植物种群性能的影响。J Biogeogr。2014;41:239-49。
- 52。
植物群体大小、适应度和遗传变异之间的正相关关系有多普遍?J生态。2006;94:942-52。
- 53。
当代有效种群大小的遗传估计:关于遗传随机性对野生种群持久性的重要性,它们能告诉我们什么?摩尔生态。2008;17:3428-47。
- 54。
Davies SJ, Cavers S, Finegan B, White A, Breed MF, Lowe AJ。在新热带先驱者树种中,在破碎的景观中花粉流动保持了遗传多样性,Vochysia ferruginea集市。遗传。2013;1 - 5。
- 55.
Lind H, Franzén M, Pettersson B, Nilsson LA。欺骗性兰花的半种群授粉Anacamptis锥体.Nord J Bot. 2007;25:176 - 82。
- 56.
Mustajärvi K, Siikamäki P, Rytkönen S, Lammi A.植物种群大小和密度对植物-传粉者相互作用的影响。J生态。2001;89:80-7。
- 57.
Setsuko S,Nagamitsu T,Tomaru N.花粉流量和人口结构对自行率和女性的影响和碎片的雌性和男性生殖成功木兰stellata人群。BMC医学杂志。2013;十三10。
- 58.
Aguilar R, Ashworth L, Galetto L, Aizen MA。植物繁殖敏感性对生境片断化的影响:综述和荟萃分析。生态。2006;9:968 - 80。
- 59。
王志强,王志强,王志强,等。兰科植物个体和种群参数对繁殖成功率的影响[j]。植物医学杂志。2009;11:454 - 63。
- 60.
Schiestl FP。性欺骗兰花中的花卉演化与粉丝伴侣选择。J EVOL BIOL。2004;17:255-64。
- 61.
黄柏,Salzmann C,Schiestl FP。粉丝器吸引力随着开花兰花的距离而增加。Proc R Soc Lond。2004;271:S212-4。
- 62.
Brzosko E,Wrablewska A,Ratkiewicz M.岛屿拖鞋的岛屿种群的空间遗传结构和克隆多样性(凤仙花calceolus),从Biebrza国家公园(波兰东北部)。摩尔生态。2002;11:2499 - 509。
- 63.
李志刚,李志刚,李志刚。稀有植物的遗传结构Epipactis atrorubens波兰东北部两个国家公园的种群。宝梯街2006;22:71 - 80。
- 64。
Brzosko E,Wrooblewska A.岛屿的遗传变异和克隆多样性Cephalanthera Rubra.来自Biebrza国家公园的人口。波兰Bot J Linn Soc。2003;143:99-108。
- 65。
Silvertown JW。有性生殖的进化维持:来自无性生殖在无性生殖植物中的生态分布的证据。植物学报2008;169:157 - 68。
- 66。
Vallejo-Marín M, Dorken ME, Barrett SCH.无性繁殖对植物交配的生态和进化后果。2010年生态学年度回顾;41:193 - 213。
- 67.
Lhuillier E, Butaud JF, Bouvet JM岛屿太平洋檀香广泛的克隆性和强分化:对其保护的启示。安机器人。2006;98:1061 - 72。
确认
从生物学,生态学和地球科学大学获得GP和AMP的补助金支持这项工作。
作者信息
从属关系
相应的作者
附加信息
利益争夺
两位作者宣称他们没有相互竞争的利益。
作者的贡献
GP设想了这项研究,并参与了其设计和协调,是撰写手稿的关键人物。FB进行了分子遗传学研究。AMP执行了统计分析并参加了稿件的写作。所有作者阅读并认可的终稿。
作者的信息
所有作者均来自意大利卡拉布里亚大学生物、生态和地球科学系I-87036 Rende
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Pellegrino,G.,Bellusci,F.&Palermo。人口结构对碎片流动,克隆品率和生殖成功的影响Serapias通用人群。BMC植物杂志15,222(2015)。https://doi.org/10.1186/s12870-015-0600-8
收到了:
公认:
发表:
关键字
- 生殖成功
- 营养繁殖
- 营养繁殖
- 花粉流量
- 兰花种类