- 研究文章
- 开放获取
- 发表:
OsRH2和OsRH34是两个高度相似的DEAD box蛋白,与真核起始因子4AIII同源,在水稻生长发育调控中发挥外显子连接复合物的作用
BMC植物生物学体积16,文章号:84(2016)
摘要
背景
外显子连接复合物(EJC)在细胞核和细胞质中同时形成,在基因表达中起重要作用,包含真核起始因子4AIII (eIF4AIII)、MAGO/NASHI (MAGO)、Y14/Tsunagi/ rna结合蛋白8A和Barentsz/转移淋巴结51四个核心成分。编码EJC核心成分的基因已经在包括水稻在内的植物中被发现。目前,MAGO和Y14同源物的功能特征已在水稻中得到证实。然而,目前尚不清楚eIF4AIII是否是水稻功能性EJC所必需的。
结果
本研究研究了水稻中与eIF4AIII同源的两种DEAD box RNA解旋酶OsRH2和OsRH34。氨基酸序列分析表明,OsRH2和OsRH34的同源性为99%,相似度为100%,其基因表达模式在水稻各组织中相似OsRH2mRNA的表达水平约为of的58倍OsRH34幼苗中的mRNA。从双分子荧光互补结果来看,OsRH2和OsRH34分别与OsMAGO1和OsY14b发生了物理相互作用,说明OsRH2和OsRH34都是水稻EJC的核心成分。为了研究OsRH2和OsRH34在水稻中的生物学作用,通过RNA干扰产生了转基因水稻植株。三个独立的表型OsRH2而且OsRH34双敲除转基因株系包括矮化、节间距离短、繁殖延迟、胚胎发育缺陷和结实率低。这些表型与具有赤霉素相关发育缺陷的突变体相似。此外,OsRH2而且OsRH34双敲除转基因株系表现出未拼接水稻的积累未发育的绒毡层信使rna。
结论
水稻含有两个eIF4AIII副同源基因,OsRH2而且OsRH34.丰富的OsRH2mRNA的表达水平约为of的58倍OsRH34表明OsRH2在水稻中是eIF4AIII的主要基因。OsRH2和OsRH34都是EJC的核心组分,参与水稻株高、花粉和种子发育的调控。
背景
DEAD box RNA解旋酶家族是最大的RNA解旋酶家族,属于解旋酶超家族2。每个DEAD box RNA解旋酶包含9个保守的氨基酸基序,构成解旋酶核心结构域。除了DEAD box蛋白中的这些保守基序外,每个DEAD box RNA家族成员中还存在长度和组成不同的N端和c端延伸序列;它们被提出提供底物结合的特异性,并作为亚细胞定位的信号或作为与附属成分相互作用的结构域[1- - - - - -3.].DEAD盒蛋白存在于大多数原核生物和所有真核生物中,包括植物[4- - - - - -10].水稻是一种重要的主食作物,也是研究谷物功能基因组学的有价值的模式植物。虽然水稻基因组数据库中预测的蛋白质序列经硅硅分析确定,表明水稻中至少有51个DEAD box蛋白[10],其中大多数的功能特征仍然未知。
真核起始因子4AIII (eIF4AIII)是一种DEAD box RNA解旋酶,是外显子连接复合物(EJC)的核心成分,该复合物还包含MAGO/NASHI (MAGO)、Y14/Tsunagi/RNA结合蛋白8A和Barentsz/转移淋巴结51 [11- - - - - -16].EJC形成于细胞核和细胞质中,在基因表达中发挥重要作用,包括:(1)它在pre-mRNA的每个外显子上游组装20-24个碱基,参与mRNA的剪接[17].(2)参与无意义介导的衰变,这是一种降解含有过早终止密码子的mRNA的监测机制[18].(3)在翻译水平参与基因表达的调控[19].(4)在mRNA亚细胞定位中起作用[20.,21].
虽然大多数研究都是在哺乳动物中进行的,但在植物中发现了编码EJC核心成分的基因[22],表明植物和哺乳动物的EJC复合物存在结构和功能上的保守性。然而,关于EJC在植物中的生理作用的报道有限。在拟南芥, eIF4AIII与EJC组件ALY/Ref交互,并与其他EJC组件共域,如Mago, Y14和RNPS1 [23].在o .漂白亚麻纤维卷,两种形式的MAGO,OsMAGO1而且OsMAGO2的两种形式Y14,OsY14a而且OsY14b,进行分析[24- - - - - -26].OsMAGO1而且OsMAGO2双敲落水稻植株表现出矮化和异常花,而雄蕊的内膜和绒毡层得以保留[24].OsY14b可能在胚胎发生中起作用,而OsY14b下调OsY14b导致诱导植株失败[24].OsY14a敲沉植物也表现出与黄花相似的表型OsMAGO1而且OsMAGO2双拆稻株[24].此外,OsMAGO1而且OsMAGO2double-knockdown,OsY14a敲低基因转基因植物的pre-mRNA的异常积累未发育的绒毡层(OsUDT1),是雄蕊发育的主要调节因子[24].这些结果表明EJC参与了水稻pre-mRNA剪接的调控。
尽管MAGO和Y14的同源物在水稻中的功能已被证实,但eIF4AIII在水稻的EJC功能中是否必不可少尚不清楚。在本研究中,两个假定的水稻DEAD box RNA解旋酶基因,OsRH2(Os01g0639100),OsRH34(Os03g0566800),因此有了特征。OsRH2和OsRH34均与eIF4A家族成员eIF4AIII同源,其基因表达模式在水稻各组织中相似,但表达水平较低OsRH2mRNA的表达水平约为of的58倍OsRH34幼苗中的mRNA。双分子荧光互补(BiFC)分析结果表明,OsRH2和OsRH34均能与OsMAGO1和OsY14b相互作用。两者兼备的转基因植物OsRH2而且OsRH34被RNA干扰敲除的突变体显示出与赤霉素相关发育缺陷的突变体相似的表型。此外,这些OsRH2而且OsRH34双敲除植株在花粉和种子发育方面存在严重缺陷。积累OsUDT1pre-mRNA也检测到OsRH2而且OsRH34双敲除转基因株系。我们的数据表明,OsRH2和OsRH34都是水稻EJC的核心组成部分,在水稻株高、花粉和种子发育的调控中起着关键作用。
结果
OsRH2和OsRH34是假定的DEAD box RNA解旋酶
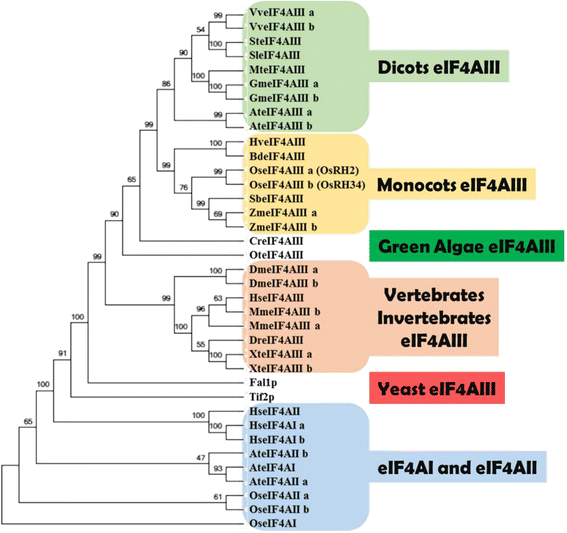
为了鉴定水稻eIF4AIII同源物,使用人类eIF4AIII蛋白序列作为查询来搜索phytozome和国家生物技术信息中心(NCBI)的蛋白质数据库。两个eif4aiii样的假定蛋白,编码于OsRH2(Os01g0639100),OsRH34(Os03g0566800)在大米中被发现(附加文件1).的OsRH2位于水稻1号染色体上,有8个外显子。推导出的氨基酸序列OsRH2cDNA由9个保守的RNA解旋酶结构域组成。1)和基序II的特征氨基酸残基D-E-A-D。此外,OsRH34基因有8个外显子,位于染色体3上。层次之间的认同OsRH2而且OsRH34DNA序列和推导出的氨基酸序列分别为97%和99%。系统发育关系是利用双子叶、单子叶、绿藻、脊椎动物、无脊椎动物和酵母eIF4A家族的氨基酸序列建立的(附加文件)2结果表明,OsRH2和OsRH34与eIF4AIII亲缘关系密切,可聚为单子叶组(图4)。2).
eIF4AIII家族成员的系统发育关系。使用MEGA 5生成了eIF4AIII在双子叶、单子叶、绿藻、脊椎动物、无脊椎动物和酵母中的系统发育树。eIF4AIII成员来自水稻、玉米、高粱和Brachypodium被归类为单子叶组,至少有50%的引导支持。在此列出的基因的接入号显示在附加文件中2
表达模式OsRH2而且OsRH34
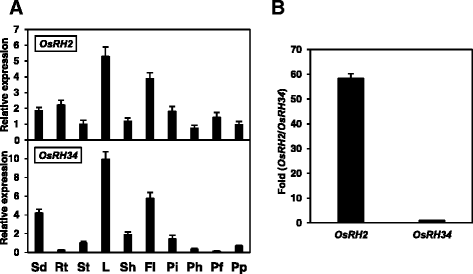
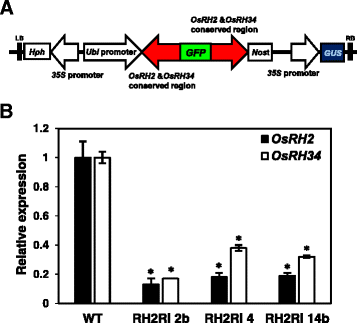
的相对表达水平OsRH2而且OsRH34在水稻中,从各种营养和生殖组织中分离出总RNA,并使用特定引物进行qRT-PCR(附加文件)1).的OsRH2转录本在所有选择的组织和器官中表达,包括根、茎、叶、鞘、穗和幼苗(图2)。3).相对较高的OsRH2在抽穗前的营养叶片、旗叶和穗中检测到mRNA。3).的表达OsRH34在营养叶片、旗叶和幼苗中相对丰富,而在根、茎和穗中很少检测到其表达(图2)。3).这些结果表明,这两个副同源基因在水稻的大多数选择组织和器官中共表达。比较…的水平OsRH2而且OsRH34采用绝对qRT-PCR法检测水稻植株的mRNA。标准曲线与连续稀释使用OsRH2互补脱氧核糖核酸——或者OsRH34cDNA-containing质粒。如图所示。3 b的水平。OsRH2mRNA的表达水平是对照组的58倍OsRH34水稻幼苗三叶期mRNA的表达。
OsRH2和OsRH34共定位于细胞核和细胞质
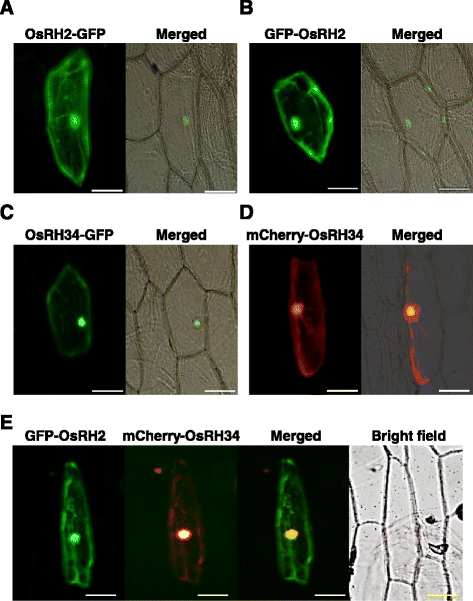
为了确定OsRH2和OsRH34的亚细胞定位,质粒含有anOsRH2-GFP融合基因OsRH34-GFP在控制之下CaMV 35 s产生启动子并导入洋葱表皮细胞。两种OsRH2-GFP均发出荧光信号。4)和OsRH34-GFP(图;4摄氏度)存在于细胞核和细胞质中。在洋葱细胞中,GFP-OsRH2的表达也得到了类似的结果。4 b)或mCherry-OsRH34(图。4 d).为了确认OsRH2和OsRH34的亚细胞定位,将洋葱细胞与GFP-OsRH2和mCherry-OsRH34共转化。GFP和mCherry信号共定位于细胞核和细胞质(图2)。4 e).这些结果表明OsRH2和OsRH34蛋白同时定位于细胞核和细胞质中。
OsRH2和OsRH34都是EJC核心复合体的组件
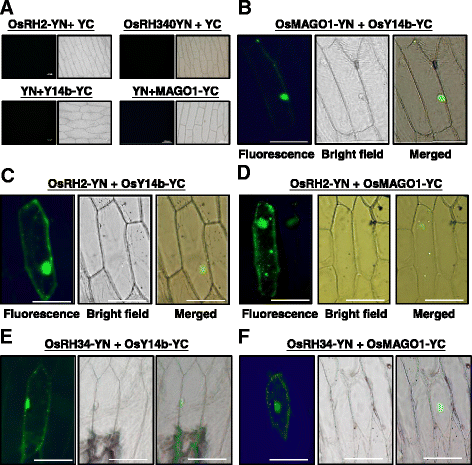
eIF4AIII在真核细胞中可与Y14和MAGO相互作用形成EJC核心复合物[27,28].龚与何[24]也报道了水稻MAGO和Y14可以形成异源二聚体。为了确定OsRH2和OsRH34是否是水稻EJC的组成部分,采用BiFC检测了水稻MAGO、Y14和eIF4AIII之间的相互作用。黄色荧光蛋白(YFP)的n端(YN)融合在OsRH2和OsRH34的下游端。YFP的c端(YC)融合在OsY14b和OsMAGO1的下游端。以洋葱表皮细胞中OsRH2-YN与YC、OsRH34-YN与YC、YN与OsMAGO1-YC、YN与OsY14b-YC共表达作为阴性对照,进行OsRH2、OsMAGO1、OsY14相互作用试验,未检测到荧光信号(图3)。5).OsMAGO1和OsY14b之间的相互作用被用作阳性对照,在洋葱细胞中表现出显著的荧光信号(图2)。5 b).这两种融合蛋白OsRH2-YN和OsY14b-YC在洋葱细胞中共表达,观察到YFP荧光(图。5度).在洋葱细胞中共表达的OsRH2-YN和OsMAGO1-YC也表现出YFP信号(图5)。5 d).同时,OsRH34-YN与OsY14b-YC共表达后,也检测到YFP荧光(图2)。5 e)和OsRH34-YN与OsMAGO1-YC(图;5 f),分别。这些结果表明,OsRH2和OsRH34都与OsY14b和OsMAGO1直接相互作用,表明它们确实是水稻EJC核心复合体的组成部分。
水稻MAGO、Y14和eIF4AIII在洋葱表皮细胞中相互作用的BiFC分析YFP (YN和YC)的N端和c端片段分别融合到OsRH2、OsRH34、OsMAGO1和OsY14b的c端。以35S:: OsRH2-YN和35S::YC、35S:: OsRH34-YN和35S::YC、35S::YN和35S:: Y14b-YC、35S::YN和35S:: MAGO1-YC为阴性对照,共转化洋葱表皮细胞(一个)洋葱表皮细胞与35S:: OsMAGO1-YN和35S:: OsY14b-YC共转化(b)、35S:: OsRH2-YN及35S:: OsY14b-YC (c), 35S:: OsRH2-YN和35S:: OsMAGO1-YC (d)、35S:: OsRH34-YN及35S:: OsY14b-YC (e), 35S:: OsRH34-YN和35S:: OsMAGO1-YC。(e) Bars = 100 μm
OsRH2和OsRH34被共定位(图。4),因此通过BiFC分析进一步检测了这两种亚型之间的蛋白质相互作用。在与OsRH2-YN与OsRH2-YC、OsRH34-YN与OsRH34-YC、OsRH2-YN与OsRH34-YC或OsRH34-YN与OsRH2-YC共表达的洋葱细胞中未观察到YFP荧光信号(附加文件)3.).这些结果表明,OsRH2和OsRH34蛋白不能相互作用形成同源体或异构体。
双击倒特性OsRH2而且OsRH34转基因线
揭示…的生理功能OsRH2而且OsRH34,采用RNA干扰介导的基因沉默方法。因为OsRH2而且OsRH34共享极高的序列同一性,难以实现特异性基因沉默。因此,双重击倒OsRH2而且OsRH34是在大米中进行的。为了最大限度地减少潜在的脱靶基因沉默,271-bp RNAi序列在的3´端设计了区域OsRH2互补脱氧核糖核酸,OsRH34以cDNA为查询对象,在NCBI的水稻mRNA数据库中进行检索。没有一个区域相同的约或超过16个核苷酸。此外,一种基于web的公共计算工具,用于识别潜在的脱靶,siRNA扫描[29],用于水稻mRNA数据库的搜索,在RNAi设计区域未检测到潜在的脱靶。在GFP编码序列的上游和下游两端融合了271 bp区域的倒重复,并在玉米泛素基因(无论在哪里启动子(图;6)。获得了几个独立的T1转基因植株OsRH2信使rna和OsRH34均用qRT-PCR法测定。结果如图所示。6 b,两个OsRH2信使rna和OsRH34在三个独立的T1转基因株系RH2Ri 2b、RH2Ri 4和RH2Ri 14b中几乎检测不到mRNAOsRH2而且OsRH34被撞倒了。因此,我们选择了RH2Ri 2b、RH2Ri 4和RH2Ri 14b来研究OsRH2和OsRH34在水稻中的作用。
描述的OsRH2而且OsRH34双敲除转基因株系。一个双消声的原理图OsRH2而且OsRH34RNA干扰结构。在3 '末端有一个271 bp的片段OsRH2而且OsRH34保守区在正义和反义方向上连接到GFP cDNA上,并在下游融合无论在哪里启动子。b的表达OsRH2而且OsRH34在T1转基因水稻幼苗中。从14日龄幼苗中分离总RNA,采用qRT-PCR方法进行检测OsRH2- - -OsRH34特殊引物。大米Act1被用作内部控制。误差条表示重复三次实验的标准差(SD)。基因表达与野生型植物相关,1。*明显不同于野生型植物(学生的t测试:p< 0.05)。OsRH2而且OsRH34双敲除系被命名为RH2Ri 2b、4和14b。野生型线用WT表示
转基因水稻的株高降低了2倍OsRH2而且OsRH34
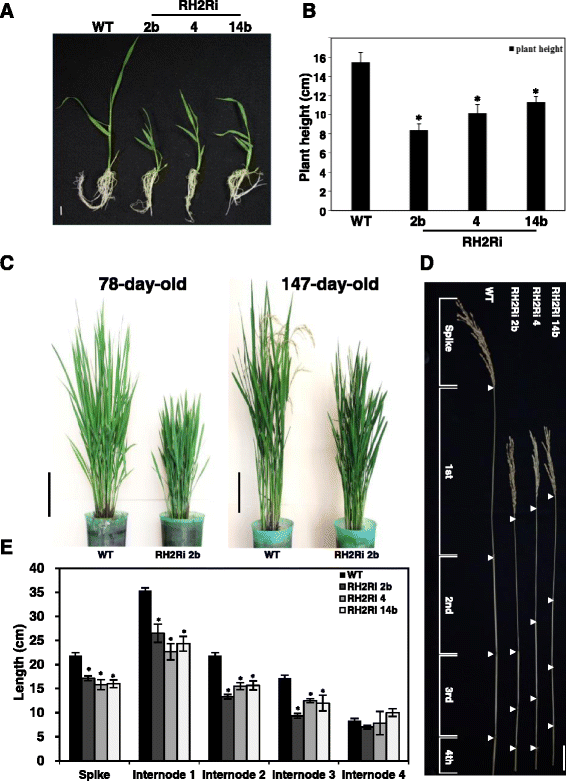
T1转基因株系植株高度有显著差异。RH2Ri 2b、RH2Ri 4和RH2Ri 14b表现为矮子表型;在2周龄时,它们的幼苗比野生型植物的幼苗矮27%至44%(图4)。7一个而且b).此外,转RH2Ri基因的植株在下一个生长阶段比野生型植株更矮。图中显示了一个例子。7 c,在78日龄和147日龄,RH2Ri 2b T1株高分别比野生型株矮20%和26%。进一步比较了野生型和转RH2Ri转基因植株在生殖期的株高。野生型植物的茎有5个节间,从上到下命名为I ~ V。与野生型植株相比,转RH2Ri基因的植株在每个节间区域的秆长也减少了(图2)。7 d而且e).在稻田中也观察到转RH2Ri基因植株的矮秆表型。在三个转基因T1-T3代的野生型植株和RH2Ri植株之间观察到显著的株高差异(表2)1).此外,与野生型植物相比,RH2Ri转基因植物的叶子是更深的绿色,它们有更多的分蘖(图2)。7 c).
表型的OsRH2而且OsRH34双敲除T1转基因水稻。一个WT和三个独立的OsRH2而且OsRH34双敲除系RH2Ri 2b、RH2Ri 4和RH2Ri 14b的幼苗在半MS琼脂培养基上生长10天,然后转移到水培培养基上培养7天。Bar = 1厘米。b苗期株高量化。测定17日龄苗株高。误差条表示每条线10个单株的SD。*明显不同于野生型植物(学生的t测试:p< 0.05)。cWT和RH2Ri 2b在78日龄和147日龄植株中株高的比较。Bars = 19 cm。d4月龄水稻WT、RH2Ri 2b、RH2Ri 4和RH2Ri 14b节间距离的比较条形= 5厘米。eRH2Ri 2b、RH2Ri 4、RH2Ri 14b和野生型植物节间距离的测定误差条显示±SD (n= 20), *与野生型植物有显著差异(Student’st测试:p< 0.05)
花粉和种子发育有严重缺陷OsRH2而且OsRH34
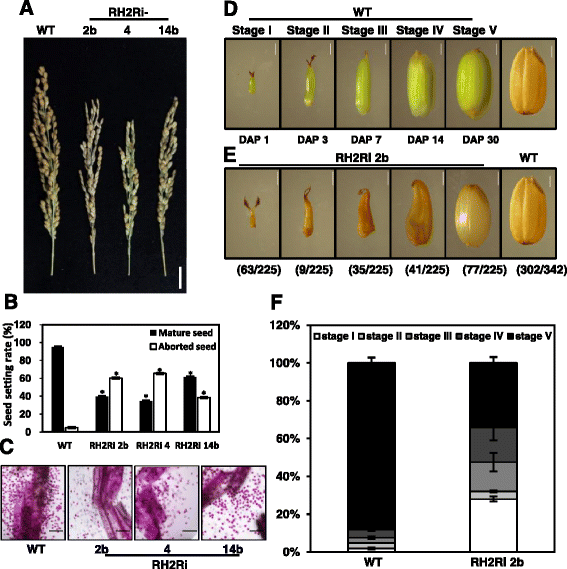
转RH2Ri基因的植物比野生型植物少了30 ~ 40%的种子。8而且b).这种种子数量的显著减少表明,双击倒OsRH2而且OsRH34可能导致受精或种子发育缺陷。花粉败育之前在OsMAGO1而且OsMAGO2双击倒植物和OsY14a推倒植物[24].为了研究OsRH2和OsRH34是否在雄配子体发育中起作用,采用Alexander染色法测定了转RH2Ri基因植株的花粉活力。在无花果。8 c结果表明,转RH2Ri基因植株的花粉败育率高于野生型植株OsRH2而且OsRH34影响雄配子体发育。
结实率和种子发育OsRH2而且OsRH34双敲除转基因水稻。一个而且b种子结实率较低OsRH2而且OsRH34double-knockdown植物。一个小穗表型三个独立OsRH2而且OsRH34双敲除系RH2Ri 2b、RH2Ri 4和RH2Ri 14b。条形= 5厘米。b中成熟种子和败育种子数量的测定OsRH2而且OsRH34double-knockdown线。误差条显示±SD (n= 20), *与野生型植物有显著差异(Student’st测试:p< 0.05)。c的OsRH2而且OsRH34双敲除系花粉发育存在缺陷。Bars = 200 μm。d- - - - - -f的OsRH2而且OsRH34双敲低系显示胚胎发育缺陷。d野生型水稻种子在不同发育阶段的壳显微照片。水稻种子分别在授粉后1、3、7、14和30天收获。eRH2Ri 2b系在30 DAP的内部种子期。f测定RH2Ri 2b转基因和野生型植物在不同阶段的种子数量
另一方面,授粉(DAP)后1、3、7、14和30天的种子发育水平分别被设定为I至V阶段(图2)。8 d).野生型植物的大部分种子在30 DAP时已发育到V期(图2)。8 d).然而,在转RH2Ri 2b基因的植株中,30dap时种子发育水平从I期到V期不等;大约三分之一的植物保持在阶段I,三分之一处于阶段II, III,或IV,三分之一形成成熟的种子(阶段V)(图。8 e而且f).这些表型表明OsRH2而且OsRH34基因在水稻种子的发育中起着至关重要的作用。
外源赤霉素酸(GA)部分挽救了RH2Ri转基因植株的表型,并对其进行了双敲除OsRH2而且OsRH34对GA生物合成和GA信号基因的影响
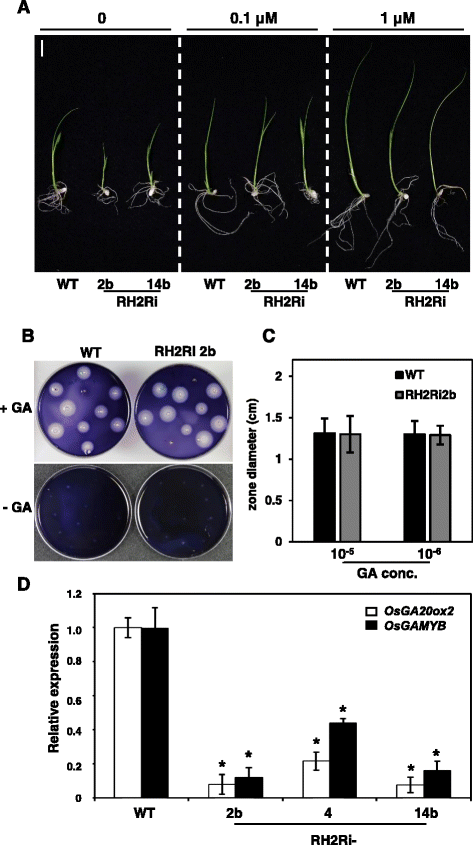
转OsRH2 RNAi的植株表型表现为矮化、节间长度缩短、叶片颜色深绿色、分蘖数增加、种子发育异常和种子发芽率降低,与GA生物合成或GA信号通路缺失的突变体相似。为了研究OsRH2和OsRH34是否参与GA生物合成或信号通路,用0.1 μM和1 μM GA3处理水稻幼苗。GA3处理部分恢复了10日龄RH2Ri幼苗矮秆表型的延长(图2)。9).为了进一步研究转基因RH2Ri植物的GA敏感性,采用淀粉板法测定糊粉层细胞α-淀粉酶活性。将无胚半种子分别放在加或不加1 μM GA3的淀粉板上2 d,然后用碘染色。在未处理GA3的RH2Ri 2b和野生型无胚半种子中未检测到α-淀粉酶活性(图2)。9 b).GA3处理的一半种子都有清除区,野生型和RH2Ri 2b转基因株系之间没有观察到清除区大小的差异(图2)。9 b而且c).这些结果表明,转RH2Ri基因的植株对外源提供的GA3有反应。
外源GA对植物生长的影响OsRH2而且OsRH34双敲除T1转基因水稻。一个3天大的水稻幼苗分别在含0、0.1和1 μM GA3的水中孵育7天。Bars = 1 cm。bα-淀粉酶活性的淀粉板测定。无胚半种子在10−6M GA3 2天。c用10−5和10−6赤霉素。误差条显示±SD (n= 40)。d的表达OsGA20ox2而且OsGAMYB在OsRH2而且OsRH34double-knockdown幼苗。从三叶期幼苗中分离总rna,进行qRT-PCR检测。大米Act1作为内部控制。误差条表示四个重复实验的SD,其中有两个生物重复。基因表达与野生型植物相关,1。*明显不同于野生型植物(学生的t测试:p< 0.05)
研究OsRH2和OsRH34在GA生物合成和GA信号通路中的作用OsGA20ox2一种编码GA生物合成的基因OsGAMYB是GA信号通路中的转录因子。从三叶期的RH2Ri转基因幼苗中分离总rna,并进行qRT-PCR分析。mRNA水平OsGA20ox2和OsGAMYB与野生型相比,各RH2Ri系的基因表达水平均显著降低(图2)。9 d).这说明OsRH2和OsRH34参与了GA生物合成和GA信号通路的调控。
双重击倒OsRH2而且OsRH34转基因植物表现出未剪接的积累OsUDT1信使核糖核酸
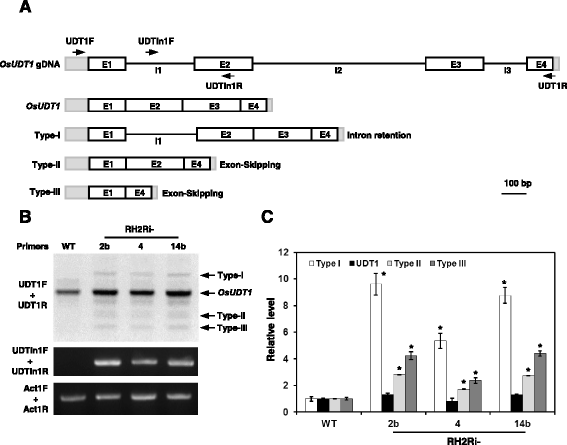
已经证明osmag1, OsMAGO2和OsY14b参与了的剪接OsUDT1信使rna (24].OsRH2和OsRH34都是EJC核心复合体的一个组成部分,这表明基因的双重敲除OsRH2而且OsRH34可能会影响OsUDT1信使rna成熟。从植物的花序中分离出总RNA,并使用特定的引物进行RT-PCR(图。10,附加文件1),以放大的片段OsUDT1信使rna。使用UDT1R和UDT1F引物扩增了I型、成熟型、II型和III型4个片段(图。10 b).I型、II型和III型的累积水平在三个独立的个体中较高OsRH2而且OsRH34与野生型相比,双击倒系(图2)。10 b而且c).使用UDTIn1F和UDTIn1R引物对特异性扩增I型片段(图。10 b),累积较多的未拼接型IOsUDT1在这三个独立的细胞中检测到mrnaOsRH2而且OsRH34与野生型相比,双敲除转基因株系(图。10 b而且c).这些结果表明,OsRH2和OsRH34在基因的准确剪接中起着关键作用OsUDT1pre-mRNA。
异常积累OsUDT1记录在OsRH2而且OsRH34double-knockdown植物。一个基因结构和异常转录结构的说明OsUDT1[24],以及RT-PCR分析所用引物的位置。灰色矩形,utr;白色矩形外显子(E);行,内含子(I)。b而且c的积累OsUDT1异常记录。从WT、RH2Ri 2b、RH2Ri 4和RH2Ri 14b植物营养期的花序中分离得到总rna。UnsplicedOsUDT1特异性引物RT-PCR检测pre- mrna(附加文件)1).Act1mrna被用作内部对照。c异常(I型、II型、III型)和成熟的相对水平OsUDT1mRNAs由相对于WT的归一化的图像J确定。误差条表示4个重复实验(2个生物重复)的SD。DNA片段水平与野生型植物相关,1。*明显不同于野生型植物(学生的t测试:p< 0.05)
讨论
在这项研究中,两个DEAD box RNA解旋酶基因,OsRH2而且OsRH34的特征。氨基酸序列分析表明,OsRH2和OsRH34具有99%的同源性和100%的相似性,表明这两种DEAD box RNA解旋酶在水稻中可能具有相似的生化特性。OsRH2和OsRH34都与eIF4AIII同源,后者是eIF4A家族的成员。eIF4AIII是EJC的核心成分,是真核生物转录后过程的基本因子之一[17,30.].除了eIF4AIII, EJC还包含另外三个亚基,MAGO, Y14和Btz [28].本研究得到的结果表明,OsRH2和OsRH34都与OsMAGO1和OsY14b发生物理相互作用。三个独立OsRH2而且OsRH34双敲除转基因株系所表现出的表型与转基因植株所表现出的表型相似OsY14a吉恩被撞倒了,或者两者都有OsMAGO1而且OsMAGO2已被击倒,即株高降低,花内膜和绒毡层异常[24].因此,OsRH2和OsRH34是水稻EJC的核心组分。
免疫荧光显微镜显示eIF4AIII定位于核质[28]海拉细胞;在瞬时表达的myc-eIF4AIII中观察到类似的eIF4AIII定位模式[28].而亚细胞分离分析发现细胞质中存在过多的eIF4AIII [28,31].这些研究表明,eIF4AIII定位于细胞核和细胞质。在OsRH2-GFP和GFP-OsRH2融合蛋白的亚细胞定位结果中,在细胞核和细胞质中检测到荧光。同样,在细胞核和细胞质中检测到OsRH34-GFP和mCherry-OsRH34荧光。这些结果表明,OsRH2和OsRH34蛋白都定位于细胞核和细胞质中,也表明它们可以在这两个位置之间穿梭。的确,拟南芥eIF4AIII在正常生长条件下主要定位于核浆中,但在缺氧胁迫下位于核仁中并形成剪接斑点[23].
EJC在水稻中的功能尚不清楚。然而,最近发现了EJC的核心亚基OsMAGO2、osmag1、OsY14a和OsY14b。已经确定存在不同类型的MAGO-Y14复合物,并提出了其特定功能的变化[25].击倒一个单打MAGO没有导致任何可见的表型,而双敲除MAGO水稻的基因导致了花不正常的矮化[24],表明OsMAGO1而且OsMAGO2是功能冗余的。的表型OsY14a打倒的水稻植株与之相匹配OsMAGO1而且OsMAGO2双击倒植物,同时击倒OsY14b导致植株诱导失败[24],提示OsY14b在胚胎发生中的功能特化。OsRH2和OsRH34的氨基酸序列高度保守,在不同水稻组织中的基因表达模式也相似。然而,丰的OsRH2mRNA的表达水平约为of的58倍OsRH34幼苗中的mRNA。这些结果表明,OsRH2和OsRH34可能是功能冗余的,OsRH2在水稻中起着主要作用。因为DNA序列OsRH2而且OsRH34由于过于相似,在水稻中无法使特定基因沉默,因此不能排除它们各自在水稻中是否具有特定功能的可能性。
我们介绍了OsRH2以信使RNA为基础的干扰RNA进入水稻,并将两者击倒OsRH2和OsRH34同一转基因系中的基因。的OsRH2而且OsRH34双敲低转基因株系表现为矮秆表型。节点的数量和节点间的距离OsRH2而且OsRH34双击倒系比野生型少。此外,叶子的OsRH2而且OsRH34双敲除转基因植物的绿色较深,并且比野生型植物有更多的分蘖。这些表型与赤霉素信号缺陷突变体的表型相似[32- - - - - -35]或赤霉素生物合成[36- - - - - -40].外源GA能部分挽救矮秆表型,诱导糊粉层α-淀粉酶活性OsRH2而且OsRH34双敲除转基因株系。的表达水平OsGA20ox2减少了OsRH2而且OsRH34这些结果表明,转基因株系的矮秆表型OsRH2而且OsRH34双敲低转基因株系可能是由于GA水平降低所致。然而,低水平的OsGAMYBmRNA的表达OsRH2而且OsRH34双敲除转基因株系。在之前的研究中,OsY14a击倒水稻和双击倒水稻MAGO基因也表现出矮小畸形花,低水平的OsGA20ox2和OsGAMYB信使rna (24].因此,EJC的功能与赤霉素在水稻中的作用密切相关。
野生型和野生型结实率存在差异OsRH2而且OsRH34双敲除转基因株系。成熟种子与总种子的比率OsRH2而且OsRH34双敲除转基因株系低于野生株系。花粉败育表型观察OsRH2而且OsRH34双击倒植物与先前鉴定的一致OsMAGO1而且OsMAGO2双击倒植物和OsY14a推倒植物[24].这些结果表明,低结实率可能是由于EJC缺陷导致的,从而影响了花粉的发育。然而,有必要研究EJC是否也参与了雌性配子体的发育。另外,还比较了野生型和野生型种子的发育情况OsRH2而且OsRH34双敲除转基因株系。授粉后,野生型90%的种子发育到成熟期。相比之下,在转基因品系中,三分之一的种子发育成熟,三分之一保持在中间阶段,三分之一没有超过非常早期的阶段。这些结果表明,双敲除OsRH2而且OsRH34种子发育受损。把这些发现结合在一起,双重打击OsRH2而且OsRH34基因可能导致花粉和种子发育缺陷。
在真核细胞中,无义介导的mRNA衰变(nonsense mediated mRNA decay, NMD)是一种监测机制,它消除含有无义突变或因异常剪接而获得过早终止密码子的mRNA [18].因此,它是消除异常基因表达的有效保障[18,41- - - - - -44].在真核生物中,EJC已被证明参与mRNA的转录后处理,包括mRNA剪接和NMD [45].在大米、OsMAGO1而且OsMAGO2双击倒植物和OsY14a敲沉植株表现出异常的剪接OsUDT1记录。多种类型的OsUDT1mRNA的表达OsMAGO1而且OsMAGO2双击倒植物和OsY14a推倒植物[24].在本研究中,双敲除OsRH2而且OsRH34基因也会导致异常OsUDT1前mrna剪接积累。由此可见,EJC中某一组分的敲低导致EJC功能缺陷,这与某些异常pre-mRNA的积累密切相关。然而,这种类型的内含子保留的pre-mRNA积累可能是由于EJC依赖的剪接缺陷或EJC依赖的nmd缺陷。未来的研究将鉴定与OsRH2或OsRH34相互作用的蛋白质,这可能为水稻EJC功能的特异性提供更多信息。
结论
EJC包含四个核心成分,真核起始因子4AIII (eIF4AIII)、MAGO/NASHI、Y14/Tsunagi/ rna结合蛋白8A和Barentsz/转移淋巴结51,在基因调控中发挥重要作用。编码EJC核心成分的基因已经在水稻中被发现,目前。the functional characterizations of MAGO and Y14 homologs have been demonstrated in economically important crop, rice. However, little is known about how important of eIF4AIII in rice. In this study, two rice eIF4AIII homologous genes,OsRH2而且OsRH34,被确认。OsRH2和OsRH34的氨基酸序列同源性99%,相似度100%。水稻eIF4AIII荧光融合蛋白均定位于细胞质和细胞核。此外,OsRH2和OsRH34可以与水稻MAGO和Y14相互作用,表明OsRH2和OsRH34是EJC的核心成分。OsRH2和OsRH34可能是功能冗余的,但大量表达的OsRH2可能在水稻中起主要作用。Double-knockdown的OsRH2而且OsRH34在株高、花粉和种子发育方面表现出严重缺陷。而且,双重击倒的OsRH2而且OsRH34基因导致的表达水平下降OsGA20ox2和OsGAMYB和异常积累OsUDT1pre-mRNA。这些可见的和分子表型所引起的OsRH2而且OsRH34双击倒都类似OsMAGO1而且OsMAGO2双击倒植物和OsY14a可拆卸的植物。总的来说,我们的研究结果表明,eIF4AIII蛋白OsRH2和OsRH34在水稻EJC功能中起着关键作用。
方法
植物材料和生长条件
水稻品种栽培稻本研究采用台湾农业研究所提供的L. cv Tainung 67 (TNG67)。转基因水稻在国立中兴大学(台湾台中)农业实验站栽培。为了种子萌发,将种子去壳,用3% NaOCl消毒30分钟,并用无菌水大量清洗。将灭菌后的种子放置在½Murashige Skoog (MS)琼脂培养基上,然后在28°C的生长室中恒光培养。将三叶期幼苗转入水培培养基(木村B溶液)培养2 d,然后进行各种处理。
引物
用于质粒构建、PCR、RT-PCR和qRT-PCR分析的所有引物的核苷酸序列都列在附加文件中1.
质粒
质粒pMDC43 [46]用于OsRH2-GFP嵌合蛋白的融合。质粒pSAT4-DEST-nEYFP-C1和pSAT5-DEST-cEYFP-C1被用作BiFC检测的网关载体拟南芥生物资源中心。pCAMBIA载体来源于CAMBIA。
质粒构建
的OsRH2而且OsRH34用特定引物扩增编码区域(附加文件1),采用Phusion High-Fidelity DNA Polymerase (NEB, Ipswich, MA, USA)以三叶期幼苗cDNA为模板。PCR产物克隆到yT&A克隆载体(ye, Taipei, Taiwan),分别生成pOsRH2和pOsRH34。为了研究OsRH2和OsRH34的亚细胞定位,我们从pOsRH2和pOsRH34中切除了它们的全长cDNA片段Asc我和不I,然后连接到pENTR-TOPO向量的相同位点,生成pOsRH2-ENTR和pOsRH34-ENTR向量。使用LR克隆酶(Invitrogen, Carlsbad, CA)进行重组转移OsRH2而且OsRH34将进入克隆的DNA片段导入目的载体pMDC43,分别生成GFP-OsRH2和GFP-OsRH34。的OsRH2而且OsRH34将DNA片段构建到pMDC85中,分别生成OsRH2-GFP和OsRH34-GFP质粒。为了构建OsRH34-mCherry表达向量,将pMDC43中的GFP替换为mCherry,生成mCherry目标向量pMDC43m。通过LR克隆酶获得mCherry-OsRH34的表达质粒。
在BiFC检测中,用特异性引物扩增OsRH2、OsMAGO1和OsY14b的全长编码区,然后亚克隆到pDonor221二元载体中丙氨酸L1和丙氨酸L2位点使用BP克隆酶(Invitrogen)。利用LR克隆酶将每个片段亚克隆到psat4 - est - neyfp - c1和psat5 - est - ceyfp - c1 (B)二进制载体上,生成OsRH2 -、OsMAGO1 -和OsY14b-YFP (n),以及OsRH2 -、OsMAGO1 -和OsY14b-YFP (c)融合基因。
用于建造OsRH2干扰RNA载体,一个271 bp的DNA片段,包含153 bp的编码区和117 bp的3”UTROsRH2使用特定引物进行扩增(附加文件1).该DNA片段被克隆到yT&A克隆载体中,生成pRH2Ri。绿色荧光蛋白(GFP) cDNA用正向引物和反向引物进行PCR扩增(附加文件)1),再亚克隆到yT&A克隆载体中,生成pGFPRI。的OsRH2用消化法从pRH2Ri中分离出RNAi DNA片段生态国际扶轮和BamHI,从pGFPRI中分离出GFP DNA片段生态RI,这两个碎片被结扎到BamHI位点的pAHC18表达载体,生成pAHC18- osrh2 - ri。这种RNA沉默结构通过消化线性化欣dIII和插入欣dIII位点的pCAMBIA1301二进制向量农杆菌属-介导基因转化。
RT-PCR和qRT-PCR分析
用Trizol试剂(Invitrogen)从整个幼苗和成熟植物的各种组织中分离总RNA,然后用RNase-free DNase I (NEB)处理去除基因组DNA污染。利用RTace逆转录酶(Toyobo, Osaka, Japan)和oligo-dT引物合成第一链cDNA。将得到的第一链cDNA稀释20倍,用基因特异性引物进行PCR(22-35个反应周期)1).qRT-PCR反应采用SuperScript III逆转录酶(Invitrogen)合成第一链cDNA。按照制造商的说明,使用FastStart Essential DNA Green Master (Roche, Basel, Switzerland)和iQ5 RT-PCR仪(Bio-Rad, Hercules, CA, USA)对稀释10倍的第一链cDNA进行qRT-PCR。PCR过程独立重复至少三次。相对基因表达水平表示为目标基因mRNA丰度与mRNA丰度的比值Act1信使rna。数据采用厂商提供的iQ5 2.1软件进行分析。用于qRT-PCR的基因特异性引物在附加文件中列出1.
植物转化
用9 μM - 2,4-二氯苯氧基N6固体培养基诱导水稻胚愈伤组织。根癌土壤杆菌菌株EHA105用于水稻转化,如前所述[47].在含25 mg/L潮霉素B的N6培养基上选择转化愈伤组织。
亚细胞定位分析和BiFC检测
制备洋葱鳞茎表皮,如前所述进行粒子轰击[48,49] PDS-1000生物设备(Bio-Rad)在1100 psi的压力下。为了引入质粒DNA,将被轰射的材料在MS培养基中培养24 h,然后用Olympus IX71倒置荧光显微镜(Olympus, Tokyo, Japan)和数码相机观察成像。使用Olympus UMWIBA3和Olympus U-MWIGA3滤波器分别获取GFP和mCherry图像,并通过DP Manager程序进行图像合并。
采用颗粒轰击法,在洋葱鳞茎表皮细胞中共表达YFPN-和yfpc -融合基因的不同表达载体组合,进行BiFC分析。使用Olympus IX71倒置荧光显微镜和Olympus UMWIBA3滤光片观察YFP信号。
GA处理
将灭菌后的种子放在1 / 2 MS琼脂培养基上,然后在28°C的生长室中恒光培养3天。将幼苗转入不同GA浓度的水培培养基(木村B溶液)中培养7天。
α-淀粉酶活性测定
无胚半种子(胚乳)用3% NaOCl消毒30分钟,用无菌水大量冲洗。每个盘子里有16颗一半的种子,它们被排列成一个小圆圈。30°C在黑暗中培养1-3天,然后用碘溶液染色。测量了无色区大小。
伦理批准并同意参与
不适用。
发表同意书
不适用。
数据和材料的可用性
支持本文结果的数据集包含在本文及其附加文件中。
缩写
- 行为:
-
肌动蛋白
- 阿里/参考:
-
Aly/REF输出因子
- BiFC:
-
双分子荧光互补
- 衣冠楚楚的:
-
授粉后几天
- eIF4A:
-
真核起始因子4A
- eIF4AIII:
-
真核起始因子4AIII
- EJC:
-
外显子结复合物
- 遗传算法:
-
赤霉酸
- GA20ox2:
-
赤霉素20氧化酶2
- GAMYB:
-
GAMYB转录因子
- 绿色荧光蛋白:
-
绿色荧光蛋白
- MAGO:
-
外显子结复合马哥纳什
- mCherry:
-
mCherry红色荧光蛋白
- 媒介女士:
-
Murashige Skoog medium
- NCBI:
-
国家生物技术信息中心
- NMD:
-
无意义介导的mRNA衰变
- 存在:
-
定量实时逆转录聚合酶链反应
- RH:
-
RNA解旋酶
- RNPS1:
-
rna结合蛋白S1
- 无论在哪里:
-
玉米泛素基因
- UDT1:
-
未发育的绒毡层
- Y14:
-
外显子连接复合物蛋白Y14
- YFP:
-
黄色荧光蛋白
参考文献
伯德AK,兰尼KD。超家族2解旋酶。前沿生物科学(Landmark Ed)。2012; 17:2070 - 88。
Cordin O, Banroques J, Tanner NK, Linder P. RNA解旋酶的死盒蛋白家族。基因。2006;367:17-37。
Fairman-Williams ME, Guenther UP, Jankowsky E. SF1和SF2解译:家庭事务。中国生物医学工程杂志,2010;20(3):313-24。
张晓明,李志强,李志强,等。拟南芥死亡盒RNA解旋酶家族的研究。中国生物医学工程学报,1999;27(2):628-36。
王志强,李志强,李志强,等。拟南芥死亡盒atp酶/RNA解旋酶蛋白的鉴定。中国生物医学工程学报,1998;26(11):2638-43。
Owttrim GW。RNA解旋酶:在非生物胁迫的原核反应中的不同作用。中国生物工程学报。2013;10(1):96-110。
Owttrim GW。RNA解旋酶和非生物胁迫。核酸研究,2006;34(11):3220-30。
Rocak S, Linder P.死盒蛋白:RNA代谢背后的驱动力。中国生物化学,2004;5(3):232-41。
杨晓明,王晓明,王晓明,等。水稻和拟南芥解旋酶基因家族全基因组分析:酵母和人的比较。中国生物医学工程学报,2010;43(4):449-65。
徐蓉,张松,黄娟,郑晨。玉米和甘氨酸RNA解旋酶基因家族全基因组硅晶分析的比较:拟南芥和水稻的比较。公共科学学报,2013;8(11):e78982。
金文敏,张志伟,张志伟,等。体外显子-外显子连接复合物中胡夫子-外显子衰变因子hUpf3的研究进展。科学。2001;293(5536):1832 - 6。
Le Hir H, Gatfield D, Braun IC, Forler D, Izaurralde E.蛋白Mago提供剪接和mRNA定位之间的链接。EMBO报告2001;2(12):1119-24。
Mohr SE, Dillon ST, Boswell RE。在果蝇卵发生过程中,rna结合蛋白Tsunagi与Mago Nashi相互作用,建立极性并定位oskar mRNA。基因工程学报。2001;15(21):2886-99。
Palacios IM, Gatfield D, St Johnston D, Izaurralde E.含有eif4aiii的复合物需要mRNA定位和无意义介导的mRNA衰变。大自然。2004;427(6976):753 - 7。
朴n - i,杨怡,慕尼黑DG。Mago Nashi参与拟南芥的分生组织、花粉形成和种子发育。中国植物科学,2009;26(4):461 - 461。
赵x - f, Nowak NJ,显示TB, Aplan PD。MAGOH与一种新型rna结合蛋白相互作用。基因组学。2000;63(1):145 - 8。
Tange TØ, Nott A, Moore MJ。外显子结复合物的复杂性不断增加。中国生物医学工程学报。2004;16(3):279-84。
张永福,伊玛目JS,威尔金森MF。无义介导衰变RNA监测途径。生物化学,2007;76:51-74。
Nott A, Le Hir H, Moore MJ。剪接增强了哺乳动物细胞中的翻译:外显子连接复合物的附加功能。基因开发,2004;18(2):210-22。
高希S, Marchand V, Gaspar I, Ephrussi a .通过剪接依赖结构控制RNP运动和定位的oskar mRNA。分子生物学杂志,2012;19(4):441-9。
王晓明,马西维兹,王晓明,等。oskar mRNA中SOLE元素的结构研究。RNA。2015; 21(8): 1444 - 53。
彭德尔,刘文杰,李文杰,等。拟南芥核仁的蛋白质组学分析提示了新的核仁功能。Mol Biol Cell, 2005;16(1): 260-9。
Koroleva OA, Calder G, Pendle AF, Kim SH, Lewandowska D, Simpson CG,等。拟南芥外显子连接复合物的核心蛋白eIF4A-III的动态行为:缺氧条件下快速向核仁迁移和剪接斑点。植物学报。2009;21(5):1592-606。
龚平,何超。揭示水稻外显子结复合物核心异源二聚体基因复制的差异,揭示其在生长发育和繁殖中的重要作用。中国生物医学工程学报,2014;29(3):344 - 344。
龚萍,权华,何超。用肽适体靶向MAGO蛋白增强其在水稻多种发育途径中的重要作用。植物学报,2014;30(5):369 - 369。
龚萍,赵敏,何超。MAGO和Y14蛋白家族需要缓慢的共同进化来维持其专性异二聚模式。科学通报。2014;9(1):e84842。
Ballut L, Marchadier B, Baguet A, Tomasetto C, Seraphin B, Le Hir H.外显子连接核心复合物通过抑制eIF4AIII atp酶活性锁定在RNA上。分子生物学杂志,2005;12(10):861-9。
Chan CC, Dostie J, Diem MD, Feng W, Mann M, Rappsilber J,等。eIF4A3是外显子结复合物的一种新型组分。RNA。2004; 10(2): 200 - 9。
徐萍,张玉军,康林,Roossinck MJ, Mysore KS。植物转录后基因突变中脱靶沉默的计算估计和实验验证。植物物理学报。2006;42:429 - 440。
郑浩,韩俊杰,李玉生,金耀文,黄毅,金俊杰,等。水稻未发育绒毡层1是早期绒毡层发育的主要调节因子。植物细胞学报,2005;17(10):2705-22。
Mufarrege EF, Gonzalez DH, Curi GC。拟南芥外显子连接复合物蛋白与基因在基因表达多个步骤中的功能互连。中国机械工程学报,2011;26(3):344 - 344。
Holzmann K, Gerner C, Pöltl A, Schäfer R, Obrist P, Ensinger C,等。一种人类常见的核基质蛋白,与真核翻译起始因子4A同源。生物化学学报,2000;26(1):339-44。
Ikeda A, Ueguchi-Tanaka M, Sonoda Y, Kitano H, Koshioka M, Futsuhara Y等人,细长水稻是一种组成型赤赤菌反应突变体,是由高度调节基因GAI/RGA/RHT/D8的同源基因SLR1的零突变引起的。植物学报。2001;13(5):999-1010。
Kaneko M, Itoh H, Inukai Y, Sakamoto T, Ueguchi-Tanaka M, Ashikari M等。赤霉素生物合成和赤霉素信号在水稻植株中发生在哪里?植物学报,2003;35(1):104-15。
上口-田中M,藤泽Y,小林M,足kari M,岩崎Y,北野H,等。水稻矮化突变体d1在异三聚体G蛋白α亚基上存在缺陷,影响赤霉素信号转导。中国科学(d辑),2000;29(4):344 - 344。
春田,阿雅,浅野K,山本E,森中Y,渡边M,等。赤霉素调控水稻花粉活力和花粉管生长。植物学报。2007;19(12):3876-88。
乔峰,赵凯杰。OsGA20ox2基因RNAi靶向对水稻株高的影响植物分子生物学杂志,2011;29(4):952-60。
Sakai M, Sakamoto T, Saito T, Matsuoka M, Tanaka H, Kobayashi M.新型水稻赤霉素2-氧化酶基因的表达受到生物活性赤霉素的稳态调控。中国植物学报,2003;26(2):344 - 344。
Sakamoto T, Kobayashi M, Itoh H, Tagiri A, Kayano T, Tanaka H,等。水稻茎尖附近一个赤霉素2-氧化酶基因的表达与水稻的相变有关。植物科学进展。2001;25(3):1508-16。
坂本T,三浦K,伊藤H,达隅T,上口-田中M,石山K,等。水稻赤霉素代谢酶基因及其相关突变体的研究进展。植物科学进展。2004;34(4):344 - 344。
罗顺丰,杨淑云,陈凯峰,邢毅,泽瓦特·贾,陈丽娟,等。一类新型赤霉素2-氧化酶控制水稻半矮秆、分蘖和根系发育。植物学报。2008;20(10):2603-18。
庄天伟,张伟林,李锦敏,谭伟勇。rna结合蛋白Y14抑制mRNA脱冠并调节身体形成过程。分子生物学杂志,2013;24(1):1 - 13。
Kalyna M, Simpson CG, Syed NH, Lewandowska D, Marquez Y, Kusenda B,等。选择性剪接和无意义介导的衰变调节拟南芥重要调控基因的表达。中国生物医学工程学报,2012;40(6):2454-69。
鹿岛I,山下A,泉N,片冈N,森下R,星野S,等。新型SMG-1-Upf1-eRF1-eRF3复合物(SURF)与外显子连接复合物的结合触发了Upf1磷酸化和无意义介导的mRNA衰变。基因开发。2006;20(3):355-67。
Nyikó T, Kerényi F, Szabadkai L, Benkovics AH, Major P, Sonkoly B,等。植物无义介导的mRNA衰变受不同的自调节回路控制,可由ejc样复合体诱导。中国生物医学工程学报,2013;41(13):6715-28。
Isken O, Maquat LE。真核生物mRNA的质量控制:保护细胞免受异常mRNA功能的影响。基因工程学报。2007;21(15):1833-3856。
植物基因高通量功能分析的网关克隆载体集。植物科学进展。2003;33(2):462 - 466。
黄昌强,于思明,吕建新。水稻死盒蛋白OsRH36可以补充拟南芥atrh36突变体,但不能替代酵母同源蛋白Dbp8p。植物分子生物学杂志,2010;42(1):344 - 344。
李志强,李志强,李志强。植物细胞生物学模型系统:活洋葱表皮细胞中的绿色荧光蛋白成像。生物学技术,1999,26(6):1125。8-32。
确认
本研究由中华民国台湾科技部的“103-231-B-008-001-”和“104-2321-B-008-001-”资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
CKH和CAL参与了研究的设计。CKH、YSS和YFC进行了生物信息学分析、基因克隆、实时RT-PCR、亚细胞定位和BiFC。CKH、YSS、CAL进行数据分析,并撰写稿件。YSS、YFC、TSH协助采集组织进行基因表达分析。所有作者都阅读并批准了最终的手稿。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
黄,CK。, Sie, YS。,Chen, YF.et al。OsRH2和OsRH34是两个高度相似的DEAD box蛋白,与真核起始因子4AIII同源,在水稻生长发育调控中发挥外显子连接复合物的作用。BMC植物生物学16日,84(2016)。https://doi.org/10.1186/s12870-016-0769-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-016-0769-5
关键字
- 死盒RNA解旋酶
- 真核起始因子4AIII (eIF4AIII)
- 外显子结复合物(EJC)
- 大米(栽培稻)