摘要
背景
随着人们对利用基因操纵和基因编辑技术来提高植物生长、营养价值和环境适应性的植物代谢工程的兴趣日益增加,一个主要的问题是操纵目标基因或在所得到的植物中的代谢步骤可能产生不良的广泛和遥远的影响。对该产品进行全面的转录组学和代谢组学分析可能会在这方面提供一些有用的信息。由于多胺在植物生长、发育和逆境反应中起着众所周知的作用,本研究利用这两种技术与植物细胞培养分析了基因操作在多胺生物合成中的单一步骤的影响。
结果
杨树对照细胞系和高产腐胺细胞系的转录组和代谢组研究杨树黑质xmaximowiczii),采用微阵列和GC/MS进行比较。HP细胞表达an鸟氨酸脱羧酶转基因和积累的腐胺浓度提高了几倍,而亚精胺和精胺只有很小的变化。结果表明,上调多胺生物合成途径中的一个步骤(即鸟氨酸→腐胺)可改变多种基因的表达;其中许多参与转录、翻译、膜转运、渗透调节、休克/应激/损伤和细胞壁代谢。无论取样日期如何,在HP细胞中检测到的200种代谢物中,超过一半的代谢物显著改变(p≤0.05)。最显著的差异是有机酸、碳水化合物和含氮代谢物。
结论
该结果为研究多胺在杨树高产腐胺转基因细胞培养过程中调控氮碳利用途径的作用提供了有价值的信息vs。它们的低腐对应物。这些结果强调了细胞对与植物氮代谢有关的单一代谢步骤的遗传扰动的反应的复杂性。结合我们实验室最近的研究,我们发现更高的腐胺产量导致谷氨酸进入鸟氨酸的通量增加,同时通过额外的氮和碳同化提高谷氨酸的产量,本研究的结果为设计具有更高氮利用效率的转基因植物提供了指导,特别是在用于非食品/饲料应用的植物中(例如,用于生物燃料的生物质产量增加)。
背景
植物生物技术的努力通常需要有意地改变生物体的基因,并潜在地改变其代谢,以改善营养,更好地生长,和/或耐受非生物和生物胁迫。在大多数情况下,目的是针对特定的代谢步骤,对不相关的途径影响最小,从而产生被认为与原始植物相似的植物。虽然这对于涉及其产物不具有核心酶功能的基因(例如细菌)的转基因操作可能是可行的哭基因或病毒外壳蛋白基因),并在一定程度上针对二次植物产物,如花色修饰;核心代谢通常更难以操纵,因为:a)它是自我平衡调节的,b)它是高度网状的,与多种其他途径交织在一起。因此,核心代谢的变化具有深远的影响,可能涉及多种途径[1]及其中的参考文献,[2- - - - - -4]及其中的参考资料。
旨在了解植物代谢调节的研究的两个关键方面是:i)通过使用抑制剂、突变体或基因工程和基因组编辑来操纵代谢的能力,以及ii)测量这种变化的影响(即表型)的能力。在微阵列、高通量测序和代谢组分析工具出现之前,可以在任何时间研究的基因和代谢物的数量相当有限。因此,必须作出决定先天的哪些基因和代谢物是值得研究的。高通量技术通过实现全球基因表达谱,并同时分析操纵代谢途径的多效性,消除了这种偏见[5- - - - - -12]。此外,新软件平台的可用性使我们能够将这些不同工具的结果分层,以开发两种结果之间的联系(即转录组学和代谢组学)。这些技术可以揭示的影响,不仅远端操作的步骤,但也可能是意想不到的。一方面可能被认为是“钓鱼考察”,但更准确地说,这可能被视为一项完全全面的系统研究[13]。因此,在不久的将来,对新的转基因生物进行转录组学和代谢组学分析可能会成为一种标准做法,然后再将其投放到领域/市场,以确定基因表达和代谢变化的无意后果。虽然这些技术本身有局限性(例如,它们不能测量酶活性或代谢物通量的变化),但它们在检测分支通路中可能发生的变化方面仍然是有价值的,因为在任何代谢分支中发生的变化都可能伴随着相关通路中基因表达的变化。代谢谱分析是一种很有前途的途径,可以补充转录组学在全球/系统代谢分析中的应用。2,4,9,14,15]。
多胺(不是;腐胺(Put)、亚精胺(Spd)和精胺(Spm)是低分子量的富含碳(C)和氮(N)的化合物,普遍存在于活细胞中。虽然它们在植物中的许多特定细胞功能尚未被描述,但它们与各种生理反应和分子相互作用有关。研究了PAs在植物生长发育、非生物胁迫响应和钙胁迫中的作用2+缺氮、固氮及其与细胞大分子的相互作用已被频繁讨论[16- - - - - -23]。随着编码PA生物合成酶的关键基因序列的出现,通过基因工程对该途径进行代谢扰动(特别是特定步骤的上调)已成为一种常规策略[24- - - - - -31]。由于PA代谢是高度相互依赖的通路网络的一部分,是N代谢和能量转化的核心(附加文件)1:图S1),假设改变PA代谢将影响细胞中的许多这些途径和其他途径[32- - - - - -36]。
我们利用杨树(黑杨树,克隆NM6);一种表达小鼠Orn脱羧酶- mODCcDNA和产生高放(称为HP),另一个是控制(称为GUS),表达细菌β葡萄糖醛酸酶(格斯)基因。这两个基因都受组成型(2x35S CaMV -花椰菜花叶病毒)启动子的控制。这两种细胞系是同时产生的[25,31]并在相同的(物理和化学)生长条件下体外生长。通过使用等基因细胞系,我们最大限度地减少对照和实验(HP)细胞系之间的背景差异。此外,细胞培养的使用简化了与使用整个植物相关的并发症,例如异质组织类型和不同器官之间代谢物的易位。根据较早前公布的资料[25,34- - - - - -41],在本研究中,我们研究了PA代谢途径中单个步骤的实验操作(即从鸟氨酸- Orn生物合成Put)对这些细胞的转录组和代谢组的更广泛影响。
多年来,两种转基因杨树细胞系(HP和对照)的特点是各种代谢变化,HP细胞与对照细胞相比,Put浓度持续较高(3至10倍);非转基因细胞的含糖量与对照细胞相当。HP细胞也显示Put分解代谢增加,但Put的半衰期没有变化[25,31]。此外,在HP细胞中,天然ADC(精氨酸脱羧酶)活性不受影响[25]。在HP和对照细胞中,ACC(1-氨基环丙烷-1-羧酸酯)和乙烯的产量相当,这表明PA和乙烯的生物合成途径之间没有竞争。37]。虽然HP细胞中Spd有少量增加,但Spd的分解代谢率(半衰期)和Spm的分解代谢率(半衰期)均未受到影响[31,42]。生理上,质膜通透性增强,可溶性蛋白含量增加,对KNO的耐受性增强3.,对NH更敏感4没有3.HP细胞与对照细胞[38]。HP细胞中PA分解代谢的增加明显导致H的积累2O2伴随着氧化应激相关酶(如谷胱甘肽还原酶和单脱氢抗坏血酸还原酶)的上调,从而得出毫摩尔量的Put对HP细胞的氧化状态有负面影响的结论[34,39,40]。某些阴离子转运蛋白受到影响,在对Al处理的反应中,HP细胞比对照细胞表现出明显的优势,这可以通过其摄取减少和挤压增加来解释[40]。此外,在HP细胞中发现GABA、Ala、Thr、Val和Ile的细胞含量增加,而其他几种氨基酸(如Glu、Gln、His、Arg、Ser、Gly、Phe、Trp、Asp、Lys、Leu、Cys和Met,以及已经很低的Orn)的含量下降,C和N的同化也随之上调[34]。mODC增加对Orn的利用并没有改变Glu-Orn-Arg通路基因的表达。据推测,控制这一途径的显然是生化调控而非基因调控[35,43]。
在本研究中,我们利用杨树微阵列从三个方面分析了转录组学数据:(1)参与PA代谢的基因的表达变化,从N同化到Glu及其以外;(2)功能聚类,以检查对特定区域代谢和细胞功能的影响;(3)分层聚类,以发现可能共同调节PA代谢增强的基因群。同样,这两种细胞系在与PAs和氨基酸密切相关和远相关的途径中,以及构成核心能量代谢的途径(包括糖、有机酸和主要N化合物)的代谢物群进行了比较。结果显示转录组学和代谢组学的变化是广泛的,并且超出了与PA代谢相关的途径,证实了我们之前关于高产量对氨基酸代谢和其他生理功能的多效性影响的结论[34- - - - - -36,40]。
方法
细胞生长和收获
野生型悬浮培养黑杨树(克隆NM6)来自加拿大自然资源部,加拿大林业局,Stn。圣福伊,魁北克,加拿大。HP的生产和维护以及这里使用的对照细胞系已经在前面描述过[25,31]。前者表达了一个mODC而后者(作为对照)表达细菌格斯基因;这两种细胞系也表达新霉素磷酸转移酶(《不扩散核武器条约》II)选择性标记基因。所有转基因都在一个修饰的35S CaMV启动子的控制下组成性表达。这种策略使我们能够以相同的方式处理两种细胞系,以便在其培养过程中维持种群;例如,在卡那霉素存在下生长。液体培养维持每周传代常规,并收集用于PA和其他分析,如所述[25,31,35,36]。从长期来看,还维持了两种细胞系的固体培养(愈伤组织)(每月进行一次继代培养),如果液体培养丢失(例如由于污染),则用于重新启动液体培养。所有的文化都生长在Murashige和Skoog [44含有3%蔗糖和0.5毫克的培养基(固体或液体)。l−12,4-d(2,4-二氯苯氧乙酸)在12 h光照循环下(80-100 μE.m)−2.sec−1), 25±1℃,液体培养的细胞在Miracloth上真空过滤,用去离子水快速洗涤,称重。有关用于各种分析的单元存储和处理的更多详细信息,请参阅附加文件2:补充材料。
微阵列分析实验设计
对两种细胞系的转录组进行了以下比较:(i) HP与对照(GUS)细胞在7天培养周期的第3天和第5天,以及(ii)每个细胞系的第3天和第5天的培养周期。微阵列内部和微阵列之间的一致性通过进行一些质量控制比较得到证实;显著的表达变化分布均匀,无偏倚或大组异常值。采用如下所述的多种不同方法检查数据,所有这些方法都是从排除变异系数(CV)或染料交换试验失败的数据开始的。
按照Page和Minocha的描述提取总RNA [45]。在去除DNA(无DNA)之后TMkit - Ambion Inc., Austin, TX), NanoDrop (thermofisher, Wilmington, DE)定量,使用Superscript逆转录mRNATM间接cDNA标记系统(Invitrogen, Carlsbad, CA)。用Cy3和Cy5标记cDNA、微阵列杂交和载玻片清洗的程序在附加文件中描述2:补充材料。
使用VersArray ChipReader™扫描仪(BioRad, Hercules, CA)扫描载玻片,分辨率为5 μm,激光设置为50%至100%,以优化动态范围并均衡每个通道的信号。46,47]。所有载玻片的检测器设置为850。使用VersArray Analyzer 5.0 (BioRad)对Cy3和Cy5图像进行比对,对斑点进行鉴定和定量。使用GeneGazer软件(Bio-Rad)将局部背景减去,遗漏标记点,并将数据转换为log base 2尺度后,对阵列数据进行统计分析。该过程包括使用平滑参数0.2的LOWESS归一化[32,46]。结合重复实验(平均比率的平均值)筛选荧光强度值,并选择质量CV值<0.25的点。在每个比较中具有统计学显著差异表达的斑点使用t错误发现率p值≤0.05的检验。
广泛接受的MIAME微阵列分析和验证指南[48) (http://archive.fged.org/mged/Workgroups/MIAME/miame_2.0.html),以及其他资料来源对实验设计的建议[46- - - - - -49]。对于每个双通道阵列,一个通道来自对照细胞的cDNA,并直接与来自HP细胞的cDNA进行比较。为了更准确地检测差异表达基因,使用三个生物重复,分别从每个细胞系中独立制备总RNA/cDNA,在7天培养周期的第3天或第5天收集。此外,每个时间点对每个生物复制进行染料交换互惠双色实验[46,47,50]。因此,每个cDNA使用六个数据点(三个生物重复,每个重复两个技术重复)来确保可靠的统计分析结果。
微阵列载玻片(PICME杨树Pop_28K_3_1_4阵列)http://www.picme.at),在预杂交前用解剖显微镜检查斑点的均匀性,在缓慢的旋转激振器上进行30分钟,用足够的预杂交溶液(5X SSC, 0.1% SDS和1% BSA)覆盖它们。载玻片在ddH中冲洗20倍2O在50ml锥形管中,以避免损伤斑点。然后将载玻片置于95°C ddH中2O浸泡1分钟,在100%冷冻乙醇中洗涤15秒,离心(4℃,2500转/分,2分钟)干燥,并在4℃保存。杂交总是在预杂交后1小时内进行。原始资料载于:http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE79420.
使用R-project程序生成热图(http://www.r-project.org/)与微阵列数据。通过EMBL快速检索与植物相关的基因本体术语的基因名称,获得与分子功能/生物过程相关的特定基因本体编号(http://www.ebi.ac.uk/QuickGO/)。est(表达序列标签)根据其所代表基因的相关功能进行分类和分组。
代谢组学分析
在7 d培养周期的第2、4和6天研究代谢组差异;在7天的培养周期中,选择这些天与转录组分析交替进行。同样,在不同的日子对每个细胞系进行比较,并在同一天进行对照和HP细胞之间的比较。在代谢组学分析中,每个处理的三个独立生物重复的所有色谱峰的光谱与真实标准的电子冲击质谱进行了比较;然后将峰归一化为内标和每个样品的新鲜重量。
在GC/MS分析之前,将干燥后的80%甲醇提取物用80 μl盐酸甲氧胺(20 mg.mL)进行衍生化处理−1然后加入80 μl n -甲基- n -(三甲基硅基)三氟乙酰胺(Pierce Biotech)。(Rockford, IL)在65℃下放置60分钟进行分析。气相色谱采用HP-5MS (30 m × 0.25 mm id, 0.25 μm膜厚)毛细管柱,Agilent 6890 N气相色谱仪耦合5973 MSD (Palo Alto, CA)。进口和质谱界面温度保持在250℃,离子源温度调节到230℃,以He为载气,以1.3 mL min的恒定流速,以5:1的分割比注入2微升衍生化提取物−1.温度程序是在70℃下进行最初的5分钟等温加热,然后将烤箱温度升高5℃min−1温度程序为90℃等温加热5分钟,随后烘箱温度升高5℃min−1在m/z 50-800扫描范围内,以69.9 eV电离能的正电子冲击模式(EI)工作。使用HP Chemstation (Agilent, Palo Alto, CA)和AMDIS (NIST, Gaithersburg, MD)程序对所有色谱峰的光谱进行评估。所有色谱峰的光谱与电子冲击质谱库NIST08和WILEY08 (Palisade Corporation, NY)以及两个定制库进行比较。为了便于样品之间的比较,所有数据均归一化为内标(10 mg.mL的hentriacontanic酸)−1- Sigma, St. Louis, MO)在每个色谱图中,以及每个样品的新鲜重量。通过在提取后的细胞样品中加入作为几种化合物类别代表的真实标准,然后与相同浓度的纯标准混合物进行比较,来评估代谢物的回收率。
代谢物和转录组分析
每个样本包含3个独立生物重复的数据集采用方差分析和t-使用纳入MS Excel (Microsoft Corp., Seattle, WA)的算法进行测试。差异有统计学意义,p≤0.05。多重测试-用XLStat 2007程序(Addinsoft, New York, NY)完成5%风险的Tukey测试(HSD)。为了评估样本之间的代谢变化或差异,并识别涉及群体歧视的代谢物,对对数变换(避免最高强度峰占主导地位,使值更接近高斯分布)进行主成分分析(PCA),使用SIMCA-P+(12.0.0.0)程序(www.umetrics.com/simca)。其他资料可于以下网址查阅:https://mynotebook.labarchives.com/share/ulav72/MjIuMXwxNzEzMTkvMTcvVHJlZU5vZGUvMzg1Mzg2MTkxNHw1Ni4x.
结果
细胞系及实验设计
这里用于比较的两种细胞系已经在前面描述过[25,35,36];其重要的生理生化特性已在引言部分作了概述。在实验期间,HP系积累的Put量比对照系高4 - 5倍。HP细胞中Put的增加对Spd的细胞含量影响不大,对Spm含量影响不显著。本研究的实验设计包括比较对照和HP细胞在7天培养周期中不同天数的转录组和代谢组。同时检测了各细胞系中基因表达和细胞代谢物随培养时间的变化。
高腐胺的产生/积累与转录组的主要变化有关
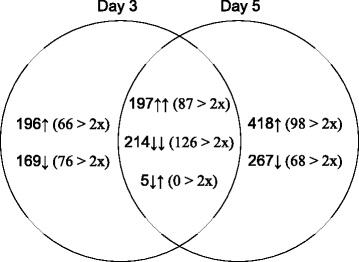
通过各种测试的ESTs和在两种细胞系中第3天和第5天差异表达的ESTs的结果摘要如图所示。1和附加文件1:图S2。在第3天和第5天通过质量控制测试的10470和16101个ESTs中,约有7 - 8%在分析的任何一天显示两种细胞系之间的显著差异。当进一步检查这些est时,发现416个中有214个在这两天的差异都大于两倍;在HP细胞中表达上调的ESTs(197个,87 > 2倍)和表达下调的ESTs(214个,126 > 2倍)平均分布。仅在第3天表达不同的365个ESTs中,有66个表达上调,76个表达下调,均超过2倍;对其他人来说,差异是显著的,但小于2倍。两种细胞系仅在第5天对应的ESTs数目差异大于2倍,分别为98个(上调)和68个(下调),而存在显著差异的基因总数分别为418个(上调)和267个(下调)。至少有5个ESTs在HP细胞中的表达在第3天显著降低,在第5天显著升高,但均不超过2倍。
参与多胺代谢的基因
从氮(N)同化的第一步到三种PAs的实际产生,所有27个基因可能参与PA代谢的基因模型(附加文件)1:图S1,附加文件3.:表S1)杨树基因组。PICME爆炸分析(www.picme.at)的基因模型(http://genome.jgi-psf.org/Poptr1/Poptr1.home.html)表明PA及其相关氨基酸(Arg和Pro)通路中的10个基因,即AS、CARB, DAO, NAGK, NAGPR, NAOD, NAOGAcT, ODC, OTC,以及法拉第笼,实际上并未在本研究中使用的微阵列芯片上表示(附加文件3.:表S1;有关缩写,请参见附加文件1:图S1)。其余17个基因共有106条ESTs,包括47个基因模型。它们的分布并不均匀;例如,一个点代表两个基因(艾尔和卡拉),其他公司则有更大的冗余。后一组中最引人注目的是Gln合成酶(GS), 28个点代表7个基因模型SAMDC15个点代表4种基因模型。虽然在这些基因的表达中发现了一些微小的变化,但在给定的一天内,两个细胞系之间或同一细胞系在不同的日子里,没有一个变化超过两倍。
高腐胺影响基因的功能聚类
对仅在第3天、仅在第5天、两天内HP与对照细胞表达差异大于2倍的ESTs进行功能聚类分析。由于大部分杨树基因组序列尚未进行功能注释,目前很难对阵列上的许多ESTs进行特定的功能标记。然而,我们使用了基因本体术语(http://go.princeton.edu)来定义与代表每个基因的est相关的功能。它们被分为以下一般功能类别:酶功能、转录/翻译(包括核糖体基因)、膜转运和渗透调节、应激/伤口诱导、细胞壁、未知/未命名(未注释)和其他(附加文件)3.:表S2-S4)。
与酶功能簇相关的10个ESTs(7个基因)在两种细胞系之间在两天内发生变化(附加文件)3.(表S2),远远小于任何一天的变化。除谷胱甘肽s转移酶和乙酰转移酶两种外,HP细胞在第3天和第5天均较对照细胞下调。在第3天,大部分与光合作用、糖酵解和蛋氨酸生物合成相关的基因被下调(附加文件)3.表S3)。与泛素周期相关的基因(5个ESTs)在第3天下调,与多糖分解代谢相关的1个EST上调。相反,在第5天,一个与泛素周期对应的EST上调(附加文件)3.:表S4)。总的来说,与第3天相比,第5天有更多的est(11个)上调。
包括组蛋白2A在内的5个核糖体/转录/翻译相关蛋白编码基因中的3个在第3天和第5天均上调。其中7个基因在第3天上调,11个基因在第5天下调(附加文件)3.:表S3和表S4)。相比之下,对于膜相关基因,仅在第5天就有几个上调。质膜固有蛋白(8ests)在这两天被发现上调了近10倍。膜联蛋白(Anx1)、水通道蛋白TIP3和渗透蛋白在这两天都被下调,而另一个(未知的)水通道蛋白的表达在第5天更高。应激/创伤反应相关蛋白组11个基因中有7个基因的转录本在HP细胞中较高。编码几丁质酶和金属硫蛋白的ESTs丰度较高,而编码ESTs的过氧化物酶和致病相关蛋白则下调。微阵列检测到的6个细胞壁相关蛋白基因(28个ESTs)在HP细胞中均下调;其中最引人注目的是延伸蛋白家族的25个ESTs。
35个基因模型(以45个ESTs为代表)编码具有已知酶功能的蛋白(不包括PA通路中的蛋白),其表达模式在两种细胞系第3天或第5天显著不同,其中大多数(24个基因模型- 31个ESTs)在HP细胞中下调(另见文件)3.表3、表4)。该组中有几个基因参与碳水化合物和酚类代谢,这可能是在HP细胞中观察到的代谢组学变化的原因(见下文)。另一方面,在分析的任何一天,HP细胞中与应激/伤口反应相关的大量基因被上调。比较同一细胞系不同天的差异,HP细胞在第3天(17天)比第5天(24天)上调的基因更少。一般来说,编码防御相关几丁质酶、热休克蛋白、冷应激蛋白和金属硫蛋白的ESTs在HP细胞中上调;与过氧化、细胞壁维持、脱水应激和碳水化合物代谢相关的基因均下调。
分层聚类
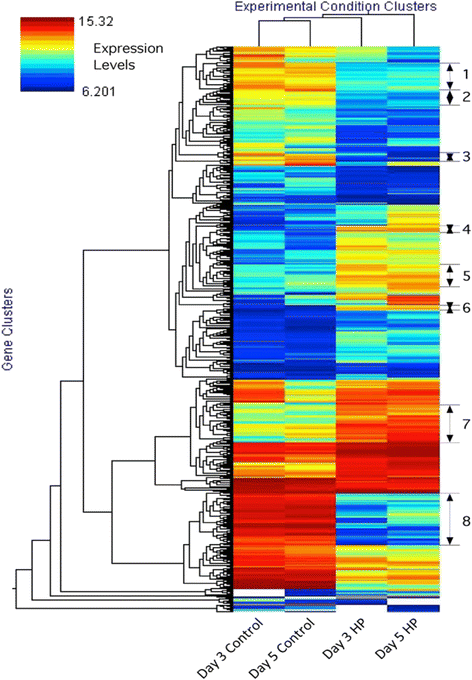
图中显示了对照组和HP细胞之间差异显著(p≤0.05)的基因的层次聚类。2.正如预期的那样,第3天和第5天的对照细胞的基因表达谱彼此相似,HP细胞的第3天和第5天的基因表达谱也是如此。可以清楚地看到,一些集群是向上或向下调节的,以响应Put操作。我们使用自组织图谱确定了8个基因簇,其中4个(4、5、6和7组)的表达显著上调,而在HP细胞中,4个(1、2、3和8组)的表达在第3天和第5天与对照细胞相比均下调。这些基因簇包含具有相似表达模式的基因,但不一定属于密切相关的途径。这些簇中最明显的是HP细胞中extensin和PVR3型基因的强下调(第8组)。总体而言,HP细胞在分析的两天内的表达谱比对照细胞更相似。
与高腐胺产生/积累相关的代谢组学变化超出了多胺和氨基酸
GC/MS分析代谢产物在对照细胞株中检测到645种化合物,在HP细胞株中检测到680种化合物。其中,在对照组和HP细胞中分别鉴定出190和178种化合物(附加文件)3.表S5);阳性鉴定的化合物总数大于200个。在7天的培养期间,52%的这些代谢物在不同的日子显著改变(p≤0.05),在对照组和37%的HP细胞系中(附加文件)3.:表S5 -粗体)。在整个培养期间比较两种细胞系发现,HP细胞中有> 30%的鉴定代谢物比对照细胞的浓度更高;HP细胞中只有13%的化合物浓度低于对照细胞。
将鉴定出的化合物(~200)在培养第2、4、6天在对照和HP细胞系中相对浓度进行比较,发现约60%的化合物在HP细胞中显著改变(P≤0.05)。然而,与同一细胞系内不同分析天数的细胞相比,细胞系之间的差异更为显著(图2)。3.和附加文件1:图S3A)。培养第2天,HP细胞中鉴定的总代谢物中有27%高于对照细胞,而HP细胞中有36%低于对照细胞(P≤0.05)。在所有三天的分析中,大约有70种代谢物差异超过两倍,主要是氨基酸、有机酸和少量碳水化合物;大约一半是向上调控的,一半是向下调控的。一些上调的氨基酸属于pa相关途径的下游(例如GABA和Ala),而那些下调的氨基酸来自该途径的底物一侧;如Glu, Gln, Acetyl-Glu,(表11)。在糖中,一些己糖和己糖-磷酸在HP细胞中被上调;还有几种胺(包括普特、Cad、乙醇胺)和许多有机酸。一些氨基酸,大部分TCA循环中间体和双糖(及其磷酸盐)被下调3.:表S1和表S5)。在4 d的旧培养中,相应的变化包括26%的代谢物增加和33%的代谢物减少(根据附加文件中的数据计算)3.(表S5),而在第6天,这些数字分别为26%(增加)和30%(减少)。4日龄和6日龄细胞的代谢物种类变化趋势相同(表2)1)。
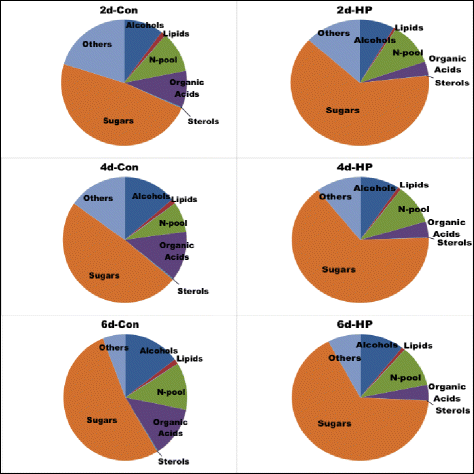
两种细胞系之间已知代谢物的分组差异以及它们在细胞系内随培养时间的变化情况表明,在所有三天的分析中,糖的差异最大,其次是有机酸,氮化合物和醇(图3)。4)。在比较的所有日子里,HP细胞中的相对糖池都较高。葡萄糖、果糖、半乳糖吡喃糖、山梨糖、山梨吡喃糖、葡萄糖吡喃糖和半乳糖的含量显著增加(> 2-5倍);蔗糖(在生长培养基中提供)是HP中唯一比对照细胞低的主要糖(附加文件)3.表5)。HP细胞中下降的有机酸主要有苹果酸、3-羟甲基戊二酸、柠檬酸和喹啉酸;琥珀酸(Put的分解代谢产物)是HP细胞中唯一含量较高的主要有机酸。在对照细胞中,除腐胺外,Ala、乙醇胺和GABA等含氮化合物浓度升高,Glu和Thr含量升高。较不丰富的含氮化合物增加了3倍以上的是Cad、β-Ala和腺苷;其他几种低丰度氨基酸在HP细胞中的浓度较低。
对照细胞和HP细胞主要代谢物组的相对组成(占总代谢物的百分比),以及它们在培养的不同天数(2、4和6 d)的变化情况。只有那些被积极鉴定的代谢物被包括在这里(详见附加文件)3.:表S5)
HP细胞的代谢物变化代表了多种代谢途径;其中以氨基酸代谢、碳水化合物代谢和脂质代谢为主。11种优势代谢物(相对浓度≥1000单位)-附加文件3.表S5)在两个细胞系中,大多数时候是肌醇、磷酸、单甲基磷酸、果糖、山梨糖、山梨糖、半乳糖、半乳糖、葡萄糖、葡萄糖吡喃糖和蔗糖;然而,它们的相对丰度在两个细胞系中是不同的。例如,对照细胞中果糖、葡萄糖、山梨糖和半乳糖的相对浓度远低于蔗糖;在HP细胞中,这些代谢物与半乳糖、葡萄糖吡喃糖、山梨吡喃糖和Ala一起占主导地位。HP细胞与对照细胞之间肌醇、蔗糖和磷酸盐的浓度差异小于2.0倍,而其他优势代谢物的浓度差异大于3-4倍。在HP细胞中发现的浓度相对较高(>100单位)的其他化合物在所有天内浓度均高于2倍,包括乙醇胺,GABA和琥珀酸,当然还有Put;低2倍以上的包括谷氨酸、柠檬酸、苹果酸、喹啉酸、2-酮葡萄糖酸、羟甲基戊二酸和果糖呋喃苷。
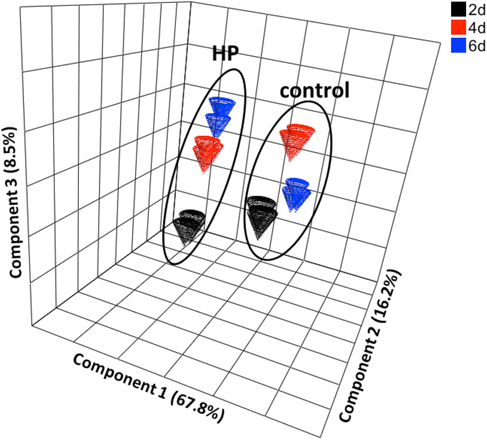
当对主成分分析的排序分数进行方差分析以确定样本之间差异的主要来源时,它们大多是根据细胞系特异性来区分的(对照与HP -图。3.;参见附加文件1(图S3B-D)第一主成分(占已解释变异的67.8%);他们的时间点在第二个PC上被区分(16.2%的总变异)。为了确定在培养期间对照和HP细胞之间的变异来源,对每对(对照2d-HP 2d,对照4d-HP 4d和对照6d-HP 6d)进行额外的PCA分析,在所有三天的分析中发现HP和控制系之间存在明显差异(附加文件)1:图S3B-D)。个体代谢物对对照系和HP系鉴别的贡献表明,高产能显著改变了除有机酸、脂质和酒精代谢外,许多与碳水化合物和氮代谢相关的代谢物。
讨论
杨树基因组序列草图完成前[51],在杨树上发表了几项微阵列研究,其中涉及对张力木材发育过程中的基因表达进行分析[52], CO的影响2臭氧[53,54],安全剂的作用[55],形成层的休眠和生长[56,57],细胞死亡[58]和草食[59]。其后的研究课题包括疾病[60]和干旱[61,62反应、生长和激素调节[63,64]、盐和渗透胁迫[65,66]和一氧化碳反应[67]。Janzet al。[65比较了一种耐受性(胡杨)和敏感的(p.x canescens)种杨树对盐度的反应。尽管转录组分析显示“一般”应激反应基因没有广泛激活,但与盐敏感物种相比,耐盐物种确实表现出一些代谢变化,特别是在原糖、糖醇和酚类物质方面。代谢组学变化伴随着与这些途径相关的几个基因表达的改变。
在这里,我们报告了一项全面的转录组学和代谢组学分析,分析了单个代谢步骤的遗传操作对实现更高的生物活性代谢物(即Put)积累的影响,Put在植物中起着广泛的生理作用。与以往使用整个杨树的转录组学和代谢组学研究(在生物复制之间表现出高度的可变性,导致很大比例的基因/代谢物被从分析中剔除)相比,本研究使用了在体外-培养细胞。大多数对动物和植物的研究都依赖于这样一个前提,即细胞培养中代谢的调节方面反映了整个生物体的实际情况。由于细胞的起源是等基因的,生长习惯是均匀的,因此细胞培养在实验重复中表现出的内在变异性要小得多,从而为检测基因表达和因转基因表达而引起的代谢谱的变化提供了更高的灵敏度。
高腐胺生物合成/积累对转录组和代谢组具有多效性影响
不同基因组的转录差异和属于多种途径的代谢物明显增强了先前报道的细胞对PA含量升高的多效性生理、生化和分子反应[20.,21,33- - - - - -36,39,40]。利用酵母对转基因番茄果实PA含量进行遗传操作的类似研究SAMDC也被证明引起了主要的和显然不相关的代谢和表型变化,包括番茄红素的增加、葡萄藤寿命的延长和果汁品质的提高[68- - - - - -70]。进一步表明,HP细胞的代谢变化反映了N和C代谢的密切相互作用,糖、有机酸和应激相关化合物的变化主要与N代谢直接相关。其他代谢产物如醇类、脂类和酚类化合物受PA途径代谢工程的影响较小。
我们对转录基因的功能聚类揭示了高产量对总细胞生理的广泛影响,包括渗透调节、细胞壁生物合成、转录和翻译等多种过程。我们还发现了几组基因,它们在HP细胞中以类似的方式表达变化,表明细胞活动或代谢区域对Put的实验操作表现出协调的反应。尽管缺乏广泛的基因组注释阻碍了许多这些基因的鉴定,但可以认为,正如代谢组学分析所揭示的那样,它们表达的变化与观察到的与糖、有机酸和富n化合物代谢相关的途径分组有关。特定基因/酶的表达变化与代谢产物改变之间的直接关系有待于正在进行的杨树基因鉴定工作的完成。与预期ODC步骤(Orn→Put)的上调可能首先引起PA通路其余部分的调整(如ADC步骤的下调和/或Orn生物合成基因的上调)相反,Glu→Orn→Arg→Put通路基因的表达差异很小且不显著。该通路中该组分的基因表达缺乏主要差异,这支持了先前的观点,即该通路的代谢调节主要发生在酶活性和底物可用性水平上[35,71]。在Page et al. [35],我们之前报道了大多数PA生物合成基因表现出协调表达,分为两个不同的簇,随着培养基中培养时间的推移,它们的表达表现出平行的变化。
鸟氨酸在植物从谷氨酸合成精氨酸的代谢途径中占有重要地位(附加文件)1:图S1),并且本身在细胞中的浓度很低(比谷氨酸或精氨酸低40至50倍)[34,71]。由于HP细胞从Orn中产生的Put量高出数倍,因此可以假设,从Glu中产生的Orn必须大大增加,以跟上其消耗的步伐。这包括一系列至少六个酶促步骤;假设的调控步骤是Glu通过NAGS的乙酰化作用作用于Orn通路[71- - - - - -74]。与预期相反,这些基因的表达可能会上调以满足对Glu→Orn→Arg代谢物通量增加的需求,在HP细胞中,这些基因的表达(基于几个ESTs在大多数情况下)没有显示出明显的变化,以响应Put的增加和Orn的利用和合成的增强。这些结果与之前发表的RT-qPCR分析数据一致[35,36],并为这里使用的微阵列协议的验证提供内部控制。该途径的前体(即Glu和Gln)的减少支持了从Glu到Orn的整个途径因Orn消耗增加而过度激活的论点[33,71]。同时,GABA、琥珀酸和β-丙氨酸的增加证实了我们早期研究中直接证明的PAs分解代谢增加[31]。这些结果类似于当苦素的代谢工程使酪氨酸的消耗增加了几倍时,酪氨酸生物合成中任何编码酶的基因的转录几乎没有变化拟南芥[14]。
两种细胞系的代谢谱差异显著,在任何一天的分析中,超过60%的代谢物在两种细胞系之间存在显著差异;在HP细胞中,约25%的蛋白含量较高,36%的蛋白含量较低(附加文件)3.表5)。细胞系内代谢变化随培养时间的PCA和培养当天两个细胞系之间代谢变化的PCA提供了充分的证据,表明观察到的变化与Put的遗传操作有关(如果不是由遗传操作引起的话),而不仅仅是培养基中营养物质在不同培养日的差异的表现。然而,还应该强调的是,提高Put的产生本身具有许多其他生理效应,特别是与氧化代谢有关(见上文引言部分);因此,有争议的是,一些观察到的代谢变化是高Put积累及其分解代谢的间接影响。
HP细胞中主要代谢物的变化,如几乎所有氨基酸(GABA、Ala和Ser除外,它们都是PAs的分解代谢产物)含量的减少,与增加Glu/Gln的利用率以产生更多的Orn一致。代谢组学分析未显示Glu→Orn→Arg通路中大多数其他中间产物的明显变化,这表明这些代谢物都是短暂存在的,并且数量很少(即没有积累),或者该技术不允许检测和鉴定它们。遗憾的是,由于Arg、Orn和瓜氨酸在三甲基硅基化过程中不受控制地转化为Orn,因此不能用代谢物分析技术单独分析它们[75]。Mohapatraet al。[34]先前通过氨基酸的HPLC分析表明,虽然在HP细胞中Orn的浓度明显较低,但在两种细胞系中Arg的浓度非常相似。
HP细胞的细胞代谢变化与PAs的生理作用一致
多胺参与了多种生理生化过程,特别是植物的生长发育、对非生物胁迫和钙胁迫的反应2+缺氮、固氮以及与细胞大分子的相互作用[21,23,76,77]。因此,在HP细胞中观察到的基因表达变化可能与高Put积累的细胞反应或高Put有害影响改善的二次反应有关;例如,那些与氧化应激增加有关的[39]。
两个细胞系在任何一天的分析中都没有核糖体基因表现出显著的表达变化,而在同一细胞系的不同培养天中有几个不同,这可能反映了总蛋白生物合成的变化率与培养时间和营养可用性有关。HP细胞中几个核糖体基因的表达在第3天增加,这与在转移到新鲜培养基培养的前2至4天内它们含有较高可溶性蛋白含量的观察结果一致[35,36]。在7 d培养周期的后期,HP细胞没有保持较高的蛋白质含量,并且比对照细胞更快地进入蛋白质含量下降的阶段。在第5天的观察结果证实了这一点,8种不同的核糖体基因模型在HP细胞中表达降低。
一个主要的惊喜是观察到HP细胞中几种细胞壁相关基因的表达与对照细胞相比有所减少;均无较高表达。这一类别中贡献最大的是扩展蛋白,其在HP细胞中的表达平均减少到对照组的10%。HP细胞中下调的细胞壁相关基因还包括3,5- epimase /4-reductase(参与细胞壁糖代谢),类似束状蛋白agp10(参与细胞粘附)和细胞壁-质膜连接蛋白。虽然这些变化没有明显的解释,但它们可能反映了两种细胞系中碳水化合物的广谱差异,这些碳水化合物参与细胞壁的生物合成。多胺已被证明在细胞壁代谢中发挥重要作用,特别是与木质素沉积有关[20.,21]。
与休克、应激或创伤反应相关的基因模型与参与膜运输和渗透调节(通常与PA效应相关的功能)的基因有一定的相似性,这些基因在第3天主要下调,在第5天上调。这类基因在对照组和HP细胞之间的表达在两天内都有显著差异,分为两组。第一类包括几丁质酶、几丁质结合蛋白、伤口诱导蛋白和热休克蛋白;这些蛋白质与细胞壁降解和防御反应有关,在HP细胞中被上调。第二组包括抗坏血酸过氧化物酶、一种阳离子过氧化物酶和一种“应激相关”基因,该基因在HP细胞中表达减少;它们可能反映了观察到的HP细胞氧化状态与高Put有关的变化[39]。
其他表现出表达变化的酶基因包括一组不同的蛋白质。HP细胞在第3天或第3天和第5天表达减少的两个基因编码两个独立的Met合成酶;这与HP细胞中较低的Met含量一致[40]。同样,在HP细胞中表达上调的乙酰基转移酶可能参与了Glu转化为Orn的生物合成,而由于HP细胞中ODC活性的提高,该子通路必须上调以满足需求的增加[73,74]。
在这样的研究中,转基因细胞系已经维持了几年(或者任何突变或转基因植物系已经生长了几代),可以预期,新的代谢稳态将导致继发代谢效应,可能与操纵的主要目标无关。通常,原代细胞系或转基因植物(如T1代)通常不能提供足够的植物材料来进行广泛的实验。当转基因是组成性表达时尤其如此。无论是细胞培养还是植物(幼苗或成熟),原代转化体都已适应了本构表达。因此,这里提出的一些结果取决于对细胞长期稳态调节的解释。最近,与拟南芥,我们已经产生了组成和诱导(由雌二醇)转基因系,并研究了一些与杨树细胞相似的生化方面,并发现它们显示出相似的结果[33,71]。
结论
本研究在生理学上的重要发现是,通过转基因的过表达上调单一代谢物可能导致广泛的基因和参与多种生理功能的多种代谢物的表达发生变化;这些结果与植物中PAs的多方面功能相一致。这里提出的结果强调了在相当简单的一组未分化细胞中对单一代谢物的扰动的细胞反应的复杂性。结合我们实验室最近的研究[33,71表明(i) Put产量的增加导致Glu进入Orn的通量增加,而对Pro和Arg (N代谢的Glu-Orn-Pro-Arg- gaba途径的另外两种氨基酸)的同时影响很小,并且(ii) Glu进入该途径的增加使用至少部分由其通过额外的N和C同化而增加的产量来补偿;这些结果可能有助于设计具有更高氮利用效率和更强碳同化的转基因植物,特别是用于非食物/饲料用途的植物(例如增加生物质产量或用于生物燃料)。
数据和材料的可用性
这里描述的细胞系正在新罕布什尔大学通讯作者的实验室(sminocha@unh.edu)进行维护。其他微阵列数据可在以下网址查阅:http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE79420(联系L.C.博士- csekel@uah.edu);更多的代谢组学数据可在:https://mynotebook.labarchives.com/share/ulav72/MjIuMXwxNzEzMTkvMTcvVHJlZU5vZGUvMzg1Mzg2MTkxNHw1Ni4x(联系a.u., ulanov@illinois.edu或ZL lucasli@illinois.edu)。
道德和同意参与
不适用
发表同意书
不适用
缩写
- ACC1:
-
Aminocyclopropane-1-carboxylate
- ADC:
-
精氨酸脱羧酶
- 简历:
-
变异系数
- 2,4 - d:
-
2,现在也是酸
- 美国东部时间:
-
表达序列标签
- GABA:
-
γ-氨基丁酸
- 格斯:
-
β葡萄糖醛酸酶
- 惠普:
-
高腐胺
- NPTII:
-
新霉素磷酸转移酶
- ODC:
-
鸟氨酸脱羧酶
- PA:
-
聚胺
- 主成分分析:
-
主成分分析
- 把:
-
腐胺
- 社民党:
-
亚精胺
- Spm:
-
精胺
- SAMDC:
-
S-Adenosylmethionine脱羧酶
参考文献
Böttcher C, von roepenak - lahaye E, Schmidt J, Schmotz C, Neumann S, Scheel D,等。生物合成突变体的代谢组学分析揭示了拟南芥代谢变化的多样性,并允许鉴定大量新的化合物。植物生理学报。2008;47(2):397 - 397。
grning N-M, Lehrach H, Ralser M.代谢网络的调控串扰。生物化学进展,2010;35(5):220 - 7。
李春华,李春华,李春华,等。植物非生物胁迫响应调控网络的组学分析。植物学报,2010;13(3):1382 - 1382。
吴志强,吴志强,吴志强,等。代谢工程的研究进展。生物医学工程学报,2013;4(4):559 - 558。
Abdeen A, Miki B.多效性效应酒吧基因和草甘膦对拟南芥转录组的影响。植物学报。2009;7(2):391 - 391。
Kogel KH, Voll L, Schäfer P, Jansen C, Wu Y, Langen G,等。大田种植转基因大麦的转录组和代谢组分析缺乏诱导差异,但表现出品种特异性差异。美国国家科学促进会。2010; 107:6198 - 203。
Laura M, conninr, Locatelli F, Fumagalli E, Allavena A, Coraggio I,等。对寒冷和冰冻的代谢反应Osteospermum ecklonisoverexpressingOsmyb4.植物生理学报,2010;48(4):764 - 764。
Bourgis F, Kilaru A, Cao X, Ngando-Ebongue G-F, Drira N, Ohlrogge JB,等。碳分配差异显著的油棕和枣树中果皮的转录组和代谢物比较分析。美国国家科学促进会。2011; 108:12527-32。
Angelcheva L, Mishra Y, Antti H, Kjellsen TD, Funk C, Strimbeck RG,等。西伯利亚云杉耐极寒性代谢组学分析(云杉obovata)。植物学报,2014;24(4):545 - 555。
韩华军,彭荣华,朱波,付晓云,赵伟,石斌,等。甲基紫病菌胁迫下拟南芥基因表达谱的微阵列分析。中国生物医学工程学报,2014;41(1):391 - 391。
杨绍勇,郝德龙,宋志忠,杨国忠,王磊,苏永华。不同供氮条件下水稻差异表达基因的RNA-Seq分析。基因。2015;555:305-17。
庄莹,张慧,林思。基于meta转录组分析的植物氮素综合利用研究2限制,氧化应激和活性毒素的生产适宜fundyense青春不谢。有害藻类。2015;42:60-70。
Gehlenborg N, O'Donoghue SI, Baliga NS, Goesmann A, Hibbs MA, Kitano H,等。系统生物学组学数据的可视化。网络学报,2010;7:556 - 68。
Kristensen C, Morant M, Olsen CE, Ekstrom CT, Galbraith DW, Moller BL等。转基因拟南芥植物中苦胆素的代谢工程及其对代谢组和转录组的影响。美国国家科学促进会。2005; 102:1779 - 84。
植物代谢物分析平台的分析方面:目前的地位和未来的目标。[J]中国生物医学工程学报,2007;6(6):998 - 998。
李建平,李建平。多胺在体细胞胚胎发生中的作用。编辑:Bajaj YPS体细胞胚胎发生和合成种子。第30版。伦敦,英国:斯普林格出版社;1995.53 - 70页。
王晓明,王晓明,王晓明,等。红杉叶片化学、多胺与土壤化学的关系。植物与土壤。1997;19(1):109 - 22。
Minocha R, Long S, Magill A, Aber J, McDowell W.叶片游离多胺和无机离子含量与土壤和土壤溶液化学的关系。植物与土壤。2000;22:119 - 37。
高桥T,笕知j . 1。多胺:普遍存在的多阳离子,在生长和应激反应中具有独特的作用。生物工程学报。2010;35(1):1 - 6。
Alcázar R, Garcia-Martinez JL, Cuevas JC, Tiburcio AF, Altabella T.ADC2在拟南芥中,GA缺乏导致矮化和晚花。植物科学学报,2005;43(3):426 - 426。
Alcázar R, Altabella T, Marco F, Bortolotti C, Reymond M, Koncz C,等。多胺:在植物非生物逆境抗性中起调节作用的分子。足底。2010;231:1237-49。
王晓明,王晓明。多胺代谢与疾病的关系。生物化学学报。2009;21(4):323 - 323。
李建军,李建军,李建军,等。植物多胺与非生物胁迫的关系。植物科学,2014;5:175。doi:10.3389 / fpls.2014.00175.
王晓明,王晓明。多胺代谢的转基因研究进展。编辑:林赛·K。转基因植物研究。英国:哈伍德;1998.p . 187 - 99。
Bhatnagar P, Glasheen BM, Bains SK, Long SL, Minocha R, Walter C等。杨树细胞多胺代谢的转基因操纵。植物生理学报。2001;25(5):559 - 559。
李春华,李春华,李春华,等。转基因水稻多胺生物合成途径的研究进展。美国国家科学促进会。2004; 101:9909-14。
何丽霞,何丽霞,李建平,李建平,李建平亚精胺合成酶增强转基因植物对多种环境胁迫的耐受性,上调多种应激调节基因的表达拟南芥.植物生理学报。2004;45(5):712 - 722。
Roy M, Wu R.S-adenosylmethionine脱羧酶水稻多胺基因增加,耐氯化钠胁迫能力增强。植物科学。2002;163:987-92。
张建军,张建军,张建军,张建军,张建军亚精胺合成酶烟草多胺生物合成途径的过表达。植物生理学报,2004;31(1):391 - 391。
邵丽,马宗达,米诺查,等。植物氨基丙基转移酶的结构、表达和调控。氨基酸。2012;42:813-30。
杨树清,李建平,李建平,等。杨树细胞多胺代谢的研究进展。植物生理学报。2002;28(2):555 - 569。
李建军,李建军,李建军,等。基因表达方差分析。生物信息学。2002;18:490-1。
马宗达,邵丽娟,王晓峰,等。鸟氨酸对多胺代谢的调控作用。植物生理学报,2013;44(4):591 - 591。
杨树多胺基因在杨树细胞中的应用研究[j]。氨基酸学报。2010;38:1117 - 291。
杨树鸟氨酸和精氨酸生物合成途径基因在高腐胺和低腐胺生成杨树细胞中的表达。氨基酸。2012;42:295-308。
李建平,李建平,李建平,等。腐胺生物合成酶基因调控对其他多胺生物合成酶转录和活性的影响。植物物理学报。2007;29:707 - 24。
王春华,李春华,李春华,等。杨树多胺代谢的遗传调控及其对乙烯生物合成的影响。植物生理学报。2002;40:929 - 937。
杨建平,李建平,李建平,等。野生型和腐胺过量转基因杨树细胞对氮素形态和浓度变化的生理响应。植物学报。2004;24:551-60。
杨树龄,杨树龄,杨树龄,等。腐胺过量对杨树细胞氧化状态的影响。植物生理学报,2009;47(1):262 - 71。
Mohapatra S, Cherry S, Minocha R, Majumdar R, Thangavel P, Long S等。多胺高产和低高产细胞系对铝和钙胁迫的响应。植物生理学报,2010;48(1):612 - 620。
Lasanajak Y, Minocha R, Minocha SC, Goyal R, Fatima T, Handa AK等。酵母工程番茄果实中多胺生物合成底物通量的增加而乙烯通量的减少S-adenosylmethionine脱羧酶基因。氨基酸。2014;46:729-42。
邵莉,Bhatnagar P, Majumdar R, Minocha R, Minocha SC.腐胺过量对杨树和拟南芥亚精胺和精胺分解代谢的影响。氨基酸。2014;46:743-57。
Majumdar R, Barchi B, Turlapati SA, Gagne M, Minocha R, Long S,等。谷氨酸、鸟氨酸、精氨酸、脯氨酸和多胺代谢相互作用:该途径在转录后水平受到调节。植物科学,2016;7:78。doi:10.3389 / fpls.2016.00078.
王晓明,王晓明,王晓明,等。烟草组织培养快速生长培养基的研究进展。植物物理学报。1962;15:473-97。
转基因植物的基因表达分析。转基因植物基因表达分析。方法中华医学杂志。2005;28:291 - 312。
Allison DB, Page G, Beasley TM, Edwards JW: DNA微阵列和相关基因组学技术:Boca Raton, FL USA: CRC Taylor and Francis Group;2006
丘吉尔GA。cDNA微阵列实验设计基础。生物学杂志。2002;32:490-5。
齐默曼P, Schildknecht B, Craigon D, Garcia-Hernandez M, Gruissem W, May S等。MIAME/Plant-增加植物微阵列实验的价值。植物方法。2006;2:1。doi:10.1186 / 1746-4811-2-1.
崔霞,邱吉尔。cDNA微阵列实验中差异表达的统计检验。中国生物医学工程学报。2003;4(4):391。
艾莉森DB,科菲CS。微阵列分析的两阶段测试:获得了什么?中国生物医学工程学报(英文版);2003;37(1):391 - 391。
杜思康,杨建军,李建军,等。黑棉杨的基因组,杨树trichocarpa(Torr & Gray)。科学。2006;313:1596 - 604。
刘建军,刘建军,刘建军,刘建军,等。富纤维素张力木的生物合成杨树转录物和代谢物的全球分析鉴定了次生壁生物合成中的生化和发育调节因子。植物学报,2006;45(5):391 - 391。
古普塔P,杜普莱西斯S,怀特H, Karnosky DF, Martin F, Podila GK。颤杨树长期暴露于相互作用的高CO后的基因表达模式2和对流层O3..植物科学学报。2005;37(1):109 - 109。
Taylor G, Street NR, Tricker PJ, Sjödin A, Graham L, Skogström O,等。的转录组杨树一氧化碳浓度升高2.植物科学学报。2005;37(1):1 - 4。
Rishi AS, Munir S, Kapur V, Nelson ND, Goyal A.安全诱导表达序列标签的鉴定和分析杨树使用cDNA微阵列。足底。2004;220:296 - 306。
Schrader J, Moyle R, balerao R, Hertzberg M, Lundeberg J, Nilsson P,等。树木形成层分生组织休眠涉及转录组的广泛重塑。植物科学进展。2004;22(1):1 - 4。
Groover AT, Mansfield SD, DiFrazio SP, Dupper G, Fontana SP, Millar R,等。的杨树同源框基因ARBORKNOXI揭示了调控茎尖分生组织和维管形成层的重叠机制。植物化学学报。2006;31(1):917 - 932。
Moreau C, Aksenov N, Lorenzo MG, Segerman B, Funk C, Nilsson P,等。植物木质组织发育细胞死亡的基因组研究杨树树。中国生物医学工程学报,2005;6:564 - 564。
Raph S, Oddy C, Cooper D, Yueh H, Jancsik S, Kolosova N,等。杂交杨树(三角杨树)与森林帐篷毛虫互动(Malacosoma disstria):标准化和全长cDNA文库,表达序列标签和cDNA微阵列,用于研究杨树昆虫诱导的防御。中国生物医学工程学报。2006;15(3):1275 - 97。
Miranda M, Ralph SG, Mellway R, White R, Heath MC, Bohlmann J,等。杂交杨树(毛杨×三角杨)感染Melampsora母体"叶锈病涉及诱导黄酮类途径基因导致原花青素积累。植物学报。2007;20(2):816 - 831。
Hamanishi ET, Raj S, Wilkins O, Thomas BR, Mansfield SD, Plant AL,等。种内变异杨树balsamifera干旱转录组。植物生态学报。2010;33(1):1 - 5。
Cohen D, Bogeat-Triboulot MB, Tisserant E, Balzergue S, Martin-Magniette ML, Lelandais G,等。干旱响应的比较转录组学研究杨树成熟叶片和根尖两种基因型的全基因组表达谱分析。生物医学工程学报。2010;11:30 3。
李海,裴埃克,Park SY, Sjodin A, Lee JS, Noh EW,等。杨树生长期相关基因表达谱(白杨x白杨varglandulosa悬浮细胞。植物物理学报。2007;31:599 - 613。
苟军,施特劳斯山,蔡俊杰,方康,陈勇,姜旭,等。赤霉素调节植物侧根的形成杨树通过与生长素和其他激素的相互作用。植物学报。2010;22:623-39。
Janz D, Behnke K, Schnitzler J-P, Kanawati B, Schmitt-Kopplin PH, Polle A.盐敏感和耐盐杨树物种转录组和代谢组的通路分析揭示了耐盐机制的进化适应。植物学报,2010;10(10):1590。
裴宜康,李海,李继生,卢新。杨树细胞渗透胁迫诱导基因的抑制减法杂交和基因芯片分析。植物生理学报,2010;48(4):526 - 531。
李建平,林勇,张军,李建平,等。的转录组杨树在高CO显示增加的花青素生物合成在延迟的秋季衰老。中国生物医学工程学报,2010;36(6):415 - 428。
Mehta RA, Cassol T, Li N, Ali N, Handa AK, Matotoo AK。工程多胺积累在番茄提高植物营养素含量,果汁品质,和藤的寿命。生物工程学报。2002;20:613-8。
Nambeesan S, Datsenka T. Ferruzzi Mg, Malladi A, Mattoo AK, Handa AK:酵母亚精胺合酶过表达对番茄成熟、衰老和腐烂症状的影响。植物科学学报,2010;43(3):836 - 847。
Mattoo AK, Minocha SC, Minocha R, Handa AK。多胺和植物细胞代谢:转基因方法揭示了对二胺腐胺与高多胺亚精胺和精胺的不同反应。生物医学工程学报。2010;38(4):591 - 591。
李建军,李建军,李建军,等。鸟氨酸:氨基酸和多胺的合成途径。内图:高等植物中的氨基酸。编辑:D 'Mello J;2015
植物精氨酸生物合成的基因、酶及其调控。植物生理学报。2005;43(3):729 - 45。
麦凯·G,夏古尔警局。豌豆n -乙酰-谷氨酸5-磷酸转移酶的纯化及特性研究Pisum一子叶。生物化学学报(英文版);2001;19(5):391 - 391。
鲍维尔·K, Abadjieva A, Hilven P, Stankiewicz A, Crabeel M.N-acetylglutamate合酶/N乙酰谷氨酸激酶的代谢酿酒酵母允许协调反馈调节精氨酸生物合成的前两个步骤。中国生物医学工程学报,2003;27(2):391 - 391。
Halket JM, Waterman D, Przyborowska AM, Patel RKP, Fraser PD, Bramley PM。GC/MS和LC/MS/MS在代谢分析中的化学衍生化和质谱库。[J] .中国生物医学工程学报,2005;56(6):519 - 523。
吴志强,吴志强,吴志强,吴志强,等。多胺稳定左手Z-DNA:利用x射线晶体学分析,我们发现了一种稳定左手Z-DNA的新型多胺(PA)。生物化学学报。2008;36(6):779 - 779。
《多胺指南》。纽约州纽约:牛津大学出版社;1998.
致谢
这项工作得到了美国农业部- nri奖#2002-35318-12674、NH农业实验站和美国农业部林业局北方研究站的部分支持。作者感谢Sridev Mohapatra博士在维持细胞培养方面的帮助,以及Smita Cherry为代谢组学分析收集样本。资助机构在研究的设计、数据的收集、分析和解释以及撰写手稿方面没有发挥任何作用。本文谨以此纪念已故的Gopi Podila教授(1957-2010)。
部分资金由新罕布什尔州农业实验站提供。这是科学贡献2466号。这项工作得到了美国农业部国家粮食和农业研究所(mcintyre - stennis)项目(NH00062和NH00076-M)的支持。本文谨以此纪念已故的Gopi Podila教授(1957-2010)。
作者谨将这篇论文献给Gopi K. Podila博士,他为这项研究提供了微阵列,并在他的实验室完成了这项工作。Podila博士不幸于2010年去世。
资金
部分资金由新罕布什尔州农业实验站提供。这是科学贡献2466号。这项工作得到了美国农业部国家粮食和农业研究所(mcintyre - stennis)项目(NH00062和NH00076-M)的支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
SCM、AFP和RM构思了这项研究,并设计了实验,作为对这些细胞系的几项先前发表的后续研究,微阵列工作由AFP在GKP和LJC的实验室完成,代谢组分析由AU和ZL完成,SAT帮助重新分析和更新转录组和代谢组数据。所有作者都对稿件的撰写和修订做出了贡献,并完整地阅读了稿件。
Gopi K. Podila去世
附加文件
附加文件1:图S1。
从氮的同化开始的多胺及相关代谢物的生物合成途径(改编自Majumdar et al. 2016)。图S2。(A, B) -质量控制散点图显示通过CV和染料交换测试的数据的表达水平。红点表示对照和HP细胞之间差异表达的统计分析数据。图S3。对照和HP细胞提取物在第2天(A)、第4天(B)和第6天(C)的OPLS-DA结果加载图(s图)。在s图中,每个点代表单个代谢物(标记物)。的x-轴表示变量的贡献。数据点离0值越远,它对样本方差的贡献越大。的y-轴表示同一样本组内的样本相关性。代谢物离0值越远,其在注射间的相关性越好。因此,s形曲线两端的代谢物代表了每个样品组的主要贡献离子。OPLS-DA是一个多变量分析模型,它将X的系统变化分为两部分,一部分与Y线性相关(因此具有预测性),另一部分与Y正交(不相关);y -预测/相关部分表示类间变化,y -正交(ToPo)部分构成类内变化。(DOCX 1653 kb)
附加文件2:
RNA提取、cDNA制备和标记、微阵列杂交和处理、代谢组学分析方法。微阵列:http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE79420.代谢组学数据:https://mynotebook.labarchives.com/share/ulav72/MjIuMXwxNzEzMTkvMTcvVHJlZU5vZGUvMzg1Mzg2MTkxNHw1Ni4x.(PDF 455kb)
附加文件3:表S1。
多胺代谢相关基因表达变化综述。缩略词见图。1.AS、CARB、DAO、NAGK、NAGPR、NAOD、NAOGAcT、ODC、OTC和SPDS的序列未在微阵列上显示。表S2。基因模型的功能聚类显示HP与对照细胞系在第3天和第5天的差异显著(P≤0.05)(≥2倍)。表S3。基因模型的功能聚类仅在第3天显示HP与对照细胞系之间存在显著(P≤0.05)差异(≥2倍)。表S4。基因模型的功能聚类仅在第5天HP与对照细胞系之间显示显著(P≤0.05)差异(≥2倍)。表S5。杨树对照和HP细胞系阳性鉴定代谢物清单。 ND = not detectable. Values that are significantly different (P ≤ 0.05) in the HP cells from the corresponding control cells on a given day are marked in bold. (DOCX 103 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
Page, a.f., Cseke, l.j., Minocha, R。et al。腐胺生物合成的基因操作可对细胞转录组和代谢组进行重编程。BMC Plant Biol16日,113(2016)。https://doi.org/10.1186/s12870-016-0796-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-016-0796-2
关键字
- 基因操作
- 代谢物
- 微阵列
- 鸟氨酸脱羧酶
- 聚胺类
- 杨树
- 转录组