抽象的
背景
次生代谢物艾属是众所周知的重要治疗性质。该属植物是黄酮类化合物和其他多酚类化合物的重要来源之一,但由于这些重要的代谢物含量低,需要在原植物中提高其浓度或寻找替代来源。目前研究的目的是检测和提高抗氧化化合物的产量艾carvifoliaBuch。进行HPLC分析,以检测抗氧化剂。随着黄酮含量的目的,的方式基因转基因A. Carvifolia建立了。利用实时定量pcr技术对黄酮类生物合成途径苯丙氨酸解氨酶和查尔酮合成酶两个基因进行了研究。采用不同的抗氧化方法测定抗氧化电位。
结果
野生型的高效液相色谱分析A. Carvifolia揭示黄酮的存在下,例如咖啡酸(30微克/克DW),槲皮素(10微克/克DW),异槲皮素(400微克/克DW)和芦丁(300微克/克DW)。相比未转化的植物,黄酮类化合物含量增加1.9-6倍和1.6-4倍的ROL乙和ROLç转基因分别。RT QPCR分析显示了类黄酮化生物合成基因的可变表达,包括编码苯丙氨酸氨酶和Chalcone合酶的那些,其发现在转化的比野生型植物中相对更大,因此与代谢物浓度相关。转基因的甲醇提取物显示出更高的抗氧化能力,降低功率和免受自由基诱导的DNA损伤的保护。在转基因植物中,那些窝藏ROL乙比稍微有效rol c-转化株。
结论
以及展示有效性的方式本研究揭示了植物次生代谢诱导基因的分子动态,并与生物合成基因的表达有关。
背景
艾是属于菊科多样化和重要经济价值的属,有超过300种[1].该属是在各种疾病的治疗中使用的有价值的次级代谢产物和精油源[2].通常是苯酚,特别是黄酮类化合物是植物中最重要的植物化学植物之一,影响氧化稳定性,外观,味道和气味。这些化合物所示的生物学特性包括抗氧化剂,抗癌和抗衰老效应,以及帕金森和亨廷顿和亨廷顿的疾病引起的不同心脏和免疫疾病和脑功能障碍的保护[3.那4.].
黄酮化生物合成从氨基酸L-苯丙氨酸开始[5.],并通过苯样途径形成4-香豆素辅酶a [6.].该途径的关键酶是苯丙氨酸解氨酶(朋友)[7.],其它为肉桂酸4-羟化酶(C4H)和4作香豆酸盐:COA Ligase(4 cl)[6.].Chalcone合成酶(CHS.)催化黄酮型途径的首次承诺步骤,通过将一种香豆素COA分子与三种丙二酰COA分子组合来涉及柚皮蛋白醌的生产。Chalcone异构酶(ch)进一步异构化查尔酮为黄酮,从这一步开始,途径分叉形成不同类别的黄酮(图。1).
黄酮类生物合成途径[57]
这艾属中含有丰富的类黄酮[8.].尽管黄花蒿是被研究最广泛的物种,导致了大约50种类黄酮的分离,这些抗氧化剂也在其他物种中检测到,包括答:苦艾l [9.],A.草[10],A. Herba-Alb[11].然而,类黄酮的浓度通常非常低,高度可变的,不仅在不同化学型而且在不同生长阶段的相同的植物[12].
在用于改善植物次生代谢物生产的不同策略中,重组DNA技术允许生物合成基因的表达被改变,以及代谢性状的操纵[13].几项研究表明的方式基因是多种植物次级代谢的强大激活因子[14].蛋白质的的方式基因与DNA结合并刺激生长,而ROL乙基因参与调控生长素信号转导途径[15]是植物二级代谢的有效诱导剂,增加了白藜芦醇生产山葡萄[16]和蒽醌茜草属cardifolia[17].这的方式C基因编码细胞分裂素葡萄糖苷酶并刺激多种植物中许多次级化合物的产生[18-22].
在之前的工作中,我们获得了ROL乙和ROLç转化株的答:carvivolia与野生型植物相比,Buch具有高产量的抗疟化合物以及更高的生物合成基因转录水平[21].本研究的目的是提高黄酮类化合物的含量艾carvifolia他们在野生型植物检测后布赫转基因。我们进行的类黄酮生物合成基因的实时定量PCR分析,以找到自己的表达水平和代谢物浓度之间的关系。在这一点上,类黄酮合成的苯丙素途径的两个基因进行了研究:这些编码朋友和CHS..采用高效液相色谱法测定黄酮类化合物含量,采用不同的抗氧化方法测定其抗氧化活性。
结果和讨论
hplc - dad法测定黄酮类化合物含量
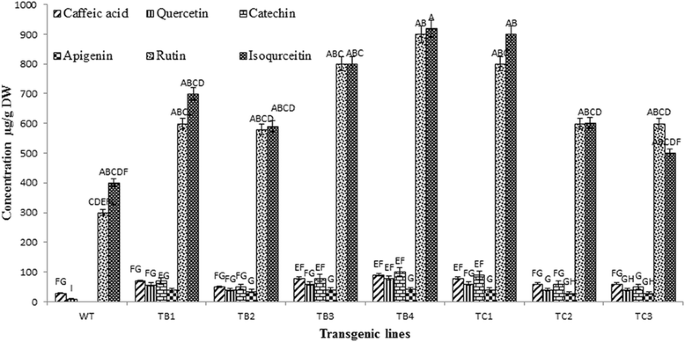
野生型芽中黄酮类化合物的定性和定量分析A. Carvifolia使用HPLC-DAD系统进行植物(4个月大)。研究了八种类黄酮标记物(咖啡酸,槲皮素,异喹啉,芦丁,儿茶素,Apigenin,Gallic酸和Kaempferol),其中在野生型植物中检测到四(咖啡酸,槲皮素,异喹啉素和芦丁),并用增强的浓度的方式基因转化株。在转化植株中检测到儿茶素和芹菜素,而在野生植株中检测不到(图2)。2).
虽然咖啡酸的浓度为30微克/克DW在野生型植物,在ROL乙转化它达到70微克/克DW,呈现出2.4倍的增加,和在ROLç转化子60 μg/g DW,增加2倍。这些浓度和下列类黄酮的浓度是平均值。槲皮素在野生型植物中含量为10 μg/g DW,在野生型植物中含量为59 μg/g DW,是野生型植物的6倍ROL乙转基因和4倍至40微克/克DW在ROLç转基因。异喹啉的野生型浓度为400μg/ g dw,增加1.9倍至770μg/ g dwROL乙为660 μg/g DW的1.6倍ROLç基因转化株。芦丁在野生型植物中的浓度为300微克/克DW,增加高达2.4倍至720微克/克DW在ROL乙为570 μg/g DW的1.6倍ROLç转化株。
在转化的但不在野生型植物中检测到儿茶素和Apigenin。在ROL乙和ROLç儿茶素转化子浓度分别为75 μg/g DW和60 μg/g DW,芹菜素转化子浓度分别为42 μg/g DW和30 μg/g DW。因此,研究的化合物在野生型的生产水平A. Carvifolia显示出高度显著的统计差异(P. = 0.000) in comparison with theROL乙和ROLç基因转移(表1).
以前在不同的情况下检测到多酚或黄酮类化合物艾物种,在引进如前所述,但远不及数量。高校广播公司已知基因是次级代谢产物生产的可靠增强剂[23-25].个人的影响的方式从的TL-DNA中的基因发根农杆菌,A4菌株,对人参皂苷产生P.人参报道了细胞培养物,有ROLç培养比对照植物更多的人参皂苷累积1.8-3倍ROL乙生产线并没有提高生产效率[26].然而,另一项研究发现,蒽醌的产量增加茜草属cardifolia随着ROL乙基因。一些报告描述的作用机制ROL乙基因(17那27那28].Kiani等人。(2015)观察到的黄酮类化合物和酚醛含量增加A.鳖用a转换后高校广播公司基因结构(29].
通过实时QPCR表达黄酮生物合成途径基因
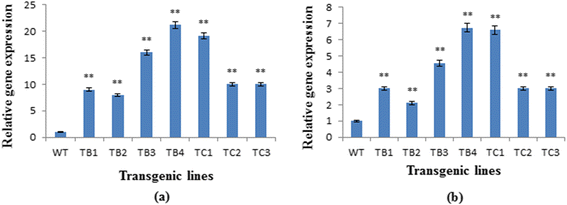
黄酮类生物合成途径基因表达的显着变化(朋友,CHS)。的方式与未转化植物相比的基因转基因(图。3.).的qPCR分析清楚地表明,这两种靶基因显著更高度表达(P˂0.0001)在转化的植物,特别是朋友.增加基因表达ROL乙转化子为8 - 21倍朋友和3-6-foldCHS..在所有的中间的方式B转基因株系,TB4具有两个完整的拷贝ROL乙基因的表达量最高朋友和CHS..同样,在ROLç转化子的表达量高10 - 19倍朋友和3-5.8倍以上CHS.,在线路TC1中达到最大值,包含两个副本ROLç基因。
以前有人说过朋友酶催化初级代谢物通过苯丙烷途径进入类黄酮生物合成途径,因此在类黄酮生物合成中起关键作用[6.那30.].CHS.作为一种类黄酮途径的第一种酶,是酰基转移酶催化4-香豆素COA的缩合到第一类黄酮,Naringenin Chalcone,其据报道,不同植物中黄酮类生物合成的速率限制步骤[6.那31那32].在核桃,CHS.在叶子和芽中表达更多,而不是在石英和树皮中,从木头和髓质中缺席[33].各种报道都描述了朋友和CHS.与植物组织中的类黄酮的积累直接相关[34那35].在目前的研究中,在研究的黄酮类积累和表达中发现了阳性相关性朋友和CHS.基因,与之前的报道一致[35那36].其他研究还证明了结构性类黄酮生物合成途径基因的过表达,包括朋友和CHS.,涉及一种增加了类黄酮积累模式[36那37].
野生型的抗氧化能力评价A. Carvifolia和的方式基因转基因
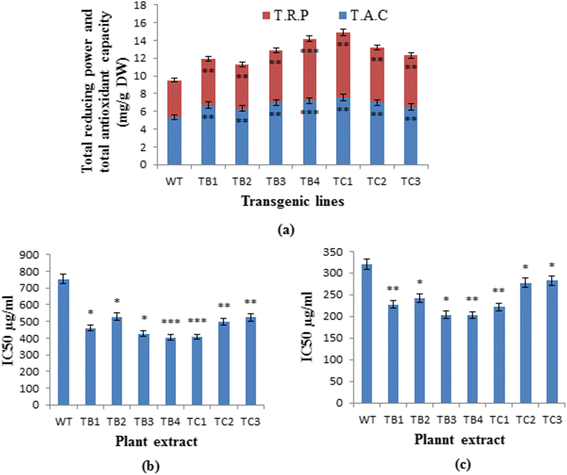
为了评估的抗氧化能力的转化和未转化A. Carvifolia植物,进行不同的抗氧化剂测定。测量为抗坏血酸(DW的Mg / g)的总抗氧化能力为0.53%(图。4),而在野生型植物中为0.76%ROL乙0.7%ROLç基因转化株。在转基因中也增强了总减少功率,适用于3.4%ROL乙和3%的人ROLç,与野生型植物相比2%(图。4).同样,转化植株的抗脂质过氧化的IC50值也较低。4 b)和清除DPPH自由基活性(图。4摄氏度);它们还更积极地保护DNA免受自由基引起的损伤(图。5.).的方式基因显示高度显著效果即P. = 0.0000 on the antioxidant potential of the plant under study (Tables2和3.).所有这些研究结果表明的整合ROL乙和ROLç基因增强了相应转基因素的抗氧化潜力。
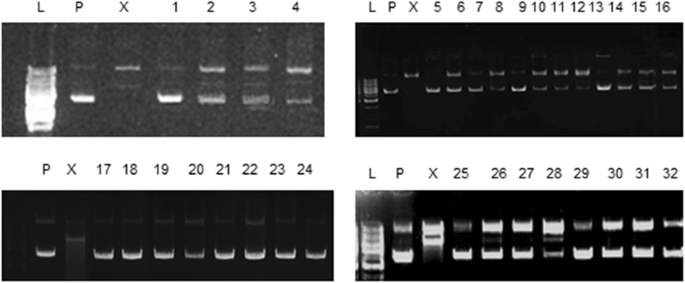
保护效果A. Carvifolia野生型和ROL乙和ROLç抗羟基自由基诱导的DNA损伤的转基因:L.代表1kb DNA阶梯,”P.“表示质粒DNA,车道X shows the damage caused to the plasmid DNA by a Fenton reaction, 1 = 1000 ppm of extract of wild-typeA. Carvifolia + plasmid DNA, 2 = 1000 ppm of extract of wild-typeA. Carvifolia+质粒DNA + FeSO4. + H2O.2, 3 = 100 PPM野生型提取物A. Carvifolia+质粒DNA + FeSO4. + H2O.2, 4 = 10 PPM野生型提取物A. Carvifolia+质粒DNA + FeSO4. + H2O.2.相似地,车道5-8显示TB1,9-12 = TB2,13-16 = TB3,17-20 = TB4,21-24 = TC1,25-28 = TC2,29-32 = TC3的结果
氧化应激被认为是许多疾病发病机制的根本原因,并且抗氧化剂可以是有效的治疗方法[38那39].含抗氧剂的植物提取物的研究提供了洞察行动的负责防止氧化损伤植物防御,以及识别所述特定的抗氧化剂组分[机制40].目前的研究表明甲醇醇提取物A. Carvifolia具有显着的抗氧化性能。
多酚是主要植物抗氧化剂,因为它们的氧化还原能力[41].他们在中和或淬火自由基和过氧化分解[中发挥重要作用42].DPPH是有机基团广泛地应用于分析纯的化合物和植物提取物[抗氧化电位43].抗氧化剂和DPPH之间的反应主要取决于前者的氢捐献能力,因此是结构确认[44].任何化合物或植物提取物的降低功率实际上是转移电子的可能性,这表明其抗氧化能力[45].铁还原力测定法用于评估膳食多酚的抗氧化潜力[46].植物提取物显示的还原能力表明其抗氧化活性[47].
甲醇提取物的抗氧化性能艾物种与它们的酚类和类黄酮含量有关[48].已经进行了实验以了解二次新陈代谢活化和反应性氧物种生产(ROS)之间的关系r . cardifolia用这件改变了ROL乙[49),ROLç基因(14那50].转化后的细胞内ROS水平显著降低r . cardifolia,从而表示ROL乙和ROLç基因是ROS的潜在抑制。这减少了ROS也伴随着编码ROS解毒酶的基因[的表达增强49那50].
结论
从这些结果可以得出结论的方式基因在增加黄酮水平的情况下是有效的A. CarvifoliaBuch,通过HPLC-DAD分析证实和增强的抗氧化潜力的方式基因转化株。转基因植物也有参与类黄酮合成比野生型植物,这是在按照自己的高黄酮含量的基因的更高转录水平。这ROL乙基因比ROLç促进次生新陈代谢的基因A. CarvifoliaBuch。
方法
种子艾carvifolia在巴基斯坦北部的Astore地区(35.3667°N, 74.8500°E;海拔8500英尺),在半强度MS培养基上生长。的识别艾carvifoliaBuch是在巴基斯坦伊斯兰堡Quaid-i-Azam大学的植物标本室完成的,那里提交了标本凭证编号。随后,通过DNA条形码确认了身份[21].野生植物的A. Carvifolia,以及四个ROL乙转基因线和三条ROLç转基因系先前制作[21],分析类黄酮含量的变化,并采用实时qPCR检测类黄酮生物合成基因的表达。此外,还测定了所有研究植物的抗氧化能力。
通过HPLC-DAD系统分析黄酮类化合物
从野生型植物芽中提取类黄酮类化合物的方式根据报告的程序进行基因转基因(4个月)[51].使用水敏锐度进行黄酮类化合物的定性和定量分析TMHPLC-DAD系统(水,西班牙)附着在对称性C-18分析柱,尺寸为5μm,3.9×150毫米(水域,西班牙)。将波长调节至235-450nm,并且施加的压力为200psi。使用0.5%甲酸(A)和水以1ml / min的流速运行的0.5%甲酸(A)和水的流动相,使用0.5%甲酸(b)来实现分离,下列梯度(t(min),%b):(0,95)(15,65)(18,10)(22,95)。注射体积为10μL,保留时间为27分钟。通过与参考标准的保留指标进行比较来确定提取物中的峰。在针对每个代谢物的波长检测分析物,具有特定保留时间(表4.).
类黄酮生物合成途径基因的实时qPCR检测
根据先前报道的方法,通过实时QPCR研究了黄酮类生物合成途径基因的表达[21].利用基因特异性引物进行扩增反应。朋友前进:5'-acactcggttagctattgctgcaa -3'和反向:5'- ccatggcgatttctgcacct -3',CHS.前进:5'-AggctaacagagGagggta-3'和反向:5'-ccaattTaccGGCTTTCT -3',Actin Forward 5'-ATCAGCAATACCAGGGGACATAGT-3'和反向5'-AGGTGCCCTGAGGTCTTGTTCC-3'。
抗氧化潜力的测量
通过进行体外抗氧化测定来确定正在研究的所有植物的抗氧化潜力。因此,在微粒后制备1g风干芽的甲醇提取物。简而言之,用3ml甲醇萃取1g干燥的粉状植物材料,并进行混音半小时。然后将提取物以4000g离心10分钟,干燥上清液,将残余物溶解在DMSO中以达到100mg / mL的终浓度。
测量总抗氧化能力
根据报告的方法确定总抗氧化能力[52使用96孔板。先向孔中加入植物提取物(100 mg/ml) 4 μl,再加入总抗氧化能力试剂196 μl。在90°C水浴中孵育90分钟后,颜色变为深蓝色。然后冷却混合物,在630 nm的酶标仪(Biotek, Elx 800)上取样品吸光度。以抗坏血酸为阳性对照,以DMSO为阴性对照。样品的总抗氧化能力计算公式如下:
总还原功率的测量
的总还原力A. Carvifolia测定转化和未转化的植物提取物[53使用96孔板。将20微升植物提取物(100mg / ml)加入Eppendorf管中,与490μl0.2M磷酸盐缓冲液和490μl1%的铁氰化物,将其在50℃温育20分钟。向Eppendorf管中加入五百微多粒子三氯乙酸,并将混合物以3000rpm离心10分钟。在新的Eppendorf管中分离出五百微多液体上清液,加入100μl氯化铁。氯化铁的颜色在减少时变为蓝色。将两百微升该样品倒入孔中。在酶标器上以630nm拍摄样品的吸光度。抗坏血酸和DMSO分别用作正和阴性对照。使用以下公式计算样品的还原功率:
抗脂质过氧化法
改编自Kanagalakshmi等人的抗脂质过氧化法的方法。[54].维生素E和滑动DMSO分别用作阳性和阴性对照。植物的萃取物在1000,100和10ppm的浓度进行测试。在每个浓度二十微升的植物提取物的溶液中加入于其中的脂质过氧化已被诱导的脂质体。温育在37进行℃进行1个小时。加入终止液的一毫升,使反应停止,将其煮沸15分钟,然后冷却。将所得溶液的两百微升放置在96孔板的孔中。吸光度在532nm测定。的抑制%和IC的50用桌布软件计算价值。
DPPH自由基清除试验
根据报告的方法测量所有植物提取物的自由基清除活性[55]与微小修改如下面给出的。该测定在96孔微孔板上四种不同浓度的植物提取物(1000,500,250和125 ppm的)的运行。简言之,将20μl的每种植物提取物,或在DMSO中的阳性对照与阴性对照和抗坏血酸,进行混合以180微升0.1毫新鲜制备的DPPH溶液。所有在每个浓度的提取物一式三份运行。温育在37℃半小时是为所有的反应混合物中进行。在此之后,吸收物吸收在517nm处。
氧化DNA损伤分析
先前报道的方法[56]获得通过寻找植物所研究的提取物的抗氧化和促氧化活性。五十毫米磷酸盐缓冲液用于溶解的pBR322质粒DNA,以达到0.5微克/微升3的浓度。植物提取物以三种不同浓度进行了分析,即1000,100,和10ppm。质粒pBR322与损伤剂,即硫酸亚铁和H2O.2,作为DNA损伤的阳性对照,而pBR322 DNA单独在磷酸盐缓冲液中作为阴性对照。37°C孵育60分钟。之后,样品在1%琼脂糖凝胶上运行,并在紫外线下拍照。
统计分析
所有实验,包括类黄酮提取,HPLC分析,实时QPCR和抗氧化剂测定,可一式三份与S.E三次进行。计算。通过施加ANOVA和DUNCHAN的多个范围测试,统计分析通过HPLC分析获得的数据。还通过ANOVA统计分析抗氧化剂测定。基因表达分析结果和总抗氧化能力和降低功率的统计学意义由a确定T.以及(P. < 0.01 = **,P.< 0.05 = *)。
缩写
- CHS:
-
查耳酮合酶
- DMSO溶液:
-
二甲亚砜
- DPPH:
-
2, 2-diphenyl-1-picrylhydrazyl
- DW:
-
净重
- 多发性硬化症:
-
murashige和斯库
- 朋友:
-
苯丙氨酸氨 - 裂解酶
- ROS:
-
反应性氧气
- 此种:
-
tris buffer edta
参考
- 1.
黄菊科属专论。Bull Nat Hist Mus London (Bot)。1993; 23(2): 71 - 177。
- 2.
Chaurasia OP,艾哈迈德·Z,Ballabh B.民族植物学和跨喜马拉雅植物。新德里:萨蒂什串行酒吧。房子;2007年。
- 3.
Pillay P,Maharaj VJ,Smith PJ。调查南非植物作为新的抗疟药来源。J属植物。2008; 119(3):438-54。
- 4.
赖H,辛格纳。口服蒿蛋白可防止并延迟大鼠中7,12-二甲基苯并[A]蒽(DMBA)诱导的乳腺癌的发育。癌症吧。2006; 231(1):43-8。
- 5.
Patra B,Schluttenhofer C,吴Y,Pattanaik S,元L.植物中次级代谢产物生物合成的转录调控。Biochim Biophys Acta,Gene Seng Mech。2013; 1829(11):1236-47。
- 6.
Lucheta AR, Silva-Pinhati ACO, Basílio-Palmieri AC, Berger IJ, Freitas-Astúa J, Cristofani M. An等柑橘sinensis..中华医学杂志。2007;30(3):819-31。
- 7.
Ritter H, Schulz GE。苯丙氨酸解氨酶催化进入苯丙氨酸代谢的结构基础。植物细胞。2004;16(12):3426 - 36。
- 8.
费雷拉JF,Luthria DL,佐佐木T,从Heyerick A.黄酮Artemisia Annua.作为抗氧化剂及其与青蒿素的潜在协同抗疟疾和癌症。分子。2010;15(5):3135 - 70。
- 9。
黄酮、总酚和单宁在不同提取物中的含量艾苦艾.中华民族药理学杂志。2012;1(2):101-4。
- 10.
豪伊杜Z,Martins的A,欧尔班-Gyapai O,放弃P,Jedlinszki N,MATHE I,等人。黄嘌呤氧化酶抑制活性和甲醇提取物和类黄酮的抗氧化性能艾蒿Asiatica.中国科学(d辑:地球科学)2014;8(3):299-302。
- 11.
Qnais E,Raad D,Bseiso Y.提取物和黄酮类化合物的镇痛和抗炎作用Artemisia Herba-alma及其行动机制。神经生理学。2014; 46(3):238-46。
- 12.
Baraldi R,Isacchi B,Predieri S,马可尼G,Vincieri FF,Bilia AR。青蒿素和生物活性黄酮类化合物的分布从Artemisia Annua.L.在植物生长过程中。生物化学学报。2008;36(5):340-8。
- 13.
王志强,王志强,王志强,等。植物次生代谢产物的研究进展。植物科学。2001;161(5):839 - 51。
- 14.
布尔加科夫副总裁。函数的方式基因在植物次生代谢。Biotechnol Adv。2008; 26(4):318-24。
- 15.
植物致癌基因的研究rolB启动改变植物蛋白与植物细胞膜的结合。植物细胞生理。1994年; 35(5):767-71。
- 16.
基谢列夫·K,杜布罗夫娜·A,维塞洛娃·M,布尔加科夫·V,费多列耶夫·S,朱拉夫列夫·n。rolB基因诱导白藜芦醇过量产生山葡萄转化细胞。生物科技J》。2007;128(3):681 - 92。
- 17.
Shkryl YN,Veremeichik GN,布尔加科夫VP,Tchernoded GK,Mischenko NP,Fedoreyev SA。,等人。的单一和组合效应罗拉那B,和C产蒽醌的基因Rubia Cordifolia转变的Calli。Biotechnol Bioeng。2008; 100(1):118-25。
- 18.
Bulgakov V, Tchernoded GK, Mischenko N, Shkryl YN, Glazunov V, Fedoreyev S, et al.;钙通道阻滞剂和蛋白激酶/磷酸酶抑制剂对植物生长和蒽醌生成的影响Rubia Cordifolia愈伤组织文化转变为rolB启动和rolC启动基因。足底。2003;217(3):349 - 55。
- 19。
Bulgakov VP,Veselova M,Tchernoded G,Kiselev K,Fedoreyev S,Zhuravlev Yn。抑制作用发根农杆菌的rolCrabdosiin基因与迷迭香酸的产生Eritrichium sericeum和紫草erythrorhizon转化细胞培养物。Planta。2005; 221(4):471-8。
- 20.
palazónj,cusidór,roig c,pinol m.表达rolC启动基因和尼古丁生产转基因的根及其再生植株。植物细胞报道1998; 17(5):384-90。
- 21.
Dilshad E,Cusido RM,Estrada KR,Bonfill M,Mirza B.遗传转型艾carvifolia书与的方式基因增强了青蒿素的积累。Plos一个。2015; 10(10),e0140266。
- 22.
Dilshad E,Cusido RM,PalazonĴ,埃斯特拉达KR,Bonfill男,米尔扎B.通过在rol基因的表达增强的产量青蒿素Artemisia Annua..颧骨j . 2015; 14(1): 424。
- 23.
Bensaddek L, Villarreal ML, Fliniaux M-A。毛状根的诱导和生长以生产药用化合物。综合生物科学电子杂志。2008;3(1,发根特刊(A. lorense and F. Medina-Bolivar,联合编辑)):2-9。
- 24.
王继,郑L,棕褐色r。从真菌内体的制剂制备引导者,以增强毛状根培养的青蒿素产生Artemisia Annua.L.中华生物技术。2006; 22(5):829。
- 25.
PutaLun W,Luealon W,De-Eknamkul W,Tanaka H,Shoyama Y.壳聚糖在毛茸茸的根文化中提高青蒿素生产Artemisia Annua.L.生物技术快报。2007; 29(7):1143-6。
- 26.
Khodakovskaya MV, Labetskaya NV, Chernoded GK, zhuavlev YN副总裁。植物的影响rolC启动人参毛状根培养生产人参皂苷的致癌基因。植物化学。1998;49(7):1929 - 34。
- 27.
结果表明,该蛋白是一种编码蛋白rolB启动植物致癌基因水解吲哚糖苷。EMBO j . 1991; 10(11): 3125。
- 28.
MAUREL C,勒布朗N,巴尔比埃-Brygoo H,佩罗特-Rechenmann C,布维尔-杜兰德男,生长素感知盖尔恩J.改建rolB启动- 转化的烟草原生质体(时间过程rolB启动mRNA表达和养肝敏感性的增加揭示了养肝剂的多种对照。植物理性。1994; 105(4):1209-15。
- 29.
Kiani Bh,Ullah N,Haq I-U,Mirza B.转基因艾dubia植物化学和药理学均发生改变。阿拉伯J化学。2015。doi:10.1016 / J.ARABJC.2015.04.020
- 30.
Chang J,罗J,他g .监管相结合的多酚类物质积累过度/沉默phyenylpropanoid途径的关键酶。生物物理学报。2009;41(2):123-30。
- 31。
Bovy酒店A,Schijlen E,大厅RD。番茄中的黄酮类化合物的代谢工程(Solanum lycopersicum):代谢组学的潜力。代谢组学。2007; 3(3):399-412。
- 32.
关键词:查尔酮合成酶,基因工程,基因工程abstract石斛兰索尼娅Earsakul。中国生物医学工程学报。2010;13(20):1000-5。
- 33.
Claudot A-C,恩斯特d,Sandermann H,杜洛埃A.克隆和查尔酮合成酶基因家族从核桃的两个成员的表征。植物理性生物化学。1999; 37(10):721-30。
- 34.
古普塔N,夏尔马SK,蛙JC,Chauhan保持RS。类黄酮生物合成基因的表达面对面的人在不同的生长阶段芦丁含量的变化Fagopyrum物种。J植物理性。2011; 168(17):2117-23。
- 35.
王小林,王志强,王志强,王小林。杜鹃花类黄酮合成基因的克隆与表达分析。Sci Hortic。2008;118(4):314 - 20。
- 36.
Jaakola L, Määttä K, Pirttilä AM, Törrönen R, Kärenlampi S, Hohtola A.越桔果实发育过程中与花青素、原花青素和黄酮醇水平相关的花青素生物合成基因的表达。植物杂志。2002;130(2):729 - 39。
- 37.
杰克逊d,罗伯茨K,马丁C.时空在显影的花的花青素合成的基因表达的空间控制Antirrhinurn Majus..工厂J.992; 2:425-34。
- 38.
维生素E对NIDDM低密度脂蛋白和低密度脂蛋白亚组分氧化敏感性及蛋白糖基化的影响。糖尿病护理。1995;18(6):807 - 16。
- 39.
坎宁安JJ。微量营养素如在糖尿病营养品干预。J Am Coll Nutr。1998; 17(1):7-10。
- 40。
廖H, Banbury LK, Leach DN。45种中草药抗氧化活性及其与中药特性的关系基于Evid的互补互补医学。2008;5(4):429-34。
- 41。
Tepe B, Sokmen M, Akpulat HA, Sokmen A.土耳其六种鼠尾草抗氧化能力的筛选。食品化学。2006;95(2):200 - 4。
- 42。
品牌 - 威廉姆斯W,屈弗利耶男,自由基方法Berset C.用于评估抗氧化活性。LWT-食品科学与技术。1995; 28(1):25-30。
- 43。
Katalinic V,米洛斯男,Kulisic T,尤基奇M.筛选的70种药用植物提取物用于抗氧化能力和总酚。食品化学。2006; 94(4):550-7。
- 44.
黄酮类化合物和酚类化合物对前列腺素合成酶的抑制作用及其对O2的清除作用(作者转译)。拱制药。1980;313(4):330 - 7。
- 45.
Meir S,Kanner J,Akiri B,哲学 - 哈斯斯S.水性还原化合物在各种参加叶片的氧化防御系统中的测定和参与。JAgric Food Chem。1995年; 43(7):1813-9。
- 46.
Luximon-Ramma A, Bahorun T, Soobrattee MA, Aruoma OI。黄芪提取物中酚类、原花青素、黄酮类成分的抗氧化活性桂皮瘘.农业食品化学学报2002;50(18):5042-7。
- 47.
黄酮的抗氧化活性和清除自由基的活性槟榔羽叶.BMC Complement Altern Med. 2008;8(1):63。
- 48.
赖特CW。蒿。博卡拉顿:CRC出版社;2003年。
- 49.
Bulgakov vp,Gorpenchenko Ty,Veremeichik Gn,Shkryl Yn,Tchernoded GK,Bulgakov dv等。这rolB启动基因通过抗氧化剂防御的持续活化抑制转化的植物细胞中的反应性氧。植物理性。2012; 158(3):1371-81。
- 50。
Shkryl Y,Veremeichik G,Bulgakov V,Gorpenchenko T,Aminin D,Zhuravlev Y.降低ROS水平和抗氧化基因表达的激活农杆菌属rhizogenes的pRiA4-转化的愈伤组织Rubia Cordifolia.足底。2010;232(5):1023 - 32。
- 51。
沙棘提取物中儿茶素、芦丁、槲皮素、山奈酚和异鼠李素的同时测定沙棘L.)叶通过RP-HPLC用DAD。J pharm biomed肛门。2006; 41(3):714-9。
- 52。
黄志强,王志强,王志强,等。磷钼配合物的分光光度法测定维生素e的含量[j] .中国生物医学工程学报。1999;29(2):337-41。
- 53。
叶子祖。褐变反应产物的研究-氨基葡萄糖褐变反应产物的抗氧化活性。日本J Nutr. 1986。
- 54。
Kanagalakshmi K,Premanathan M,Priyanka R,Hemalatha B,Vanangamudi A. 7-甲氧基噻吩和2,3-二芳基团的合成,抗癌和抗氧化活性。EUR J Med Chem。2010; 45(6):2447-52。
- 55。
二茂铁基苯胺和简单苯胺的席夫碱酯类化合物的合成及生物活性研究。有机化学学报。2009;694(14):2198-203。
- 56.
田波,华英。芦荟素和芦荟大黄素对DNA抗氧化作用的浓度依赖性。食品化学。2005;91(3):413 - 8。
- 57.
伊藤Y,Higeta d,铃木A,吉田H,从查尔酮异构酶和二氢黄酮醇4-还原酶的基因的转座因子大关Y.切除可能有助于黄色花康乃馨(Dianthus caryophyllus)的花斑。植物和细胞生理学2002年,43(5):578-585。
确认
我们感谢巴基斯坦高等教育委员会,为她的博士学位提供奖学金。我们还欣赏梅赛德斯博士博士和穆罕默德塔希尔·沃赫德提供的智力支持。
资金
研究项目没有获得资金。
可用性数据和材料
支持本文结论的数据集包含在文章中。
作者的贡献
ED和HI对所有实验进行了实际工作,即实时QPCR,HPLC和抗氧化剂测定。IUH设计并帮助进行了HPLC分析。RMC&JP监督了西班牙巴塞罗那大学药房部门的所有工作。他们还批评了智力,并批判性地审查了出版物的最终表格。KR提供了技术以及实时定量PCR分析的智力支持。她还为实验设计做出了贡献。BM监督Qu,伊斯兰堡,巴基斯坦伊斯兰堡植物分子生物学实验室所进行的所有作品。她还帮助编写了手稿及其校对。所有作者都已阅读并批准了本文的最终版本。
作者信息
从属关系
相应的作者
道德声明
利益争夺
两位作者宣称他们没有相互竞争的利益。
同意出版物
不适用。
伦理批准和同意参与
该项目由机构生物安全委员会(IBC)Quaid-I-Azam大学伊斯兰堡,巴基斯坦批准。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
黄志强,黄志强。等等。的方式基因增强了抗氧化剂的生物合成艾carvifoliaBuch。BMC植物杂志16,125(2016)。https://doi.org/10.1186/s12870-016-0811-7
已收到:
公认:
发表:
关键词
- 根癌土壤杆菌
- 艾carvifoliaBuch.
- 抗氧化试验
- Chalcone合成酶
- 类黄酮
- 苯丙氨酸ammonia-lyase
- 的方式基因