摘要
背景
(亲)花青素是通过类黄酮生物合成途径经多层调控合成的。植物中黄酮类成分的分析方法已经建立,适用于不同的目的。然而,它们通常在速度或分析深度上妥协。
结果
在这项工作中,我们结合和优化了不同的方案,以便用尽可能少的生物材料分析类黄酮生物合成途径。我们选择了这一代谢途径的核心物质作为指纹来识别途径主要分支的变化。我们使用了简化的样品制备,两个氘化内标,短而高效的LC分离,多反应监测(MRM)模式下串联质谱的高灵敏度检测和核心物质的水解释放来降低复杂性。对该方法进行优化拟南芥种子和幼苗。我们证明,一个Col-0种子/幼苗足以获得类黄酮生物合成途径核心物质的指纹图谱。对于不同基因型的比较分析,我们建议使用10个种子(龄)。分析拟南芥影响通路中步骤的突变揭示了可预见的和意外的通路改变。例如,HY5被发现在种子和幼苗中对山奈酚有不同的调节作用。此外,我们的结果表明,COP1是幼苗中类黄酮生物合成的主要调节因子,而不是种子中类黄酮沉积的主要调节因子。
结论
当样本量高且植物材料有限时,该方法有效地促进了一粒种子(ling)的代谢指纹识别,揭示了途径的变化和差异。此外,将提取的非水解样品、提取的水解样品和未提取的水解样品相结合,可以推断出单个类黄酮释放的衍生物的类别。
背景
类黄酮在多种生物现象中起着重要作用。在植物中,它们鲜艳的颜色吸引传粉者,而它们的抗氧化特性可以保护植物免受有害的紫外线辐射。对于人类来说,红酒中的原花青素被用来解释“法国悖论”——低冠心病死亡率和富含饱和脂肪的饮食同时出现[1- - - - - -3.].特别是其医学意义导致对其在动物和人类中的摄取、代谢和排泄进行了广泛研究[4,5].类黄酮是苯丙类衍生的次生代谢产物,可在各种植物组织中积累。它们的产生通常受环境因素的调节,包括光、温度、病原体的攻击和营养缺乏。类黄酮是一组复杂的化合物。主要亚群包括查尔酮、黄酮、黄酮醇、黄烷二醇、花青素和原花青素[6].
由于该通路的大多数结构基因都是单基因的拟南芥(拟南芥)[3.],该模式种非常适合分析类黄酮核心生物合成。结构基因和调控基因的潜在遗传位点主要来源于减少种皮色素沉着的突变体筛选,并初步命名透明的外种皮(TT) [7,8].
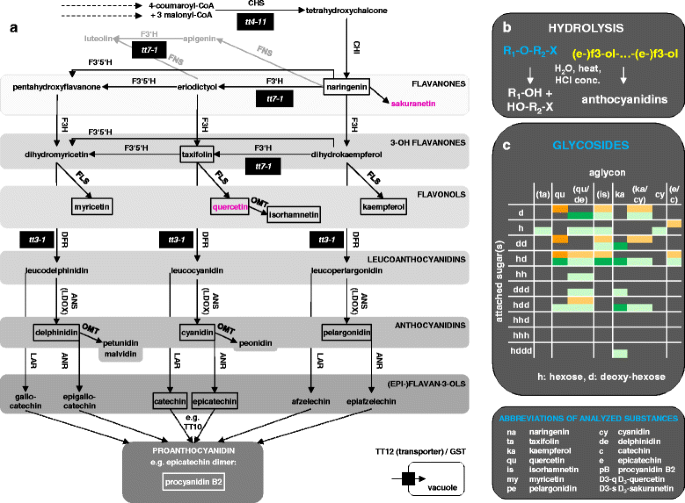
查尔酮合成酶(CHS/TT4)催化该途径的第一步(图。1):查尔酮的合成。查尔酮异构酶(CHI/TT5)将查尔酮异构化为柚皮素。柚皮素和桂皮醇是其他类黄酮的分支点。黄酮3-羟化酶(F3H/TT6)将柚皮素转化为植物类黄酮生物合成中下一阶段的第一个化合物。该水平包括3- oh黄酮二氢山萘酚、杉木素和二氢杨梅素,它们被类黄酮3'-单加氧酶(F3 ' h, TT7)和类黄酮3',5 '羟化酶(F3 ' 5 ' h)相互转化。这三种物质都是黄酮醇合酶(FLS)和二氢黄酮醇4-还原酶(DFR/TT3)的引物,导致该途径的三个进一步分支。黄酮醇山奈酚、槲皮素和杨梅素是FLS的产物。通过DFR合成了白花青素、白花青素和白花青素,并通过白花青素双加氧酶(LDOX/TT11/17/18)进一步将其转化为白花青素、蓝花青素和飞燕花青素,并通过花青素还原酶(ANR)将其转化为表黄烷-3-醇表儿茶素、表儿茶素和没食子儿茶素。亮色花青素还原酶(LAR)催化黄烷-3-醇-阿夫瑟列素、儿茶素和没食子儿茶素的合成。甲基化修饰由o - methyltransferase (OMTs)催化,如槲皮素转化为异鼠李素,花青素转化为芍药苷,飞蝶素转化为芍药苷和锦葵苷。 Multimerization and further modification of epi- and flavan-3-ols results in proanthocyanidins and condensed tannins [9].黄酮醇和(前)花青素是类黄酮生物合成途径的主要代谢库[10].合成后,黄酮类化合物——主要是黄酮醇和花青素——经过糖基、甲基和酰基转移酶的多次连续修饰,产生大量的衍生物[11].这些修饰对于花青素的稳定储存是必要的在足底[12].
黄酮生物合成途径和水解概念,降低提取物的复杂性。一个植物类黄酮核心途径。未填充的盒子:外部标准。填充盒:分析酶的突变体。粉色:氘化的内部标准。分支点柚皮素和碘二醇的下游酶和物质的例子以灰色显示。b类黄酮衍生物中的水解醚键和原花青素中的裂解黄酮间键的例子。糖基化黄酮类化合物:R1:黄酮;R2:糖;X:可能还有其他修改。(e -) f3-ol: (epi) flavan-3-ol。c从种子(橙色)和幼苗(绿色)的甲醇提取物中提取的糖基化黄酮类化合物。深色:基于LC-ESI-MS-QTOF(AutoMSMS)和LC-ESI-MS-QTOF(pseudoMS . qtof)鉴定的糖苷3.).浅色:预测的糖苷在伪oms中没有进一步的苷元碎片3.实验。所附糖基的顺序和位置未被指定。括号内:该配基是预测的,而不是识别的。在这些情况下,相同m/z值的qu/de、ka/cy和e/c分别没有差异。参见附加文件2:如表S3-S5所示。酶类:CHS:查尔酮合成酶,CHI:查尔酮异构酶,FNS:黄酮合成酶,F3H:黄酮3-羟化酶,F3 ' h:黄酮3'羟化酶,F3 '5' h:黄酮3'5'羟化酶,FLS:黄酮醇合成酶,OMT: o -甲基转移酶,DFR:二氢黄酮醇4-还原酶,ANS:花青素合成酶。, ldox:亮色花青素双加氧酶,lar:亮色花青素还原酶,anr:花青素还原酶,tt10:透明种。例如与亚细胞沉积相关的蛋白质:TT12(透明TESTA 12), GST(谷胱甘肽s -转移酶)。tt3、4,7:透明testa 3 4 7.该通路从PlantCyc中提取,并通过先前的综述进行了扩展[9,84,85]
特别是分析答:芥Mutants揭示了类黄酮生物合成途径的关键酶的多层调控[13- - - - - -15].光敏色素A-105 (SPA)复合物的组成型光形态发生1 (COP1)/抑制因子嵌入光信号,介导光调节转录因子的翻译后降解,如延长的下胚轴(HY5)和花青素色素2 (PAP2)的产生cop1突变体和转录激活途径的多种酶[16- - - - - -21].COP1蛋白被光灭活,因此主要在黑暗中活跃,在黑暗中它抑制光形态建成[22,23].它也与生物钟的调节和光周期开花有关[24].
大部分关于COP1和HY5调节花青素生物合成作为光形态发生的一部分的知识来自蛋白质稳定性的研究,突变体的遗传分析,突变体中基因表达变化的研究和花青素光度测量。
深色生长的表情剖面cop1突变体类似于光生长的野生型幼苗,解释了这些突变体的组成型光形态发生表型。在cop1突变的幼苗,例如CHS,气,FLS1而且F3H据报[21,25].CHS表达是cop1依赖光形态建成的标志之一。尽管COP1和HY5以拮抗的方式起作用,但许多HY5的基因重叠COP1-调控基因[21].HY5激活早期和晚期花青素生物合成基因的表达(CHS,气,F3H,F3'H,DFR而且LDOX)在幼苗中直接与这些基因的启动子结合[16].
DFRPAP1和PAP2也能激活表达[26].PAP2可加入V-myb成髓细胞病病毒癌基因同源物(MYB)/碱性螺旋-环-螺旋(bHLH)/WD40 (MBW)复合物。在透明TESTA GLABRA 1 (TTG1)-MBW复合物中,WD40蛋白TTG1与不同MYB和bHLH蛋白的组合一起作用,转录调控下游基因[27].TTG1的核心作用导致了类黄酮生物合成途径的早期和晚期部分的分类[28]使后期步骤依赖于ttg1 - mbw [29- - - - - -31].
不仅类黄酮的数量受到调控,而且组织特异性成分也受到调控。在答:芥种子中主要检测到表儿茶素、原花青素和槲皮素类糖苷,而叶子中以山奈酚类糖苷和花青素为主[31- - - - - -34].据报道,不同物种之间的成分差异很大[35].
所有研究的一个中心方面是选择分析类黄酮成分的方法。方法在许多方面都有折衷:提取方法决定了物质的回收和改性效率。这种分析通常在速度、灵敏度和细节深度上有所妥协。由于化学物质的多样性,不同极性物质的萃取效率取决于溶剂[36].对于极性和半极性物质使用MeOH/水,极性物质用氯仿提取[37].在MeOH/water条件下,糖化黄酮类化合物主要提取于种子的可溶性部分,而缩合单宁主要存在于未提取部分。通常情况下,两者随后被水解并进行光度测量以进行定量比较[33].在酸性条件下结合热催化乙醚裂解[38].水解效率受水解酸度、水解温度和水解时间的影响。多种物质如铁剂、TFA、丁醇、甲醇和盐酸已被用于植物提取物的水解[33,39,40].水解条件不仅会释放苷元,还会裂解原花青素的黄烷间键,最终导致原花青素释放[39,41].
LC-MS检测技术的改进极大地促进了天然产物的分析。多反应监测(MRM)是串联质谱的一种模式,对较低的检测阈值具有较高的选择性和敏感性。飞行时间探测器允许识别单个代谢物由于精确的离子痕迹[42].非水解的糖基化类黄酮的身份可以通过中性损失分析来确定,例如使用伪oms3.色谱分离后[43- - - - - -46].为了更精确的测定,碎片模式和分离的物质还可以通过核磁共振来分析[42].同时,代谢组学和转录组学的结合已成功用于解码基因功能和分析途径的多样性[11,47- - - - - -49].
在这里,我们描述了一种旨在促进高通量研究的方法,在合理的时间框架内分析类黄酮生物合成途径,具有足够的精度和灵敏度,以获得核心成分的指纹图谱。为此,我们:1)提供了一个强大的简单提取和分析方案,2)建立了外部和氘化内部标准,能够明确识别所选核心化合物,3)减少了生物材料(即种子)的数量,4)揭示了一组突变体中途径的转移和差异,作为原理证明。
结果
为高吞吐量进行优化
为了优化该方法进行高通量分析,我们考虑了四个方面的问题:缩短LC-MS运行和数据管理的时间;在可量化的水平上涵盖最多的选定物质,3。4.实验误差最小化;减少植物材料的数量。
第一点是通过在串联质谱中使用高选择性和灵敏的MRM模式来实现的,该模式结合短LC梯度产生小尺寸的数据文件。为了质量控制目的,每种参考物质选择两个mrm(附加文件)1:表S1):量词(在附加文件中下划线1:表S2)和限定符(以确保检测到正确的化合物)。对于分离,我们使用了基于核壳技术的小颗粒尺寸的短柱(KINETEX 2.6 μm C18 100 Å (4.6 mm x 50 mm) C18柱来自phenomenex),在短运行时间内获得了较高的峰值分辨率。为所有参考物质选择允许mrm峰分离的最短时间。在这项研究中,儿茶素/表儿茶素的分离是有限的。LC-MS每个样品只需要13分钟,相当于每天80个样品,包括所有对照。
在方面二到方面四的指导下,对其余参数进行优化答:芥种子。
水解的概念
在答:芥,许多类黄酮分子以各种糖基化形式存在,或以缩合单宁的形式沉积[11].正如预期的那样,在没有水解的情况下,我们使用LC-MS-QTOF建立了一个复杂的化合物混合物,导致各种重叠的峰。与之前的研究一致,我们发现种子中主要是槲皮素糖苷,幼苗中主要是山奈酚糖苷。1 c,附加文件2:表S3-S6) [33,34,50].
为了降低种子提取物中代谢物的复杂性,我们加入了一个水解步骤,释放已提取(如糖基化黄酮类化合物)和未提取(如缩合单宁)物质的指纹(附加文件)2:图S1)。修饰物通过醚连接到许多类黄酮(在大多数情况下含有一个糖苷)或形成多聚体(原花青素)的黄酮间键在水解条件下裂解,并从糖基化的类黄酮中释放苷元,从原花青素中释放花青素(图。1 b) [11,33,39].
外部和内部标准
我们选择了一组11个苷元和原花青素B2作为外部标准,代表核心通路的不同水平(图。1).这些标准涵盖了黄酮类化合物生物合成途径的几个层次答:芥从柚皮素到山奈酚或杉木素,或到槲皮素、异鼠李素或到花青素,再到表儿茶素到原花青素样的原花青素B2 [51].此外,我们还使用了黄酮醇杨梅素,花青素飞燕草素和天葵素,儿茶素,表儿茶素的外聚物(附加文件)1:表S1,附加文件3.:图S2)。
为了分析提取的和未提取的水解物,在(两步)提取过程中需要两个内部标准。因为我们的目标是开发一种适用于广泛物种的方法,我们合成了两种通常在植物提取物中不存在的物质:D3.-槲皮素和D3.-sakuranetin(附加文件3.方法S1)。选择mrm(附加文件1:表S2),两个标准都进行了线性测试(附加文件3.:图S3)。本研究中使用的浓度在各自内标的线性范围内。为维3.-槲皮素,我们观察到,在5°C下放置24小时时,在酸(1% FA)存在下,相对于未酸化的MeOH(92% +/- 15%),随着时间的推移,其反应无显著下降至76%(+/- 23%)(附加文件)3.:表S7)。相对于初始响应,D的响应3.-樱素不受酸或时间的影响,加和不加1% FA的反应分别为100%(+/- 23%)和95%(+/- 15%)。
外部标准在1 ~ 1000 nM范围内分析,用D归一化3.-sakuranetin(附加文件3.:表S7及S8)。所有成分均在线性范围内可检测,平均相对标准偏差(RSD)为14.5%。仅排除杨梅素浓度为1nM时的值。比较MeOH或MeOH + 1% FA在0和5℃下24小时的标准(附加文件3.表S7)显示,酸化的MeOH中大多数物质是稳定的。因此,采用MeOH + 1% FA进行质量控制。
提取和水解时间
所选的提取方案是根据以前用于种子的提取方案进行修改的[33].我们简化了方案,通过水溶液酸化MeOH (1% FA)提取和在MeOH中用盐酸水解而不是BuOH/HCl/铁剂(例如[33,39])。我们加入1%的甲酸(FA)来稳定提取的花青素,因为花青素对ph敏感[12].从用于类黄酮提取的广泛溶剂及其组合中[33,39,52- - - - - -54],我们决定从30- 50% MeOH的最佳窗口中选择浓度为50%的MeOH。除了柚皮素和杨梅素,当使用10种溶剂时,这种溶剂可以检测出从我们的化合物中提取的所有其他物质答:芥种子(附加文件)4:图S4、S5及表S9)。
提取的非水解样品中含有少量游离核心物质(如表儿茶素和原花青素B2),而提取的水解样品中主要含有释放的苷元。在未提取的水解物中,释放的花青素代表未提取的缩合单宁的含量[39].我们将所有三种类型的提取物进行LC-MS分析和精确质量分析,结果显示水解样品的复杂性降低(附加文件)2:图S1)。
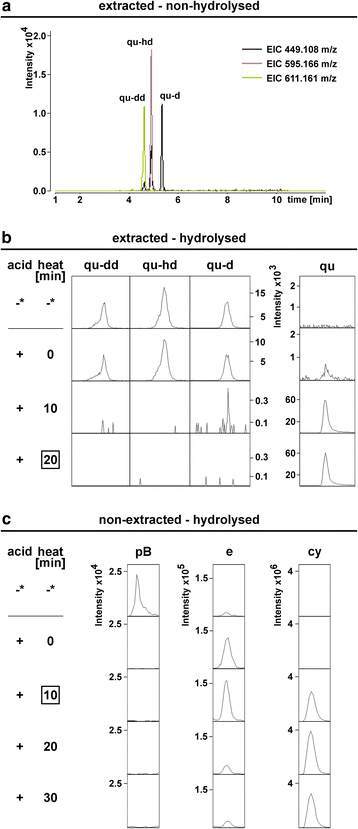
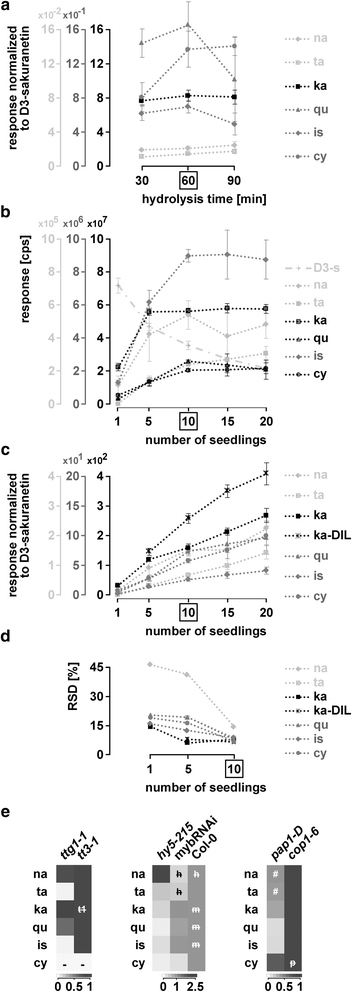
在之前的研究中,水解时间为60分钟[33,52].在下一步,我们的目标是减少水解时间,以最大限度地减少核心物质的降解,同时完全水解最丰富的糖基化黄酮类化合物。在LC-ESI-MS-QTOF(pseudoMS . qtof)中,三种槲皮素基糖苷主要提取非水解样品3.)分析(图;2).在20分钟的水解后,这些都不再被检测到(图。2 b).长时间水解导致表儿茶素水平降低(附加文件4:图S6和表S10)。因此,我们对可提取部分使用20分钟的水解时间。对于不可提取的部分,较短的水解条件应用为10分钟被证明是最佳的(图。2摄氏度,附加文件4:图S6)。
种子水解时间的选择。未水解Col-0种子样品的LC-ESI-MS-QTOF(AutoMSMS)分析n= 10)。一个槲皮素基糖化黄酮类化合物的合并EICs反应最强。b分别在加酸(+)和热处理前(-)和后提取未水解样品。c加酸(+)和热处理后的未提取样品。*:提取的非水解样品显示为比较。酸:MeOH中的HCl。框:本实验得出的水解时间。参见附加文件4:图S6和表S10
水解对标准物质的影响
在水解样品中,本研究中描述的方法旨在比较突变体或生态型之间通路的整个分支,以揭示主要转变。这有助于识别可以更详细地分析的途径部分。因此,该方法使用水解样品中分析的类黄酮途径的核心物质作为各组物质的代表,即通过水解可以释放的所有物质。
我们分别通过水解对每一种选定的物质进行相应的外部标准测试,以确定可能的降解或转化。tt4-11种子在提取前加入相应的物质(附加文件)5:图S7)。为了进行比较,将各自的标准品用相同的因素稀释,通过MeOH +/-FA提取和处理(根据各自的稳定性,见附加文件)3.:表S7)。
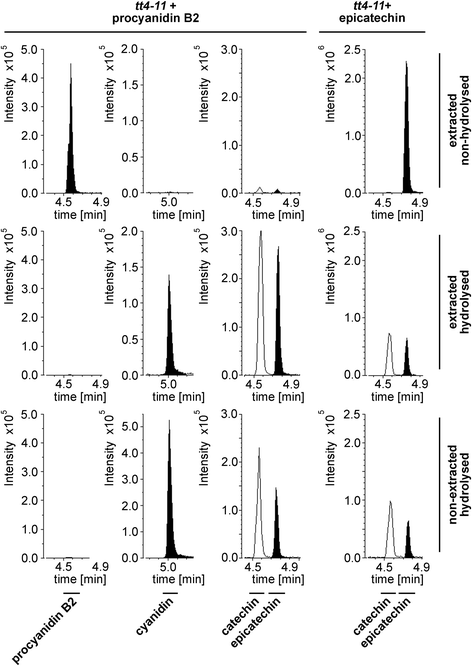
除原花青素B2外,所有物质都能承受两种水解方式。原花青素B2标准(90%纯度)释放表儿茶素和花青素在可量化的水平。在水解样品中,未检测到原花青素B2。在水解条件下,原花青素释放出花青素已被广泛用于估计原花青素水平[39].尽管由原花青素B2转化而来,但表儿茶素也可能从标准中的杂质中释放出来。
此外,我们发现表儿茶素可以转化为儿茶素(图。3.,tt4-11+表儿茶素)。儿茶素在未水解的Col-0种子样品中检测不到,但在水解样品中发现,这表明水解过程中发生了表观转化。因此,不能从水解样品中得出儿茶素存在的结论。令人惊讶的是,杨梅素、天蚕素和飞燕素在提取样品的水解条件下释放出可量化的儿茶素,但不释放表儿茶素。一种可能的解释是标准中的杂质。
从所有提取的水解样品中均可检测到天蝎菌素,包括仅含有内部标准品的样品(附加文件)5:图S7, S8a-c)。未提取的水解样品未检测到天竺葵素的释放。这表明D3.-槲皮素在水解条件下提取的样品。因此,在解释提取和随后的水解样品的结果时,不考虑微小水平的天螺菌素。
除了这些结果,我们不能排除CHS/TT4下游产生的化合物在我们的标准中没有体现,在水解条件下,从具有完整CHS/TT4基因的种子中释放出我们所选的核心物质之一。
尽量减少种子的数量
以前的研究和特定的提取方案需要多达200个种子甚至更多[33,52].然而,种子材料往往是有限的,遗传分析可能需要在多次重复中分析特定的基因型。因此,我们的目标是采用该方法使最少的数量答:芥Col-0种子。
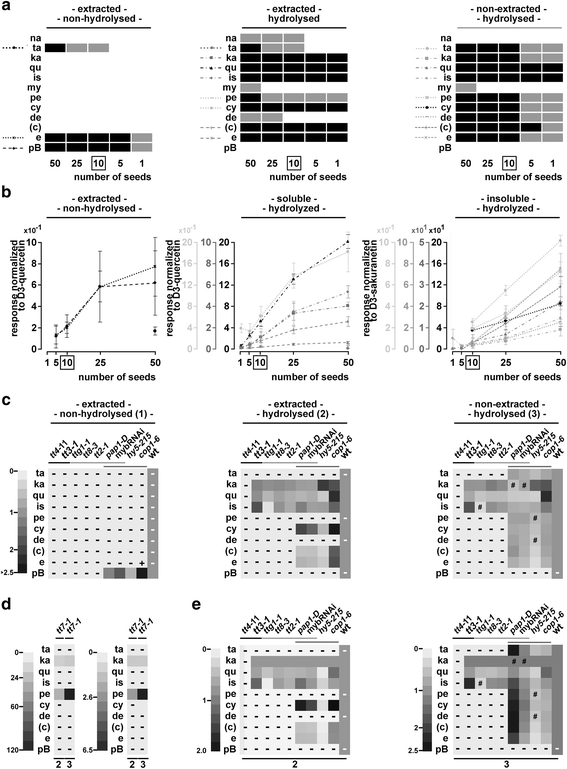
用一颗种子,我们能够在五个样本中至少三个检测到山奈酚、槲皮素、异鼠李素、花青素和表儿茶素/儿茶素的定量水平(>LOQ),这代表了种子中释放的黄酮类化合物最丰富(图。4,附加文件6:表S11)。在如图所示的实验中。4,很少有物质接近各自特定种子数的定量阈值。例如,在一个重复实验中,与山奈酚相比,五种种子中的杉木素是可量化的(附加文件)6:图S9)。虽然在从一颗种子提取的水解样品中检测到超过LOQ的水平,但上述六种物质的RSD范围在20%至50%之间(附加文件)6:表S11)。总的来说,当分析从5到25颗种子提取的部分时,大多数物质在线性范围内的可量化水平上被检测到。4 b,附加文件6:表S11)。要用未提取的部分来实现这一点,可以使用10到50颗种子。因此,我们在随后的实验中使用了10颗种子。
种子材料的减少和种子原理的证明。种子材料减少至一粒(一个,b),并应用于一组选定的突变体(c-e采用LC-ESI-MS-QTRAP(MRM)对提取的非水解样品、提取的水解样品和未提取的水解样品进行分析。一个在50、25、10、5和1中具有可检测和定量反应的类黄酮答:芥Col-0种子(s)。灰色:LOD但没有通过LOQ,黑色:大多数重复都通过LOQ。参见附加文件6:图S9和附加文件5:图S7和S8(水解对分析的黄酮类化合物的影响)。b反应与各自氘化的内部标准标准化。每个子图都使用了几个比例尺。量表的灰度值对应物质的灰度值。箱:本实验的最佳种子数。错误条= STDEV。(附加文件6:表S11:统计数据)c-e突变分析:热图显示日志2相对于各自的野生类型的褶皱差异。d与在(c)及(e)tt7-1用合适的尺度。e数据与(c),但用山奈酚标准化。-: LOD未通过,#:LOD未通过,+:突变型LOQ通过,野生型未通过。灰色的线条将三组突变体分组:酶,TTG1-MBW复合成分,光信号突变体。额外的文件7:表S12和表S13:统计数据。额外的文件7:图S10:用各自氘化内标进行归一化的响应。c检测到的儿茶素很可能来自表儿茶素的外聚体化(见图。3.)
在提取的水解样品中,天蚕素在1 ~ 25粒种子中均可检测到,但不能定量,这是由于其从D3.槲皮素。
出乎意料的是,我们在水解样品中检测到了飞燕草素。这是令人惊讶的,因为F3 ' 5'H基因不存在答:芥而飞燕草毒的检测至今未见报道答:芥.一种可能的解释是我们的参考集中没有包括类黄酮的转化。或者,飞燕草素可能从提取和非提取馏分的衍生物中释放。在这种情况下,这可能与飞燕草素随着时间的推移是相当不稳定的,随着水解时间的增加而减少有关(附加文件3.:表S7,附加文件4:图S6和表S10),我们缩短的水解时间可以检测飞燕草苷。
原理证明:揭示路径的变化
作为揭示代谢变化和途径差异的原则证明,我们将该方法应用于一组在类黄酮途径的不同步骤中受影响的突变体。
研究人员分析了两种对通路产生不同影响的突变体:首先,有缺陷或缺失的酶完全阻断了整个分支或整个通路。第二,有缺陷的转录调控因子影响通路中的一种或多种酶。我们选择了CHS、f3’h和DFR (tt4-11,tt7-1而且tt3-1),包括TTG1、TT8和TT2在内的通路转录调控因子突变体(与的突变体阻断通路的同一分支)DFR / TT3)和光信号突变体COP1,HY5,一个PAP1过表达线和RNAi抑制线PAP1通过4(Pap1, pap2, myb113 (pap3), myb114 (pap4)[28,55].
在所选的3例中均观察到通路内的移位和阻塞答:芥影响酶的突变体(tt4-11,tt7-1而且tt3-1)(图。4 c, d,附加文件7:图S10),这与以往的研究相一致[33,56].在tt7-1观察到的山奈酚/天螺定素分支的转变之前已经报道过,并且是清晰可见的(图。4 d) [33].令我们惊讶的是,我们还检测到可量化水平的花青素tt7-1水解后的提取物。然而,对色谱图的仔细分析显示,水解从天竺葵素参比物质中释放少量的花青素(附加文件)5:图S8d,e)。因此,对天竺葵素含量高的水解提取物进行定量分析需要调整花青素定量阈值。
已知MBW复合物成分TTG1, TT8和TT2是重要的调控因子DFR[27,57].与此一致的是,在前面所述的三个突变体中均未检测到晚期酶的产物(例如:[33])。拦截在DFRtt3-1突变体导致异鼠李素大幅增加,山奈酚水平略有升高,而槲皮素水平与野生型相似。相比之下tt3-1三个MBW突变体ttg1-1,tt8-3而且tt2-1没有表现出山奈酚水平升高,所有的槲皮素水平降低。最引人注目的是,异鼠李素的水平在ttg1-1(无花果。4摄氏度,附加文件7:图S10、表S12及表S13)tt8-3而且tt2-1.在tt8-3而且tt2-1并因此指向一个独立的作用TTG1调节异鼠李素。
除了TT2外,已知四个R2R3 MYB因子PAP1到4与TTG1一起调节类黄酮的生物合成。活化标记系中PAP1的过表达pap1-D导致提取的水解花青素衍生物的积累,而牺牲了槲皮素,表儿茶素及其各自的衍生物(图。4 c, e).山奈酚、槲皮素、花青素和表儿茶素等未提取但可水解的衍生物均显著减少pap1-D种子。在未提取的水解样品中,我们的组中没有任何物质增加。这表明,与野生型相比,未提取的物质中沉积的类黄酮较少。可能,PAP1主要调控种子中的花青素修饰酶,因此,当过表达时,会产生影响种子类黄酮组成的下沉情况。
黄酮类化合物的种子来自mybRNAi系与野生型相似。与野生型相比,很少有物质如槲皮素和表儿茶素显著减少。后者可以通过转录调控来解释ANR通过人民行动党(s).这一观点得到了先前发现的支持,即PAP4在答:芥叶肉原生质体激活ANR[55].非正态化和正态化结果表明通路略有下调,因为相对于山奈酚,没有任何物质突出。的结果pap1-D和mybRNAi线提示(部分)类黄酮通路的冗余调控。
在幼苗中,已知HY5通过直接结合早期和晚期生物合成基因的启动子来激活这些基因的表达[16].hy5 - 215在水解样品中,山奈酚显著增加,其他大部分类黄酮减少(图2)。4 c, e).这表明HY5在调控TT7或者下游基因。
COP1被预测影响通路中大多数物质的水平,因为它调节相关转录因子如HY5和PAP2的稳定性[19,58].不出所料,提取的水解黄酮类化合物的光谱在cop1-6部分重叠在pap1-D.在cop1-6种子,花青素衍生物的水平很高,但不以牺牲山奈酚下游的其他物质为代价,正如山奈酚正常化所见。此外,我们还发现了COP1调控事件影响种子中类黄酮组成和沉积的几个意想不到的方面。
首先,我们揭示了一个角色COP1抑制提取的槲皮素和异鼠李素类物质的积累。一种可能是体内核心酶的错误调节cop1-6.或者,COP1可以抑制至少一种槲皮素和异鼠李素修饰酶。其次,虽然提取的水解样品中存在高水平的花青素,但与野生型相比,表儿茶素水平保持不变。因此,抑制花青素和表儿茶素下游的酶是不可能的。这表明了对花青素下游酶的积极调节,而不影响表儿茶素和下游物质如花青素修饰(如糖基化)酶的水平。第三,相比于未萃取的缩合单宁或未水解的原花青素B2在预期的增强沉积cop1-6在种子中,我们检测到非提取部分释放的物质(紫杉素、天葵素、花青素和表儿茶素)显著减少。
该方法对苗木的适应性
许多分析类黄酮的研究都是用幼苗进行的。从光度分析到不同类型的代谢组学和其他特定应用,已经为特定需求制定了协议[37,59,60].在这里,我们的目标是在高通量下从幼苗中获得用于移位检测的指纹。我们使用提取的水解装置来适应我们的方法。通过LC-ESI-MS-QTRAP(MRM)对幼苗水解提取物进行筛选,筛选出最佳幼苗数量。此外,我们将实验装置应用于基于种子结果选择的突变体。
最初,与其他研究一样,采用了60分钟的水解时间[33,52,53].这个水解时间被证明是最佳的,因为当使用30或90分钟时,检测到的、可量化的物质都没有显著增加。5,附加文件8:表S14)。此外,主要的糖基化类黄酮在60分钟水解后不存在(附加文件8:图S11)。
该方法对苗木的适应性。LC-ESI-MS-QTRAP(MRM)分析。一个D3.-樱黄酮在不同水解时间下的归一化反应。b-d所分析的黄酮类化合物的最佳幼苗数量的选择。b不同黄酮类化合物的反应,包括D3.-樱素,1、5、10、15和20株。Cps:每秒次数。cD3.-樱素归一化反应来自(b)及山奈酚的稀释样本。请注意,仅显示可量化的金额(附加文件8:表S14)d) 1、5和10株幼苗的RSD (c).e突变体。显示日志的热图2改变了维3.-樱素归一化反应(n相对于tt3-1, Col-0和cop1-6.统计和平均规范化响应:附加文件8:表S14。箱装:根据这些实验得出的最佳苗数。错误条= STDEV。# LOD但没有LOQ通过。-: LOD未通过。h,米,p而且t1:各突变体间无显著差异。h:hy5 - 215m:mybRNAi p:pap1-Dt1:ttg1-1.ka-DIL: kaempferol-diluted
对几种物质的检测反应在十株幼苗时达到最大值,这足以检测大多数物质(图2)。5 b).山奈酚的反应很高,在5株幼苗中已经达到最大值。这就需要对五株幼苗的稀释样品进行分析,以检测山奈酚。5度).使用10株幼苗时发现的所有物质(杉木素、柚皮素、山奈酚、槲皮素、异鼠李素和花青素)在5株和1株幼苗中均可定量,除杉木素在1株幼苗中未达到定量限度外。总的来说,内标降低了rsd(图2)。5 b, c).因为在可量化的水平上,所有物质的RSD都要达到20%以下,需要10棵幼苗。5 d),因此我们建议使用十棵幼苗。
突变种子的指纹图谱揭示了通路的意外变化,促使我们进行分析ttg1-1光信号突变体的幼苗和幼苗。
当比较ttg1-1来tt3-1变种人,我们又找到了证据TTG1在调节TT7因为杉木素水平在ttg1-1当与tt3-1.相对于tt3-1,异鼠李素水平大幅下降,槲皮素水平略有下降ttg1-1突变体。这表明TTG1调节异鼠李素在种子和幼苗中的积累。
种子和幼苗之间的类黄酮组成也存在差异mybRNAi线。在水解提取物mybRNAi幼苗、柚皮素、杉木素和花青素含量显著降低,而黄酮醇含量不受影响。这表明人民行动党基因调控柚皮素合成的上游步骤(例如。CHS而且气).的附加规定DFR和/或答研究结果表明,花青素水平降低,而槲皮素水平保持不变。这与之前的发现是一致的DFRPAP1和PAP2可激活表达[26].另一种解释是沿柚皮素-紫杉素-花青素分支修饰类黄酮的酶的调节。
在hy5 - 215,我们发现柚皮素下游的所有物质水平都有所下降。随着种子中山奈酚含量的增加,可以想象HY5在种子和幼苗类黄酮途径的不同步骤起作用。
摘录pap1-D而且cop1-6必须稀释20倍才能达到黄酮的线性范围。所有D3.-樱素归一化反应cop1-6在稀释超过未稀释,标准化野生型反应。为pap1-D与种子中相似,与其他检测到的物质相比,花青素的反应表现出最强的增加,甚至达到与种子中相似的水平cop1-6突变体。
花青素上游所有分析物质的含量均较低pap1-D相比之下cop1-6.因此,我们得出结论:COP1是幼苗类黄酮生物合成途径的主要调节因子,但不是种子类黄酮沉积的主要调节因子。
讨论
植物中黄酮类化合物的定性和定量分析已经建立起来。光度法可快速估计花青素含量[33,60]或结合LC和UV检测器,评估其成分(例如:[33,61])。LC-MS使用MRM, TOF检测器,MSMS或伪oms进行更详细的分析3.[42- - - - - -46].根据具体问题,可以使用提取的部分或未提取的水解部分。通常,为了适应特定的目标,方法会在许多方面妥协。这里建立的方法是针对需要在许多样品和有限的生物材料中定量监测整个类黄酮途径的情况进行优化。与优化相关的有三个方面。首先,我们通过考虑两个标准来确定最短的水解时间:完全去除糖基化修饰和最小化类黄酮转化为其他物质。后者对于避免错误信号导致通路改变的错误解释很重要。第二,该方法适用于仅检测一颗种子或幼苗中的大多数关键类黄酮。使用这种指纹,可以比较许多生物样品中类黄酮途径的变化。第三,我们将三种类型的样品组合,即提取的非水解样品、提取的水解样品和未提取的水解样品。 This combination proofed to be very useful to decide whether individual flavonoids have been released from extracted or non-extracted derivatives. In our study it was particularly helpful to recognize a role of COP1 in the regulation of enzymes modifying quercetin, isorhamnetin and cyanidin.
我们对突变体中类黄酮通路的分析揭示了几个有趣的新发现。人们普遍认为DFRTTG1、bHLH蛋白TT8和R2R3MYB蛋白TT2可能在TTG1- mbw复合体中调控[27,57].因此,人们会认为ttg1-1突变体显示类似的类黄酮组成和水平tt3-1,tt8-3而且tt2-1突变体。事实显然并非如此。一方面,ttg1-1突变体并没有表现出预期的异鼠李素水平的增加,而是减少。另一方面,tt8-3而且tt2-1突变体不同于ttg1-1因为它们显示出野生型异鼠李素水平。此外,ttg1-1,tt8-3而且tt2-1槲皮素水平下降,这在tt3-1.这些数据表明了TTG1的两个调控特征。首先,槲皮素水平的降低表明TTG1、TT8和TT2参与了通路或槲皮素修饰的早期步骤。一个可能的解释是它对TT7如前所述[28].不同的成分tt8-3而且tt2-1突变体表明TTG1也独立于TT8和TT2发挥这一功能。可能的目标有OMT或者异鼠李素修饰酶。
的作用TTG1异鼠李素也存在于幼苗中,这表明TTG1调节OMT或者异鼠李素修饰酶以同样的方式存在于两个组织中。相比之下,我们发现光信号突变体中黄酮类化合物途径的组织特异性调节,特别是通过COP1.
而COP1对种子类黄酮通路影响不大,是幼苗类黄酮通路的主要调节因子。研究结果表明,对于所有在幼苗中检测到的物质,cop1-6变种人释放了最高水平。
在COP1下游转录因子突变体中也观察到种子和幼苗中类黄酮通路的差异调控。类似于cop1-6突变体,pap1-D与其他类黄酮相比,幼苗的花青素含量显著增加。在mybRNAi系柚皮素、杉木素和花青素水平在幼苗中降低,但在种子中没有降低。有趣的是,HY5在种子和幼苗中同样重要,但作用于途径的不同水平。在种子中,山奈酚积聚在hy5 - 215突变体在幼苗中减少,这说明HY5调节上游的步骤TT7而在种子中,TT7或下游酶受到控制。总之,我们的数据支持了COP1功能在发育阶段的依赖性:虽然种子的类黄酮组成仅适度依赖于COP1依赖的光信号通路,但COP1是幼苗中该通路的主要调节因子。
结论
在这项工作中,我们开发了一种分析类黄酮生物合成途径的方法,优化了与有限植物材料进行定量比较的目的。在原理验证实验中,该方法揭示了HY5在幼苗和种子中对山奈酚的不同调节,并为COP1在幼苗中作为途径的主要调节因子的作用提供了证据,而不是种子中类黄酮沉积的作用。这种方法将有助于遗传学研究,特别是不同生态型或遗传突变体的自然变异分析。
方法
植物材料和生长条件
本研究中使用的所有突变体以前都有过描述[7,28,57,62- - - - - -73].以下突变体可从诺丁汉拟南芥库存中心(NASC)获得:tt2-1(N83),tt3-1(N84),tt4-11(N2105573),tt7-1(N88),tt8-3(N891),pap1-D(N3884),cop1-6(N69041)。基因分型的突变体和引物在附加文件中列出9:表S15和表S16。在设计dCAPS引物时,使用dCAPSfinder 2.0 [74].
所有答:芥成熟的种子来自于21°C在16/8小时光照下(90 ~ 120 μmol*m)生长的植物-2年代-1, LUMILUX酷白L58W/840,欧司朗,http://www.osram.de).种子播种于含1%蔗糖的MS固体板上,4℃暗处保存2.5 d,然后转入白光(4d, 21℃,40 μmol*m)下进行幼苗分析-2年代-1欧司朗,欧司朗L58W/77,http://www.osram.de).
化学品,外部标准
MeOH (CHROMASOLV, Fluka,http://www.sigmaaldrich.com)、甲酸(FA)及盐酸conc。(NORMAPUR, AnalaR,www.vwr.com)用于LC-MS级。外部标准(Sigma-Aldrich (https://www.sigmaaldrich.com)、罗斯(https://www.carlroth.com))列于附加文件1:表S1。为了控制LC-MS分析的质量,将所有12个外部标准品(100 nM)与400 nM D混合3.-槲皮素和5 nM D3.受到外界。(对于外部标准的实验:参见附加文件9:方法S2)
内部标准综合
合成D3.-槲皮素,我们使用BF遵循了修改的三步程序3..THF溶液代替BF溶液3.气体(75,76].使用Thermo Exactive Orbitrap质谱仪(Thermo Fisher,http://www.thermoscientific.com).D3.-樱素由柚皮素甲基化合成,如前所述[77]在基本条件下使用氘化碘化甲酯。内部标准合成的所有方法都在附加文件中有记录3.方法1。
黄酮提取
在优化了种子的MeOH浓度、种子(ling)数和种子(ling)s的水解时间后,描述了导出的协议。在所有实验中,如果没有另行说明,则分析五次重复。
用100 μl MeOH:H均质10粒种子2O:FA(50:49:1),加10 μl D3.-槲皮素(100 μM)使用TISSUELYSER (Qiagen,https://www.qiagen.com)与三个玻璃珠(BIOSPEC, #11079125/N032.1, Roth,www.carlroth.com)以30hz频率持续3分钟。离心(14000 rpm, 5 min, 4℃)后,在200 μl提取液(4℃过夜)中重新提取颗粒,然后离心。将60 μl组合上清液与440 μl MeOH(提取的未水解样品)混合。上清120 μl, MeOH:HClconc 380 μl。(95:5)水解(99°C, 20 min),与D 1:1稀释3.-樱素(200 nM):MeOH(1:20)(提取的水解样品)。D3.-樱素用于监测机器波动。未提取的原花青素用210μl D水解(99℃,10 min)3.受到外界(200海里):甲醇:HClconc(1:19:1)。离心两轮(未提取的水解样品),用MeOH 1:1稀释上清液。
10 N2用210μl D冻苗3.-樱素(210nM):MeOH(1:20)均质,22Hz,暗处孵育(4℃过夜),离心(14000rpm, 12min)。取100 μl上清液(99℃,60 min)水解后离心,60 μl上清液以MeOH 1:1稀释。对于10株Col-0和突变株幼苗,进一步用MeOH稀释这些提取物,在线性范围内分析山奈酚(图2)。5c, d)。
质
KINETEX 2.6 μm C18 100 Å (4.6 mm × 50 mm) C18色谱柱(Phenomenex,http://www.phenomenex.com)用于所有样品。在MRM模式下通过LC-MS/MS (=LC-ESI-MS-QTRAP(MRM))进行定量,Agilent 1260 HPLC (http://www.agilent.com/home)耦合到QTRAP 5500质谱仪(ABSCIEX,http://sciex.com);用于识别(AutoMSMS和伪oms)3.一台DIONEX 3000 RSL UPLC(赛默飞世尔,http://www.dionex.com)系统耦合到MAXIS 4G (Bruker Daltonic,www.bruker.com=LC-ESI-MS-QTOF(自动sms或伪oms3.))。LC-MS的详细信息请参见附加文件9方法2。
糖基化黄酮类化合物的检测及其苷元的鉴定
提取的非水解样品注射两次,一次LC-ESI-MS-QTOF(AutoMSMS),一次LC-ESI-MS-QTOF(pseudoMS)3.).自动MSMS检测显示了糖基化黄酮类化合物,即假oms3.与各自的外部标准相比,通过MS/MS碎片模式确定了特定的类黄酮。两者都有助于通过中性损失分析来识别糖基化类型(这里:己糖或脱氧己糖,以获取进一步的细节和参考m / z值见附加文件2:表S3-S6)。
一般的数据分析、统计和具体的可视化
使用非平滑数据,检测极限(LOD)定义为信噪比(S/N)为3,量化极限(LOQ)为S/N为10。当超过一半的重复超过相应的阈值时,为平均值分配LOD或LOQ。所有LC-ESI-MS-QTRAP原始数据均使用analyzer 1.6 (ABSCIEX,http://sciex.com).内置分析定量向导的集成峰值区域被手动修正。LC-ESI-MS-QTOF原始数据用甲酸钠簇进行大规模校正,使用Compass AutomationEngine 4.1高性能计算。后续分析使用Compass DataAnalysis Version 4.1 SP5进行。
采用R 3.0.2 (Shapiro检验、Welch检验、Wilcoxon秩和检验)进行统计分析[78- - - - - -81].为日志生成热图10转换值与热图。2in R 3.0.1 using gplots and RColorBrewer [82,83].所有其他热图都是用BAR HeatMapper Plus工具生成的(http://bar.utoronto.ca/ntools/cgi-bin/ntools_heatmapper_plus.cgi),并更改为灰度。
缩写
- (e -) f3-ol:
-
(epi) flavan-3-ol
- ANR:
-
花青素还原酶
- 答:
-
花青素合成酶
- BF3:
-
三氟化硼
- bHLH:
-
Basic-helix-loop-helix
- BuOH:
-
丁醇
- c:
-
儿茶素
- 气:
-
查耳酮合酶
- CHS:
-
查耳酮syntase
- COP1:
-
本构光形态发生
- cps:
-
每秒计数
- cy:
-
花青色素
- d:
-
Deoxy-hexose
- D3-q:
-
D3-quercetin
- D3-s:
-
D3-sakuranetin
- 德:
-
花翠素
- DFR:
-
Dihydroflavonol 4-reductase
- 艾凡:
-
表儿茶素
- 启德集团:
-
萃取离子色谱
- 应急服务国际公司:
-
电喷雾电离
- F3’5是什么:
-
黄酮3 ',5 '羟化酶
- F3'H:
-
类黄酮3 '单氧酶
- F3H:
-
黄烷酮3-hydroxylase
- 费尔南多-阿隆索:
-
甲酸
- 读者:
-
黄酮醇合成酶
- 销售税:
-
谷胱甘肽S-transferase
- h:
-
己糖
- 盐酸:
-
盐酸
- 高性能计算:
-
高精度校准
- HY5:
-
延长的下胚轴5
- 是:
-
异鼠李亭
- 卡:
-
山柰酚
- ka-DIL:
-
Kaempferol-diluted
- 政治:
-
Leucoanthocyanidin还原酶
- LC:
-
液相色谱法
- LDOX:
-
Leucoanthocyanidin加双氧酶
- LOD:
-
检测限度
- 定量限:
-
量化限度
- MBW:
-
MYB / bHLH / WD40
- 甲醇:
-
甲醇
- MRM:
-
多重反应监测
- 女士:
-
质谱分析
- 我:
-
杨梅酮
- MYB:
-
V-myb成髓细胞病病毒癌基因同源物
- 拿拿淋:
-
柚苷配基
- 核磁共振:
-
核磁共振波谱学
- OMT:
-
O-methyltransferase
- 人民行动党:
-
花青素的生产
- 铅:
-
原花青素B2
- 体育:
-
天竺葵色素
- 曲:
-
槲皮素
- RNAi:
-
RNA干扰
- 相对标准偏差:
-
相对标准偏差
- S / N:
-
信噪比
- SPA1:
-
光敏色素抑制因子A-105
- 助教:
-
花旗松素
- 组织:
-
三氟乙酸
- 四氢呋喃:
-
四氢呋喃
- TOF:
-
飞行时间
- TT:
-
透明的外种皮
- TTG1:
-
透明的毛胚
- WD40域:
-
由WD40重复序列组成
- WD40重复:
-
通常由大约40个氨基酸组成,通常以W-D(色氨酸-天冬氨酸)结尾。
参考文献
Corder R, Mullen W, Khan NQ, Marks SC, Wood EG, Carrier MJ,等。红酒原花青素与血管健康。大自然。2006;444:566。
高桥A,武田K, Ohnishi T.光诱导花青素减少紫外线照射培养半人马菊蓝细胞DNA损伤程度。植物细胞物理学报。1991;32:541-7。
类黄酮生物合成。遗传学、生物化学、细胞生物学和生物技术的彩色模型。植物科学,2001;
Hichri I, Barrieu F, Bogs J, Kappel C, Delrot S, Lauvergeat V.黄酮类化合物生物合成途径转录调控的研究进展。中国科学(d辑),2011;
波杰E,马蒂维F,约翰逊D,斯托克利CS。花青素消费促进人类健康的案例:综述。Compr Rev Food science Food saf2013; 12:483-508。
花青素在植物胁迫反应中的环境意义。光化学与生物工程。1999;30(1):1 - 9。
ttg突变体的复杂综合征。拟南芥Inf Serv. 1981; 18:45-51。
影响拟南芥种皮颜色的突变。拟南芥Inf Serv. 1990; 27:1-4。
李平,李志强,李志强,等。种子类黄酮的遗传学与生物化学研究。植物生物学,2006;57:405-30。
缩合的单宁。进:戴维斯KM编辑。植物色素及其调控。牛津:布莱克威尔出版有限公司;2004.p . 150 - 84。
齐藤K,米仓神原K,中林R,东Y,山崎M, Tohge T,等。拟南芥类黄酮生物合成途径:结构和遗传多样性。植物化学学报,2013;
花青素的改性与稳定研究。进:Winefield C, Davies K,编辑。古尔德K编辑。花青素:施普林格纽约;2009.p . 169 - 90。
刘娟,李志刚,马平。MYB转录因子在植物苯丙类代谢中的调控作用。植物学报。2015;8:689-708。
类黄酮生物合成的转录控制:一个涉及拟南芥分化多个方面的保守调控因子的复杂网络。植物学报,2005;8:272-9。
黄志刚,李志刚。生殖器官花青素合成调控的研究进展。植物科学进展(英文版);2011;
申杰,朴e,崔强。拟南芥中PIF3调控花青素生物合成依赖于hy5,二者直接结合花青素生物合成基因启动子。植物J. 2007; 49:981-94。
朱丹,Maier A,李俊华,Laubinger S, Saijo Y,王华,等。含photomorphophogenic1和PHYA蛋白抑制因子的拟南芥复合体在光控制植物发育中的生化特性。《植物科学》2008;20:2307-23。
杨晓东,李志强,李志强,李志强。拟南芥轻度调控发育过程中HY5的靶向失稳。大自然。2000;405:462-6。
Maier A, Schrader A, Kokkelink L, Falke C, Welter B, Iniesto E,等。光照和E3泛素连接酶COP1/SPA控制MYB转录因子PAP1和PAP2在拟南芥花青素积累中的蛋白稳定性。植物J. 2013; 74:638-51。
Cominelli E, Gusmaroli G, Allegra D, Galbiati M, Wade HK, Jenkins GI,等。拟南芥花色苷调控基因对不同光质响应的表达分析。中国植物学报。2008;26(2):344 - 344。
马琳,高原,曲林,陈震,李娟,赵辉,等。COP1作为拟南芥光调控基因表达和发育的抑制因子的基因组证据。《植物科学》2002;14(2):366 - 366。
冯·阿尼姆股份公司,邓晓伟。拟南芥光形态发生抑制因子COP1的光失活涉及其核质分配的细胞特异性调控。细胞。1994;79:1035-45。
Pacin M, Legris M, Casal JJ。核组成光形态发生丰度的迅速下降预示着它的目标下胚轴在光照下的稳定。植物物理学报。2014;164:1134-8。
余景文,卢比奥五世,李永宁,白山,李世永,金世寿,等。COP1和ELF3通过调节GI稳定性控制昼夜节律功能和光周期开花。Mol Cell, 2008; 32:617-30。
邓晓文,王晓明,王晓明,王晓明。拟南芥光控发育和基因表达的调控位点。基因发展,1991;5:1172-82。
Zimmermann IM, Heim MA, Weisshaar B, Uhrig JF。拟南芥MYB转录因子与R/ b样BHLH蛋白相互作用的综合鉴定植物J. 2004; 40:22-34。
Ramsay NA, Glover BJ。MYB-bHLH-WD40蛋白复合物与细胞多样性的进化。植物科学进展2005;10:63-70。
赵敏,李伟,李志刚。拟南芥幼苗TTG1/bHLH/Myb转录复合物对花青素生物合成途径的调控植物J. 2008; 53:814-27。
Debeaujon I, Nesi N, Perez P, Devic M, Grandjean O, Caboche M,等。拟南芥原花青素积累细胞的分化调控及其在种子发育中的作用。《植物科学》2003;15:514 - 531。
Baudry A、Heim MA、Dubreucq B、Caboche M、Weisshaar B、Lepiniec L. TT2、TT8和TTG1协同调控拟南芥BANYULS的表达和原花青素的生物合成。植物J. 2004; 39:366-80。
Yonekura-Sakakibara K, Tohge T, Matsuda F, Nakabayashi R, Takayama H, Niida R,等。综合黄酮醇谱分析和转录组共表达分析,解码拟南芥基因代谢物相关性。植物学报。2008;20:2160-76。
田东格,西山Y,平井MY,矢野M,中岛J,阿津原M,等。过表达MYB转录因子的拟南芥植物代谢组和转录组整合分析的功能基因组学。植物学报,2005;
Routaboul JM, Kerhoas L, Debeaujon I, Pourcel L, Caboche M, Einhorn J,等。拟南芥种子类黄酮多样性及生物合成。足底。2006;224:96 - 107。
李文杰,李志强,李志强,等。拟南芥种子中主要黄酮苷的结构特征。农业化学学报。2006;54:6603-12。
苯丙类生物合成。Mol Plant, 2010; 3:2-20。
沃芬德,马蒂·G,托马斯·A, Bertrand S.复杂天然提取物代谢产物分析的当前方法和挑战。中国生物医学工程学报(英文版);2015;
齐藤K,松田F.代谢组学的功能基因组学,系统生物学和生物技术。植物学报,2010;
主任RL。醚的裂解。化学Rev. 1954; 54:615-85。
陈志伟,陈志伟,陈志伟。原花青素和原飞燕草素向花青素和飞燕草素的转化。植物化学。1985;25:223-30。
彭震,杨早坂,伊兰PG, Sefton M, Hoj P, Waters EJ。反相高效液相色谱法定量分析葡萄种子中聚合原花青素(单宁)。农业食品化学,2001;49:26-31。
福赛斯WG,罗伯茨JB。可可多酚类物质。5.可可白色素1的结构。生物化学学报(英文版);
Wolfender杰。HPLC在天然产物分析中的检测问题。植物科学。2009;25(5):719 - 34。
鲍彻,冯·罗佩纳克-拉哈耶,施密特,施莫茨C,诺伊曼S,谢尔D,等。生物合成突变体的代谢组分析揭示了代谢变化的多样性,并允许在拟南芥中鉴定大量新化合物。植物学报。2008;147:2107-20。
Marczak L, Kachlicki P, Kozniewski P, Skirycz A, Krajewski P, Stobiecki M.基质辅助激光解吸/电离飞行时间质谱监测拟南芥叶片提取物中花青素。快速共质谱。2008;22:3949-56。
小西杨,清田T, Draghici C,高JM, Yeboah F, Acoca S,等。通过MS/MS/MS技术进行分子式分析,以加速天然产物的复制。《肛肠化学》2007;79:1187-97。
Stobiecki M, Skirycz A, Kerhoas L, Kachlicki P, Muth D, Einhorn J,等。拟南芥叶片酚糖苷缀合物的LC/MS分析。代谢组学。2006;2:197 - 219。
陈晓峰,王晓峰,王晓峰。植物基因功能的遗传多样性、信息学和代谢组学研究。Nat protocol . 2010; 5:1210-27。
Goossens A, Hakkinen ST, Laakso I, Seppanen-Laakso T, Biondi S, De Sutter V,等。理解植物细胞次生代谢的功能基因组学方法。中国环境科学学报,2003;21(2):366 - 366。
Saito K, Hirai MY, Yonekura-Sakakibara K.用共表达网络和代谢组学解码基因-“大多数由预言报告”。植物科学进展,2008;13:36-43。
Pelletier MK, Burbulis IE, Winkel-Shirley B.特定类黄酮基因的破坏增强了类黄酮酶和最终产物在拟南芥幼苗中的积累。植物分子生物学杂志1999;40:45-54。
王志刚,王志刚,王志刚,等。拟南芥黄酮醇和花青素的合成。植物化学学报,2010;
Tohge T, Matsui K, Ohme-Takagi M, Yamazaki M, Saito K.转基因拟南芥种子自由基清除活性增强。生物技术,2005;27:297-303。
北村S,松田F, Tohge T, Yonekura-Sakakibara K,山崎M,斋藤K,等。拟南芥黄酮积累突变体未成熟种子原花青素的代谢谱分析和细胞学分析。植物学报2010;62:549-59。
Matsuda F, Yonekura-Sakakibara K, Niida R, Kuromori T, Shinozaki K, Saito K.基于MS/MS谱标记的植物次生代谢产物非靶向谱的注释。植物学报(英文版);2009;
hepelsc, Jaffe FW, Takos AM, Schellmann S, Rausch T, Walker AR,等。花青素和原花青素调控MYB因子启动子靶特异性进化的关键氨基酸鉴定。中国生物医学工程学报,2013;
斯特拉克·R,贾恩斯·O,凯克·M, Tohge T, Niehaus K, Fernie AR,等。拟南芥黄酮醇苷的积累依赖于MYB11-、MYB12-和myb111 -的黄酮醇苷积累。植物学报。2010;18:985 - 1000。
Nesi N, Debeaujon I, Jond C, Pelletier G, Caboche M, Lepiniec L. TT8基因编码了拟南芥DFR和BAN基因表达所需的基本螺旋-环-螺旋结构域蛋白。《植物细胞》2000;12:1863-78。
光信号中的蛋白水解调控。植物学报,2005;8:469-76。
Kueger S, Steinhauser D, Willmitzer L, Giavalisco P.高分辨率植物代谢组学:从质谱特征到代谢物,从全细胞分析到亚细胞代谢物分布。植物J. 2012;
张志刚,张志刚,张志刚。光敏色素介导花青素合成的研究进展。植物物理学报,1971;47:649-55。
鲍尔曼PA,拉米雷斯MV,普莱斯MB,海尔姆RF,温克尔BS。拟南芥哥伦比亚生态型黄酮合成基因T-DNA等位基因分析。BMC Res Notes. 2012;5:485。
nei N, Jond C, Debeaujon I, Caboche M, Lepiniec L.拟南芥TT2基因编码R2R3 MYB结构域蛋白,该蛋白在种子发育过程中对原花青素积累起关键决定作用。植物学报,2001;13:2099-114。
Alonso JM, Stepanova AN, Leisse TJ, Kim CJ, Chen H, Shinn P,等。拟南芥全基因组插入突变研究。科学。2003;301:653-7。
阿佩尔哈根I, Thiedig K, Nordholt N, Schmidt N, Huep G, Sagasser M,等。拟南芥透明睾丸突变体的最新进展:从等基因集合中鉴定新等位基因。足底。2014;240:955 - 70。
布尔CS,穆代GK,德约杰维奇MA。类黄酮在拟南芥中的吸收和长距离运输存在差异。植物科学学报。2007;45:478 - 491。
Oyama T, Shimura Y, Okada K.拟南芥HY5基因编码调控刺激诱导的根和下胚轴发育的bZIP蛋白。基因工程学报,1997;11:2983-95。
赵丽娟,杨晓明,杨晓明,杨晓明。MYB基因在苯丙类生物合成中的调控作用。《植物科学》2000;12:2383-94。
McNellis TW, von Arnim AG, Araki T, Komeda Y, Misera S, Deng XW。cop1突变体等位基因系列的遗传和分子分析表明,多个蛋白质域的功能作用。《植物科学》1994;6:487-500。
Schoenbohm C, Martens S, Eder C, Forkmann G, Weisshaar B.拟南芥黄酮3’-羟化酶基因的鉴定及编码P450酶的功能表达。生物化学,2000;381:749-53。
张志强,王志强,王志强。拟南芥中控制黄酮-3'-羟基化的基因。拟南芥Inf Serv. 1982; 19:113-5。
雪莉BW,汉利S,古德曼HM。电离辐射对植物基因组的影响:两个拟南芥透明睾丸突变的分析。植物细胞。1992;4:33 - 47。
李文杰,李志强,李志强。拟南芥(Arabidopsis thaliana, L.)单个基因座的EMS和相关诱导突变频率Heynh。Mutat Res. 1982; 93:109-23。
肖尔RL, May ST,韦尔DH。拟南芥种子及分子资源。植物学报。2000;124:1477-80。
李志强,李志强。基于网络的单核苷酸多态性引物设计。《趋势》,2002;18:613-5。
Wahala K, Rasku S.合成d -4-染料木素,一种稳定的氘标记异黄酮,通过预氘化-选择性氘化方法。四面体杂志,1997;38:7287-90。
王志强,王志强,王志强,等。多羟基黄酮和3-黄酮醇的合成。四面体。2000;56:913-6。
Oyama K, Kondo T.基于黄烷6- c糖基化直接合成黄烷黄酮的蓝色超分子色素成分黄酮黄酮。化学学报。2004;49:5240 - 6。
R核心团队R统计计算语言和环境。奥地利维也纳:R统计计算基金会;2013.
罗伊斯顿JP。算法as181:正态性W检验。J R统计Soc C(应用统计)。1982; 31:176 - 80。
摩根富林明的盒子。《吉尼斯,戈塞特,费希尔和小样本》1987。45-52页。
鲍尔DF。使用秩统计构造置信集。美国统计学会,1972;67:687-90。
Warnes GR, Bolker B, Bonebakker L, Gentleman R, Huber W, lilaw A等。gplots:用于绘制数据的各种R编程工具。R包2.16.0版本。2015.http://cran.r-project.org/package=gplots.
Neuwirth E. RColorBrewer: ColorBrewer调色板。R包版本1.1-2。2014.http://cran.r-project.org/package=RColorBrewer.
黄志刚,李志刚,黄志刚。黄酮类色素分子遗传学研究进展。入:编辑格罗特沃尔德E。类黄酮的科学。纽约:施普林格;2006.p . 147 - 73。
Caspi R, Altman T, Dreher K, Fulcher CA, Subhraveti P, Keseler IM,等。代谢途径和酶的MetaCyc数据库和途径/基因组数据库的BioCyc集合。核酸研究,2012;40:D742-D53。
确认
作者对科隆大学生物中心- ms平台所做出的重大贡献表示感谢。感谢您提供种子:M. Koornneef (tt2-1,tt7-1)、魏沙和阿佩尔哈根(tt4-11), A. Lloyd (mybRNAi), ABRC (pap1-D).我们感谢M. Schäfer关于氘化物质和所需分析的讨论,感谢E. von Elert提供他的Thermo Exactive Orbitrap MS和Thomas Sadler对该设备的帮助,感谢B. Welter提供技术援助,感谢S. Metzger对基本LC-MS数据分析的反馈。
资金
这项工作得到了德国科学研究院SFB 680资助M.H.和植物科学卓越集群资助M.H., u.h., M.B. (CEPLAS;EXC 1028)。B.J.得到了IMPRS研究生院的支持。X.Y.由IMPRS研究生院和科隆大学支持。
数据和材料的可用性
所有支持数据都可以在手稿及其附加文件中找到。原始数据可根据合理要求从通讯作者处获得。这两个内部标准都是由A.O.T./ h.g s合成的。并移交给科隆大学Biocenter-MS平台的责任。关于两个内部标准的合成和特性的详细信息可以在手稿和附加文件中找到(附加文件3.. pdf)。
作者的贡献
MB, UH, MH, AS设计项目;项目管理也是如此;MH,正如写作一样;MKU优化LC-MS设置;CL, MKU应用LC-MS设置;CL、MKU、AS表征标准;AOT, H-GS开发方法,执行和验证内部标准综合;XY、AS、UH优化的苗木提取及方法;BJ、AS优化种子提取及方法研究AS做了所有的整合,分析和验证所有的数据; BJ validated data and did statistic analysis using R; all interpreted data and did proof reading. All authors have read and approved the manuscript.
相互竞争的利益
作者宣称他们之间没有利益冲突。
发表同意书
不适用。
伦理批准并同意参与
不适用。
作者信息
从属关系
相应的作者
附加文件
附加文件1:表S1。
优化高吞吐量。外部标准清单;和表S2。转换参数。(PDF 381 kb)
附加文件2:图S1。
水解概念。降低水解后提取物的复杂度;表S3。计算糖基化黄酮类化合物检测的m/z值;表S4。提取的非水解样品中的糖基化黄酮类化合物答:芥种子;表S5。提取的非水解样品中的糖基化黄酮类化合物答:芥幼苗;和表S6。计算选定物质的m/z值。(PDF 174kb)
附加文件3:图S2。
外部和内部标准。外部标准的eic;图S3。氘化、内标的线性度和EICs;表S7。标准品随时间的稳定性和对酸的依赖性,表S8。所选外部标准的精度和线性度;方法1。内部标准综合。(PDF 1682 kb)
附加文件4:图S4。
提取和水解时间。甲醇浓度的选择;图S5。图S4的未调整响应;图S6。不同水解时间处理的种子提取物;表S9。图S4、S5的数据;和表S10。图数据2和图S6。(PDF 1210kb)
附加文件5:图S7。
水解对标准物质的影响。水解对分析黄酮类化合物的影响和图S8。从内标中释放天竺葵素,从天竺葵素中释放花青素。(PDF 493 kb)
附加文件6:图S9。
尽量减少种子的数量。种子材料减少到重复一次;和表S11。图数据4 a、b.(PDF 356 kb)
附加文件8:图S11。
该方法对苗木的适应性。苗木提取物中主要糖化黄酮的水解研究和表S14。图6数据。(PDF 445kb)
附加文件9:表S15。
突变体和引物。本研究使用的突变体和插入系;表S16。底漆;方法2。(PDF 430kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
Jaegle, B., Uroic, M.K, Holtkotte, X.。et al。基于lc - ms的几种种子类黄酮生物合成途径的快速和简单表征。BMC植物生物学16日,190(2016)。https://doi.org/10.1186/s12870-016-0880-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-016-0880-7
关键字
- 花青素
- Proanthocyanidin
- 类黄酮
- 种子
- 幼苗
- 氘化内标
- 质
- 水解
- 拟南芥