- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
钙/钙调素缓解草莓udp -糖基转移酶的底物抑制,该酶参与水果花青素的生物合成gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba16gydF4y2Ba文章编号:gydF4y2Ba197gydF4y2Ba(gydF4y2Ba2016gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
UGT是花青素生物合成的关键酶,它通过催化花青素的糖基化作用增加花青素在植物中的溶解性和积累。之前我们展示了收获前喷洒的氯化钙gydF4y2Ba2gydF4y2Ba通过刺激花青素结构基因的表达增强草莓果实中花青素的积累gydF4y2BaFvUGT1gydF4y2Ba.gydF4y2Ba
结果gydF4y2Ba
为了进一步了解花青素生物合成的调控机制,我们对重组FvUGT1对草莓果实中主要花青素天马草素的糖基化进行了动力学分析。在天马蒿素浓度固定的条件下,FvUGT1基本遵循Michaelis-Menten动力学催化dp -葡萄糖的糖转移。相比之下,在固定的udp -葡萄糖浓度下,超过150 μM的天马草素表现出明显的部分底物抑制作用,且表现为非竞争模式。这些结果表明,糖受体在高浓度下通过结合到除催化位点外的另一个位点来抑制FvUGT1的活性。此外,钙/钙调蛋白可特异性结合FvUGT1与结构域间连接子部分重叠的位点,显著缓解底物抑制。在0.1和0.5 μM钙调素存在时,gydF4y2BaVgydF4y2Ba马克斯gydF4y2Ba分别提高了71.4和327%。gydF4y2Ba
结论gydF4y2Ba
FvUGT1的活性被糖受体底物花青素抑制,钙/钙调素结合到FvUGT1通过减轻底物抑制增强了花青素的积累。gydF4y2Ba
背景gydF4y2Ba
花青素是一类酚类化合物,在植物中作为彩色色素,吸引传粉者或种子传播者[gydF4y2Ba1gydF4y2Ba].花青素还可以保护植物免受病原体和昆虫的攻击以及环境胁迫[gydF4y2Ba2gydF4y2Ba- - - - - -gydF4y2Ba4gydF4y2Ba].此外,膳食摄入的花青素可能有助于预防氧化应激介导的疾病,如癌症和炎症性疾病[gydF4y2Ba5gydF4y2Ba].花青素由查尔酮经类黄酮途径合成。最后一步,花青素的糖基化,由一种依赖于udp的葡萄糖基转移酶(UGT)催化[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].糖基化稳定花青素,从而促进其运输和储存在液泡。在植物中有超过100种ugt,它们可以糖基化各种小分子,如激素、次生代谢物和毒素。大多数负责花青素生物合成的UGTs属于家族1糖基转移酶78亚家族[gydF4y2Ba8gydF4y2Ba].它们通常使用udp -葡萄糖(UDP-Glc)作为糖供体。糖受体因植物种类和器官或组织而异[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].草莓果实中常见的花青素有天竺葵素和花青素[gydF4y2Ba11gydF4y2Ba].所有ugt都包含一个保守的PSPG基序(推测次生植物糖基转移酶)。比较78亚家族中的几个结晶UGTs,如葡萄VtGT1,gydF4y2BaMedicagogydF4y2BaMtUGT78G1和蝴蝶豌豆Ct3GT-A在三维结构上非常保守。两个N端和c端结构域具有类似的Rossmann-like褶皱,在底物结合处形成一个裂缝[gydF4y2Ba12gydF4y2Ba- - - - - -gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
花青素的生物合成受发育和环境信号的调控[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].钙是一种重要的第二信使,在识别外部和内部信号、调节植物生长和发育以及对生物和非生物胁迫的反应中发挥作用[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].细胞钙浓度的变化可以被钙传感器感知和解释。钙调素是一种普遍存在的钙传感器,在与靶蛋白结合时调节其功能[gydF4y2Ba19gydF4y2Ba- - - - - -gydF4y2Ba21gydF4y2Ba].在gydF4y2Ba拟南芥gydF4y2Ba,内源性钙水平的变化可调节蔗糖诱导的糖吸收和调节花青素积累[gydF4y2Ba22gydF4y2Ba].采前喷钙刺激花青素结构基因的表达水平,如二氢黄酮醇4-还原酶(gydF4y2BaDFRgydF4y2Ba)、花青素合酶(gydF4y2Ba答gydF4y2Ba),gydF4y2BaUGTgydF4y2Ba,增加草莓果实中花青素的积累[gydF4y2Ba23gydF4y2Ba].钙调素通过影响蔗糖诱导的糖吸收调节葡萄花青素积累[gydF4y2Ba24gydF4y2Ba,激活类黄酮通路基因[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].葡萄细胞悬浮培养中钙调素丰度的变化与花青素含量有关gydF4y2Ba其中,bettzickianagydF4y2Ba苗(gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].然而,钙/钙调素调节的潜在机制尚不清楚。gydF4y2Ba
草莓是一种经济上重要的蔷薇科作物,富含花青素[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].商业草莓(gydF4y2Ba草莓属x ananassagydF4y2Baduh .)是一个具有复杂遗传背景的八倍体杂交种。相比之下,二倍体林地草莓(gydF4y2Baf . vescagydF4y2Bal . ssp。gydF4y2BavescagydF4y2Ba)身材矮小,生命周期短,基因组测序完整。因此,林地草莓被认为是蔷薇科功能基因组学研究的一个模型系统[gydF4y2Ba29gydF4y2Ba- - - - - -gydF4y2Ba31gydF4y2Ba].最近我们分析了8种ugt的表达模式(gydF4y2BaFvUGT1gydF4y2Ba-gydF4y2Ba8gydF4y2Ba)在不同组织中的78D亚科gydF4y2Baf . vescagydF4y2Ba[gydF4y2Ba23gydF4y2Ba].gydF4y2BaFvUGT1gydF4y2Ba在红系变种果实中特异性表达,而在黄系变种果实中不表达。的表达gydF4y2BaFvUGT1gydF4y2Ba与红果成熟高度相关,钙处理刺激其表达和花青素积累。因此,FvUGT1可能是草莓果实中催化花青素糖基化的主要UGT。本文报道了FvUGT1介导的花青素糖基化的生化特性以及钙调素对酶活性的影响。gydF4y2Ba
结果gydF4y2Ba
FvUGT1的结构特点gydF4y2Ba
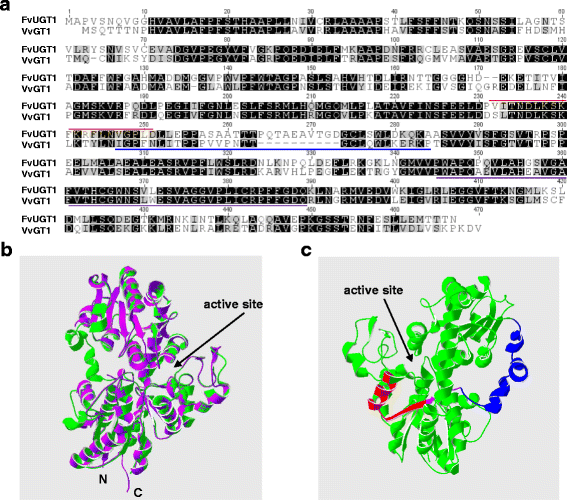
克隆的核苷酸序列gydF4y2BaFvUGT1gydF4y2Ba与预测基因12538-v1.0-ab_initio的同源性最高,为99.4%gydF4y2Baf . vescagydF4y2Ba基因组。它们之间的五种氨基酸差异可能是基因组测序错误和/或错误预测的结果。FvUGT1的氨基酸序列与FaGT1同源性分别为96.6和59.8%gydF4y2Baf . x ananassagydF4y2Ba和VvGT1分别来自葡萄[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].特别是,靠近c端部分的保守PSPG基序可以通过与植物ugt对齐很容易地被识别(图1)。gydF4y2Ba1gydF4y2Ba额外的文件gydF4y2Ba1gydF4y2Ba:图S1)。FvUGT1与UGT78的成员也有很高的同源性gydF4y2Ba1gydF4y2Ba:图S1)。来自这个亚家族的大多数有特征的ugt催化单糖从udp -糖供体转移到糖受体的3号位,如花青素和黄酮醇。gydF4y2Ba
FvUGT1的结构特点。gydF4y2Ba一个gydF4y2Ba.FvUGT1与葡萄VvGT1的氨基酸序列比对。相同和相似的氨基酸用阴影表示gydF4y2Ba黑色的gydF4y2Ba而且gydF4y2Ba灰色gydF4y2Ba,分别。FvUGT1中假定的钙调蛋白结合位点由a标记gydF4y2Ba红色的gydF4y2Ba线。VvGT1中的域间连接器用a标记gydF4y2Ba蓝色的gydF4y2Ba线。保守推定的次生植物糖基转移酶(PSPG)基序有一个下划线gydF4y2Ba紫色的gydF4y2Ba线。gydF4y2BabgydF4y2Ba.FvUGT1 (gydF4y2Ba绿色gydF4y2Ba)基于VvGT1 (gydF4y2Ba紫色的gydF4y2Ba).gydF4y2BacgydF4y2Ba.预测的FvUGT1的三维结构显示了假定的钙调蛋白结合位点的区域(gydF4y2Ba红色的gydF4y2Ba)和域间连接器(gydF4y2Ba蓝色的gydF4y2Ba).钙调蛋白结合位点和结构域间连接子的重叠区域用a表示gydF4y2Ba紫色的gydF4y2Ba线。GenBank的登录号和蛋白来源为FvUGT1 (KP165417;gydF4y2Baf . vescagydF4y2Ba), FaGT1 (AAU09442,gydF4y2BaFgydF4y2Ba.×gydF4y2BaananassagydF4y2Ba)和VtGT1 (AAB81682;葡萄)gydF4y2Ba
进一步根据葡萄VvGT1的三维结构对FvUGT1进行同源建模。FvUGT1的主干与VvGT1的主干匹配良好(图1)。gydF4y2Ba1 bgydF4y2Ba),表明它们的二级和三级结构高度保守。根据VvGT1的晶体结构,投影出FvUGT1的N端和c端结构域形成深裂,成为活性位点。活性位点可能包含两个空腔,作为糖供体和受体的结合位点[gydF4y2Ba12gydF4y2Ba- - - - - -gydF4y2Ba14gydF4y2Ba].域间连接器(aa 245-275)连接n端和c端域。这种植物ugt之间的连接子在长度和序列方面是高度可变的。gydF4y2Ba1gydF4y2Ba和额外的文件gydF4y2Ba1gydF4y2Ba:图S1),通常与酶活性和结构域移动有关[gydF4y2Ba8gydF4y2Ba].这些结果表明,FvUGT1具有UDP-Glc:花青素-3-的所有结构特征gydF4y2BaOgydF4y2Ba-glycosyltransferases。gydF4y2Ba
FvUGT1是一个UDP-Glc:花青素-3-gydF4y2BaOgydF4y2Ba糖基转移酶gydF4y2Ba
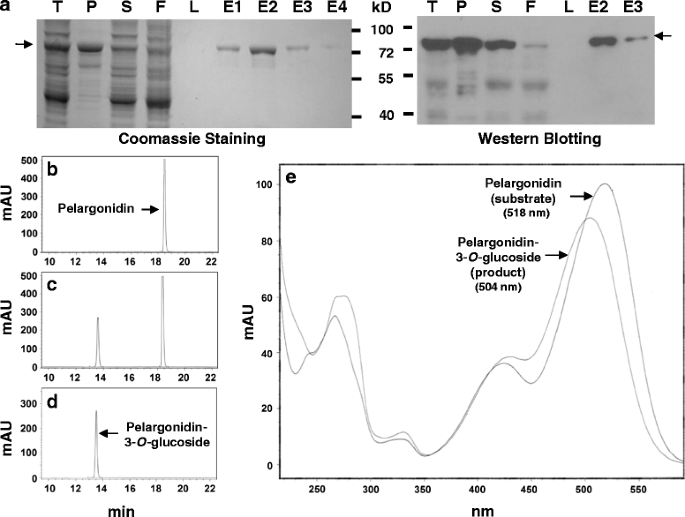
为了证实FvUGT1具有花青素糖基化活性,将融合了N端和C端his -标签的FvUGT1异质表达于gydF4y2Ba大肠杆菌gydF4y2Ba.SDS-PAGE分析表明,可溶性部分出现了一个大小为72kd的主带。这与FvUGT1-His-tag融合蛋白的预测大小相匹配。gydF4y2Ba2gydF4y2Ba).用Ni-NTA柱纯化FvUGT1,使其均匀gydF4y2Ba2gydF4y2Ba),并用抗his抗体的Western blot分析验证。gydF4y2Ba2gydF4y2Ba).同样,我们还纯化了pET32载体中携带的His-tag蛋白,并将其作为所有实验的阴性对照。gydF4y2Ba
重组蛋白FvUGT1的纯化及糖基化活性分析。gydF4y2Ba一个gydF4y2Ba.SDS-PAGE和Western blotting检测结果显示重组蛋白FvUGT1的纯度。SDS-PAGE凝胶用考马斯锡染色gydF4y2Ba蓝色的gydF4y2Ba(左面板)。对抗his -tag抗体进行Western blotting(右图)。T,总细胞裂解液;P,球团;年代,上层清液;F,主要材料;L,最后洗;E1, 2,3,4,第一,第二,第三,第四次洗脱。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba.天竺蒿素(底物)、FvUGT1糖基化反应混合物和天竺蒿素-3-的HPLC色谱图gydF4y2BaOgydF4y2Ba葡萄糖苷(产品)。茂,milli-absorbance单元。gydF4y2BaegydF4y2Ba.天竺葵素(底物)与天竺葵素-3-的重叠紫外吸收光谱gydF4y2BaOgydF4y2Ba葡萄糖苷(产品)gydF4y2Ba
以UDP-Glc和天竺萸素为底物进行初始糖基化活性测定。HPLC-DAD分析表明,原天竺葵素和天竺葵素3-gydF4y2BaOgydF4y2Ba-葡萄糖苷标准品的洗脱时间分别为18.5和13.5 min(图5)。gydF4y2Ba2 b和dgydF4y2Ba).FvUGT1催化的反应在13.5 min时产生峰值。gydF4y2Ba2摄氏度gydF4y2Ba),底物峰在18.5 min。这两个峰与真正的天竺葵素和天竺葵素3-的峰相同gydF4y2BaOgydF4y2Ba葡萄糖苷的标准。与此相吻合的是,FvUGT1反应混合物中产物峰的紫外吸收光谱与正品天马草素3-的紫外吸收光谱非常接近gydF4y2BaOgydF4y2Ba-葡萄糖苷标准品,最大值在504 nm。此外,FvUGT1产品的紫外光谱与真正的天马草素标准品的紫外光谱有很大差异,在518 nm处吸收最大(图1)。gydF4y2Ba2 egydF4y2Ba).FvUGT1也能够使用花青素作为糖受体底物,生成花青素3-gydF4y2BaOgydF4y2Ba-葡萄糖苷(数据未显示)。携带his -标签的pET32载体阴性对照蛋白没有显示任何糖基化活性(数据未显示)。变性的FvUGT1没有表现出HPLC所显示的活性(数据未显示)。这些结果表明FvUGT1是一个gydF4y2Ba善意的gydF4y2BaUDP-Glc: anthocyanidin-3 -gydF4y2BaOgydF4y2Ba糖基转移酶。gydF4y2Ba
FvUGT1对糖供体底物的动力学分析gydF4y2Ba
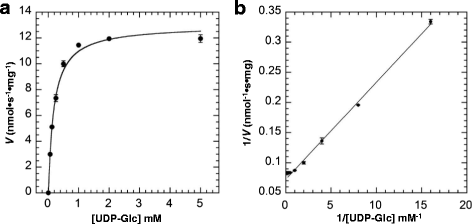
为了研究FvUGT1的酶动力学,我们选择了间接糖基转移酶活性测定法,而不是基于hplc的方法,因为前者的方法高通量,但与后者的方法有相似的结果[gydF4y2Ba33gydF4y2Ba- - - - - -gydF4y2Ba35gydF4y2Ba].在确定FvUGT1的动力学参数之前,我们对反应条件进行了优化,包括反应温度和反应时间。重组蛋白FvUGT1在37℃时活性高于30℃。在时间过程分析中,我们发现产物形成与孵育时间在10-30分钟范围内呈线性正相关,这表明在30分钟内初速度是一致的(数据未显示)。因此,所有的初速度实验都在37℃下进行,持续30分钟。在固定浓度的氯化天竺蒿素(150 μM)下,得到的dp - glc图(图1)。gydF4y2Ba3gydF4y2Ba)遵循经典的Michaelis-Menten动力学(Eq。gydF4y2Ba1gydF4y2Ba),线性Lineweaver-Burk图证明了这一点(图5)。gydF4y2Ba3 bgydF4y2Ba).的gydF4y2BaVgydF4y2Ba马克斯gydF4y2Ba而且gydF4y2BaKgydF4y2Ba米gydF4y2Badp - glc约为12.7 nmol·sgydF4y2Ba−1gydF4y2Ba·毫克gydF4y2Ba−1gydF4y2Ba和201.8 μM。但是,当添加量超过150 μM时,天竺萸素的含量会降低gydF4y2BaVgydF4y2Ba马克斯gydF4y2Ba显著下降,尽管绘图仍然遵循Michaelis-Menten动力学(数据未显示)。可见,高天竺葵素对酶活性有抑制作用。gydF4y2Ba
FvUGT1对糖受体底物的动力学分析gydF4y2Ba
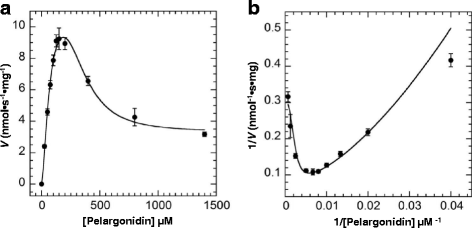
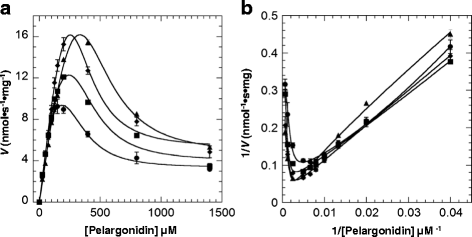
在固定的UDP-Glc (5 mM)条件下,酶活性不表现出经典的Michaelis-Menten动力学。当天竺蒿素含量达到约100 μM时,活性急剧上升;当天竺蒿素含量超过150 μM时,活性急剧下降(图1)。gydF4y2Ba4gydF4y2Ba).如图所示。gydF4y2Ba4 bgydF4y2Ba, Lineweaver-Burk图为非线性。这些结果进一步支持糖受体底物具有抑制作用。然而,反应动力学并不符合典型的底物抑制方程,说明非竞争抑制是不完全的。在使用各种模型拟合我们的数据后,我们发现FvUGT1的动力学与一个修正的Hill方程(Eq。gydF4y2Ba2gydF4y2Ba,当Hill系数gydF4y2BaxgydF4y2Ba设置为3(图。gydF4y2Ba4gydF4y2Ba),表明FvUGT1在非竞争模式下经历了部分底物抑制。请注意,gydF4y2BaxgydF4y2Ba值设为3,以获得与Eq的最佳拟合。gydF4y2Ba2gydF4y2Ba,提示天竺葵素除了活性位点外,可能还有另一个结合位点。gydF4y2Ba
钙调素与FvUGT1结合gydF4y2Ba
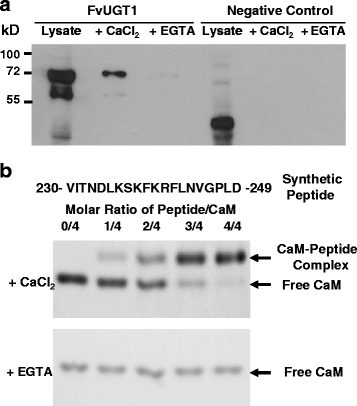
生物信息学分析表明,FaUGT1中可能存在一个钙调蛋白结合位点(a230 - 249),该区域可以形成一个基本的两向性α-螺旋结构,这是一种典型的钙调蛋白结合基序结构。有趣的是,假定的结合位点与结构域间连接子部分重叠。gydF4y2Ba1gydF4y2Ba).为了验证钙调素是否与FvUGT1结合,将含有FvUGT1- his -tag的细菌总蛋白在钙或EGTA存在下与钙调素-琼脂糖珠孵育,用SDS-PAGE进行分区。在钙存在的情况下,使用抗his抗体进行Western blot分析,检测与钙调素-琼脂糖珠结合的FvUGT1-His-tag。gydF4y2Ba5gydF4y2Ba).相比之下,在EGTA存在下孵育时,未检测到FvUGT1带。钙调素珠没有从含有对照蛋白(His-tag)的细菌细胞中拉出任何东西。gydF4y2Ba
钙/钙调素在体外与FvUGT1结合gydF4y2Ba一个gydF4y2Ba.在钙存在的情况下FvUGT1与钙调素-琼脂糖珠共沉淀。总蛋白质(裂解物)gydF4y2Ba大肠杆菌gydF4y2Ba携带pET-FvUGT1-His-tag或阴性对照(pET32)的细胞被应用于钙调素-琼脂糖珠,在1 mM的CaCl存在gydF4y2Ba2gydF4y2Ba或1 mM EGTA。结合在珠子上的蛋白质被洗脱,并用Western blotting对抗his -tag抗体进行分析。gydF4y2BabgydF4y2Ba.凝胶迁移率测定显示,钙/钙调蛋白结合合成的肽段与FvUGT1中钙调蛋白结合区域相对应。合成的肽序列显示在面板的顶部gydF4y2BabgydF4y2Ba.箭头表示游离钙调蛋白和钙调蛋白/肽复合体的位置。凸轮,钙调蛋白gydF4y2Ba
此外,使用凝胶迁移率移位试验来验证FvUGT1中钙调蛋白是否与假定的钙调蛋白结合位点(aa 230-249)特异性结合(图2)。gydF4y2Ba5 bgydF4y2Ba).在钙或EGTA存在的情况下,与FvUGT1上这个位点对应的合成肽与钙调素一起孵育。经天然PAGE分离后,钙调肽复合体在钙的存在下出现。复带强度随肽/钙调素比值的增加而增加。在EGTA存在下孵育后,只观察到游离钙调素带。这些结果表明,钙调蛋白与假定的FvUGT1钙调蛋白结合域以钙依赖的方式相互作用。gydF4y2Ba
钙调素增加FvUGT1的活性gydF4y2Ba
为了确定钙调素结合对酶活性的影响,进一步分析了钙/钙调素存在下FvUGT1的酶促动力学。由于偶联磷酸酶活性测定需要钙,我们只能研究不同钙调素浓度对FvUGT1活性的影响。添加钙调素显著提高了酶活性(图。gydF4y2Ba6gydF4y2Ba),尽管速度与天马草素浓度的关系图仍然表现出底物抑制模式,这可以从非线性Lineweaver-Burk图中得到证明(图1)。gydF4y2Ba6 bgydF4y2Ba).为了获得最佳的拟合,采用gydF4y2BaxgydF4y2Ba值仍为3,说明钙调素与FvUGT1结合并不影响天马草素与附加位点的结合亲和力。在0.1,0.5和2.5 μM钙调素的存在下,明显的gydF4y2BaVgydF4y2Ba马克斯gydF4y2Ba分别提高了71.4%、227%和246%。这些结果表明,钙调蛋白与FvUGT1结合可以部分缓解底物抑制。gydF4y2Ba
FvUGT1动力学表明钙调素可以缓解天马草素的抑制作用。gydF4y2Ba一个gydF4y2Ba.数据拟合到部分非竞争抑制模型(Eq。gydF4y2Ba2gydF4y2Ba).gydF4y2BabgydF4y2Ba.Lineweaver-Burk图显示钙调素并不能完全缓解抑制动力学。凸轮,钙调蛋白。每个点表示三次测定的平均速度+/ - SD (gydF4y2Ba●gydF4y2Ba, 0 μM Calmodulin;■,0.1 μM Calmodulin;♦0.5 μM钙调素;▲,2.5 μM Calmodulin)。反应中UDP-Glc的浓度保持固定(5 mM)gydF4y2Ba
讨论gydF4y2Ba
在花青素生物合成过程中,UGT的糖基化是一种重要的修饰,因为它提高了花青素苷元的溶解性和稳定性,促进了植物细胞液泡中的储存和积累。通常糖基化也是决定天然产物生物活性和生物利用度的主要因素之一[gydF4y2Ba8gydF4y2Ba- - - - - -gydF4y2Ba10gydF4y2Ba].我们之前的研究表明gydF4y2BaFvUGT1gydF4y2Ba为78D亚家族的UGT,与草莓果实成熟过程中花青素积累密切相关,在花青素缺失突变体中不表达[gydF4y2Ba23gydF4y2Ba].在本研究中,我们发现FvUGT1表现出糖基化花青素的活性,当供糖量超过150 μM时,该活性受到糖受体(如天马草素)明显的底物抑制。在其他几种有特征的ugt中也观察到底物抑制[gydF4y2Ba36gydF4y2Ba- - - - - -gydF4y2Ba39gydF4y2Ba].例如,大豆UGT78K1在100 μM浓度下表现出明显的底物抑制作用[gydF4y2Ba36gydF4y2Ba].当黄酮醇底物超过150 μM时,葡萄VtGT6活性受到抑制[gydF4y2Ba38gydF4y2Ba].有趣的是,表现出抑制作用的底物通常是糖受体。因此,糖受体的前馈抑制可能是ugt的普遍现象。gydF4y2Ba
FvUGT1动力学分析表明,描述抑制作用的最佳模型是修正的Hill方程。该方程用于描述多亚基酶(如天冬氨酸氨基酰基转氨酶和D-3磷酸甘油酸脱氢酶)的部分非竞争性底物抑制模型[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].已经观察到一些ugt可以形成同聚寡聚物[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].然而,目前尚不清楚FvUGT1是否形成同寡聚体。然而,根据模型,FvUGT1除了催化位点外,可能还有一个额外的天马草素结合位点。有人认为,在大鼠肝脏的udp -葡萄糖醛酸基转移酶中存在变构调节[gydF4y2Ba44gydF4y2Ba- - - - - -gydF4y2Ba46gydF4y2Ba]和其他哺乳动物ugt(见[gydF4y2Ba47gydF4y2Ba])。以大鼠肝脏UGT为例,ATP和NADPgydF4y2Ba+gydF4y2Ba等显著降低了4-甲基伞形酮UGT活性,而没有与4-甲基伞形酮或udp -葡萄糖醛酸竞争,表明抑制剂与变构位点结合[gydF4y2Ba44gydF4y2Ba- - - - - -gydF4y2Ba46gydF4y2Ba].研究FvUGT1中是否存在变构调控是很有趣的。此外,FvUGT1活性受到植物体内普遍存在的钙传感器钙调素的正向调控。钙/钙调素能够结合FvUGT1(图。gydF4y2Ba5gydF4y2Ba),并通过增加在高浓度天竺蒿素下的表观反应限制速度,显著提高了糖基化活性。同时,gydF4y2BaKgydF4y2Bam值随速度的增大而增大(表2gydF4y2Ba1gydF4y2Ba),表明钙调素是agydF4y2BaVgydF4y2Ba-type的FvUGT1激活剂。虽然gydF4y2BaVgydF4y2Ba型活化并不常见,但在某些酶中观察到[gydF4y2Ba48gydF4y2Ba- - - - - -gydF4y2Ba50gydF4y2Ba].例如,一种名为化合物14的化学物质作为v型激活剂激活谷胱甘肽水解[gydF4y2Ba48gydF4y2Ba].为gydF4y2Ba根癌土壤杆菌gydF4y2Baadp -葡萄糖焦磷酸化酶突变体,VgydF4y2Ba马克斯gydF4y2Ba和KgydF4y2Ba米gydF4y2Ba在丙酮酸激活剂的存在下ATP增加[gydF4y2Ba50gydF4y2Ba].目前还不清楚钙调素结合是如何导致FvUGT1对天马草素活性位点亲和力降低的。然而,钙调素的结合并不影响天麻素与“变构位点”的结合,这表明它们是两个独立的事件。我们注意到,FvUGT1中的钙调蛋白结合位点部分重叠于结构域间连接子(图。gydF4y2Ba1gydF4y2Ba).有人认为,域间连接子对UGT活性的调节至关重要,因为它涉及域移动、活性、口袋形状和域间相互作用[gydF4y2Ba8gydF4y2Ba].由于钙调蛋白通常通过调节靶蛋白的结构变化来调节其功能[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba51gydF4y2Ba],钙调蛋白结合到结构域间连接子区域可能导致FvUGT1构象变化,部分缓解底物抑制。FvUGT1及其底物复合物的进一步结构表征是必要的,以确定是否存在另一个糖受体结合位点,它位于哪里,以及钙调蛋白如何缓解底物抑制。gydF4y2Ba
花青素生物合成是类黄酮途径的一部分,而类黄酮途径又是苯丙素途径的一个主要分支[gydF4y2Ba7gydF4y2Ba].近年来,关于花青素调节基因和结构基因在植物激素、光和蔗糖等发育和环境线索作用下的转录调控途径的研究已经收集了大量的信息[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].已知钙/钙调素参与介导对环境和激素刺激反应的信号转导途径[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba51gydF4y2Ba- - - - - -gydF4y2Ba53gydF4y2Ba].已有研究表明钙/钙调素调节蔗糖诱导的糖摄取[gydF4y2Ba24gydF4y2Ba,类黄酮途径基因的表达[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].我们最近的研究表明,草莓叶面喷钙可以通过刺激花青素结构基因的表达来促进果实中花青素的积累gydF4y2BaFvUGT1gydF4y2Ba[gydF4y2Ba23gydF4y2Ba].本研究揭示了钙调控花青素生物合成的另一途径,即钙调蛋白与FvUGT1结合,从而减轻底物抑制作用。FvUGT1的钙调素结合位点与FaGT1和葡萄VvGT1的钙调素结合位点的对齐显示出高度的相似性gydF4y2Ba1gydF4y2Ba:图S1)。与许多其他植物物种的其他FvUGT1同源序列的比较显示,域间连接子附近的区域在它们的二级结构中也是保守的,尽管它们的一级结构(aa序列)没有显示高度同源性(数据未显示)。人们已经认识到靶蛋白中的钙调素结合基序是不保守的。然而,目标肽通常形成基本的两亲性α-螺旋[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba54gydF4y2Ba].因此,在其他UGT正交图中的域间连接子区域可能包含钙调蛋白靶位点。钙/钙调素可能对其他植物的花青素/类黄酮糖基化具有类似的调控作用。gydF4y2Ba
结论gydF4y2Ba
FvUGT1是草莓花青素糖基化生成花青素的关键酶。FvUGT1活性受负调控和正调控的双重影响。这种负调控是糖受体(花青素苷元)在高浓度下前馈抑制的结果。钙/钙调素结合发挥正调控作用,减轻底物抑制。众所周知,有几种类黄酮是通过类黄酮途径合成的,如花青素、黄酮醇苷和原花青素。它们都在争夺同一个碳源。因此,钙的复杂调控可能使植物协调花青素、黄酮醇和原花青素等的生物合成,以响应环境和发育信号。此外,FvUGT1中钙调蛋白结合位点的识别为通过改变钙调蛋白结合位点来修改FvUGT1的结构/功能提供了机会[gydF4y2Ba55gydF4y2Ba].Du和Poovaiah(2005)通过突变DWF1基因钙调素结合位点上的一到两个氨基酸,培育出了不同高度的植物[DWF1基因负责油菜素类固醇生物合成][gydF4y2Ba56gydF4y2Ba].进一步对FvUGT1进行结构和功能表征,结合钙调素结合位点的位点定向突变分析,将有助于揭示钙/钙调素调节植物花青素生物合成的重要性,以及未来花青素积累代谢工程的潜力。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
二倍体林地草莓(gydF4y2Baf . vescagydF4y2Bassp。gydF4y2BavescagydF4y2Ba)第7代自交系Ruegen F7-4 (RF7-4)由Dr. Slovin [gydF4y2Ba11gydF4y2Ba].植株在26°C的温室中生长,按照正常的栽培方法,昼夜循环为16 h光照和8 h黑暗。果实样本采集自4 ~ 5株成熟植株(花托呈全红色)。采收后,用蒸馏水冲洗果实,立即在液氮中冷冻,保存在- 80°C以备将来使用。gydF4y2Ba
FvUGT1的克隆及生物信息学分析gydF4y2Ba
按照制造商的说明,使用RNeasy Plant Mini Kit (Qiagen, Germantown, MD, USA)从RF7-4成熟水果中提取总RNA。的gydF4y2BaFvUGT1gydF4y2Ba全长开放式阅读架被放大gydF4y2Ba可以gydF4y2BaDNA聚合酶(Invitrogen, Frederick, MD, USA)使用基于GDR草莓基因组数据的基因特异性引物对(ATGGCACCAGTATCAAACCAG/ATTGGTTGTGGTCATTTCCAAC) (gydF4y2Bahttps://www.rosaceae.org/gydF4y2Ba).使用CLC Genomics软件(CLC, Aarhus, Denmark)将FvUGT1氨基酸序列与其他植物ugt进行比对。利用Calmodulin靶数据库(gydF4y2Bahttp://calcium.uhnres.utoronto.cagydF4y2Ba).基于瑞士葡萄品种VvGT1 (pdb编码:2C1Z)的晶体结构,构建了FvUGT1的同源性模型(gydF4y2Bahttp://swissmodel.expasy.orggydF4y2Ba) [gydF4y2Ba13gydF4y2Ba].使用瑞士PDB查看器(gydF4y2Bahttp://spdbv.vital-it.ch/gydF4y2Ba) [gydF4y2Ba57gydF4y2Ba].gydF4y2Ba
FvUGT1蛋白的表达和纯化gydF4y2Ba
的cDNA片段gydF4y2BaFvUGT1gydF4y2Basubcloned进gydF4y2BaKpngydF4y2Ba我和gydF4y2BaBamgydF4y2BapET-32的HI位点(Novagen, Madison, WI, USA)在有N端和c端his -tag的帧中。经过验证的结构被转换为gydF4y2Ba大肠杆菌gydF4y2BaBL21 (DE3)胶质细胞。通过加入0.1 mM异丙基β-D-1-硫代半乳糖吡喃苷(IPTG)诱导重组蛋白的生物合成,并按照制造商的说明使用Ni-NTA Superflow树脂(Qiagen, Germantown, MD, USA)纯化。重组蛋白的存在通过SDS-PAGE和针对抗his抗体(Novagen, Madison, WI, USA)的Western Blot分析确认。用Microcon YM-50色谱柱(Millipore, Billerica, MA, USA)淡化来自馏分2、3和4的重组蛋白,用糖基化活性测试缓冲液(25 mM Tris-HCl, 10 mM CaCl)浓缩1 μg/μlgydF4y2Ba2gydF4y2Ba, pH值7.5)。使用Bradford蛋白测定试剂(Bio-Rad, Hercules, CA, USA)测定蛋白质浓度。来自同一批的重组蛋白被混合并储存在−80°C待进一步使用。gydF4y2Ba
花青素的HPLC-DAD分析gydF4y2Ba
如先前所述,使用Agilent 1100系列系统(Agilent, Technologies, Wilmington, DE, USA)对花青素糖基化生成花青素的HPLC-DAD分析[gydF4y2Ba23gydF4y2Ba].化合物的鉴定主要基于HPLC洗脱时间和吸收光谱(200-650 nm)与从Sigma(美国密苏里州圣路易斯)购买的以下真实标准的比较:天竺葵素,花青素,天竺葵素-3-gydF4y2BaOgydF4y2Ba葡萄糖苷和cyanidin-3 -gydF4y2BaOgydF4y2Ba葡萄糖苷。gydF4y2Ba
Calmodulin-binding降水gydF4y2Ba
钙调素结合沉淀法如所述进行了少量修改[gydF4y2Ba58gydF4y2Ba].简单地说,gydF4y2Ba大肠杆菌gydF4y2Ba过表达his标记的FvUGT1细胞在含有20 mM Tris-HCl (pH 7.5), 150 mM NaCl, 1% trton - x -100和蛋白酶抑制剂鸡尾酒的沉淀缓冲液中裂解(Invitrogen, Frederick, MD, USA)。离心后在20,000gydF4y2BaggydF4y2Ba4℃时,将上清分离到两个管中,每个管中分别含有1 mM的CaClgydF4y2Ba2gydF4y2Ba或1 mM乙二醇四乙酸(EGTA),一种钙螯合剂(Sigma, St. Louis, MO, USA),与Calmodulin-Separopore 4B珠(Bioworld, Atlanta, GA, USA)一起孵育,在125 rpm和4°C的转速下旋转摇晃1小时。珠在750转速下旋转gydF4y2BaggydF4y2Ba然后用沉淀缓冲液和1毫米氯化钙洗涤两次gydF4y2Ba2gydF4y2Ba或1 mM EGTA。通过加入蛋白质负载缓冲液并煮沸3分钟释放与小球结合的蛋白质,然后使用抗his抗体进行Western blot分析(Sigma, St. Louis, MO, USA)。gydF4y2Ba
钙调素结合迁移率移位测定gydF4y2Ba
与FvUGT1中的钙调素结合位点(aa 230-249)相对应的肽由Genemed Synthesis, Inc. (San Antonio, TX, USA)合成。混合(总体积30 μL),含有240 pmol (4 μg)牛钙调素(Sigma, St. Louis, MO, USA)和不同数量的纯化合成肽,100 mm Tris-HCl (pH 7.2),外加1 mm CaClgydF4y2Ba2gydF4y2Ba或1 mM EGTA,室温下孵育1 h。通过非变性PAGE对混合物进行分析,如所述[gydF4y2Ba59gydF4y2Ba].gydF4y2Ba
酶活性测定gydF4y2Ba
使用糖基转移酶活性试剂盒(R&D Systems, Minneapolis, MN, USA)按照制造商说明进行修改,检测FvUGT1活性。分别选择dp - glc和天竺葵素或花青素(Sigma, St Louis, MO, USA)作为葡萄糖的供体和受体底物。在糖基化反应中,一段葡萄糖从UDP- glc转移到花青素上,释放出游离的UDP。随后,用一种特定的磷酸酶从游离UDP中去除无机磷酸盐,并使用孔雀石绿磷酸盐检测试剂定量。糖基化和磷酸酶反应均在反应缓冲液(25 mM Tris-HCl, 10 mM CaCl)中进行gydF4y2Ba2gydF4y2Ba, pH值7.5)在96孔微孔板。为了制备糖供体底物(100 mM的UDP-Glc),将566.3 mg的UDP-Glc溶解在10毫升水中。对于糖受体底物(16.3 mM天竺葵素),我们将5 mg氯化天竺葵素溶解到0.25 ml乙醇中,然后用H稀释到1 mlgydF4y2Ba2gydF4y2BaO. 0.2 μg FvUGT1蛋白用于每个反应,最终体积为50 μl。为了避免低估VgydF4y2Ba马克斯gydF4y2Ba,我们设置一个底物(可以是糖供体dp - glc,也可以是糖受体天竺蒿素氯),并将其固定在饱和浓度良好的状态下。此外,为了确保我们能够获得合适的速度来确定动力学参数,我们在30°C和37°C的几个时间点(15、30和40 min)测量了另一种基质的每种浓度下的初速度。最佳反应温度为37℃。在15和30 min处的初速度在不同浓度底物下产物生成的线性范围内。因此我们选择37℃,30 min作为反应条件。为了评估钙调素的效果,将不同浓度的牛钙调素(Sigma, St Louis, MO, USA)添加到含有5 mM ud - glc和0 - 1400 μM天马草素氯化的反应混合物中。除了FvUGT1外,包含所有其他组件的井作为空白对照。在每个孔中加入孔雀石试剂A和B,开始显色反应,用DTX880 Microplate Reader (Beckman Coulter, Pasadena, CA, USA)在620 nm处读取。用磷酸盐标准曲线测定了620 nm吸光度与无机磷酸盐浓度之间的转换系数。gydF4y2Ba
酶动力学分析gydF4y2Ba
正态动力学数据拟合为Michaelis-Menten方程(Eq。gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
其中[S]为不同底物的浓度,gydF4y2BaVgydF4y2Ba马克斯gydF4y2Ba表示最大反应速率,和gydF4y2BaKgydF4y2Ba米gydF4y2Ba是反应速率减半的底物浓度吗gydF4y2BaVgydF4y2Ba马克斯gydF4y2Ba.gydF4y2Ba
非典型底物抑制数据通过部分非竞争性抑制模型(Eq。gydF4y2Ba2gydF4y2Ba)如所述[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba60gydF4y2Ba]:gydF4y2Ba
情商。gydF4y2Ba2gydF4y2Ba是修正的希尔方程,在哪里gydF4y2BaVgydF4y2Ba我gydF4y2Ba是存在抑制时的反应速度,gydF4y2BaKgydF4y2Ba我gydF4y2Ba是抑制常数,它是将反应的最大速率降低到未抑制值的一半所需的抑制剂浓度,gydF4y2BangydF4y2Ba为希尔系数,且gydF4y2BaxgydF4y2Ba是另一个希尔系数,它允许底物在抑制模式下的结合也可能是合作的。为得到Eq的收敛性。gydF4y2Ba2gydF4y2Ba的价值。gydF4y2BaxgydF4y2Ba固定为一个整数,这是由经验确定的最佳拟合(方差最小)。gydF4y2Ba
所有数据均使用Synergy Software (Eden Prairie, MN, USA)的KaleidoGraph 4.5版本进行分析。动力学参数从至少三个重复得到。使用Student 's软件对各参数进行统计分析gydF4y2BatgydF4y2Ba以及(gydF4y2BaPgydF4y2Ba0.05gydF4y2Ba).gydF4y2Ba
支持数据的可用性gydF4y2Ba
支持本文结果的数据包含在本文和附加文件中。gydF4y2Ba
缩写gydF4y2Ba
- 答:gydF4y2Ba
-
花青素合成酶gydF4y2Ba
- DFR:gydF4y2Ba
-
Dihydroflavonol 4-reductasegydF4y2Ba
- PSPG:gydF4y2Ba
-
推测次生植物糖基转移酶gydF4y2Ba
- UDP-Glc:gydF4y2Ba
-
UDP-glucosegydF4y2Ba
- UGT:,gydF4y2Ba
-
UDP-glucosyltransferasegydF4y2Ba
参考文献gydF4y2Ba
Winkel-Shirley B.类黄酮生物合成。遗传学、生物化学、细胞生物学和生物技术的一个丰富多彩的模型。植物杂志。2001;126(2):485 - 93。gydF4y2Ba
Berli FJ, Moreno D, Piccoli P, heespanhol - viana L, Silva MF, Bressan-Smith R, Cavagnaro JB, Bottini R.脱落酸参与葡萄的反应(gydF4y2Ba葡萄gydF4y2Bal .)简历。Malbec叶组织通过增强吸收紫外线的化合物、抗氧化酶和膜甾醇来抵抗紫外线b辐射。植物细胞环境学报,2010;33(1):1 - 10。gydF4y2Ba
李建勇,Oulee TM, Raba R, Amundson RG, Last RL。拟南芥类黄酮突变体对UV-B辐射高度敏感。植物细胞。1993;5(2):171 - 9。gydF4y2Ba
Mohanta TK, Occhipinti A, Zebelo SA, Foti M, Fliegmann J, Bossi S, Maffei ME, Bertea CM。gydF4y2Ba银杏叶gydF4y2Ba通过激活早期信号和直接防御反应草食。科学通报,2012;7(3),e32822。gydF4y2Ba
何志军,陈晓明。花青素:一种具有健康促进作用的天然着色剂。食品科学学报2010;1:163-87。gydF4y2Ba
植物色素的遗传与生物化学。植物生物学杂志2006;57:761-80。gydF4y2Ba
苯丙烷生物合成。摩尔。2010;3(1):2 - 20。gydF4y2Ba
Osmani SA, Bak S, Moller BL.从晶体结构和同源建模预测植物dp依赖性糖基转移酶的底物特异性。植物化学。2009;70(3):325 - 47岁。gydF4y2Ba
家族1糖基转移酶功能多样性的进化研究。植物j . 2011; 66(1): 182 - 93。gydF4y2Ba
Bowles D, Lim EK, Poppenberger B, Vaistij FE。亲脂性小分子糖基转移酶。植物生物学杂志2006;57:567-97。gydF4y2Ba
孙建华,刘新军,杨培涛,Slovin J,陈鹏。利用uhplc - hrrmsn分析草莓二倍体自交系多酚类物质。食品化学。2014;146:289 - 98。gydF4y2Ba
Hiromoto T, Honjo E, Tamada T, Noda N, Kazuma K, Suzuki M, Kuroki R. udp -葡萄糖:花青素3-的晶体结构gydF4y2BaOgydF4y2Ba葡糖基转移酶的gydF4y2BaClitoria ternateagydF4y2Ba.同步辐射学报,2013;20:894-8。gydF4y2Ba
Offen W, Martinez-Fleites C, Yang M, Kiat-Lim E, Davis BG, Tarling CA, Ford CM, Bowles DJ, Davies GJ。类黄酮糖基转移酶的结构揭示了植物天然产物修饰的基础。Embo j . 2006; 25(6): 1396 - 405。gydF4y2Ba
王XQ。植物天然产物糖基转移酶的结构、机理及工程研究。2月。2009;583(20):3303 - 9。gydF4y2Ba
对水果花青素生物合成调控的新见解。植物学报,2013;18(9):477-83。gydF4y2Ba
Carbone F, Preuss A, De Vos RCH, D 'Amico E, Perrotta G, Bovy AG, Martens S, Rosati C.发育、遗传和环境因素影响草莓果实中类黄酮基因、酶和代谢物的表达。植物细胞环境学报2009;32(8):1117-31。gydF4y2Ba
DeFalco TA, Bender KW, sneden WA。破解密码:CagydF4y2Ba2 +gydF4y2Ba植物信号传感器。j . 2010; 425:27-40。gydF4y2Ba
Reddy ASN, Ali GS, Celesnik H, Day IS。应对压力:钙和钙/钙调蛋白调节基因表达的作用植物细胞。2011;23(6):2010 - 32。gydF4y2Ba
布彻N, Yellin A, sneden WA, Fromm H.植物特异性钙调素结合蛋白。植物生物学2005;56:45 - 66。gydF4y2Ba
普瓦雅BW,杜丽青,王兆宏,杨涛。钙/钙调素介导的植物-微生物相互作用信号的研究进展。植物杂志。2013;163(2):531 - 42。gydF4y2Ba
植物钙信号通路中的钙调蛋白和钙调蛋白样蛋白。Biochimie。2011;93(12):2048 - 53年。gydF4y2Ba
申德华,崔明明,李hk,赵敏,崔雪生,崔刚,朴毅。拟南芥中钙依赖性蔗糖摄取与花青素生物合成的糖信号有关。中国生物医学工程学报(英文版);2013;gydF4y2Ba
徐伟,彭辉,杨涛,Whitaker B,黄亮,孙杰,陈萍。钙对草莓果实类黄酮途径基因表达和花青素积累的影响。植物生理与生物化学,2014;82:289-98。gydF4y2Ba
Lecourieux F, Kappel C, Lecourieux D, Serrano A, Torres E, Arce-Johnson P, Delrot S.葡萄中糖转运和信号传递的最新进展。中国生物医学工程学报(英文版);2014;gydF4y2Ba
葡萄二氢黄酮醇还原酶基因的表达及其启动子区分析。中国科学(d辑:自然科学版)2002;gydF4y2Ba
Vitrac X, Larronde F, Krisa S, Decendit A, Deffieux G, Merillon JM。糖感与钙gydF4y2Ba2 +gydF4y2Ba钙调蛋白要求gydF4y2Ba葡萄gydF4y2Ba细胞生产花青素。植物化学,2000;53(6):659 - 65。gydF4y2Ba
王长泉,赵烨峰,陶丽。钙调素和钙的活性变化gydF4y2Ba2 +gydF4y2Ba- atp酶在低温诱导花青素积累过程中的作用gydF4y2Ba其中,bettzickianagydF4y2Ba.杂志杆菌。2005;124(2):260 - 6。gydF4y2Ba
Giampieri F, Tulipani S, Alvarez-Suarez JM, Quiles JL, Mezzetti B, Battino M.草莓:成分、营养质量和对人类健康的影响。营养。2012;28(1):9-19。gydF4y2Ba
Shulaev V, Sargent DJ, Crowhurst RN, Mockler TC, Folkerts O, Delcher AL, Jaiswal P, Mockaitis K, Liston A, Mane SP,等。林地草莓的基因组(gydF4y2Ba草莓属vescagydF4y2Ba).43 Nat麝猫。2011;(2):109 - 16。gydF4y2Ba
Slovin JP, Schmitt K, Folta KM。二倍体草莓的近交系gydF4y2Ba草莓属vescagydF4y2Baf。gydF4y2BasemperflorensgydF4y2Ba用于基因组和分子遗传学研究gydF4y2Ba蔷薇科gydF4y2Ba.工厂方法。2009;5:15。gydF4y2Ba
金曙华,申德华,崔荣荣,schulz - gahmen U,陈松,金瑞。结构基因组学中基于结构的功能推断。结构功能基因组学杂志。2003;4(2-3):129-35。gydF4y2Ba
Griesser M, Hoffmann T, Bellido ML, Rosati C, Fink B, Kurtzer R, Aharoni A, Munoz-Blanco J, Schwab w草莓果实成熟过程中通过下调花青素糖基转移酶重定向黄酮生物合成植物杂志。2008;146(4):1528 - 39。gydF4y2Ba
D’urzo N, Malito E, Biancucci M, Bottomley MJ, Maione D, Scarselli M, Martinelli M.难辨梭菌毒素A糖基转移酶结构域与Mn2+和UDP结合,为糖基转移酶活性和产物释放提供了深刻的见解。2月j . 2012; 279(17): 3085 - 97。gydF4y2Ba
琼斯MB,奥斯瓦尔德DM,乔希S,怀特哈特SW,奥兰多R,科布BA。独立于b细胞的IgG唾液化。中国生物医学工程学报(自然科学版),2016;29(6):557 - 557。gydF4y2Ba
吴志林,Ethen CM, Prather B, Machacek M,蒋伟。通用磷酸酶偶联糖基转移酶检测。糖生物学。2011;21(6):727 - 33所示。gydF4y2Ba
黑豆种皮中一种dp -葡萄糖类黄酮3- o -葡萄糖基转移酶的功能表征(gydF4y2Ba大豆gydF4y2Ba(l)稳定)。植物化学,2010;71(11 - 12):1253 - 63。gydF4y2Ba
Nagatoshi M, Terasaka K, Owaki M, Sota M, Inukai T, Nagatsu A, Mizukami H. UGT75L6和UGT94E5介导藏红花素向藏红花素的顺序糖基化gydF4y2Ba栀子gydF4y2Ba.586年2月。2012;(7):1055 - 61。gydF4y2Ba
小野E,本马Y,堀川M,国菅-土井S,井井H,高桥S,河合Y,石黑M,福井Y,中山t。葡萄黄酮醇苷多样性中糖基转移酶的功能分化(gydF4y2Ba葡萄gydF4y2Ba).植物细胞。2010;22(8):2856 - 71。gydF4y2Ba
Saleh NAM, Poulton JE, Grisebach H. udp -葡萄糖-花青素3-gydF4y2BaOgydF4y2Ba-葡萄糖基转移酶从红甘蓝幼苗。植物化学,1976;15(12):1865 - 8。gydF4y2Ba
Burton RL, Chen S, Xu XL, Grant GA。结核分枝杆菌d -3-磷酸甘油酸脱氢酶底物抑制的新机制。中国生物化学杂志2007;282(43):31517-24。gydF4y2Ba
LiCata VJ, Allewell NM。底物抑制是天门冬氨酸氨基酰基转氨酶变构的结果吗?Biophys化学1997;64(1 - 3):225 - 34。gydF4y2Ba
Hashimoto K, Madej T, Bryant SH, Panchenko AR.同源寡聚物的功能状态:从糖基转移酶进化的认识。中华分子生物学杂志2010;399(1):196-206。gydF4y2Ba
糖基转移酶复合物的形成及其生物学意义。糖苷学报。2006;18(101):209-30。gydF4y2Ba
石井勇,安K,西村勇,山田华。ATP作为UGT的内源性抑制剂:对UGT潜伏期的新认识。中国药学杂志,2012;40(11):2081-9。gydF4y2Ba
Nishimura Y, Maeda S, Ikushiro S, Mackenzie PI, Ishii Y, Yamada H.腺嘌呤核苷酸和相关物质对ud -葡萄糖醛酸基转移酶的抑制作用:结构效应关系和变构机制的证据。Bba-Gen科目。2007;1770(11):1557 - 66。gydF4y2Ba
布吕尼S,张TMS。肝细胞葡萄糖醛酸基转移酶的动力学研究:一种变构酶的证据。Artif细胞血液杂志1999;27(4):343-56。gydF4y2Ba
尿苷二磷酸葡萄糖醛酸基转移酶的转录后调控。2015;11(6): 949-65。gydF4y2Ba
Wickham S, Regan N, West MB, Thai J, Cook PF, Terzyan SS, Li PK, Hanigan MH.人γ -谷氨酰转肽酶的抑制:更有效的、生理相关的、非竞争性抑制剂的开发。j . 2013; 450(3): 547 - 57。gydF4y2Ba
Kruep DA, Dunaway GA。磷酸果糖激酶调节因子的性质。中国生物化学学报,1984;35(2):533 - 533。gydF4y2Ba
Gomez-Casati DF, Igarashi RY, Berger CN, Brandt ME, Iglesias AA, Meyer CR.用谷氨酸扫描诱变法鉴定农杆菌adp -葡萄糖焦磷酸化酶中功能重要的氨基末端精氨酸。Biochemistry-Us。2001; 40(34): 10169 - 78。gydF4y2Ba
杨TB, Poovaiah BW。植物钙/钙调素介导的信号网络。植物学报,2003;8(10):505-12。gydF4y2Ba
杨涛,彭辉,包灿。番茄钙调素基因家族在果实发育和成熟过程中的功能分析。园艺杂志2014;1:14057。gydF4y2Ba
彭辉,杨涛,朱力克。机械损伤对钙调蛋白基因表达的影响gydF4y2Ba葡萄孢菌gydF4y2Ba番茄果实的感染。植物。2014;3:427-41。gydF4y2Ba
钙调素的作用:目标识别和激活机制的多样性。细胞。2002;108(6):739 - 42。gydF4y2Ba
Yang TB, Du LQ, Poovaiah BW。通过操纵钙/钙调素结合结构域来重新设计蛋白质的概念,以改造植物的性状。功能植物学报2007;34(4):343-52。gydF4y2Ba
Du LQ, Poovaiah BW。CagydF4y2Ba2 +gydF4y2Ba/钙调素是油菜素内酯生物合成和植物生长的关键。大自然。2005;437(7059):741 - 5。gydF4y2Ba
基弗F,阿诺德K,昆兹利M, Bordoli L, Schwede T.瑞士模型库和相关资源。核酸学报2009;37:D387-92。gydF4y2Ba
帕特尔·金RS,戈巴育克·奥,武部S,金SM。鞭毛径向辐条包含CagydF4y2Ba2 +gydF4y2Ba-刺激核苷二磷酸激酶。分子生物学细胞。2004;15:3891-902。gydF4y2Ba
杨TB, Poovaiah BW。钙/钙调素参与生长素作用的分子和生化证据。中国生物化学杂志2000;275(5):3137-43。gydF4y2Ba
Pastra-Landis SC, Evans DR, Lipscomb WN。pH值对大肠杆菌天门冬氨酸氨基转氨酶协同行为的影响。中国生物医学工程学报,1998;29(4):369 - 369。gydF4y2Ba
确认gydF4y2Ba
作者要感谢Ernest Paroczay的技术支持,以及Jane Slovin提供的草莓种子。FvUGT1的GenBank登录号为KP165417。gydF4y2Ba
资金gydF4y2Ba
本研究由美国农业部- ars NP306项目资助。8042 - 43000 - 012 - 00 - d。gydF4y2Ba
作者的贡献gydF4y2Ba
HP进行了克隆、蛋白纯化和酶动力学实验并进行了分析,并撰写了手稿草稿。LS和JF进行了生物信息学分析和钙调素结合实验。BW进行和分析了HPLC实验,并编辑了整个手稿。TY构思和协调了这项研究并撰写了论文。所有作者审阅了结果并批准了最终版本的手稿。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明,他们与本文的内容没有任何利益冲突。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的文件gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
FvUGT1与其他6种植物ugt的氨基酸序列比对。颜色和强度的变化表明保护水平的差异。深红和深蓝分别代表最高和最低的保守水平。α螺旋和β链用黑线标出。推测的次生植物糖基转移酶(PSPG)基序用红线标出,PSPG基序的10个保守的糖供体相互作用残基用黑色实心三角形标记。FvUGT1中假定的钙调蛋白结合区域用一个黑色的打开框表示。GenBank的登录号或蛋白质来源为FvUGT1 (KP165417;gydF4y2Baf . vescagydF4y2Ba), VtGT1 (AAB81682;葡萄),FaGT1 (AAU09442;gydF4y2BaFgydF4y2Ba.×gydF4y2BaananassagydF4y2Ba), Ct3GT (BAF49297;gydF4y2Bac . ternateagydF4y2Ba), MtUGT78G1 (A6XNC6.1;gydF4y2Bam . truncatulagydF4y2Ba), AtUGT72B1 (Q9M156.1;gydF4y2Ba答:thialianagydF4y2Ba), MtUGT71G1 (AAW56092.1;gydF4y2Bam . truncatulagydF4y2Ba)和MtUGT85H2 (2PQ6_A;gydF4y2Bam . truncatulagydF4y2Ba).(PDF 787 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用署名4.0国际许可协议发布(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。创作共用公共领域奉献放弃书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条提供的资料。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
彭浩,杨涛,惠特克,B.D.gydF4y2Baet al。gydF4y2Ba钙/钙调素缓解草莓udp -糖基转移酶的底物抑制,该酶参与水果花青素的生物合成。gydF4y2BaBMC植物杂志gydF4y2Ba16,gydF4y2Ba197(2016)。https://doi.org/10.1186/s12870-016-0888-zgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-016-0888-zgydF4y2Ba
关键字gydF4y2Ba
- 草莓属vescagydF4y2Ba
- 天竺葵色素gydF4y2Ba
- 钙信号gydF4y2Ba
- UGTgydF4y2Ba
- 酶动力学gydF4y2Ba