- 方法论的文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
基于生物传感器的玉米叶片谷氨酰胺在静脉水平分辨率上的空间和发育映射,以响应不同氮速率和吸收/同化持续时间gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba16gydF4y2Ba,文章号:gydF4y2Ba230gydF4y2Ba(gydF4y2Ba2016gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
氨基酸谷氨酰胺(Gln)是根吸收后氮在脉管系统中的主要运输形式,对玉米和其他谷物的生长位置/时间至关重要。分析化学方法不允许gydF4y2Ba原位gydF4y2BaGln分析,包括血管网络的可视化。它们的成本和组织要求是探索Gln动力学复杂性的障碍。我们之前报道过一种生物传感器,gydF4y2BaGlnLuxgydF4y2Ba这种方法可以用少量的组织廉价地测量Gln的相对水平。gydF4y2Ba
结果gydF4y2Ba
在不同摄取/同化时间下,给玉米幼苗施氮量不同,然后对> 1500个叶盘提取物进行分析。允许的第二种技术gydF4y2Ba原位gydF4y2Ba所有叶片同时采样的Gln成像。我们证明了多因素相互作用控制Gln的积累,包括每片叶片内的位置(中外侧/近端)、叶片沿茎轴的位置、N速率和摄取时间。gydF4y2Ba原位gydF4y2Ba首次在叶脉中成像局部Gln。一个新的假设是叶片Gln可能沿着优先的血管路径流动,例如响应机械损伤或代谢需求。gydF4y2Ba
结论gydF4y2Ba
的gydF4y2BaGlnLuxgydF4y2Ba技术实现了所有植物中Gln相对积累的最详细的地图,以及第一个关于Gln的报告gydF4y2Ba原位gydF4y2Ba静脉级分辨率的Gln。这项技术可以以类似的方式应用于任何植物物种。gydF4y2Ba
背景gydF4y2Ba
氮(N)约占植物干物质的2%,是植物最重要的营养物质[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].氮对氨基酸、蛋白质、核酸、叶绿素和次生代谢产物的生物合成至关重要,这些都是必需的大分子[gydF4y2Ba3.gydF4y2Ba].植物根系主要以铵(NH)的形式吸收氮gydF4y2Ba4gydF4y2Ba+gydF4y2Ba)或硝酸盐(NOgydF4y2Ba3.gydF4y2Ba−gydF4y2Ba).无gydF4y2Ba3.gydF4y2Ba−gydF4y2Ba部分还原为NHgydF4y2Ba4gydF4y2Ba+gydF4y2Ba硝酸还原酶和亚硝酸盐还原酶(NR, NiR)的结合。免费的NHgydF4y2Ba4gydF4y2Ba+gydF4y2Ba然后通过谷氨酰胺合成酶(GS)/GOGAT循环被同化为氨基酸池,并用于各种各样的生物过程,包括在年轻的、膨胀的组织中合成蛋白质[gydF4y2Ba1gydF4y2Ba].在玉米方面(gydF4y2Ba玉米gydF4y2BaL.),氮同化发生在与其他物种相似的根和芽中[gydF4y2Ba4gydF4y2Ba- - - - - -gydF4y2Ba7gydF4y2Ba],并视乎环境情况而定[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].主要同化氨基酸之一谷氨酰胺(Gln)在根部施氮后,表现为硝酸盐和/或铵,叶片含量立即迅速增加,浓度根据发育阶段而有显著差异[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].因此,Gln的浓度和定位可以作为研究氮同化发育依赖动态的方便代理[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].gydF4y2Ba
虽然许多关于氮吸收和同化的研究都是在整块地的尺度上进行的[gydF4y2Ba13gydF4y2Ba- - - - - -gydF4y2Ba16gydF4y2Ba]或植物鳞片[gydF4y2Ba17gydF4y2Ba- - - - - -gydF4y2Ba20.gydF4y2Ba],对个体组织内N的空间、发育和时间动态的研究有限。特别是,玉米幼枝组织中氮动态的高分辨率代谢图谱极其稀缺。玉米的茎部包含了一个完整的发育梯度,依次形成叶片[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba],并且在任何时间点,同一株植物的叶子都具有不同的年龄,对应于出现的顺序,最低的叶子是最古老的叶子[gydF4y2Ba21gydF4y2Ba].此外,叶生长发生在两个维度上,沿近远轴和中外侧轴。在玉米中,沿着叶轴的近远端生长基本发生:年轻的下沉组织在叶片基部(叶舌)附近开始,并向叶尖分化[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].玉米的中外侧轴围绕中脉两侧对称。额外的纵向静脉平行于中静脉,并由较窄的横向静脉相互连接[gydF4y2Ba25gydF4y2Ba].在被根系吸收后,氮和同化物通过这些发育和空间梯度随时间被运输,部分利用静脉网络。gydF4y2Ba
近年来,几位作者在单个玉米叶片中沿着一维基瓣梯度漂亮地描述了代谢、蛋白质组和转录组的变化[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].这些研究利用分析化学技术检验氮同化物[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].这些分析方法的一个局限性是它们不允许gydF4y2Ba原位gydF4y2Ba代谢物的空间分析,因此提供有限的二维空间分辨率,并忽略了关键的静脉网络。此外,当根系吸收氮时,氮化物的积累不仅取决于组织内的二维空间梯度,还取决于组织的位置和年龄(生长与成熟)、与其他源/库组织的关系、有效氮浓度以及吸收、同化和迁移的时间[gydF4y2Ba3.gydF4y2Ba].阐明这些多因素相互作用将需要简单、低成本和需要最少组织的诊断技术,以便能够测量Gln和其他N同化物的数千个数据点。gydF4y2Ba
全细胞生物传感器是经过工程改造的微生物,可检测分析物,放大信号并发出可测量的输出,如荧光或发光[gydF4y2Ba28gydF4y2Ba].之前,我们报道了一种Gln生物传感器,命名为gydF4y2BaGlnLux,gydF4y2Ba基于gydF4y2Ba大肠杆菌gydF4y2Ba谷氨酰胺营养不足型,当外源提供游离谷氨酰胺时发光[gydF4y2Ba12gydF4y2Ba].我们证明了当gydF4y2BaGlnLuxgydF4y2Ba当细胞暴露于玉米组织提取物中的Gln时,由于构成性表达的存在,它们会繁殖并释放光子gydF4y2Ba勒克斯gydF4y2Ba操纵子。光子可以用光度计测量。我们证明了gydF4y2BaGlnLuxgydF4y2Ba玉米叶盘提取物的产量与高效液相色谱(HPLC)测定Gln高度相关[gydF4y2Ba12gydF4y2Ba].该技术对< 1 nM的Gln很敏感,这表明它可以使用96孔板进行精确、高通量的Gln映射。对Gln成像gydF4y2Ba原位gydF4y2Ba直接从整个器官取出,它们可能会被冻融,导致Gln因细胞损伤而泄漏,并放置在琼脂上预先嵌入gydF4y2BaGlnLuxgydF4y2Ba细胞(gydF4y2BaGlnLuxgydF4y2Ba琼脂)。这一策略确保了组织表面与生物传感器细胞的平等接触,而不是直接结合,这是不切实际的。光子从生物传感器细胞释放到植物细胞附近,然后使用光子捕获电荷耦合装置(CCD)相机对植物细胞进行成像[gydF4y2Ba12gydF4y2Ba].gydF4y2Ba
这项研究的主要目的是使用gydF4y2BaGlnLuxgydF4y2Ba利用生物传感器技术,对玉米叶片Gln在不同氮素速率和吸收/同化持续时间下的空间和发育梯度进行详细绘制。第二个目标是确定是否gydF4y2BaGlnLuxgydF4y2Ba原位gydF4y2Ba成像可达到叶脉水平的分辨率。gydF4y2Ba
方法gydF4y2Ba
植物生长条件gydF4y2Ba
玉米gydF4y2BaL. hybrid CG60 X CG102 [gydF4y2Ba29gydF4y2Ba所有实验都使用种子。种子在70%乙醇溶液中浸泡4分钟,4% NaClO浸泡2分钟,然后在无菌双蒸馏H中洗涤5次gydF4y2Ba2gydF4y2BaO.种子在Turface®(Profile Products, Buffalo Grove, USA)的18个细胞(每个细胞2个,8.5×8.5×9 cm)生长盘中发芽,Turface®是一种具有极低背景氮(N)水平的烘烤粘土砂砾。在先前的实验中[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba]砾石含氮0.053%,其中只有一小部分可供植物吸收;用Turface®碎石浸泡24小时的无氮营养液中总氮含量仅为1.42 mg/L,相当于0.1 mM。生长平面放置在含有2 L ddH的塑料次灌溉托盘(51×25.5×6 cm)中gydF4y2Ba2gydF4y2Ba没有额外的营养萌发时,将培养盘初始放置在室温下实验室柜中,黑暗中直至植株出苗,然后将培养盘稀释至每个细胞一株,再将培养盘布置在生长条件为28°C/20°C昼夜(16 h/8 h)的温室中,用1000w高压钠灯和1000w金属卤化物灯辅以GroLux灯泡,平均光强范围为803 ~ 1026 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba(中午林冠高度)。每天随机抽取植株,用ddH浇灌gydF4y2Ba2gydF4y2Ba如有需要。gydF4y2Ba
叶盘提取物中谷氨酰胺的相对测定gydF4y2Ba
播后12天(DAS),次灌盘清空剩余ddHgydF4y2Ba2gydF4y2Ba为植物提供六种不同的改性霍格兰营养液中的一种,其中包括0.1 mM KgydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba, 1.0 mM KCl, 2 mM KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 1 mM MgSOgydF4y2Ba4gydF4y2Bah·7gydF4y2Ba2gydF4y2BaO, 0.03 g/L螯合微量营养素(10046,Plant Products, Leamington, Canada)和0、2、5、10、15或20 mM总N作为NH提供gydF4y2Ba4gydF4y2Ba没有gydF4y2Ba3.gydF4y2Ba.每种营养液(1.5 L)倒入分灌盘,并在每株植株基部附近再加30 ml。gydF4y2Ba
在施肥后的不同时间点(1、6、18、12和24小时;分别从上午9:30、2:30、8:30、2:30和8:30开始),根据叶片1、2和3的出苗顺序对其进行取样。叶片组织圆盘(直径6.35 mm)用手打孔工具(235270975,Fiskar’s Brands Inc., Middleton, USA)沿叶脉中部等距收获,从叶舌区延伸到叶1和叶2的叶尖。由于叶片3仍在扩张,收获的叶盘从叶片出轮处一直延伸到叶尖。所有组织立即在氮液中冷冻gydF4y2Ba2gydF4y2Ba−80℃保存。叶1、叶2、叶3分别收获3、5、4个不同位置。每次时间/氮组合取样4株植物(重复),并在独立试验中重复进行信息最丰富的处理。gydF4y2Ba
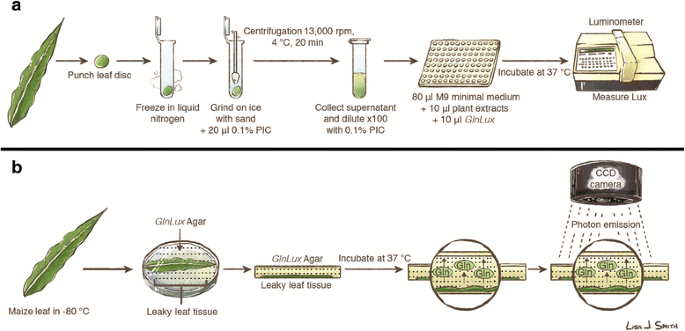
对叶片组织盘进行谷氨酰胺(Gln)含量测定gydF4y2BaGlnLuxgydF4y2Ba上文所述的生物传感器[gydF4y2Ba12gydF4y2Ba,并进行了一些修改(图;gydF4y2Ba1gydF4y2Ba).叶盘在无菌沙和20 μl 0.1%冷冻蛋白酶抑制鸡尾酒(PIC) (P9599-1ml, Sigma-Aldrich, St. Louis, USA)的混合物中用颗粒研锤均质,离心(型号5415R, Eppendorf, Hauppauge, USA;4°C, 20分钟,13 200转)。将得到的植物组织提取物上清液在0.1% PIC中稀释100倍,并在−20°C下保存过夜,直到分析。gydF4y2Ba
有关gydF4y2BaGlnLuxgydF4y2Ba协议。概述gydF4y2BaGlnluxgydF4y2Ba用叶片冲孔的提取物培养的液体试验gydF4y2BaGlnLuxgydF4y2Ba生物传感器细胞在96孔板中,并使用光度计测量(gydF4y2Ba一个gydF4y2Ba).概述gydF4y2BaGlnLuxgydF4y2Ba原位gydF4y2Ba影像化验(gydF4y2BabgydF4y2Ba).叶片在−80℃冷冻,在室温下解冻30 s,导致Gln泄漏。叶子被压在预先嵌入的琼脂上gydF4y2BaGlnLuxgydF4y2Ba细胞,简称为gydF4y2BaGlnLuxgydF4y2Ba琼脂。平板倒置,孵育2.5小时,然后使用发光成像系统成像1000秒。PIC,蛋白酶抑制鸡尾酒。图片由丽莎·史密斯(圭尔夫大学)提供,可以在创作共用许可下重新使用gydF4y2Ba
与此同时,gydF4y2BaGlnLuxgydF4y2Ba生物传感器细胞在Luria肉汤(LB)中培养16小时(37°C),震动(245 rpm)。然后将生物传感器细胞制成颗粒(2500 rpm, 10分钟),用M9最小生长培养基(DF0485170, BD,美国)洗涤三次。细胞重新悬浮在M9培养基中(ODgydF4y2Ba595gydF4y2Ba= 0.025)并孵育16小时(37°C, 245 rpm)以消耗内源性Gln。在培养基中分别添加50 μg/ml卡那霉素和100 μg/ml卡本西林gydF4y2BaGlnLuxgydF4y2Ba包含菅直人gydF4y2BargydF4y2Ba和安保gydF4y2BargydF4y2Ba抗性基因[gydF4y2Ba12gydF4y2Ba].gydF4y2Ba
各叶盘提取物(10 μl)配以10 μl制备gydF4y2BaGlnLuxgydF4y2Ba细胞和80 μl M9置于白色平底96孔板中(07-200-589,Corning Inc., Corning, USA)。在96孔板上添加10 μl 0.1% PIC作为阴性对照,对发光数据进行减法归一化。培养板孵育2小时以激活生物传感器,然后使用96孔发光计(MicroLumatPlus, Berthold Technologies, Bad Wildbad, Germany)定量发光输出(37°C,每孔捕获1 s光子)。gydF4y2Ba
归一化光度计数据(原始输出-阴性对照)与氮吸收/同化持续时间和氮施用量作对比。用ROUT识别并去除异常值,Q = 1% [gydF4y2Ba32gydF4y2Ba].均值与Holm-Šídák方法比较[gydF4y2Ba33gydF4y2Ba- - - - - -gydF4y2Ba35gydF4y2Ba],或Dunnett的多重均值比较[gydF4y2Ba36gydF4y2Ba)gydF4y2BaPgydF4y2Ba< 0.05如图例所示。当数据显示出非正态性时,使用Kruskal-Wallis检验和Dunn的多重均值比较,与Bartlett检验相同[gydF4y2Ba37gydF4y2Ba- - - - - -gydF4y2Ba39gydF4y2Ba].所有统计分析均采用GraphPad Prism 6 (GraphPad Software Inc., San Diego, USA)进行。gydF4y2Ba
生成whole-leafgydF4y2Ba原位gydF4y2Ba游离谷氨酰胺的图像gydF4y2Ba
如上所述,在12 DAS时,次灌盘清空剩余的ddHgydF4y2Ba2gydF4y2Ba然后向植物提供0或20毫米总氮(NH)gydF4y2Ba4gydF4y2Ba没有gydF4y2Ba3.gydF4y2Ba)作为改良的霍格兰营养液(如上所述)提供。同样,在每个分灌盘中倒入1.5 L营养液,每株植株基部倒入30 ml。gydF4y2Ba
在N吸收/同化1小时(上午9:30开始)、12小时(晚上8:30和24小时(上午8:30)后收获叶片。叶1的收获包括在叶舌处切除整片叶。对于较年轻的叶子,由于叶舌还没有发育出来,叶子2和3从叶片卷曲到茎的地方被切掉。每个处理组合采集3个重复,立即在氮液中冷冻gydF4y2Ba2gydF4y2Ba,并保存在−80°C,直到成像。gydF4y2Ba
玉米叶片组织中游离谷氨酰胺的图像gydF4y2BaGlnLuxgydF4y2Ba上文所述的固体琼脂培养基[gydF4y2Ba12gydF4y2Ba,并进行了修改(图;gydF4y2Ba1 bgydF4y2Ba).简单地说,gydF4y2BaGlnLuxgydF4y2Ba生物传感器细胞在添加0.2 mM Gln、4.0 mM葡萄糖、50 μg/ml卡那霉素和100 μg/ml卡本西林的LB肉汤中培养16 h(37°C, 245 rpm)。然后将细胞离心(2500 rpm, 10分钟),重新悬浮在0.01 M磷酸钾缓冲液(pH 7.0)中,并再洗涤两次。细胞悬浮于M9培养基中(ODgydF4y2Ba595gydF4y2Ba1.0)。gydF4y2BaGlnLuxgydF4y2Ba结合琼脂固体培养基gydF4y2BaGlnLuxgydF4y2Ba用含有10 g/L Bacto琼脂的浓缩M9培养基(10% v/v)培养(预冷至42°C),并将混合物倒入无菌150×15 mm培养皿中。gydF4y2BaGlnLuxgydF4y2Ba固体琼脂培养基板在使用前在4°C保存过夜。冷冻叶片在室温下解冻30 s后压入gydF4y2BaGlnLuxgydF4y2Ba琼脂(室温预培养)。底片倒置,孵育(37°C, 2.5 h),用电荷耦合器件(CCD)芯片相机(7383-0007,普林斯顿仪器,特伦顿,美国)预冷却至−100°C,曝光1000秒成像。板的孵育和成像是交错的,以确保重复的条件是恒定的。但是,要消除微小孵育时间差异(以秒为单位)的潜在影响gydF4y2Ba原位gydF4y2Ba在WinView (version 2.5.16.5, Princeton Instruments, Trenton, USA)中,根据含有1 × 10的琼脂(2.4%琼脂在水中,半径= 3 mm)圆盘产生的信号调整图像强度,在平板间进行图像标准化gydF4y2Ba−2gydF4y2BaM Gln压入每个板时,叶片放置。通过将标准圆盘图像强度与N个处理集合的叶片图像强度进行比较,检查了这种效应的潜在混淆结果gydF4y2BaFgydF4y2Ba测试gydF4y2BaPgydF4y2Ba< 0.05 (GraphPad Prism 6, GraphPad Software Inc.)gydF4y2Ba
研究Gln扩散对全叶的影响gydF4y2Ba原位gydF4y2Ba图片gydF4y2Ba
来检查Gln扩散通过gydF4y2BaGlnLuxgydF4y2Ba琼脂,叶片的发光输出在多个连续的孵育间隔中可见。植株最初仅用ddH发芽和生长gydF4y2Ba2gydF4y2Ba在Turface®砾石中添加O,直到与主要实验处于相同的生长阶段。然后提供含有20mm N的Hoagland溶液2小时,之后将植株移回无N溶液中再培养10小时。收获叶片1、2和3并放置在叶片上gydF4y2BaGlnLuxgydF4y2Ba琼脂与Gln (0,3.125 × 10gydF4y2Ba−4gydF4y2Ba, 6.250 × 10gydF4y2Ba−4gydF4y2Ba, 1.250 × 10gydF4y2Ba−3gydF4y2Ba, 2.500 × 10gydF4y2Ba−3gydF4y2Ba, 5000 × 10gydF4y2Ba−3gydF4y2Ba, 1 × 10gydF4y2Ba−2gydF4y2BaM,从左到右;体积= 51 μl,半径= 3 mm)。孵育前成像一次,然后在37°C下孵育1000秒,每次孵育后成像。培养皿进一步孵育6.5小时并成像。所有图像都在1000s曝光下捕获,并在WinView(版本2.5.16.5,普林斯顿仪器,特伦顿,美国)中标准化到1000 - 6000光强单位的范围。gydF4y2Ba
以确定Gln扩散通过的效果gydF4y2BaGlnLuxgydF4y2Ba琼脂对静脉水平分辨率的影响,使用ni - elements(4.51版,尼康仪器,日本东京)在4倍明场显微镜下(尼康Eclipse 50i,尼康仪器)定量中脉、纵向和横向叶脉组织的直径。全叶纵向和横向叶脉组织直径gydF4y2Ba原位gydF4y2Ba图像用ImageJ(版本1.50i, NIH, Bethesda, USA)进行量化,以与Holm-Šídák测试的显微镜进行比较gydF4y2BaPgydF4y2Ba< 0.05 (GraphPad Prism 6, GraphPad Software Inc.)。3个生物重复的静脉分别用显微镜和gydF4y2Ba原位gydF4y2Ba图像。gydF4y2Ba
假设不同的组织厚度可能会影响发光输出gydF4y2Ba原位gydF4y2Ba图像。为了研究这种可能性,我们进行了两个实验:gydF4y2Ba
- 我)gydF4y2Ba
制备三组不同高度/体积的琼脂Gln盘,线性缩放(gydF4y2BahgydF4y2Ba= 1.8、3.6、5.4 mm;gydF4y2BaVgydF4y2Ba= 51、102、153 μl。半径保持在3mm)。在三个不同的高度/体积水平(0,3.125 × 10gydF4y2Ba−4gydF4y2Ba, 6.250 × 10gydF4y2Ba−4gydF4y2Ba, 1.250 × 10gydF4y2Ba−3gydF4y2Ba, 2.500 × 10gydF4y2Ba−3gydF4y2Ba, 5000 × 10gydF4y2Ba−3gydF4y2Ba, 1 × 10gydF4y2Ba−2gydF4y2Ba米Gln)。2.5 h和6 h后,使用WinView软件(版本2.5.16.5,普林斯顿仪器)进行图像标准化(1000 s曝光,1000 - 6000光强单位)。gydF4y2Ba
- (二)gydF4y2Ba
制备3组不同高度/体积的琼脂Gln盘,按上述线性缩放。然而,在三个不同的高度/体积水平(0、15.94、31.87、63.75、127.5、255.0、510.0 nmol),标准内Gln的总摩尔数保持不变。2.5 h和6 h后,使用WinView软件(版本2.5.16.5,普林斯顿仪器)进行图像标准化(1000 s曝光,1000 - 6000光强单位)。gydF4y2Ba
结果gydF4y2Ba
叶片谷氨酰胺的梯度与氮素吸收/同化的速率和持续时间有关gydF4y2Ba
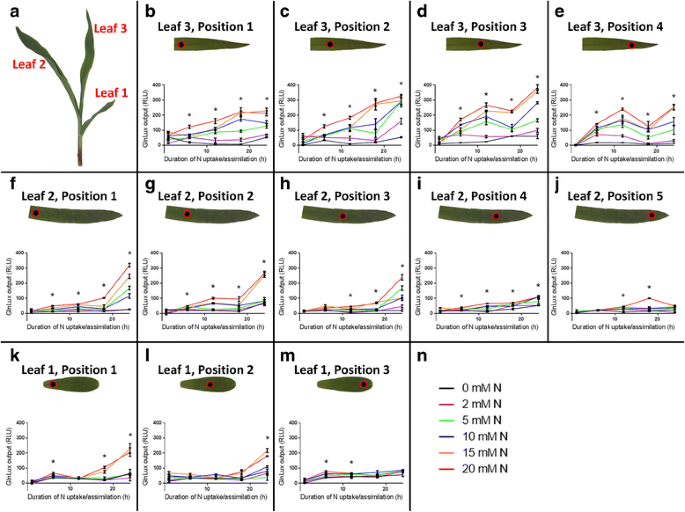
经过12天的N饥饿期后,在样品采集前1 - 24小时内,向植物提供从0-20 mM不等的N浓度,进行N吸收/同化(图2)。gydF4y2Ba2gydF4y2Ba).然后用叶片冲床分析叶片的相对游离谷氨酰胺(Gln)水平gydF4y2BaGlnLuxgydF4y2Ba分析(无花果。gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba1gydF4y2Ba:图S1)。一般而言,对于给定的空间位置,氮素吸收/同化速率和持续时间的增加诱导的氮素吸收/同化效应更大gydF4y2BaGlnLuxgydF4y2Ba输出(无花果。gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba1gydF4y2Ba:图S1),但有趣的是,这因叶位置而异(见下文)。一个较小的独立的第二次试验证实了这些趋势gydF4y2Ba2gydF4y2Ba:图S2)。此外,gydF4y2Ba原位gydF4y2Ba将其置于叶片上,生成整个叶片中Gln积累的图像gydF4y2BaGlnLuxgydF4y2Ba琼脂(无花果。gydF4y2Ba1 bgydF4y2Ba而且gydF4y2Ba3.gydF4y2Ba).当施入0 (- N) mM或20 (+N) mM总氮时,叶片表现出与叶片冲孔试验观察到的相似趋势(图2)。gydF4y2Ba3.gydF4y2Ba).这在叶2和叶3中尤其明显。gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
渐变的gydF4y2BaGlnLuxgydF4y2Ba玉米幼苗叶片的产量gydF4y2BaGlnLuxgydF4y2Ba叶盘测定。叶片1、2、3取样(gydF4y2Ba一个gydF4y2Ba).叶3在位置1 (gydF4y2BabgydF4y2Ba), 2 (gydF4y2BacgydF4y2Ba), 3 (gydF4y2BadgydF4y2Ba),及4 (gydF4y2BaegydF4y2Ba),从叶基部向叶尖延伸。叶2在位置1 (gydF4y2BafgydF4y2Ba), 2 (gydF4y2BaggydF4y2Ba), 3 (gydF4y2BahgydF4y2Ba), 4 (gydF4y2Ba我gydF4y2Ba),及5 (gydF4y2BajgydF4y2Ba).叶1在位置1 (gydF4y2BakgydF4y2Ba), 2 (gydF4y2BalgydF4y2Ba),及3 (gydF4y2Ba米gydF4y2Ba).植株发芽后12天不施氮,此时,修改后的Hoagland溶液含0、2、5、10、15或20 mM N (gydF4y2BangydF4y2Ba)。允许植株进行不同时间(1、6、12、18或24 h)的N吸收/同化,之后收获组织盘。显示3-4个重复+/−SEM的均值。RLU,由光度计在每孔一秒间隔内截获的相对光单位。星号表示0 mM(黑线)和20 mM(红线)N处理之间的显著差异,基于Holm-Šídák测试gydF4y2BaPgydF4y2Ba< 0.05。显示的数据突出了氮吸收/同化梯度。N速率响应梯度在附加文件中突出显示gydF4y2Ba1gydF4y2Ba:图S1。两个数据集是相同的。所示为试验1。关于试验2,请参阅附加文件gydF4y2Ba2gydF4y2Ba:图S2和附加文件gydF4y2Ba3.gydF4y2Ba:图S3gydF4y2Ba
谷氨酰胺水平沿茎轴和叶片近远轴呈梯度分布,沿中外侧轴呈对称性分布gydF4y2Ba
使用叶片冲孔试验,gydF4y2BaGlnLuxgydF4y2Ba产量沿茎轴呈叶龄(羽化顺序)依赖性(图。gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba1gydF4y2Ba:图S1)。在相同的相对采样位置上,最老叶(叶1)的产量最低,而叶2和叶3的产量则随时间的增加而逐渐增加gydF4y2BaGlnLuxgydF4y2Ba叶片穿孔试验(图gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba1gydF4y2Ba:图S1)。试验2与这些结果一致(附加文件gydF4y2Ba3.gydF4y2Ba:图S3)。这一趋势在gydF4y2Ba原位gydF4y2Ba这些图像显示,在+ N处理的植物中,叶片3的发光输出比叶片1显著增加,叶片2表现出中间反应(图2)。gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
叶片冲孔试验表明gydF4y2BaGlnLuxgydF4y2Ba输出依赖于叶片内沿近远轴的采样位置(图。gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba1gydF4y2Ba:图S1)。与叶尖(基瓣梯度)相比,靠近叶基部的位置对N速率和持续时间的响应增加,这在叶1和叶2中尤其明显,但在叶3中不太明显(图3)。gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba1gydF4y2Ba:图S1)。试验2与这些结果一致(附加文件gydF4y2Ba3.gydF4y2Ba:图S3)。的gydF4y2Ba原位gydF4y2BaGln积累的图像同样表现得最好gydF4y2BaGlnLuxgydF4y2Ba在+ N处理下,叶片2和3基部的产量。N处理的植株叶片1表现为低而多变gydF4y2BaGlnLuxgydF4y2Ba输出。gydF4y2Ba
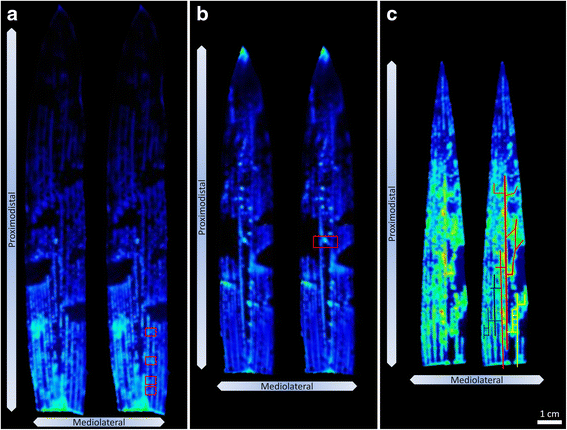
总的来说,在gydF4y2BaGlnLuxgydF4y2Ba沿中外轴从中脉到叶边缘输出(图2)。gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba).然而,观察到不对称的高强度和低强度斑块(图。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
原位gydF4y2Ba施氮后玉米叶片图像显示叶脉水平分辨率为gydF4y2BaGlnLuxgydF4y2Ba输出。图中所示为放大图像。gydF4y2Ba3.gydF4y2Ba.图像突出了叶片2 (gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2Ba红框gydF4y2Ba).Gln通过纵向和横向静脉运动的潜在血管网络显示在叶片3 (gydF4y2BacgydF4y2Ba,gydF4y2Ba彩色的轮廓gydF4y2Ba).在每个面板中,显示单个叶子的重复图像,并在右侧突出静脉级别的细节。箭头指示近远轴和中外侧轴的方向gydF4y2Ba
原位gydF4y2BaGlnLuxgydF4y2Ba叶片图像将Gln定位到静脉级分辨率gydF4y2Ba
的gydF4y2Ba原位gydF4y2Ba图像达到静脉级分辨率,揭示了Gln定位的精细细节(图。gydF4y2Ba4gydF4y2Ba).沿近远轴的大小平行纵静脉均可观察到发光(图。gydF4y2Ba4 a、bgydF4y2Ba).在连接纵静脉的横静脉(沿中外侧轴)中,也可以观察到发光(图2)。gydF4y2Ba4gydF4y2Ba).沿着纵向静脉和横向静脉明显相连的网络有时观察到强烈的发光(彩色示踪,图。gydF4y2Ba4摄氏度gydF4y2Ba).虽然叶脉之间有明显的分离,但确定了分辨率的水平达到gydF4y2BaGlnLuxgydF4y2Ba成像小于标准光学显微镜(附加文件gydF4y2Ba4gydF4y2Ba:图S4)可能是由于光子散射和有限的Gln扩散在琼脂的组合(附加文件gydF4y2Ba5gydF4y2Ba:图S5)。gydF4y2Ba
讨论gydF4y2Ba
高分辨率gydF4y2BaGlnLuxgydF4y2Ba方法允许单因素梯度的测量和可视化gydF4y2Ba
在本研究中,灵敏度较高gydF4y2BaGlnLuxgydF4y2Ba生物传感器(< 1nm) [gydF4y2Ba12gydF4y2Ba]允许小叶盘用于相对Gln测量,从而便于详细的空间叶分析。该方案的低成本(每个样品约1美元)和高通量特性使> 1500个样品被处理,以提供玉米幼株相对Gln的详细空间/时间图。沿中脉取样的叶盘显示出渐增的梯度gydF4y2BaGlnLuxgydF4y2Ba根据施氮量的增加和氮吸收/同化时间的延长,以及沿叶片近远轴和茎轴的位置(图2)。gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba1gydF4y2Ba:图S1)。更密集的技术,gydF4y2BaGlnluxgydF4y2Ba成像,允许这些梯度被可视化gydF4y2Ba原位gydF4y2Ba沿叶片近端轴和中外侧轴的二维分布(图;gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba)和第一次在静脉水平分辨率(图。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
以前的研究观察到施氮后玉米叶片组织中Gln的快速出现[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].在幼龄玉米植株的叶片2中,Gln以基部梯度积累,在基部达到峰值[gydF4y2Ba9gydF4y2Ba].最近,高度详细的分析显示,与蛋白质代谢相关的Gln和转录本在叶片3中显示出类似的梯度[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].gydF4y2Ba
逐渐升高gydF4y2BaGlnLuxgydF4y2Ba沿梢轴输出(图;gydF4y2Ba3.gydF4y2Ba)可能表明同化代谢产物优先穿梭于年轻的、进行光合作用的、正在生长的组织中[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].另一种可能的情况是,叶1-3之间在解剖学上可能存在根本差异(这对潜在的生理学有影响),尽管它们属于相同的胚胎发育阶段[gydF4y2Ba43gydF4y2Ba- - - - - -gydF4y2Ba45gydF4y2Ba].gydF4y2Ba
GlnLuxgydF4y2Ba方法允许分析复杂的相互作用gydF4y2Ba
上述关于基底梯度的详细研究[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba]在单一玉米叶片(叶片2或叶片3)上进行了分析。据我们所知,本报告是第一次在施用多种氮量和吸收/同化时间后,在同一植物上同时采样的不同叶片上进行这种分析。当高通量的性质gydF4y2BaGlnLuxgydF4y2Ba叶片冲孔试验与细部试验相结合gydF4y2Ba原位gydF4y2Ba图像,几种复杂的相互作用效果可以确定。具体来说,至少观察到五种类型的相互作用:(1)N速率x N持续时间的相互作用(加性,图。gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba3.gydF4y2Ba);(2) N速率/生育期X轴相互作用(N优先在幼叶中观察,图。gydF4y2Ba2 jgydF4y2Ba而且gydF4y2Ba3.gydF4y2Ba);(3)茎轴X叶近端互作(叶1和叶2的叶基梯度大于叶3,图5)。gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba3.gydF4y2Ba);(4)施氮量/时间X叶片近端互作(只有施氮量最高的叶1与叶2表现出叶基部梯度,图2)。gydF4y2Ba2 f, kgydF4y2Ba而且gydF4y2Ba3.gydF4y2Ba);(5)与叶片中外侧轴的相互作用(图;gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba)(一般近外侧轴和中外侧轴表达一致)。这些相互作用,用gydF4y2BaGlnLuxgydF4y2Ba氮素吸收动态的复杂性在苗期就已显露出来。gydF4y2Ba
原位gydF4y2Ba成像可以揭示Gln通过叶脉网络的优先运动路线gydF4y2Ba
目前使用示踪染料与显微镜、x射线成像或磁共振成像(MRI)相结合的方法能够以精细的细节观察静脉[gydF4y2Ba46gydF4y2Ba- - - - - -gydF4y2Ba50gydF4y2Ba].然而,这种分析通常仅限于注意液体的存在/不存在,而没有具体代谢物的可视化。此外,大多数研究都是在茎组织的横截面上进行的,而没有提供整个叶片的图像。放射性同位素标记(gydF4y2Ba13gydF4y2BaC或gydF4y2Ba15gydF4y2BaN)可用于追踪代谢物的运动[gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba],但施于植物根部的标记氮除游离谷氨酰胺外,还会与其他同化代谢产物(如其他氨基酸、蛋白质、叶绿素)结合。gydF4y2Ba
在这里gydF4y2BaGlnLuxgydF4y2Ba原位gydF4y2Ba成像允许在静脉水平分辨率下显示游离Gln。强烈的gydF4y2BaGlnLuxgydF4y2Ba在某些叶位置观察到信号,即纵向和横向叶脉明显相互连接的分支模式(彩色示踪,图。gydF4y2Ba4摄氏度gydF4y2Ba).这些分支结合在一起形成了一个可见的网络,其间点缀着低强度的斑块。最简单的解释是,Gln不是通过静脉网络随机扩散,而是可以有优先的血管路线,要么满足局部需求,要么绕过血管损伤点。叶子可能在手术过程中受损,迫使Gln绕道到达目的地。具体来说,在组织处理过程中可能对静脉造成了物理损伤,或者与叶片剥离或冷冻相关的空化诱导栓塞(气泡)可能形成。所有这些都暗示了植物在现实世界中对类似事件的反应[gydF4y2Ba46gydF4y2Ba- - - - - -gydF4y2Ba48gydF4y2Ba,gydF4y2Ba53gydF4y2Ba例如,与害虫损害、静脉胼胝质的形成和冰晶的形成有关。gydF4y2BaGlnLuxgydF4y2Ba原位gydF4y2Ba成像将允许未来对这些假设进行调查,并可能开启氮同化研究的新领域。gydF4y2Ba
分析叶脉时必须谨慎gydF4y2BaGlnLuxgydF4y2Ba,因为可见的叶脉组织(发光)比光学显微镜定量的直径更大,这表明有一定程度的扩散和/或光散射(附加文件)gydF4y2Ba4gydF4y2Ba:图S4)。上的叶子产生的发光的进一步检查gydF4y2BaGlnLuxgydF4y2Ba与易于扩散的Gln琼脂标准相比,在多个连续孵育间隔(1000秒)中琼脂的扩散率不显著(附加文件)gydF4y2Ba5gydF4y2Ba:图S5)。gydF4y2Ba
的局限性gydF4y2BaGlnLuxgydF4y2Ba技术gydF4y2Ba
文献表明,玉米叶片中Gln的浓度范围为0.06 ~ 1.1 μmol/g鲜重[gydF4y2Ba10gydF4y2Ba].的缺点gydF4y2BaGlnLuxgydF4y2Ba该技术仅报道了Gln的相对浓度,而没有报道Gln的绝对浓度。包含纯Gln的标准曲线,尽管高度可复制(附加文件gydF4y2Ba6gydF4y2Ba:图S6和附加文件gydF4y2Ba7gydF4y2Ba:图S7),很难解释,部分原因是与叶片组织相比,扩散速率不同(见上文)。此外,玉米叶片含有许多代谢物,至少其中一些可能会影响植物的生长gydF4y2BaGlnLux大肠杆菌gydF4y2Bacell,可能是负的(附加文件gydF4y2Ba8gydF4y2Ba:图S8)。然而,这种负面影响可能在所有组织和N处理中都相同(见附加文件)gydF4y2Ba5gydF4y2Ba:图S5)。gydF4y2Ba
对于叶盘的测定,叶脉的厚度确实有所变化,这可能会增加实验误差。不同的厚度可能对…产生混淆效应gydF4y2BaGlnLuxgydF4y2Ba原位gydF4y2Ba成像,类似于观察不同高度/体积的Gln标准磁盘(附加文件gydF4y2Ba6gydF4y2Ba:图S6和附加文件gydF4y2Ba7gydF4y2Ba:图S7)。不同厚度的组织可能有不同的扩散速率gydF4y2BaGlnLuxgydF4y2Ba媒体。图像分析是相对的,因此在同一平板上进行处理和控制是至关重要的。然而,生物传感器在概念上类似gydF4y2BaGlnLuxgydF4y2Ba依赖于代谢物扩散到琼脂培养基的方法以前已被利用,具有良好的图像强度相关性和独立的代谢物定量[gydF4y2Ba54gydF4y2Ba].gydF4y2Ba
另外一个限制是叶片的轻微弯曲,导致不完全粘附gydF4y2BaGlnLuxgydF4y2Ba琼脂,导致暗区(图。gydF4y2Ba3.gydF4y2Ba).此外,组织破裂可导致局部液体泄漏,导致人工制品(例如图。gydF4y2Ba3.gydF4y2Ba,比较光图像到gydF4y2BaGlnLuxgydF4y2Ba对于叶1,−N, 12 h的顶部复制图像)。最后,在成像方案中可以同时处理的有限数量的组织可能被认为是一个限制。然而,如果gydF4y2BaGlnLuxgydF4y2Ba板是适当交错的,板与板的变化不会混淆结果(附加文件gydF4y2Ba9gydF4y2Ba:表S1)。gydF4y2Ba
结论和未来应用gydF4y2Ba
Gln是初级氮代谢的中心,因此Gln的潜在应用gydF4y2BaGlnLuxgydF4y2Ba技术是广泛的。的gydF4y2BaGlnLuxgydF4y2Ba测定可促进详细的代谢研究,其中高重复数已被认为是理想的[gydF4y2Ba55gydF4y2Ba- - - - - -gydF4y2Ba57gydF4y2Ba].具体来说,该方法可用于探测更复杂的氮动态、昼夜节律、氮吸收/同化的时间过程,并创建Gln运动的高分辨率地图。这些方法可应用于其他物种,以及不同的器官,包括根[gydF4y2Ba12gydF4y2Ba].此外,还可以检查生长后期的成熟植物。随着成熟叶片进入衰老,可能有兴趣跟踪从茎部组织到籽粒的Gln的再动员,这已被证明可以提高氮利用效率(NUE), NUE定义为每单位生产所需的N施肥[gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba].的高处理能力gydF4y2BaGlnLuxgydF4y2Ba叶盘试验可通过在精细尺度上提供遗传性状和表型性状之间的联系来进行基因型筛选和改良NUE育种[gydF4y2Ba57gydF4y2Ba,gydF4y2Ba60gydF4y2Ba].gydF4y2Ba
缩写gydF4y2Ba
- Gln:gydF4y2Ba
-
谷氨酰胺gydF4y2Ba
- 护士:gydF4y2Ba
-
氮gydF4y2Ba
- 自虐:gydF4y2Ba
-
氮利用效率gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
威廉姆斯LE,米勒AJ。负责氮源吸收和分配的转运体。植物学报2001;52:659-88。gydF4y2Ba
- 2.gydF4y2Ba
郭德华,陈志伟,陈志伟,等。无机氮营养的分子生物学和发育生物学。阿拉伯B. 2002;1:e0011。gydF4y2Ba
- 3.gydF4y2Ba
Masclaux-Daubresse C, Daniel-Vedele F, Dechorgnat J, Chardon F, Gaufichon L, Suzuki A.植物对氮的吸收、同化和再动员:可持续和生产性农业的挑战。杨文杰,2010;gydF4y2Ba
- 4.gydF4y2Ba
张晓玲,李丽娟,张晓玲。玉米叶片氮同化酶的定位及其在绿化过程中的活动。足底。1977;134:195 - 200。gydF4y2Ba
- 5.gydF4y2Ba
Amancio S, Santos H.玉米根系吸收硝酸盐和铵的研究(gydF4y2Ba玉米gydF4y2BaL.)幼苗用gydF4y2Ba在活的有机体内gydF4y2BaNgydF4y2Ba15-NMR。中国科学(d辑),2001;gydF4y2Ba
- 6.gydF4y2Ba
Sakakibara H, Kawabata S, Takahashi H, Hase T, Sugiyama T.玉米谷氨酰胺合成酶基因家族的分子克隆:谷氨酰胺合成酶和铁氧还原蛋白依赖性谷氨酸合成酶基因在光合和非光合组织中的表达。植物细胞物理学报。1992;33:49-58。gydF4y2Ba
- 7.gydF4y2Ba
李敏,维勒默R,赫西PJ, Silflow CD,甘特JS, Snustad DP。谷氨酰胺合成酶6个基因的差异表达gydF4y2Ba玉米gydF4y2Ba.植物分子生物学。1993;23:41 - 7。gydF4y2Ba
- 8.gydF4y2Ba
高等植物对硝酸盐的同化和转运:比较生理学和生态后果。植物科学。1985;64:133-40。gydF4y2Ba
- 9.gydF4y2Ba
查普曼DJ, Leech RM。植物叶片和质体中游离氨基酸和酰胺库大小的变化gydF4y2Ba玉米gydF4y2Ba在叶片发育过程中。植物物理学报。1979;63:567-72。gydF4y2Ba
- 10.gydF4y2Ba
Magalhães JR, Ju GC, Rich PJ, Rhodes D. 15NH动力学gydF4y2Ba4gydF4y2Ba+gydF4y2Ba同化的gydF4y2Ba玉米gydF4y2Ba.植物科学学报。1990;44:457 - 457。gydF4y2Ba
- 11.gydF4y2Ba
Miflin BJ, Habash DZ。谷氨酰胺合成酶和谷氨酸脱氢酶在氮同化中的作用及改善作物氮利用的可能性。中国科学(d辑),2002;gydF4y2Ba
- 12.gydF4y2Ba
Tessaro MJ, Soliman SSM, Raizada MN。谷氨酰胺细菌全细胞生物传感器及其在植物中谷氨酰胺的定量和可视化应用。应用环境微生物学。2012;78:604-6。gydF4y2Ba
- 13.gydF4y2Ba
马BL,德怀尔LM。叶片衰老不同的两种对比玉米杂交种氮素吸收和利用。植物土壤,1998;gydF4y2Ba
- 14.gydF4y2Ba
王文杰,马立平。Bt和非Bt近等值系玉米杂种干物质和氮分配规律。作物科学,2007;47:1186-92。gydF4y2Ba
- 15.gydF4y2Ba
Abbasi MK, Tahir MM, Rahim N.氮肥来源和施肥时机对旱作玉米产量和氮素利用效率的影响(gydF4y2Ba玉米gydF4y2BaL.)在克什米尔-巴基斯坦。Geoderma。2013;195:87 - 93。gydF4y2Ba
- 16.gydF4y2Ba
Burzaco JP, Ciampitti IA, Vyn TJ。春季施氮对硝酸吡啶对玉米产量和氮素利用效率的影响:田间研究与元分析比较。Agron J. 2014; 106:753-60。gydF4y2Ba
- 17.gydF4y2Ba
王志强,王志强,王志强,等。植物根生长区生长过程中代谢产物组成及物质转移的研究gydF4y2Ba玉米gydF4y2Ba在不同外源养分条件下生长。植物细胞环境,2003;26:1451-66。gydF4y2Ba
- 18.gydF4y2Ba
Cañas RA, Quilleré I, Christ A, Hirel B.玉米发育穗氮代谢的研究(gydF4y2Ba玉米gydF4y2Ba):两系氮素管理模式对比分析。新植物,2009;184:340-52。gydF4y2Ba
- 19.gydF4y2Ba
孙文杰,李志强,李志强,等。利用分区化玉米叶片基因组尺度模型评估氮有效性的代谢影响。植物物理学报。2014;166:1659-74。gydF4y2Ba
- 20.gydF4y2Ba
金旭,李伟,胡东,石旭,张旭,张峰,等。缺氮条件下玉米幼苗的生物学响应和蛋白质组学变化。植物摩尔生物学报告。2015;33:490-504。gydF4y2Ba
- 21.gydF4y2Ba
叶的起始和确定。植物细胞。1992;4:1017-27。gydF4y2Ba
- 22.gydF4y2Ba
Schluter U, Mascher M, Colmsee C, Scholz U, Brautigam A, Fahnenstich H, Sonnewald U.玉米源叶片对氮缺乏的适应不仅影响氮和碳代谢,还影响磷酸盐稳态的控制。植物科学进展。2012;gydF4y2Ba
- 23.gydF4y2Ba
挑选TR, Bräutigam A, Schlüter U, Denton AK, Colmsee C, Scholz U,等。玉米叶片发育梯度的系统分析重新定义了当前的C4模型,并提供了调控的候选。植物学报。2011;23:4208-20。gydF4y2Ba
- 24.gydF4y2Ba
王玲,Czedik-Eysenberg A, Mertz RA, Si Y, Tohge T, Nunes-Nesi A,等。玉米和水稻发育叶片C4和C3光合作用的比较分析。生物工程学报。2014;32:1158-65。gydF4y2Ba
- 25.gydF4y2Ba
玉米束鞘和叶肉细胞的细胞系分析。Dev Biol, 1989; 133:128-39。gydF4y2Ba
- 26.gydF4y2Ba
马杰兰,郭丽娟,王丽娟,等。用显微镜和定量蛋白质组学研究玉米C4叶片发育和分化的结构和代谢转变。《植物科学》2010;22:359 - 342。gydF4y2Ba
- 27.gydF4y2Ba
李鹏,Ponnala L, Gandotra N,王玲,司杨,Tausta SL,等。玉米叶片转录组的发育动态。Nat Genet, 2010; 42:1060-7。gydF4y2Ba
- 28.gydF4y2Ba
高伦TL,莱扎达MN。当前和未来植物宏、微量营养素转基因全细胞生物传感器。植物科学,2014;33:392-413。gydF4y2Ba
- 29.gydF4y2Ba
Khanal R, Earl H, Lee EA, Lukens L.两个早开花玉米品系开花时间及相关性状的遗传结构。作物科学,2011;gydF4y2Ba
- 30.gydF4y2Ba
高伦,瓦茨,希勒,莱扎达。Turface粘土的生长允许沿着谷类作物的整个冠根进行根毛表型,并表明根毛的生长可以远远超出根毛区域。BMC Res Notes. 2015;8:143。gydF4y2Ba
- 31.gydF4y2Ba
高伦TL, Bhosekar VK, Shearer CR, Watts S, Raizada MN。指谷子对低氮胁迫的全株驯化响应。前沿植物学报2015;6:1-14。gydF4y2Ba
- 32.gydF4y2Ba
莫图尔斯基,布朗。非线性回归拟合数据时异常值的检测——一种基于鲁棒非线性回归和错误发现率的新方法。BMC生物信息学。2006;7:123。gydF4y2Ba
- 33.gydF4y2Ba
多元正态分布均值的矩形置信区域。美国统计学会,1967;62:626-33。gydF4y2Ba
- 34.gydF4y2Ba
一个简单的顺序拒绝多重测试程序。杨晓明,杨晓明,杨晓明。gydF4y2Ba
- 35.gydF4y2Ba
Aickin M, Gensler H.在报告研究结果时调整多重测试:Bonferroni vs Holm方法。《公共卫生》,1996;86:726-8。gydF4y2Ba
- 36.gydF4y2Ba
一种多重比较程序,将几个处理与一个对照进行比较。美国统计学会。1955;50:1096-121。gydF4y2Ba
- 37.gydF4y2Ba
充分性和统计检验的性质。Proc R Soc A. 1937; 160:268-82。gydF4y2Ba
- 38.gydF4y2Ba
Kruskal WH, Wallis WA。在单准则方差分析中使用秩。美国统计学会,1952;47:583-621。gydF4y2Ba
- 39.gydF4y2Ba
邓恩橙汁。使用秩和的多次比较。技术计量学。1964;6:241-52。gydF4y2Ba
- 40.gydF4y2Ba
矿质氮源对玉米根系谷氨酰胺合成酶异构体和各器官氨基酸平衡的影响不同。中国生物医学工程学报。2015;gydF4y2Ba
- 41.gydF4y2Ba
Sakurai N, Hayakawa T, Nakamura T, Yamaya T.水稻叶片维管束中细胞质谷氨酰胺合成酶蛋白在不同发育阶段的细胞定位变化。足底。1996;200:306-11。gydF4y2Ba
- 42.gydF4y2Ba
Rana NK, Mohanpuria P, Yadav SK.茶叶胞浆谷氨酰胺合成酶的表达具有组织特异性,并受镉和盐胁迫诱导。生物植物。2008;52:361-4。gydF4y2Ba
- 43.gydF4y2Ba
玉米、燕麦和小麦的胚胎和幼苗的比较解剖和形态。Bot Gaz, 1930; 89:1-39。gydF4y2Ba
- 44.gydF4y2Ba
刘志刚,刘志刚,刘志刚。玉米未成熟胚体胚发生的组织学研究(gydF4y2Ba玉米gydF4y2Bal .)。原生质。1985;127:1-8。gydF4y2Ba
- 45.gydF4y2Ba
植物发育时间的变化与调控。科学。2003;301:334-6。gydF4y2Ba
- 46.gydF4y2Ba
谢恩,麦cully M, Canny M.玉米茎的维管系统:对水分运输和木质部安全的影响。Ann Bot. 2000; 86:245-58。gydF4y2Ba
- 47.gydF4y2Ba
玉米叶板中的栓塞和填充,以及原生木质部陷窝的作用。中国科学(d辑),2001;gydF4y2Ba
- 48.gydF4y2Ba
霍尔布鲁克NM,阿伦斯ET,伯恩斯MJ, Zwieniecki MA。gydF4y2Ba在活的有机体内gydF4y2Ba磁共振成像对空化和栓塞修复的观察。植物物理学报2001;126:27-31。gydF4y2Ba
- 49.gydF4y2Ba
李世杰,金勇。gydF4y2Ba在活的有机体内gydF4y2Ba用x射线显微成像技术观察木质部血管的水填充过程。《科学》2008;101:595-602。gydF4y2Ba
- 50.gydF4y2Ba
金洪科,李世杰。水稻叶片木质部导管单元液流动态的同步x射线成像无损监测。新植物,2010;188:1085-98。gydF4y2Ba
- 51.gydF4y2Ba
Kiyomiya S, Nakanishi H,内田H, Tsuji A, Nishiyama S, Futatsubashi M,等。实时可视化gydF4y2Ba13gydF4y2Ba不同环境条件下水稻氮转运的正电子示踪成像系统研究。植物物理学报。2001;125:1743-53。gydF4y2Ba
- 52.gydF4y2Ba
摄取后代谢影响氨基酸摄取的定量。新植物,2012;193:522-31。gydF4y2Ba
- 53.gydF4y2Ba
干旱诱导玉米木质部栓塞和气孔关闭。足底。2002;215:466 - 71。gydF4y2Ba
- 54.gydF4y2Ba
Soudry E, Ulitzur S, Gepstein S.离体和附着叶片衰老过程中氨基酸的积累和再动员:gydF4y2Ba在足底gydF4y2Ba重组发光细菌色氨酸水平的分析。中国生物医学工程学报,2005;26(2):349 - 349。gydF4y2Ba
- 55.gydF4y2Ba
Roessner U, Luedemann A, Brust D, Fiehn O, Linke T, Willmitzer L, Fernie A.代谢分析允许遗传或环境修饰植物系统的综合表型。植物细胞。2001;13:11-29。gydF4y2Ba
- 56.gydF4y2Ba
李志刚,李志刚,李志刚,李志刚。植物代谢产物的气相色谱质谱分析。Nat Protoc 2006; 1:387-96。gydF4y2Ba
- 57.gydF4y2Ba
草野M,福岛A, Redestig H,齐藤k。植物氮代谢代谢的代谢组学方法。中国科学(d辑),2011;gydF4y2Ba
- 58.gydF4y2Ba
康德,毕勇,罗斯坦。了解植物对氮素限制的响应,提高作物氮素利用效率。中国科学(d辑),2010;gydF4y2Ba
- 59.gydF4y2Ba
李志刚,李志刚,李志刚。提高作物氮素利用效率的挑战:遗传变异和数量遗传学在综合方法中的更核心作用。中国机械工程学报,2007;29(2):349 - 349。gydF4y2Ba
- 60.gydF4y2Ba
Hirel B, Bertin P, Quillere I, Bourdoncle W, Attagnant C, delay C,等。为了更好地了解玉米氮素利用效率的遗传和生理基础。植物科学,2001;gydF4y2Ba
致谢gydF4y2Ba
我们感谢Dietmar Scholz(圭尔夫大学)在温室实验维护方面的协助,以及Hanan R. Shehata(圭尔夫大学)在使用温室实验设备方面对TLG进行培训gydF4y2BaGlnLuxgydF4y2Ba方法。我们感谢Elizabeth a . Lee(圭尔夫大学)赠送的玉米种子和Mary Ruth McDonald(圭尔夫大学)使用的光学显微镜。gydF4y2Ba
资金gydF4y2Ba
TLG的部分资助来自圭尔夫大学奖学金,安大略省政府的QEII-GSST奖,以及加拿大政府的NSERC-PGSD奖。这项研究得到了安大略省农业、食品和农村事务部(OMAFRA)、安大略省粮食农民和加拿大自然科学与工程研究委员会(NSERC, CRD计划)对MNR的资助。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持本文结论的数据集包含在本文及其附加文件中gydF4y2Ba1gydF4y2Ba:图S1;额外的文件gydF4y2Ba2gydF4y2Ba:图S2;额外的文件gydF4y2Ba3.gydF4y2Ba:图S3;额外的文件gydF4y2Ba4gydF4y2Ba:图S4;额外的文件gydF4y2Ba5gydF4y2Ba:图S5;额外的文件gydF4y2Ba6gydF4y2Ba:图S6;额外的文件gydF4y2Ba7gydF4y2Ba:图S7;额外的文件gydF4y2Ba8gydF4y2Ba:图S8;额外的文件gydF4y2Ba9gydF4y2Ba:表S1。gydF4y2Ba
作者的贡献gydF4y2Ba
TLG和MNR构想了这项研究。TLG承担了所有的实验室实验,进行了所有的分析并撰写了手稿。MNR编辑了手稿。两位作者都已阅读并认可了这份手稿。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明,这项研究是在没有任何商业或财务关系的情况下进行的,这些关系可能被解释为潜在的利益冲突。然而,这项技术已经获得了美国专利(US 61/499286)。MNR是BMC Plant Biology的编委会成员。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
渐变的gydF4y2BaGlnLuxgydF4y2Ba玉米幼苗叶片的产量gydF4y2BaGlnLuxgydF4y2Ba叶盘测定。对叶片1、2和3取样(a)。对叶片3从叶基部到叶尖的位置1 (b)、2 (c)、3 (d)和4 (e)进行分析。叶2在1 (f)、2 (g)、3 (h)、4 (i)和5 (j)位置进行测定。叶1在1 (k)、2 (l)和3 (m)位置进行测定。植株发芽后12天不施氮,此时施氮量为0、2、5、10、15或20 mM的改良Hoagland溶液。植物接受不同时间(1、6、12、18或24 h)的氮吸收/同化(N),之后收获组织盘。显示3-4个重复+/−SEM的均值。RLU,由光度计在每孔一秒间隔内截获的相对光单位。星号表示在不同N施用量下,处理1 h(黑线)和24 h(红线)之间存在显著差异,基于Holm-Šídák试验gydF4y2BaPgydF4y2Ba< 0.05。显示数据以突出显示N速率响应梯度。图中突出显示了氮吸收/同化梯度。gydF4y2Ba2gydF4y2Ba.两个数据集是相同的。所示为试验1。关于试验2,请参阅附加文件gydF4y2Ba2gydF4y2Ba:图S2和附加文件gydF4y2Ba3.gydF4y2Ba:图S3。(PNG 4607 kb)gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
独立试验gydF4y2BaGlnLuxgydF4y2Ba用叶盘法测定玉米幼苗叶片产量。如图所示为试验1 (b, e, h, k)和试验2 (c, f, i, l)的数据。图(a-f)中显示N吸收和同化的两个时间点(1,24 h),以突出时间响应梯度,而图(g-l)中显示单个时间点(24 h),以突出N速率响应梯度。2013年(b)和2014年(c),在摄取/同化0、2、5、10、15或20 mM n 1和24 h后,在摄取/同化1和24 h后,在位置1 (d)取样叶1 (e)和2014年(f)。在吸收/同化24 h后,于2013年(h)和2014年(i)在位置1 (g)取样。在吸收/同化24 h后,于2013年(k)和2014年(l)在位置3 (j)取样。给出了3-4个重复+/−SEM的均值。星号表示有显著差异(gydF4y2BaPgydF4y2Ba< 0.05)与0 N施用量的差异,基于Dunnett的多均值比较。Dunn的多重均值比较用于非正态数据。RLU,由光度计在每孔一秒间隔内截获的相对光单位。叶位置梯度在附加文件中突出显示gydF4y2Ba3.gydF4y2Ba:图S3。(PNG 1669 kb)gydF4y2Ba
附加文件3:图S3。gydF4y2Ba
独立试验gydF4y2BaGlnLuxgydF4y2Ba利用叶盘法测定玉米幼苗叶片产量的空间叶位梯度。下图为2013年(b, c, g, h)和2014年(d, e, i, j)的数据。叶3 (a-e)在位置1和4取样,叶1 (f-j)在位置1和3取样,在N吸收/同化24 h后,以0、2、5、10、15或20 mM N进行N吸收/同化。星号表示有显著差异(gydF4y2BaPgydF4y2Ba< 0.05)与0 N施用量的比较,基于Dunnett的倍数均值比较,或数据为非正态时的Dunn的倍数均值比较。RLU,由光度计在每孔一秒间隔内截获的相对光单位。n吸收/同化和时间响应梯度在附加文件中突出显示gydF4y2Ba2gydF4y2Ba:图S2(PNG 1157 kb)gydF4y2Ba
附加文件4:图S4。gydF4y2Ba
之间叶脉分辨率的比较gydF4y2BaGlnLuxgydF4y2Ba原位gydF4y2Ba成像和光学显微镜。gydF4y2BaGlnLuxgydF4y2Ba原位gydF4y2Ba图像(见图;gydF4y2Ba3.gydF4y2Ba)的叶片1、叶片2和叶片3(来自+ N处理24 h吸收/同化的植物)被分为基部、中间和尖端(1200毫米宽),沿叶片等距分布(a)gydF4y2Ba2gydF4y2BaO在Turface®碎石中,直到它们与主要实验处于相同的生长阶段),以同样的方式进行4倍明场显微镜(b)。在ns - elements(4.51版,尼康仪器,日本东京)中,用显微镜定量中静脉组织的直径(c)。星号表示通过Šídák的多重比较测试确定的显著差异(gydF4y2BaPgydF4y2Ba在单个叶片内任意一个基部、中间或尖端位置与其他两个位置之间均< 0.05)。中脉未见任何gydF4y2BaGlnLuxgydF4y2Ba图像。纵向(d)和横向(e)静脉组织直径用gydF4y2BaGlnLuxgydF4y2Ba原位gydF4y2BaImageJ图像分析(版本1.50i, NIH, Bethesda, USA),并使用显微镜。用Holm-Šídák试验比较了两种量化方法在所有叶片的基部、中部和尖端位置的直径,发现有显著差异(gydF4y2BaPgydF4y2Ba< 0.05)gydF4y2BaGlnLuxgydF4y2Ba与显微镜比较(d, e)。显示由三个子样本+/−SEM组成的每个叶片位置三个生物重复的平均值。(PNG 136kb)gydF4y2Ba
附加文件5:图S5。gydF4y2Ba
放置在玉米叶片1、2和3(从左到右显示)上时随时间产生的发光的可视化gydF4y2BaGlnLuxgydF4y2Ba琼脂。植株最初仅用ddH发芽和生长gydF4y2Ba2gydF4y2Ba直到与主实验处于相同的生长阶段(8天)。然后提供含有20mm N的Hoagland溶液2小时,之后将植株移回无N溶液中继续10小时。收获叶片1、2和3,冷冻解冻,并放置在叶片上gydF4y2BaGlnLuxgydF4y2Ba琼脂与Gln (0,3.125 × 10gydF4y2Ba−4gydF4y2Ba, 6.250 × 10gydF4y2Ba−4gydF4y2Ba, 1.250 × 10gydF4y2Ba−3gydF4y2Ba, 2.500 × 10gydF4y2Ba−3gydF4y2Ba, 5000 × 10gydF4y2Ba−3gydF4y2Ba, 1 10gydF4y2Ba−2gydF4y2BaM Gln,从左到右;gydF4y2BaVgydF4y2Ba= 51 μl, r = 3 mm) (a)。孵育前成像一次(b),然后在37°C下孵育1000秒,每间隔一次成像(C -m)。平板进一步孵育6.5小时并成像(n)。所有图像都在1000秒曝光下捕获,并标准化到1000 - 6000光强单位的范围。红-黄-绿表示减少gydF4y2BaGlnLuxgydF4y2Ba响应,黑色表示不存在gydF4y2BaGlnLuxgydF4y2Ba输出。(PNG 1339 kb)gydF4y2Ba
附加文件6:图S6。gydF4y2Ba
GlnLuxgydF4y2Ba琼脂对含有Gln标准(0,3.125 × 10gydF4y2Ba−4gydF4y2Ba, 6.250 × 10gydF4y2Ba−4gydF4y2Ba, 1.250 × 10gydF4y2Ba−3gydF4y2Ba, 2.500 × 10gydF4y2Ba−3gydF4y2Ba, 5000 × 10gydF4y2Ba−3gydF4y2Ba, 1 × 10gydF4y2Ba−2gydF4y2BaM Gln;分别为C0-C6)的三种不同高度/体积线性缩放(gydF4y2BahgydF4y2Ba= 1.8、3.6、5.4 mm;gydF4y2BaVgydF4y2Ba= 51, 102, 153 μl)。磁盘放在gydF4y2BaGlnLuxgydF4y2Ba固体琼脂培养基(a, b)。然后,培养皿在37°C下孵育2.5小时并成像(C, d)。原始图像输出显示(C)与相同的标准化图像一起显示1000-6000光强单位的范围(d)。培养皿再孵育3.5小时并成像(e),应用标准化(f)。白-红-黄-绿表示减少gydF4y2BaGlnLuxgydF4y2Ba响应,黑色表示不存在gydF4y2BaGlnLuxgydF4y2Ba输出。所有图像都是在1000s曝光下拍摄的。(PNG 1672 kb)gydF4y2Ba
附加文件7:图S7。gydF4y2Ba
GlnLuxgydF4y2Ba固体琼脂对纯Gln琼脂盘(半径= 3 mm)的反应(0、15.94、31.87、63.75、127.5、255.0、510.0 nmol;M0-M6)跨不同级别的磁盘高度/卷(gydF4y2BahgydF4y2Ba= 1.8、3.6、5.4 mm;gydF4y2BaVgydF4y2Ba= 51, 102, 153 μl)。磁盘放在gydF4y2BaGlnLuxgydF4y2Ba固体琼脂培养基(a, b)。然后将培养皿在37°C下孵育2.5小时并成像(C, d)。原始图像输出如图(C)所示,与相同的标准化图像一起显示1000-6000光强单位(d)。培养皿再孵育3.5小时并成像(e),应用标准化(f)。红-黄-绿表示减少gydF4y2BaGlnLuxgydF4y2Ba响应,黑色表示不存在gydF4y2BaGlnLuxgydF4y2Ba输出。所有图像都是在1000s曝光下拍摄的。(PNG 1470 kb)gydF4y2Ba
附加文件8:图S8。gydF4y2Ba
玉米幼苗叶片对植物生长有明显抑制作用gydF4y2BaGlnLuxgydF4y2Ba发光的输出。植株最初仅用ddH发芽和生长gydF4y2Ba2gydF4y2Ba直到与主实验处于相同的生长阶段(8天)。然后提供含有20 mM N的Hoagland溶液1小时。收获叶片1,冷冻解冻,并放置在叶片上gydF4y2BaGlnLuxgydF4y2Ba琼脂旁边有无菌绿纸和两块标准盘(1 × 10gydF4y2Ba−2gydF4y2BaM Gln,体积= 51 μl) (a)。孵育前成像一次(b),然后在37°C下孵育1000秒,每次间隔后成像(C - M)。平板进一步孵育6.5小时并成像(n)。所有图像以1000秒曝光时间捕获,并标准化到1000 - 6000光强单位的范围。红-黄-绿表示减少gydF4y2BaGlnLuxgydF4y2Ba响应,黑色表示不存在gydF4y2BaGlnLuxgydF4y2Ba输出。(PNG 776 kb)gydF4y2Ba
附加文件9:表S1。gydF4y2Ba
复制和治疗的变异性gydF4y2BaGlnLux在原地gydF4y2Ba成像协议。生料3个重复gydF4y2BaGlnLuxgydF4y2Ba琼脂平板图像(图。gydF4y2Ba3.gydF4y2Ba),并对各N处理(+/-)和叶片(1-3)组合(每叶片共6盘)进行分析。A 1 x 10gydF4y2Ba-2gydF4y2Ba每个平板上还包括M Gln琼脂盘进行标准化。由每个标准圆盘产生的发光比gydF4y2BaGlnLuxgydF4y2Ba聚合琼脂背景以生成扫描电镜,并估计板与板之间的变异性。对每个氮处理的所有三个重复的发光输出进行汇总,以生成扫描电镜,并估计因氮吸收/同化而引起的相对变异性。值表示每个6个板的SEM。显著差异为gydF4y2BaPgydF4y2Ba标准化比与叶片发光的方差<0.05用星号表示,以gydF4y2BaFgydF4y2Ba测试。发光定量使用WinView软件(版本2.5.16.5,普林斯顿仪器,特伦顿,美国)。(docx43 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Goron, T.L, Raizada, M.N.基于生物传感器的玉米叶片谷氨酰胺在静脉水平分辨率上的空间和发育映射,以响应不同氮速率和吸收/同化持续时间。gydF4y2BaBMC植物生物学gydF4y2Ba16日,gydF4y2Ba230(2016)。https://doi.org/10.1186/s12870-016-0918-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-016-0918-xgydF4y2Ba
关键字gydF4y2Ba
- 玉米gydF4y2Ba
- 生物传感器gydF4y2Ba
- 氮gydF4y2Ba
- 谷氨酰胺gydF4y2Ba
- 叶gydF4y2Ba
- 代谢组学gydF4y2Ba
- 纵向脉gydF4y2Ba
- 横静脉gydF4y2Ba
- 氮利用效率gydF4y2Ba
- 成像gydF4y2Ba