摘要
背景
油菜素内酯(Brassinosteroids, BRs)是一种类固醇类植物激素,参与多种生理过程,影响植物的许多重要性状,如株高、抗逆性、叶角、肥力和籽粒灌浆等。在许多植物中,如双子叶植物中,BR信号通路和生物合成途径已经被研究过拟南芥;然而,相对较少地了解这些途径在单焦点中。
结果
描述模型草中与br相关的过程Broachypodium distachyon.,我们研究了这些植物对特定BR生物合成抑制剂丙环唑(Pcz)的响应。我们发现用Pcz处理会产生矮化表型b . distachyon幼苗,类似于在pcz处理的拟南芥植株和特征的br缺陷突变体中观察到的情况。通过生物信息学分析,我们确定了一系列已知参与拟南芥BR生物合成和信号转导的基因的同源性,如DWF4那BR6OX2那CPD那BRI1,BIN2.评估这些基因对Pcz治疗的反应显示候选基因BdDWF4那BR6OX2而且,CPD处于反馈监管之下。此外,拟南芥也有异源表达BdDWF4表现出高大的身材和细长的叶柄,这在BRs水平较高的植株中是可以预期的。此外,异种表达BdBIN2拟南芥导致侏儒症,表明BDBIN2用作BR信号传导的负调节器。但是,拟南芥的矮化表型bri1-5,一个弱BRI1突变等位基因,没有被过表达补充BdBRI1,表示BDBRI1和BRI1在功能上不等同。
结论
我们确定和短柄信号传导途径的BR合成的部件,并且两个相似性和在这两种植物的BR生物学差异提供了实例。我们的研究结果表明在单子叶作物如理解BR生物学框架Zea Mays.(玉米)和奥雅萨苜蓿(大米)。
背景
油菜素内酯(BRs)是一种植物多羟基化类固醇,具有促生长激素的功能。它们与许多发育和生理过程有关拟南芥包括维管分化、茎和根伸长、生殖发育、光形态建成和胁迫反应。因此,BR合成或感知缺陷的突变植株表现出矮个子、叶圆、叶卷、叶柄短等特征表型,降低育性[1-3.].
br的生物合成和信号转导途径已在国内外得到了广泛的研究拟南芥.细胞色素p450的一个酶家族介导了BR生物合成的大部分步骤,这些酶中缺陷的突变体的特性有助于理解BR生物学[4.那5.].各种方法已经建立的组件和BR信号传导途径的机制;一旦BR与受体结合激酶,油菜素类固醇不敏感的1(BRI1)时,信号传送到下游基因,最终导致的BR应答基因的抑制或激活[6.那7.].
在单子叶植物和双子叶植物之间,BR信号是保守的,因为在拟南芥中存在一些对应的蛋白奥雅萨苜蓿(大米)。例如,受体BRI1和共受体BRI1- associated receptor KINASE 1 (BAK1)的同源基因分别命名为OsBRI1和OsBAK1;BR信号蛋白BR INSENSITIVE 2 (BIN2)的负调控子,GSK3/SHAGGY-like激酶1和2 (OsGSK1和OsGSK2)的同源物;BRASSINAZOLE RESISTANT 1 (OsBZR1)主要转录因子的同源基因在水稻中已被鉴定[7.-10].
尽管与双子叶BR生物学相似,单子叶BR也有一些差异。油菜素内酯(Brassinolide, BL)是BR在拟南芥中最活跃的形式和BR合成的最终产物,但在水稻中未检测到,其最终产物似乎是蓖麻酮(castasterone, CS)。此外,在水稻中未发现介导BL合成的CYP85A2同源物[11].此外,在水稻中还发现了在拟南芥中没有已知同源基因的BR信号成分,这表明单子叶中存在特定的BR功能或存在一定程度的功能冗余。这些成分的例子有矮秆和低分蘖(DTL)和分蘖角增加控制器(LIC),它们分别作用于OsBRI1和OsGSK2的下游,正调控和负调控水稻BR信号[12那13U3泛素连接酶TAIHU DWARF 1 (TUD1),该酶与D1/OsRGA在遗传和物理上相互作用,D1/OsRGA是一种参与赤霉素(GA)和BR应答的异三聚体G蛋白亚基[14].
Broachypodium distachyon.(下文刹车片)是一个相对较新的模型工厂,提出了对草的研究,因为它具有短暂的活循环,是自我肥沃的,易于生长,而且比淘汰更密切相关答:芥[15].然而,对植物激素的研究却知之甚少b . distachyon.只有两个侏儒突变体,与所述受体BRI1缺陷和C-6氧化酶(油菜素类固醇亏DWARF 1; BRD1),已经表征在该模型植物[16那17].
在本工作中,我们使用了一种特定的BR生物合成抑制药物丙环唑(Pcz) [18研究BR在短叶植物中的作用,并对BR-生物合成酶DWARF4、BR6ox2和CPD进行同源性鉴定。此外,通过异源互补,我们研究了BR信号通路中两个重要基因的同源性,受体BRI1和负调控基因BIN2。本研究揭示了拟南芥和短葶植物中BR合成和信号通路的相似性和差异性。
结果
Broachypodium distachyon.在丙环唑处理下,幼苗表现出br相关表型
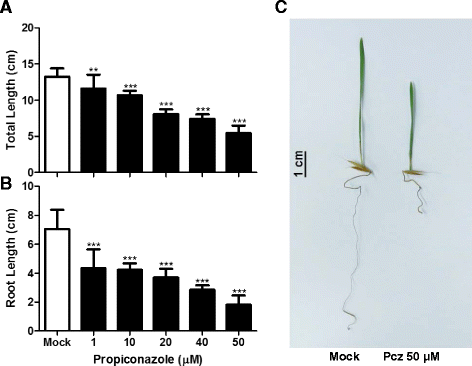
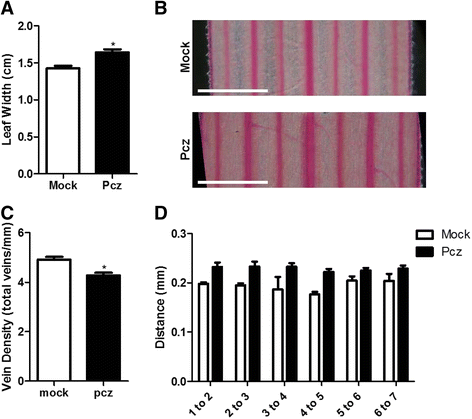
由于短柄草是一种较新的模式植物,目前对其激素调控过程和基因的研究还很有限。Brachypodium BR缺陷或不敏感突变体的不可获得,使确定BR功能是否在植物物种中是保守的具有挑战性。为了研究BRs的作用模式和参与这些过程的因素,我们首先用1 ~ 50 μM浓度的brachiypodium Bd21幼苗处理BRs特异性抑制剂Pcz 7天(图2)。1A-C.).我们观察到植物总长度的剂量反应减少;与模拟条件相比,1 μM Pcz的长度减少了约13%,而最大浓度为50 μM时,长度减少了约60%(图4)。1).这种减少在根部尤其严重;与对照相比,20 μM Pcz处理的主根减少了50%,50 μM处理的主根减少了74%以上(图2)。1 b).在光照和黑暗条件下观察pcz诱导的抑制作用(附加文件1:图S1)。相比于对植株总长度的影响,最强的Pcz处理仅使叶片长度减少了~25%(附加文件2:图S2)。为了评估Pcz是否对叶片形态或维管系统有其他影响,我们更详细地研究了叶片构型,重点是脉序模式、脉总数、脉密度和脉间距离。有趣的是,我们发现经过pcz处理的叶子比在控制条件下生长的叶子更厚更宽,但叶脉的数量保持不变。因此,经过Pcz处理的叶片中,叶脉之间的距离平均较大,因此叶脉密度降低(图2)。2).
Brachypodium BR反应调控基因的鉴定
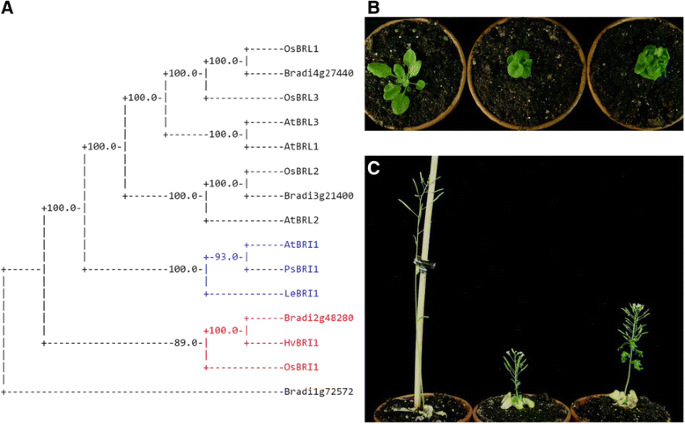
随着全基因组序列的释放Broachypodium distachyon.,我们能够在该物种中寻找可能参与油菜素内酯生物合成或信号转导的同源物。我们利用拟南芥蛋白的氨基酸序列对Brachypodium数据库进行BLAST搜索,然后使用多序列比对(MSA)和系统发育分析,将同源候选蛋白的数量减少到每个蛋白一个,以进一步评估。以BIN2为例,利用拟南芥BIN2、BIN2- like 1 (BIL1)和BIN2- like 2 (BIL2)以及水稻同源物OsGSK1、OsGSK2和OsSKetha进行MSA和系统发育分析。我们还做了第二次MSA,包括答:芥bin2,来自人的gsk3(p49841)和d .腹(P18431),和米饭OsKetha(Y13437)使用T-Coffee程序筛选保存的图案。我们观察到,在Brachypodium同源物中也存在激酶结构域和TREE结构域,它们被酪氨酸激酶II确定为苏氨酸磷酸化位点,因此对负调控事件很重要。3.).因此,我们选择Bradi2g48280那Bradi2g32620那Bradi2g36370那Bradi1g23550那Bradi1g69040那Bradi4g43110,Bradi1g15030同源染色体的BRI1那BIN2那BSU1那BZR1那DWF4那CPD,BR6ox2,以作进一步的描述。
BrachypodiumDWF4那CPD,BR6OX2同源物在反馈调节下
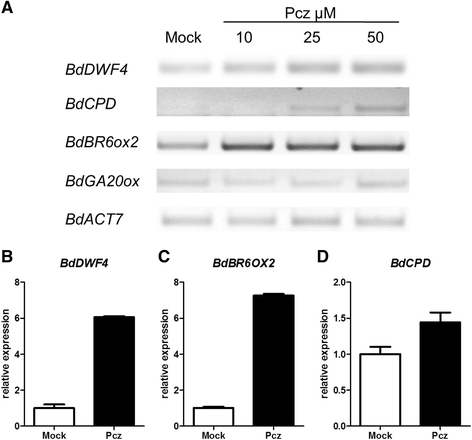
验证生物信息学工具所鉴定的基因与生物合成基因的同源性b . distachyon我们考察了承受各种PCZ处理苗木的成绩单水平。为了获得基因表达响应于所述治疗的一般意义上,我们与用模拟沿三个不同浓度的PCZ(10,25,和50μM)处理的秧苗进行半定量RT-PCR分析。我们注意到,这三个BR相关基因的转录水平随着PCZ浓度增加。该GA生物合成基因GA20ox1作为Pcz处理的对照,以确保只有br相关基因被抑制(图。4).确定产生了明显的转录反应的条件之后,我们进行了类似的实验中只使用模拟和一个PCZ浓度(50μM)来分析BdDWF4那BdBR6ox2,BdCPD实时定量RT-PCR检测mRNA水平。对于前两个基因,pcz处理后的幼苗的表达量比模拟处理增加了6倍以上BdCPD仅轻微上调(图。4罪犯).尽管如此,三个候选基因被发现都处于负反馈调节,这是参与BR生物合成的基因的特征。正常情况下,这些基因的表达被BR的存在抑制,当BR水平较低时,如在抑制剂的作用下(即,一种负反馈机制调节BR下游基因的活性),这些基因的表达就会增强。因此,Bradi1g69040(BdDWF4),Bradi4g43110(BdCPD),Bradi1g15030(BR6ox2)可能确实参与BR的生物合成Broachypodium distachyon..
过度的BdDWF4在拟南芥长而纤细的植株
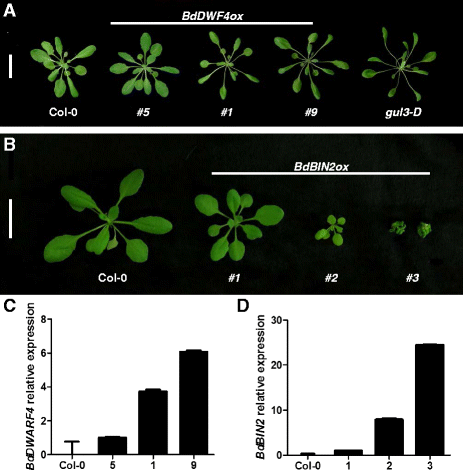
进一步评估BdDWF4在BR反应中,我们将该基因的全长编码序列引入答:芥在CAMV 35 S启动子下。从总共分析了26个BdDWF4overexpressing行(bddwf4ox.),半显示在植物高度的增加,并且具有更长的和更窄的叶子比野生型对照,Col-0中(图5).这些特征是典型的芸苔类固醇过度突变植物,例如gulliver3 - D(gul3-D.),其中BR水平的增加是激活标记的结果DWF4.对转基因植物中表达水平的分析证实,表型程度与转录水平成正比(图。5度).结果强烈表明,Bradi1g69040在…中起重要作用Brachypodium生长和发育,可能是在BR生物合成途径中发挥作用。
过度的BdBIN2导致生长发育不良的表型
然后我们过表达了一个参与BR信号转导的候选基因BdBIN2,在答:芥研究该基因对转基因植物表型的影响。在总共32个被分析的株系中,近14%的转基因植株表现出严重的矮化表型,不能开花,几周后死亡(图2)。5 b).这些极矮植株的转录本积累量最高(图2)。5 d).其他BdBIN2ox与野生型相比,品系表现出更温和的表型,能够产生种子,但仍然表现出紧凑的身材和更小的卷曲叶片(图。5 b).这些发现暗示着Bradi2g32620Brachypodium是BRIN2的功能同源体,作为BR信号通路的负调控因子。
BdBRI1过表达不会恢复弱表型答:芥bri1-5.
搜索BRI1在Brachypodium基因组中产生了三个候选基因(附加文件3.表S1),我们将其与其他在不同双子叶植物中描述的BRI1蛋白(答:芥豌豆(Pisum一)和番茄(Lycopersicon esculentum)及单子叶植物(水稻(奥雅萨苜蓿)及大麦(大麦芽)植物。作为参考,我们还使用了拟南芥和水稻中BRI1-LIKE蛋白BRL1、BRL2和BRL3。如图所示6,我们观察到的蛋白质产物Bradi2g48280与单子叶同源基因BRI1在同一类群,虽然与AtBRI1的氨基酸序列同源性仅为53%,但与单子叶同源基因BRI1的氨基酸序列同源性超过80%。为了测试Bradi2g48280(从今命名为BdBRI1)具有与AtBRI1相同的功能,我们进行了异源互补实验。具体来说,我们检查了是否过度表达BdBRI1能恢复br不敏感的矮化表型吗bri1-5.突变体,是弱等位基因AtBRI1.在第一次实验中,我们获得了13个独立的株系,所有株系都表现出类似于矮秆的表型bri1-5..类似地,在第二变换我们获得了另一个21个的转基因品系的Basta的其中没有显示出表型救出抗性(附加文件4.:图S3A);bri1-5 / bdbri1ox.线条略高于bri1-5.对照,但叶片形态异常,仍然矮化(图。6 c).这些结果表明,尽管Bradi2g48280可能是同系物吗拟南芥BRI1,这两个基因可能具有不同的结构和/或功能,使得BdBRI1在拟南芥中不能作为BR受体运行。
讨论
敲除和激活标记突变体的使用促进了许多重要基因的特性,涉及植物激素信号和生物合成途径。以BRs为例,主要在拟南芥中发现的矮生突变体的特征有助于我们对BRs生物学的理解。然而,很少有研究评估了禾本科植物中的BRs,这些作物的大多数进展都是在水稻和玉米中取得的[18-21].缺乏BR缺陷突变体是揭示BR在其他模式植物中的功能的一个障碍,在这项工作开始时,只有一个BR突变体被鉴定Brachypodium[16].随后,又出现了一个BR生物合成缺陷突变体[17].
在本报告中,我们试图通过测量一种有效和特异的BR抑制剂Pcz的作用,以Brachypodium作为模式植物,为BR生物学的研究做出贡献。我们证明了Pcz处理模拟了缺乏油菜素内酯的植物的典型矮化表型,而且这种反应是剂量依赖性的,类似于拟南芥和玉米[18].50 μM Pcz处理导致幼苗表型严重,特别是根系,与模拟处理相比,根长减少了75%,叶长减少了近34%。对根的显著影响可能与应用Pcz的方法有关。当我们将幼苗种在用Pcz溶液浸泡过的蛭石土壤中,根系与Pcz有永久直接的接触,而气生组织则没有。尽管如此,这种方法不仅能够导致叶片长度的减少,而且还能导致叶片中的其他表型,这些表型与过度表达BR负调控因子BIN2的转基因水稻植株中描述的表型相似[10].
虽然pcz处理的叶片起初发育相对正常,但随后卷曲,特别是向顶部卷曲,与模拟处理相比,叶片的宽度和厚度增加。通过对叶片截面的进一步分析,可以进一步揭示Pcz对这些组织的脉序模式或细胞组织的可能影响。考虑到使用化学抑制剂在短叶植物中获得的表型,我们认为Pcz处理是研究该模式植物中BRs的有力工具。Pcz可用于研究维管和气孔发育、根生长、细胞伸长和分生组织细胞维持等已知BR在其中发挥积极作用的具体过程[22那23].
BR生物合成基因主要在转录水平进行调控,这种调控主要由转录因子BZR1介导,其他转录因子也进行辅助调控。当BR信号被激活时,BZR1的去磷酸化(即活性)形式与BR合成基因的启动子序列结合,抑制其转录。这种机制被称为BR生物合成基因的负反馈下调[4.那24].这样,BL处理降低了DWF4那CPD,BR6ox2而Pcz应用则有相反的效果,因为它降低了BR水平[18].考虑到生物合成基因的这种反馈调节,我们评估了候选br相关基因的转录水平BdDWF4(Bradi1g69040),BdCPD(Bradi4g43110),BdBR6ox(Bradi1g15030)。我们观察到三个候选测试的pcz依赖诱导,尽管增加BdCPD表达量低于其他两个基因。然而,此前在拟南芥中也观察到了类似的结果CPD在PCZ应用[18],可能是因为另一种机制调节的转录后水平CPD.综上所述,BdDWF4那BdCPD,BdBR6ox在Pcz处理下,一旦BR水平降低,则在转录水平上受到反馈回路的调控,表明它们可能是参与BR合成的酶。
到目前为止,许多BR基因的同源性特征为答:芥已经在不同的单子叶植物物种被确定和这些作品大多是基于表型的变异,从植物中描述,在大多数情况下,目前侏儒症或其他特征BR相关的表型。然而,并非许多研究探讨在拟南芥这些建议的同源基因的过量表达异位的影响,如果他们履行其双子叶相当于类似角色的检查。一些例外是玉米的表达DWF4(ZmDWF4)和米饭GSK1的同系物之一BIN2,在拟南芥[25那26].异位的超ZmDWF4生成拟南芥植物,叶柄较长,叶片较窄,尺寸增加[25,这与我们过表达BdDWF4得到的效果相似。这种典型的促生长表型也可以通过转基因植物的过表达表现出来AtDWF4[27]和功能的突变体gulliver3-D./矮人4 - D,我们用它来比较过度表达的效果[28].对于BIN2,由于其调节BZR1/BES1降解的作用,观察到相反的表型。水稻的异种表达BIN2同族体OsGSK1在拟南芥中产生的植株高度仅为对照植株的三分之一[26].同样,过表达BdBIN2在我们的实验中影响株高和其他特征,但影响程度更大。这种差异可能是由于OsGSK1在BR信号中起次要作用,因为在水稻中BIN2的另一个同源物OsGSK2似乎是一个更突出的负调控因子,在转录因子如OsBZR1、LIC和DTL的上游起作用[10].
到目前为止,BR受体BRI1的同源物已经在三个单子叶植物中被鉴定和研究,包括水稻、大麦和Brachypodium [29-32].Brachypodium中BRI1同源物的功能在植物研究中得到揭示BdBRI1RNAi技术的沉默[30.],而其他两个物种的同源性则用突变植物进行了表征。除了OsBRI1外,在水稻以及水稻和大麦的不同等位基因中也发现了BRI1-LIKE同源物(OsBRL1和OsBRL3)BRI1已在后来的著作中发现[33那34].然而,这些研究未能确定在双子叶植物中BRI1的单子叶同源物是否能够作为BR受体。这一事实确实很重要,因为BR合成的最终产物和单子叶中活性更高的BR似乎不是油菜素内酯,而是蓖麻酮。因此,在单子叶植物和双子叶植物中,BRI1的结构还有待于比较[11].为此,我们首先搜索了短叶藻基因组BRI1推定的同源物。我们发现了Bradi2g48280可能在犁囊中的BR受体起作用[30.];然而,为了验证我们的假设,我们克隆了该基因并在答:芥bri1-5.突变体植物。令我们惊讶的是,全长编码序列BdBRI1无法拯救的矮化表型bri1-5.,这是一个弱等位基因bri1.尽管植株表达的是短叶柄版本的BRI1(附加文件4.:图S3B).部分转基因株系株高略有提高,但叶片仍呈极卷曲,开花和种子形成缺陷。据我们所知,这是BRI1单子叶版本首次在大肠杆菌中表达答:芥评估互补是否可行。我们的结果为比较双子叶和单子叶植物中BRI1的功能和结构迈出了早期的一步,从而拓宽了对作物植物中BRI1反应的理解。BRs对植株大小、育性和叶片倾斜度等生理反应具有深远的影响,是控制植株构型向理想农艺性状方向发展的良好生物技术靶点。brachiypodium BR基因的鉴定和表征以及基因工程的应用有可能提高重要作物的产量,甚至可能减少肥料的使用,减少对环境的负面影响。
结论
我们的研究结果表明,丙环唑在Brachypodium上的使用模拟了BR缺陷或-钝感植物的矮化表型,因此Pcz是研究BR在该模式植物中的响应的有力工具。我们鉴定了Brachypodium BR生物合成途径DWF4、CPD和BR6ox2以及BR信号通路BRI1、BIN2、BSU1和BZR1的组分。我们表明,BdDWF4那BdCPD,BdBR6ox在转录水平上是否受负反馈回路调控BdDWF4在拟南芥中赋予转基因植株与过表达拟南芥DWF4表型相似的基因。我们的结论是,Bradi1g69040那Bradi4g43110,Bradi1g15030(BdDWF4那BdCPD,BdBR6ox分别)编码BR生物合成基因,其功能与拟南芥同源基因相似。不同的表达Bradi2g32620(BdBIN2)导致拟南芥矮化表型。因此我们得出结论Bradi2g32620Brachypodium可能作为BR负调控因子。此外,Bradi2g48280(BdBRI1)基因可能是Brachypodium的BR受体。然而,全长编码序列BdBRI1无法拯救的矮化表型bri1-5.,这是一个弱等位基因bri1在拟南芥中。这个结果表明,BdBRI1和BRI1可能不会在功能上等同。需要进一步的调查,以验证在单子叶和双子叶植物的生物学BR的差异。
方法
植物材料及生长条件
Broachypodium distachyon.根据Hong等人之前的描述,本研究采用群落标准二倍体自交系Bd21生态型[35].种子在水浸滤纸中灭菌并发芽3天后移栽土壤。植物在22°C和长日照(16 h光照,8 h黑暗)光周期的生长室内条件下生长。拟南芥野生型Col-0和Ws-2生态型或突变种子(gulliver3-D.和bri1-5.)表面消毒后洒于琼脂凝固MS (Murashige and Skoog)培养基上。在4°C分层3天后,将平板转移到生长室,在22°C长日条件下生长。10天后,将幼苗移栽到土壤中,并在生长室内保持相同的条件。
化学处理和形态分析
所有的治疗Brachypodium,将3日龄的幼苗转移到用指定浓度的丙环唑溶液或模拟物(DMSO)浸泡的粗蛭石中作为对照植株,再生长7天。幼苗在正常的长时间生长条件下被保存在生长室内,除了那些在黑暗条件下生长的幼苗,这些幼苗的生长板被铝箔覆盖,以模拟在完全黑暗下的生长。然后对植物进行收割、拍照,并使用ImageJ软件进行分析。叶长由根-枝过渡区至主叶尖端测量,而根长由主根长度决定。对于叶子的宽度,每片叶子都在精确的中间测量,以便进行适当的比较。测量完成后,将叶子从中间切开,用乙醇(EtOH)溶液清洗。切片首先在37°C的90% EtOH中清洗3小时。如果有必要,更换90%的溶液以加速清洗。然后在50%溶液中替换5分钟。切片清除后,置于50%乙醇稀释的1% saffranin O中过夜,使静脉呈现鲜红色,便于显微镜下观察。采用Primo Vert倒置显微镜(Zeiss)对样品进行检查和成像,然后使用ImageJ软件计算总宽度和静脉间距等参数。
促识别Br相关基因在刷孔中
使用UniProt服务器(http://uniprot.org/blast/)、拟南芥和水稻(奥雅萨苜蓿)利用BLAST技术在短叶木基因组中搜索br相关基因。每一次搜索都使用已知的拟南芥BR信号通路蛋白BRI1、BIN2、BSU1、BZR1的多肽序列,以及合成的DWF4、CPD、BR6OX2的多肽序列。使用T-Coffee多重序列比对服务器(http,//tcoffee.crg.cat/)对已鉴定的序列进行多序列比对(MSA),这些序列至少具有40%的同源性,之前已经对其他植物中具有相同功能的蛋白进行了特征分析。使用BoxShade软件(http,//embnet.vital-it.ch/software/BOX_form.html)对保守序列进行识别和可视化。利用获得的MSA构建Neighbor-joining系统发育树,以说明已知蛋白和候选同源蛋白之间的相关性b . distachyon并选择一个进行进一步的描述。br相关蛋白和候选蛋白的列表b . distachyon用于校准和MSAs可在(附加文件3.:表S1)。
RT-PCR和实时定量RT-PCR
用于基因表达分析,总RNA从模拟转或制备PCZ-处理b . distachyon幼苗使用Trizol (Qiagen)。用M-MLV酶(ELPIS)逆转录RNA (2 μg),按照厂家说明合成cDNA,作为PCR反应的模板。对于半定量RT-PCR,将得到的cDNA样本稀释(1,10),并使用等量的量扩增每个基因。基因表达水平用BdACT7作为参照基因。采用Applied Biosystems StepOne real-time PCR System和Power SYBR Green PCR Master Mix结合设计的特异性引物进行实时定量RT-PCR检测BdDWF4那BdBR6ox2,BdCPD(附加文件5.:表S2)。反应进行三次,并使用所有样品的连续稀释cDNA混合生成标准曲线,对产物进行定量。相对表达,代表fold的变化在模拟对照,是标准化的每个cDNA样本使用BdACT7内部控制。作为阴性对照(NC),我们使用等量的蒸馏水样品。在RT-PCR的情况下,优化条件,直到样品中观察到预期大小的清晰条带,NC中未检测到条带。在定量RT-PCR中,NC与样品一起运行三次,通常给我们一个不确定的Cт值或至少高于我们标准曲线中最稀释的样品的值,以证明我们的引物在每次运行中的准确性和特异性。每一套引物的熔化曲线也由应用生物系统的StepOne软件(v2.3)自动生成。
克隆BdDWF4那BdBIN2,BdBRI1
来表达BdDWF4那BdBIN2,BdBRI1下花椰菜花叶病毒35S启动子(35S)答:芥,提取RNA,合成cDNAb . distachyon10日龄的幼苗和特异性引物(附加文件5.表S2)用于扩增感兴趣的全长编码序列(CDSs)。采用Invitrogen Gateway入口载体pENTR/SD/D-TOPO结合目的载体pEarleyGate101 (C-YFP-HA),对PCR产物进行纯化和克隆。利用常规方法将构建物转化为拟南芥农杆菌属介导技术。为了35个年代那BdDWF4和35个年代那BdBIN2,使用的是Col-0背景中的植物,而for35个年代那BdBRI1,结构被引入bri1-5.突变体的背景。在添加50 mg/L BASTA的MS培养基上筛选转基因苗。
缩写
- BAK1:
-
BRI1相关受体激酶1
- BIN2:
-
BR不敏感2
- 提单:
-
油菜素内酯
- BR:
-
油菜素内酯
- BR6ox2:
-
BRASSINOSTEROID-6-OXIDASE 2
- BRI1:
-
油菜素内酯不敏感的1
- BZR1:
-
BRASSINAZOLE耐1
- CPD:
-
本构PHOTOMORPHOGENIC矮
- CS:
-
Castasterone
- 迪泰:
-
矮秆低分蘖
- DWF4:
-
矮4
- 葛兰素史克公司:
-
GSK3 /粗像激酶
- 地方政府投资公司:
-
舵柄角增加控制器
- PCZ:
-
Propiconazole
- TUD1:
-
太湖矮1,赤霉素,赤霉素,BRD1,油菜素内酯缺陷矮1
参考
- 1.
陈志刚,陈志刚。油菜素内酯。中国科学(d辑:地球科学)1997;14(1):1 - 10。
- 2.
Clouse SD, Langford M, McMorris TC。拟南芥中一个油菜素激素不敏感突变体在生长发育中表现出多种缺陷。植物杂志。1996;111(3):671 - 8。
- 3.
Choe S, Dilkes BP, Fujioka S, Takatsuto S, Sakurai A, Feldmann KA。拟南芥的DWF4基因编码一个细胞色素P450,介导油菜素内酯生物合成中的多个22 -羟基化步骤。植物细胞。1998;10(2):231 - 43。
- 4.
Chung Y,Choe S.在拟南芥中对芸苔类固醇生物合成的调节。CRIT Rev Plant Sci。2013; 32(6):396-410。
- 5.
黄志强,黄志强。油菜素内酯生物合成与矮化突变体。植物学报,2005;48(1):1 - 15。
- 6.
李军,金华。油菜素内酯信号转导的调控。植物科学进展。2007;12(1):37-41。
- 7.
金TW,王征。油菜素内酯从受体激酶到转录因子的信号转导。植物学报2010;61:681-704。
- 8.
仝红,朱志强。油菜素内酯的信号转导及其在水稻中的应用。遗传与基因组学杂志=易传学报。2012年,39(1):3 - 9。
- 9.
植物激素与水稻产量、遗传改良策略与机遇。转基因研究杂志2006;15(4):399 - 404。
- 10.
佟华,刘丽丽,金勇,杜丽,尹勇,钱强,朱丽,楚楚成。矮秆和低分蘖对水稻油菜素内酯反应的调控作用。植物细胞,2012;24(6):2562 - 77。
- 11.
kimbk, Fujioka S, Takatsuto S, Tsujimoto M, Choe S. Castasterone可能是水稻油菜素内酯生物合成途径的最终产物。生物化学学报。2008;37(4):614-9。
- 12.
张超,徐勇,郭胜,朱军,环强,刘辉,王磊,罗刚,王鑫,Chong K.负性调节因子LIC调控水稻油菜素内酯反应的动态。公共科学图书馆麝猫。2012;8 (4):e1002686。
- 13.
关键词:矮秆,低分蘖,油菜素内酯,信号转导,水稻植物杂志,细胞和分子生物学。2009; 58(5): 803 - 16。
- 14.
Hu X, Qian Q, Xu T, Zhang Y, Dong G, Gao T, Xie Q, Xue Y. The U-box E3 ubiquitin ligase TUD1 and a heterotrieric G alpha subunit in调控油菜素内酯介导的水稻生长。公共科学图书馆麝猫。2013;9 (3):e1003391。
- 15.
Girin T, David LC, Chardin C, Sibout R, Krapp A, Ferrario-Mery S, Daniel-Vedele F. Brachypodium,模型物种和谷物之间的一个有前途的枢纽。J Exp Bot. 2014;65(19): 5683-96。
- 16.
Thole V, Peraldi A, Worland B, Nicholson P, Doonan JH, Vain P.短柄草T-DNA突变的研究。中国生物医学工程学报。2012;63(2):567-76。
- 17.
Xu Y Y, Zhang X ., Li Q ., Cheng Z ., Lou H., Ge L., An H. BdBRD1: brassinosteroid C-6 oxidase homolog in Brachypodium distachyon L., and is required for multiple organ development.(作者简介:徐永强,张旭,李强。)植物生理生化。2015;86:91-9。
- 18.
作者简介:Hartwig T, Corvalan C, Best NB, Budka JS, Zhu JY, Choe S, Schulz B. a specific and accessible brassinosteroids (BR) biosynthesis inhibitor for Arabidopsis and maize.作者简介:《公共科学图书馆•综合》。2012;7 (5):e36625。
- 19.
张C,白我,冲K.油菜素介导的水稻农艺性状的调控。植物细胞报道2014; 33(5):683-96。
- 20.
马凯瑞维奇1,汤普森A,米尔鲍尔GJ,施普林格NM。玉米Brd1基因编码油菜素内酯C-6氧化酶。《公共科学图书馆•综合》。2012;7 (1):e30798。
- 21.
陈志强,陈志强,陈志强,等。油菜素内酯对玉米性别的影响。中国科学院院刊2011;108(49):19814-9。
- 22.
Singh AP,Savaldi-Goldstein S.生长控制,芸苔类固醇活动得到了背景。J Exp Bot。2015; 66(4):1123-32。
- 23.
法布雷加斯N,卡诺-德尔加多AI。打开显微镜转塔,为油菜素内酯信号转导在植物发育中的研究提供了新的视角。杂志。2014;(2)151:172 - 83。
- 24.
Kim HB, Kwon M, Ryu H, Fujioka S, Takatsuto S, Yoshida S, An CS, Lee I, Hwang I, choi S矮人4油菜素内酯在拟南芥中的表达可能是维持生物活性油菜素内酯稳态的关键机制。植物杂志。2006;140(2):548 - 57。
- 25.
刘天生,张建平,王美美,王志勇,李光国,曲丽,王国英。玉米(Zea mays L.)拟南芥DWF4基因的表达及功能分析。植物学报2007;26(12):2091-9。
- 26.
酸值S,李SC,金MK,酸值JH,李S,一个G,崔S,金SR。T-DNA敲除标记大米OsGSK1,拟南芥BIN2的直向同源物,突变具有增强耐受性的多种非生物胁迫。植物mol biol。2007; 65(4):453-66。
- 27.
Choe S, Fujioka S, Noguchi T, Takatsuto S, Yoshida S, Feldmann KA。在油菜素内酯生物合成途径中过表达DWARF4会增加拟南芥的营养生长和种子产量。植物j . 2001; 26(6): 573 - 82。
- 28.
金B,藤冈S,权男,全度Ĵ,崔S.拟南芥油菜素类固醇,过量生产gulliver3-d / dwarf4-d突变体表现出对茉莉酸和病原体改变的响应。植物细胞报道2013; 32(7):1139至1149年。
- 29.
蝶野男,本田I,Zeniya H,米山K,宰相d,武田K,Takatsuto S,星野T,从在该基因的核苷酸取代编码推定的油菜素类固醇受体大麦UZU结果渡边Y.甲半矮化表型。植物理性。2003; 133(3):1209年至1219年。
- 30.
关键词:油菜素内酯受体(BdBRI1),矮化表型,抗旱性植物科学,国际实验植物生物学杂志。2015; 234:163 - 73。
- 31.
Nakamura A, Fujioka S, Sunohara H, Kamiya N, Hong Z, Inukai Y, Miura K, Takatsuto S, Yoshida S, Ueguchi-Tanaka M,等。OsBRI1及其同源基因OsBRL1和OsBRL3在水稻中的作用。植物杂志。2006;140(2):580 - 90。
- 32.
一种水稻油菜素内酯不敏感同源基因的功能缺失阻止了节间和叶片关节的伸长和弯曲。植物细胞。2000;12(9):1591 - 606。
- 33.
赵军,吴超,袁胜,尹龙,孙伟,赵强,赵斌,李晓霞。油菜素内酯调控水稻生长发育的关键酶OsBRI1激酶活性。植物科学,国际实验植物生物学杂志。2013; 199 - 200:113 - 20。
- 34.
Gruszka D,Szarejko I,Maluszynski M.编码大麦铜氏菌类固醇受体的HVBRI1基因的新等位基因。J Appl Genet。2011; 52(3):257-68。
- 35.
洪诗,李诗,徐pj,杨ms, Park CM。单子叶植物和双子叶植物中一株短叶苔GIGANTEA基因的鉴定及功能保护。acta botanica sinica(云南植物学报),2010;72(4-5):485-97。
致谢
不适用。
资金
这项研究部分是由三个基金支持的;第一个下一代生物绿色21计划(PJ01104501)资助项目参与了该研究的设计;论文由韩国政府第三届韩国国家研究基金会(NRF)资助项目(MSIP) (No. 2015R1A2A1A10051668)撰写。
数据和材料的可用性
本研究中产生或分析的所有数据均可在合理要求下由通讯作者提供。
作者的贡献
CC进行实验,分析数据,撰写手稿。SC作为主要的指导老师,设计了整个研究,支持了实验,解释了数据,撰写了手稿。两位作者都已阅读并批准了本手稿的最终版本。
利益争夺
两位作者宣称他们没有相互竞争的利益。
同意出版物
不适用。
伦理批准和同意参与
不适用。
作者信息
从属关系
相应的作者
附加文件
附加文件1:图S1。
丙环唑暗处理下,短叶木幼苗表现出矮化现象。模拟处理和50 μM Pcz处理7日龄幼苗的形态。(PPTX 1022 kb)
附加文件2:图S2。
丙环唑处理降低了短叶木幼苗的叶片和根的长度。模拟(白色条状)或50 μM Pcz(黑色条状)暴露7天后幼苗、叶片和根的总长度。图表代表平均值(N> 10)和误差柱标准差。处理之间的显著差异由学生的决定T.以及,* * *,P.< 0.0001。(45 PPTX kb)
附加文件3:表S1。
BR基因列表答:芥和短柄草同源候选。(多克斯17 kb)
附加文件4:图S3。
表型相关BdBRI1ox线和BdBRI1记录积累。(A)在Basta培养基和Ws-2野生型和Ws-2转基因植株中选择的5周龄转基因植株的形态bri1-5.突变体控制。(B)的表达BdBRI1通过RT-PCR证实了其中5株转基因植物的基因。AtUBQ10作为内部加载控制。(PPTX 1026 kb)
附加文件5:表S2。
研究中使用的引物。(多克斯14 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
陈志强,陈志强,陈志强,等。油菜素内酯类基因的鉴定Broachypodium distachyon..BMC植物杂志17,5(2017)。https://doi.org/10.1186/s12870-016-0965-3
收到了:
公认:
发表:
关键字
- BIN2
- Broachypodium distachyon.
- Brassinosteroids
- BRI1
- DWF4
- 单子叶植物分支
- Propiconazole