摘要
背景
土壤内的植物根部的运动是它们与环境相互作用的能力的关键,并最大限度地提高锚固和营养采集。通过感测外部提示,激素信号传导和细胞骨骼变化的组合来产生根的方向生长。生长在倾斜的鳞型生长培养基上的根部显示特征挥舞和偏移,并且在这些表型上的偏差有助于鉴定根运动所需的基因。我们的研究确定了一个角色反式-GOLGI网络局部蛋白质,根偏斜。
结果
我们发现拟南芥TNO1 (tgn定位的syp41相互作用蛋白),推测是定位于反式-GOLGI网络,影响根偏斜。tno1敲除突变体显示增强的根倾斜和表皮细胞锉旋转。偏离tno1根在微管稳定时增加,但对微管稳定不敏感。微管的不稳定导致细胞形态的严重缺陷tno1幼苗。微管阵列取向不受突变根部的影响,表明细胞文件旋转的增加与微管阵列的取向无关。
结论
我们得出结论,TNO1在依赖于微管的机制中调节根偏移,而是与微管阵列的取向的破坏有关。此外,TNO1需要维持在根系成熟区域和幼杆基碱中的细胞形态。因此,TGN局部的圈套机械可能对于根生长期间适当的表皮细胞文件旋转和细胞扩张可能是重要的。
背景
植物根系的建立对植物有效的扎根和养分的获取至关重要。根的开发和体系结构都得到了很好的研究[1]但我们对根源与土壤成分相互作用的理解仍然不完整。这是部分原因是在进入土壤时可视化根的难度,尽管最近的发展如Glo-Roots平台辅助在这一过程中的成像[2,3.].根生长到底层上向根尖提供多个线索,例如机械障碍,水分和营养梯度。这些提示是集成的,然后信号下游过程涉及激素途径和细胞扩张[4].这导致累积生理响应驱动根运动并建立根系结构。
在实验室中对合成生长介质上的根系运动和定向生长的研究和模拟揭示了不同的运动类型,以及一些控制它们的基因和途径[4].根拟南芥幼苗根据外部条件显示各种生长行为。当嵌入均相介质(可渗透琼脂)时,根部响应于重力而向下生长,并且显示与重力载体的最小偏差。相比之下,当根源进行多个方向性提示时,发生复杂的生长模式[5].例如,拟南芥在倾斜的冒险介质(1.5%琼脂)上生长的根部显示了沿着它们的轨迹(挥动)的周期性波状图案的垂直(偏斜)的特征偏差。这是由于触摸的组合[6],祖食主义[7],回旋运动[5根尖与生长培养基之间的物理相互作用[8].
弯曲和波浪状的根表现出沿根表皮细胞锉旋转的特征,称为细胞锉旋转(CFR)。当根拟南芥树苗倾斜和波动,正弦波序列在左手和右手CFRs之间交替,这与它们分别向右和向左运动有关[6,7].根据卢瑟福和Masson(1996),从所述板的背面看时歪斜被描述为向右或向左[7[虽然CFR的手交易被定义为左手或在观察根指向射击的轴时右手。根拟南芥在倾斜的硬质介质上生长,在生长轴上表现出显着的左旋旋转,导致主要是逆时针/左手左手表皮CFR。这通常对应于从板后部看到的右偏斜[7,9,10.].CFR还通常与扭曲小区文件中的倾斜微管(MT)阵列取向相关,尽管存在异常确实存在[11.].
外部提示(例如水分,光或重力),激素途径和细胞骨骼和细胞壁动力学的多种因素影响了根系生长的方向[4].激素信号通路的变化,包括生长素[12.- - - - - -14.),乙烯(8,15.),细胞分裂素(16.和油菜素内酯途径[17.].在激素和环境感知的下游,细胞骨架和细胞壁沉积模式的变化调节细胞分裂和细胞扩张动力学,从而介导根的运动。微管蛋白结构或活性或MT相关蛋白的缺陷导致MT动力学和排列方向的改变。这将导致细胞膨胀的变化,并影响CFR和倾斜[18.,19.].细胞壁特性和细胞壁组分向质膜的运输是根伸长和运动的关键,从观察到的在纤维素沉积、细胞壁锚定蛋白或细胞壁组分交联缺陷的突变体中改变的根运动推断[20.- - - - - -22.].
细胞壁组分的分类发生在反式高尔基网络(TGN),由两个或三个成熟的管状泡状细胞器反式-高尔基人的大部分贮水池[23.].它作为早期核内体,接受内吞物质,并指导液泡和分泌物质的运输,具有不同的亚域,在各种运输途径中起作用[24.- - - - - -30.].特定膜融合因子称为绞死(可溶N-乙基马来酰亚胺敏感因子附着蛋白受体)维持细胞内囊泡运输保真度和货物分类[31.].tgn定位的SYP4 (41/42/43) SNARE家族在调节生长素稳态和抗病的多种运输途径中是必需的[30.]. SYP61是另一个TGN定位的陷阱,与SYP41相互作用,在液泡运输和细胞壁酶(如纤维素合成酶和果胶多糖修饰蛋白)的分泌中发挥作用。这表明SYP61在细胞壁成分和酶的合成和修饰中起着重要作用[32.- - - - - -34.].TNO1 (tgn定位的SYP41相互作用蛋白)是一种与SYP41 SNARE机制相互作用的tgn定位的螺旋-螺旋蛋白。缺乏TNO1的突变植株(tno1)部分错误分拣空泡货物,错误定位SYP61,显示TGN动力学改变和缓慢的重力响应[35.,36.].
TGN的转运在生长素反应、细胞壁组分的转运和细胞扩张中发挥作用,所有这些都对根的生长和运动非常重要。此外,向重力弯曲被延迟tno1根,这表明在根中的定向生长缺陷。因此,我们在根运动考察潜在功能TNO1。我们在这里报告,TNO1作为根歪斜的负调节因子,因为tno1突变根具有增强的倾斜,这也与增强的CFR相关。
方法
植物材料及生长条件
拟南芥Col-0(野生型,WT)和tno1敲除突变体(Salk_112503)是从拟南芥生物资源中心获得的;补充tno1突变体以前在我们的实验室产生[35.].拟南芥种子在33%漂白剂中被表面灭菌,0.1%(V./ v)Triton X-100 20分钟,用无菌水冲洗5次,在4℃下保持在黑暗中,至少2天,然后进行下面描述的根偏斜和挥动测定或药物敏感性测定。拟南芥下胚轴通过电镀在0.5X固体的Murashige-Skoog的(MS)培养基灭菌的种子[(的Murashige-Skoog的维生素和盐的混合物,沉箱,MSPA0910]用1%蔗糖,2.4毫MES(pH为5.7),和0.8%(分析W./V.)PhyoBlend琼脂(Caisson,PTP01)并在22°C的黑暗中垂直生长。
根偏斜和挥动测定
如前所述进行倾斜和摆动分析[7,37.].拟南芥植物在22℃长日照条件(16 h光照)下生长,在0.5X Murashige-Skoog (MS)固体培养基(Murashige-Skoog维生素和盐混合物,藻井,MSPA0910), 1%蔗糖,2.4 mM MES (pH 5.7), 1.5% (W./V.)Phytoblend琼脂(沉箱,PTP01)。幼苗进行3天,之后根尖位置被标记为垂直地生长。然后将板向后倾斜,30O.然后再生长4天。使用尼康SMZ1000光学显微镜和尼康S10 CoolPix相机从平板背面采集根的图像。使用Image J进行根参数分析[38.]. 从钢板背面向右的根尖偏差被认为是正偏差,而向左的偏差被认为是负偏差。
根形态分析按所述进行[39.].使用ImageJ软件分析倾斜/波动根的图像[38.]用于测量根尖横坐标(Lx)和根长(L),然后计算水平生长指数(Lx/L)。
药物敏感性测定
在含有紫杉醇(紫杉醇,σ猫#T7191)或丙嘧啶(Sigma-Aldrich,Cat#45645)的平板上垂直生长在所示浓度下,测定根部的偏斜角度。通过将7天幼粒子置于载玻片上的温热的3%低熔点琼脂糖的表面上,分析暗种缺苗细胞表型[40[然后用Zeiss AxioPlan II光学显微镜对印记进行成像。
细胞文件旋转分析和碘化丙啶染色
根表面拟南芥使用Zeiss宏观变焦显微镜在Iowa State University的显微镜和纳米瘤设施中可视化幼苗。或者,用碘化丙锭(Thermofisher Scientific Cat#P3566)染色根。将幼苗浸入工作水溶液(10μg/ ml)碘化钛丙啶1分钟后,然后通过浸入填充用水30秒的培养皿中的两次洗涤两次。将根部安装在水中,并在爱荷华州立大学的联盟和多光子设施中使用Leica共聚焦激光扫描显微镜(Leica SP5; Leica Microsystems)。激发和发射波长分别为488nm和617nm。激光功率,扫描频率和线路平均进行了优化,并在样品之间保持恒定并复制。如上所述计算根部的CFR角度[7,41.]使用ImageJ [38.].
免疫染色和微管的分析
五日龄拟南芥在倾斜培养基上生长的幼苗被固定,免疫染色如所述[42.].鼠标反α-管蛋白抗体(Sigma-Aldrich,Cat#T6074),稀释1:100,用于MTS的免疫标记,然后用于Alexafluor 488-缀合的山羊抗小鼠IgG(Thermofisher Scientific,Cat#A11029)作为次级抗体,稀释1:500。伸长区内的细胞通过共聚焦显微镜与爱荷华州立大学的联合型激光扫描显微镜(Leica SP5; Leica Microsystems)进行成像,使用40x(1.25 na)或63x(1.4 na)徕卡浸没客观的。激发和发射波长为488nm和507nm。激光功率,扫描频率和线路平均进行了优化,并在样品之间保持恒定并复制。通过自由可用的软件包微丝分析仪(MFA)分析了共聚焦图像[43.[数据显示为软件生成的圆形图。使用Microsoft Excel将软件生成的MT角度分为三类,0到10,11至30和31至90度,并用于后续分析。
结果
TNO1的损失导致夸张的根偏移
缺乏TNO1的突变体根系伸长正常,但在重力刺激下根系向地弯曲滞后[36.].阳性祖国是驱动根挥舞和偏移的关键组件,因此我们假设TNO1可能在这些过程中发挥作用。
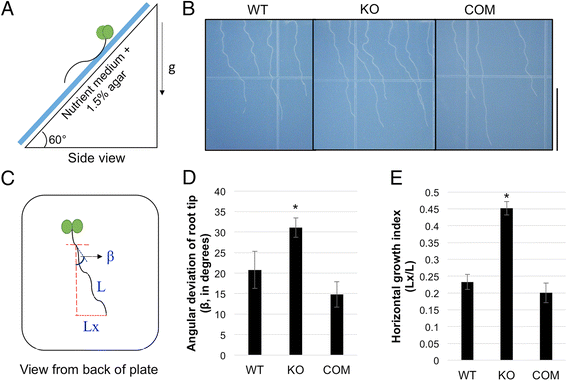
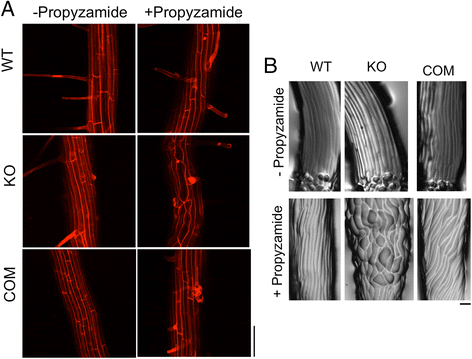
为了检验这一假设,3日龄幼苗硬琼脂培养基(1.5%琼脂)的表面上垂直生长,板放倒30O.,并允许幼苗额外4天生长(图1A).倾斜迫使根尖由于正重引起的较难式介质。由于根部未能穿透介质,电池膨胀和循环驱动根部到侧面,这在右向右校正偏差之间交替,导致特征挥动和偏斜响应[4,7].tno1突变根(KO)形成类似于WT (Col-0)根的正弦波状生长模式,但与WT根相比,其向右偏的程度更大。1B.).tno1突变体与转基因相关的突变体TNO1在自身启动子(COM)的控制下[35.与突变体相比,它们的倾斜程度降低了,并且与WT根相似(图。1B.).使用imagej分析根图像[38.[在倾斜引发时的位置(β)的位置,定量根尖从它们的位置偏差(图。1C)[7,39.].tno1突变体的偏离角比野生型或补充型根更大(图。1D;P< 0.05)。为了确认表型的差异,另一个形态参数,水平生长指数(HGI),计算斜根。HGI为根尖横坐标(Lx)与根长(L)的比值(图2)。1C)并且是一个敏感且稳健的参数,用于量化生长的横向方向,与根系形状无关[39.].当根偏斜时,根尖偏斜向右偏向于右侧,产生正LX值和负值。正LX导致正HGI值,然后在负值表明向左偏差时表示向右偏向[39.].tno1根的HGI显著高于野生型和补种系(图。1E;P<0.05),确认tno1突变体确实有更大的垂直向右偏移。
TNO1蛋白质功能的损失导致右下根偏斜增加。一个在用1.5%琼脂固化的生长培养基上进行根倾斜试验的设置侧视图。幼苗在长日(LD)条件下垂直生长3天,然后标记根尖位置。然后盘子向后倾斜30度O.然后再生长4天。bWT的照片,tno1突变体(ko)和补充tno1突变体(COM)显示根部偏离垂直方向的倾斜。比例尺= 1厘米。c根的分析示意图,用于确定根尖(β)的角度偏差,水平根尖端偏差(LX)和根(L)的长度。β和hgi(= lx / l)的较高值表明偏斜增加。D.如(a)描述的WT,KO的根尖和COM幼苗角度偏差进行根倾斜测定。E.倾斜试验测定野生型、KO和COM幼苗根系水平生长指数(HGI)。HGI是水平根尖偏差(Lx)与根长(L)的比值。所有值都代表3个生物重复的平均值,每个重复分析12-15个幼苗。误差栏表示标准错误。星号表示统计上有显着差异(P<0.05),通过Student的T.-测试
扭曲tno1根表皮细胞旋转增强(CFR)
CFR的细胞基础尚不完全清楚,但已被提出是根尖旋转的结果[20.].线圈依赖于内部机制,导致围绕生长轴的椭圆形或圆形轨迹[44.].根尖的细胞分裂的螺旋模式已被假设为表皮CFR的基础[6,10.,37.].根尖分生组织细胞外圆螺旋式的细胞分裂方式,使细胞锉呈螺旋状,从而形成CFR [45.,尽管这并不能解释为什么CFR开始于延伸区的底部,远离最初细胞分裂的位置。表皮层和内层细胞层之间各向异性膨胀率的滞后也会导致细胞文件扭曲,以补偿可能导致组织破裂的应力和应变[9].通常在根部弯曲和歪斜之前[41.],在偏斜根的伸长区的底部是可见的。向右偏斜的突变体通常显示显性左手CFR [4,11.].因此,我们假设增强的右前偏斜tno1突变体将与左手CFR的增加相关。
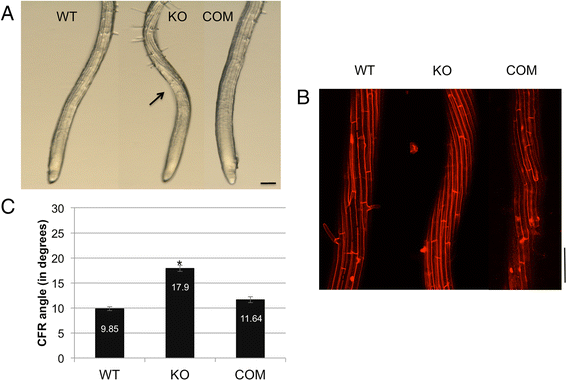
突变体根的显微镜分析显示出明显的左手系表皮CFR中根伸长区(黑色箭头,图发起。2A)而WT和补充的根源主要具有在该区域中缺乏不同CFR的细胞文件的垂直布置(图。2A).碘化丙啶染色根的共聚焦成像显示了一个独特的左手CFR,在延伸区有较高的扭曲tno1线与WT和辅助线相比(图。2B.). 使用ImageJ对图像进行分析,以量化细胞锉相对于牙根纵轴的左旋扭曲。这个tno1CFRs显著升高(P< 0.01);2C).这可能解释了突变体根的倾斜增强,因为增加的左旋可能导致更大的偏离生长轴。
偏离tno1紫杉醇能增强MT的稳定性
CFR可以通过改变的皮质MT组织直接引起,这影响了各向异性膨胀,因为MT对准控制纤维素沉积的方向[46.,47.].MT稳定性、组织和动力学缺陷的几个突变体增强了右或左偏斜,左或右撇子CFR分别占主导地位[18.]. 许多,但不是全部,也显示出皮层MT阵列的利手性,这与根延伸区的CFR利手性相反。一些MT相互作用蛋白缺陷的突变体显示右手CFR,向左倾斜,并在延伸区显示左手螺旋皮质MT阵列[48.,49.],而其他有歪斜缺陷,但在根伸长区正常横向MT阵列定向。这表明MT动力学、方向和倾斜之间的关系是复杂的。我们假设增强的倾斜和CFRtno1突变体也可能是由于皮质MT阵列组织或动态的变化。TNO1被定位于TGN,该假设从最近的研究接收到最近的研究,其中显示TGN局部化蛋白激活Kinesin并参与根偏斜和颅重塑,在根偏斜过程中连接MTS和TGN [50.].
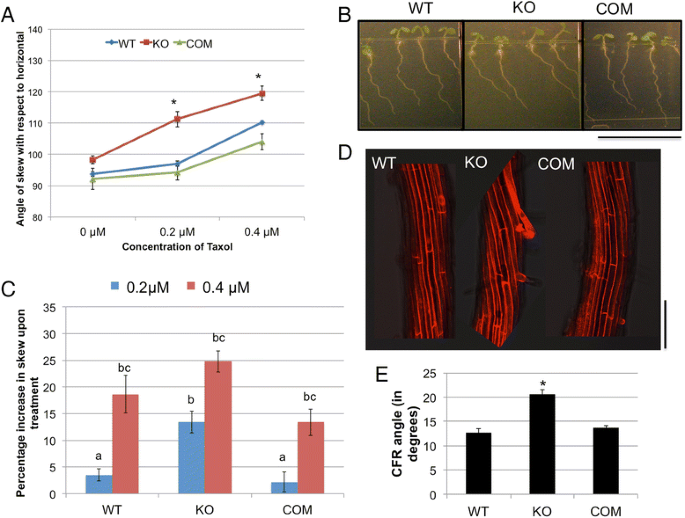
MT稳定化学紫杉醇导致MT束并增强WT根的右偏[9,51.].当垂直生长时,在增加紫杉醇浓度上(图。3A),tno1根显示出比野生型和补充线(图显著更高向右偏斜。3a,b).从0 μM到0.2 μM紫杉醇,突变体根系的倾斜角度增加的百分比显著增加(P<0.05)比在WT和互补的线根中(图。3C).我们假设这种倾斜的增加是由于根的左旋增加。在0.2 μM紫杉醇存在下,碘化丙啶染色根的共聚焦图像分析显示,根中有较大的左旋CFRtno1根与WT和补充线的比较(图。3d,E.).表型反映了紫杉醇对根生长的影响,而不是倾斜的基质的影响,因为药物分析是在垂直方向的平板上进行的。这些结果表明,MT稳定性夸大了根的倾斜和CFR表型tno1突变体。
偏离tno1紫杉醇能增强MT的稳定性。一个WT、KO和COM根在两种不同浓度紫杉醇的作用下生长,根系相对于水平方向的倾斜角。幼苗在LD条件下垂直生长5天,生长培养基用1.5%琼脂固化,含紫杉醇或溶剂作为对照。所有值代表三个生物重复的平均值,每个重复至少有12-15株幼苗。误差栏表示标准错误。星号表示统计上有显着差异(P<0.05),通过Student的T.-测试。b在0.2μM紫杉醇存在下垂直生长5天的WT、KO和COM系根的光镜图像。比例尺=1厘米。c与溶剂对照上的平均值相比,紫杉醇的每个基因型的平均偏差表示为偏斜的百分比增加。值表示3个生物重复的分析,每次重复至少12种幼苗。错误栏表示标准错误。不同的字母表示统计上显着的差异(P<0.05),通过Student的T.-测试。D.碘化丙啶染色的WT、KO和COM根延伸区共聚焦图像显示表皮CFR。根在0.2 μM紫杉醇上垂直生长5 d。比例尺= 100 μm。E.在0.2μm紫杉醇中生长的WT,KO和COM线的偏斜根的细胞文件旋转角度。所有值代表3个生物重复的平均值,每个重复至少分析了来自3个幼苗的10个细胞文件。错误栏表示标准错误。星号表示统计上有显着差异(P<0.01)由学生的T.-测试
丙烯酰胺(PPD)破坏MT对根内倾斜的影响tno1突变体
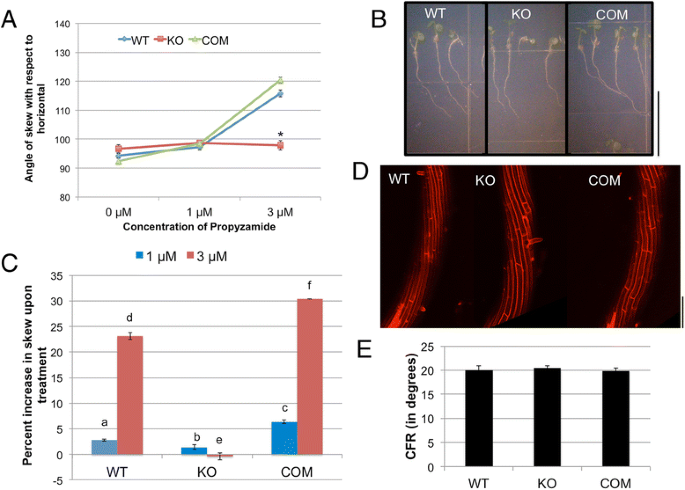
MT-Destabilized化学丙嘧啶(PPD)也增强了WT幼苗的右偏斜[9].由于MT稳定对根偏斜的影响tno1幼苗表明了基于MT的TNO1在根运动中的作用,我们测试了PPD对根部偏斜的影响tno1突变体。WT和补充根在1 μM PPD时向右倾斜轻微增加,在3 μM PPD时显著增加。令人惊讶的是,扭曲的tno1突变体的根对PPD不敏感(图。4a,b).在PPD存在的情况下,WT和补充根的歪斜增加的百分比显著高于在PPD存在的情况下tno1(无花果。4C.). 补充品系的偏斜增加略高于野生型,表明TNO1蛋白的精确表达模式可能反映在根偏斜的程度上。虽然补充系中的TNO1转基因在其天然启动子下表达,且其总体表达水平与内源性蛋白相似,但基因组内的位置效应可能导致不同细胞类型中的表达模式略有差异。
丙烯酰胺(PPD)破坏MT对根内倾斜的影响tno1突变体。一个倾斜相对于WT,KO和COM根部的水平倾斜,在两种不同浓度的PPD上生长。幼苗在长期的条件下垂直生长5天,在用1.5%琼脂固化的生长培养基上,含有PPD或溶剂作为对照。所有值代表3个生物重复的方法,每次重复至少12-15个幼苗。误差栏表示标准错误。星号表示与WT的统计显著差异(P<0.05),通过Student的T.-测试。bWT,KO的根和COM线的光学显微镜图像在3μMPPD存在5天垂直生长。比例尺= 1厘米。c与溶剂对照上的平均值相比,PPD的每个基因型的平均根偏差,表达为抑制百分比。值表示3个生物重复的分析,每组至少有12个幼苗。误差栏表示标准错误。不同的字母表示统计上显着的差异(P<0.05),通过Student的T.-测试。D.在3μM PPD上垂直生长5天的WT、KO和COM根的碘化丙啶染色延伸区的代表性图像,用共焦显微镜成像。比例尺=100μm。E.在3 μM PPD上生长的WT、KO和COM系的根的细胞文件旋转角度。所有值代表3个生物重复的平均值,每个重复至少分析了来自3个幼苗的10个细胞文件。误差条表示标准误差
我们假设减小的倾斜度tno1与PPD处理-WT的CFR相比,PPD存在下的根部与降低的CFR相关联。在3μmPPD上生长的根表面的共聚焦显微镜分析显示WT和互补表皮细胞文件的扭曲。突变的根表皮细胞文件还显示相当大的左手CFR,与WT和辅助线难以区分(图。4D,E.).因此,抵抗tno1ppd诱导的倾斜的根源与ppd诱导的CFR无关。为了解释这一观察结果,我们假设PPD处理可能对突变体的根有其他影响,包括对根的生长或形态的影响。WT的根生长速率之间没有可测量的差异,tno1当生长在PPD存在或不存在时(未显示),因此不太可能是由于生长速率的不同而导致倾斜的差异。
令人惊讶的是,成熟的地区tno1与PPD处理的WT和互补的线相比,在3μmPPD上生长的根部在细胞形态中具有更严重的缺陷,突变体显示畸形细胞(图。5A).虽然PPD治疗的WT和辅作的根具有典型的长,窄细胞,tno1突变体的根细胞较短且较宽,表明各向异性生长的缺陷。这表明在细胞成熟或细胞壁沉积中可能存在缺陷,可能会潜在地干扰细胞的能力tno1即使随着伸长区中的CFR继续形成,仍然在PPD存在下倾斜的根。PPD处理的成熟区中可能存在缺陷tno1根会影响生长中的根与基质的相互作用,进而影响根的倾斜。
为了评估突变体中的其他器官和细胞类型是否也对PPD破坏MT敏感,我们分析了对照和PPD处理的暗生长下胚轴的琼脂糖印迹。与未处理的品系相比,WT和补充品系的下胚轴基部有更宽的细胞。tno1下胚轴对PPD异常敏感,与未处理相比,其细胞形态缺陷更为严重tno1苗和PPD-处理的WT和可补苗(图5B.).PPD治疗tno1幼苗还缺乏在处理过的WT和补充线中观察到的细胞的螺旋化。如在偏斜测定中所观察到的,互补的线对PPD略微敏感,而不是WT,这再次可能是由于位置效应。在深色生长的下杆基的碱中引发细胞伸长率[52.]并且TNO1的损失可能导致这种细胞膨胀过程的易感性增加到PPD的MT稳定化。据报道,用低浓度的PPD(例如2μm)治疗导致皮质MTS的动态不稳定性降低,导致更多静态MT,与未处理的细胞相比,在暂停状态下花费更多时间的静态MT [53.]. 我们的研究结果表明,PPD对MT动力学的破坏对患者有更不利的影响tno1这可能表现为mt阵列组织缺陷,或各向异性膨胀,或两者都有,从而导致观察到的细胞形态的破坏tno1.
MT阵列在倾斜伸长单元中的取向tno1根不受影响
根伸长区的磁导系统阵列通常横向排列,以促进各向异性扩展。一些标记CFR突变体的斜根具有明显的MT斜排列,MT排列的手性与CFR相反[18.].在偏斜的角度和MT阵列的间距之间也观察到强的相关性[11.].许多突变体是在MT-相关联的进程缺陷具有与在CFR的相应变化相关联的MT阵列的间距的变化。然而,一些突变体具有提高的CFR显示没有该MT阵列的倾斜度,而是具有类似于WT根的中央伸长区细胞横向安排。例如,sku6突变体尽管其左手CFR [CFR,突变体保持MT阵列的横向对准9,54.),而mor1-1突变体,在MT聚合中受损,也显示左手CFR,但在MT阵列方向上没有偏差[55.].这些突变表型表明,除了Mt阵列方向之外,还可以对CFR的变化负责。
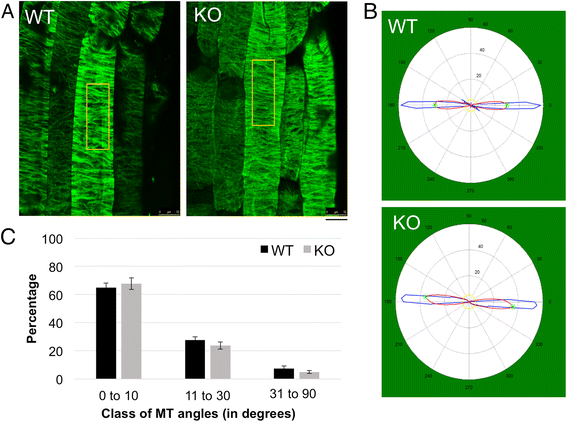
我们假设主要的左撇子CFR在tno1与野生型根相比,根在延伸区表皮细胞中对应的是右撇子MT序列。四天大的化学固定野生动物重量和tno1在倾斜的冒险培养基上生长的根,与管蛋白抗体免疫染色[42.]以检测MTS和通过共聚焦显微镜成像。表皮细胞中的突变体根部MT阵列没有显示与WT相比,表皮MT阵列间距任何不同螺旋性或变化(图6A).利用MATLAB软件包MicroFilament Analyzer对采集的图像进行定量分析[43.]允许比较来自不同生物复制的多个图像中的MT方向。分析得出的具有代表性的圆形输出图表明,WT和WT延伸区的MTs主要为横向方向tno1根(沿0-180度轴的蓝线)(图。6B.).为了评估在WT和突变体之间的倾斜的MT的百分比的差是否可能解释在突变体的较高的CFR,MT根细胞从WT角和tno1将根部分为三类,0至10,11至30和31至90度(图。6C.).在WT和突变体之间的每个阶级中的MT百分比没有发现显着差异。因此,我们得出结论tno1突变体在斜根中具有正常的横向MT阵列,这表明CFR的变化可能与另一种机制有关。
讨论
TNO1在高尔基体后转运、向地性和生长素转运依赖过程中发挥重要作用。在这里,我们证明了TNO1是根倾斜和CFR形成所必需的。偏离tno1与WT根相比,突变根部在紫杉醇的稳定性增加,但是通过PPD抵抗MT不稳定的脂肪酸。这使我们在MT依赖过程中假设TNO1的作用,尽管也据报道了MT不稳定的药剂,以诱导左手CFR而不影响MT阵列[53.].在根中,Mt阵列从共聚区中的无序状态转变为伸长区的横向取向,并且该组织对于促进快速各向异性生长至关重要[42.].微管蛋白结构/活性和MT相关蛋白的缺陷会导致根中央延伸区倾斜的MT阵列。在伸长细胞中,倾斜的MT方向导致细胞以垂直角度扩张,导致CFR和根偏斜[4,20.,56.,57.].歪斜的根源tno1在延伸区没有显示出倾斜的MT取向,而是显示出横向的MT取向。这表明根的运动表型在tno1突变体的产生与根伸长区MT阵列的组织无关,尽管依赖于MT动态。这是有可能的,尽管它的正常方向,皮质MT阵列tno1根部可能在重组或函数中妥协,因为根部导航在偏斜期间的复杂轨迹时。TNO1的损失可能也可能影响MT相关蛋白如显着的蛋白质;作为一个例子,最近据报道了TGN局部化的Kinesin结合分离酶影响根偏斜[50.].
某些根倾斜突变体具有横向MT阵列或在根伸长区MT阵列中缺乏方向性偏差,但具有明显的CFR [54.,58.,59.].此外,CFR仍然可能在MT中断的破坏稳定剂如柚子和PPD中断时发生53.].这表明MT阵列并不是产生CFR的唯一因素。由于这些异常,wasteney(2004)提出,由于根固有的扭转手性,CFR可能产生,而CFR和MT阵列方向之间的相关性可能是MT阵列和细胞壁机制之间的信号传递造成的。因此,CFR可能是由于MT阵列对延伸区各向异性膨胀的影响,或者是由于纤维素微纤维对质膜上MT阵列排列的影响[46.,47.].影响CFR形成但不是伸长区中的MT阵列取向的突变体支持该模型,包括在各向异性细胞扩张的调节中有缺陷的突变体[20.,54.].基于该模型,并与PPD存在时观察到的细胞形态表型相一致,TNO1可能在各向异性的细胞扩张过程或细胞壁运输动力学中具有重要作用。
与表皮细胞相比,内部细胞类型扩增率的滞后可能导致根部歪斜以防止机械剪切[9,57.].成熟的根细胞和幼杆子tno1PPD处理的幼苗细胞形态出现明显的破坏,表明TNO1在细胞成熟或扩张过程中发挥了作用。这个模型也可以解释其中的原因tno1尽管根伸长区的表皮细胞中横向Mt阵列,但是根倾斜。垂直成长tno1苗具有相似的根的长度,以WT苗,表明垂直生长在正常细胞扩增。因此TNO1可能被用于从它们的生长轨迹根偏差期间细胞扩增特别需要。
在细胞膨胀和纤维素沉积过程中,纤维素合酶复合物通过TGN运输[60.,61.].细胞形态和扩张中观察到的缺陷可能是由于TNO1在适当定位TGN局部化Q-SNARE SYP61 [31.,32.].含SYP61囊泡的蛋白质组分析[34.]揭示了纤维素合酶复合物亚基的存在,表明纤维素合酶亚基的贩运起到了一定的作用,进而推动纤维素的沉积。MT阵列动态调节扩张细胞中纤维素微纤维的沉积,因为纤维素合酶与MT阵列平行运行,而纤维素合酶INTERACTIVE1作为纤维素合酶机制和皮质MTs之间的连接[62.- - - - - -65.].的MT也调节含纤维素合酶复合物亚基或复合物相关的蛋白质如KOR1和CSI1 [囊泡的胞吐66.- - - - - -68.].因此破坏MT阵列影响纤维素合成,沉积和取向,相反,抑制纤维素合酶活性引起MT阵列的缺陷[69.,70],这可能会影响方向增长模式[18.].投放如CESTRIN原因MT不稳定性和降低的纤维素含量的纤维素合酶的抑制剂,并增加SYP61和纤维素合酶共定位[68.].由于CESTRIN不影响大量分泌和内吞途径,TGN的syp61修饰结构域及其相关蛋白(如TNO1)似乎对纤维素沉积至关重要,并间接地影响MT的稳定性。然而,纤维素合酶组分的突变(rsw1-1,Any1.)或用纤维素合酶抑制剂处理不会诱发CFR [58.,71.,72.].此外,Sugimoto(2003)还报告说,即使MTS受损时,纤维素合酶突变体也可以经历CFR [58.].
细胞扩张和根运动所需的其他蛋白质的运输也可能被中断tno1突变体。例如,细胞壁的酶促反应需要SKU5,缺乏该蛋白的突变体表现出增强的根倾斜,这可能是由于细胞扩张过程中细胞壁组成改变所致[20.].我们的观察结果表明CFR形成涉及复杂的相互作用,并且不仅仅是依赖于Mt阵列和纤维素沉积图案。目前的螺旋增长机制模型受到研究挑战tortifolia2突变体,个体自由生长的毛状体扭曲。因此,这些突变体使细胞分裂模式和组织应变与扭曲分离,并表明单个细胞的扭曲可以转化为更高阶的器官扭曲[73.].理解TNO1在TGN处的确切作用以及它调制CFR和偏斜的机制将是一个挑战。
我们的研究结果表明,TNO1和TGN在CFR和根系运动中起着关键作用,为控制根系运动的网络增加了另一个成分。需要进一步的实验来测试TNO1及其相互作用的伙伴在调节根偏斜和CFR形成中的确切作用。今后研究TNO1在纤维素合成酶运输、MT稳定性和斜根中细胞扩张动力学中的作用将增加我们对TNO1功能的理解。因为TNO1影响生长素的运输[36.[我们的研究现在指出了TNO1对TNO1的影响,在TGN处于养阴运输,MT动态和细胞壁贩运的可能性。发现TNO1的确切作用将有助于阐明TGN圈套机械在植物生长和形态发生中的功能。
结论
总之,我们已经发现了在难以穿透的介质表面上的根部偏斜的TGN局部化蛋白的作用。这增加了援助根部运动的内源因素的日益增长的列表。我们的数据以及先前的调查,也建议TNO1,依赖于依赖和MT相关过程之间的可能链接。更好地理解这些机制可以导致可用于在各种土壤条件下操纵根生长和开发模式的信息,并改善整体根系结构。这随后可以导致工程优质作物,具有更好的土壤穿透和营养增散性状。
缩写
- CFR:
-
旋转单元文件
- MT(s):
-
微管
- PPD:
-
Propyzamide
- 陷阱:
-
可溶性N- 乙基马来酰亚胺敏感因子附着蛋白受体
- TGN:
-
反式-高尔基网络
- TNO1:
-
TGN-localized SYP41-interacting蛋白质
参考
- 1。
Hodge A,Berta G,Doussan C,Merchan F,Crespi M.植物根生长,建筑和功能。植物土壤。2009; 321(1-2):153-87。
- 2。
Dunbabin VM,邮政ja,schnepf a,页面l,javaux m,wu lh,leitner d,chen yl,rengel z,doggle aj。利用根生长,架构和功能的三维模型建模根土相互作用。植物土壤。2013; 372(1-2):93-124。
- 3.
Rellan-Alvarez R,Lobet G,Lindner H,Pradier PL,Sebastian J,Yee MC,Geng Y,Trontin C,Larue T,Schrager-Laplle A等。GLO-ROOTS:一种成像平台,实现土壤生长根系的多维特征。Elife。2015; 4:E07597。
- 4。
Roy R, Bassham DC。根的生长运动:波动和倾斜。植物科学。2014;221 - 222 c: 42-7。
- 5。
Migliaccio F,Piconese S.螺旋化和拟南芥根的罗伯利。趋势植物SCI。2001; 6(12):561-5。
- 6。
冈田卡斯。植物根尖的可逆旋转拟南芥通过障碍触控刺激引起的幼苗。科学。1990年; 250:274-6。
- 7。
卢瑟福河,马龙博士。拟南芥Sku突变体幼苗在根生长载体上表现出明显的表面依赖性改变。植物杂志。1996;111(4):987 - 98。
- 8.
乙烯调控拟南芥根波响应。植物杂志。2003;132(2):1085 - 96。
- 9.
Furutani I, Watanabe Y, Prieto R, Masukawa M, Suzuki K, Naoi K, Thitamadee S, Shikanai T, Hashimoto T.螺旋基因在A细胞伸长的定向控制中是必需的拟南芥蒂利亚纳.发展。2000;127(20):4443 - 53年。
- 10
Yuen Cyl,Sedbrook JC,Perrin RM,Carroll KL,Masson PH。根发缺陷的功能突变缺陷3抑制拟南芥中的根挥舞,偏移和表皮细胞旋转。植物理性。2005; 138(2):701-14。
- 11.
Vaughn LM,Masson PH。QTL研究区的贡献拟南芥在倾斜的表面上的根倾斜。G3(贝塞斯达)。1(2): 105 - 2011; 15。
- 12.
桑特纳AA,沃森JC。WAG1和WAG2蛋白激酶对拟南芥的根波动具有负调控作用。植物J。2006;45(5):752–64.
- 13。
齐波,郑华。KNAT1对水稻根斜响应的调控拟南芥.工厂J. 2013; 76(3):380-92。
- 14。
Whitford R,Fernandez A,Tejos R,Perez AC,Kleine-Vehn J,Vanneste S,Drozdzecki A,Leitner J,Abas L,Aerts M等。Golven分泌肽调节植物重力响应期间的养蛋白载体周转。DEV细胞。2012; 22(3):678-85。
- 15。
Santisree P、Nongmaites S、Sreelakshmi Y、Ivanchenko M、Sharma R。根就像钻一样:乙烯-生长素相互作用促进了根在土壤中的渗透。植物信号行为。2012;7(2):151–6.
- 16。
关键词:葡萄糖,细胞分裂素,信号转导通路,细胞分裂素拟南芥.植物学报。2014;37(1):235-53。
- 17。
Lanza M, Garcia-Ponce B, Castrillo G, Catarecha P, Sauer M, Rodriguez-Serrano M, Paez-Garcia A, Sanchez-Bermejo E, T CM, Leo del Puerto Y,等。肌动蛋白细胞骨架在油菜素内酯信号转导中的作用及其与植物生长素反应的整合。Dev细胞。2012;22(6):1275 - 85。
- 18。
石田等。皮质微管的扭曲生长与组织结构。植物学报2007;120(1):61-70。
- 19.
Sedbrook JC,Kaloriti D. Microtubules,地图和植物定向细胞扩展。趋势植物SCI。2008; 13(6):303-10。
- 20
Sedbrook JC,卡罗尔KL,洪KF,马森PH,萨默维尔CR。拟南芥基因SKU5编码参与定向根生长的细胞外糖基磷脂锚定的糖蛋白。植物细胞。2002; 14(7):1635至1648年。
- 21
Roudier楼费尔南德斯AG,藤田男,Himmelspach R,伯尔纳GH,Schindelman G,宋S,巴斯TI,Dupree的P,Wasteneys GO,等人。COBRA,拟南芥细胞外糖基磷脂酰肌醇锚定蛋白,特别是控制通过其在纤维素微纤维取向参与高度各向异性膨胀。植物细胞。2005; 17(6):1749至1763年。
- 22
植物细胞壁稳态是由油菜素内酯反馈信号介导的。咕咕叫医学杂志。2012;22(18):1732 - 7。
- 23。
Staehelin La,康BH。通过电子断层扫描确定的内质网出口网站和高压膜的纳米级结构。植物理性。2008; 147(4):1454-68。
- 24。
植物核内体转运途径。植物学报。2011;14(6):666-73。
- 25。
阿尔,巴沙姆特区。植物细胞内核内体的结构与功能。中华细胞杂志2012;125(p15): 3511-8。
- 26。
Gendre D, Jonsson K, Boutte Y, Bhalerao RP。到达细胞表面——植物中反式高尔基网络的中心作用。原生质。2015;252(2):385 - 98。
- 27。
xu M, xu M, xu M, et al., et al., et al., et al.等。MTV1和MTV4编码植物特异性的ENTH和ARF GAP蛋白,介导来自反高尔基网络的网格蛋白依赖的液泡货物运输。植物细胞。2013;25(6):2217 - 35。
- 28。
齐晓燕,郑指挥部。raba1c GTPase定义了拟南芥胞质分裂过程中对内sidin1敏感的反式高尔基网络群体。摩尔。2013;6(3):847 - 59。
- 29。
abx5 /RabA1b调控拟南芥中反式高尔基网络到质膜蛋白的转运。植物细胞,2012;24(7):3074 - 86。
- 30.
Uemura T,Kim H,Saito C,Ebine K,Ueda T,Schulze-Lefert P,Nakano A. QA-Snares定位于Trans-Golgi网络中的多种运输途径和植物细胞外疾病抗性。Proc Natl Acad SCI U S A. 2012; 109(5):1784-9。
- 31.
拟南芥陷阱复杂性的研究。植物科学学报2012;3:28。
- 32
Bassham DC,Sanderfoot AA,Kovaleva V,郑H,Raikhel NV。AtVPS45复合物形成的跨高尔基网络。mol Biol细胞。2000; 11(7):2251-65。
- 33
朱家,龚Z,张C,歌曲CP,Damsz B,Inan G,Koiwa H,Zhu Jk,Hasegawa PM,Bressan Ra。OSM1 / SYP61:在拟南芥突触蛋白控制对非生物胁迫脱落酸介导的和非脱落酸介导的应答。植物细胞。2002; 14(12):3009-28。
- 34
Drakakaki G,Van de Ven W,Pan S,Miao Y,Wang J,Keinath NF,耐候B,Jiang L,Schumacher K,HICKS G,等人。SYP61隔室的分离和蛋白质组学分析揭示了拟南芥贩运贩运中的作用。细胞res。2012; 22(2):413-24。
- 35。
Kim SJ,巴沙姆特区。TNO1参与拟南芥的耐盐性和液泡运输。植物杂志。2011;156(2):514 - 26所示。
- 36。
Roy R, Bassham DC。祖国和横向根出苗依赖于转毒性网络蛋白TNO1。前植物SCI。2015; 6:969。
- 37。
Rutherford R, Gallois P, Masson PH.突变拟南芥参与色氨酸生物合成途径的基因影响倾斜琼脂表面的根波动。植物j . 1998; 16(2): 145 - 54。
- 38。
Schneider CA, Rasband WS, Eliceiri KW. NIH Image to ImageJ: 25年的图像分析。Nat方法。2012;9(7):671 - 5。
- 39。
Grabov A,Ashley Mk,Rigas S,Hatzopoulos P,Dolan L,Vicente-Agullo F.根形的形状分析。新植物。2005; 165(2):641-51。
- 40.
马图尔J,康茨C。用琼脂糖制备表皮印迹的方法。生物技术。1997;22(2):280–2.
- 41.
Mochizuki S, Harada A, Inada S, Sugimoto-Shirasu K, Stacey N, Wada T, Ishiguro S, Okada K, Sakai T.拟南芥WAVY GROWTH 2蛋白调节根弯曲响应环境刺激。植物细胞。2005;17(2):537 - 47。
- 42.
Sugimoto K, Williamson RE, wasteney GO。新技术使得拟南芥完整根系中的微管取向,墙体纹理和生长速率的比较分析。植物理性。2000; 124(4):1493-506。
- 43.
Jacques E,Buytaert J,Wells DM,Lewandowski M,Bennett MJ,Dirckx J,Vellelen JP,Vissenberg K.微丝分析仪,用于量化纤维状取向的图像分析工具,揭示了重力中微管组织的变化。工厂J. 2013; 74(6):1045-58。
- 44
Migliaccio F,Tassone P,Fortunati A.循环作为植物中的自主根运动。我是J机器人。2013; 100(1):4-13。
- 45
超越大分裂的扩展:超越大分裂的扩展:细胞骨架和轴向生长。In: Hussey PJ,编辑。牛津:布莱克威尔出版有限公司;2004: 83 - 115页。
- 46
Fisher DD,Cyr RJ。延伸微管/微纤维范式。纤维素合成是伸长细胞中正常皮质微管对准所必需的。植物理性。1998; 116(3):1043-51。
- 47。
Wasteneys GO。在了解微管在植物细胞中的作用研究进展。CurrOp植物BIOL。2004; 7(6):651-60。
- 48。
Buschmann H,Fabri CO,Hauptmann M,Hutzler P,Laux T,Lloyd CW,Schaffner AR.拟南芥突变体tortifolia1的螺旋生长揭示了一种植物特异性微管相关蛋白。Curr-Biol。2004;14(16):1515–21.
- 49。
Sedbrook JC。植物细胞的图:描绘微管的生长动态和组织。植物学报。2004;7(6):632-40。
- 50。
Moschou PN,古铁雷斯 - 贝尔特兰E,Bozhkov PV,Smertenko A. Separase通过激活CENP-E相关的驱动蛋白KIN7促进微管聚合。DEV细胞。2016; 37(4):350-61。
- 51.
现场JJ,迪亚兹JF,米勒JH。微管稳定剂的结合位点。Chem Biol。2013; 20(3):301-15。
- 52.
下胚轴生长的细胞基础拟南芥.植物杂志。1997;114(1):295 - 305。
- 53.
中村M,直K,昭治T,桥本T。低浓度的丙苯酰胺和谷霉素改变了拟南芥表皮细胞的微管动力学。植物细胞生理学。2004;45(9):1330–4.
- 54.
Sedbrook JC, Ehrhardt DW, Fisher SE, Scheible WR, Somerville CR.拟南芥sku6/spiral1基因编码一个末端定位的微管相互作用蛋白,参与细胞定向扩张。植物细胞。2004;16(6):1506 - 20。
- 55.
Whittington at,Vugrek O,Wei Kj,Hasenbein Ng,Sugimoto K,Rashbroke MC,Wastieneys Go。Mor1对于组织植物中的皮质微管是必不可少的。自然。2001; 411(6837):610-3。
- 56
李志刚,李志刚,李志刚,等。拟南芥根系发育的研究进展。新植醇。2007;176(1):37-43。
- 57
石田,桥本T.安拟南芥用条件根偏移表型突变体突变体。j植物res。2007; 120(5):635-40。
- 58
Sugimoto K, Himmelspach R, Williamson RE, wasteney GO。突变或药物依赖的微管破坏导致径向肿胀,而不改变拟南芥根细胞中平行纤维素微纤丝沉积。植物细胞。2003;15(6):1414 - 29。
- 59。
Galva C,Kirik V,Lindeboom Jj,Kaloriti D,Rancor Dm,Hussey PJ,Bednarek Sy,Ehrhardt DW,Sedbrook JC。微管加端跟踪蛋白SPR1和EB1B相互作用,以保持拟南芥的极性细胞伸长和定向器官生长。植物细胞。2014; 26(11):4409-25。
- 60。
Crowell EF,Bischoff V,Desprez T,Rolland A,Stierhof Yd,Schumacher K,Gonneau M,Hofte H,Volgietes S. Golgi尸体对微管体的暂停调节拟南芥中纤维素合成酶复合物的分泌。植物细胞。2009; 21(4):1141-54。
- 61。
古铁雷斯R、林德博姆JJ、帕雷迪兹AR、埃蒙斯AM、埃哈特DW。拟南芥皮层微管将纤维素合成酶输送至质膜,并与纤维素合成酶运输室相互作用。Nat细胞生物学。2009;11(7):797–806.
- 62。
Lei L,Li S,Du J,Bashline L,Gu Y.纤维素合成酶Interactive3在拟南芥中调节微管依赖性和独立于微管的纤维素生物合成。植物细胞。2013; 25(12):4912-23。
- 63.
Bashline L,Li S,Gu Y.在高等植物中抗纤维素合成酶络合物的贩运。Ann Bot。2014; 114(6):1059-67。
- 64.
Bashline L,Lei L,Li S,Gu Y.细胞壁,细胞骨架和高等植物中的细胞膨胀。莫尔植物。2014; 7(4):586-600。
- 65.
李树华,李树华,李永玲,顾玉英。拟南芥纤维素合成酶复合物在质膜上的快速循环利用。植物细胞。2015;27(10):2926 - 40。
- 66.
Robert S,Bichet A,Grandjean O,Kierzkowski D,Satiat-Jeunemaitre B,Pelletier S,Hauser Mt,Hofte H,Vernhettes S.涉及纤维素合成中的拟南芥内肠-1,4-Beta-D-Blucanase经过调节的细胞内循环.植物细胞。2005; 17(12):3378-89。
- 67.
李树林,李丽丽,顾宇。纤维素的合成及其调控。拟南芥的书。2014;12:e0169。
- 68
Worden N, Wilkop TE, Esteve VE, Jeannotte R,车床R, Vernhettes S, Weimer B, Hicks G, Alonso J, Labavitch J,等。CESA TRAFFICKING INHIBITOR抑制纤维素沉积,干扰纤维素合酶复合物及其相关蛋白KORRIGAN1和POM2/纤维素合酶互动蛋白1的贩运。植物杂志。2015;167(2):381 - 93。
- 69
叶振华。卡丹蛋白样微管切断蛋白突变对纤维素微纤维定向沉积的影响。植物细胞。2002;14(9):2145 - 60。
- 70。
Paredez Ar,Somerville Cr,Ehrhardt DW。纤维素合酶的可视化证明了与微管的功能关系。科学。2006; 312(5779):1491-5。
- 71。
Sugimoto K, Williamson RE, wasteney GO。纤维素缺乏突变体Of的细胞壁结构拟南芥蒂利亚纳:在根的有丝分裂和伸长区,微原丝(而非微管)在无法识别微原丝之前就失去了横向排列。原生质。2001;215(1):172 - 83。
- 72。
Fujita M, Himmelspach R, Ward J, Whittington A, Hasenbein N, Liu C, Truong TT, Galway ME, Mansfield SD, Hocart CH,等。拟南芥纤维素合成酶1催化结构域D604N的各向异性突变降低了细胞壁的结晶度和纤维素合成酶复合物的速度。植物杂志。2013;162(1):74 - 85。
- 73。
拟南芥突变体tortifola2的螺旋生长不依赖于细胞分裂模式,而是涉及分离细胞的手扭转。植物细胞。2009;21(7):2090 - 106。
致谢
感谢帕特里克·马森博士和凯特·鲍德温博士建议扭曲化验,科尔顿McNinch杨和小陈博士为技术帮助和建议,本盾和詹妮弗·约翰逊博士关于MFA软件的帮助,玛格丽特·卡特对共焦成像和Divita Mathur博士指导概念的见解。
资金
本工作得到了国家航空航天局(NNX09AK78G授予DCB的补助金。
可用性数据和材料
本研究期间生成或分析的所有数据都包含在本公布的文章中。根据Rahul Roy博士(Rroy@umm.edu)的要求,可以获得原始文件。
作者的贡献
RR和DCB构思了这项研究并设计了实验。RR收集并分析了数据。RR和DCB撰写并修改了最终出版的手稿。
相互竞争的利益
提交人声明他们没有竞争利益。
同意出版物
不适用。
伦理批准和同意参与
不适用。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
作者信息
隶属关系
通讯作者
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
TNO1,一种定位于tgn的snare相互作用蛋白,调节根的倾斜拟南芥.BMC植物BIOL.17,73(2017)。https://doi.org/10.1186/s12870-017-1024-4
收到:
接受:
发表:
关键词
- T.反式高尔基网络
- 根运动
- 旋转单元文件
- 拘束的因素
- 微管