摘要
背景
农业产业受到高度重视的混合活力。雄性不育是作物育种的重要特征。花粉发育是严格控制配子育和孢子素的因素,并且该过程中的缺陷可能导致雄性不育。两者族在拟南芥和山米米中,绦虫中程序化细胞死亡(PCD)的适当时间确保花粉发育。据报道,动态ROS水平控制Tapetal PCD,从而在拟南芥和米中进行花粉发育。然而,目前尚不清楚它是否进化地保守,因为只研究了这两个远远相关的物种。
结果
本文对两种重要的双子叶植物烟草和番茄的花药发育进行了组织学分析。我们在这两个物种的花药发育过程中发现了相同的ROS振幅,并发现动态ROS水平与绒毡层PCD的起始和发展相关。我们进一步表明,在花药发育过程中调控ROS水平会严重损害花粉发育,导致部分雄性不育。最后,实时荧光定量PCR结果表明,几种烟草和番茄的生长情况RBOH编码NADPH氧化酶的S优先于花药中表达。
结论
本研究通过在茄科中的两种商业上重要的作物物种检查了种植的发展期间,在花药期间表现出了进化的ROS振幅。通过遗传干扰操纵ROS幅度RBOH因此,这可能是一种产生雄性不育植株的实用方法。
背景
农业产业受重视杂交活力,因此雄性无菌线在商业上产生杂种。此外,雄性不育是一种对生物质生产至关重要的特征,因为植物衰老在肥沃的菌株中比无菌菌株更快[1,2].因此,育种新品种的雄性无菌系是种子工业的重要性,以低成本产生杂种,而且对延迟衰老和增加植物生物质的致力至关重要。
有缺陷的花粉发育是导致雄性不育的主要因素。花粉发育可能受到缺口不规则的影响[3.- - - - - -6],细胞骨骼改变[7,8],疾病中的畸变代谢[9,10,改变糖的利用。在控制花粉发育的所有因素中,绒毡层(花粉囊周围的一层孢子体细胞)起着至关重要的作用[11].绒毡层在花粉发育过程中经历细胞程序性死亡(PCD)过程,提供酶从四分体中释放小孢子,调节小孢子发育,并为花粉外壳沉积成分[3.,12,13].Tapetal PCD的时序和进展通过进化保守的转录网络紧密控制[3.,12- - - - - -17.].
除了转录网络调控绒毡层PCD外,最近在这一过程中还发现了细胞内因子。活性氧(ROS),包括过氧化氢和超氧化物,通过翻译后修饰影响大量蛋白质,ROS也作为关键信号分子[18.- - - - - -20.].ROS在rapidopsis和米中都在Tapetal PCD中发挥着关键作用[21.- - - - - -23.].未能去除蓟马中的ros导致雄性不育,由于预先诱导的塔皮特细胞死亡[21.- - - - - -23.而在花药发育过程中通过突变降低ROS水平RBOH编码NADPH氧化酶的基因,延迟绒毡层PCD [22.].在这种情况下,花粉发育严重受损了[21.- - - - - -23.].
虽然在拟南芥和水稻中已经证实了动态ROS水平对绒毡层PCD和花粉发育的重要作用,但这一机制在茄科中是否保守尚不清楚。在这里,我们研究了两个重要的经济双子叶植物烟草(尼古利亚娜·宾夕法尼亚州)及番茄(Lycopersicon esculentum,简历。很会赚钱的),详细。我们在这两个物种的花药发育过程中发现了相同的ROS振幅,并发现动态ROS水平与绒毡层PCD的起始和发展相关。我们进一步表明,在花药发育过程中调控ROS水平会严重损害花粉发育,导致部分雄性不育。最后,实时定量pcr (qpcr)结果表明,几种烟草和番茄的生长发育情况均不理想RBOH编码NADPH氧化酶的S优先于花药中表达。通过遗传干扰操纵ROS幅度RBOH为茄科植物雄性不育植株的培养提供了一种实用的途径。
结果
花药开发烟草和番茄伴随着动态ROS水平
研究烟草和番茄花药在发育过程中是否表现出与拟南芥相似的动态ROS振幅[22.],我们首先将花药分为六组(附加文件1根据花药横切面发育阶段与花蕾和花药大小的相关性(附加文件1:图S1和S2)。这六组代表减数分裂前、减数分裂、四分体、小孢子、有丝分裂和分裂(附加文件)1:图S1、S2和表S1)。
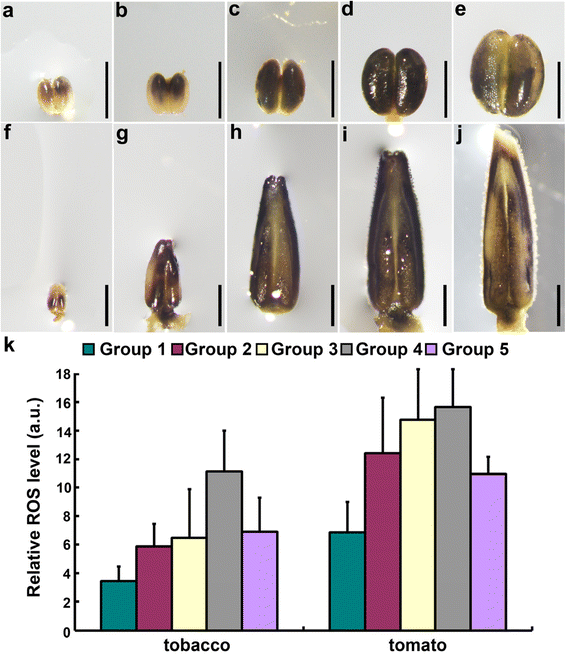
其次,用硝基四唑蓝氯化物(NBT)和2 ',7 ' -二氯二氢荧光素二乙酸酯(H2DCF-DA)染料,两者都是ROS水平的代理指标[21.,22.,24.- - - - - -26.].在烟草花药中,早在减数分裂前就能检测到活性氧(ROS)染色。1A和k),在减数分裂期逐渐增加(图。1B.c、k),在小孢子后期最高(图。1D和k)。从有丝分裂阶段到花药的开放,ROS信号减少(图。1 d-k).在番茄花药期间观察到类似的ROS振幅(图。1 f - k).在一起,这些数据在烟草和番茄中的花药开发期间显示了动态ROS振幅,类似于拟南芥报告的[22.].
烟草和番茄花药发育过程中ROS水平的变化。一个- - - - - -j烟草的代表性NBT染色(一个- - - - - -e)或番茄(f- - - - - -j)花药发育期间。对3批独立植株各发育阶段的20 ~ 25株花药进行分析,得到相似的结果。k基于ROS的H2DCF-DA染色的每个发育阶段的烟草或番茄花药中的相对ROS水平。显示的结果是手段+标准偏差(SD,N= 20)。A.U.,任意荧光装置。花药分类基于其他文件中描述的花药大小1S1:表。酒吧, 800 μm用于(一个- - - - - -e);1000μmfor(f- - - - - -j)
烟草花盆的花粉发育
为了在花粉开发期间检查塔皮特PCD的时序和进展,有必要将花粉发育阶段精细解剖。与Arabidopsis和Rice不同,对花药中的花粉发育过程进行了广泛的研究[27.,28.],烟草和番茄的花粉发育尚未被彻底描述,尽管有一些组织学研究[29.,30.].
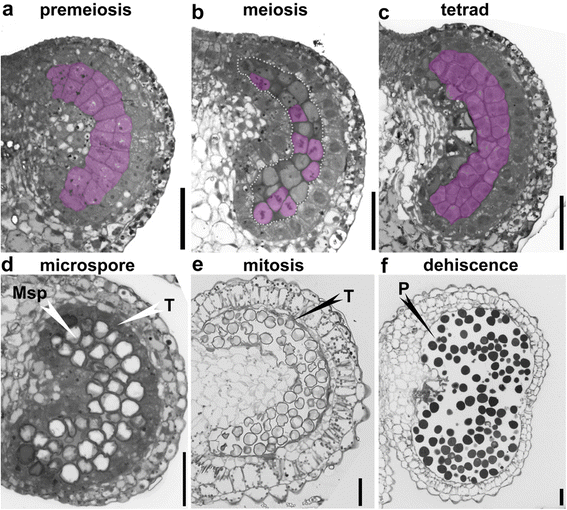
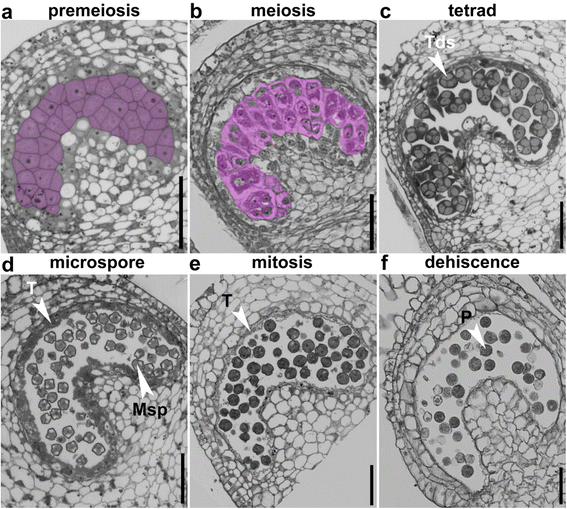
因此,我们首先对烟草(尼古利亚娜·宾夕法尼亚州)基于大致定义的发育分期的不同大小的花纹(附加文件1:图S1和表S1)。在减数分裂前阶段,花粉囊由4个花药细胞层组成。2A).从最外层到最内层为表皮层、内膜层、中间层和绒毡层,它们围绕着小孢子母细胞(MMC)。2A).在MMC进入减数分裂阶段时,塔皮特细胞的细胞核逐渐增大,细胞质凝结(图。2B.).从这一阶段开始,烟草花药迅速增大1:图S1)。在完成减数分裂后,形成由厚核壁包围的幼儿孢子(MSP)(图。2C).在四阶段期间,Tapetal细胞接受核划分以形成双核或多核细胞,细胞体积增加(图。2C).最终从微孔阶段的四肢释放MSP,并变为真空(图。2D).同时绒毡层细胞收缩收缩(图。2D),表明其内容物释放到花粉囊。在有丝分裂阶段,绒毡层缩小到非常薄的一层(图。2e).在这个阶段,内膜扩张(图。2e).最后,在裂开期,隔膜和气孔被破坏,释放出成熟的花粉粒,绒毡层不再可见(图。2f.).
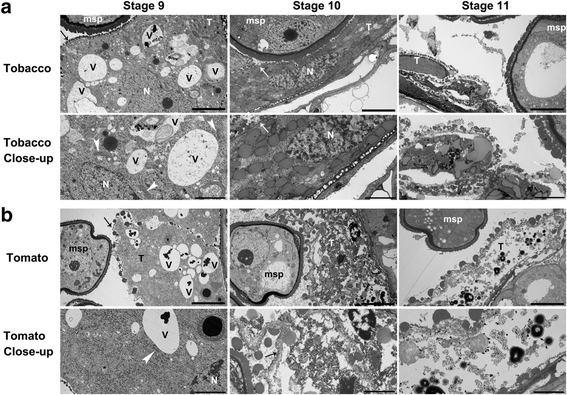
为了验证半薄切片的结果,更好地评价绒毡层细胞的变化,我们对烟草花药在不同发育阶段的透射电镜(TEM)进行了观察。与半薄切片的结果一致,绒毡层细胞在第9期保持细胞完整性,线粒体和高尔基体可见(图。3).在后续微孔阶段,即阶段10,塔皮细胞的血浆膜(PM)完好无损,尽管核开始显示崩解的迹象(图。3).只有在第11阶段,是塔皮特细胞的细胞完整性破坏,细胞内容物释放到花粉囊中(图。3),提示绒毡层退化。
Tapetal PCD在烟草中
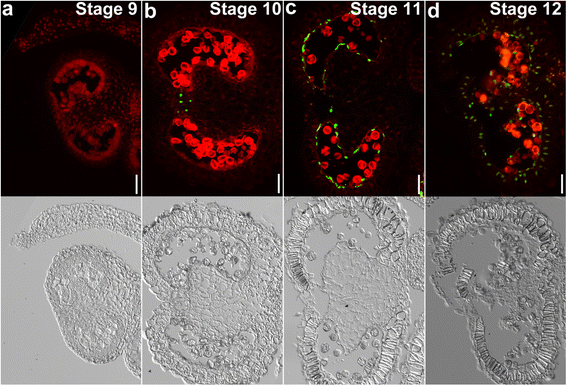
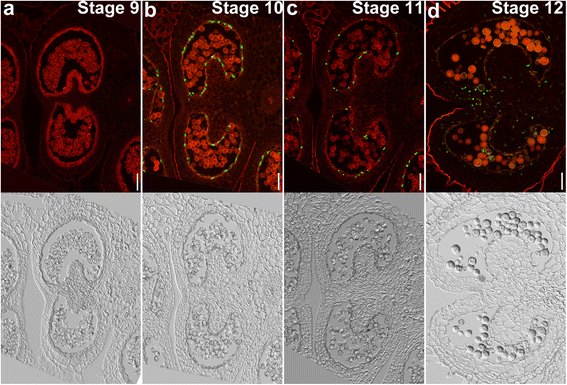
在确定花粉发育的详细组织学事件后,我们对烟草花药在不同发育阶段进行末端脱氧核苷酸转移酶介导的dUTP末端标记(TUNEL)试验,以确定绒毡层PCD的时间和进程。TUNEL阳性信号表明PCD发生[22.].烟草花药第9阶段未检测到TUNEL信号。4),对应于四分体晚期或小孢子早期。第10阶段对应于小孢子晚期,在隔层细胞中检测到TUNEL阳性信号(图2)。4 b),表明隔膜的退化早于拟南芥[22.].然而,这一阶段在绒毡层中未检测到TUNEL信号(图。4 b),表明烟草花药绒毡层PCD发生时间远晚于拟南芥[22.].第11阶段检测到大量TUNEL信号(图)。4摄氏度),与有丝分裂阶段相对应。在这个阶段,隔膜细胞完全退变(图。4摄氏度).在第12阶段,当花药开始开裂时,花药的其他细胞层,如内膜,也有TUNEL信号(图。4 d),表明孢子体花药组织中细胞广泛死亡。结果表明,烟草花药绒毡层PCD发生在小孢子晚期或有丝分裂早期,发育迅速。
番茄的花粉发育
我们还在番茄的花子上应用了半薄横截面(Lycopersicon esculentum),以确定其花粉发育的组织学过程。在减数分裂前阶段,原始孢子组织形成,可见mmc(图。5).随后,细胞开始减数分裂,胼胝质沉积在细胞周围(图。5 b).在该阶段,胶质细胞是双核或多核(图。5 b).减数分裂的结束导致花粉囊内形成四面体,被厚胼隙壁包围(图。5度).与烟草不同,在这个阶段,番茄的塔皮拉特层变得更薄,更稠密(图。5度).在微孔阶段,MSP被释放并变为真空(图。5 d).胶束细胞的血浆膜(PM)变为崩解(图。5 d),提示细胞死亡的进展。在有丝分裂阶段,花粉细胞质浓缩而不是液泡化(图。5 e),绒毡层变薄且破碎(图。5 e).最后,番茄花药裂开,释放出成熟的花粉,尽管有一层很薄的绒毡层贴在中间层上,仍然可以看到(图。5 f).TEM研究证实,在微孔阶段,番茄中翅片细胞的退化开始于微孔阶段(图。3 b),在第9阶段,绒毡层细胞已经显示出细胞解体的迹象,即绒毡层细胞的PM,虽然完整,但卷曲(图。3 b),细胞核也有变性的迹象(图。3 b).在晚期微孔阶段,即第10阶段,番茄花药的胶质细胞已经退化,几乎没有任何细胞内细胞器含有(图。3 b).从小孢子时期开始,经透射电镜证实,PM已解体(图2)。3.).细胞表面有大量的乌氏体,甚至不是连续的(图。3 b).在第11阶段,Tapetal细胞已经退化(图。3 b).
Tapetal PCD在番茄中
番茄和烟草在花粉发育过程中的组织学差异表明绒毡层有明显的PCD。为了验证这一假设,我们对不同发育阶段的番茄花药进行了TUNEL实验。事实上,番茄绒毡层PCD与拟南芥相似,而与烟草不同,它始于第10阶段,即小孢子晚期(图2)。6 b).从第10阶段被检测到TUNEL信号作为阶段12(图。6B-D.).在阶段12中可见塔皮层处的几个Tunel信号(图。6 d),表明完成塔皮特细胞变性。在第12阶段,隔膜细胞和内皮细胞具有退化并表现出调节信号(图。6 d),表明花药开裂开始。结果表明,番茄绒毡层PCD发生较早,但进展较慢。
ROS振幅的药理学干扰影响花粉发育
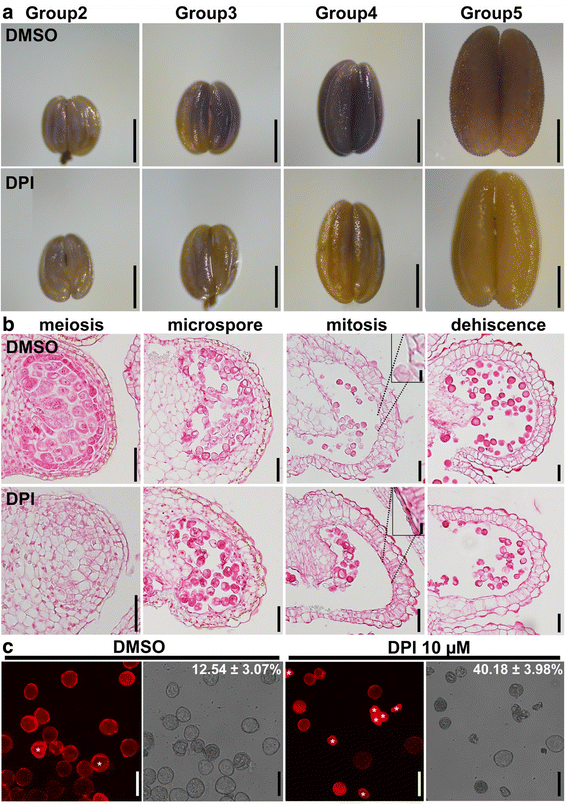
烟草和番茄花药中活性氧的动态振幅(图。1)在开发过程中,在拟南芥中,[22.].因为拟南芥ROS对绒毡层PCD的时间和进展至关重要[22.,我们想知道对这些物种是否也是如此。在烟草花药上应用10 μm二苯碘铵(DPI)清除活性氧[31.].在不同发育时期的不同时间点采集DPI或DMSO (mock)处理的花药,用NBT染色测定ROS水平。事实上,与DMSO处理的花药相比,DPI处理的花药中ROS水平从四分体到有丝分裂阶段下降(图)。7一个).为了确定DPI治疗后塔皮特变性的程度,我们通过使用波特的横截面进行组织学分析。用DMSO处理的烟草花药的塔布拉胶层几乎在第11期几乎消失(图。7 b),但DPI处理的花药仍含有一层薄的绒毡层细胞(图。7 b).DPI治疗后绒毡层延迟变性与ROS幅值降低密切相关。最后,为了确定ROS振幅降低对花粉发育的影响,我们对DPI-和dmso处理的花药释放的成熟花粉粒进行了染色。同样,dpi处理的花药中有更多的败育花粉粒(图。7 c).结果表明,减少ROS幅度延迟塔皮特变性并损害花粉发育。
ROS振幅的药理学干扰影响绒毡层退化和花粉发育。一个用DMSO处理或用10μMDPI处理的烟草中的烟草的代表性NBT染色烟草的烟草的染色阶段不同的发育阶段。bDMSO或dpi处理花芽减数分裂、小孢子、有丝分裂或开裂时烟草花药横切面。箭头指向绒毡层。插图是显示毯层的特写(用突出显示)溺爱的线条,DPI治疗)或其不存在(DMSO治疗)。c对经DMSO或DPI处理的烟草花药发育过程中释放的成熟花粉粒进行PI染色。透射图像显示在其对应的荧光图像的右侧。星号表示中止花粉颗粒。顶部的数字是平均值±标准偏差(SD,N= 20-25)。DMSO和DPI治疗显着不同(T.以及,P< 0.01)。酒吧, 500 μm用于(一个);50 μm (b,c);10μmfor(b插图)
花药优先表达RBOH在烟草和番茄中
ROS可以由线粒体,过氧化物体,细胞质和血浆膜(PM)产生[32.].广泛的研究表明PM局部化的NADPH氧化酶在ROS信号中的关键作用[20.,33.],包括绒毡层PCD [22.].因此,我们有兴趣确定NADPH氧化酶编码基因的表达变化,RBOHs,有助于烟草和番茄花药发育过程中活性氧的动态变化。
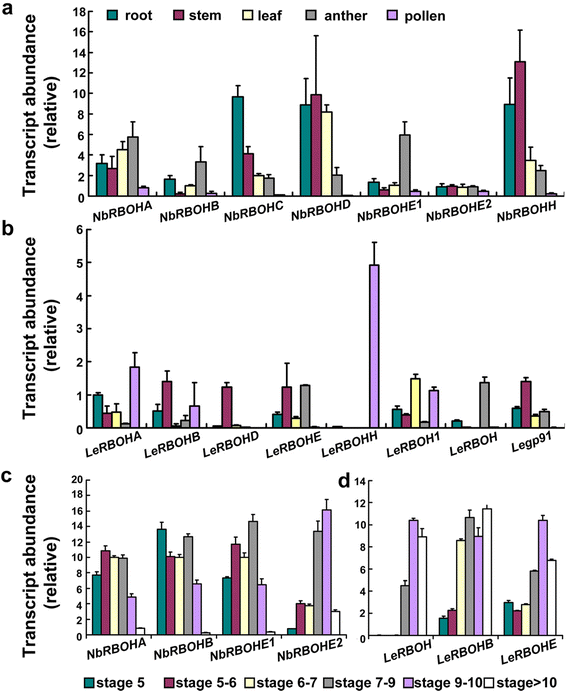
我们首先在NCBI进行BLAST搜索,以识别烟草和番茄RBOH他在使用拟南芥RBOH序列的查询。我们鉴定出7种烟草和8种番茄RBOH(额外的文件1:图S4)。其中,只有NbRBOHA和NbRBOHB已经研究过,并在引导者诱导的气孔闭合和过敏反应方面[34.,35.].通过实时定量pcr (qpcr)检测这些基因在烟草和番茄的根、茎、叶、花药和花粉等组织中的表达。8B)。在7个烟草中RBOH年代,NbRBOHA、NbRBOHB NbRBOHE1, 和NbRBOHE2优先于花药中表达(图。8),Lerbohb.,Lerbohe., 和lerboh.优先于花药中表达(图。8 b).然后,我们从不同发育阶段的波提琴中提取MRNA(附加文件1:表S1)并通过QPCR检测这些花药优先基因的时间表达。的确,NbRBOHE1,NbRBOHE2,Lerbohe., 和lerboh.显示出花药发育的时间表达模式(图。8 cd),类似于拟南芥RBOHE[22.,其功能对拟南芥的动态ROS振幅至关重要[22.].这四种基因在烟草和番茄中的时空表达意味着它们参与在花药开发期间有助于动态ROS振幅。
烟草或Tomatao的转录物丰富RBOH在不同组织或花药发育阶段进行实时定量pcr检测。一个- - - - - -b烟草的转录物丰度(一个)或番茄(b)RBOH在各种组织中。c- - - - - -d烟草的转录物丰度(c)或番茄(d)RBOHS在花药的不同发育阶段。用于(一个- - - - - -b),从根、茎、叶、成熟花药或花粉中提取。用于(c- - - - - -d)从不同发育阶段的花药中提取。花药分类基于其他文件中描述的花药大小1S1:表。所示数据为平均值+ SE (N= 3)
讨论
烟草和番茄的另一个发育阶段被分为从雄蕊原始形成到花粉成熟的20个阶段[29.,30.].基于拟南芥花药发育阶段的明确定义[27.组织学分析(图。2和5),将烟草和番茄花药发育分为六个主要阶段,即减数分裂前、减数分裂、四分体、小孢子、有丝分裂和开裂。这些阶段的特征是花粉成熟过程中发生的主要事件。番茄和烟草的花药发育与拟南芥或水稻略有不同,特别是绒毡层细胞。烟草和番茄花药月牙形花药室中,近端绒毡层细胞比远端绒毡层细胞液泡化程度高,电子密度高。2和5).相比之下,在拟南芥和水稻的圆形花药室中,绒毡层细胞不是二形的[27.,28.].
利用NBT和H2通过对烟草和番茄不同发育阶段花药中ROS的DCF-DA染色,研究了花药发育过程中ROS的动态变化。尽管在花药发育过程中ROS的逐渐增加发生在番茄(小孢子早期)略早于烟草(图。1,附加文件1(图S3),两种植物小孢子阶段的ROS水平最高(图S3)。1),表明在花药发育过程中ROS的振幅是保守的。虽然目前已有4种不同植物花药发育过程中ROS水平的动态变化,但在时间和幅度上存在细微差异。在拟南芥和水稻中,ROS水平在第8阶段迅速增加,在第9阶段达到最高水平[21.,22.].之后,它迅速下降,在第11阶段达到基础水平[21.,22.].相比之下,番茄和烟草的ROS水平从第5-6阶段开始缓慢且逐渐升高(图5-6)。1,附加文件1:图S3),在第8-9阶段达到最高,随后从第10阶段开始下降(图8-9)。1).
通过使用横截面以及TUNEL测定,我们分析了烟草和番茄花药中Tapetal PCD的启动和进展。据rabidopsis报道[22.],番茄花盆的塔皮特层早期开始冷凝作为四阶段(图。5).小孢子释放后不久(图。5),在番茄花药绒毡层中检测到阳性TUNEL信号(图。6),提示大量的绒毡层PCD。在有丝分裂阶段,绒毡层细胞的PM失去其完整性(图。5),表明Tapetal退化的结束。相比之下,烟草花纹的塔皮特细胞含有斑块核核和细胞体积(图。2).只有在小孢子晚期才观察到细胞凝聚(图。2),导致TUNEL信号的出现(图。4).烟草花药有丝分裂时绒毡层细胞大量死亡。4),与同一时期绒毡层的快速减少相一致(图。2).相比之下,水稻花药中绒毡层PCD开始于二分体期(8a期),结束于小孢子中期(9期)[36.,表明不同植物绒毡层PCD发生的时间或进程可能不同。
烟草和番茄绒毡层PCD在时间和进展上的微小差异与活性氧动态幅值有很好的相关性。番茄花药中ROS的增加开始较早,但进展缓慢,这与绒毡层PCD的早期启动和持续时间较长是一致的(图2)。6).相比之下,烟草花药中的ROS在有丝分裂阶段突然增加,然后突然下降(图。1,附加文件1图S3),与绒毡层PCD起始晚、持续时间短相一致(图S3)。4).在花药发育过程中通过DPI清除ROS,严重抑制ROS的振幅(图)。7).因此,绒毡层退化延迟,花粉发育受阻(图。7).这些结果表明,花药发育过程中ROS的动态幅度与绒毡层PCD的发生和发展密切相关。
尽管ROS可以由不同的细胞内来源产生[32.[我们考虑在花药开发期间的动态ROS振幅所必需的PM局部的NADPH氧化酶。一,拟南芥RBOH已经证明,这些基因的突变可以调节动态ROS振幅,干扰绒毡层PCD [22.].第二,作为pm相关的ROS来源[37.,38., NADPH氧化酶定位于发育中的小孢子和绒毡层细胞之间的界面,因此可能是促进细胞间通讯的良好候选酶。第三,在几个RBOH在烟草和番茄中,我们鉴定了一些人在花药中的优先表达表明它们在塔伯拉卡PCD期间的潜在功能(图。8).确实,这些表达RBOH■不仅显示出组织特异性,而且在花药期间也显示出时间表达模式(图。8),与ROS的时间模式相关(图。8).通过新开发的基因组编辑技术逆转遗传,例如CRISPR-CAS9 [39.,对这些花药优先RBOH这为烟草和番茄的雄性不育提供了一种可行的途径。
方法
植物材料和生长条件
烟草(尼古利亚娜·宾夕法尼亚州)及番茄(Lycopersicon esculentum,简历。)在25/20°C(白天/晚上)的培养箱中长时间生长。
rna提取与实时定量PCR (qpcr)
根据制造商的说明书(CWBIO),使用超纯RNA试剂盒在不同发育阶段的不同发育阶段的各种组织或花纹中提取总RNA。使用逆转录酶M-MLV(Takara)进行逆转录。使用Sybr绿色实时PCR主混合物(Toyobo)使用Sybr绿色实时PCR主混合物(Toyobo)进行QRT-PCR分析。[40].使用来自烟草或番茄的花药尺寸来确定发育阶段,如附加文件所示1S1:表。所有使用的引物在附加文件中列出1S2:表。
TUNEL检测
根据供应商的说明,使用原位细胞死亡检测试剂盒TUNEL系统(Roche)进行TUNEL检测(核DNA片段原位标记)。样品使用配备CCD相机(蔡司)的Axio Observer D1显微镜进行分析。TUNEL信号和PI信号的发射/激励分别为488 nm/ 505-550 nm和561 nm/ 575-650 nm。
花药的组织学及活性氧的组织化学分析
对不同发育阶段的花芽进行半薄横切面和透射电镜观察[41.].电视台染色(21.]和H.2DCFDA花药染色[42.按描述进行。H的荧光成像2DCFDA染色花药采用Axio Observer D1显微镜和蔡司(Zeiss) CCD相机,在相同参数下对所有样品进行比较定量。根据花药的大小,将花药分为五组1S1:表。3个独立实验,每组20 ~ 25个花药。利用ImageJ软件定量测定整个花药的荧光强度(http://rsbweb.nih.gov/ij/).
DPI治疗
DPI在DMSO中溶解,制成10mm的原液。用0.02% (W./V.)Triton X-100作为10μm的工作溶液。为DMSO制成相同的稀释度作为对照。除去与花药发育阶段5-7相对应的花芽的一个萼片,如第0天(D0)。DPI或DMSO每天在花芽上喷洒一次5天,直至花药阶段10-11。在D0,D2,D4,D6和D8处收获了花药,其对应于MeIosis,Tetrad,微孔,有丝分裂和裂缝的阶段,用于NBT染色和横截面。来自D8收获的花粉的花粉颗粒用PI染色以确定花粉活力。
拟南芥、烟草和番茄RBOHs的系统发育分析
拟南芥RBOHs蛋白序列从TAIR网站(http://www.arabidopsis.org/)。在NCBI的爆炸搜索中使用拟南芥RBOHS的蛋白质序列以识别烟草RBOHS。从番茄基因组网站获得番茄RBOHS的蛋白质序列(http://www.solgenomics.net./)。软件载体NTI(Invitrogen)用于进行系统发育分析。
结论
在这项研究中,我们证明了两种经济上重要的单萝卜物种,烟草和番茄的花粉开发需要在花药开发期间动态ROS振幅。这种ROS幅度与塔皮PCD的开始和进展相关。此外,我们提供了证据支持花药优先表达的关键作用RBOH在塔皮特罗斯幅度的产生中的基因。这里提出的结果提供了理论基础,以产生商业上有价值的雄性无菌植物。
参考文献
- 1.
Sadras VO, Echarte L, Andrade FH。向日葵和玉米生殖生长过程中叶片衰老的特征。安机器人。2000;85(2):187 - 95。
- 2。
Madhuri B,Raut S,Dey D,Nazneen A,Uma B,Podile AR。Harpinpss的Tapetum特异性表达导致转基因烟草中的雄性不育。BIOL植物。2012; 56(4):628-34。
- 3.
关键词:拟南芥,花药发育,细胞信号分子,转录调控植物学报,2007;49(1):60-8。
- 4。
关键词:拟南芥,mir156 -靶向SBP-box转录因子,雄性育性植物细胞。2010;22(12):3935 - 50。
- 5.
潘哈,李顺丰,李顺丰,教区RW。MYB80转录因子在花粉发育和绒毡层程序性细胞死亡的调控中是必需的拟南芥蒂利亚纳.植物细胞。2011; 23(6):2209-24。
- 6.
张志斌,朱军,高建峰,王超,李辉,李辉,张海清,张胜,王东梅,王启新,黄辉,夏海军,杨振宁。在拟南芥中,转录因子AtMYB103通过调控绒毡层发育、胼胝质溶解和外壁的形成来调控花药的发育。植物j . 2007; 52(3): 528 - 38。
- 7.
棕色rc,lemmon是。γ-小管蛋白和微管组织在肝脏的分裂过程中Ricciocarpus•(ricciaceae)。我是J机器人。2008; 95(6):664-71。
- 8.
叶军,徐敏。肌动蛋白束蛋白PLIM2s参与拟南芥花粉发育和管体生长的调控。植物生理学报,2012;169(5):516-22。
- 9.
程颖,戴旭,赵艳艳。丝兰黄素单加氧酶合成生长素对拟南芥花器官和维管组织形成的调控。基因Dev。2006;20(13):1790 - 9。
- 10.
生长素对拟南芥花药开裂、花粉成熟和花丝伸长具有调控作用。植物细胞。2008;20(7):1760 - 74。
- 11.
金伯格RB,比尔斯TP,桑德斯总理。花药发展:基本原理与实际应用。植物细胞。1993;5:1217-29。
- 12.
威尔逊za,张db。从拟南芥到米饭:花粉发育的途径。J Exp Bot。2009; 60(5):1479-92。
- 13。
朱茹,娄y,徐X,杨泽。拟计的绦虫发育和功能的遗传途径。J Intent Plant Biol。2011; 53(11):892-900。
- 14。
CAI CF,朱茹,娄y,郭ZL,Xiong SX,王k,杨ZN。OSTDF1的功能分析揭示了水稻和拟南芥之间的胶质发育的保守遗传途径。SCI BULL。2015; 60(12):1073-82。
- 15.
Schreiber DN,Bantin J,Temselhaus T. MADS箱转录因子ZMMADS2是玉米和花粉成熟所必需的,并且在花药裂开期间在凋亡体中累积。植物理性。2004; 134(3):1069-79。
- 16.
牛宁,梁伟,杨旭,金伟,Wilson ZA,胡军,张东东。水稻雄性生殖发育过程中,EAT1通过调节天冬氨酸蛋白酶促进绒毡层细胞死亡。Nat Commun。2013;4:1445。
- 17.
李楠,张东升,刘海生,殷春生,李晓晓,梁文清,袁智,徐斌,褚宏文,王杰,文天强,黄辉,罗东,马辉,张栋梁。水稻绒毡层退化阻滞基因是绒毡层退化和花药发育所必需的。植物细胞。2006;18(11):2999 - 3014。
- 18.
过氧化氢信号。植物学报2002;5:388-95。
- 19.
控制细胞死亡、植物存活和发育。细胞生物学杂志。2004;5(4):305-15。
- 20。
呼吸爆发氧化酶:ROS信号转导的引擎。植物学报。2011;14(6):691-9。
- 21.
胡丽,梁伟,尹超,崔新,宗杰,王旭,胡杰,张东东。水稻MADS3对花药发育后期ROS稳态的调控。植物细胞。2011;23(2):515 - 33所示。
- 22.
Xie HT, Wan ZY, Li S, Zhang Y. study on the study of NADPH oxidase and reactive oxygen species in Arabidopsis thopsis . acta physica sinica(植物学报),29(4):564 - 572。植物细胞,2014,26(5):2007 - 23所示。
- 23.
罗丹,徐辉,刘铮,郭健,李辉,陈丽,方超,张强,白敏,姚宁,吴辉,吴辉,纪超,郑辉,陈勇,叶胜,李旭,赵旭,李锐,刘玉刚。一种有害的线粒体-核相互作用导致水稻细胞质雄性不育。Nat麝猫。2013;45(5):573 - 7。
- 24。
低氧对玉米减数分裂命运获得的影响。科学。2012;337(6092):345 - 8。
- 25。
张东,杨磊。花药内绒毡层和小孢子细胞的特性。植物学报。2014;17:49-55。
- 26。
杨丽丽,钱晓霞,陈敏,费强,梁伟,张东东。一种受体样激酶在花药细胞鉴定中的调控作用。植物杂志。2016;171(3):2085 - 100。
- 27.
桑德斯PM,Bui AQ,Wettersings K,McIntire Kn,Hsu Y-C,Lee Py,Truong Mt,Beals TP,Goldberg RB。花药发育缺陷拟南芥蒂利亚纳雄性无菌突变体。性植物团体。1999; 11:297-322。
- 28.
张丹,张伟生。水稻雄蕊发育与花药发育。Sci公牛。2009;54(14):2342 - 53。
- 29.
Brukhin V, Hernould M, Gonzalez N, Chevalier C, Mouras A.番茄花发育时间表Lycopersicon esculentum简历。甜樱桃。性植物再生2003;15:311-20。
- 30.
Koltunow Am,Truettner J,Cox Kh,Wallroth M,Goldberg RB。在花药开发期间发生不同的时间和空间基因表达模式。植物细胞。1990; 2:1201-24。
- 31。
Foreman J,Demidchik V,Bothwell JHF,Mylona P,Miedema H,Torresk MA,Linstead P,Costa S,Brownle C,Jonesk JDG,Davies JM,Dolan L. NADPH氧化酶产生的反应性氧物种调节植物细胞生长。自然。2003; 422:442-6。
- 32。
李志刚,李志刚,李志刚。植物活性氧基因网络的研究进展。植物科学进展。2004;9(10):490-8。
- 33.
植物NADPH氧化酶的爆发。植物科学进展。2012;17(1):9-15。
- 34.
Yoshioka H, Numata N, Nakajima K, Katou S, Kawakita K, Rowland O, Jones JDG, Doke N。尼古利亚娜·宾夕法尼亚州gp91phox同系物NbrbohA和NbrbohB参与H2O2积累和抵抗5种.植物细胞。2003;15(3):706 - 18。
- 35.
张H,方Q,张Z,王Y,Zheng X.呼吸爆发氧化酶同源物在引导者诱导的气孔闭合和过敏反应中的作用尼古利亚娜·宾夕法尼亚州.中国生物医学工程学报。2009;60(11):3109-22。
- 36。
纪超,李辉,陈林,谢明,王峰,陈勇,刘永刚。一种新的水稻bHLH转录因子DTD与TDR协同调控绒毡层功能和花粉发育。摩尔。2013;6(5):1715 - 8。
- 37。
日本武田CG。Hidetaka Kaya, Elizabeth Bell, Kazuyuki Kuchitsu, Liam dolan根毛细胞的局部正反馈调节决定了细胞的形状。科学。2008;319:1241-4。
- 38。
通过gp91的植物同源物产生超氧化物phoxNADPH氧化酶。植物杂志。2001;126:1281 - 90。
- 39.
邢HL,东路,王ZP,张海,汉联,刘B,王XC,陈QJ。用于植物中的多重基因组编辑的CRISPR / CAS9工具包。BMC植物BIOL。2014; 14:327。
- 40.
关键词:拟南芥,S- acyl TRANSFERASE10,耐盐性,生长发育植物细胞。2013;25(3):1093 - 107。
- 41。
王jg,李士,赵xy,周lz,黄gq,冯c,zhang y. hapless13,rapidopsisμ1适应素,对蛋白质分类至关重要反式-GOLGI网络/早期内肢组。植物理性。2013; 162(4):1897-910。
- 42。
黄国强,李娥,葛福瑞,李松,王强,张春强,张颖。拟南芥RopGEF4和RopGEF10在feronia介导的根毛生长发育中起重要作用。新植醇。2013;200(4):1089 - 101。
确认
我们感谢Sheila McCormick教授对本文的英文编辑。
资金
山东省自然科学基金项目(no . ZR2014CM027);国家自然科学基金项目(no . 31471304);本实验室是山东省政府“泰山学者计划”的一部分资助项目。
可用性数据和材料
本研究过程中产生或分析的所有数据均包含在本发表的文章及其补充信息文件中。
作者的贡献
SY、QF、HX进行实验并获取数据;SY和SL分析数据;YZ设计实验;YZ和SY写了这篇文章。所有作者阅读并批准了最终的手稿。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
同意出版
不适用。
伦理批准和同意参与
本研究不包含任何需要伦理同意或批准的研究。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
作者信息
隶属关系
通讯作者
额外的文件
额外的文件1:
以下材料可在本文的在线版本中获得。图S1。烟草花药发育的分期。图S2。番茄花药开发的分期。图S3。烟草和番茄花药发育过程中活性氧水平的变化2DCF-DA染色。图S4。拟南芥、烟草和番茄RBOHs的系统发育分析。表S1。在烟草或番茄交换机发展中的大小和重大事件。表S2。Oligos用于实时pcr。(PDF 2041 kb)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Yu, SX。,Feng, QN., Xie, HT.et al。活性氧介导烟草和番茄绒毡层程序性细胞死亡。BMC植物杂志17,76(2017)。https://doi.org/10.1186/s12870-017-1025-3
已收到:
接受:
发表:
关键字
- 雄性不育
- 花粉
- 花药发育
- 毯
- 罗斯