摘要
背景
单侧不亲和性(UI)是一种不对称的生殖障碍,它单向地阻止物种和/或种群之间的基因流动。UI的特征是伴侣之间在一个方向上的兼容相互作用,但在互交受精失败,通常是由于花粉管被雌蕊排斥。虽然在不同物种间杂交中发现了UI,但其潜在的分子机制才刚刚开始。野生番茄的近亲茄属植物habrochaites提供一种独特的研究系统,以研究这种生殖屏障的分子基础,因为物种内的种群表现出间隙和口腔UI。在这里,我们利用转录组方法来鉴定可能是UI中的关键参与者的花粉和雌蕊组织中的基因。
结果
我们在花粉-雌蕊水平上证实了自交不亲和群体和自交亲和群体间的UI美国habrochaites.表达表现出不相容性响应和未加压对照的授粉曲线之间的基因表达的比较仅揭示了少量差异表达的转录物。在UI竞争力与UI受损的生殖组织之间鉴定了成绩单谱的更多差异。高度差异表达了许多有趣的候选基因,包括推定的花粉阿拉伯半乳蛋白,智捷野宫Kunitz家族蛋白酶抑制剂和智能肽激素快速碱化因子。我们的数据还提供转录组的证据,即包括反应性氧(ROS)信号传导的基本过程可能在群体和物种之间的UI花粉裂解中的相互作用中的关键。
结论
生殖组织的基因表达分析使我们在花粉-雌蕊互作水平上更好地了解种群间不亲和性的分子基础。我们的转录组分析突出了一些特定的基因,包括那些在UI研究中需要进一步研究的ROS信号通路中的基因。据我们所知,这是第一个在一个物种内的种群之间的单侧屏障中识别候选基因的报告。
背景
生殖障碍是维持物种完整性的关键,种群间生殖障碍的出现与基因流动减少和遗传分化增加有关,最终导致物种形成。在包括茄科在内的许多植物科中,花粉-雌蕊相互作用水平上存在着一种单向的交后未合子障碍,称为单边不亲和性(UI)。UI最常被研究的是属和种之间的关系[1,2,3.,4,5],但也有证据表明同一物种的种群之间存在UI [1,6,7,8,9].
ui在物种之间的十字架中的单向性与植物交配系统有关,具体涉及自我不相容响应。自我不相容的(Si)物种是屈服者,而自相容性(SC)物种能够通过自我授粉产生后代。杂草类科是开花植物中最常见的不相容性系统[10.在许多家族中,它依赖于雌蕊表达的活性年代-locus核糖核酸酶,或S-RNases [11.,12.].与芸苔属的孢子体SI不同的,花粉在柱头表面被排斥[13.,14.],在杂草类生长花粉管中,在风格内积极拒绝[11.,15.,16.,17.].这种基于s - rnase的SI类型是由多态性决定的年代-位点,含有雌蕊- (S-RNase)和花粉- (S-locus F-box)表达的因子,这些因子是SI反应特异性所必需的[18.,19.,20.,21.].额外的因素也涉及SI,尽管它们不确定特异性。这些包括雌蕊表达的HT-蛋白和120k糖蛋白[22.,23.,24.]以及E3泛素连接酶复合物(Cullin1和Skp1)的花粉表达组分[15.,25.,26.,27.,28.,29.].
UI通常遵循SI x SC规则,其中SC种的花粉不能使SI胚珠受精,但互交是相容的[4].由于SI和UI之间的这种联系,最初的研究表明年代-基因座在种间不亲和性上。事实上,最近的研究表明,蛋白质S-RNase, HT-protein, S-locus F-box 23和Cullin1都在SI和UI反应中起作用,显示了这两种类型的生殖屏障之间的机制重叠[26.,28.,30.,31.,32.,33.].然而,还可以清楚地说,除了在UI中涉及SI功能的遗传因素。
SC物种或人群(其中许多不表达S-RNase)之间的交叉表现出意外的不兼容[1,2,3.,4,7,31.,34.,35.].这表明UI至少有两种机制,一种是基于S-RNase的,另一种是独立于S-RNase的。大多数SC种表现出与其他SC种完全的杂交性,但SI种最近进化的SC居群表现出UI [2,4].这表明S-RNase不依赖UI的机制因素也存在于含有S-RNase的群体中。然而,UI中涉及的因素的数量和类型仍然不清楚,大多数模型表明多个UI基因的作用有大的和小的影响[2,5,8,36.].
茄科植物SI和UI的现有数据可以用一个功能体系结构来描述,在这个体系结构中,花粉侧抗性因子是克服雌蕊侧屏障的必要条件[37.].从这个意义上讲,雌蕊(如S-RNase和HT)中存在屏障的存在使其能够抑制花粉管,而花粉中的抵抗因子(例如SLF和CUL1)使其能够克服克斯侧屏障[37.].由于许多影响UI的因素还没有明确的描述,这种雌蕊屏障和花粉抗性的结构为研究花粉-雌蕊相互作用提供了一个有用的框架。
番茄思工(茄属植物部分Lycopersicon)提供了充分的机会进一步了解和识别UI所涉及的基因[38.].这一小型人民队最近从一个普通的Si祖先分歧[39.,40.在大约250万年的时间里[41.].该分支有6种SC种和7种SI种,其中3种同时包含SI和SC种群[42.].许多研究已经检查了生理方面[1,5,43.,44.和遗传基础[26.,27.,28.,30.,31.,33.在分支成员之间的UI。此外,少数研究评估了一个物种内SI和SC种群间的UI [1,6,7,8,9,44.].
野生番茄茄属植物habrochaites是一种理想的物种,其中在最近分叉的人群的背景下研究了三个缺点和流言例UI。美国habrochaites在北部和南部物种范围边距,经历了至少两个从祖先SI州的独立转变到SC到SC范围边距[6,7,9,45.].北部山脉边缘SI的丢失与雌蕊侧SI因子S-RNase的丢失相关[6,31.,46.];而南部美国habrochaitesSC群体表达少量或不具有RNase活性的S-RNase蛋白[31.].的遗传结构美国habrochaites是一致的种群从北部和南部从一个中心起源,与中心SI种群显示出最高水平的多样性[45.,47.].有趣的是,许多种群表现出的繁殖障碍的类型和强度也遵循同样的分化纬度轴[6,45.].
以往的研究表明,在不同的种群中,种内和种间UI的强度都存在差异美国habrochaites人口[1,6,7,8,9,31.,35.].例如,一个中央美国habrochaitesSI群体(LA1777)拒绝来自北方亚群的花粉管美国habrochaitesSC群体,包括LA0407;而LA0407和其他SC群体接受LA1777花粉管[1,6].
在三个相互作用中,当sc时美国lycopersicum或SCS. Neorickii.(作为女性)越过美国habrochaites(如雄性),杂交结果为果实[48.,49.].在倒数十字架中,Si和Southern群体的雌蕊美国habrochaites通过花柱生长几毫米后迅速排斥种间SC花粉,显示典型的UI反应[1,6,31.].然而,在北方的许多SC居群中,种间花粉管排斥被延迟美国habrochaites,(1,6,31.,一个唯一的SC群体(LA1223)无法拒绝两者美国lycopersicum和S. Neorickii.花粉管(6].LA1223是唯一已知的美国habrochaites不积累雌蕊ht -蛋白的群体[6,31.,这可能解释了花粉-雌蕊水平上UI的异常缺乏。
虽然优雅的映射,生化和转基因研究表明,SI因素是UI的重要参与者[12.,23.,26.,28.,30.,31.,33.,50.,涉及复杂UI反应的全套分子因素才刚刚开始被描述。种间和种群间UI的证据美国habrochaites这表明除了参与SI的因素外,其他因素也参与UI。这与番茄中的转基因研究一致,表明S-RNase和ht -蛋白一起可以排斥来自SC子集的花粉,即使这样,花粉管排斥也会延迟[33.].
转录组分析可以提供有关花粉 - 雌蕊相互作用的因素的广阔视野,并且代表了候选基因鉴定的强大工具。研究拟南芥已经确定了花粉或雌蕊特异的大量基因,以及那些在兼容授粉中两者之间的相互作用诱导的基因。51.,52.,53.,54.].然而,很少有研究对花粉-雌蕊对UI反应的转录组进行研究。在最近的一项研究中,Pease等人[55.[通过比较UI主管的智捷宫转录om确定许多均匀特异性UI候选基因S. Pennellii.和UI-deficient美国lycopersicum,这两个物种可能在2年的时间里分化[41.].它们的结果确定了这两个物种样式之间表达中的大量基因座,并突出了UI中HT-蛋白的重要性[55.].
在这里,我们使用了一种类似的转录组学方法来广泛地描述UI中涉及的分子因子美国habrochaites在花粉-雌蕊相互作用水平。研究选择的人群最近出现了分化(< 0.8 mya, [41.),并表现出种间和种群间生殖障碍的差异。据我们所知,这是第一个使用转录组学来识别与物种内不同种群之间生殖障碍相关的新候选基因的报告。
结果
SI LA1777和SC LA0407的花粉-雌蕊相互作用
使用花粉管生长测定,我们证实,RNA-SEQ实验中使用的所有LA1777(SI)个体都被拒绝了自我花粉管和LA0407的那些,但从其他LA1777个体中接受了花粉(血管包积)。此外,我们证实,每个LA0407(SC)来自La1777,自我和跨腔内的各个接受的花粉管。
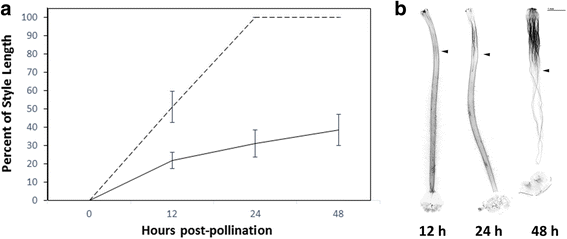
在相容的十字架中,花粉管通常在24小时内到达卵巢[1,31.].然而,不亲和的杂交在花粉管排斥的时间上可能不同[1].为了确定LA1777(雌)和LA0407(雄)不亲和杂交后花粉管排斥发生的时间点,对雌蕊进行了授粉和采收。LA1777的雌蕊在授粉后12 h积极排斥LA0407的花粉,48 h完全排斥(图1)。1).虽然重要基因表达的变化可能发生在授粉后立即在早期跨度为花粉管拒绝,我们选择收获花柱组织16 h post-pollination后续RNA-seq实验试图捕获基因表达的变化对应于活跃的花粉管拒绝风格。这时,不相容的花粉管将穿过花柱长度的20%(图。1),而相容花粉管将穿过花柱长度的60%(图。1,(31.])。
UI主管和受损人群之间的差异基因表达
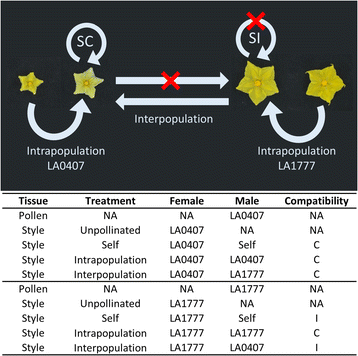
我们取样了花粉和花柱组织,以更好地表征ui活性LA1777和ui受损LA0407之间转录组的差异(图1)。2).花柱要么未授粉(UP),要么经过自花授粉、群体内授粉和群体间授粉三种处理;而花粉则被单独处理(未萌发)(图。2).我们认为La1777的雌蕊是“UI能力”,因为它们含有允许拒绝自我,口腔和三分之一花粉管的功能障碍[1,6,31.].另外,我们认为LA0407的雌蕊是“ui受损”的,因为屏障的丧失导致了无法排斥自身、种群间和某些类型的种间花粉管[1,6,31.].在花粉的情况下,我们也认为LA1777是“UI-competent”,因为它具有花粉侧抗性因子,使其能够克服雌蕊侧屏障,而LA0407花粉被认为是“ui -妥协”,因为它被所有SI雌蕊拒绝[1,6,31.].
共分析了33055个基因,其中花粉特异基因7358个(22.3%),花粉特异基因4793个(14.5%)。此外,我们发现1492个基因仅在LA1777组织中高表达,1382个基因仅在LA0407组织中高表达(分别占分析基因的4.5%和4.2%)。
授粉类型对少数基因有显著影响
我们预计花柱转录组会因授粉类型和授粉是否兼容而表现出差异。我们进行了三个单独的两两比较,以观察不同授粉类型(居群内、自群体和居群间)的UP LA1777花型的差异基因表达。授粉后的LA1777花柱和UP的LA1777花柱之间的两两比较显示只有少量的差异表达基因,这些基因的表达水平都很低(< 0.3 counts per million (cpm);额外的文件1:表S1 (self vs UP),附加文件1:表S2 (intrpopulation vs UP)和附加文件1:表S3 (interpopulation vs UP))。在所有授粉处理中,我们鉴定了授粉诱导的一些假想蛋白质、rna定向DNA聚合酶和逆转录病毒相关逆转录酶的差异表达。然而,在所有授粉处理中,只有3个基因表现出相似的调控作用:一个假设的蛋白质(sopopen05g010690)和两个与copia样逆转录转座子具有高度同源性的基因(sopopen01g019140和sopopen02g008750)。
与LA1777不亲和组合(自交和群体间组合;额外的文件1:表S1和表S3)与兼容十字架(跨困境;附加文件1表S2),其中三个编码了假想的蛋白质。此外,在不亲和的杂交组合中,含有胱硫氨酸β合成酶(CBS)结构域的蛋白(Sopen06g019460)下调了3倍。有人提出,CBS蛋白是氧化还原调节因子,参与了细胞壁组成的修改,并在拟南芥, CBS表达的变化会降低自我生育能力[56.].一个同源际分生组织沉默缺陷3(DMS3,SOPEN03G019410),涉及沉默和表观遗传改性的基因[57.],在不亲和的组合中也下调3倍。
有32个基因在群体间传粉和UP花型之间存在差异1:表S3),但在其他处理(self vs UP;额外的文件1表S1或内种群vs UP;额外的文件1:表S2)。有趣的候选者,包括RAS相关的GTP酶(SOPEN04G023040,RAB3),花粉特异性钙结合膜蛋白(SOPEN04G003390)和K+在群体间传粉过程中,Transporter (Sopen11g006300)上调约3倍。另一个候选基因在群体间授粉中上调了16倍,编码H2O2转运体(Sopen10g033580 PIP2)。这些基因中的每一个都可能参与花粉-雌蕊相互作用中活性氧(ROS)信号的传递[58.,59.,60,61,62[他们在口腔授粉中的上调可以改变ROS信号,导致UI表征的功能失调的花粉管生长。此外,在口腔授粉中,将内切核酸酶上调超过18倍,并且在2.9倍超过2.9倍的DNA酶。有趣的,在Pyrus pyrifolia和罂粟花rhoeas,不相容(自)花粉管中ROS信号的中断导致肌动蛋白细胞骨架的解聚和核DNA降解的增加[63,64].
样式中与ui能力相关的基因表达差异
虽然从我们的两两比较中发现了许多潜在的有趣的UI候选基因,但它们的表达水平相对较低,通常只表现出较低的fold-changes,且具有相对较高的表达水平P.值(P.< 0.05)。对所有花柱处理的主成分分析(PCA)表明,大多数样品之间的差异可以用来源种群来解释,而由于授粉处理,没有一致的花柱分组(附加文件)2:图S1)。在上脑和授粉治疗之间检测到少数显着差异可能反映先前研究的结果,表明涉及UI竞争力的基因,无论授粉状态如何,都表达了款式[31.,38.,55.].换句话说,具有ui能力的花柱似乎“准备好”排斥不亲和花粉,因为UP花柱和那些授粉的亲本与亲本不亲和的花柱之间的基因表达没有明显变化。基于这些结果,我们还进行了一项分析,将一个群体内的所有花柱处理(UP、自交授粉、群体内和群体间花粉)合并在一起,以捕获UI-competent (LA1777)和ui - included (LA0407)花柱之间的差异表达。
我们确定了179个基因在UI-competent与折衷风格中显著上调,179个基因显著下调(附加文件)1:表S4和表S5)。然而,我们主要关注我们的兴趣,这些兴趣在展示平均表达水平超过3个归一化CPM的基因上,并且在UI竞争力与受损风格中的10倍上升超过10倍。表现出UI主管风格最大上调的前25个基因如表所示1.
在UI-competent和折中风格中显示最高上调的前25个基因中,我们发现有10个参与氧化还原反应(见表)1).其中包括3个细胞色素P450基因(Sopen02g037430、Sopen06g021780、Sopen07g028940)、一个Alkenal还原酶(Sopen12g006330)、一个谷胱甘肽s -转移酶(Sopen12g026980)、一个NAD(P) h -脱氢酶(Sopen05g003640)和一个NAD(P)氧化还原酶(Sopen12g021490)。此外,我们还鉴定了两个参与类黄酮生物合成早期步骤的基因:查尔酮合成酶2 (Chalcone Synthase 2, Sopen05g032070)和查尔酮-黄酮异构酶(Chalcone- flavanone Isomerase, Sopen05g030780)。最后,我们发现在UI-competent样式中显示最高上调的基因(假设蛋白,soopen12g017530)包含一个重金属相关域(附加文件2:图S2),提示它也可能参与氧化还原反应。
在UI-competent风格中,我们还确定了三个上调基因,推测它们参与了防御反应。其中包括一种参与茉莉酸和乙烯信号传导的几丁质内切酶(Sopen02g027710),高表达(182 cpm)并上调20倍以上,一种beta -葡萄糖苷酶(Sopen11g004500)和一种抗病蛋白(Sopen10g025030)(见表)1).这些基因令人感兴趣,因为参与植物-病原体相互作用的许多分子成分与参与花粉管生长和引导的分子成分有显著重叠[65].
有一个特殊的基因在UI-competent方式中高度上调,它是假设的蛋白Sopen02g033850(见表)1),与野生马铃薯的肽激素快速碱化因子(RALF)具有80%的氨基酸同源性,美国chacoense.包括RALF的小分泌肽涉及各种植物功能,包括发育和免疫力[66和花粉特异的RALF美国lycopersicum(slpralf)被发现在体外负调节花粉管伸长[67].我们还鉴定了一个参与寡肽运输的蛋白(sophen05g001950),该蛋白以UI-competent方式上调了>28倍,可能参与肽激素(如ralf)的运输/分泌。
另一个感兴趣的基因在ui有效型和妥协型中高度上调是Kunitz家族蛋白酶抑制剂(见表)1).在烟草, Kunitz家族蛋白酶抑制剂,NaStep,在SI种的雌蕊中高度表达,被认为可以稳定ht -蛋白,尽管这种相互作用的机制基础尚不清楚[68].Nastep蛋白由相容性和不相容的花粉管造成,以及转基因抑制NaStep在SI烟草物种损害了自我和某种类型的种类斑块花粉管[68].该基因在ui受损的LA0407中表达减少,可能反映了该群体缺乏排斥某些种间花粉管类型的能力[1,6].
虽然我们最感兴趣的是在UI-competent风格中显示最高上调的基因,但我们也分析了高度下调的基因。我们发现,在UI-competent风格中,前25个高度下调的基因中,有3个参与了氧化还原反应,一个被认为参与了防御反应(附加文件)1:表S5)。值得注意的是,在UI-competent风格中下调的前25个基因中,有5个被认为与细胞壁修饰有关(附加文件)1:表S5)。其中包括2个果胶裂解酶(Sopen12g009500和Sopen01g038750)、1个葡萄糖基转移酶(Sopen00g008620)和2个糖基水解酶(Sopen04g034210和Sopen07g001240),均下调了13倍以上。另外8个涉及细胞壁修饰的基因在UI-competent风格中下调,尽管幅度较小(附加文件)1:表S5)。
除了我们对UI-competent和折衷风格中高度上调或下调的基因进行分析外,我们还调查了33个先验候选基因的表达(附加文件)1表S6)基于可能涉及UI的样式基因的文献报道[26.,28.,31.,55.].这些候选者包括在最近的研究中鉴定的基因,比较UI主管之间的狼镖转录omS. Pennellii.LA0716和栽培番茄美国lycopersicumM82显示没有UI响应[55.].在33个先验候选对象中,只有3个显示出能够胜任ui的LA1777的样式比ui受损的LA0407的样式增加了2倍以上(附加文件1:表S6)。其中包括一个果胶-甲基酯酶抑制剂(Sopen04g027820,上调2.4倍)和两个糖基转移酶(Sopen08g002330和Sopen08g002350,均上调8倍以上);然而,所有的表达水平都很低,< 1 cpm。ht -蛋白,基于s - rnase的UI所需的一种富含天冬酰胺的小蛋白[33.]在两个群体的花型中均有高表达,在LA1777中有轻微下调(HT-A, 1.3倍)。有趣的是,HT-B转录本在两个群体中都有表达,尽管由于转录本中的早期终止密码子,两个群体都没有积累功能蛋白[31.].每个LA1777个体都如预期的那样携带两个独特的S-RNase等位基因(数据未显示),而LA0407不表达S-RNase转录本,这在以前的研究中已经有记录[31.].
花粉中ui竞争力相关的差异基因表达
花粉和雌蕊之间的协调相互作用是受精成功的必要条件,我们还比较了不同群体间的花粉转录组。LA1777的花粉管到达番茄枝内所有SI和SC种的子房[1].然而,La0407花粉管由所有SI种拒绝,包括SI美国habrochaitesLA1777 [1].La0407花粉的无法遍历La1777和其他Si的风格茄属植物表明它已经失去了抵抗s - rnase所需的花粉因子。因此,在我们的分析中,我们认为LA1777花粉具有ui能力,而LA0407花粉具有ui缺陷。
我们在RNA-seq分析中使用了干燥的成熟花粉,因为之前在番茄UI中发现的基因(CUL1和SLF23)在干燥/未萌发花粉中有高水平的基因表达[26.,28.].然而,在UI中一些重要的花粉特异基因可能需要通过水合作用或与雌蕊组织的相互作用来诱导,而这些在我们的分析中没有捕捉到。
我们鉴定了90个基因在具有ui能力的花粉中上调(附加文件1:表S7)和被下调的99(附加文件1:表S8)。在UI竞争力与UI受损的花粉中提升的十大基因中的十个被注释为假设蛋白(表2;额外的文件1:表S7)。经过进一步分析,在ui花粉中上调最高的假设基因(Sopen12g014190)可能编码阿拉伯半乳糖蛋白(AGP)(附加文件)2:图S2)。在拟南芥,花粉agp是花粉管正常发育和生长所必需的[69,70,71],而雌蕊agp则可刺激花粉管生长[70,71,72,73].我们还鉴定了一个rabgtpase (Rab4A, Sopen01g033860),该酶在具有ui活性的花粉中上调了近200倍。来自这个家族的花粉特定蛋白已被发现可以促进花粉管顶端的生长,并在花粉管感知方向线索的能力中发挥作用[74,75].
我们对花粉的分析还鉴定了可能参与蛋白质降解途径的差异表达基因(表2;额外的文件1:表S7和表S8)。这些基因是感兴趣的,因为花粉SCF(SKP-CULLIN-F箱)的组分(SKP-CULLIN-F盒)E3泛素连接酶复合物在SI和UI中涉及,并且可能涉及解毒诸如S-RNASES的解毒侧因子蛋白酶体降解途径[11.,15.,21.,26.,27.,29.,76].我们发现两个F-box/Skp2样基因(Sopen05g003280和Sopen12g022970)在具有ui活性的花粉中被上调了150倍以上2).另一个参与蛋白质降解的基因,天冬氨酸蛋白酶(Sopen01g032940)在花粉中上调了189倍(见表)2).没有先前识别的SLF [28.显着差异化,花粉UI因子Cullin1也不是差异调节[26.)(附加文件1:表S9)。
我们在花粉中发现了两种蛋白激酶上调50倍以上,其中一种编码钙结合丝氨酸/苏氨酸壁相关激酶(Sopen10g028190),另一种编码富含半胱氨酸受体样激酶(RLK) (Sopen02g013470)(见表)2).因为RLKs已被证实在花粉管生长中发挥作用[77,这些基因具有潜在的价值。此外,花粉表达的RLKs参与接收来自雌蕊的肽和激素信号[78,79,80].
参与转录调控的基因可能是花粉管生长的重要组成部分。我们确定了两种已知的转录因子,它们在应激反应中发挥关键作用[81,82在具有ui活性的花粉中高度上调的蛋白:一个含nac结构域的蛋白(Sopen03g020850)和一个bZIP家族蛋白(Sopen12g006170),此前已定位于花粉2;额外的文件1:表S7)。
一项对具有ui活性花粉中高度下调基因的分析发现,一个F-box蛋白(Sopen11g004020)和一个富含半胱氨酸的RLK (Sopen05g014070)分别下调了45倍和100倍以上(附加文件)1:表S8)。在具有ui活性的花粉中,减少了100倍以上的基因还包括两种组蛋白去乙酰化酶(HDACs、Sopen11g004040和Sopen11g004050;额外的文件1:表S8)。HDACs的正常功能与花粉管的萌发和花粉管顶端的生长有关云杉willsoni[83].
额外的UI能力美国habrochaites人口
我们的初步分析比较La1777和La0407生殖组织的转录om LED对UI可能是一体的有趣候选者。试图进一步缩小候选基因并将我们的分析扩展到更广泛的范围内美国habrochaites我们进行了第二个RNA-seq实验,包括UP花柱和花粉美国habrochaites群体含有所选表型(表3.;额外的文件1:表S10)。
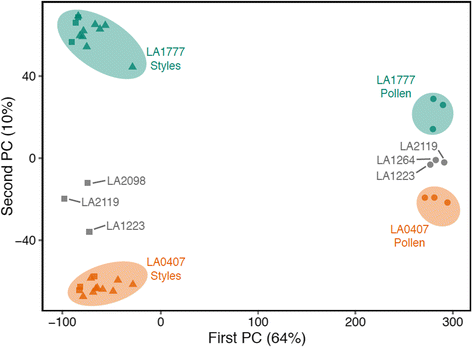
首先,我们确认了被测试个体的UI表型反映了之前的结果[6表型总结见表3.).所有样品的PCA表明,可以通过组织类型解释大部分样品变化(第1PC),而源群和潜在的配合系统解释了较小的变化(第2 PC)的百分比(图。3.).有趣的是,转录组分析选择的地理位置介于LA1777和LA0407之间的额外群体在PCA中聚在这两个群体之间。
对于每个基因,我们培训了La1777和La0407的表达值的UI能力的线性判别功能,然后在其他群体中分类基因表达为UI主管或UI损害。我们考虑了使用LA0407的这些群体的UI模式,以及以前报告的Interpecific UI结果([6,总结于表3.).由于LA2119的花型是独特的,它们接受群体间的LA0407花粉而排斥种间花粉,我们解释了表中的信息4以反映LA2119类型UI表型的变化:即LA2119上位的基因是种间UI的首选基因,而LA2119下位的基因是种间UI的首选基因。
线性判别分析(linear discriminant analysis, LDA)中确定的最具种间ui能力的候选蛋白包括假设的蛋白sofopen01g011020,该蛋白高表达并上调了>100倍(表1)4).鉴定六个基因,包括NAD(P) - 链接氧化还原酶(SOPEN12G021490),细胞色素P450(SOPEN07G030750),脂质氧化还原蛋白(SOPEN06G026260),重金属转运蛋白(SOPEN05G028380),过氧化合物蛋白质膜蛋白质(SOPEN03G005470)和照相I反应中心(氧化氧化丁蛋白氧化还原酶,SOPEN12G006800)。
在LDA中识别的型号的口腔辅导级别的顶级候选者包括两个可能涉及ROS信令(表4).一种对赤霉素敏感的类della转录因子(Sopen01g0311700) [84],并通过调节ROS积累参与ROS信号传导[85],被上调11倍。含有氧化还原活性过渡金属的血红蛋白蛋白(SOPEN08G021970)被上调3倍。其他口腔UI候选包括细胞壁合成蛋白α-1,4-葡聚糖蛋白合酶(SOPEN05G006860),α/β水解酶家庭蛋白(SOPEN11G005210),一种p-糖蛋白ABC转运蛋白(SOPEN08G025270)和F.-Box-LRR蛋白(SOPEN12G006260)。
花粉基因的LDA更为直接,LA2119和LA1264预计具有ui能力(即类似于LA1777),而LA1223具有ui能力,可能缺少穿越SI花型所需的花粉因子。如表所示5利用LDA,我们鉴定了22个基因在ui花粉中表达上调。两个基因,>上调25倍,编码F-box蛋白,都被认为参与了泛素连接酶复合物(Sopen03g040880和Sopen01g027170)。此外,与CUL4 RING泛素连接酶复合物相关的RAPTOR/KOG激酶同系物(Sopen10g027930)在花粉中被上调12倍,一种可能参与钙信号传导和多糖运输的膜联蛋白样钙结合蛋白(Sopen05g030530)被上调4倍以上。在分析中还鉴定了两个转录因子:Sopen12g027920编码FRI1抑制因子,该抑制因子可能会招募组蛋白H3甲基转移酶;Sopen11g020250编码锌指转录因子。
讨论
虽然UI普遍存在植物家庭中,但这种单向生殖障碍的潜在分子基础尚不清楚。在这里,使用转录组方法,我们在花粉和溜癖组织中鉴定了基因,该组织代表了涉及UI的强烈候选者。总体而言,我们的分析鉴定了涉及氧化还原反应和ROS信号传导的大量差异表达基因。氧化应激反应涉及各种植物生理过程,包括繁殖[58.,60,86,87,88].植物中的ROS的生产通常导致两种结果之一:适应压力或编程的细胞死亡[86].花粉和雌蕊ROS产生之间的平衡相互作用可以显示以下结果之一:信号传导和解毒作用是成功受精(适应胁迫)所必需的,也可以在不相容(SI)反应(不相容花粉管细胞死亡)中起作用。例如,在罂粟科中,ROS被认为是不相容(自)花粉管中细胞程序性死亡的关键调节器[64,89及近年来对蔷薇科成员的研究Pyrus pyrifolia已展示ROS累积,CA之间的联系2+自花粉管排斥过程中的信号转导、钙调素水平和肌动蛋白丝解聚[63,90].在茄科植物中,ROS可能参与花粉管生长和交叉相容性的初步迹象之一来自花粉管类型的组织化学染色佩妮矮牵牛,表明过氧化物酶活性在未授粉花柱中存在,在亲和授粉后降低,但在不亲和的自花授粉中保持较高[91].在对野生马铃薯细胞色素P450 (CYP51G1-Sc)的分析中也发现了这一现象s . chacoense在亲和授粉中,CYP51G1-Sc的mRNA水平下降,但在不亲和授粉(自交)中,这种细胞色素的水平保持稳定。
在我们调查UP和授粉方式之间变化的两两比较中,我们发现在不相容的种群间授粉中ROS通路成员的增加1表S3),但不兼容的自授粉(附加文件1:表S1)或兼容的种群内授粉(附加文件1:表S2)。例如,一个h2O2运输器仅在不相容的口腔授粉中超过16倍。这些运输器通常泵泵2O2质外体是一种酸性环境,具有少量的ROS清除剂,导致氧化应激[86].一个K+频道和CA2+-Binding Annexin Protein,这两个被注释为花粉表达的蛋白也在种群间相互作用中上调,rabp - gtpase也是如此。这三种蛋白在ROS的生成和信号转导中都发挥着重要作用。在花粉管中,膜层蛋白可能是钙结合的重要环节2+、细胞膜和细胞骨架[92].此外,许多膜联蛋白形成Ca2+这些通道不仅对振荡的Ca至关重要2+内流与花粉管顶端生长有关,但也有助于ROS信号传导、细胞伸长和细胞壁重塑[86,93].有趣的是,k+像我们分析中发现的通道一样,也可以作为ros激活的Ca2+渠道(93].小GTP酶,包括Rab,增加了CA中的NADP(H) - 氧化酶活性2+端依赖的方式(59.,94]花粉管生长需要它们适当的功能[59.,61,74,75,95].在烟草, RAB11蛋白活性和突变形式的过表达均抑制花粉管生长[75提示有效的花粉管生长需要多个Rabs的正确平衡。
在UI主管风格中,十二个前25个最高度上调的基因中的十个涉及ROS生成和/或信号传导,包括NADP(H) - 氧化酶和多种细胞色素P450s(表1).我们还确定了两种高度上调的基因候选的类黄酮途径,其可以产生类黄酮化合物以充当促氧化剂或抗氧化剂(表1).在我们随后的分析中使用了额外的转录组数据美国habrochaites人群,我们发现,六个可能涉及三种均匀uI的九个候选智者基因是ROS途径基因(表4).令人惊讶的是,只有两个ROS相关基因在种群间的UI-competent风格中上调,其中一个编码一个类della转录因子,间接抑制ROS积累和抑制细胞扩张[84,85].综上所述,这些结果表明,花粉和雌蕊之间ROS的产生和信号转导必须保持紧密平衡,才能使花粉管顺利通过花柱生长到达子房。
ROS的生成与细胞的扩张、生长、细胞壁交联和胼胝质沉积有关[96,我们的分析确定了可能参与细胞壁修饰的基因。花粉管壁由许多聚合物(胼胝质、纤维素和果胶)组成,它们彼此高度交联;然而,调控细胞壁修饰的机制尚不清楚[97,98,99].利用微阵列分析的研究发现,在授粉和未授粉的花柱中细胞壁修饰基因的表达上调[52.].然而,很少有人专门研究SI或UI反应的特异性(但见Pease等人[55.])。利用电子显微镜,de Nettancourt等人[One hundred.]发现SI和UI之间的调用沉积差异美国peruvianum其中SI杂交在花粉管顶端表现出高水平的胼胝质沉积,而种间杂交则没有[One hundred.].我们对UP和授粉的LA1777花柱的两两比较没有发现任何涉及细胞壁修饰的基因。然而,我们在花柱组织的大型分析中发现了一些涉及细胞壁修饰的差异表达基因(附加文件l:表S4和表S5),其中大多数基因在UI-competent花柱中高度下调。
来自我们对智能宫组织的分析中最有趣的基因候选之一包括一种推定的RALF肽激素(SOPEN02G033850),其在UI主管风格中升高超过22倍。肽激素信号传导在花粉雌蕊相互作用期间涉及多种方法,从花粉水合到施肥中[78].番茄的RALF已被证明在特定的发育窗口期减少花粉管的生长[67,因此,柱体分泌的RALF可能在种间花粉管的排斥中起作用。另一个有趣的表达风格的候选人是Kunitz-like蛋白酶抑制剂,它在UI-competent风格中上调。的烟草来自这个家族的NaStep蛋白对某些(但不是所有)种间花粉的排斥是必需的[68,该蛋白酶抑制剂可能在美国habrochaitesUI。最后,在UI-competent styles中发现的最高上调的样式基因编码一个推定的戊基化重金属结合蛋白(附加文件)2:图S2),这可能值得进一步研究。其他这种类型的蛋白质已经在多种组织中被鉴定出来,少数已经被鉴定出来的蛋白质与应激反应有关[101].
在具有ui活性的花粉中,我们鉴定了一个高度上调的假定AGP (Sopen12g014190)(表2),包含AGP的多个定义特征(附加文件2:图S2;[71,102])。该蛋白包含一个信号肽,一个疏水的c端结构域,八个含脯氨酸的二肽,由>35%的Pro/Ala/Ser/Thr (PAST)氨基酸组成(附加文件)2:图S2)。在拟南芥,花粉agp是花粉管生长所必需的,可能参与复杂的信号级联[69,70,71],花粉agp已定位于某些物种的花粉管顶端[103].另一个值得进一步研究的基因是rabo - gtpase (Sopen01g033860),该基因在具有ui活性的花粉中上调了近200倍。增加这些候选基因在ui受损花粉中的表达是否能够通过SI花柱增加花粉管的生长速度,这将是有趣的。
结论
我们的分析揭示了可能导致种群间生殖不亲和性的差异表达基因美国habrochaites.这项工作代表了了解种群之间如何产生单边屏障以及物种形成过程中如何维持屏障的重要第一步。用户界面响应的可变性美国habrochaites群体提供了一个令人兴奋的机会,进一步分析这些候选基因,并将它们与特定的UI表型联系起来。
方法
索兰属植物材料及生长
茄属植物habrochaites(S. Knapp & D. M. Spooner)是西红柿的野生亲缘,在交配系统中显示出多样性[42.,45.,以及种间[31.,35.[中介[1,6,7,8跨平台兼容性。种子的美国habrochaites本研究中使用的加入(以后称为人群)(表3.)从加州大学戴维斯分校的C.M. Rick番茄遗传资源中心(TGRC) (http://tgrc.ucdavis.edu,(104]),根据TGRC的建议进行消毒,如前所述在温室条件下种植[1,然后移植到科罗拉多州立大学有盖的户外农田中。所有农艺试验都是按照当地法律进行的,不需要批准。在这项研究中使用的植物被随机分配到一个单独的区,并且在整个实验中保持大而健康。根据Broz等人的生殖特征选择特定群体[6),见表3.为更多的信息。
花粉管生长表型
通过花柱测定了自交、居群内和居群间交互组合的花粉管生长美国habrochaites虽然在LA0407中,自交和居群内杂交结果一致,因此没有对每个个体的花粉管生长进行评估。所有杂交组合在开花前1天(−1天)去芽,24 h后人工授粉(0天,破芽),授粉后48 h收获固定物(1:3乙醇)。对LA1777(雌)和LA0407(雄)的杂交组合,分别在授粉后(12、24和48 h)的不同时间点采收花柱,以确定花粉管排斥发生的时间。授粉通常在下午晚些时候进行,并在第二天早上采集。然而,花粉管通过花柱的生长在上午和下午的授粉中是相似的(数据未显示)。
用网袋覆盖粉粉,以防止粉丝患者意外的花粉沉积。使用荧光显微镜评估花粉管生长,如前所述[31.]使用imagej 1.47V测量样式的曲款长度和不超过三个花粉管的风格的长度(https://imagej.nih.gov/ij/;[105])。
组织收集、RNA提取和文库构建
进行初级RNA-SEQ实验以鉴定参与在La1777女性和La0407男性之间的交叉口中观察到的间隔花粉管排斥的基因。样品由未加压的风格,授粉风格(自授粉,跨型授粉或口腔授粉)和未渗透的花粉组成(图。1;额外的文件1:表S10) - 导致每个单独的5种治疗/组织类型。每个人口的三个人被用作生物重复,导致总共30个图书馆。在一个设计用于缩小涉及口腔间相互作用的基因列表的后续实验中,在图书馆创建前的等摩尔比(附加文件)之前将来自一个和三个人之间的RNA样品(附加文件1:表S10)。
对于所有风格样品,如上所述,花粉管生长实验和授粉后16小时(在口腔流动的近似发生的近似时间)的花粉管生长实验和收获16小时的污染造血。未加长的控制在相同的治疗中(第1天的阉割),除非他们被撤离了。对于每个植物,每种治疗收集大约30件款式并在RNA提取之前合并。为了最大限度地减少因环境条件而导致的变化,所有治疗均在同一天进行并在一天中大约同一时间收获。将款式(包括柱塞)直接收获到RNATATER(QIAGEN)中并在4℃下储存1周,之后将曲目较好,在-80℃下立即冷冻直至加工。从每个植物中收获约100mg干粉,并立即在-80℃下冷冻。未结石的花粉用于RNA提取。
使用组织裂解器(QIAGEN)研磨组织,使用QIAGENRNEASY植物迷你试剂盒提取RNA,并达到终浓度为70-200ng / uL。通过琼脂糖凝胶电泳检查RNA样品的一部分,并通过溴化乙锭染色可视化。在图书馆创建前使用Agilent 2200 RNA挂毯系统进一步评估样品质量。使用Illumina Truseq链状mRNA样品试剂盒为每个样品产生滞留的总RNA的成对结束文库。汇集了图书馆,并均匀地分发了Illumina Hiseq™2000(Illumina Inc.,San Diego,Ca,USA)的两个车道。印第安纳大学基因组学和生物信息学,对RNA质量控制,图书馆准备和汇集进行了汇集。原始转录组数据可在NCBI SRA数据库上使用(Bioproject Prjna310635https://www.ncbi.nlm.nih.gov/bioproject/310635).
RNA-seq读取处理和映射
在映射和汇编之前,使用SHEAR程序对读取进行修剪和过滤(http://www.github.com/jbpease/shear;[55.])。简单地说,SHEAR首先使用Scythe算法(https://github.com/vsbuffalo/scythe.;[106])从3'结束删除适配器,然后过滤低质量读取(平均Q <10),用> 7个模糊的基础(n's)读取,读取<50 bp,并重复读取,使用相互信息分数> 0.5。然后通过去除低质量的基础(Q <20),多A或Poly-T运行,修剪在两端的修剪读数N≥12和含糊不清的基础。当我们推测时,3'末端的AGATC的外观也被取消,这是一个适配器片段。如果其中一个失败过滤器,我们将在一对中删除两个读取。平均而言,所有读数中的2.9%未能通过过滤器(最小2.5%,最多3.4%)。可以在附加文件中找到用于剪切的完整命令和参数2S1:方法。
我们将RNA-seq读取映射到茄属植物pennellii使用带有默认参数的STAR拼接比对器的参考基因组[107].下载参考基因组序列和基因组注释(SPENN V2.0)https://solgenomics.net[108].在整个文库中,平均81%的reads被唯一映射到参考基因组。我们计算了映射到参照基因注释和未注释假定的S-locus F-box (SLF)基因的reads [28.[共48,938个基因区],使用featurecots v1.4.5-p1 [109].总共663,185,500读对(占原料读数的72%)。对于SPENN V2.0中作为“假设”的基因进行注释[108[使用NCBI Blast搜索进行进一步的序列比对(https://blast.ncbi.nlm.nih.gov;[110.])。
差异基因表达分析
对于所有差异表达的测试,我们使用了由此实现的线性模型limma包(111.,112.]来自Edger包的模块[113.在R中[114.].首先,我们对原始读取进行规范化和转换轰,基于表达式与方差之间的预期关系的加权转换[112.].我们计算T.-使用标准误差的经验贝叶斯调整对每个基因的转化表达值进行统计易趣功能 [111.].
我们首先通过进行单独的两两比较来寻找花柱组织之间的差异表达。对LA1777的花柱处理进行了比较:群体内授粉(亲和)和未授粉(UP)花柱、自授粉(不亲和)和群体间(不亲和)花柱。
通过每种基因的归一化平均读数(CPM在图书馆中的CPM读数)的PCA通过PCA可视化表达的基因组表达模式prcomp函数(在R中实现;[114.])。PCA显示,在全基因组范围内,种群内所有类型处理之间的差异可以忽略不计(图2)。3.;额外的文件2:图S1)。由于这些基因表达谱的高度一致性,在我们的线性模型中,一个种群内的所有花柱处理(UP、自交、种群内和种群间授粉)被认为是相同的,该模型专注于UI-competent (LA1777)和ui - exposed (LA0407)花柱之间的差异。
我们使用具有单一固定效应(与起源种群共线)的线性模型鉴定了在ui能力组织中差异表达的基因(N= 6)和风格(N单独= 24)。从这些模型中,我们将表现出较大表达差异(> 3倍变化)的基因视为差异表达,在错误发现率(FDR)为5%的情况下具有统计学意义。此外,我们只考虑了组织特异性基因:在一般线性模型中,我们要求基因具有显著的(FDR < 5%)组织效应Y〜P+T+E.(P是人口效应,T是组织效应吗E.是错误术语)。对于尺侧因子,我们包括差异表达的基因,如果它们相对于花粉的曲位上调,并且对花粉侧因素反之亦然。最后一次过滤器确保了风格的差异不太可能在授粉样品的风格中由花粉贡献。
许多先验的花粉和雌蕊UI候选基因是根据以前出版物的信息选择的[23.,26.,28.,31.,55.].一些SLF基因尚未注释S. Pennellii.基因组,所以我们使用了Li和Chetelat的位点数量和序列[28.在我们的数据集中找到这些基因。我们确定了所有先验候选的表达水平,并进行了类似于上述的统计检验,以确定它们是否存在差异表达。
缩写
- AGP:
-
阿拉伯半乳聚糖蛋白
- 哥伦比亚广播公司:
-
胱硫醚β合酶
- CPM:
-
每百万计数
- CUL1:
-
Cullin 1
- CYP51G1-Sc:
-
茄属植物chacoense甾醇14Alpha-脱甲基酶
- DMS:
-
缺陷的公司默许沉默
- HDAC:
-
组蛋白脱乙酰酶
- H T:
-
小芦笋富含蛋白质
- LDA:
-
线性判别分析
- 远程雷达:
-
富亮氨酸重复
- NaStep:
-
烟草alataStigma-Expressed蛋白质
- 过去:
-
脯氨酸、丙氨酸、丝氨酸/苏氨酸
- PC:
-
主成分
- 主成分分析:
-
主要成分分析
- 皮普:
-
质是膜的内在蛋白质
- 拉尔夫:
-
快速碱化因素
- RLK:
-
受体激酶
- ROS:
-
活性氧
- SC:
-
Self-compatible
- 自洽场:
-
SKP-Cullin-F-box
- SI:
-
宗的
- SKOR:
-
振动器家庭钾外矫正通道
- SKP:
-
s阶段Kinase-associated蛋白质
- SLF:
-
S-LOCUS F-BOX蛋白
- SLPRALF:
-
茄属植物lycopersicum花粉快速碱化因子
- TGRC:
-
瑞克番茄遗传资源中心
- 界面:
-
单方面的不相容
- :
-
Unpollinated
参考文献
- 1。
Baek YS, Covey PA, Petersen JJ, Chetelat RT, McClure B, Bedinger PA。SI x SC规则的检验:番茄分支成员种间杂交的花粉-雌蕊相互作用(茄属植物部分Lycopersicon,solanaceae)。我是J机器人。2015; 102(2):302-11。doi:10.3732 / AJB.1400484.
- 2。
DE NETTANCOURT D.野生和栽培植物中的不相容性和不相对性。柏林:斯普林克;2001年。
- 3.
Hogenboom NG。亲密伴侣关系中不协调的典范。Euphytica。1973;22(2):219 - 33所示。doi:10.1007 / bf00022629.
- 4.
王志强,王志强。开花植物种间单侧不亲和性的研究。遗传。1958;12:233-56。
- 5。
马丁·弗兰克-威廉姆斯。两个番茄种间单侧不亲和的遗传控制。p1基因。1967;56(3):391 - 8。
- 6.
Broz AK, Randle AM, Sianta SA, Tovar-Méndez A, McClure B, Bedinger PA。交配系统的转变茄属植物habrochaites影响种群和物种之间的相互作用。新植醇。2017;213:440-54。doi:10.1111 / nph.14130.
- 7.
马丁·弗兰克-威廉姆斯。不相容障碍的分布和相互关系Lycopersicon分子humb。和bonpl。复杂。进化。1963; 17(4):519-28。doi:10.2307 / 2407103.
- 8.
马丁·弗兰克-威廉姆斯。单侧不亲和性遗传Lycopersicon分子.遗传学。1964;(3):459 - 69。
- 9.
自交不亲和性的崩溃Lycopersicon分子.在:Hawkes JG, Lester RN, Nee M, Estrada N,编辑。茄科III:分类学、化学、进化。伦敦:伦敦皇家博塔尼花园邱园和林奈学会;1991.253 - 6页。
- 10.
开花植物自交不亲和机制的研究。细胞生物学杂志。2001;58(14):1988-2007。doi:10.1007 / PL00000832..
- 11.
基于s - rnase的系统的兼容性和不兼容性。安机器人。2011;108(4):647 - 58。doi:10.1093 / aob / mcr179.
- 12.
等。花柱自交不亲和基因产物烟草阿尔塔核糖核酸酶。大自然。1989;342(6252):955 - 7。doi:10.1038 / 342955 a0.
- 13。
Chapman La,Goring Dr。花粉雌蕊相互作用调节碳粉术中的成功施肥。J Exp Bot。2010; 61(7):1987-99。doi:10.1093 / JXB / ERQ021.
- 14。
高山华。植物的自交不亲和。植物学报。2005;56(1):467-89。doi:10.1146 / annurev.arplant.56.032604.144249.
- 15.
等。泛素-蛋白酶体介导的S-RNase在茄科交叉相容性反应中的降解。植物J 2014; 78(6): 1014 - 1021。doi:10.1111 / TPJ.12528.
- 16.
Kao Th,Tsukamoto t。基于S-RNase的自相相同的分子和遗传基因。植物细胞。2004; 16(SUP):S72-83。doi:10.1105 / tpc.016154.
- 17.
王志强,王志强,王志强,等。花粉-雌蕊相互作用的物种特异性。中国科学(d辑:地球科学)2004;doi:10.1146 / annurev.genet.38.072902.092356.
- 18.
王宁,王志强,王志强,等。基于s - rnase的自不相容协同非自识别系统。科学。2010;330(6005):796 - 9。doi:10.1126 / science.1195243.
- 19.
王雪梅,王永强,王永强,等。s - rnase介导的自交不亲和花粉决定因素的鉴定。大自然。2004;429(6989):302 - 5。doi:10.1038 / nature02523.
- 20.
王宁,高涛。矮牡丹的自交不亲和:利用S-locus F-box蛋白和S-RNase防止近交系的自/非自识别机制。中国生物医学工程学报。2012;1(2):267-75。doi:10.1002 / wdev.10.
- 21.
李胜,孙鹏,高涛。中s - rnase的自不亲和性佩妮:最近的发现和未来的方向。植物科学学报2015;6:41。doi:10.3389 / fpls.2015.00041.
- 22.
汉考克CN,肯特L,麦克卢尔文学士花柱120kda糖蛋白是s特异花粉排斥反应所必需的烟草.43植物j . 2005;(5): 716 - 23所示。doi:10.1111 / j.1365 - 313 x.2005.02490.x.
- 23.
一种小的富含天冬酰胺的蛋白质,用于S等位基因特异性的花粉排斥烟草.Proc Natl Acad Sci U S A. 1999; 96(23):13548-53。doi:10.1073 / pnas.96.23.13548.
- 24.
o'brien m,Kapfer C,主要g,laurin m,bertrand c,Kondo k等人。智能宫的分子分析表达茄属植物chacoense与HT修饰配子体自交不亲和相关的富天冬酰胺小蛋白家族烟草.植物j . 2002; 32(6): 985 - 96。
- 25.
华Z.Kao T-h。推定组件的识别与表征佩妮包含S-locus f- box的E3连接酶复合物参与s - rnase基自交不亲和。植物细胞。2006;18(10):2531 - 53。doi:10.1105 / TPC.106.041061.
- 26。
李W,恰特拉特特室温。一种在番茄中连接鞘内花粉排斥的花粉因子。科学。2010; 330(6012):1827-30。doi:10.1126 / science.1197908.
- 27。
Li W W, Chetelat RT. Cullin1蛋白在配子体自交不亲和中的作用茄属植物.遗传学。2014;196(2):439 - 42。doi:10.1534 / genetics.113.158279.
- 28。
李W,恰特拉特特室温。单侧不相容性基因UI1.1编码在花粉中表达的S-LOCUS F箱蛋白茄属植物物种。中国科学院院刊2015;112(14):4417-22。doi:10.1073 / pnas.1423301112.
- 29。
乔辉,王海英,赵玲,周建林,黄杰,张永生,等。在兼容授粉过程中,F-box蛋白AhSLF-S-2与可能被泛素/26S蛋白酶体抑制的S-RNases发生物理作用金鱼草属植物.植物细胞。2004;16(3):582 - 95。doi:10.1105 / tpc.017673.
- 30.
Bernacchi D, Tanksley SD。种间回交Lycopersicon esculentumXl .分子:连锁分析及性亲和性因子和花部性状的QTL研究。遗传学。1997;147(2):861 - 77。
- 31.
陈志强,陈志强,陈志强,等。区分番茄分枝中单侧不协调和自交不亲和的多重特征。植物j . 2010; 64(3): 367 - 78。doi:10.1111 / J.1365-313x.2010.04340.x.
- 32.
Murfett J, Strabala TJ, Zurek DM, Mou BQ, Beecher B, McClure B. S-RNase与属间花粉排斥烟草:多种花粉排斥途径导致自交不亲和种之间的单侧不亲和。植物细胞。1996;8(6):943 - 58。
- 33.
Tovar-Mendez A, Kumar A, Kondo K, Ashford A, Baek YS, Welch L, et al.;修复雌蕊侧自交不亲和因子再现了番茄种间的种间生殖屏障。植物j . 2014; 77(5): 727 - 36。doi:10.1111 / tpj.12424.
- 34.
Liedl BE, McCormick S, Mutschler MA。涉及的交叉的单侧不协调Lycopersicon pennellii和L. Esculentum.与自交不亲和在表达、时间和位置上是不同的。植物生殖学报1996;9:299-308。
- 35。
马丁·弗兰克-威廉姆斯。复杂单侧杂交Lycopersicon分子.中国科学(d辑:地球科学)(英文版);doi:10.1073 / pnas.47.6.855.
- 36。
不相容与不协调:亲密伴侣关系不正常的两种不同机制。中国生物科学(英文版),1975;188(1092):361-75。doi:10.1098 / RSPB.1975.0025.
- 37。
王志强,王志强,王志强,等。花粉-雌蕊相互作用及其对雌蕊选择的影响。植物杂志。2017;173(1):79 - 90。http://dx.doi.org/10.1104/pp.16.01286.
- 38。
beindinger PA, Chetelat RT, McClure B, Moyle LC, Rose JKC, Stack SM等。番茄进化枝的种间生殖屏障:解读生殖隔离机制的机会。植物生殖学报。2011;24(3):171-87。doi:10.1007 / s00497 - 010 - 0155 - 7.
- 39。
古老的多态性揭示了育种系统的单向转移。中国科学院院刊2006;103(5):1359-63。doi:10.1073 / pnas.0506283103.
- 40.
IGIC B,KOHN JR。植物交配系统的分布:迫害偏向物种的偏见。进化。2006; 60(5):1098-103。doi:10.1554 / 05 - 383.1.
- 41.
Pease JB, Haak DC, Hahn MW, ML C.系统基因组学揭示了快速辐射中适应性变异的三个来源。公共科学图书馆杂志。2016;14 (2):e1002379。doi:10.1371 / journal.pbio.1002379..
- 42.
Peralta I,Spooner M,Knapp S.野生西红柿和亲属的分类学(茄属植物教派。Lycopersicoides.,教派。Juglandifolia,教派。Lycopersicon).Syst Bot monor . 2008;84
- 43.
瑞克cm。生物系统研究Lycopersicon和紧密相关的物种茄属植物.在:Hawkes JG, Lester RN, Skelding AD,编辑。茄科植物的生物学与分类,专题讨论会第2期。7:林奈Soc;1979.
- 44.
瑞克cm。生殖隔离Lycopersicon Peruvianum.复杂。出自:D’arcy WG,编辑。Solanaceae.,生物学和系统性。纽约:哥伦比亚大学出版社;1986. p。477-95。
- 45.
Rick CM, forbes JF, Tanksley SD。交配系统的进化Lycopersicon分子从电泳和形态特征的遗传变异中推断出。植物系统中的Evol。1979年; 132(4):279-98。doi:10.1007 / bf00982390.
- 46.
等。洞见自交亲和性的进化Lycopersicon通过对风格因素的研究。植物j . 2002; 30(2): 143 - 53年。doi:10.1046 / J.1365-313x.2002.01275.x.
- 47.
张志强,张志强,张志强,等茄属植物habrochaites在其自然的分布区域。遗传资源作物evol。2011; 58(3):347-60。doi:10.1007 / s10722 - 010 - 9578 - 0.
- 48.
陈志强,李志强。种间交叉屏障的研究进展Lycopersicon以及它们与自我不相容的关系。In: Williams E,编辑。开花植物自交不亲和与生殖发育的遗传控制。荷兰:Klewer学术;1994.p . 164 - 88。
- 49.
Sacks EJ,St Clair Da。七种基因型之间的变异Lycopersicon esculentum36份l .分子种间crossability。Euphytica。1998;101(2):185 - 91。doi:10.1023 /: 1018376806570.
- 50.
Beecher B,Zurek D,McClure B. RNases对来自花粉排斥的影响烟草和N.甲骨悚然.植物生殖学报。2001;14(1-2):69-76。doi:10.1007 / s004970100078.
- 51.
Becker JD, Boavida LC, Carneiro J, Haury M, Feijó JA。的转录分析拟南芥组织揭示了花粉转录组的独特特征。植物杂志。2003;133(2):713 - 25所示。doi:10.1104 / pp.103.028241.
- 52.
Boavida LC, Borges F, Becker JD, Feijo JA。基因表达的全基因组分析揭示了花粉-雌蕊相互作用过程中信号通路和代谢途径的协同激活拟南芥.植物杂志。2011;155(4):2066 - 80。doi:10.1104 / pp.110.169813.
- 53。
D.比较分析拟南芥花粉转录组。植物杂志。2003;132(2):640 - 52。doi:10.1104 / pp.103.020925.
- 54。
秦玉峰,王志强,王志强,等。柱头和花柱的渗透在花粉管中引出一个新的转录组,指向对雌蕊生长至关重要的基因。公共科学图书馆麝猫。2009;5 (8):e1000621。doi:10.1371 / journal.pgen.1000621.
- 55.
皮斯-杰比,格雷罗- RF,谢尔曼- NA,哈恩- MW,莫伊尔- LC。通过转录组分析揭示交配后合子前生殖分离的分子机制。摩尔生态。2016;25(11):2592 - 608。doi:10.1111 / mec.13679.
- 56.
Yoo Ks,OK Sh,Jeong Bc,Jung Kw,Cui Mh,Hyoung S等人。单胱硫脲β-合成酶域蛋白质通过调节硫氧吡嗪系统调节发育拟南芥.植物细胞。2011;23(10):3577 - 94。doi:10.1105 / tpc.111.089847.
- 57.
钟旭东,刘志强,冯胜,等。DDR复合物促进RNA聚合酶V与启动子和进化年轻转座子的全球关联。中国生物医学工程学报。2012;19(9):870-5。doi:10.1038 / nsmb.2354.
- 58.
Jimenez-Quesada MJ, Traverso JA, Alche JD。植物生殖组织中NADPH氧化酶依赖的超氧化物产生。植物科学学报2016;7:359。doi:10.3389 / FPLS.2016.00359.
- 59。
Nibau C, Wu HM,张AY。RAC/ROP GTPases:植物信号整合和多样化的“枢纽”。植物科学进展。2006;11(6):309-15。doi:10.1016 / j.tplants.2006.04.003.
- 60.
Potocky M,Jones Ma,Bezvoda R,Smirnoff N,Zarsky V. NADPH氧化酶产生的反应性氧物种参与花粉管生长。新植物。2007年; 174(4):742-51。doi:10.1111 / j.1469-8137.2007.02042.x.
- 61.
陈志强,陈志强,陈志强,等。花粉管中NADPH氧化酶活性受钙离子、信号磷脂和Rac/Rop GTPases的影响。acta botanica yunnanica(云南植物研究),2012;doi:10.1016 / j.jplph.2012.05.014.
- 62.
王志强,王志强,王志强,等。钙离子对花粉萌发和花粉管生长的影响。Acta botanica yunnanica(云南植物研究),2013;doi:10.1016 / j.bbamcr.2012.10.009.
- 63.
王C-L,Wu J,Xu G-H,GAO Y-B,Chen G,Wu J-Y等。S-RNase D持次尖端局部反应性氧物质,并在不相容的花粉管中诱导核DNA降解Pyrus pyrifolia.中国细胞科学(英文版);
- 64.
Bosch M, Franklin-Tong VE。Self-incompatibility在罂粟:在不亲和花粉中触发PCR的信号。J Exp Bot. 2008; 59:481-90。
- 65.
珠孔花粉管引导和爆裂:适应防御机制?植物学报。2009;12(6):773-80。http://dx.doi.org/10.1016/j.pbi.2009.09.015
- 66.
墨菲e,de smet i.了解Ralf家族:许多物种的故事。趋势植物SCI。2014; 19(10):664-71。http://dx.doi.org/10.1016/j.tplants.2014.06.005
- 67.
Covey PA, Subbaiah CC, Parsons RL, Pearce G, Lay FT, Anderson MA等。一种来自番茄的花粉特异的RALF,调节花粉管伸长。植物杂志。2010;153(2):703 - 15所示。doi:10.1104 / pp.110.155457.
- 68.
Jimenez-Duran K, McClure B, Garcia-Campusano F, Rodriguez-Sotres R, Cisneros J, Busot G, et al.;NaStEP:一种自交不亲和必需的蛋白酶抑制剂,同时也是HT-B稳定性的正调节因子烟草alata花粉管。植物杂志。2013;161(1):97 - 107。doi:10.1104 / pp.112.198440.
- 69.
Coimbra S, Costa M, Jones B, Mendes MA, Pereira LG。花粉粒发育受阻拟南芥Agp6 agp11 null突变体。中国农业科学。2009;60(11):3133-42。doi:10.1093 / jxb / erp148.
- 70.
阿拉伯半乳聚糖蛋白:植物生物学家日益关注。植物天线转换开关。2015;28(1):1 - 15。doi:10.1007 / s00497 - 015 - 0254 - 6.
- 71.
阿拉伯半乳糖蛋白:细胞表面的关键调控因子?植物杂志。2010;153:403-19。
- 72.
张AY, Wang H, Wu H-m。一种花的传递组织特异性糖蛋白吸引花粉管并刺激其生长。细胞。1995;82(3):383 - 393。doi:http://dx.doi.org/10.1016/0092-8674(95)90427-1.
- 73.
吴慧敏,黄娥,奥格达尔J,张AY。一种花粉管生长促进阿拉伯半乳聚糖蛋白烟草alata类似于烟草的TTS蛋白。植物j . 2000; 22(2): 165 - 76。
- 74.
Chen CY,张AY, Wu HM。肌动蛋白解聚因子介导Rac/Rop gtpase调控花粉管生长。植物细胞。2003;15(1):237 - 49。
- 75.
De Graf Bhj,Cheung Ay,Andreyeva T,Levasseur K,Kieliszewski M. Wu H-M。Rab11 GTPase-Curmuply膜贩运对于烟草聚焦的花粉管生长至关重要。植物细胞。2005; 17(9):2564-79。doi:10.1105 / TPC.105.033183.
- 76.
张颖,赵志军,薛玉英。蛋白质水解在植物自交不亲和中的作用。Ann Rev Plant Biol. 2009; 60:21-42。doi:10.1146 / annurev.arplant.043008.092108.
- 77。
张D,WENGIER D,Shuai B,GUI CP,Muschietti J,McCormick S等人。花粉受体激酶Leprk2介导生长促进信号,并积极调节花粉萌发和管生长。植物理性。2008; 148(3):1368-79。doi:10.1104 / pp.108.124420.
- 78。
Kanaoka mm,Higashiyama T.花粉管引导中的肽信号传导。CurrOp植物BIOL。2015; 28:127-36。doi:10.1016 / j.pbi.2015.10.006.
- 79.
关键词:花粉管,花粉管,诱导剂,诱导剂拟南芥.大自然。2016;531(7593):245 - 8。doi:10.1038 / Nature17413.
- 80.
王t,梁l,薛y,jia pf,chen w,张mx等。受体异构体介导植物中女性引诱剂的男性感知。自然。2016; 531(7593):241-4。doi:10.1038 / nature16975.
- 81.
陈W.表达谱矩阵拟南芥转录因子基因表明其假定的功能是响应环境压力。植物细胞。2002;14(3):559 - 74。doi:10.1105 / tpc.010410.
- 82。
王志强,王志强,王志强,等。NAC转录因子在植物生物和非生物胁迫响应中的作用。Microbiol前面。2013;4:248。doi:10.3389 / FMICB.2013.00248.
- 83。
崔颖,凌云,周军,李晓霞。组蛋白去乙酰化酶干扰对花粉管萌发和生长的影响云杉wilsonii桅杆上。《公共科学图书馆•综合》。2015;10 (12):e0145661。doi:10.1371 / journal.pone.0145661.
- 84。
程华,秦磊,李胜,傅旭东,曹东,等。赤霉素调控拟南芥通过抑制DELLA蛋白功能来调控花的发育。发展。2004;131(5):1055 - 64。doi:10.1242 / dev.00992.
- 85.
Mittler R,Vanderauwera S,Suzuki N,Miller G,Tognetti VB,Vandepoele K,等。ROS信号:新浪潮?趋势植物SCI。2011; 16(6):300-9。doi:10.1016 / j.tplants.2011.03.007.
- 86.
植物的氧化应激机制:从经典化学到细胞生物学。Environ Exp Bot. 2015; 109:212-28。doi:10.1016 / j.envexpbot.2014.06.021.
- 87.
花粉管NAD(P)H氧化酶在极化细胞生长过程中具有抑制生长速率振荡的作用。植物j . 2014; 78(1): 94 - 106。doi:10.1111 / tpj.12452.
- 88.
Wilkins Ka,Bancroft J,Bosch M,Ensing J,Smirnoff N,Franklin-Tong Ve。反应性氧物种和一氧化氮在自我不相容响应中介导肌动蛋白重组和编程细胞死亡罂粟.植物杂志。2011;156(1):404 - 16。doi:10.1104 / pp.110.167510.
- 89.
活性氧和一氧化氮在自交不亲和相关的程序性细胞死亡中的作用。J Exp Bot. 2015; 66:2869-7。
- 90.
江X,高y,周H,陈继,吴j,张某培养钙调蛋白通过增强钙流入和反应性氧物种浓度来促进自我不相容的花粉管生长Pyrus pyrifolia.植物细胞代表2014;33:255-63。
- 91.
Carraro L,Gerola PD,Lombardo G,Gerola FM。过氧化物酶活性和配子蛋白的不相容性:芽授授粉佩妮矮牵牛.Caryologia。1989;42(3 - 4):225 - 34。doi:10.1080 / 00087114.1989.10796969.
- 92.
朱家,吴X,元S,钱D,南Q,朗,等。annexin5在它中发挥着重要作用拟南芥通过CA2 +依赖膜贩运花粉开发。Plos一个。2014; 9(7):E102407。doi:10.1371 / journal.pone.0102407.
- 93.
Swarbreck SM, Colaco R, Davies JM。植物calcium-permeable频道。植物杂志。2013;163(2):514 - 22所示。doi:10.1104 / pp.113.220855.
- 94.
黄海林,林志强,黄志强,等。Rac GTPase结合水稻NADPH氧化酶的n端延伸调控。植物细胞。2007;19(12):4022 - 34。doi:10.1105 / tpc.107.055624.
- 95.
rabb GTPase RabA4d调控花粉管顶端生长拟南芥.植物细胞。2009; 21(2):526-44。doi:10.1105 / tpc.108.060277.
- 96.
活性氧在植物细胞壁代谢和发育中的作用。植物化学。2015;112:22-32。doi:10.1016 / j.phytochem.2014.09.016.
- 97.
安德森CT。我们在干扰:最新的果胶生物合成,贩运和动态。中国生物医学工程学报。2016;67(2):495-502。doi:10.1093 / jxb / erv501.
- 98.
chabli Y, Kaneda M, Zerzour R, Geitmann a拟南芥花粉管-多糖的空间分布、循环和网络形成。植物杂志。2012;160(4):1940 - 55。doi:10.1104 / pp.112.199729.
- 99.
Mollet J-C,Leroux C,Dardelle F,Lehner A.细胞壁组成,生物合成和花粉管生长过程中的重塑。植物。2013; 2(1):107-47。doi:10.3390 / plants2010107.
- One hundred.
张志强,张志强,张志强,等。自交亲和种间杂种自交和杂交不亲和性的遗传和超微结构分析Lycopersicum esulentum和宗l . peruvianum.Theor Appl Genet. 1974; 44:278-88。
- 101。
重金属相关的异戊二烯基植物蛋白(HIPP):植物特有的一个蛋白家族的特征。2月j . 2013; 280(7): 1604 - 16。
- 102。
黄志强,李志强,李志强,等。一种基于生物信息学的富羟脯氨酸糖蛋白鉴定、分类和分析方法。植物杂志。2010;153:485 - 513。
- 103。
杰斯勋爵耶和华。植物和阿拉伯半乳蛋白的定位在百合(百合longiflorum花粉管和花柱及其在传粉中的可能作用。足底。1995;199:251 - 61。
- 104.
加州大学戴维斯分校夹住。C. M. Rick番茄遗传资源中心。加州戴维斯。2016。http://tgrc.ucdavis.edu.Accessed Aug 16 2016。
- 105.
Rasband WS。美国国家卫生研究院。贝塞斯达。1997 - 2016。http://imagej.nih.gov/ij/.
- 106.
布法罗V.镰刀,一种贝叶斯适配器修剪器。2011 - 2014。https://github.com/vsbuffalo/scythe..2016.
- 107.
Dobin A,Davis Ca,Schlesinger F,Drenkow J,Zaleski C,JHA S等人。星:超快通用RNA-SEQ对齐器。生物信息学。2013; 29(1):15-21。doi:10.1093 / Bioinformatics / BTS635.
- 108.
Fernandez-Pozo N,Menda N,Edwards Jd,Saha S,Tecle Iy,Strickler SR等。溶胶基因组学网络(SGN) - 从基因型到繁殖的表型。核酸RES。2015; 43:D1036-D41。
- 109.
廖勇,史伟。一种高效的基因组特征赋值通用程序。生物信息学。2014;30(7):923 - 30。doi:10.1093 /生物信息学/ btt656.
- 110.
NCBI的信息。基本的局部对齐搜索工具。2016.https://blast.ncbi.nlm.nih.gov/blast.cgi..访问日期:2016年10月10日
- 111.
罗春华,陈勇,史伟,史文华。Voom:精确权重解锁线性模型分析工具的RNA-seq读取计数。基因组医学杂志。2014;15 (2):R29。doi:10.1186 / gb - 2014 - 15 - 2 - r29.
- 112.
Smyth GK。Limma:微阵列数据的线性模型。使用R和Biocumons的生物信息学和计算生物学解决方案。纽约:斯普林克;2005. p。397-420。
- 113.
罗宾逊医学博士,麦卡锡DJ,史密斯GK。edgeR: Bioconductor包,用于数字基因表达数据的差异表达分析。生物信息学,2010,26(1):139 - 40。doi:10.1093 /生物信息学/ btp616.
- 114.
R核心团队。统计计算的语言和环境。维也纳:统计计算基础;2015.
致谢
作者感谢Charles M. Rick番茄遗传资源中心提供的种子,J. Pease, M. Wu和L. Moyle提供的分析帮助,A. Ashford提供的植物护理,O. Todd, T. Randall和A. Martin帮助合成显微图像。从国家科学基金会的植物基因组研究计划中授予号码DBI-0605200和MCB-1127059得到了这项工作。
资金
从国家科学基金会的植物基因组研究计划中授予号码DBI-0605200和MCB-1127059得到了这项工作。
数据和材料的可用性
在当前的研究中生成和分析的数据集可在NCBI SRA(国家生物技术信息中心序列阅读档案)数据库获得,(BioProject PRJNA310635 athttps://www.ncbi.nlm.nih.gov/bioproject/310635).
作者的贡献
AB进行了RNA提取,分析和解释了数据,并将手稿写着来自所有作者的编辑贡献。RG进行了所有生物染色实验并分析了数据。AR设计并进行了交叉实验和收集的组织。YB进行过横穿实验并收集组织。MH设计实验,监督生物信息学实验并辅助数据分析。PB构思和设计实验,收集组织和解释数据。所有作者均阅读并批准了手稿。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
同意出版
不适用。
伦理批准和同意参与
不适用。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
作者信息
从属关系
相应的作者
附加文件
额外的文件1:
此Excel文件包含与稿件相关联的所有其他表(表S1-TABLE S10)。每个表都在不同的选项卡中。表编号和标题如下所示:表S1。在LA1777自花和未授粉(UP)花柱的两两比较中显示差异调节的基因。表S2。在LA1777授粉和未授粉(UP)群体内花柱的两两比较中显示差异调控的基因。表S3.在LA1777群体间(LA0407)授粉和未授粉(UP)花柱的两两比较中显示差异调控的基因。表S4。LA1777与LA0407的基因表达均显著上调。表S5。LA1777基因与LA0407基因均显著下调。表S6。一个先验候选基因在LA1777和LA0407类型中的表达模式表S7。La1777对La0407的花粉中所有显着上调基因。表S8。与LA0407相比,LA1777花粉中所有基因均显著下调。表S9。一个先验候选基因在LA1777和LA0407花粉中的表达模式表S10。茄属植物habrochaites用于创建RNA-SEQ库的样本。(XLSX 140 KB)
附加文件2:
该PDF包含与稿件相关联的所有附加材料(图S1,图S2和方法S1)。下面列出了图/方法编号和标题。图S1。两种群体的曲目中的基因组宽模式茄属植物habrochaites.图S2。假设蛋白的序列比对显示,在具有ui能力的组织和ui受损的组织中,变化幅度最大。方法S1全命令和参数用于剪切的生物信息学分析茄属植物habrochaites转录组。(多克斯52 kb)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
布罗兹,a.k.,格雷罗,r.f.,兰德尔,A.M.et al。转录组分析将基因表达与单侧花粉-雌蕊生殖障碍联系起来。BMC植物BIOL.17,81(2017)。https://doi.org/10.1186/s12870-017-1032-4
收到了:
接受:
发表:
关键字
- 间隙的生殖障碍
- 口腔互动
- 植物交配系统
- 花粉雌蕊转录om
- Self-incompatibility
- 茄属植物habrochaites
- 单方面的不相容
- 野生番茄种质资源