- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
在吸收休眠和成熟的种子的吸收过程中差异表达基因 - 反向遗传方法gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba17gydF4y2Ba, 文章编号:gydF4y2Ba151.gydF4y2Ba(gydF4y2Ba2017年gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
种子休眠是自然界和农业中一个重要的特性,是指一颗有活力的种子在有利条件下无法发芽。尽管对休眠和萌发有广泛的研究,但这些性状的分子控制机制仍然存在许多问题,这可能是由于这些数量性状的遗传复杂性和巨大的环境效应。为了进一步揭示控制种子休眠和萌发的机制,我们需要鉴定控制这些性状的基因。gydF4y2Ba
方法gydF4y2Ba
我们使用转录组分析结合反向遗传学方法鉴定了在被吸收的种子中对休眠维持和萌发起重要作用的基因gydF4y2Ba拟南芥gydF4y2Ba.在新鲜收获(休眠)和成熟的(AR;非休眠)24-H后的种子中使用比较转录组织分析。四种不同的种子gydF4y2Ba延迟发芽gydF4y2Ba靠近同种型线条(gydF4y2Ba狗gydF4y2BaNILs)和LandsberggydF4y2Baerecta.gydF4y2Ba(L.gydF4y2Ba呃gydF4y2Ba)野生型,具有不同水平的主要休眠。鉴定基因的T-DNA敲除线对其对休眠和AR的影响进行了表型研究。gydF4y2Ba
结果gydF4y2Ba
我们确定了46和25种基因的保守组,其在所有休眠种子的种子中显示出更高的表达,并在成熟后gydF4y2Ba狗gydF4y2Ba尼尔斯和LgydF4y2Ba呃gydF4y2Ba, 分别。这些基因中的敲除突变体显示出休眠和发芽相关表型。gydF4y2Ba
结论gydF4y2Ba
大多数已鉴定的基因没有涉及种子休眠或萌发。该研究将有助于进一步破译这些重要生态和商业特征的分子机制。gydF4y2Ba
背景gydF4y2Ba
新鲜成熟的种子通常表现出初级休眠,这一特性被定义为有活力的种子在有利条件下无法发芽[gydF4y2Ba8gydF4y2Ba].种子休眠在植物物种的存活中发挥着至关重要的作用,但对于农业实践而言也很重要,以防止在阴凉,高湿度条件下进行收获预先发芽[gydF4y2Ba24gydF4y2Ba].初级休眠可以通过冷分层(即对浸渍的种子进行低温处理)或延长种子的干燥贮藏期(成熟后;基于“增大化现实”技术)[gydF4y2Ba9gydF4y2Ba].gydF4y2Ba
从休眠到萌发的过渡是植物生命周期的关键步骤[gydF4y2Ba25gydF4y2Ba].植物激素脱落酸(ABA)长期以来一直扮演着重要角色在建立和维护种子休眠和种子萌发的抑制作用,而赤霉素(气)和其他一些激素,包括brassinosteroids、乙烯、细胞分裂素,可以促进种子萌发(gydF4y2Ba38.gydF4y2Ba].然而,正是ABA和GA之间的平衡决定了发芽与否[gydF4y2Ba19gydF4y2Ba].调节ABA水平或 - 敏感度的基因的突变导致种子休眠程度降低[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].虽然Ga生物合成或传感突变体导致萌发块[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba33gydF4y2Ba].这种激素控制还与种子对环境条件(如光照)的反应结合在一起[gydF4y2Ba45.gydF4y2Ba], 温度 [gydF4y2Ba55.gydF4y2Ba,gydF4y2Ba60.gydF4y2Ba]和营养素[gydF4y2Ba40.gydF4y2Ba].gydF4y2Ba
利用微阵列进行基因表达分析的最新进展使全基因组表达研究能够表征种子休眠和萌发[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba36.gydF4y2Ba,gydF4y2Ba41.gydF4y2Ba,gydF4y2Ba52.gydF4y2Ba].Carrera等人。[gydF4y2Ba12gydF4y2Ba]在吸收的非休眠突变体中使用了目标转录组学方法(gydF4y2Baaba1gydF4y2Ba和gydF4y2BaAbi1.gydF4y2Ba)与未成熟或未成熟的野生型种子相比。他们得出的结论是,在拟南芥中,催熟和休眠是由不同的遗传途径控制的,ABA只影响被吸收的种子的休眠诱导和维持,而不影响催熟。研究还表明,外源ABA对成熟后种子的表达谱并不能模拟休眠种子状态。最近研究表明,种子在吸收状态下的休眠维持主要受转录水平的控制[gydF4y2Ba3.gydF4y2Ba而休眠种子和非休眠种子之间的转录差异在早期吸胀时就已经可见[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba48.gydF4y2Ba].gydF4y2Ba
尽管对休眠和萌发有广泛的研究,但这些性状的分子控制机制仍然存在许多问题,这可能是由于这些数量性状的遗传复杂性和巨大的环境效应。采用全基因组定量性状位点(QTL)扫描是鉴定复杂表型相关基因的常用方法。这种方法特别重视自然变异在调节与植物适应有关的性状中的作用。自然变异已被用来鉴定自然界中控制种子休眠的基因座。对6个重组自交系(RIL)群体进行QTL分析,鉴定出11个群体gydF4y2Ba延迟发芽gydF4y2Ba(gydF4y2Ba狗gydF4y2Ba)QTL,其中九条近的等源性线(NIL)确认。不同gydF4y2Ba狗gydF4y2Ba基因座主要通过QTL分析的缺乏强烈的认证相互作用所结论的明显遗传途径影响休眠。该发现是通过在主要收获的干燥种子中的转录组分析证实了gydF4y2Ba狗gydF4y2Ba与它们的遗传背景Landsberg相比,这些细胞系表现出不同的表达模式gydF4y2Baerecta.gydF4y2Ba(L.gydF4y2Ba呃gydF4y2Ba).基因在不同的gydF4y2Ba狗gydF4y2BaNILs代表截然不同的基因本体论资料[gydF4y2Ba6gydF4y2Ba].gydF4y2Ba
在这里,我们的目的是识别休眠维持所需的基因,并且对吸收的种子的萌发。此外,我们专注于不同途径之间的共同点。对于这种新鲜收获(休眠)和成熟(AR;非休眠)24-H的转录组合的同一组的种子gydF4y2Ba狗gydF4y2Ba尼尔斯和LgydF4y2Ba呃gydF4y2Ba调查了。我们已经确定了46个和25个基因,这些基因在所有休眠(D-Up)的种子中上调,所有的成熟(Ar-Up)gydF4y2Ba狗gydF4y2Ba尼尔斯和LgydF4y2Ba呃gydF4y2Ba, 分别。通过分析这些基因中的敲除(KO)突变体,我们研究了种子性能中的作用。随着种子性能,我们指的是在各种环境条件下种子发芽的能力。有助于种子性能的特质是种子休眠,种子寿命(如在加速的老化试验中估计)和胁迫条件下的萌发,如高盐,渗透胁迫和ABA治疗[gydF4y2Ba32gydF4y2Ba].在这项研究中,我们已经鉴定了几个影响种子性能的基因。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
四个近的四分之二gydF4y2Ba延迟发芽gydF4y2Ba(gydF4y2Ba狗gydF4y2Ba)基因座;gydF4y2Banordog1.gydF4y2Ba-cvi,gydF4y2Banildog2.gydF4y2Ba-cvi,gydF4y2Banildog3.gydF4y2Ba-Cvi和gydF4y2Banildog6.gydF4y2Ba-Kas-2和兰茨贝格gydF4y2Baerecta.gydF4y2Ba(L.gydF4y2Ba呃gydF4y2Ba)较早时由Bentsink等人描述[gydF4y2Ba6gydF4y2Ba].尽管对于一些gydF4y2Ba狗gydF4y2Ba有几个含有来自不同accessions的旋气碎片的轨迹几个含量,我们选择了具有最强的表型效果的那些。T-DNA插入突变线和哥伦比亚-0(COL-0; N60000)从欧洲拟南芥股票中心(NASC,gydF4y2Bawww.arabidopsis.infogydF4y2Ba).在附加文件中提供T-DNA系线的详细信息(Salk / Sail进入,AGI代码,敲除号和编码蛋白)gydF4y2Ba1gydF4y2BaS1:表。gydF4y2Ba
生长条件gydF4y2Ba
NILS:种子在水饱和滤纸上播种在培养皿上,然后在4℃下进行4天的冷处理,并在25℃下转移到适应室,16小时/ 8小时黑暗2天用标准土壤种植7厘米的锅。植物在70%相对湿度下的空调温室中生长,补充有额外的灯光(型号Son-T加400 W,飞利浦,埃因霍温,荷兰),提供每天16小时的光(漫长的一天),有光线强度125 mmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba,温度维持在22-25°C(白天)和18°C(晚上)。NILs采用随机完全区组设计,共8个重复。试验田由一排12株植物组成。收割时,八棵植物的种子发芽了。8个重复中的3个用于微阵列分析。gydF4y2Ba
T-DNA敲除线:筛选纯合的插入线,并在使用岩羊的温室条件下使用补充有脱钙溶液的温室条件,在随机完整块设计中,每种基因型四重复。gydF4y2Ba
微阵列分析的样品制备gydF4y2Ba
休眠种子在22°C连续光照下吸收24 h,然后在−80°C下保存至RNA分离。在萌发实验中,当种子萌发率达到100%时,将成熟后的种子在与休眠种子相同的条件下吸吸24 h,并在−80℃下保存至RNA分离。gydF4y2Ba
微阵列分析gydF4y2Ba
根据制造商的协议,使用具有植物RNA分离助剂(Ambion,Austin,TX,USA)的RNAWNY水柱,由24-H中吸收的种子制备总RNA。通过用异丙醇和含有0.24M柠檬酸钠和0.16μm氯化钠的高盐溶液进一步纯化RNA,随后用2M氯化锂。使用RNA 6000纳米Labchip®套件(Agilent,Santa Clara Ca,USA)和Nanodrop1000™光谱(Nanodrop Technologies,Inc.,Wilmington,De,USA)使用Agilent 2100 BioAnalyzer定性评估和定量RNA定性评估和定量。加工RNA和根据3'GeneChips oneCycle试剂盒合成的CRNA,并在Ath1 Genechip上杂交(Affymetrix Inc.,Santa Clara,CA,USA)。使用R统计编程环境和生物导体包进行分析GeneChip数据[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba51.gydF4y2Ba,gydF4y2Ba54.gydF4y2Ba].采用RMA算法对数据进行归一化,并对数据进行线性拟合,以比较各基因型内休眠种子和成熟后种子的差异,采用经验贝叶斯方法减小基因的样本方差[gydF4y2Ba49.gydF4y2Ba].的gydF4y2BaPgydF4y2Ba然后调整值,以便使用Benjamini和Hochberg方法进行多次测试,以控制误报[gydF4y2Ba5gydF4y2Ba].微阵列数据保存在NCBI基因表达集(GEO号GSE90162)中。微阵列质量和重现性数据在附加文件中gydF4y2Ba2gydF4y2Ba:图S1。休眠上调基因(up-regulated genes)表示上调基因(gydF4y2BaPgydF4y2Ba> 0.0001)在下列比较中,LgydF4y2Ba呃gydF4y2Ba休眠和LgydF4y2Ba呃gydF4y2Baafter-ripened,零gydF4y2BaDOG1gydF4y2Ba休眠和零gydF4y2BaDOG1gydF4y2Baafter-ripened,零gydF4y2BaDOG2gydF4y2Ba休眠和零gydF4y2BaDOG2gydF4y2Baafter-ripened,零gydF4y2BaDOG3gydF4y2Ba休眠和零gydF4y2BaDOG3gydF4y2Baafter-ripened,零gydF4y2BaDOG6gydF4y2Ba休眠和零gydF4y2BaDOG6gydF4y2Ba成熟的,反之亦然后逐升调节基因(AR-UP)在以下比较中表示上调(P> 0.0001)的基因gydF4y2Ba呃gydF4y2Ba成熟的vs lgydF4y2Ba呃gydF4y2Ba休眠,零gydF4y2BaDOG1gydF4y2Baafter-ripened vs零gydF4y2BaDOG1gydF4y2Ba休眠,零gydF4y2BaDOG2gydF4y2Baafter-ripened vs零gydF4y2BaDOG2gydF4y2Ba休眠,零gydF4y2BaDOG3gydF4y2Baafter-ripened vs零gydF4y2BaDOG3gydF4y2Ba休眠,零gydF4y2BaDOG6gydF4y2Baafter-ripened vs零gydF4y2BaDOG6gydF4y2Ba休眠状态。gydF4y2Ba
T-DNA敲除基因型分析gydF4y2Ba
改进自[的快速分离方法gydF4y2Ba13gydF4y2Ba进行了从叶子中提取基因组DNA。简而言之,在含有2M NaCl,200mM Tris-HCl(pH8),70mM EDTA和20mM Na 2 O 5的萃取缓冲液中研磨样品。研磨在30 Hz的不锈钢球中进行1分钟(96孔板振荡器,Mo Bio实验室)。然后将样品在65℃下温育1小时。以最大速度离心10分钟后收集上清液。通过在上清液中加入二丙醇和10μmnH4Ac来沉淀DNA,其比例为1:1/2:1。将该混合物在室温下孵育至少15分钟,然后以最大速度离心20分钟。检索DNA粒料并用70%乙醇冲洗,然后以最大速度离心5分钟以回收颗粒。干燥后,将DNA沉淀溶于蒸馏水中。用基因特异性引物(左右)和插入边界引物(附加文件)筛选纯合T-DNA插入线(附加文件gydF4y2Ba1gydF4y2Ba:表S1)。只扩增插入产物的T-DNA植物被认为是纯合突变体。gydF4y2Ba
聚合酶链反应(PCR)在含有约30ng的DNA的12.5μl-体积,每个DNTP的25μm,25ng前向和反向引物中,0.05u U的DNA聚合酶(Firepol,Solis Biodyne),312.5μm的MgClgydF4y2Ba2gydF4y2Ba.反应方案如下;95℃变性5分钟,95℃30s, 52 ~ 57℃30s, 72℃延伸45 s ~ 2分钟,重复35次,最后72℃扩增10分钟。在浓度为1.5%及以上时,用琼脂糖凝胶电泳检测多态性(gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba)根据差异的尺寸。gydF4y2Ba
发芽试验gydF4y2Ba
按照阿隆索-布兰科等人的描述进行种子休眠释放后的发芽试验[gydF4y2Ba2gydF4y2Ba做了一些小小的调整。简单地说,在种子干燥贮藏期间的若干时间间隔,直到所有批次的种子达到100%的发芽率,将每个基因型的50 ~ 100颗种子均匀地播种在用0.7 ml去盐水浸泡过的滤纸上,置于6cm培养皿中。皮氏培养皿被放置在由塑料托盘组成的湿气室中,塑料托盘中装有滤纸,滤纸被自来水浸透,并用透明盖子封闭。在22°C连续光照下,38-W Philips TL84荧光管8 W m2照明的气候室中保存1周。然后对种子总数和萌发数进行评分,计算萌发率。gydF4y2Ba
在胁迫条件下对完全成熟的种子进行发芽试验。应力条件为:渗透应力(−1 MPa甘露醇;Sigma-Aldrich),盐胁迫(130 mM NaCl;ABA胁迫(0.15 μM ABA;Duchefa对)。ABA溶解在10 mM MES缓冲液(Sigma-Aldrich)中,调整pH至5.8。为了测定种子的寿命,进行了加速老化试验,种子在饱和ZnSO4溶液(40°C, 85%的相对湿度)上封闭罐中培养5天。然后取出种子,如前所述在去盐水中发芽。gydF4y2Ba
结果gydF4y2Ba
鉴定种子休眠和成熟后调节基因gydF4y2Ba
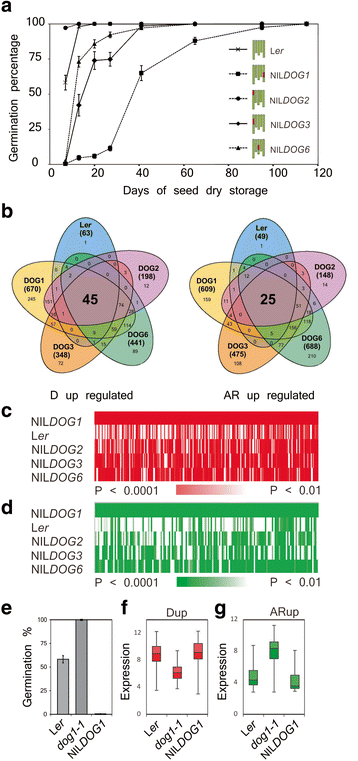
我的种子gydF4y2Ba呃gydF4y2Ba,零gydF4y2BaDOG1gydF4y2Ba-CVI,NIL.gydF4y2BaDOG2gydF4y2Ba-CVI,NIL.gydF4y2BaDOG3gydF4y2Ba-Cvi和零gydF4y2BaDOG6gydF4y2Ba- cas -2的休眠状态。在种子干燥贮藏的一段时间内进行催熟后的发芽试验(图。gydF4y2Ba1gydF4y2Ba).120天后,所有基因型都失去了休眠,呈100%发芽。零gydF4y2BaDOG2gydF4y2Ba更少休眠和零gydF4y2BaDOG3gydF4y2Ba,零gydF4y2BaDOG6gydF4y2Ba而不是gydF4y2BaDOG1gydF4y2Ba与LgydF4y2Ba呃gydF4y2Ba.在播种(具有)以进行微阵列分析后24小时取样每种基因型的休眠和熟化的种子,允许比较这五种基因型的休眠和熟化的种子转录om,其具有不同水平的原发性休眠。gydF4y2Ba
5种不同休眠水平基因型种子吸胀24 h后休眠和后熟的基因芯片分析lgydF4y2Ba呃gydF4y2Ba,零gydF4y2BaDOG1gydF4y2Ba,零gydF4y2BaDOG2gydF4y2Ba,零gydF4y2BaDOG3gydF4y2Ba而不是gydF4y2BaDOG6gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba五种基因型的成熟要求。在右图中显示出含有狭窄区域的5染色体的右图所示,否则gydF4y2Ba呃gydF4y2Ba背景(绿色)。gydF4y2BabgydF4y2Ba显示差异表达基因数量的维恩图(gydF4y2BaPgydF4y2Ba<0.0001)在休眠(D-UP)和成熟(AR-UP)后24-H的不同基因型的种子。对于每个基因型,差异表达基因的总数在括号之间表示。在所有基因型的交叉点中,分别为D-UP和Ar-Up设定呈现该研究中研究的基因数。gydF4y2BacgydF4y2Ba热图由245个零值组成gydF4y2BaDOG1gydF4y2BaD-UP基因(P <0.0001)。指出了这些基因在其他基因型中的重要性,白色表明在其他基因型中没有显着差异的基因(gydF4y2BaPgydF4y2Ba< 0.01)。gydF4y2BadgydF4y2Ba加热图由159毫升组成gydF4y2BaDOG1gydF4y2BaAR-up基因(P < 0.0001)。表明这些基因在其他基因型中的显著性,白色表示在其他基因型中差异不显著的基因(P < 0.01)。gydF4y2BaegydF4y2Ba黄颡鱼鲜采种子萌发特性研究gydF4y2Ba呃gydF4y2Ba,gydF4y2Badog1gydF4y2Ba而不是gydF4y2BaDOG1gydF4y2Ba.gydF4y2BafgydF4y2BaBox - plot显示了45 -up基因在新鲜收获的吸收LgydF4y2Ba呃gydF4y2Ba,gydF4y2Badog1gydF4y2Ba而不是gydF4y2BaDOG1gydF4y2Ba(表达数据取自Dekkers等人[gydF4y2Ba16gydF4y2Ba])。gydF4y2BaggydF4y2Ba箱形图显示了25个up基因在新鲜收获的LgydF4y2Ba呃gydF4y2Ba,gydF4y2Badog1gydF4y2Ba而不是gydF4y2BaDOG1gydF4y2Ba种子gydF4y2Ba
研究了转录组数据以鉴定在24小时内上调的基因被吸收的休眠(d)lgydF4y2Ba呃gydF4y2Ba,零gydF4y2BaDOG1gydF4y2Ba,零gydF4y2BaDOG2gydF4y2Ba,零gydF4y2BaDOG3gydF4y2Ba而不是gydF4y2BaDOG6gydF4y2Ba种子和基因在24小时内上调后熟(AR;非休眠的)同一株系的种子。1896个基因(gydF4y2BaPgydF4y2Ba< 0.0001)在进行分析的两个阶段(休眠与AR)的基因型内比较时差异表达。休眠种子中有63,670、198、348和441个基因表达上调,AR种子中有49,609、148、475和688个基因表达上调gydF4y2Ba呃gydF4y2Ba,零gydF4y2BaDOG1gydF4y2Ba,零gydF4y2BaDOG2gydF4y2Ba,零gydF4y2BaDOG3gydF4y2Ba而不是gydF4y2BaDOG6gydF4y2Ba分别(无花果。gydF4y2Ba1 bgydF4y2Ba).gydF4y2Ba
大部分差异表达基因对于分析的基因型是特异性的特异性gydF4y2BaPgydF4y2Ba< 0.0001;然而,这些基因在其他基因型中差异表达的意义较低。这已经被可视化为NIL的特定基因gydF4y2BaDOG1gydF4y2Ba(图。gydF4y2Ba1gydF4y2Ba光盘)。245岁的大部分gydF4y2BaDOG1gydF4y2Ba向上和159空gydF4y2BaDOG1gydF4y2BaAR-up基因有差异表达(gydF4y2BaPgydF4y2Ba < 0.01) in the other genotypes. This indicates that the genes that are specifically differentially expressed are based on quantitative expression differences rather than qualitative.
对于休眠和AR重要的基因,预计在测试的所有基因型之间的这些阶段之间存在差异表达(图3的VENN图中的交叉点。gydF4y2Ba1 bgydF4y2Ba).这导致在所有休眠基因型中鉴定了45个上调基因(休眠;起来吗;表格gydF4y2Ba1gydF4y2Ba)和25个基因在所有后熟基因型中表达上调(后熟;AR-up;表格gydF4y2Ba2gydF4y2Ba).使用SEED EFP浏览器进一步调查表达式模式(gydF4y2Bahttp://www.bioinformatics.nl/efp/cgi-bin/efpweb.cgi.gydF4y2Ba[总的来说,通常,在24 hai在24 hai的休眠种子中上调上调的所有基因在干燥的种子中高度表达,在休眠种子的吸收过程中仍然很高,但在ar种子的萌发过程中被调节下降。反之亦然,在Ar种子中调节的基因,在白垩种子中具有低表达,随着吸收时间而增加(附加文件gydF4y2Ba2gydF4y2Ba:图S2)。此外,通过对紫花苜蓿种子中单个基因表达的研究,进一步揭示了其与休眠的关系gydF4y2Ba呃gydF4y2Ba,gydF4y2Badog1-1gydF4y2Ba而不是gydF4y2BaDOG1 -gydF4y2Ba具有非常明显的休眠差异的CVI(图。gydF4y2Ba1 egydF4y2Ba).D-Up基因在休眠L中高度表达gydF4y2Ba呃gydF4y2Ba而不是gydF4y2BaDOG1gydF4y2Ba-Cvi种子,而AR-up基因在非休眠状态下高表达gydF4y2Badog1-1gydF4y2Ba突变体(图。gydF4y2Ba1gydF4y2Baf, g)。gydF4y2Ba
在鉴定的基因中,有几个以前与种子休眠或萌发有关的基因,包括gydF4y2BaPHYTOCHROME-INTERACTING因子6gydF4y2Ba(gydF4y2BaPIF6、KO19 AT3G62090)gydF4y2Ba)[gydF4y2Ba47.gydF4y2Ba],gydF4y2Ba赤霉素3-氧化酶2gydF4y2Ba(gydF4y2BaGA3OX2gydF4y2Ba)[gydF4y2Ba59.gydF4y2Ba),gydF4y2Ba种子萌发改变5gydF4y2Ba(gydF4y2BaASG5,gydF4y2BaKO23,AT1G20650)[gydF4y2Ba4gydF4y2Ba].此外,我们发现了编码胚胎后期发育丰富蛋白(LEA)的基因,这些蛋白已知在种子干燥和响应干旱、低温或盐诱导的水分亏缺时积累[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba43.gydF4y2Ba].所鉴定的基因涵盖了氧化石墨烯的各个分子功能类别,其中与酶相关的基因所占比例最大,包括转移酶活性、激酶活性和水解酶活性,其次是核苷酸结合蛋白,包括转录因子。gydF4y2Ba
种子休眠和萌发中涉及的基因T-DNA突变体的分离gydF4y2Ba
为了探讨所识别的基因是否确实影响休眠,我们已经分析了种子性能表型的T-DNA敲除线。对于大多数已识别的基因,T-DNA突变体可选自Salk和Sail系列(NASC,gydF4y2Bahttp://arabidopsis.info.gydF4y2Ba/),但8个基因没有T-DNA插入突变体(附加文件gydF4y2Ba1gydF4y2Ba:表S1)。在所有病例中,都产生了纯合子系,并使用基于pcr的方法进行了确认。对于47个基因,可以筛选出一个纯合子的KO突变体。对于9个基因(大部分在AR-up组),没有在任何基因型植物(在附加文件中称为“所有野生型”)中发现插入gydF4y2Ba1gydF4y2Ba:表S1)。此外,对于两个基因gydF4y2BaFRUCTOSE-BISPHOSPHATE醛缩酶gydF4y2Ba(gydF4y2BaFBA2gydF4y2Ba;AT4G38970)和gydF4y2BaDELTA-9 DESATURASE1gydF4y2Ba(gydF4y2BaADS1gydF4y2Ba检测到AT1G06080) T-DNA插入,但未筛选出纯合子突变体。这些基因的纯合子突变体很可能是致命的;因此,我们对这些株系的角部进行解剖,以研究可能的种子败育。这证实了这些品系的纯合突变种子在种子发育的早期阶段流产(约四分之一)。gydF4y2Ba2gydF4y2Ba).完整的基因分型信息在附加文件中gydF4y2Ba1gydF4y2BaS1:表。gydF4y2Ba
与野生型哥伦比亚(COL)相比,T-DNA敲除植物表型。gydF4y2Ba一个gydF4y2Ba与插入的杂合T-DNA系中的单独中止种子中止的种子gydF4y2BaFBA2gydF4y2Ba(AT1G06080)和gydF4y2BaADS1gydF4y2Ba(AT4G38970)。gydF4y2BabgydF4y2BaNAD(P)-BINDING rosssmann - fold超级家族蛋白(gydF4y2BanbrsfpgydF4y2Ba;KO1 AT2G29300)和gydF4y2Ba琥珀酸氨基醛脱氢酶gydF4y2Ba突变体(gydF4y2Bassadh1gydF4y2Ba, KO25, At1G79440) (gydF4y2BacgydF4y2Ba)gydF4y2BanbrsfpgydF4y2Ba,col和gydF4y2Bassadh1gydF4y2Ba发芽后6周gydF4y2Ba
所有纯合子T-DNA品系与野生型Columbia (Col)一起培养进行表型分析。这揭示了大多数突变体的正常植物表型;但是,对于gydF4y2Banad(p) - 缠绕罗斯曼折叠超级家庭蛋白质gydF4y2Ba(gydF4y2BaNBRSFP.gydF4y2Ba;KO1 AT2G29300)和gydF4y2Ba琥珀酸氨基醛脱氢酶gydF4y2Ba(gydF4y2BaSSADH1gydF4y2BaKO25, At1G79440)突变体的表型发生显著改变(图。gydF4y2Ba2gydF4y2Ba).在种子收获种子后对其种子性能表型进行测试。gydF4y2Ba
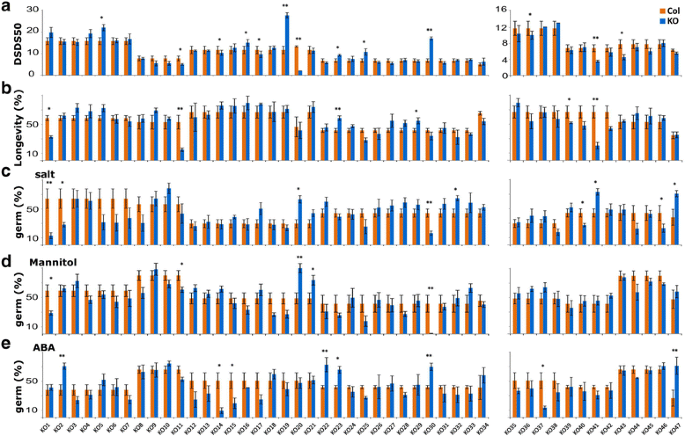
改变休息突变体的种子休眠,休眠突变体和熟化的基因套装gydF4y2Ba
最初仅通过评估达到50%的种子干储存的天数(种子干燥储存天达50%以达到萌发的50%)来检查种子休眠水平的仅检查种子休眠水平; DSDS50);无花果。gydF4y2Ba3AgydF4y2Ba).然后,对完全成熟后的种子进行种子寿命测试(图。gydF4y2Ba3B.gydF4y2Ba)盐中的发芽(图。gydF4y2Ba3CgydF4y2Ba)、甘露醇(无花果。gydF4y2Ba3dgydF4y2Ba)和ABA(图。gydF4y2Ba3EgydF4y2Ba).13个株系表现出与野生型显著不同的休眠水平(DSDS50),其中7个株系的休眠水平低于野生型(KO11、14、16、17、20、36、41和43),6个株系的休眠水平高于野生型(KO5、16、19、23、25和30)。一些突变体在其种子休眠水平上受到特殊影响,因此没有检测到其他种子性能表型。在这些突变体中,有一个已知的转录因子相关基因(KO5, At3G14880)响应karrikin,gydF4y2Ba卵磷脂胆固醇酰基转移酶:3gydF4y2Ba(gydF4y2BaLCAT3gydF4y2Ba;KO16, At3G03310)是一种参与脂质代谢的种子成熟蛋白(KO17;AT3G22490),gydF4y2BaSSADH1gydF4y2Ba,gydF4y2BaPIF6gydF4y2Ba,抗氧化基因gydF4y2Ba酶类问gydF4y2Ba(gydF4y2BaPRXQgydF4y2Ba;KO36, AT3G26060)gydF4y2Ba种子储存2s白蛋白超级家庭成员gydF4y2Ba(KO43 AT2G455180)。gydF4y2BaPif6gydF4y2Ba比野生类型(11.67)显示出多倍的DSDS50(27.7天)。gydF4y2BaPIF6gydF4y2Ba曾被发现负调控种子休眠[gydF4y2Ba47.gydF4y2Ba].其他突变体也受到至少一种其他种子性能特征的影响。与突变的线条gydF4y2Ba苹果酸盐1gydF4y2Ba(gydF4y2Ba组织gydF4y2Ba、KO11 At2G19900)gydF4y2Ba, ASG5gydF4y2Ba和gydF4y2Ba未知蛋白质gydF4y2Ba(gydF4y2BaPUF.gydF4y2Ba,KO41,AT4G31330)显示休眠和种子寿命表型。有趣的是,gydF4y2Baatnadp-me1gydF4y2Ba和gydF4y2BapufgydF4y2Ba减少了休眠和寿命gydF4y2BapufgydF4y2Ba对盐胁迫也不那么敏感。gydF4y2BaAsg5gydF4y2Ba表现出更强的休眠和寿命。KO的gydF4y2BaALLANTOATE酰胺水解酶gydF4y2Ba(gydF4y2Ba啊gydF4y2Ba;KO30,AT4G20070)除了种子寿命之外,所有调查的种子特征显示了一种表型。该基因编码一种酶,其将硫化物氨基酸酯,CO 2和两种铵分子水解氨基氨基。的gydF4y2Ba啊gydF4y2Ba突变体对盐和甘露醇更敏感,对ABA敏感。一个kogydF4y2BaU-Box超级家庭蛋白质gydF4y2Ba(KO14, At2G27940)的休眠期略低于野生型,但对ABA的敏感性远高于野生型。A KO在gydF4y2BaUNCHARACTERISED蛋白家族gydF4y2Ba基因(gydF4y2BaUPF.gydF4y2Ba;At4G19390, KO20)表现出很强的非休眠表型,对甘露醇和盐相当不敏感。gydF4y2Ba
其他种子性能表型用于D-up和Ar-up基因gydF4y2Ba
在所选突变体中也是在种子休眠水平中不受影响的基因型,但显示出其他种子性能性状的改变表型。gydF4y2Ba
突变体具有改变的种子长寿表型gydF4y2Ba
的gydF4y2BanbrsfpgydF4y2Ba突变体(KO1,AT2G29300)除了其降低的种子寿命之外,对盐和甘露醇的萌发也更敏感。线条突变gydF4y2BaGIBBERELLIN-REGULATED基因家族gydF4y2Ba(gydF4y2BaGASA3,gydF4y2BaAT4G09600 KO29)和gydF4y2Ba73 b3 UDP-GLUCOSYL转移酶gydF4y2Ba(gydF4y2BaUGT73B3,gydF4y2BaAT4G34131,KO39)显示了寿命性表型。之前尚未报道种子寿命中这些基因的作用。gydF4y2Ba
对NaCl和/或渗透胁迫反应改变的突变体gydF4y2Ba
线粒体发生突变gydF4y2Ba乙二醛酶2gydF4y2Ba(gydF4y2BaGLX2gydF4y2Ba;KO2gydF4y2Ba,gydF4y2BaAT2G31350),gydF4y2Ba液泡加工酶gydF4y2Ba(gydF4y2BaDELTA-VPEgydF4y2Ba,KO40,AT3G20210)和gydF4y2Ba丝氨酸CARBOXYPEPTIDASE-LIKE 48gydF4y2Ba(gydF4y2BaSCPL48gydF4y2Ba,KO46,AT3G45010)显示出盐的萌发,但耐受由高浓度的甘露醇引起的低渗透势。虽然对盐更敏感,gydF4y2BaGLX2.gydF4y2Ba对ABA的抗性较野生型强。KO的gydF4y2BaMyb转录因子lyh - cca1 - like1gydF4y2Ba(gydF4y2BaLCL1gydF4y2Ba与野生型相比,KO21,AT5G02840)对甘露醇的发芽更耐药。在盐的发芽后看到了类似的趋势,但这种效果并不重要。线条突变gydF4y2Ba杯子超级家庭蛋白质gydF4y2Ba(KO32,AT4G36700)和gydF4y2Ba改变XYLOGLUCAN 8gydF4y2Ba(AXY8;KO47、AT4G34260)表现出耐盐表型,但在甘露醇下萌发与野生型相似。除了对盐的敏感性较低之外gydF4y2Baaxy8gydF4y2Ba对ABA的敏感性也降低。gydF4y2Ba
休眠相关基因对ABA的反应gydF4y2Ba
上面已经提到了几个对ABA反应发生改变的株系,因为它们至少还有另一种表型。然而,有3个株系仅在ABA存在时表现出萌发表型。两条线,进去gydF4y2Ba热休克转录因子a1egydF4y2Ba(gydF4y2BaHSFA1EgydF4y2Ba;KO15 AT3G02990)和gydF4y2Ba低亲和力磷酸盐转运蛋白gydF4y2Ba(gydF4y2BaPHT2; 1gydF4y2Ba突变株中,KO37、AT3G26570)的敏感性较高,而在gydF4y2Bavps4活性调节因子gydF4y2Ba在MVB途径蛋白(KO22,AT1G13340)中更耐受ABA。gydF4y2Ba
讨论gydF4y2Ba
我们在寻找新的球员中的规定gydF4y2Ba拟南芥gydF4y2Ba我们采用了一种比较转录组学方法来研究24小时休眠和成熟后的种子休眠gydF4y2Ba狗gydF4y2Ba尼尔斯和LgydF4y2Ba呃gydF4y2Ba种子。同样的基因型早先被用于研究休眠干种子的转录组[gydF4y2Ba6gydF4y2Ba,表明种子在gydF4y2Ba狗gydF4y2BaNILs主要由不同的加性遗传和分子途径控制。在干燥的种子中,休眠和成熟后的种子几乎没有任何差异,但一旦种子暴露在水里,转录组的差异就很明显。在此基础上,我们假设gydF4y2Ba狗gydF4y2Ba在种子成熟期间,读出的种子成熟期间,读出的干燥种子在很大程度上被不同的分子途径调节,但种子中的休眠维持和萌发的开始可能非常保守过程。这种守恒允许我们鉴定在24小时中表达的休眠和ar种子的强大基因组。确定的基因在选择的时间点取决于很多。从我们之前的工作来看,我们知道已经在早期吸收(吸收开始后3小时)可以识别休眠和成熟的种子之间的第一个差异[gydF4y2Ba17gydF4y2Ba].然而,我们也知道,大多数基因表达的变化与种子复水本身有关,这些变化在休眠和成熟后的种子之间是相似的。为了专门鉴定与休眠维持和萌发相关的差异,我们选择在吸胀后24小时研究转录组。与之前发表的表达分析(在一系列生理状态下对Cvi加入的种子进行的表达分析)相比,已确定基因的这种稳健性得到了证实[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].休眠和溶血基因分别为63%和32%,与Cadman等人鉴定的基因重叠。[gydF4y2Ba10gydF4y2Ba)(附加文件gydF4y2Ba1gydF4y2Ba:表S1)。此外,up基因在休眠Cvi种子中的表达明显高于AR Cvi种子,AR-up基因在休眠Cvi种子中的平均表达也高于AR Cvi种子(附加文件)gydF4y2Ba2gydF4y2Ba:图S2)。一些被鉴定的基因已经被证明在几种植物的萌发和/或启动过程中发挥作用。其中包括gydF4y2BaGA3OX2gydF4y2Ba(AT1G80340)是赤霉素生物合成途径的关键基因,gydF4y2BaPIF6,gydF4y2Ba参与植物色彩信号通路和gydF4y2BaASG5.gydF4y2Ba这参与蛋白质和氨基酸磷酸化。鉴定这些已知的休眠突变体是研究其他休眠和成熟的特异性基因的动力。我们通过使用T-DNA插入线用于差异表达基因的T-DNA插入线进行了逆向遗传方法,实际上,我们鉴定了之前没有与种子休眠或发芽有关的基因。在我们的目标列表中66个基因,八个目前没有任何确认的淘汰赛。这与最近的报告一致,即12%的拟南芥基因在先前产生的收集中没有可用的插入线[gydF4y2Ba44.gydF4y2Ba].事实上,大多数突变体表现出近野生型休眠表型,可以用几种方法来解释。T-DNA插入的位置可能是决定性的,例如,是否在内含子、外显子或未转录区域,如启动子。此外,t - dna诱导的突变并不总是导致高效的突变。插入一个基因的蛋白质编码区产生敲除的案例占86%,如果插入在起始密码子前面,只有41%的案例[gydF4y2Ba56.gydF4y2Ba].此外,基因冗余可能掩盖了植物中的任何表型差异,其中只有一个同源物的表达被中断[gydF4y2Ba28gydF4y2Ba].此外,在我们的实验中,我们使用了具有哥伦比亚-0背景的突变体,这些突变体通常有较低的休眠状态,因此不允许对降低休眠水平的微小影响进行可视化。种子休眠可以通过抑制或促进基因表达来调节,考虑到在up基因中我们发现两种突变体的休眠都更少(图。gydF4y2Ba3.gydF4y2Ba;KO11, 14和17)和更多的休眠(KO5, 16, 19, 23, 25和30)。这些例子表明,不能仅根据表达模式预测表型。gydF4y2Ba
种子的许多性能特征(如种子脱水耐性、种子寿命和种子休眠)是在种子成熟过程中获得的。如果基因一般影响种子的成熟,则很可能是多效效应。在我们的研究中,一些突变体表现出一个以上的萌发性状的表型。的gydF4y2Ba啊gydF4y2Ba例如,突变体对所有研究的种子性状都显示出一种表型,除了寿命。该酶降解植物中嘌呤环氮循环所需的尿囊酸。的gydF4y2Ba啊gydF4y2BaT-DNA突变体不能在丙二醇中生长,作为唯一的氮源[gydF4y2Ba57.gydF4y2Ba].此外,众所周知,有利于母植物硝酸盐积累的病症可能导致较低的种子休眠水平[gydF4y2Ba1gydF4y2Ba].因为AAH是嘌呤通路中的关键基因[gydF4y2Ba57.gydF4y2Ba],我们推测该基因的缺陷阻断了这一途径,从而影响了铵态氮的利用,导致初级休眠增加,并影响了该突变体的其他种子性能性状。gydF4y2BaAtnadh-me1gydF4y2Ba,gydF4y2Baasg5gydF4y2Ba和gydF4y2BaufpgydF4y2Ba突变体不仅影响了休眠和寿命,还影响了另一个特性。众所周知,种子寿命可能是基因的多效效应,它调节其他性状,如种子成熟[gydF4y2Ba53.gydF4y2Ba,对温度的反应[gydF4y2Ba37.gydF4y2Ba氧化应激[gydF4y2Ba14gydF4y2Ba]和休眠[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba39.gydF4y2Ba].以前的研究使用突变分析表明种子休眠突变体gydF4y2Badog1gydF4y2Ba和gydF4y2Bardo4gydF4y2Ba也有一个减少的种子寿命表型[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba39.gydF4y2Ba].gydF4y2Ba
休眠损失表示为发芽窗口的开口(允许环境范围)[gydF4y2Ba19gydF4y2Ba].正是因为这在应力下的萌芽(即盐或渗透胁迫)通常与初始种子休眠水平相关。我们揭示了两种情况,降低了休眠的休眠,确实与对盐压力的敏感性降低(gydF4y2Ba趟车gydF4y2Ba(ko20)和gydF4y2BapufgydF4y2Ba(KO41))。对于一些突变体,gydF4y2BanbrsfpgydF4y2Ba(KO1),gydF4y2Ba趟车gydF4y2Ba(ko20)和gydF4y2Ba啊gydF4y2Ba(KO30), NaCl和甘露醇处理的种子萌发模式正相关,可能是因为两种处理都给予了渗透胁迫。其中两个突变体(gydF4y2BanbrsfpgydF4y2Ba和gydF4y2Ba啊gydF4y2Ba)显示增强的盐度和渗透压力的敏感性。NAD(P) - 缠结的Rossmann-Fold Superfamily蛋白质具有氧化还原酶活性,结合,催化活性,并且基于TAIR注释,它位于EndoMembrane系统中。gydF4y2BaUPF.gydF4y2Ba是唯一对盐和渗透胁迫不敏感的唯一突变体,表明该突变体主要是OsMotolerent。此外,对于一些耐盐性突变体gydF4y2BaRMLC样铜超级家庭蛋白质gydF4y2Ba(KO32),gydF4y2Ba未知蛋白质gydF4y2BaKO41和gydF4y2Baaxy8gydF4y2Ba(KO47)甘露醇的发芽率类似于野生型。对于耐盐性线,基因突变了基因,其产品是应力信号传导的元素,并在盐水应激条件下抑制发芽。盐敏感gydF4y2BaGLX2.gydF4y2Ba突变体对ABA的应用具有较强的耐受性。乙二醛酶途径由GLX1和GLX2两种酶组成,在化学解毒中具有重要作用。在gydF4y2Ba拟南芥,gydF4y2Ba在非生物压力期间需要GLX2,正如从更高的敏感的敏感性结束gydF4y2Baglx2-1gydF4y2Ba与野生型种子相比,在盐胁迫和缺氧条件下,种子的生长速度较慢。此外,GLX2-1-OE种子比野生型更能抵抗缺氧胁迫[gydF4y2Ba18gydF4y2Ba].gydF4y2Ba
有趣的是,gydF4y2Baaxy8gydF4y2Ba(KO47)显示对ABA和盐的耐受性较高。gydF4y2BaAXY8gydF4y2Ba编码α-聚焦酶作用于半纤维素木葡聚糖(XyG),发生在所有维管植物的初生细胞壁。因为它在伸展组织中含量高[gydF4y2Ba11gydF4y2Ba和细胞伸长过程中的结构改变[gydF4y2Ba46.gydF4y2Ba], XyG已被提议成为扩展增长的主要参与者[gydF4y2Ba15gydF4y2Ba].在细胞伸长和添加生长激素生长素时,参与XyG代谢的基因的诱导证实了这一点[gydF4y2Ba50.gydF4y2Ba].总的来说,这些发现强调了细胞壁重塑在萌发过程中的重要性,特别是在应对胁迫条件时。gydF4y2Ba
在休眠和成熟后,我们都鉴定了许多编码酶的基因。这一结果可能与我们观察了24小时浸渍的种子有关。在这个阶段,胚胎中的大多数细胞都具有潜在的代谢活性。这也会激活水解酶和合成酶以及生长激素来调动营养物质并合成生长所需的成分。其中包括编码ABA-和ga -生物合成-和-失活酶的基因,这些酶在决定种子中的ABA- ga平衡,从而决定休眠和萌发中发挥关键作用[gydF4y2Ba42.gydF4y2Ba,gydF4y2Ba58.gydF4y2Ba].gydF4y2Ba
在鉴定的基因中还包括核苷酸结合蛋白和转录因子,如热应激转录因子家族成员(gydF4y2BaHSFA1EgydF4y2Ba,KO15),ERF转录因子家族的成员,转录因子相关蛋白(KO5),转录因子与ABI5同源gydF4y2BaPIF6gydF4y2Ba(KO19)。有趣的是,所有的突变体都处于上升状态,对突变体进行分析后,它们要么表现出更多的休眠状态(gydF4y2Ba转录factor-related蛋白质gydF4y2Ba和gydF4y2Bapif6gydF4y2Ba)或对ABA更敏感(gydF4y2Bahsfa1agydF4y2Ba).gydF4y2Ba
结论gydF4y2Ba
我们确定了以前没有与种子休眠有关的基因的种子休眠和发芽表型。我们只测试了每条线的一个T-DNA等位基因,这可能不是一个明确的证明,即插入突变导致观察到的表型,多达50%的线可以包含在未知基因座的附加插入物[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba44.gydF4y2Ba].我们鉴定了近50%的调查基因的萌发相关表型,这远远高于从随机选择基因中可以预期的结果。它也远高于我们在早期转录组分析中确定的基因型。然而,第二个位点可能引起感兴趣的表型,或可能改变敲除突变的表型效应。因此,这项工作代表了可能参与控制种子休眠或萌发的基因清单。然而,这些基因影响这些重要种子性状的分子机制还有待深入研究。gydF4y2Ba
缩写gydF4y2Ba
- aah:gydF4y2Ba
-
ALLANTOATE酰胺水解酶gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱盐酸gydF4y2Ba
- ADS1:gydF4y2Ba
-
DELTA-9 DESATURASE1gydF4y2Ba
- 基于“增大化现实”技术:gydF4y2Ba
-
After-ripenedgydF4y2Ba
- AR-up:gydF4y2Ba
-
催熟上调基因gydF4y2Ba
- ASG5:gydF4y2Ba
-
种子萌发改变5gydF4y2Ba
- AXY8:gydF4y2Ba
-
改变XYLOGLUCAN 8gydF4y2Ba
- 上校:gydF4y2Ba
-
哥伦比亚gydF4y2Ba
- DELTA-VPE:gydF4y2Ba
-
液泡加工酶gydF4y2Ba
- 狗gydF4y2Ba:gydF4y2Ba
-
延迟发芽gydF4y2Ba
- 狗gydF4y2Banils:gydF4y2Ba
-
延迟发芽gydF4y2Ba近代源线gydF4y2Ba
- DSDS50:gydF4y2Ba
-
种子干燥贮藏天数达到萌发率的50%gydF4y2Ba
- 起来吗:gydF4y2Ba
-
休眠上调基因gydF4y2Ba
- FBA2:gydF4y2Ba
-
FRUCTOSE-BISPHOSPHATE醛缩酶gydF4y2Ba
- GA3OX2:gydF4y2Ba
-
赤霉素3-氧化酶2gydF4y2Ba
- 气体:gydF4y2Ba
-
赤霉素gydF4y2Ba
- GASA3:gydF4y2Ba
-
GIBBERELLIN-REGULATED基因家族gydF4y2Ba
- GLX2:gydF4y2Ba
-
乙二醛酶2gydF4y2Ba
- 拥有:gydF4y2Ba
-
播种后的小时gydF4y2Ba
- HSFA1E:gydF4y2Ba
-
热休克转录因子a1egydF4y2Ba
- ko:gydF4y2Ba
-
淘汰赛gydF4y2Ba
- LCAT3:gydF4y2Ba
-
卵磷脂胆固醇酰基转移酶:3gydF4y2Ba
- LCL1:gydF4y2Ba
-
Myb转录因子lyh - cca1 - like1gydF4y2Ba
- 李:gydF4y2Ba
-
胚胎晚期丰富gydF4y2Ba
- lgydF4y2Ba呃gydF4y2Ba:gydF4y2Ba
-
兰德斯堡gydF4y2Baerecta.gydF4y2Ba
- 组织:gydF4y2Ba
-
苹果酸酶gydF4y2Ba
- NBRSFP:gydF4y2Ba
-
nad(p) - 缠绕罗斯曼折叠超级家庭蛋白质gydF4y2Ba
- PHT2; 1:gydF4y2Ba
-
低亲和力磷酸盐转运蛋白gydF4y2Ba
- PIF6:gydF4y2Ba
-
PHYTOCHROME-INTERACTING因子6gydF4y2Ba
- PRXQ:gydF4y2Ba
-
酶类问gydF4y2Ba
- QTL:gydF4y2Ba
-
定量特质基因座gydF4y2Ba
- 瑞来斯:gydF4y2Ba
-
重组自交系gydF4y2Ba
- SCPL48:gydF4y2Ba
-
丝氨酸CARBOXYPEPTIDASE-LIKE 48gydF4y2Ba
- SSADH1:gydF4y2Ba
-
琥珀酸氨基醛脱氢酶gydF4y2Ba
- UGT73B3:gydF4y2Ba
-
73 b3 UDP-GLUCOSYL转移酶gydF4y2Ba
- UPF:gydF4y2Ba
-
UNCHARACTERISED蛋白家族gydF4y2Ba
参考gydF4y2Ba
- 1.gydF4y2Ba
alboresi a,gestin c,leydecker mt,bedu m,meyer c,truong hn。硝酸盐,一种解除拟南芥中种子休眠的信号。植物细胞环境。2005; 28:500-12。gydF4y2Ba
- 2.gydF4y2Ba
Alonso-Blanco C,AARTS MGM,Bentsink L,Keurentjes JJB,Reymond M,VReugenhil D,Koornneef M.自然变化教授我们关于植物开发,生理学和适应的内容?植物细胞。2009; 21:1877-96。gydF4y2Ba
- 3.gydF4y2Ba
转录组和翻译组的联合分析揭示了转录抑制对色氨酸依赖型生长素生物合成的控制作用gydF4y2BaDOG1gydF4y2Ba依赖种子休眠。2017.未发表的。gydF4y2Ba
- 4.gydF4y2Ba
基于规则的机器学习在拟南芥功能网络构建中的应用。植物细胞。2011;23:3101-16。gydF4y2Ba
- 5。gydF4y2Ba
Benjamini Y,Hochberg Y.控制虚假的发现率:多种测试的实用和强大的方法。J ROY统计数据库SOC B MEC。1995年; 57:289-300。gydF4y2Ba
- 6。gydF4y2Ba
Bentsink L, Hanson J, Hanhart CJ, blankestijin -de Vries H, Coltrane C, Keizer P, El-Lithy M, Alonso-Blanco C, de Andrés MT, Reymond M, van Eeuwijk F, Smeekens S, Koornneef M.拟南芥种子休眠的自然变异受加性遗传和分子途径调控。美国国家科学研究院2010;107:4264-9。gydF4y2Ba
- 7。gydF4y2Ba
Bentsink L,Jowett J,Hanhart CJ,Koornneef M.狗克隆,一种控制拟南芥种子休眠的定量特质基因座。Proc Natl Acad Sci U S A. 2006; 103:17042-7。gydF4y2Ba
- 8。gydF4y2Ba
布雷JD。种子萌发和休眠。植物细胞。1997;9:1055。gydF4y2Ba
- 9。gydF4y2Ba
王志强,王志强,王志强,等。种子发育、萌发和休眠的生理机制。纽约:施普林格;2012.gydF4y2Ba
- 10.gydF4y2Ba
Cadman CS, Toorop PE, Hilhorst HW, Finch-Savage WE。拟南芥Cvi种子在休眠周期中的基因表达谱表明了一种共同的潜在的休眠控制机制。植物j . 2006; 46:805-22。gydF4y2Ba
- 11.gydF4y2Ba
Carpita NC, Gibeaut DM.开花植物初生细胞壁结构模型:生长过程中细胞壁分子结构与物理性质的一致性植物j . 1993; 3:1-30。gydF4y2Ba
- 12.gydF4y2Ba
Carrera E, Holman T, Medhurst A, Dietrich D, Footitt S, Theodoulou FL, Holdsworth MJ。在拟南芥中,种子后熟是一个与特定基因网络相关的离散发育途径。植物j . 2008; 53:214-24。gydF4y2Ba
- 13.gydF4y2Ba
张W, Hubert N, Landry B.一种简单、快速的植物、动物和昆虫DNA微提取方法,适用于RAPD和其他PCR分析。基因组研究》1993;3:69 - 70。gydF4y2Ba
- 14。gydF4y2Ba
不同拟南芥突变体种子寿命的遗传差异。杂志。2004;121:448 - 61。gydF4y2Ba
- 15.gydF4y2Ba
•DJ。增强细胞壁延展性的酶和其他制剂。植物学报1999;50:391-417。gydF4y2Ba
- 16。gydF4y2Ba
德克斯BJW,皮尔斯SP,范博尔德伦-费尔德坎普RPM,霍尔兹沃斯MJ, Bentsink L.休眠和后熟gydF4y2Ba拟南芥gydF4y2Ba种子通过吸收状态的早期转录差异而区分。前植物SCI。2016B; 7:1323-38。gydF4y2Ba
- 17。gydF4y2Ba
Dekkers BJ, He H, Hanson J, Willems LA, Jamar DC, Cueff G, Rajjou L, Hilhorst HW, Bentsink L.拟南芥gydF4y2Ba发芽延迟1gydF4y2Ba基因影响gydF4y2Ba脱落酸不敏感gydF4y2Ba(gydF4y2BaAbi5.gydF4y2Ba)的表达,并与ab3基因在拟南芥种子发育过程中相互作用。植物j . 2016; 85:451 - 65。gydF4y2Ba
- 18。gydF4y2Ba
Devanathan S,Erban A,Perez-Torres R JR,Kopka J,Makaroff Ca.(2014)gydF4y2Ba拟南芥gydF4y2Ba在非生物胁迫期间需要乙醛酸酶2-1,但在正常植物生长下不是必需的。Plos一个。2014; 9:E95971。gydF4y2Ba
- 19。gydF4y2Ba
种子休眠对种子萌发的影响。新植醇。2006;171:501-23。gydF4y2Ba
- 20.gydF4y2Ba
傅Q,王B,金X,李H,韩P,魏K-h,张X-M,朱Y.蛋白质组学分析与干旱,发芽拟南芥种子和幼苗广泛的蛋白质鉴定。J Biochem mol Biol。2005; 38:650。gydF4y2Ba
- 21.gydF4y2Ba
Gallardo K,Job C,Groot SPC,Puype M,Demol H,VandekerCkhove J,Job D.拟南芥种子萌发和引发的蛋白质组学分析。植物理性。2001; 126:835-48。gydF4y2Ba
- 22.gydF4y2Ba
Gase K,Weinhold A,Bozorov T,Schuck S,Baldwin It。高效筛选转基因植物线的生态研究。Mol Ecol Resour。2011; 11:890-902。gydF4y2Ba
- 23.gydF4y2Ba
格里菲斯j,murase k,rieui,zentella r,张zl,力量sj,贡f,菲利普斯al,hedden p,sun tp,thomas sg。拟南芥GID1赤霉素受体的遗传表征及功能分析。植物细胞。2006; 18:3399-414。gydF4y2Ba
- 24.gydF4y2Ba
Gubler F, Millar AA, Jacobsen JV。休眠释放,ABA和收获前发芽。植物学报。2005;8:183-7。gydF4y2Ba
- 25.gydF4y2Ba
Holdsworth MJ, Bentsink L, Soppe WJJ。调控拟南芥种子成熟、后熟、休眠和萌发的分子网络。新植醇。2008;179:33-54。gydF4y2Ba
- 26.gydF4y2Ba
Holdsworth Mj,Finch-Savage We,Grappin P,工作D.种子休眠和萌发后基因组学解剖。趋势植物SCI。2008B; 13:7-13。gydF4y2Ba
- 27.gydF4y2Ba
Howell KA, Narsai R, Carroll A, Ivanova A, Lohse M, Usadel B, Millar AH, Whelan J.对水稻萌发过程中代谢和转录时间开关的定位突出了特定转录因子和RNA不稳定性在萌发过程中的作用。植物杂志。2009;149:961 - 80。gydF4y2Ba
- 28.gydF4y2Ba
陈建平,王志强。乙烯反应受一个受体基因家族的负调控gydF4y2Ba拟南芥gydF4y2Ba.细胞。1998;94:261 - 71。gydF4y2Ba
- 29.gydF4y2Ba
irzarry RA, Hobbs B, Collin F, bezer - barclay YD, Antonellis KJ, Scherf U, Speed TP。高密度寡核苷酸阵列探针水平数据的探索、标准化和总结。生物统计学。2003;4:249 - 64。gydF4y2Ba
- 30.gydF4y2Ba
Ismail Am,Hall Ae,关闭TJ。幼苗出苗期间脱氢基因COSEGREGATE与冷却耐受性的等位基因变异。Proc Natl Acad Sci U S A. 1999; 96:13566-70。gydF4y2Ba
- 31.gydF4y2Ba
Iuchi s,铃木,金YC,Iuchi A,Kuromori T,Ueguchi-Tanaka M,Asami T,Yamaguchi I,Matsuoka M,Kobayashi M,Nakajima M.拟南芥胃癌嗜酸盐蛋白受体ATGID1s的多重失程造成了完全关闭吉布林素信号。工厂J. 2007; 50:958-66。gydF4y2Ba
- 32.gydF4y2Ba
Joosen RV, Arends D, Li Y, Willems LA, Keurentjes JJ, Ligterink W, Jansen RC, Hilhorst HW。利用广义遗传基因组学鉴定发芽拟南芥种子代谢中基因型与环境的相互作用。植物杂志。2013;162:553 - 66。gydF4y2Ba
- 33.gydF4y2Ba
科恩尼夫,范德维恩。赤霉素敏感突变体的诱导与分析gydF4y2Ba拟南芥gydF4y2Ba(L.)Heynh。Theor Appl Genet, 1980; 58:257-63。gydF4y2Ba
- 34.gydF4y2Ba
关键词:赤霉素,ABA (ABA),突变体,诱导突变体gydF4y2Ba拟南芥gydF4y2Ba(L.)Heynh。Al Appl Genet。1982; 61:385-93。gydF4y2Ba
- 35.gydF4y2Ba
关键词:水稻,脱落酸,突变体,抗性gydF4y2Ba拟南芥gydF4y2Ba.杂志。1984;61:377 - 83。gydF4y2Ba
- 36.gydF4y2Ba
li BH, Cheng C, Bui AQ, Wagmaister JA, Henry KF, Pelletier J, Kwong L, Belmonte M, Kirkbride R, Horvath S.拟南芥种子发育过程中基因活性的整体分析和种子特异性转录因子的鉴定。美国国家科学研究院2010;107:8063-70。gydF4y2Ba
- 37.gydF4y2Ba
李宝华,李华,熊林,朱建坤。线粒体复合物I缺陷损害冷调节核基因表达。植物细胞。2002;14:1235-51。gydF4y2Ba
- 38。gydF4y2Ba
刘X,张h,赵y,风z,李q,杨h-q,栾s,李j,他z-h。(2013)通过在拟南芥中诱导ARF介导的ABI3激活来控制种子休眠通过刺激脱离酸信号传导。Proc Natl Acad Sci U S A. 2013; 110:15485-90。gydF4y2Ba
- 39。gydF4y2Ba
刘y,koornneef m,soppe wj。(2007)拟南芥中没有组蛋白H2b单磺中共杂交gydF4y2Bahub1gydF4y2Ba(gydF4y2Bardo4gydF4y2Ba)突变体揭示了染色质重塑在种子休眠中的作用。植物细胞。2007;19:433-44。gydF4y2Ba
- 40。gydF4y2Ba
Matakiadis T, Albores A, Jikumaru Y, Tatematsu K, Pichon O, Renou J-P, Kamiya Y, Nambara E, Truong H-N。拟南芥脱落酸分解基因CYP707A2在硝酸盐对种子休眠的控制中起关键作用。植物杂志。2009;149:949-60。gydF4y2Ba
- 41。gydF4y2Ba
王志刚,王志刚,王志刚,等。拟南芥种子萌发过程中转录因子的表达及其调控机制研究。植物j . 2005; 41:697 - 709。gydF4y2Ba
- 42.gydF4y2Ba
Nambara E,Marion-pol A.脱落酸生物合成和分解代谢。Annu Rev植物Biol。2005; 56:165-85。gydF4y2Ba
- 43.gydF4y2Ba
王志强,王志强,王志强,等。(2001)胁迫诱导的脱水醇的积累和组织特异性定位gydF4y2Ba拟南芥gydF4y2Ba.acta botanica sinica(云南植物学报),2001;45:263-79。gydF4y2Ba
- 44.gydF4y2Ba
O'Malley RC,Ecker JR。将基因型与使用拟南芥的无意量收集连接到表型。工厂J.2010; 61:928-40。gydF4y2Ba
- 45.gydF4y2Ba
OH E,Kang H,Yamaguchi S,Park J,Lee D,Kamiya Y,Choi G. GeNoe-ide-Incative in Arabidopsis种子萌发过程中的植物色谱互动因子3的基因分析。植物细胞。2009; 21:403-19。gydF4y2Ba
- 46.gydF4y2Ba
Pauly M,Qin Q,Greene H,Albersheim P,Darvill A,York Ws。细胞伸长型Xyloglucan结构的变化。Planta。2001; 212:842-50。gydF4y2Ba
- 47.gydF4y2Ba
Penfield S,Josse E-M,Halliday KJ。拟南芥原发性种子休眠控制中PIF6的替代剪接变体的作用。植物mol biol。2010; 73:89-95。gydF4y2Ba
- 48.gydF4y2Ba
Preston J, Tatematsu K, Kanno Y, Hobo T, Kimura M, Jikumaru Y, Yano R, Kamiya Y, Nambara E.(2009)在吸胀过程中激素代谢基因的时间表达模式gydF4y2Ba拟南芥gydF4y2Ba种子:对休眠和非休眠的比较研究。植物细胞生理。2009; 50:1786-800。gydF4y2Ba
- 49.gydF4y2Ba
吴丹,胡勇,罗春华,史伟,史密斯GK。Limma为rna测序和微阵列研究提供差异表达分析。核酸学报2015;43:e47。gydF4y2Ba
- 50。gydF4y2Ba
SánchezM,Gianzo C,Sampedro J,Revilla G,Zarra I.在完整和生长素诱导的松树皂细胞生长期间α-木质素酶的变化。植物细胞生理。2003; 44:132-8。gydF4y2Ba
- 51。gydF4y2Ba
史密斯星期。微阵列实验中评估差异表达的线性模型和经验贝叶斯方法。3:第3条。gydF4y2Ba
- 52.gydF4y2Ba
Sreenivasulu N, Usadel B, Winter A, Radchuk V, Scholz U, Stein N, Weschke W, Strickert M, Close TJ, Stitt M.大麦谷物成熟和发芽:代谢途径和调控网络的共性和差异,由新的MapMan/PageMan分析工具突出。植物杂志。2008;146:1738-58。gydF4y2Ba
- 53.gydF4y2Ba
苏利亚尼,杨志强,杨志强。保守剪接因子SUA控制拟南芥发育调节剂ABI3的可变剪接。植物细胞。2010;22:1936-46。gydF4y2Ba
- 54.gydF4y2Ba
团队,RC R.一种统计计算的语言和环境。维也纳,奥地利:统计计算基金会;2012年。ISBN 3-900051-07-0.gydF4y2Ba
- 55.gydF4y2Ba
关键词:拟南芥,高温诱导,脱落酸,赤霉素,生物合成植物杂志。2008;146:1368 - 85。gydF4y2Ba
- 56.gydF4y2Ba
王YH。拟南芥中T-DNA插入突变的效果如何?生物化学学报2008;1:11-20。gydF4y2Ba
- 57.gydF4y2Ba
Werner AK, Sparkes IA, Romeis T, Witte C-P。拟南芥和大豆尿囊酸酰胺水解酶的鉴定、生化特性和亚细胞定位。植物杂志。2008;46:418-30。gydF4y2Ba
- 58.gydF4y2Ba
山口赤霉素代谢及其调控。植物生物学学报2008;59:225-51。gydF4y2Ba
- 59.gydF4y2Ba
Yamaguchi S, Smith MW, Brown RG, Kamiya Y, Sun T-P。赤霉素3β-羟化酶基因在拟南芥萌发过程中的光敏色素调控及差异表达植物细胞。1998;10:2115-26。gydF4y2Ba
- 60。gydF4y2Ba
关键词:赤霉素,低温,生物合成,响应途径gydF4y2Ba拟南芥gydF4y2Ba种子。植物细胞。2004;16:367 - 78。gydF4y2Ba
确认gydF4y2Ba
不适用gydF4y2Ba
资金gydF4y2Ba
这项工作得到了荷兰技术基金会(STW)的支持,该基金会(STW)是荷兰科学研究和经济部技术方案的应用科学司(对LB)和Bio4Energy,是由此指定的战略研究环境瑞典政府(至jh)。融资机构既不涉及数据收集,分析和解释既不写作稿件。gydF4y2Ba
可用性数据和材料gydF4y2Ba
在目前的研究中生成的微阵列数据集储存在NCBI的基因表达综合(GEO号GSE90162)中。在当前的研究中使用的所有其他数据集都可以从通信作者在合理的要求下获得。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
LB和JH设计、执行和分析转录组分析。FY分析了T-DNA KO系的萌发性能。FY, HH和LB撰写了手稿。所有作者阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用gydF4y2Ba
同意出版gydF4y2Ba
不适用gydF4y2Ba
相互竞争的利益gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
微阵列的质量和重现性。所有28个ATH1阵列杂交后显示出类似的强度模式(A和B)。根据Bio-analyzer 2001对RNA模板和生物素化的cRNA的分析,用作cRNA合成模板的RNA是完整的。同意这是控制基因的杂交模式在幻灯片上显示出几乎相同的杂交(c)的模式。规范化的任何范围的一致性SE (NUSE)和相对日志表达式(RLE)表明杂交数据的高质量和一致性(d和e)(1)原始强度数据受到RMA正常化(2),使得一致性之间的一般水平之间不同的幻灯片(f和g)。复制实验的重现性高,以两个生物复制的数据之间的相关性高(h)。数组1和数组2与从不同的复制的cRNA L杂化gydF4y2Ba呃gydF4y2Ba种子。gydF4y2Ba图S2。gydF4y2Ba休眠和成熟后上调基因的时空表达模式在吸胀后1、3、7、12、16、20、25、31和38 h,拟南芥胚珠和合点胚乳(MCE)和胚根和下胚轴(RAD)中(a) up和(b) AR-up基因的平均相对表达量。数据取自Seed EFP Browser (gydF4y2Bahttp://www.bioinformatics.nl/efp/cgi-bin/efpweb.cgi.gydF4y2Ba).gydF4y2Ba图S3。gydF4y2Ba图中显示的up和AR-up基因的Log2表达差异。gydF4y2Ba1 c和dgydF4y2Ba.(a)热图显示245毫米的log2表达差异gydF4y2BaDOG1gydF4y2Ba起来吗基因(gydF4y2BaPgydF4y2Ba< 0.0001)在NILgydF4y2BaDOG1gydF4y2Ba以及其他基因型。(b) 159个NIL的Log2表达差异gydF4y2BaDOG1gydF4y2BaAR-up基因(gydF4y2BaPgydF4y2Ba< 0.0001)在NILgydF4y2BaDOG1gydF4y2Ba以及其他基因型。(XLS 81 kb)gydF4y2Ba
附加文件2:表S1。gydF4y2Ba
T-DNA选择46个D-UP和25个AR-UP基因。细节,T-DNA鉴定,基因型,用于基因分型的引物,插入T-DNA的分析中,敲除#,基因是否与Cadman等人的研究重叠。[gydF4y2Ba10gydF4y2Ba)表示。多克斯(803 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条提供的数据,除非另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
Yazdanpanah, F., Hanson, J., Hilhorst, H.W.gydF4y2Ba等等。gydF4y2Ba在吸收休眠和成熟的种子的吸收过程中差异表达基因 - 反向遗传方法。gydF4y2BaBMC植物BIOL.gydF4y2Ba17,gydF4y2Ba151(2017)。https://doi.org/10.1186/s12870-017-1098-z.gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-017-1098-z.gydF4y2Ba
关键词gydF4y2Ba
- 拟南芥gydF4y2Ba
- 延迟发芽gydF4y2Ba
- 迷人的线条gydF4y2Ba
- 种子表现gydF4y2Ba
- TranscriptromicsgydF4y2Ba