抽象的
背景
木质植物,尤其是树木,通常必须面对在生活期间由不同的药剂引起的几种伤害。茎和树枝伤害的愈合,影响血管结合的血管和木耳可能需要几年。在针叶树中,愈合主要来自伤口边缘的剩余血管挂钩。在愈合过程中在针叶树上形成的伤口木本通常呈现畸形和无序的躯干和丰富的创伤树脂管道。这些特征影响其功能作为导线及其技术特性。
结果
在这项工作中,我们首次分析了针叶草中创伤木材的转录组的转录组,并揭示了正常的早期和后期木材的一些差异。通过定量RT-PCR确认的微阵列分析差异的创伤木材,在愈合的第一个期间揭示了在愈合的第一个期间高达1408个基因的转录曲线的变化。根据其转录型材,我们在十二个簇中分组了这些基因,并在第一次愈合期间具有相应的两个主要阶段。
结论
伤人诱导转录程序的完整的重排在形成层区靠近受伤。在第一种情况下,径向生长停止,以及一套完整的防御基因,大多与生物胁迫,诱导。后来,形成层活动恢复伤口的横向边界,即使以高速率。在相关的早期木材形成,包括参与细胞壁形成和转录因子的基因该第二阶段的某些基因被过表达显著,而某些晚期木材相关基因被抑制。此外,报告中的丰富的非注释基因,转录概况显著改变。
背景
生物体通常会在其一生中遭受损伤。在多细胞生物中,这些损伤可导致分化组织或器官的损伤或丢失,并使病原体的进入和传播变得容易。近年来,动植物再生过程的异同分析备受关注[1,2,3.].动物通常可以再生这些受损的组织,甚至在某些情况下,丢失的器官,并且由于某些组织如皮肤的恒定再生,最终在一段时间后没有损伤的信号仍然存在。
在它们这方面,植物不能持续地再生它们的组织。增殖通常局限于某些生态位:木本植物的根和茎尖分生组织(包括腋芽)以及维管形成层和栓根。如果发生损伤,植物从这些分生组织产生新的组织和器官,或最终从活细胞(通常是实质细胞)发展新的分生小生境[4,5].这是从例如皮质实质或叶肉中开发的创伤性外形的情况,以将伤口密封在幼茎或休假中。
当木枝或茎受到很深的创伤,影响次生木质部时,维管形成层必须恢复。在某些被子植物中,已经描述了由木质部薄壁组织或不成熟木质部传导元件增殖,如蒂利亚[6],杜仲[7] 或者杨树[8].这些细胞可以逆转它们的分化途径,大量分裂,产生薄壁组织愈伤组织。随后,一个新的创伤性维管形成层在愈伤组织中分化,产生新的次生木质部和韧皮部。
相反,来自(部分)分化细胞的这种增殖在针叶树中不常见。在这些物种中,愈合主要是从伤口边缘的剩余血管结合,如最近所述Pinus canariensis.[9].
无论如何,以这种方式形成的创伤性木材很容易与正常木材区分开来。外伤性木材通常表现为畸形的管状成分和纤维,木质化模式改变,并有高比例的实质细胞。这些元素的方向也经常被扭曲[9,10.,11.,12.],可能是由于荷尔蒙助焊剂改变,也是改变的机械信号,如Chano所示等.[9].这种混乱的木耳意味着水和养分转运的显而易见的缺点[10.].在针叶树,特别是松科,创伤木材也呈现非常高比例的树脂管,如所述雪松libani[13.],落叶松属蜕膜[14.,15.],挪威云杉[15.,16.],Pinus nigra.[17.] 或者Pinus Pinaster.[18.].实际上,创伤树脂管道的形成是传统树脂剥削的基础,过去对于几种地中海松树而言,通常常见,并且在过去几年中越来越令人利益[18.].
由于植物不更新次生木质部,而是产生新的木质部薄片,年复一年地离心式地,创伤性木质部也保留在受损的枝或茎中,在木材上留下一个“伤疤”。这些疤痕已经被证明是非常有用的,例如,在树木年代学研究中[15.,19.].然而,从技术的角度来看,创伤性木材呈现出不受欢迎的特征。虽然由于树脂含量的增加而增加的密度可以改善木材的某些机械质量,但它也会在加工和钝化时造成问题[20.].此外,无序和不适当形成的创伤性管胞也有助于改变木材的物理力学性能。因此,木材经销商将创伤性木材视为一种缺陷,降低了具有重要伤痕的木片的价格,降低了其适用性。
一些工作集中在针叶树的创伤对木材发展的后果:早-晚木材比,环宽,创伤树脂管道的形成(f.i., [10.,21,22,23,24]),并在愈合过程的描述其他几个从一个角度解剖点[9,25,26,27].然而,尽管在不同的高管(f.i.,[4,28,29,30.,31]),该过程较少在裸子植物中研究,大多数作品在创伤性,昆虫攻击或真菌感染的情况下专注于创伤树脂管道的诱导[32,33,34,35].在这项工作中,我们专注于裸子植物创伤性木材形成的分子基础,p . canariensis以其非凡的愈合能力而闻名。为此目的,我们在茎中进行了深伤p . canariensis树木,影响血管结合,并在愈合过程中评估了转录组曲线和创伤性木材生长。
结果与讨论
鉴定伤害诱导和压抑的基因
为了分析爪区中的转录组反应并将木瓜区分开在松树茎中的深伤的边界中,我们杂交了一种60K双色cDNA微阵列(Agilent,USA),包括所涉及的基因p . canariensisXylocyesis [36].样本收集三个日期在伤口反应:伤害我)H1收集七天后,ii) H2后75天,当创伤木的发展是显而易见的,而伤口区域以外的树木还形成早材,最后受伤iii) H3 92天后,当树木已经形成晚材。在离创面较远的枝条上,在相同的采样日期采集每个样本的对照,以区分创面反应引起的局部效应与营养季节基因表达的结构性变化。
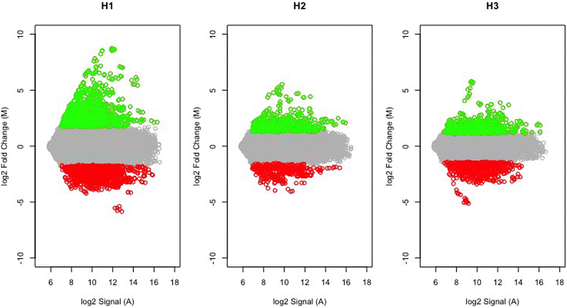
数字1显示在每个采样点被选择为过表达和过表达的基因的分布。我们鉴定了1408个差异表达基因(DEG),这些基因与正常木材形成相比显著过表达或受抑制。表格1显示了91个具有最强反应(诱导或抑制)的deg,按照它们可能相关的功能过程分组,根据它们最高的BLASTx打击,如前所述[36].(附加文件的完整表格可以在辅助表中找到1).
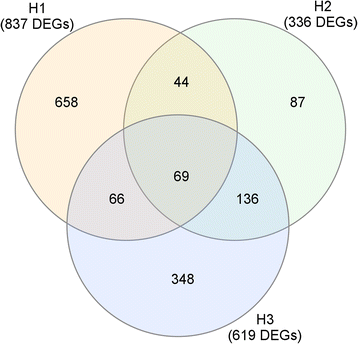
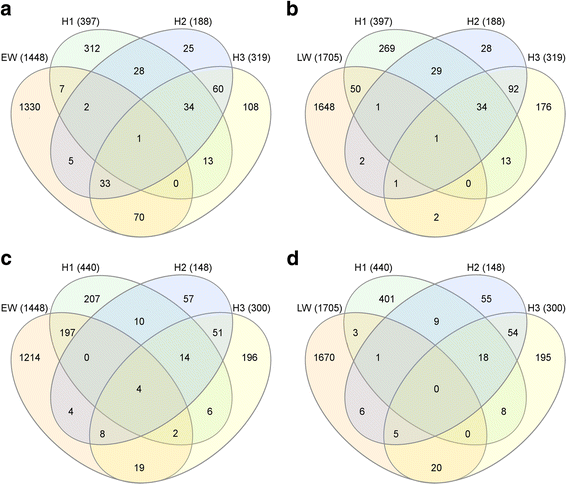
即时反应H1包含837个DEGs;H3检测到619个DEGs,而H2仅检测到336个DEGs。在三个采样日期,H1, H2和H3,只有69个基因被确定为DEG。此外,只有87个基因被鉴定为H2专属的DEGs,而348个基因被鉴定为H3专属的DEGs,高达658个基因被鉴定为H1专属的DEGs(图2)。2).
DEGs的富集分析表明,在生物过程(BP)范畴中,“防御反应”、“应激反应”和不同形式的“刺激反应”等类别的mRNA水平都有所增加,如“对非生物刺激的反应”或“对生物刺激的反应”等。此外,在分子功能(MF)范畴中,富集了“核酸结合转录因子活性”和“序列特异性DNA结合转录因子活性”;在细胞成分范畴中,富集了“细胞外区”、“细胞壁”、“细胞外周”和“外部封装结构”的氧化石墨烯术语。
分层聚类的DEGS
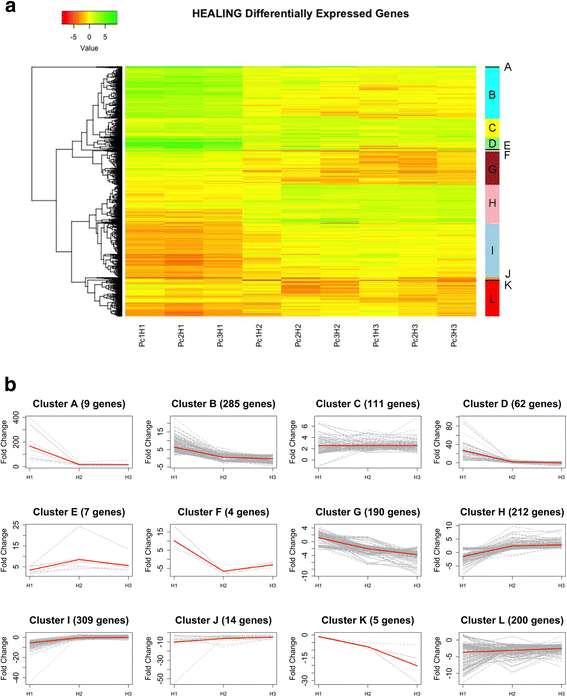
根据在H1, H2和H3中检测到的DEGs的转录模式,建立了12个簇。3.).
簇A包括在H1上清楚地诱导的基因,但在H 2和H 3期间保持高转录水平,尽管在次要程度上。在簇B,D和F中包含的基因在H1中也过表达,但后来在其转录水平下降,甚至在H 2和/或H3处抑制。簇C中的基因显示在整个三个阶段的微弱过度表达,而簇E和H显示H2和H3的越来越表达。相反的图案被簇g和k反射,在H 2和H3时抑制增加。簇中的基因I在H1上显示出显着的抑制,然后在H2和H3的正常水平恢复转录。最后,簇j和l的特征在于三个阶段的一般镇压。
样本的聚类显示了生物重复之间的一致性,如图所示(附加文件)2).在H1中收获的样品聚集在一起并与其他采样日期分开;在它们的侧面,H2和H3样品包含在同一组中。轻微的不规则性(例如,样品PC3H2比另一个H2的样品更接近H3样品)可能是由于树木之间的遗传变异性。如下所述,该结果支持在对伤害的响应中的两个主要相(H1和H2 / H3)的分化。
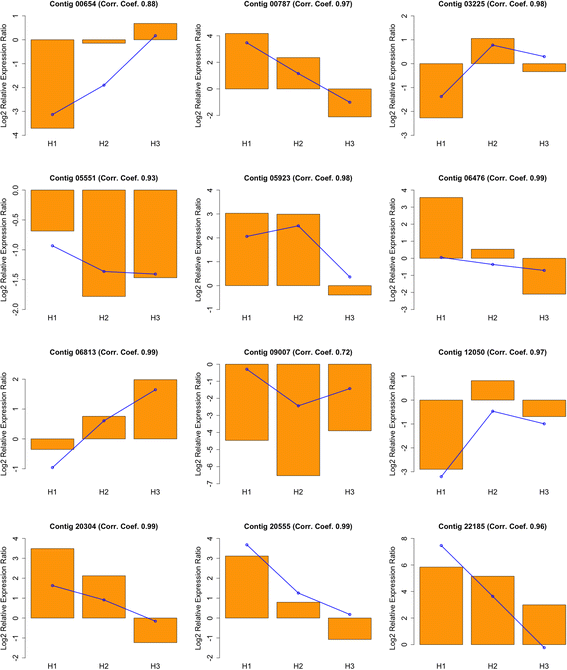
为了验证从微阵列杂交中获得的转录概况的可靠性,我们选择了12个基因用于qRT-PCR分析,覆盖上述主倾向和基因的推定的功能。因此,我们选择三种基因直接参与细胞生长和细胞壁形成,如棒曲(重叠群03225,簇1H),一个CESA样(重叠群00654,簇L)和一个义-CCoAOMT(重叠群06476,簇G),转录因素也涉及xylogenesis,作为MYB46样(重叠群12050,簇L),一个WOX4样(重叠群06813,簇1H),一个bHLH35样(重叠群05923,丛集C)ATHB13状的(重叠群20304,簇B),一个NAC2样(重叠群00787,簇B),和一个WRKY51样(重叠群05551,簇L)。最后,我们还分析了基因编码一个PAL蛋白(重叠群20555,簇B),涉及水杨酸生物合成和推测有关国防,一个绪论样蛋白(重叠群09007,簇G),大概是参与细胞增殖,和主要变应原保诚AR1样(重叠群22185,簇A),推定参与防御反应。
通过QRT-PCR获得这些基因的谱与从微阵列杂交中获得的曲线,具有高相关系数,从而验证上述微阵列分析的一般趋势(图。4).
对差异表达基因(DEGS)的转录模式的详细分析导致对伤害响应的两个主要阶段的鉴定。
H1。即时响应
转录程序的完全重新排列为立即对伤害的反应进行。在H1,检测到涉及早期木材正常发育的基因的一般镇压。特别是,与共同性活性,细胞分裂或细胞壁的合成有关的基因表明其转录水平显着降低。这与解剖学观察一致:Chano等等。[9]描述了响应近期伤口何时停止驼齿活性,并且在伤口后未在大约4周内进一步检测到爪区的生长。相反,在这一点上显着诱导了对抗压力(包括生物应力)进行防御的许多基因,作为针对感染伤口的机会理性病原体的防御。值得注意的是,据报道,许多这些基因在晚木形成期间展示了正常的Xyloysis中的转录物最大值[36].在其他物种中还报道了与鉴别晚木的应力和防御过程相关的基因的表达。例如,Mishima等.[37]描述从山地区获得的“生长簇的停止”和区分木耳的丰富“防御机制基因”日本柳杉粳稻在正常的木材形成后期,这些基因可以作为一种预防性防御,防止假定的病原体在休眠前感染树木,因为休眠可能会妨碍在冬季表现出诱导的反应。随后,分化良好的晚期木材构成了一个屏障,防止可能在冬季发生的最终感染,正如CODIT(树木腐烂分区)模型所描述的[38].
因此,在参与细胞壁发展通常在早期木材发育中过度表达,我们可以发现H1受到抑制转录因子如HD-ZIP III类家族成员ATHB15-like或MYB46-like转录因子,被报道参与细胞的细胞壁生物合成拟南芥[39]分别包括在簇I和L中(图。3.).其他直接参与细胞壁生物合成并在这一阶段受到抑制的基因包括一些CAZymes (f.i, Contigs 03231, 11436, 13611, 19457, 00766, 08356), COBRA或KORRIGAN内切葡聚糖酶(Contigs 01405,或10173),以及一个CCoAOMT (Contig 02447),参与木质素生物合成和沉积。此外,还发现水稻NAC29转录因子(Contig 13895)的同源基因在H1位点被局部诱导(FC=22.81)。此前有报道称,这种基因参与了加那利岛松树正常的晚木材发育[36]用调用的纤维素合酶样蛋白共表达,始终如一的是其报告的米饭中CESA的激活剂[40].而在H1中未发现明显的CesA诱导。这一事实可能是由于在这一点上观察到MYB546的抑制,MYB546是CesA的另一个激活因子[39].另外,NAC29也可以参与与伤口应激相关的其他途径,而不仅在纤维素的合成中,而且在H1中没有未检测到生长。实际上,已经描述了该基因涉及对高盐度和面包小麦干旱引起的应力的反应[41].
相反,在H1显著过表达的基因中,我们可以发现与氧化应激、水解酶和激素信号有关的基因。氧化应激是机械损伤和感染的主要影响之一。细胞裂解导致过氧化氢的产生,这对于病原体有毒,而且对植物细胞进行毒性,引发过敏反应[42].然后对ROS(反应性氧物质)排毒诱导过氧化物酶[43,44].有趣的是,除了它们对病原体的反应[45,46]过氧化物酶也参与木质素生物合成和芬化[47,48,49].虽然有些氧化酵素被压抑在H1,几叠连群编码不同亚型的peroxidase12-like蛋白过表达此时(f.i, Ppnisotig 01747 FC值为97.76,集群D)。同样的,其他基因参与氧化应激诱导在这个阶段,重叠群03079 (B组),推测为参与谷胱甘肽解毒作用的乳酸谷胱甘肽裂解酶的编码[50以及对干旱和寒冷胁迫的反应[51].以相同的方式,谷胱甘肽-S-转移酶(在簇D中发现的PPNISOTIG 06171)或硫氧嗪(CONTIG 09180,Cluster B),也参与抗氧化植物防御[52],在H1也过表达。
在这个阶段,另一组重要的基因是编码水解酶攻击病原体细胞壁。其中在A群中发现了与抗病应答蛋白PI206同源的Contig 18804和Ppnisotig 13431Pisum一,其中是接种后诱导的腐皮镰孢霉菌[53,54].以相同的方式,并且在簇A中,推定的PR-4样蛋白CONDIG 22375,PPNISOTIG 13133和CONTIG 19053在H1(分别为343.24,206.36和96.55的FC值)。首先描述PR-4蛋白Solanum Tuberosum.[55,又被命名为win-1和win-2,意思是“伤口诱导基因”。在Capsicum Chinense.L.,PR-4发现在应力条件期间在细胞外空间中具有RNase和DNase活性[56].其他推定的PR4样蛋白质,具有内切酶活性[57,如Ppnisotig 08058和Ppnisotig 00751,也在H1位点诱导,并在聚类d中发现。该聚类还包括其他几丁质酶,如几丁质酶a样蛋白(Contig 21216, Contig 10307和Contig 00126)和几丁质酶1样蛋白(Contig 23442)。在A群中也发现了一个主要的过敏原pru ar1同源(Contig 22185),在H1位点强烈诱导(FC 138.29)。该蛋白首次在李属armeniaca在成熟过程中被注释为致病相关蛋白[58].在簇G中发现的PPNISOTIG 12265对应于引用的抗微生物肽1,其广泛存在于生物体中,并且具有抗真菌和抗菌性能[59].最后,我们还可以提到Contig 00602(群集B)和Contig 17617(簇D),编码两种防御素,植物中最丰富的抗微生物肽,参与与国防相关的过程,生物应激反应和植物发育[60],也据报道,在正常晚木分化期间表达p . canariensis[36].
在伤害植物后的第一阶段显示出广泛的激素信号.例如,分别包括在簇B和C中的CONTIG 00715和PPNISOTIG 12073分别用于载有1-氨基环丙烷-1-羧酰胺氧化酶(ACO)蛋白,其涉及乙烯的合成,已知参与不同的应力 - 和与国防相关的流程[61,62].
已知茉莉酸(JA)在本地触发复杂的信令网络,通过Systemin肽激活伤口诱导的基因的表达,并系统性地激活伤口诱导的基因的表达[63],由乙烯介导[64].但是,我们尚未检测到与JA生物合成相关的任何DEG。在这项工作中使用的限制标准来选择Degs可以考虑此结果。另外,据报道,通过乙烯生产的局部抑制JA依赖性途径拟南芥[65,其中还描述了另外一个独立于ja的路径的存在。这也可能是Pinus canariensis。
两个编码水杨酸结合蛋白2-like (SABP2-like)蛋白的基因在H1 (Contig 03482,聚类B)和H1和H2 (Contig 14053,聚类D)过表达。这些蛋白通过其水杨酸(SA)刺激的脂肪酶活性参与植物免疫应答[66].SA也参与了植物病因相关基因的表达[67],和被认为是拮抗JA [的68],阻止其合成[69,70].这也与本研究中未检测到与ja依赖的创伤反应通路相关的DEGs相一致。
几个non-annotated H1基因差异中显示高水平的过度,特别是63年集群度B,集群11 D,尽可能多的度有关国防和压力上面所提到的,在集群和2 F (f.i重叠群09209,22448或24621 B,在集群重叠群23569,22397或19474 D,在集群使用FC值超过20,或叠连群03012和03111 F)。此外,其他non-annotated度被压抑在H1,主要分为集群我(86度,FC值低于-10重叠群02729,13781,19504和16419年),和L(30度,与FC值接近-10重叠群10360,12514或14477)。此外,在与h1相关的基因中还可以发现其他注释较差的基因。例如,Contig 03506在H1处被强烈诱导,FC值为63.88,在H2和H3中保持过表达。该序列被注释为在clubmoss中预测的假想蛋白SELMODRAFT_115352的同源性Selaginella Moellendorfii.[71.].此外,其他注释较差的显著contigs包括:预测的H1 FC值为24.06的Contig 20761(聚类D)和预测的H1 FC值为-10.94的Contig 34794(聚类L),注释为与鹰嘴豆非特征蛋白LOC101509257同源[72.].
H2/H3:外伤性木材的发展。
Chano.等等。[9]描述了创伤性木质部的明显形成开始于创伤后4周。因此,我们在创伤(H2)后11周收集了创伤木材样本,在愈合边界可见创伤生长。那时,早期木材还在形成[36].两周后,当树木已经在鉴别晚期木材时36],另在独立创伤(H3)处采集创伤木材样本。
正如预期的那样,在第一阶段之后,其特征在于,通过增长的停止和通过防御基因的表达,在伤口边缘和创伤性木材的发育方面处于明显的情况下,爪活动显而易见。始终如一地,与...有关的基因细胞增殖和细胞壁生物合成表达。因此,H2和H3之间的转录模式更相似,而与H1的转录模式更不同。
虽然在胶水形成期间涉及Xyloyesis的大多数基因不会改变它们的正常转录图案,因此在H 2或H 3时未被检测为DEG,但是在这些相时,早期木形成的几个基因的特征在这些阶段过表达。这是CONTIG 06813(簇H)的情况,用于WOX4样转录因子的编码。WOX4属于Wuschel相关的Homeobox(Wox)家族,这参与了顶端拍摄组织中心的差异化[73.],在原形成层和形成层生长中起作用,在维管束发育中起作用[74.,75.]并且在胚胎发生后的根部和芽分泌中的干细胞氏菌属的扩散调节[76.与CLAVATA (CLV;[77.])。此外,CLAVATA3样蛋白(CLV3)的同源被发现在H3被诱导,以及(重叠群14178,簇1H),响应于组织再生和创伤性木材发育期间伤人及分生组织活性表明类似的组合的作用。在the same way, homologues of two expansins (Contigs 03225 and 18811), two KORRIGAN endoglucanases (f.i., Contigs 18777 and 10173) or several CAZymes (f.i., Contigs 00603, 13281, 09907, 05424, or 05066), typically expressed during early wood formation inp . canariensis[36],在H3处过度表达,当晚木已经区分在茎的其他部位。相反,其他辛酶(Contigs 01916,17013或21865)或纤维素合酶(Contig 15857),通常在晚木形成期间表达p . canariensis[36,在H2和H3下受到抑制,与早期木材诱导的CCoAOMT (Contig 06476)相同,CCoAOMT在木质素生物合成中起关键作用。图中总结了推测的早、晚木材基因在H1、H2和H3中的抑制和过表达。5.
这些结果与解剖学观察一致。如图1所示。6在受伤后18个月的创伤木材中观察到早期和晚木之间的明显差异。相反,在这个创伤木材中出现了大量的树脂管道,如Chano报道等[9].因此,已检测到与树脂合成有关的几个基因在H 2和H 3处被检测为过度抑制。油树脂是针对病原体的主要针叶树防御之一,避免了感染的传播。在该工作中,我们检测到在H3诱导的单α和二萜中分别编码聚苯基二磷酸合酶和甲苯基甲基二磷酸二磷酸二磷酸合酶(ContIG 03270和PPNISOTIG 10634)的DEGS。以相同的方式,在同一群体中,在H3的过表达出现CONTIG 08417,编码阿哌替亚酚/前一种氧化酶样蛋白,其催化Diterpenol生物合成中的几个氧化步骤[78.].编码(-)-莰烯三环烯合成酶样的Contig 13499在H3也被诱导,出现在簇c中。该单萜合成酶参与不同单萜的合成,如莰烯、三环烯、柠檬烯或月桂烯[79.].
在H2/H3条件下也出现了几个可能参与乙烯合成的基因,尽管这种激素应该在反应的第一步起作用[62].这是ACS(1-氨基环丙烷-1-羧酸合成酶)或ACO(1-氨基环丙烷-1-羧酸氧化酶)的情况。例如,在云杉和道格拉斯FIR中,发现多个ACS基因和单个ACO基因在对伤口的立即响应期间被诱导[80].相反,我们发现在整个应答过程中(从H1到H3)有多个ACO基因过表达,如cong 00524 (C组)和cong 16100 (I组)p . canariensis相比Picea.和Pseudotsuga,这可能与加那利岛松的有效愈合响应有关。
相反,许多其他的转录水平防御基因当晚木在树的其他部分形成时,在H1中过表达降低到正常水平的H2/H3,甚至在H3中受到抑制。在晚红木形成过程中,防御基因被表达,如先前报道的p . canariensis[36] 或者C. japonica.[37].这些基因的该组成型上调可以考虑针对创伤木材形成检测到的相对较低的表达水平。这是在H1诱导的两个HSPRO基因(CONTIGS 02906和19857)的情况,并且与线虫电阻相关,或者诺霉素(CONTIG 12353),可能参与植物微生物相互作用,其显示H2 / H3的较低的转录水平愈合边框比对照。
如前所述为立即响应,在H 2和/或H3下,其他非注释的液体显着过表达。因此,26个非注释的末端包括在簇C中,并且在簇H中含有80个。例如,CONTIG 21346,H2和H3中的FC值超过7,或CONTIG 12627,H2和8.62中的FC值为4.42在H3)。Important numbers of non-annotated sequences were found in clusters G and L, where 58 and 70 DEGs, respectively, showed underexpression for H2 and/or H3 (f.i., Contigs 20076, 23934 or 24690 in cluster G were strongly repressed at H3, with FC values close to -10, or Contigs 14134 and 20478, repressed for H2 and H3 with FC values from -9.5 to -3.12 and from -5.43 to -2.76, respectively). As well, some poorly annotated contigs were remarkably repressed. For instance, Contig 02798 (cluster L) and Contig 12685 (cluster G), homologous to uncharacterized LOC101210414, and LOC101213469 fromCucumis巨大成功[81.[分别显示出H3的-5.06和-6.43的Fc值。
结论
伤口诱导钳子区的转录程序完全重新排列,接近伤害。特别地,可能参与木膜发育的相当大量的基因,响应于伤口和愈合期间,转录模式改变。
在第一个实例中,在伤口附近停止径向生长,并且诱导了一整套与生物应激相关的防御基因,作为对机会主义病原体的障碍。有趣的是,一些这些基因也据报道,优先在区分后木材中优先转录。后来,凸轮活动在伤口的横向边界中恢复,甚至比茎的其他部分更高的速率。这种快速增长,这取决于树的一般健康和储备,最终导致颈部环的伤口和恢复的完全愈合。解剖学上,我们在伤口后18个月内形成的创伤木材中没有检测到早期和后期木材之间的明确造影。在此期间,大多数优先在正常晚木发育期间表达的基因不会改变它们在Chano中描述的表达模式等等。[36].然而,有一部分基因显示它们的转录水平因伤口和愈合而显著改变。其中,值得注意的是参与细胞壁形成的基因的存在。因此,正常木材形成后期过表达的CAZymes和纤维素合成酶的编码基因在创伤木材中相对受到抑制。相反,早期木材典型的类似基因在创伤木材中保持高转录水平,即使在晚期木材形成的时刻。相反,参与木质素生物合成的早期木材CCoAOMT在创伤木材中也受到抑制。这些基因和许多其他尚未注释的基因一起,在愈合组织中显示出类似的修饰转录模式,可能是创伤木材异常特征的基础。同样,我们也不能抛弃其他由于本研究使用的限制性标准而未被检测为DEG的基因,这些基因仍可能在伤材形成过程中发挥重要的生物学作用。
我们的研究结果表明,在针对最终病原体的防御分子合成后树,一旦在伤口边界处恢复,产生快速生长的创伤木材。这种组织,其中每年的戒指都没有明确区分,至少第一年可能对预防性屏障比正常晚木的预防障碍较低,但它呈现出高比例的树脂管道,也提供了一种好方法在最短的时间内愈合伤口。需要进一步调查来澄清这一点。
方法
植物材料及伤害
我们用了3Pinus canariensis.树,5岁。松树在温室中种植,使用650毫升的锥形容器与3:1 (v/v)泥炭:蛭石。第一年之后,树木被转移到UPM设施的试验园土壤中,并在环境条件下生长。在试验开始时,树高约2米,基部直径7-10厘米。使用无菌手术刀,我们做了两个伤口,从一个10厘米高、覆盖茎周长一半的矩形窗口中去除树皮、韧皮部、维管形成层和第一行木质部。7).伤口在杆的相对侧上并用约3伤口高度的间隔执行。
收集样品,根据所描述的季节生长和愈合图形的种类[先前描述的9,36创伤于4月9日进行th,形成层活动正在进行。一周后,我们从两个伤口的伤口边缘收集了一组组织(H1);此时,第一个创伤组织的形成是可以预料的[9].6月25日th当随着伤口边缘的爆炸物出现时,在早期的木制发育期结束时,我们将在每棵树(H2)的一个伤口的边缘中收集生长的组织。后来,7月9日th,与晚熟木材发展期相一致[36[我们在剩余的伤口框架中收集厚的Calous组织(H3)。
对于每个样本,在相同的采样日期,从离创面较远的分支采集对照,以区分创面引起的营养生长的转录组变化。对照标本的组织包括树皮、韧皮部、维管形成层和最外层的木质部。采集的样品单独处理,立即在液氮中冷冻并保存在-80°C。
RNA分离和测序
采用CTAB-LiCl沉淀法从每个样品中分离总RNA [82.],用RNeasy Plant Mini Kit (Qiagen, CA, USA)纯化。使用Nanodrop模型ND-1000 (Thermo Scientific, MA, USA)测定每个样品的总RNA数量,使用Experion生物分析仪(Bio-Rad, CA, USA)检查RNA质量。
生物芯片分析
参与分生组织活动的一组15266个contigsPinus canariensis.从上一个工作中选择[36],用于设计双色60K微阵列(Agilent,USA)。此外,我们添加了来自其他cDNA文库的2303个葡萄片P. Pinea.,来自松基因指数数据库的遗漏松树的日期和序列(http://www.mgel.msstate.edu/dna_libs.htm).对于每个COLIG,在载玻片上设计并发现了一个60bp长探针并察觉了至少3次。设计探头杨树将公共数据库中可用的小鼠和人类ESTs作为阴性对照。
对于每个采样点(H1,H2,H3),在制造商(Agilent Technologies,CA,USA)提供的双色协议之后,三种生物复制杂交(伤口与控制),并且通过Genepix捕获图像使用Genepix软件(Axon,CA,USA)量化4000B(Axon,CA,USA)和斑点。微阵列数据上传到NCBI的基因表达式Omnibus,可通过Geo系列登录号GSE102275访问(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=gse102275).
背景校正和表达数据归一化使用LIMMA(微阵列数据线性模型;[83.])。对于局部背景校正和归一化,分别采用LIMMA中的“normexp”和“loess”方法。为了在数组之间实现相似的分布和数组之间的一致性,使用中值-绝对值作为规模估计值对对数比值进行缩放。
非参数算法“等级产品”,可用作r中的Biocumond的包装84.,85.,86.,用于差异表达基因(DEGs)的评价。这种方法检测的基因在许多重复实验中始终排名高,而不依赖于它们的数值强度。结果以表格的形式提供P根据错误发现率(FDR)调整,错误发现率的定义是一个给定基因在观察位置上的概率。
选取FC大于2、小于-2且FDR显著性水平低于0.05的探针作为差异表达。因此,每个contig将技术重复合并为一个值,并创建一个由所选差异表达基因(DEGs)的实验和对照测量值的比率组成的数据矩阵,包括采样时间和生物重复。在R中进行聚类,并使用热图绘制热图。gplot包的功能[87.].使用Blast2GO v.2.7.2对DEGs进行富集分析。
中存在的验证
使用用于微阵列杂交的相同RNA,通过QRT-PCR确认覆盖从微阵列获得的主要曲线的12°的表达模式。使用Superscript TM III逆转录酶(Invitrogen,USA)在制造商的指示和使用4μgR的总RNA和随机六烷烃中进行第一链cDNA合成。基因特异性引物设计成12个选定的DEG(表2)使用Primer3软件[88.],熔融温度在60至65℃之间,产生80至120 bp之间的扩增子。qRT-PCR was performed in a CFX96™ Real-Time PCR Detection System (Biorad, USA), using the SsoFast™ EVAgreen® Supermix (Biorad, USA), according to manufacturer’s protocol, and following the standard thermal profile: 95° C for 3 min, 40 cycles of 95° C for 10 s and 60° C for 10 s. In order to compare data from different qRT-PCR runs, the CT values were normalized using the Ri18S as housekeeping gene, whose specific primers were FW 5’-GCGAAAGCATTTGCCAAGG-3’ and REV 5’-ATTCCTGGTCGGCATCGTTTA-3’. This genes has been previously proved to be useful for this purpose in pine species (f.i., see Perdiguero et al. [89.])。然后使用对每个DEG的PCR效率校正的DELTA-DERTA-CT方法获得表达比率[90.].
参考
- 1。
Birnbaum Kd,Alvarado为。跨国公司切片:植物和动物的再生。细胞。2008:697-710。
- 2.
Sugimoto K,Gordon Sp,Meyerowitz em。植物和动物的再生:消除,转移,或只是分化?细胞生物学的趋势。2011年:212-8。
- 3.
Sánchez Alvarado A, Yamanaka S.重新思考分化:干细胞、再生和可塑性。细胞。2014:110-9。
- 4.
王旭,刘海英,王旭。器官再生不需要功能性的干细胞生态位。大自然。2009;457:1150-3。
- 5.
塞纳·G,伯恩鲍姆·KD。为重建而建:寻找植物再生的组织原则。《遗传学与发育》,2010:460-5。
- 6.
Stobbe H.活椴树剥皮后表面愈伤组织的发育阶段和精细结构(蒂利亚sp)。安机器人。2002;89:773 - 82。
- 7。
庞Y,张健,曹Ĵ,尹SY,他XQ,崔KM。树皮再生过程中从不成熟细胞木质部韧皮部在转后环剥杜仲摘要采用。J Exp Bot. 2008; 59:1341-51。
- 8。
张静,高刚,陈建军,泰勒格,崔昆,何新强。树皮环化后次生维管组织再生的分子特征杨树.新植物。2011; 192:869-84。
- 9。
Chano V, López R, Pita P, Collada C, Soto Á。轴向薄壁木质部细胞的增殖是环茎创面闭合的关键步骤Pinus canariensis..BMC植物BIOL。2015; 15:64。
- 10.
Arbellay E,Stoffel M,Sutherland Ek,Smith Kt,Falk Da。北美针织品火灾瘢痕中的颅内和光线特征的变化及其生态学意义。Ann Bot。2014; 114:223-32。
- 11.
苏格兰Zajaczkowska U.再生PINE受伤后的茎。IAWA J. 2014; 35:270-80。
- 12.
杜布拉斯冷杉(pseudotousuga menziensii再生组织的残肢作为细胞排序和组织重组的一个例子。足底。2014;240:1203-11。
- 13.
陈志强,陈志强,陈志强,等。创伤性和生长性物质对创伤性树脂管道发育的季节性影响雪松libani.新植物。1979; 82:537-44。
- 14.
Bollschweiler M, Stoffel M, Schnewly D, Bourqui K.创伤性树脂导管落叶松属蜕膜被泥石流影响的茎干。树杂志。2008;28:255 - 63。
- 15.
Stoffel M.使用带切向性的创伤树脂管道的地貌过程。树脂结构。2008;26:53-60。
- 16.
挪威云杉(Pinaceae)茎的创伤诱导树脂管发育:解剖和细胞化学特征。Am J Bot. 2000; 87:302-13。
- 17.
刘志强,刘志强,刘志强,等。松脂接种对松脂导管和松脂流动的诱导作用Sphaeropsis sapinea和Dupidodia scrobiculata..Planta。2005; 221:75-84。
- 18。
Rodríguez-garcíaa,lópezr,martínja,小植物f,Gil L.树脂产量Pinus Pinaster.与树树枝状系统,立体密度和攻丝引起的Xylem解剖学的系统变化有关。对于ECOL管理。2014; 313:47-54。
- 19。
Stoffel M, Klinkmüller M.机械损伤后针叶树解剖反应的3D分析:来自x射线计算机断层成像的首次定性观察。树木。2013;27:1805-11。
- 20.
García-Iruela A, Esteban L, de Palacios P, García-Fernández F, de Miguel Torres Á, Vázquez-Iriarte E, Simón cPinus Pinaster.AIT .:物理机械性能。生物资源。2016; 11:5230-41。
- 21.
Gärtnerh,海因里希I.形成树脂管道的创伤行落叶松属蜕膜和挪威云杉(松科)作为休眠季节伤人实验的结果。IAWA J. 2009; 30:199-215。
- 22.
Schneuwly DM,Stoffel M,Dorren LKA,Berger F.欧洲针叶粉机械干扰解剖学生长反应的三维分析。树生理。2009; 29:1247-57。
- 23。
骨痂组织的形成和扩散和切向排列的树脂管落叶松属蜕膜和挪威云杉在落石的影响。树杂志。2009;29:281-9。
- 24。
Ballesteros ja,Stoffel M,Bodoque JM,Boldschweiler M,Hitz O,Díez-Herrero A.树木解剖中的变化Pinus Pinaster.ait。在闪蒸洪水伤害之后。树圈res。2010; 66:93-103。
- 25.
Mullick DB。针叶树树皮坏死表皮形成的一种新组织。Can J Bot. 1975;53:2443-57。
- 26.
健康和衰退银冷杉树皮的创伤反应(冷杉属阿尔巴).IAWA j . 1994; 15:407-15。
- 27.
烤箱P,针叶树伤人的形成层区的托勒N.响应。植酮,安。REI博特。1999; 39:133-7。
- 28.
徐建军,王志强,王志强,等。植物再生的分子框架研究进展。科学。2006;311:386-8。
- 29.
杉本,焦勇,迈耶罗维茨。拟南芥多个组织的再生通过根的发育途径发生。Dev细胞。2010;18:463 - 71。
- 30.
WAN X,LandhäusserSM,Lieffers VJ,Zwiazek JJ。信号控制aspen的根系吮吸和不定枝形成(Populus Temuloides.).树杂志.2006; 26:681-7。
- 31.
Asahina M,Azuma K,Pitaksaringkarn W,Mitsudaki,Mitsuda N,Ohme-Takagi M,Yamaguchi S,Kamiya Y,Okada K,Nishimura T,Koshiba T,Yokota T,Kamada H,Satoh S。Rap2的空间选择性荷尔蒙控制.6L和ANAC071涉及组织重租的转录因子拟南芥.中国科学院院刊2011;108:16128-32。
- 32.
Fäldt J, Martin D, Miller B, Rawat S, Bohlmann J.挪威spruce (挪威云杉):甲基己酸酯诱导的萜烯合酶基因表达,以及(+) - 3-甲烯合酶的cDNA克隆和功能表征。植物mol biol。2003; 51:119-33。
- 33.
Krookene P,Nagy Ne,Solheim H.甲基己酸甲基己酸酯和挪威云杉的草酸治疗:基于解剖学的防御反应和对真菌感染的增加。树生理。2008;28: 29-35。
- 34.
王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞,王淑霞。云杉(Sitka spruce)松脂导管发育及(-)-蒎烯合成酶基因表达。植物杂志。2003;133:368 - 78。
- 35。
叶志强,王志强,王志强,等。萜类生物合成与针叶树防御的特殊维管细胞。acta botanica sinica(云南植物学报). 2010:86-97。
- 36。
夏诺V, López de Heredia U, Collada C, Soto Á:生长期幼木形成的转录组分析Pinus canariensis..Holzforschung.2017年,AOP:1-19。DOI:10.1515 / HF-2017-0014
- 37.
三岛K, Fujiwara T, Iki T, Kuroda K, Yamashita K, Tamura M, Fujisawa Y, Watanabe A.日本雪松形成层区和木质部分化表达基因的转录组测序和分析(日本柳杉粳稻).BMC基因组学。2014;15.:219。
- 38.
分类:一个理解树木如何生长和保护自己的概念框架。植物病理学杂志1984;22:189-214。
- 39.
Zhongardson ea,ye z。MYB46转录因子是SND1的直接目标,并调节二级墙体生物合成拟南芥.植物细胞。2007; 19:2776-92。
- 40.
黄D,王某,张B,尚冠熊,石y,张d,刘x,吴k,xu z,富x,周y,胃肠杆菌蛋白介导的a。della-nac信号传导梯级调节水稻中的纤维素合成.植物细胞。2015;27: 1681 - 96。
- 41.
徐Z,Gongbuzhaxi,王C,薛楼张H,纪宽:小麦NAC转录因子TaNAC29参与盐胁迫。植物生理学生物化学2015,96:356-363,1999。
- 42.
Levine A,Tenhaken R,Dixon R,Lamb C. H2O2从氧化突发策划植物过敏性疾病抗性反应。细胞。1994年;79.: 583 - 93。
- 43.
Diehn SH, Burkhart W, Graham JS。大豆叶片中创伤诱导、发育调节的阴离子过氧化物酶的纯化和部分氨基酸序列。生物化学学报1993;195:928-34。
- 44.
Mohan R, Vijayan P, Kolattukudy PE。番茄阴离子过氧化物酶(TAP1)基因的发育和组织特异性表达。植物学报1993;22:475-90。
- 45.
Gunnar Fossdal C,Sharma P,LönneborgA.将第一推定过氧化物酶cDNA从针叶树分离和相关蛋白质的局部和系统积累在病原体感染时。植物mol biol。2001; 47:423-35。
- 46.
王杰,刘克坤,李德伟,张玉林,赵强,何玉明,龚志华。一种新的过氧化物酶CanPOD基因参与了辣椒的防御反应Phytophtora capsici抗感染和抗非生物胁迫能力。中华医学杂志。2013;14:3158-77。
- 47。
Hiraga S,Sasaki K,Ito H,Ohashi Y,Matsui H.一大族III级植物过氧化物酶。植物细胞生理。2001; 42:462-8。
- 48。
Valério L, De Meyer M, Penel C, Dunand C.表达分析拟南芥过氧化物酶多基因家族。植物化学。2004; 65:1331年至1342年。
- 49.
Passardi F, Cosio C, Penel C, Dunand C.过氧化物酶的功能比瑞士军刀还多。植物细胞代表2005;24:255-65。
- 50。
Thornalley PJ。乙醛酸酶系统的谷胱甘肽依赖性解毒α-氧氧醛:参与甘氧酶I抑制剂的疾病机理和抗增殖活性。Chem Biol相互作用。1998; 111-112:137-51。
- 51.
Seki M, Narusaka M, Abe H, Kasuga M, Yamaguchi-Shinozaki K, Carninci P, Hayashizaki Y, Shinozaki K.监测1300的表达模式拟南芥利用全长cDNA芯片研究干旱和寒冷胁迫下的基因。植物细胞。2001;13:61 - 72。
- 52.
Meyer Y,Siala W,Bashandy T,RIONDET C,Vignols F,Reichheld JP。谷氨酸和患有植物的毒素。Biochim Biophys Acta。2008; 1783:589-600。
- 53.
豌豆的抗病反应与特定mrna水平的增加有关。植物学报1985;4:81-6。
- 54.
Culley DE, Horovitz D, Hadwiger LA。抗病性应答基因DDR206-d的分子特征Pisum一(l)。植物杂志。1995;107:301-2。
- 55.
Stanford A,Bevan M,Northcote D.在马铃薯的新型伤口诱导基因家族内的差异表达。Mol Gen Genet。1989; 215:200-8。
- 56.
格瓦拉 - 拉托马,德Lacoba MG,加西亚 - 卢克我,塞拉MT。在诱导发病机理相关蛋白4(PR-4)的表征Capsicum Chinense.L3植物具有双RNase和DNase活动。J Exp Bot。2010; 61:3259-71。
- 57.
SEO PJ,Lee Ak,Xiang F,Park Cm。分子和功能性分析拟南芥致病相关基因:它们在种子萌发的盐反应中的作用。acta botanica yunnanica(云南植物研究). 2008;49:34 - 44。
- 58.
Mbéguié-A-Mbeguié D, Gomez RM, Fils-Lycaon B:杏果过敏原-、应激-和致病相关蛋白的序列(Accession No. 029529588)。U93165)。果实成熟过程中的基因表达(PGR 97-180)。植物营养与肥料学报,1998,19(4):513 - 514。
- 59。
植物抗微生物活性肽的研究。蛋白质与生物技术。2005;12:11-6
- 60。
谭太平,王胜,黄宏,谭伟林。来自植物的抗菌肽。药品,2015:711-57。
- 61。
袁某,王义,迪恩·吉姆。ACC氧化酶基因在洛利松的木材形成组织中表达(Pinus Taeda.包括一对几乎相同的谬误(NIPs)。基因。2010;453:24-36。
- 62。
Hudgins JW,Ralph SG,FranceChi VR,Bohlmann J.乙烯诱导针叶树防御:CDNA克隆,蛋白质表达和1-氨基环丙烷-1-羧酸氧化酶中的细胞和细胞和亚细胞定位在树脂管道和酚类幼儿细胞中。Planta。2006; 224:865-77。
- 63.
Rojo E,LeónJ,Sánchez-Serrano JJ。缠绕信号通路之间的串扰决定了局部对系统基因表达拟南芥.工厂J. 1999; 20:135-42。
- 64.
O 'Donnell PJ, Calvert C, Atzorn R, Wasternack C, Leyser HMO, Bowles DJ。乙烯作为介导番茄植株创伤反应的信号。科学。1996;274:1914-7。
- 65.
León J, Rojo E, Sánchez-Serrano JJ。植物的伤口信号。实验机器人。2001;52:1-9。
- 66.
库马尔d,Klessig DF。高亲和力水杨酸结合蛋白2所需的植物先天免疫和具有水杨酸刺激的脂酶活性。PROC NATL ACAD SCI。2003; 100:16101-6。
- 67.
病房E,Uknes S,威廉姆斯S,Dincher S,Wiederhold d,亚历山大d,AHL-GOY P,MetrauxĴ,Ryals J.坐标基因活性响应于代理诱导系统获得性抗性。植物细胞。1991; 3:1085至94年。
- 68.
Vidhyasekaran P.植物先天免疫中的糖酸酸信号传导。在:植物激素信号传导系统,植物先天免疫。DONDRECHT:SPRINGER;2015. p。27-122。
- 69.
Pena-cortésh,albrecht t,prat s,Wiler ew,Willmitzer L. Aspirin通过阻断茉莉酸生物合成来阻止番茄叶中的伤口诱导的基因表达。Planta。1993; 191:123-8。
- 70。
Spoel SH,Koornneef A,克拉森SMC,Korzelius JP,凡佩尔特JA,穆勒MJ,Buchala AJ,MétrauxJP,布朗R,喀山K,房龙LC,董X,Pieterse CMJ。NPR1通过调节在细胞质中一个新的功能与水杨酸盐和茉莉酸依赖的防御途径串扰。植物细胞。2003; 15:760-70。
- 71。
银行JA,西山T,周年M,鲍曼杰,Gribskov M, dePamphilis C,阿尔伯特·VA Aono N,青山T,安布罗斯英航,阿什顿NW, Axtell MJ,巴克E,巴克女士,Bennetzen杰,博纳ND, Chapple C,程C,科雷亚LGG,戴克这样M, DeBarry J,德雷尔,伊莱亚斯M, EM,埃斯特尔M, L,冯Finet C,弗洛伊德SK, Frommer WB, T Fujita et al。的卷柏基因组鉴定与血管植物的演变相关的遗传变化。科学。2011; 332:960-3。
- 72。
Varshney RK, Song C, Saxena RK, Azam S, Yu S, Sharpe AG, Cannon S, Baek J, Rosen BD, Tar’an B, Millan T, Zhang X, Ramsay LD, Iwata A, Wang Y, Nelson W, Farmer AD, Gaur PM, Soderlund C, Penmetsa R V, Xu C, Bharti AK, He W, Winter P, Zhao S, Hane JK, Carrasquilla-Garcia N, Condie JA, Upadhyaya HD, Luo MC, et al.: Draft genome sequence of chickpea (Cicer Arietinum.)为特质改进提供资源。NAT Biotechnol 2013,31:240-246。
- 73。
WUSCHEL在干细胞命运调控中的作用拟南芥射击公司。细胞。1998; 95:805-15。
- 74。
Ji J, Strable J, Shimizu R, Koenig D, Sinha N, Scanlon MJ。WOX4促进原形成层发育。植物杂志。2010;152:1346-56。
- 75.
Ji J, Shimizu R, Sinha N, Scanlon MJ。WOX4转基因的分析为WOX4基因家族在多种干细胞功能调控过程中的进化提供了进一步的证据。植物信号行为。2010;5:916-20。
- 76.
Haecker A, Gross-Hardt R, Geiges B, Sarkar A, Breuninger H, Herrmann M, Laux t拟南芥.发展。2004;131:657 - 68。
- 77.
Miwa H,Kinoshita A,Fukuda H,Sawa S.植物分生:Clavata3 / ESR相关的信令在拍摄顶端分页和根顶部分页中。j植物res。2009; 122:31-9。
- 78.
RO D-K,Arimura G-I,Lau Syw,Piers E,Bohlmann J. Loblmann J. Loblolly Pine Abietadienol / apietadienal氧化酶Ptao(CYP720B1)是多功能的多相族细胞色素P450单氧化酶。Proc Natl Acad SCI U S A. 2005; 102:8060-5。
- 79.
关键词:番茄,萜烯合成酶,基因家族,分子生物学,分子生物学,分子生物学植物杂志。2011;157:770 - 89。
- 80.
氨基环丙烷羧酸合酶是乙烯依赖诱导针叶树防御的一个调控步骤。云杉和道格拉斯冷杉多基因家族的全长cDNA克隆、差异表达及细胞和亚细胞定位。植物杂志。2007;143:410-24。
- 81.
李张黄年代,李R, Z, L,顾X,风扇W,卢卡斯WJ王X,谢B,倪P,任Y,朱H,李J,林K金W,范Z,李G,斯桃波J, Kilian, van der Vossen E G,吴Y,郭J,他J,贾Z,任Y,田G,陆Y,阮J,钱W,王M, et al。黄瓜的基因组,Cucumis巨大成功l.NAT Genet 2009,41:1275-1281。
- 82。
关键词:松树,RNA,分离,分子生物学植物生物学报告。1993;11:113-6。
- 83。
史密斯GK:线性模型和用于在微阵列实验评估差异表达的经验贝叶斯方法。Stat Appl Genet Mol Biol2004年,3:第三条。
- 84。
关键词:生物导体,差异表达基因,meta分析生物信息学。2006;22:2825-7。
- 85。
Gentleman Rc,Carey VJ,Bates DM,Bolstad B,Dettling M,Dudoit S,Ellis B,Gautier L,Ge Y,Gentry J,Hornik K,Hothorn T,Huber W,Iacus S,Irtizarry R,休息面,Li C,Maechler M, Rossini AJ, Sawitzki G, Smith C, Smyth G, Tierney L, Yang JYH, Zhang J. Bioconductor: open software development for computational biology and bioinformatics. Genome Biol. 2004;5:R80.
- 86。
R核心团队:统计计算的语言和环境。统计计算基础,2013年维也纳(奥地利)。
- 87.
Warnes Gr,Bolker B,Bonebakker L,Gentleman R,Liaw Wha,Lumley T,Maechler M,Magnusson A,Moeller S,Schwartz M,Venabes B:GPLOTS:各种R编程工具(用于绘制数据).R包版本3.0.1,2016。
- 88.
Untergasser A,Cutcutache I,Koressaar T,Ye J,Faircloth BC,Remm M,Rozen SG。Primer3-新功能和接口。核酸RES。2012; 40:E115。
- 89.
Perdiguero P,Barbero MDC,Cervera MT,Collada C,Soto A.分子反应水分胁迫在两种对比的地中海松树中(Pinus Pinaster.和松果体pinea).植物生理与生物化学。2013;67:199-208。
- 90。
Pfaffl兆瓦。一种新的实时RT-PCR相对定量数学模型。核酸学报2001;29:e45。
确认
作者感谢编辑和两个匿名裁判员,以获得有用的意见和建议。这项工作已通过项目AGL2009-10606(西班牙科学和创新部)和Spip2014-01093(西班牙国家公园,农业部)资助。VC由西班牙科学和创新部授予博士学位奖学金。
可用性数据和材料
当前研究期间生成的数据集可在NCBI'基因表达式Omnibus中获得,可通过Geo系列登录号GSE102275访问(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=gse102275).
作者信息
从属关系
贡献
CC和设计和监督实验。VC和如伤口进行并制备样品。VC进行了表达分析。vc和起草稿件。所有作者都阅读并批准了最终手稿。
相应的作者
道德声明
相互竞争的利益
作者声明他们没有竞争利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
陈志强,陈志强,陈志强,等。木质部形成的转录组分析Pinus canariensis..BMC植物杂志17,234(2017)。https://doi.org/10.1186/s12870-017-1183-3
收到了:
接受:
发表:
关键词
- 伤口
- 疗愈
- 松柏
- 转录组
- 木头
- Pinus canariensis.