- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
雌雄异株、雌雄同株和化学上雄性化的雌性花蕾的从头转录组组装gydF4y2BaCoccinia茅gydF4y2Ba揭示与性表达和性修饰相关的基因gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba17gydF4y2Ba、物品编号:gydF4y2Ba241gydF4y2Ba(gydF4y2Ba2017gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
Coccinia茅gydF4y2Ba(常青藤葫芦),是葫芦科具有异型性染色体的雌雄异株成员。植物雌雄植株的染色体组成gydF4y2Bac .茅gydF4y2Ba分别为22A + XY和22A + XX。之前我们展示了一种独特的雌雄同体形式gydF4y2Bac .茅gydF4y2Ba(22A + XX)也存在于自然界中,具有形态雌雄同体的花(GyM-H)。此外,硝酸银(AgNO)的应用gydF4y2Ba3.gydF4y2Ba)诱导雄蕊发育,形成形态上雌雄同体的花(Ag-H),尽管没有y染色体。由于基因组序列的不可获得和性别连锁基因鉴定的缓慢步伐,性别表达和修饰在生物学中的应用越来越广泛gydF4y2Bac .茅gydF4y2Ba并没有被很好地理解。gydF4y2Ba
结果gydF4y2Ba
我们对早期雄性、雌性、GyM-H、Ag-H以及中期雄性和GyM-H花蕾进行了全面的RNA-Seq研究。使用Trinity组装了一个全新的转录组,并用BLAST2GO和Trinotate管道进行注释。组装的转录组由467,233个“Trinity Transcripts”组成,聚集成378,860个“Trinity Genes”。Female_Early_vs_Male_Early、Ag_Early_vs_Female_Early和GyM-H_Middle_vs_Male_Middle比较分别显示了35,694、3574和14,954个差异表达转录本。此外,所选候选基因的qRT-PCR分析验证了数字基因表达谱的结果。有趣的是,与雄性芽相比,乙烯反应相关的基因在雌性芽中被发现上调。同时,我们观察到AgNOgydF4y2Ba3.gydF4y2Ba处理通过下调乙烯应答转录因子导致雄蕊发育来抑制Ag-H花的乙烯应答。此外,与雌花相比,雄蕊、体操- h和Ag-H花蕾中与雄蕊发育相关的氧化石墨烯含量丰富,这支持了雄蕊生长在雌花中受阻的事实。gydF4y2Ba
结论gydF4y2Ba
与雌蕊相比,雄芽和Ag-H对乙烯的抑制表明,乙烯在雄蕊抑制中的作用可能类似于甜瓜和黄瓜等雌雄同株瓜类。此外,与雄性芽相比,与花粉育性相关的GO项在GyM-H芽中期减少,这表明y染色体对花粉育性的必要性。总的来说,该研究将为进一步研究雄蕊停滞、花粉育性和AgNO提供新的性别偏向基因gydF4y2Ba3.gydF4y2Ba介导的变性。gydF4y2Ba
背景gydF4y2Ba
单性、雌雄异株和雌雄同体是开花植物中观察到的三种主要的性形式。百分之九十(90%)的被子植物是雌雄同体(雄性和雌性器官在同一朵花上),而百分之五的植物是雌雄同体(雄花和雌花在同一株植物上),其余百分之五的植物是雌雄异体(雄花和雌花在不同的植物上)。[gydF4y2Ba1gydF4y2Ba]。雌雄异株为研究性别决定的遗传基础提供了一个独特的机会。gydF4y2Ba硅宾latifoliagydF4y2Ba(石竹科),gydF4y2BaRumex acetosagydF4y2Ba(蓼科),gydF4y2Ba番木瓜gydF4y2Ba(番木瓜科),gydF4y2Ba菠菜oleraceagydF4y2Ba(藜科),gydF4y2Ba杨树gydF4y2Ba(水杨科),已被很好地表征,以了解性别决定的机制[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba]。然而,控制性别决定的分子机制和基因尚不清楚。gydF4y2Ba
Coccinia茅gydF4y2Ba(l)Voigt是葫芦科雌雄异株植物,子房下位,受到的关注相对较少。葫芦科的成员表现出多种性别形式[gydF4y2Ba6gydF4y2Ba]。除了丰富的药用价值,C。gydF4y2Ba检测结果gydF4y2Ba通常被称为常青藤葫芦,也被用作蔬菜。gydF4y2BaCoccinia茅gydF4y2Ba在不同的植株上产生雄性和雌性单性花。类似于gydF4y2Ba硅宾latifoliagydF4y2Ba(石竹科),性中gydF4y2BaCoccinia茅gydF4y2Ba是由y染色体的存在决定的[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba]。雌雄植株的染色体组成分别为22A + XY和22A + XX,其中y染色体大于x染色体[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba]。雄花由三个卷曲的雄蕊组成[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba缺少女性生殖器官;然而,雌花由三个未发育的雄蕊组成,围绕着三个融合的心皮和一个下位子房[gydF4y2Ba14gydF4y2Ba]。有两种方法可以实现单性花的发育。其中一种方式是,雄性和雌性性器官原基都在花发育的早期阶段形成,但在后期阶段,相反的性器官就会流产gydF4y2Ba硅宾latifoliagydF4y2Ba[gydF4y2Ba15gydF4y2Ba]gydF4y2Ba.gydF4y2Ba另一种方式是异性器官的器官原基根本不发育,如图gydF4y2BaThalictrum dioicumgydF4y2Ba[gydF4y2Ba16gydF4y2Ba]gydF4y2Ba.gydF4y2Ba此外,还有一些花,其中不合适的性器官保留在初级形式(而不是流产)gydF4y2BaRumexgydF4y2Ba和gydF4y2Bac .茅gydF4y2Ba[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba14gydF4y2Ba]。此外,gydF4y2BaCoccinia茅gydF4y2Ba在应用AgNO后表现出性别改变gydF4y2Ba3.gydF4y2Ba导致雌花(这种花称为Ag-H)的雄蕊发育,如我们在上一份报告[gydF4y2Ba14gydF4y2Ba]。Ag)gydF4y2Ba+gydF4y2Ba一直被认为是乙烯反应的抑制剂[gydF4y2Ba17gydF4y2Ba]。有人提出,银的结合gydF4y2Ba+gydF4y2Ba抑制乙烯受体的构象变化,使受体保持活性构象[gydF4y2Ba18gydF4y2Ba]。硝酸银(AgNO)等银化合物的应用gydF4y2Ba3.gydF4y2Ba)或硫代硫酸银(AggydF4y2Ba2gydF4y2Ba年代gydF4y2Ba2gydF4y2BaOgydF4y2Ba3.gydF4y2Ba)雄性化雌雄同株植物,如gydF4y2BaCucumis巨大成功gydF4y2Ba以及雌雄异株的雌性植物,如gydF4y2Ba硅宾latifoliagydF4y2Ba和gydF4y2Ba大麻gydF4y2Ba[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba]。然而,Ag的作用机制gydF4y2Ba+gydF4y2Ba诱导雄蕊发育至今尚不清楚[gydF4y2Ba21gydF4y2Ba]。gydF4y2Ba
尽管50多年前在雌雄异株植物中有趣地发现了性染色体,但性别决定的机制仍然知之甚少[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba]。这主要是因为从雌雄异株物种中鉴定出性别相关基因的速度很慢(每年一至两个基因)[gydF4y2Ba24gydF4y2Ba]。然而,NGS技术的改进已经开始通过加快性别连锁基因鉴定的速度来改变这种情况。基于ngs的方法有一个很大的优势,那就是它不需要事先知道要研究的基因序列。最近,一种基于ngs的RNA-Seq方法被应用于gydF4y2Ba硅宾latifolia,gydF4y2Ba这是第一份证明植物中剂量补偿现象的报告[gydF4y2Ba24gydF4y2Ba]。采用比较转录组学方法对异种木瓜进行了性别决定的候选基因鉴定。该研究鉴定出312个独特的标签,这些标签被特异性地映射到原始性染色体(X或Y)上gydF4y2BahgydF4y2Ba)木瓜的序列[gydF4y2Ba5gydF4y2Ba]。对黄瓜雌雄同株突变体(Csg-G)和雌雄同株野生型(Csg-M)的根尖组织进行了全基因组转录分析,以分离与性别决定有关的基因。这项研究揭示了参与植物激素信号通路的基因,如gydF4y2BaACSgydF4y2Ba,gydF4y2BaAsr1gydF4y2Ba,gydF4y2BaCsIAA2gydF4y2Ba,gydF4y2BaCS-AUX1gydF4y2Ba,gydF4y2Ba张力腿平台gydF4y2Ba它们之间的相声可能在性别决定中起着关键作用。作者还预测了一些转录因子的调控,包括gydF4y2BaEREBPgydF4y2Ba-9,在性别决定中[gydF4y2Ba25gydF4y2Ba]。在另一项研究中,对两个近等基因系的黄瓜花蕾进行了转录组测序,其中WI1983G是一种只生雌蕊花的雌同体植物,而WI1983H是一种只生两性花的雌雄同体植物[gydF4y2Ba26gydF4y2Ba]。本研究鉴定了两种不同性别花的差异表达基因以及推测的SSR和SNP标记。赤木,刘国强,陶志明及康梅[gydF4y2Ba27gydF4y2Ba对柿子花蕾的基因组DNA、mRNA和小RNA进行测序,鉴定出y染色体编码的小RNA,gydF4y2Ba奥吉,gydF4y2Ba靶向同源域转录因子gydF4y2Ba政府鼓励gydF4y2Ba以剂量依赖的方式调节花粉的育性。最近在花园里进行的从头转录组学研究gydF4y2Ba芦笋gydF4y2Ba鉴定出570个差异表达基因,其中涉及花粉小孢子和绒毡层发育的基因在雄性和超级雄性中特异性表达,而在雌性中特异性表达[gydF4y2Ba28gydF4y2Ba]。gydF4y2Ba
为了识别性别偏见基因gydF4y2Bac .茅gydF4y2Ba阐明AgNO的作用机制gydF4y2Ba3.gydF4y2Ba对早期雄性(M)、雌性(F)、GyM-H和Ag-H以及中期雄性和GyM-H花蕾进行了全面的RNA-Seq研究。重新组装转录组进行鉴定gydF4y2Bac .茅gydF4y2Ba各种花发育基因的同源物。通过数字表达谱分析,我们确定了可能在抑制雌花雄蕊发育中起关键作用的性别偏向基因,以及在AgNO作用下促进雌花花药发育的基因gydF4y2Ba3.gydF4y2Ba雄花花粉育性的处理及控制基因。gydF4y2Ba
方法gydF4y2Ba
花芽采集及RNA分离gydF4y2Ba
野生型雄性、雌性和雌雄同株(GyM)形式的克隆gydF4y2Bac .茅gydF4y2Ba在印度浦那的试验田种植。雌雄同株(GyM)植物有雌蕊花(GyM- f)和雌雄同体花(GyM- h)(植物标本馆凭证:特里普拉大学校园,Karmakar, 433)。叶面喷35毫米AgNOgydF4y2Ba3.gydF4y2Ba根据我们之前的观察,在一些雌性植物的基叶上的溶液导致两性花(Ag-H)的发育[gydF4y2Ba14gydF4y2Ba]。Ag-H花蕾形态与GyM-H花蕾相似。雄性(M)、雌性(F)、GyM-H和Ag-H的花蕾分别在液氮中收获,根据我们之前的研究分为早期和中期[gydF4y2Ba14gydF4y2Ba(图。gydF4y2Ba1gydF4y2Ba)。在早期雄花蕾中,只有雄蕊存在,没有心皮首字母的迹象。然而,早期雌花(3-4期,图3)gydF4y2Ba1gydF4y2Ba)同时具有心皮和雄蕊原基。雌花的雄蕊生长在4-5期左右停止。在雌雄同株植物的雌雄同体花中,雄蕊和心皮在发育的早期和中期同时发育。我们选择了早期花蕾,以便分析雌花中雄蕊抑制的事件。而选择中期花蕾则是为了研究减数分裂期和花粉成熟事件。按照制造商的说明,用TRIzol试剂(Invitrogen)分离总RNA。采用Agilent生物分析仪RNA纳米芯片评估RNA质量,采用RIN > 8.0的RNA样品进行文库制备。gydF4y2Ba
RNA-Seq文库制备及测序gydF4y2Ba
文库制备在gentypic Technology的Genomics设施进行,班加罗尔,使用Illumina TruSeq RNA样品制备试剂盒,根据制造商的规格。前期雄芽(M)、雌芽(F)、GyM-H和Ag-H花蕾以及中期雄芽(M)和GyM-H花蕾的RNA测序文库一式两份。使用Agilent高灵敏度生物分析仪芯片评估所有12个文库的质量和插入物大小分布。文库在250 ~ 1000 bp范围内出现峰值。有效测序插入片段长度为130 ~ 880 bp,插入片段两侧有接头,接头总长度为120 bp。使用Qubit对文库进行定量,并在Illumina NextSeq 500平台上进行测序,产生2 X 150个核苷酸配对的末端reads。本研究产生的RNA-Seq数据已存入NCBI SRA研究SRP111347中。gydF4y2Ba
Illumina reads的预处理和从头转录组组装gydF4y2Ba
使用Trimmomatic v0.33处理原始RNA-Seq reads,修剪适配器以及reads末端的低质量碱基[gydF4y2Ba29gydF4y2Ba]。Phred平均质量评分< 20和长度< 36的质量较差的reads也被过滤掉。然后使用Trinity v2.1.1软件使用默认参数[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba]。gydF4y2Ba
通过各种方法评估了所得到的装配的质量。首先,使用bowtie2检查装配体的RNA-Seq读取表示[gydF4y2Ba32gydF4y2Ba]。Ex90N50转录序列长度(基于代表90%表达数据的转录集的转录序列N50值)使用gydF4y2Bacontig_ExN50_statistic.plgydF4y2Ba脚本与Trinity捆绑在一起。然后研究了全长重构蛋白编码基因的表示。使用BLAST将组装的转录本与Swiss-Prot进行比较,并使用perl脚本分析命中gydF4y2Bablast_outfmt6_group_segments.tophit_coverage.pl,gydF4y2Ba提供了三位一体套餐使用BUSCO (Benchmarking Universal Single-Copy Orthologs)来根据保守的同源内容探索转录组的完整性[gydF4y2Ba33gydF4y2Ba]。最后,使用TransRate将程序集与公开可用的程序集进行比较gydF4y2BaCucumis巨大成功gydF4y2Ba蛋白质编码初级转录序列[gydF4y2Ba34gydF4y2Ba]。gydF4y2Ba
重新组装的转录本的注释gydF4y2Ba
使用BLASTX将新组装的转录本与来自nr和Swiss-Prot数据库的病毒植物序列进行比较,e值阈值为1e-3 [gydF4y2Ba35gydF4y2Ba]。从这个比较中产生的BLAST输出被加载到BLAST2GO中,用于将GO术语映射到转录本和注释[gydF4y2Ba36gydF4y2Ba]。还进行了酶编码和KEGG通路作图。使用ANNEX (Annotation Expander)对标注进行增强。最后,应用GO-Slim映射对本体内容进行全面概述。gydF4y2Ba
除了BLAST2GO辅助注释外,还利用Trinotate管道利用各种注释数据库(eggNOG/GO/KEGG数据库)对转录本进行了全面的功能注释[gydF4y2Ba31gydF4y2Ba]。Trinotate管道还包括开放阅读框的识别,与Swiss-Prot和TrEMBL的同源性搜索。采用HMMER/PFAM进行蛋白结构域鉴定。分别用signp和tmHMM预测蛋白信号肽和跨膜结构域。gydF4y2Ba
转录物定量及差异表达分析gydF4y2Ba
align_and_estimate_abundance.plgydF4y2Ba使用来自Trinity包的script将每个文库的清洗reads与新生转录组进行比对,并使用RSEM估计转录丰度[gydF4y2Ba37gydF4y2Ba]。gydF4y2Baabundance_estimates_to_matrix.plgydF4y2Ba脚本用于构建计数矩阵和规范化表达式值矩阵。gydF4y2BaPtRgydF4y2Ba使用script生成相关矩阵和主成分分析(PCA)图,对所有样本进行重复比较。差异表达分析用计数矩阵的两个生物重复进行gydF4y2Barun_DE_analysis.plgydF4y2Ba用edge作为选择方法[gydF4y2Ba38gydF4y2Ba]。gydF4y2Baanalyze_diff_expr.plgydF4y2Ba脚本用于检查氧化石墨烯富集并提取所有具有的转录本gydF4y2BapgydF4y2Ba-值最多为1e-3,差异表达至少为2^2倍。将DE特征划分为具有相似表达模式的聚类gydF4y2Badefine_clusters_by_cutting_tree.plgydF4y2Ba脚本与Ptree方法。gydF4y2Ba
qRT-PCR验证差异表达基因gydF4y2Ba
对于表达分析,使用用于RNA测序的相同RNA样品的等分进行qRT-PCR。2微克(2 μg)的总RNA通过SuperScript IV逆转录酶(Invitrogen)利用寡核苷酸(dT)引物合成互补DNA (cDNA)。gydF4y2BaCgACT2gydF4y2Ba基因作为标准基因。在BIO-RAD CFX96机器上使用基因特异性正向和反向引物进行qRT-PCR(附加文件)gydF4y2Ba1gydF4y2Ba:表1)。使用Takara SYBR Premix Ex Taq II (Takara Bio Inc.)进行反应,在95℃下孵育3 min,然后进行40个循环,分别为95℃15 s, 58℃15 s和72℃15 s。采用熔化曲线分析检验PCR的特异性,采用2gydF4y2Ba——∆∆CTgydF4y2Ba方法(gydF4y2Ba39gydF4y2Ba]。gydF4y2Ba
结果gydF4y2Ba
RNA测序,使用BLAST2GO和Trinotate进行基于trinity的从头转录组组装和注释gydF4y2Ba
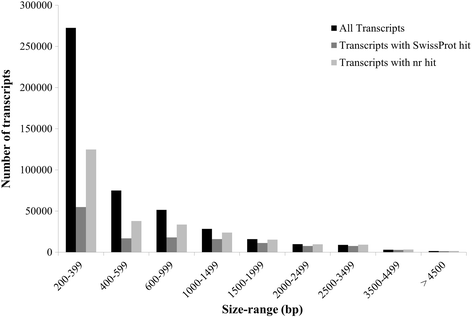
在Illumina NextSeq 500平台上对所有12个文库进行测序后,共获得306,575,536对末端reads (150 bp)。随后,186,399,131条高质量的成对末端reads用于从头组装gydF4y2BaCoccinia茅gydF4y2Ba花芽转录组使用Trinity软件包,默认参数(表1)gydF4y2Ba1gydF4y2Ba)。得到的组装包括467,233个“Trinity Transcripts”聚类为378,860个“Trinity Genes”,N50值为881 bp(表1)gydF4y2Ba2gydF4y2Ba、附加文件gydF4y2Ba2gydF4y2Ba)。在组装转录本的长度分布中,200-399 bp大小的转录本最为丰富(图2)。gydF4y2Ba2gydF4y2Ba)。然而,与较小的转录本相比,长度在1000-2000 bp左右的转录本有更高比例的BLAST命中(图2)。gydF4y2Ba2gydF4y2Ba)。使用bowtie2将清洗后的reads映射回转录组,每个文库中有70%或更多的reads对齐一致(表2)gydF4y2Ba1gydF4y2Ba)。使用来自程序集的80,806个转录本(忽略其余读取覆盖率低的转录本)计算出的Ex90N50统计值为1784 bp(附加文件)gydF4y2Ba3.gydF4y2Ba:图S1)。gydF4y2Ba
总的来说,在Swiss-Prot数据库中,8916个独特的BLAST片段由接近全长的转录本表示,具有超过70%的比对覆盖率,12,315个片段显示超过50%的比对覆盖率(附加文件)gydF4y2Ba4gydF4y2Ba表2)。BUSCO输出[C:89.8%(S:14.5%,D:75.3%),F:5.0%,M:5.2%,n:1440]表明,在1440个植物BUSCO数据集中,我们的新组装的BUSCO中检测到1293个全长BUSCOgydF4y2BaCoccinia茅gydF4y2Ba花芽转录组完整性为89.8%。最后使用TransRate,我们能够检测到gydF4y2Bac .茅gydF4y2Ba84%(18039)的蛋白质编码初级转录本具有同源性gydF4y2Bac .巨大成功gydF4y2Ba其中,13,430个参考序列至少有95%的碱基被CRB-BLAST击中(附加文件)gydF4y2Ba5gydF4y2Ba表S3)。gydF4y2Ba
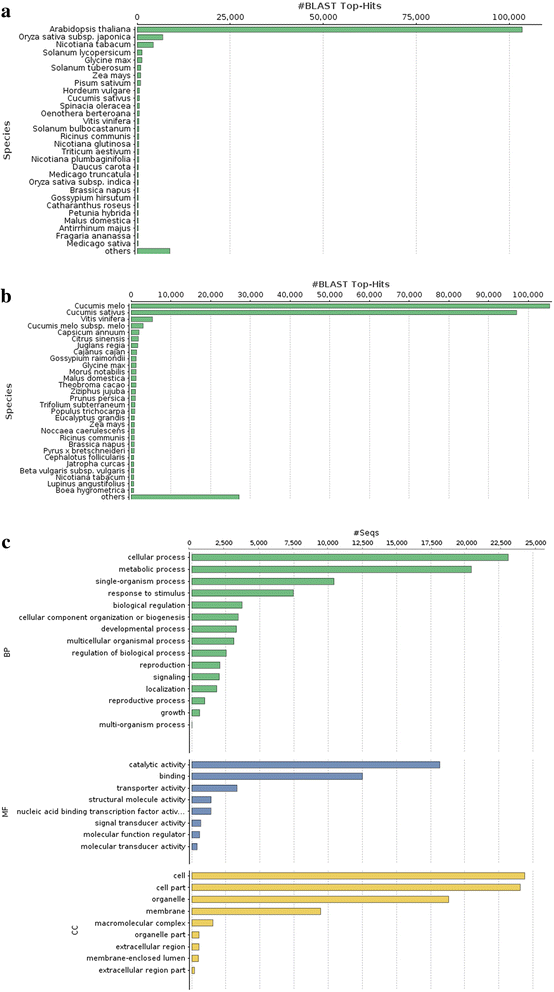
Coccinia茅gydF4y2Ba将花蕾转录本与nr和Swiss-Prot数据库中的植物蛋白序列进行比较,结果分别有259,200和136,663个转录本在各自的数据库中至少有一个匹配。BLAST命中的物种分布分析表明,这些命中大部分来自gydF4y2Ba拟南芥gydF4y2Ba和大米在Swiss-Prot数据库中,而在nr数据库中,最热门的是黄瓜和甜瓜(图2)。gydF4y2Ba3 a, bgydF4y2Ba)。用生物过程、分子功能和细胞成分类别的各种氧化石墨烯术语注释的转录本数量见图。gydF4y2Ba3 cgydF4y2Ba.gydF4y2Ba
同时使用Trinotate v3管道对gydF4y2BaCoccinia茅gydF4y2Ba花芽转录本。关于瑞士- prot /TrEMBL BLAST命中,GO, KEGG和eggNOG映射的详细信息可以在附加文件中找到gydF4y2Ba6gydF4y2Ba表S4。HMMER/PFAM预测蛋白结构域,以及有关信号肽和跨膜结构域的信息也可以在Additional文件中找到gydF4y2Ba6gydF4y2Ba表S4。总之,我们已经组装了一个高质量的转录组,用于早期和中期的花蕾gydF4y2BaCoccinia茅gydF4y2Ba并使用完善的BLAST2GO和Trinotate管道对转录本进行全面注释。gydF4y2Ba
差异表达分析揭示了花粉育性和变性的可能因素gydF4y2Ba
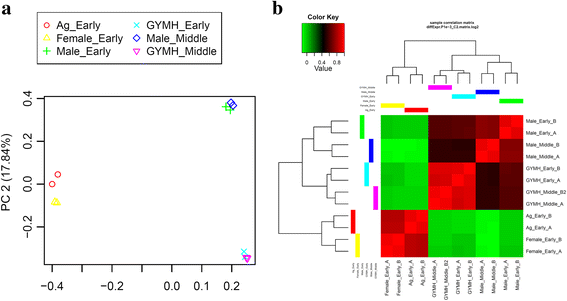
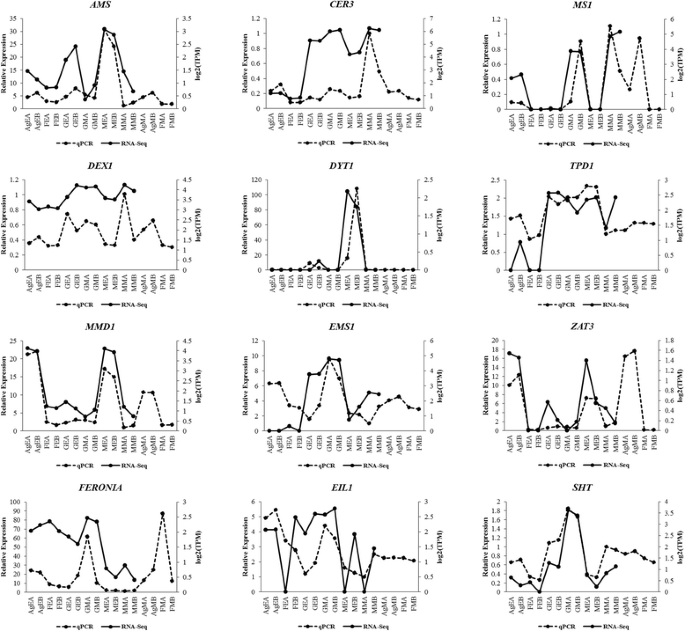
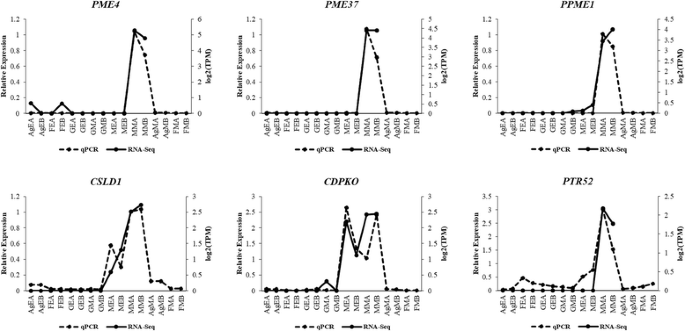
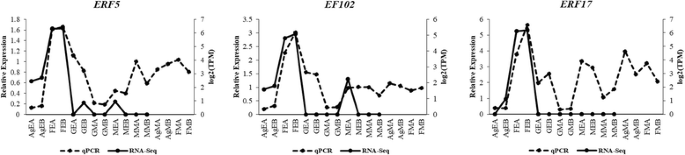
转录组组装和注释后,进行差异表达分析。首先,使用RSEM进行转录本丰度估计。之后,我们检查了所有样本的重复之间的相关性gydF4y2BaPtRgydF4y2Ba脚本。主成分分析和相关矩阵显示,6个样本的重复集之间具有良好的相关性(图2)。gydF4y2Ba4gydF4y2Ba)。EdgeR用于鉴定6个样本之间所有两两比较的差异表达转录本(表2)gydF4y2Ba3.gydF4y2Ba;无花果。gydF4y2Ba5gydF4y2Ba;额外的文件gydF4y2Ba7gydF4y2Ba:图S2)。差异表达转录本的最小倍数变化为2^2gydF4y2BapgydF4y2Ba-值最多提取1e-3,并进行氧化石墨烯富集分析(附加文件)gydF4y2Ba8gydF4y2Ba表S5,附加文件gydF4y2Ba9gydF4y2Ba表6)。在所有比较中,Ag_Early_vs_Female_Early、Female_Early_vs_Male_Early和GYM-H_Middle_vs_Male_Middle等几个有趣的比较分别有3574、35,694和14,954个差异表达转录本(表1)gydF4y2Ba3.gydF4y2Ba,无花果。gydF4y2Ba5gydF4y2Ba)。将DE特征划分为具有相似表达模式的聚类(图2)。gydF4y2Ba6gydF4y2Ba;额外的文件gydF4y2Ba10gydF4y2Ba:图S3)。在花药发育的背景下,我们发现了几个氧化石墨烯(GO:0080110, GO:0010208, GO:0010584, GO:0009555, GO:0055046, GO:0048658, GO:0048653)在花发育早期雄芽与雌芽中的富集差异。用qRT-PCR验证了一些有趣的差异表达分析结果gydF4y2BaCocciniagydF4y2Ba同源染色体的gydF4y2Ba自动对盘及成交系统gydF4y2Ba(夭折的小孢子),gydF4y2BaCER3gydF4y2Ba(ECERIFERUM 3),gydF4y2BaDEX1gydF4y2Ba(外壁结构1缺陷);gydF4y2BaDYT1gydF4y2Ba(功能失调的绒毡层1);gydF4y2BaEIL1gydF4y2Ba(乙烯不敏感3-样1);gydF4y2BaEMS1gydF4y2Ba(过量小孢子细胞1);gydF4y2Ba拿来gydF4y2Ba(FERONIA),gydF4y2BaMMD1gydF4y2Ba(雄性减数细胞死亡1)gydF4y2BaMS1gydF4y2Ba(男性不育);gydF4y2BaSHTgydF4y2Ba(亚精胺羟基肉桂酰转移酶)gydF4y2BaTPD1gydF4y2Ba(绒毡层决定因素1)和gydF4y2BaZAT3gydF4y2Ba(锌指蛋白ZAT3)通过qRT-PCR推断出的这些基因的表达谱显示出与数字DE分析结果相似的模式(图2)。gydF4y2Ba7gydF4y2Ba)。此外,我们还发现雄性芽(GO:0080092, GO:0009846, GO:0009860)中与花粉育性相关的GO术语比具有不育花粉的GyM-H和Ag-H芽丰富。因此,许多参与花粉管发育的同源基因的表达谱,如gydF4y2BaCSLD1gydF4y2Ba纤维素合酶样蛋白D1;TRINITY_DN92683_c0_g1_i1),gydF4y2BaCDPKOgydF4y2Ba钙依赖性蛋白激酶24;TRINITY_DN93671_c0_g1_i3),gydF4y2BaPME4gydF4y2Ba果胶甲基酯酶4;TRINITY_DN14239_c0_g1_i1),gydF4y2BaPME37gydF4y2Ba果胶甲基酯酶37;TRINITY_DN3663_c0_g1_i1),gydF4y2BaPPME1gydF4y2Ba花粉特异性果胶甲基酯酶1;TRINITY_DN66415_c0_g1_i1)和gydF4y2BaPTR52gydF4y2Ba蛋白NRT1/PTR FAMILY 2.8;对TRINITY_DN112735_c0_g14_i3)进行了分析,发现在中期雄性芽中富集,与我们基于RNA-Seq数据的数字表达谱相似(图2)。gydF4y2Ba8gydF4y2Ba)。AgNO对乙烯信号的下调gydF4y2Ba3.gydF4y2BaGO:0009723(对乙烯的反应)和GO:0009873(乙烯激活的信号通路)在AgNO中被耗尽gydF4y2Ba3.gydF4y2Ba处理过的植物(附加文件gydF4y2Ba9gydF4y2Ba表6)。为了验证这一点,我们研究了gydF4y2Ba乙烯应答转录因子gydF4y2Ba,gydF4y2BaERF5gydF4y2Ba,gydF4y2BaERF17,gydF4y2Ba和gydF4y2BaEF102gydF4y2Ba.我们发现这三个gydF4y2Ba小块土地gydF4y2Ba在AgNO上被下调调控gydF4y2Ba3.gydF4y2Ba治疗(图。gydF4y2Ba9gydF4y2Ba)。gydF4y2Ba
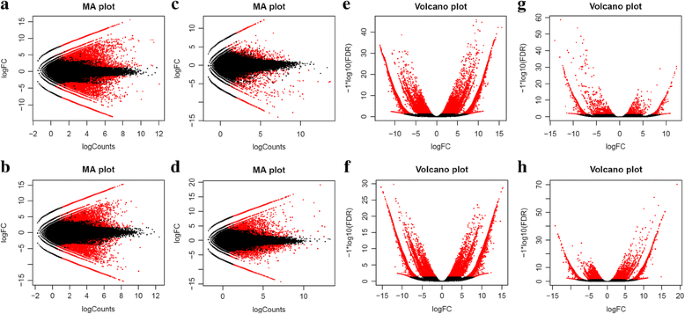
转录物丰度的两两比较。显示平均对数折叠变化(logFC)的MA图与(gydF4y2Ba一个gydF4y2Ba)女性(早期阶段)与男性(早期阶段)成绩单,(gydF4y2BabgydF4y2Ba)女性(早期阶段)与体操- h(早期阶段)成绩单,(gydF4y2BacgydF4y2BaAg-H(早期)与女性(早期)转录本和(gydF4y2BadgydF4y2Ba)跨重复的GyM-H(中期)vs. male(中期)。火山图显示与FDR(错误发现率)有关的差异表达转录本(gydF4y2BaegydF4y2Ba)女性(早期阶段)与男性(早期阶段)成绩单,(gydF4y2BafgydF4y2Ba)女性(早期阶段)与体操- h(早期阶段)成绩单,(gydF4y2BaggydF4y2BaAg-H(早期)与女性(早期)转录本和(gydF4y2BahgydF4y2Ba体操- h(中间阶段)vs男性(中间阶段)。DE在FDR <0.05处的特征以红色表示。功能与gydF4y2BaPgydF4y2Ba-最大为1e-3和至少为2^2倍变化的值是差分表示的gydF4y2Ba
用qRT-PCR对所选DE基因进行2个生物重复验证。在中期男性- a (MMA)样本中的相对表达量设为1,绘制qRT-PCR数据。AgEA,早期Ag-H A;AgEB,早期Ag-H B;FEA,早期女性A;FEB,前期女B;GEA,早期体操- h A;GEB,早期体操- h B;GMA,中期健身房- h A;GMB,中期健身房- hb; MEA, Early-staged Male A; MEB, Early-staged Male B; MMA, Middle-staged Male A; MMB, Middle-staged Male B; AgMA, Middle-staged Ag-H A, AgMB, Middle-staged Ag-H B; FMA, Middle-staged Female A; FMB, Middle-staged Female B
基于qRT-PCR的花粉管发育相关基因双生物重复表达分析。在中期男性- a (MMA)样本中的相对表达量设为1,绘制qRT-PCR数据。AgEA,早期Ag-H A;AgEB,早期Ag-H B;FEA,早期女性A;FEB,前期女B;GEA,早期体操- h A;GEB,早期体操- h B;GMA,中期健身房- h A;GMB,中期健身房- hb; MEA, Early-staged Male A; MEB, Early-staged Male B; MMA, Middle-staged Male A; MMB, Middle-staged Male B; AgMA, Middle-staged Ag-H A, AgMB, Middle-staged Ag-H B; FMA, Middle-staged Female A; FMB, Middle-staged Female B
基于qRT-PCR的表达分析gydF4y2Ba乙烯应答转录因子gydF4y2Ba(gydF4y2Ba小块土地gydF4y2Ba),有两个生物重复。在中期男性- a (MMA)样本中的相对表达量设为1,绘制qRT-PCR数据。AgEA,早期Ag-H A;AgEB,早期Ag-H B;FEA,早期女性A;FEB,前期女B;GEA,早期体操- h A;GEB,早期体操- h B;GMA,中期健身房- h A;GMB,中期健身房- hb; MEA, Early-staged Male A; MEB, Early-staged Male B; MMA, Middle-staged Male A; MMB, Middle-staged Male B; AgMA, Middle-staged Ag-H A, AgMB, Middle-staged Ag-H B; FMA, Middle-staged Female A; FMB, Middle-staged Female B
讨论gydF4y2Ba
性别决定和分化的遗传基础在中国尚未得到很好的研究gydF4y2Bac .茅gydF4y2Ba.性别连锁基因的鉴定和研究将有助于更好地了解植物的雌雄异株,这可以通过全基因组测序方法来实现。然而,性别决定基因最有可能与y染色体的非重组区域有关,而这些区域很难从序列数据中组装出来[gydF4y2Ba40gydF4y2Ba]。另一种方法是使用比较转录组学来识别可能在性别分化和决定中发挥作用的性别偏向基因[gydF4y2Ba24gydF4y2Ba]。此外,性别偏倚基因中突变和snp的存在可以为雌雄异株的进化提供见解。利用这种方法,我们从雌雄异株、雌雄同株和AgNO的花蕾中组装并注释了一个全新的转录组gydF4y2Ba3.gydF4y2Ba对待女性gydF4y2Ba检测结果。gydF4y2Ba我们已经确定了可能在雌花雄蕊阻滞中起作用的差异表达基因。此外,我们还分析了AgNO上差异表达的基因gydF4y2Ba3.gydF4y2Ba雌性植株上促进雄蕊发育的处理。最后,我们比较了中期雄芽(携带可育花粉)和GyM-H芽(携带不育花粉)来研究花粉成熟和育性的相关基因。gydF4y2Ba
雌花雄蕊发育基因的差异表达与雄蕊生长阻滞gydF4y2Ba
雌花发育的早期阶段(3-4期)gydF4y2Bac .检测结果gydF4y2Ba心皮和雄蕊器官同时发生。然而,雄蕊生长在发育过程中(第4-5阶段)被阻止,导致雌花具有初级雄蕊。而雄花发育的组织学研究未发现心皮原基gydF4y2Bac .茅gydF4y2Ba如本署上一份报告所述[gydF4y2Ba14gydF4y2Ba]。在雌雄同体植物中,参与雄蕊起始和发育过程的分子分子被很好地描述了gydF4y2Ba拟南芥gydF4y2Ba.为了确定雄蕊生长停滞的阶段,gydF4y2BaCoccinia茅gydF4y2Ba同源染色体的gydF4y2Ba拟南芥gydF4y2Ba从重新组装的转录组中鉴定出雄蕊发育基因。在参与雄蕊起始的基因中,gydF4y2BaPistillatagydF4y2Ba(gydF4y2BaCgPIgydF4y2Ba, TRINITY_DN71631_c0_g1_i1)被发现以男性偏向的方式表达(附加文件)gydF4y2Ba8gydF4y2Ba表5)。gydF4y2BaPistillatagydF4y2Ba已被证明在gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba41gydF4y2Ba)(表gydF4y2Ba4gydF4y2Ba)。此外,过量的小孢子细胞1 (EMS1)已被证明与调节生殖细胞和体细胞规格的绒毯区决定因子1 (TPD1)相互作用gydF4y2Ba拟南芥gydF4y2Ba条件下(gydF4y2Ba42gydF4y2Ba]。差异表达分析显示两者同源gydF4y2BaEMS1gydF4y2Ba(TRINITY_DN106236_c0_g4_i1)和gydF4y2BaTPD1gydF4y2Ba(TRINITY_DN116795_c2_g1_i3)在雄花中的含量高于雌花(表1)gydF4y2Ba4gydF4y2Ba;额外的文件gydF4y2Ba8gydF4y2Ba表S5;无花果。gydF4y2Ba7gydF4y2Ba)。gydF4y2Ba功能失调绒毡层1gydF4y2Ba(gydF4y2BaDYT1)gydF4y2Ba在绒毡层发育中起着重要的作用gydF4y2Ba绒毡发育和功能有缺陷gydF4y2Ba(gydF4y2BaTDF1gydF4y2Ba)gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba43gydF4y2Ba]。此外,DYT1已知与基本螺旋-环-螺旋蛋白89 (bHLH89)相互作用,bHLH89在花药中高表达,是正常花药发育和雄性生殖所必需的[gydF4y2Ba44gydF4y2Ba]。gydF4y2BaTDF1gydF4y2Ba同源物(TRINITY_DN97604_c1_g7_i1)以及gydF4y2BabHLH89gydF4y2Ba同源基因TRINITY_DN85771_c0_g1_i1在中表现出雄性偏倚表达gydF4y2Bac .茅gydF4y2Ba(表gydF4y2Ba4gydF4y2Ba;额外的文件gydF4y2Ba8gydF4y2Ba:表S5)gydF4y2Ba.gydF4y2Ba这些与雄蕊发育相关的基因的差异调控解释了雌花早期雄蕊停滞的可能原因gydF4y2Bac .茅gydF4y2Ba.gydF4y2Ba
根据最近对甜瓜、黄瓜和西瓜等雌雄同株瓜类的报道,乙烯通过抑制雄蕊发育过程在性别决定中起主要作用[qh]gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba]。我们发现,与雄性相比,GO:0009723(对乙烯的反应)在雌性芽中丰富,这表明乙烯在性别决定中的潜在作用gydF4y2Bac .茅gydF4y2Ba(附加文件gydF4y2Ba9gydF4y2Ba表6)。gydF4y2Ba
AgNOgydF4y2Ba3.gydF4y2Ba母株处理可解除雄蕊抑制gydF4y2Ba
雌植株gydF4y2Bac .茅gydF4y2Ba熊花具融合的心皮和初级雄蕊。早些时候,我们已经表明,叶面喷35毫米AgNOgydF4y2Ba3.gydF4y2Ba的雌株上gydF4y2Bac .茅gydF4y2Ba促进初级雄蕊的进一步发育[gydF4y2Ba14gydF4y2Ba]。在本研究中,我们比较了早期Ag-H花蕾与雌性花蕾的基因表达谱(表1)gydF4y2Ba3.gydF4y2Ba;无花果。gydF4y2Ba5度gydF4y2Ba,gydF4y2BaggydF4y2Ba)。Ag)gydF4y2Ba+gydF4y2Ba离子可以抑制对乙烯的反应,乙烯是一种气态植物激素[gydF4y2Ba17gydF4y2Ba]。此外,在许多雌雄异株的物种中,银化合物已被证明通过促进雄蕊发育来诱导雄性[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba]。没有其他的乙烯生物合成或信号传导抑制剂能诱导雄蕊发育gydF4y2Ba硅宾latifolia,gydF4y2Ba这表明乙烯信号可能不是唯一受硫代硫酸银影响的途径[gydF4y2Ba21gydF4y2Ba]gydF4y2Ba.gydF4y2Ba与…相反gydF4y2Ba硅宾latifoliagydF4y2BaAVG(氨基乙氧基乙烯基甘氨酸),一种乙烯生物合成抑制剂,已被证明在雌蕊甜瓜中诱导雄花,类似于银化合物[gydF4y2Ba49gydF4y2Ba]。考虑到1-氨基环丙烷-1-羧酸合成酶(ACS,一种参与乙烯生物合成的酶)在许多葫芦科其他成员性别决定中的作用,乙烯介导的AgNO效应gydF4y2Ba3.gydF4y2Ba似乎更有可能涉及到性别的改变gydF4y2Bac .茅gydF4y2Ba[gydF4y2Ba50gydF4y2Ba]。gydF4y2Ba
在我们的研究中,与Ag-H芽相比,GO:0009723(乙烯应答)和GO:0009873(乙烯激活信号通路)在雌性芽中富集(附加文件)gydF4y2Ba9gydF4y2Ba表6)。基因转录本,如gydF4y2Ba乙烯反应转录因子,ERF5gydF4y2Ba(TRINITY_DN102355_c3_g13_i1),gydF4y2BaERF17gydF4y2Ba(TRINITY_DN80749_c0_g6_i1), EF109 (TRINITY_DN87049_c0_g1_i1), EF102 (TRINITY_DN90257_c1_g2_i1), ERF99 (TRINITY_DN93821_c0_g1_i2), ERF60 (TRINITY_DN93262_c1_g6_i2)和gydF4y2BaERF78 (TRINITY_DN98503_c3_g1_i1)gydF4y2Ba在Ag-H芽中下调,表明乙烯信号受损(附加文件gydF4y2Ba8gydF4y2Ba表5)。此外,基于qRT-PCR的表达模式分析gydF4y2BaERF5gydF4y2Ba,gydF4y2BaERF17gydF4y2Ba和gydF4y2BaEF102gydF4y2Ba基因明显显示AgNO对乙烯的抑制作用gydF4y2Ba3.gydF4y2Ba(无花果。gydF4y2Ba9gydF4y2Ba)gydF4y2Ba.gydF4y2Ba
Ag-H芽中乙烯信号的下调与促进雄蕊生长有关。GO:0048655(花药壁绒毡层形态发生)、GO:0048657(花药壁绒毡层细胞分化)、GO:0048658(花药壁绒毡层发育)在早期Ag-H芽中比雌性芽中富集(附加文件)gydF4y2Ba9gydF4y2Ba表6)。gydF4y2Bac .茅gydF4y2Ba同源染色体的gydF4y2BaMS1gydF4y2Ba,gydF4y2BaMMD1gydF4y2Ba(TRINITY_DN109512_c4_g3_i1 TRINITY_DN108927_c0_g6_i1),gydF4y2BaZAT3gydF4y2Ba(TRINITY_DN108658_c0_g2_i1)和gydF4y2Ba自动对盘及成交系统gydF4y2Ba(TRINITY_DN116105_c0_g2_i1)基因,在绒毡层和花粉发育中起重要作用gydF4y2Ba拟南芥gydF4y2Ba花在AgNO上被上调gydF4y2Ba3.gydF4y2Ba表明促进雄蕊生长的处理[gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba[附加文件gydF4y2Ba8gydF4y2Ba表S5;无花果。gydF4y2Ba7gydF4y2Ba)。gydF4y2BaMYB35gydF4y2Ba(TRINITY_DN92649_c0_g7_i1),该基因被认为是一种推测的性别决定基因gydF4y2Ba芦笋gydF4y2Ba也被发现在Ag-H芽中表达上调[gydF4y2Ba57gydF4y2Ba[附加文件gydF4y2Ba8gydF4y2Ba表5)。此外,与花粉壁组装(GO:0010208)、花粉外壁形成(GO:0010584)、孢粉素生物合成过程(GO:0080110)、花粉发育(GO:0009555)和花粉精细胞分化(GO:0048235)相关的基因本体术语也在Ag-H芽中富集(附加文件)gydF4y2Ba9gydF4y2Ba表6)。此外,我们注意到gydF4y2Ba乙烯应答转录因子gydF4y2Ba(小块土地)并不影响GyM-H味蕾比雌性花蕾表明雄蕊发展GyM-H花蕾可能由其他机制逃避乙烯信号抑制。gydF4y2Ba
控制花粉育性的转录本在GyM-H和Ag-H花蕾中被耗尽gydF4y2Ba
c .茅gydF4y2Ba是少数被报道存在异型性染色体的物种之一。男性的大y染色体可能在性别决定中起主要作用。的健身形式gydF4y2Bac .茅gydF4y2Ba没有y染色体[gydF4y2Ba14gydF4y2Ba]。尽管缺少y染色体,GyM-H花仍能发育成雄蕊。同样,AgNOgydF4y2Ba3.gydF4y2Ba在具有XX性染色体的雌性植株中,处理诱导雄蕊发育。然而,从GyM-H和Ag-H花蕾中发现的花粉与雄性花蕾的花粉不同,是不育的[gydF4y2Ba14gydF4y2Ba]。差异表达分析显示,与中期的GyM-H芽相比,中期雄芽中花粉管(GO:0090406)、花粉萌发(GO:0009846)、花粉管生长调控(GO:0080092)、花粉管生长(GO:0009860)和小孢子发生(GO:0009556)的基因本体术语丰富gydF4y2Ba9gydF4y2Ba表6)。gydF4y2Ba
GAUTEgydF4y2Ba在花粉管壁生物合成中起重要作用gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba58gydF4y2Ba]。TRINITY_DN111340_c1_g1_i6,与gydF4y2BaGAUTEgydF4y2Ba与GyM-H芽相比,雄性芽丰富。与大多数其他植物细胞壁不同,花粉管壁不含胼胝质或纤维素。果胶甲基酯酶(PMEs)在花粉管的生长中起着非常重要的作用[gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba]。gydF4y2BaPME4gydF4y2Ba(TRINITY_DN14239_c0_g1_i1),gydF4y2BaPME37gydF4y2Ba(TRINITY_DN3663_c0_g1_i1)和gydF4y2BaPPME1gydF4y2Ba(TRINITY_DN66415_c0_g1_i1, TRINITY_DN71598_c0_g2_i1)在GyM-H芽中与雄芽相比下调(附加文件)gydF4y2Ba8gydF4y2Ba表5)。这可能是源于GyM-H的花粉不能形成花粉管的原因。詹辉,钟毅,杨忠,夏辉[j]。gydF4y2Ba62gydF4y2Ba已经表明gydF4y2BaIPMKBgydF4y2Ba肌醇多磷酸多激酶(Inositol polyphosphate multikinase beta)是花粉发育的重要因子。我们发现TRINITY_DN96290_c0_g3_i2转录本与拟南芥匹配gydF4y2BaIPMKBgydF4y2Ba(gydF4y2BaAtIpk2beta)gydF4y2Ba与雄性芽相比,在GyM-H中的表达下调。早些时候,几份报告已经证明了这一点gydF4y2Ba男性不育1gydF4y2Ba(gydF4y2BaMS1gydF4y2Ba)基因gydF4y2Ba拟南芥gydF4y2Ba在绒毡层细胞中表达,在花粉成熟过程中起重要作用[gydF4y2Ba51gydF4y2Ba,gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba]。gydF4y2Bac .茅gydF4y2Ba同族体的gydF4y2BaMS1gydF4y2Ba, TRINITY_DN109512_c4_g3_i1以男性偏倚的方式表达(附加文件gydF4y2Ba8gydF4y2Ba表S5;无花果。gydF4y2Ba7gydF4y2Ba)。同样,对花粉管生长很重要的同源基因,如gydF4y2BaCSLD1gydF4y2Ba(TRINITY_DN92683_c0_g1_i1),gydF4y2BaCDPKOgydF4y2Ba(TRINITY_DN93671_c0_g1_i3),gydF4y2BaNRX1gydF4y2Ba(TRINITY_DN106708_c1_g2_i3),gydF4y2BaPTR52gydF4y2Ba(TRINITY_DN112735_c0_g14_i3;TRINITY_DN112735_c0_g3_i1),gydF4y2BaTAF6gydF4y2Ba(TRINITY_DN96231_c1_g1_i2)和gydF4y2BaCALS5gydF4y2Ba(TRINITY_DN113564_c1_g1_i1)富集于雄性[gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba,gydF4y2Ba65gydF4y2Ba,gydF4y2Ba66gydF4y2Ba,gydF4y2Ba67gydF4y2Ba,gydF4y2Ba68gydF4y2Ba(图。gydF4y2Ba8gydF4y2Ba、附加文件gydF4y2Ba8gydF4y2Ba表5)。参与花粉外皮形成的基因,如gydF4y2BaFACR2gydF4y2Ba/gydF4y2Ba一份gydF4y2Ba(TRINITY_DN74585_c1_g5_i3),gydF4y2BaEA6gydF4y2Ba(TRINITY_DN76274_c1_g1_i1),gydF4y2BaC70A2 / DEX2gydF4y2Ba(TRINITY_DN99059_c0_g1_i1)在男性[gydF4y2Ba69gydF4y2Ba,gydF4y2Ba70gydF4y2Ba,gydF4y2Ba71gydF4y2Ba]。gydF4y2BaEMS1gydF4y2Ba(TRINITY_DN89942_c0_g7_i1),gydF4y2BaSERK1gydF4y2Ba(TRINITY_DN108624_c1_g7_i5),gydF4y2Ba杰森gydF4y2Ba(TRINITY_DN83440_c0_g1_i1),gydF4y2BaRPK2gydF4y2Ba(TRINITY_DN113423_c0_g1_i4)是小孢子发生和花粉成熟所必需的基因,在雄芽中期的表达量显著高于GyM-H芽。[gydF4y2Ba72gydF4y2Ba,gydF4y2Ba73gydF4y2Ba,gydF4y2Ba74gydF4y2Ba,gydF4y2Ba75gydF4y2Ba[附加文件gydF4y2Ba8gydF4y2Ba表S5;无花果。gydF4y2Ba7gydF4y2Ba)。gydF4y2Ba
同源物的表达谱分析gydF4y2BaMS1gydF4y2Ba,gydF4y2BaEMS1gydF4y2Ba,gydF4y2BaDYT1, PME4, PME37, PPME1, CSLD1, CDPKO, PTR52gydF4y2Ba采用qRT-PCR对包括中期Ag-H芽在内的所有组织样本进行了研究(图2)。gydF4y2Ba7gydF4y2Ba和gydF4y2Ba8gydF4y2Ba;表格gydF4y2Ba4gydF4y2Ba)。所有这些同源基因在Ag-H和GyM-H花蕾中的转录本均下调,表明在Ag-H和GyM-H花蕾中存在雄性偏倚的表达模式,这可能是导致花粉不育的原因。gydF4y2Ba
结论gydF4y2Ba
从不同性别表型的RNA-Seq发展而来的全新组装转录组已经能够鉴定gydF4y2Bac .茅gydF4y2Ba已知的许多基因的同源物参与花发育的物种,如gydF4y2Ba拟南芥gydF4y2Ba、甜瓜和黄瓜。我们发现,与雄性芽相比,雌性芽中与雄蕊起始、绒毡层发育和花粉成熟有关的许多基因被下调。有趣的是,乙烯反应相关基因在雌性花蕾中比在雄性花蕾中上调,这表明乙烯在雄蕊抑制中的作用可能类似于甜瓜和黄瓜等雌雄同株葫芦。我们推测y染色体可能表达抑制乙烯信号或抑制心皮发育的基因,心皮是雄花中产生乙烯导致雄蕊形成的部位。这一点得到了AgNO的观察结果的支持gydF4y2Ba3.gydF4y2Ba处理抑制了乙烯反应,诱导了雌花的雄蕊发育gydF4y2Bac .茅gydF4y2Ba.Ag-H花产生的花粉是不育的,表明y染色体在决定雄性中起决定性作用。由此可见,与雄芽相比,GyM-H中期芽中与花粉成熟、花粉萌发和花粉管伸长相关的转录本缺失。这可能是由于GyM植物中没有y染色体。总之,在这项研究中发现的差异表达基因可能揭示了生物性别决定、分化和修饰的可能机制gydF4y2Ba检测结果。gydF4y2Ba
缩写gydF4y2Ba
- Ag-H花蕾:gydF4y2Ba
-
用硝酸银处理过的植物的雌雄同体花gydF4y2Ba
- AVG:gydF4y2Ba
-
AminoethoxyvinylglycinegydF4y2Ba
- 车身:gydF4y2Ba
-
通用单拷贝正字词的基准测试gydF4y2Ba
- CRB-BLAST:gydF4y2Ba
-
条件互易最佳爆破gydF4y2Ba
- 磨边机:gydF4y2Ba
-
数字基因表达数据的实证分析gydF4y2Ba
- 蛋酒:gydF4y2Ba
-
基因的进化谱系:无监督的同源群gydF4y2Ba
- FPKM:gydF4y2Ba
-
每百万次读取的每kb片段数gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- 健身:gydF4y2Ba
-
GynomonoeciousgydF4y2Ba
- GyM-H花蕾:gydF4y2Ba
-
雌雄同株植物的雌雄同体花gydF4y2Ba
- HMMER:gydF4y2Ba
-
用于搜索序列数据库中序列同源物的工具gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因和基因组百科全书gydF4y2Ba
- 门店:gydF4y2Ba
-
新一代测序gydF4y2Ba
- Nr:gydF4y2Ba
-
非冗余蛋白数据库gydF4y2Ba
- 包含了:gydF4y2Ba
-
蛋白质家族数据库,每个家族由多个序列比对和隐马尔可夫模型(hmm)表示。gydF4y2Ba
- 存在:gydF4y2Ba
-
实时定量PCRgydF4y2Ba
- RIN:gydF4y2Ba
-
RNA完整性数gydF4y2Ba
- RSEM:gydF4y2Ba
-
期望最大化RNA-SeqgydF4y2Ba
- Swiss-Prot:gydF4y2Ba
-
注释蛋白序列数据库gydF4y2Ba
- TrEMBL:gydF4y2Ba
-
对Swiss-Prot数据库的计算机注释补充gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
植物性别决定与性染色体。遗传。2002;88(2):94 - 101。gydF4y2Ba
- 2.gydF4y2Ba
Ainsworth C, Crossley S, Buchanan-Wollaston V, Thangavelu M, Parker J.雌雄异株酢豆草雌雄花MADS box基因表达模式不同。植物学报。1995;7(10):1583-98。gydF4y2Ba
- 3.gydF4y2Ba
李建军,李建军,李建军,等gydF4y2BaSpAPETALA3gydF4y2Ba和gydF4y2BaSpPISTILLATAgydF4y2Ba, B类花的身份基因在gydF4y2Ba菠菜oleraceagydF4y2Ba,以及它们与两性异形的关系。遗传学报,2005;21(3):362 - 362。gydF4y2Ba
- 4.gydF4y2Ba
Yin TM, DiFazio SP, Gunter LE, Zhang X, Sewell MM, Woolbright SA, Allan GJ, Kelleher CT, Douglas CJ, Wang M,等。基因组结构和早期性染色体的新证据gydF4y2Ba杨树gydF4y2Ba.基因工程学报,2008;18(3):422-30。gydF4y2Ba
- 5.gydF4y2Ba
Urasaki N, Tarora K, Shudo A, Ueno H, Tamaki M, Miyagi N, Adaniya S, Matsumura H.木瓜性别决定基因的数字转录组分析(gydF4y2Ba番木瓜gydF4y2Ba)。科学通报,2012;7(7):e40904。gydF4y2Ba
- 6.gydF4y2Ba
库诺农,李建军,李建军,李建军,李建军,李建军,李建军。雌雄同体生殖生物学的研究进展gydF4y2BaCucumis梅洛gydF4y2Ba无性系种群。gydF4y2Baagrestis)gydF4y2Ba(葫芦科)。生物医学工程学报,2009;34(6):1109 - 1109。gydF4y2Ba
- 7.gydF4y2Ba
Kumar LSS, Deodikar GB。的性染色体gydF4y2BaCocciniagydF4y2Ba籼稻gydF4y2Ba怀特和阿恩。当代科学,1940;9(3):128-30。gydF4y2Ba
- 8.gydF4y2Ba
Bhaduri PN, Bose PC。一些常见瓜类的细胞遗传学研究,特别关注作为物种形成物理基础的染色体断裂。[J] .中华医学杂志,2007;32(2):387 - 391。gydF4y2Ba
- 9.gydF4y2Ba
Chakravorti正义与发展党。细胞学的gydF4y2BaCocciniagydF4y2Ba籼稻gydF4y2Ba与性染色体的行为有关。植物科学学报。1948;27(3):74-86。gydF4y2Ba
- 10.gydF4y2Ba
Kumar LS, Viseveshwaraiah S.性别机制gydF4y2BaCoccinia籼gydF4y2Ba怀特和阿恩。大自然。1952;170(4321):330 - 1。gydF4y2Ba
- 11.gydF4y2Ba
Bhowmick BK, Jha TB, Jha S.雌雄异株瓜的染色体分析gydF4y2BaCoccinia茅gydF4y2Ba(l)沃伊特。染色体科学,2012;15(1+ 2):9-15。gydF4y2Ba
- 12.gydF4y2Ba
李建军,张建军,张建军。分子细胞遗传学(FISH, GISH)研究进展gydF4y2BaCoccinia茅gydF4y2Ba葫芦科的一种,约有3万年历史,在开花植物中Y/常染色体分化最大。细胞遗传学和基因组研究。139(2): 107 - 2013; 18。gydF4y2Ba
- 13.gydF4y2Ba
Bhuskute S, Makde K, Deshpande P.gydF4y2BaCoccinia茅gydF4y2Ba(l)沃伊特。安·博特。1986:415-8。gydF4y2Ba
- 14.gydF4y2Ba
Ghadge AG, Karmakar K, Devani RS, Banerjee J, Mohanasundaram B, Sinha RK, Sinha S, Banerjee AK。三种性表型的花发育、花粉育性及性表达分析gydF4y2BaCocciniagydF4y2Ba检测结果gydF4y2Ba.植物学报,2014;14(1):325。gydF4y2Ba
- 15.gydF4y2Ba
叶德华,陈建军,李建军,等。植物MADS box基因在雄性和雌性花期的表达比较。植物细胞。1994;6(12):1775-87。gydF4y2Ba
- 16.gydF4y2Ba
Di Stilio VS, Kramer EM, Baum DA。花型MADS箱型基因与雌雄同体二态现象gydF4y2BaThalictrum dioicumgydF4y2Ba毛茛科植物——雌雄异株研究的新模式。植物学报,2005;41(5):755 - 756。gydF4y2Ba
- 17.gydF4y2Ba
拜尔EM.植物中乙烯作用的有效抑制剂。植物生理学报,2006;22(3):368 - 368。gydF4y2Ba
- 18.gydF4y2Ba
麦克丹尼尔BK,宾德BM。乙烯受体1 (ETR1)是充足的,并在介导银对乙烯反应的抑制中起主导作用gydF4y2Ba拟南芥gydF4y2Ba.生物化学学报,2012;31(1):26094-103。gydF4y2Ba
- 19.gydF4y2Ba
王晓明,王晓明,王晓明,等。银离子和赤霉素对水稻雌花诱导效应的比较研究gydF4y2Ba大麻gydF4y2Ba植物。35 Experientia。1979;(3):333 - 4。gydF4y2Ba
- 20.gydF4y2Ba
尹婷,奎茵雅。一种激素调节两性的机制模型的试验gydF4y2BaCucumis巨大成功gydF4y2Ba(葫芦科)。中华医学会杂志。1995:1537 - 1546。gydF4y2Ba
- 21.gydF4y2Ba
Law TF, Lebel-Hardenack S, Grant SR. Silver对雌性白种雄蕊发育的影响(gydF4y2Ba硅宾latifoliagydF4y2Ba[石竹科])。[J] .生物医学工程学报,2002;39(6):1014 - 1020。gydF4y2Ba
- 22.gydF4y2Ba
布莱克本KB。植物中的性染色体。大自然。1923;112(2819):687 - 8。gydF4y2Ba
- 23.gydF4y2Ba
木原,小野gydF4y2BaRumex acetosagydF4y2Ba.[j] .科学技术学报。2005;39(1):1 - 7。gydF4y2Ba
- 24.gydF4y2Ba
刘建军,刘建军,刘建军,刘建军。快速gydF4y2Ba新创gydF4y2BaX染色体剂量补偿的进化gydF4y2Ba硅宾latifoliagydF4y2Ba一种具有年轻性染色体的植物。生物科学进展,2012;10(4):e1001308。gydF4y2Ba
- 25.gydF4y2Ba
吴涛,秦志,周霞,冯志,杜勇。黄瓜花性别决定的转录组分析。植物生理学报,2010;32(1):1 - 4。gydF4y2Ba
- 26.gydF4y2Ba
郭松,郑勇,杨建刚,刘森,张志,Crasta OR, Sobral BW,徐勇,黄松,费铮。黄瓜不同性别花的转录组测序及比较分析。生物医学工程学报,2010;11(1):384。gydF4y2Ba
- 27.gydF4y2Ba
李建军,李建军,李建军,等。柿子y染色体编码小RNA的性别决定因素研究。科学。2014;346(6209):646 - 50。gydF4y2Ba
- 28.gydF4y2Ba
李建军,李建军,李建军,李建军。芦笋雌雄异株基因表达的研究[j]。gydF4y2Ba芦笋gydF4y2BaofficinalisgydF4y2Ba)。植物学报,2015,37(3):883-92。gydF4y2Ba
- 29.gydF4y2Ba
Bolger AM, Lohse M, Usadel B. Trimmomatic:一种用于Illumina序列数据的灵活修剪器。生物信息学2014:btu170。gydF4y2Ba
- 30.gydF4y2Ba
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I, Adiconis X, Fan L, Raychowdhury R, Zeng Q, Chen Z, Mauceli E, Hacohen N, Gnirke A, Rhind N, di Palma F, Birren BW, Nusbaum C, Lindblad-Toh K, Friedman N, Regev A. Trinity:基于RNA-Seq数据的转录组重建。生物工程学报,2011;29(7):644。gydF4y2Ba
- 31.gydF4y2Ba
Haas BJ, Papanicolaou A, Yassour M, Grabherr M, Blood PD, Bowden J, Couger MB, Eccles D, Li B, Lieber M, MacManes MD, Ott M, Orvis J, Pochet N, Strozzi F, Weeks N, Westerman R, William T, Dewey CN, Henschel R, LeDuc RD, Friedman N, Regev A。gydF4y2Ba新创gydF4y2Ba利用trinity平台从RNA-seq中重建转录本序列,进行参考文献生成和分析。学报,2013;8(8):1494-512。gydF4y2Ba
- 32.gydF4y2Ba
张国强,张国强。基于bbowtie的快速间隙读取比对。网络学报,2012;9(4):357-9。gydF4y2Ba
- 33.gydF4y2Ba
李建军,李建军,李建军,李建军。基于基因序列的基因组序列分析。gydF4y2Ba生物信息学gydF4y2Ba2015: btv351。gydF4y2Ba
- 34.gydF4y2Ba
杨建军,刘建军,刘建军,等。中文翻译:无参考文献质量评价gydF4y2Ba新创gydF4y2Ba转录组组件。基因工程学报,2016;26(8):1134-44。gydF4y2Ba
- 35.gydF4y2Ba
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ。基本的局部对齐搜索工具。中华生物医学杂志。1990;21(3):391 - 391。gydF4y2Ba
- 36.gydF4y2Ba
Götz S, García-Gómez JM, Terol J, Williams TD, Nagaraj SH, Nueda MJ, Robles M, Talón M, Dopazo J, Conesa A.基于Blast2GO的数据挖掘方法。核酸学报,2008;36(10):3420-35。gydF4y2Ba
- 37.gydF4y2Ba
李波,杜威,CN。RSEM:从有或没有参考基因组的RNA-Seq数据中准确定量转录本。BMC生物信息学。2011; 12(1): 323。gydF4y2Ba
- 38.gydF4y2Ba
罗宾逊MD,麦卡锡DJ,史密斯GK。edgeR:用于数字基因表达数据的差异表达分析的Bioconductor包。生物信息学,2010,26(1):139 - 40。gydF4y2Ba
- 39.gydF4y2Ba
Livak KJ, Schmittgen TD。利用实时定量PCR和2gydF4y2Ba−ΔΔCTgydF4y2Ba方法。方法。2001;25(4):402 - 8。gydF4y2Ba
- 40.gydF4y2Ba
刘建军,刘建军,刘建军,刘建军,刘建军。性别检测器:一种概率方法来研究非模式生物的性染色体。基因组生物学与进化,2016;8(8):2530-43。gydF4y2Ba
- 41.gydF4y2Ba
Krizek BA, Meyerowitz EMgydF4y2Ba拟南芥gydF4y2Ba同源基因APETALA3和PISTILLATA足以提供B类器官身份功能。发展。1996;时间为122(1):月11日至22日。gydF4y2Ba
- 42.gydF4y2Ba
贾刚,刘霞,Owen HA,赵东。TPD1小蛋白和EMS1受体激酶对细胞命运的影响。科学通报,2008;35(6):888 - 888。gydF4y2Ba
- 43.gydF4y2Ba
顾晋,朱军,于勇,滕晓东,娄勇,徐晓峰,刘建林,杨祖南。DYT1直接调控gydF4y2BaTDF1gydF4y2Ba用于绒毡层发育和花粉壁形成gydF4y2Ba拟南芥gydF4y2Ba.植物学报,2014,35(6):1010 - 1010。gydF4y2Ba
- 44.gydF4y2Ba
朱娥,尤春,王生,崔健,牛波,王勇,齐军,马宏,常峰。dyt1相互作用蛋白bHLH010, bHLH089和bHLH091是冗余需要的gydF4y2Ba拟南芥gydF4y2Ba花药发育和转录组。植物学报,2015;33(6):976 - 990。gydF4y2Ba
- 45.gydF4y2Ba
boalem A, Fergany M, Fernandez R, Troadec C, Martin A, Morin H, Sari M-A, Collin F, Flowers JM, Pitrat M, puruganan MD, Dogimont C, Bendahmane A。科学。2008;321(5890):836 - 8。gydF4y2Ba
- 46.gydF4y2Ba
王晓明,王晓明,王晓明,等。乙烯生物合成酶在植物雄性雄性不育研究中的应用gydF4y2BaCucumisgydF4y2Ba物种。科学通报,2009;4(7):644。gydF4y2Ba
- 47.gydF4y2Ba
Boualem A, Troadec C, Camps C, Lemhemdi A, Morin H, Sari M-A, Fraenkel-Zagouri R, Kovalski I, Dogimont C, Perl-Treves R, Bendahmane A。科学。2015;350(6261):688 - 91。gydF4y2Ba
- 48.gydF4y2Ba
Boualem A, lehemdi A, Sari M-A, Pignoly S, Troadec C, Abou Choucha F, Solmaz I, Sari N, Dogimont C, Bendahmane A.雌雄同体的性别决定基因早于分离gydF4y2BaCucumisgydF4y2Ba和gydF4y2BaCitrullusgydF4y2Ba属。科学通报,2016;11(5):e0155444。gydF4y2Ba
- 49.gydF4y2Ba
欧文克,Peterson C, Tolla G.硝酸银和氨基乙基氧乙烯基甘氨酸在雌蕊甜瓜上产生雌雄同体花的研究。Hortscience。1980;15(5):654 - 5。gydF4y2Ba
- 50.gydF4y2Ba
张杰,张建军,张建军,明荣。性别决定基因组学研究。植物学报,2014;18(6):1109 - 1106。gydF4y2Ba
- 51.gydF4y2Ba
Ito T, Shinozaki kgydF4y2Ba男性STERILITY1gydF4y2Ba基因的gydF4y2Ba拟南芥gydF4y2Ba它编码一个带PHD-finger基序的核蛋白,在绒毡层细胞中表达,是花粉成熟所必需的。植物生理学报,2002;43(11):1285-92。gydF4y2Ba
- 52.gydF4y2Ba
Sorensen AM, Kröber S, unus, Huijser P, Dekker K, Saedler H.gydF4y2Ba拟南芥败育小孢子gydF4y2Ba(gydF4y2Ba自动对盘及成交系统gydF4y2Ba)基因编码MYC类转录因子。植物学报,2003;33(2):413 - 423。gydF4y2Ba
- 53.gydF4y2Ba
杨鑫,Makaroff CA,马宏gydF4y2Ba拟南芥雄性减数细胞死亡1gydF4y2Ba基因编码一种博士指蛋白,这种蛋白是雄性减数分裂所必需的。植物学报。2003;15(6):1281-95。gydF4y2Ba
- 54.gydF4y2Ba
伊藤T,永田N, Yoshiba Y,高木大美M,马H, Shinozaki K。gydF4y2Ba拟南芥雄性不育性gydF4y2Ba编码博士型转录因子,调控花粉和绒毡层发育。植物学报。2007;19(11):3549-62。gydF4y2Ba
- 55.gydF4y2Ba
杨建军,张建军,张建军。雄性不育1是绒毡层发育和花粉壁生物合成所必需的。植物学报。2007;19(11):3530-48。gydF4y2Ba
- 56.gydF4y2Ba
杨建军,李建军,李建军,等。R2R3 MYB转录因子DUO1在男性生殖系生殖细胞分化中的作用gydF4y2Ba拟南芥gydF4y2Ba.植物学报,2011;23(2):534-49。gydF4y2Ba
- 57.gydF4y2Ba
Tsugama D, Matsuyama K, Ide M, Hayashi M, Fujino K, Masuda K.一个推测的MYB35同源基因的性别决定基因候选gydF4y2Ba芦笋gydF4y2BaofficinalisgydF4y2Ba.7 .科学代表2017gydF4y2Ba
- 58.gydF4y2Ba
王磊,王伟,王永强,刘永勇,王建新,张学强,叶东,陈立强。gydF4y2Ba拟南芥gydF4y2Ba半乳糖醛基转移酶(GAUT) 13和GAUT14在花粉管生长中具有冗余功能。植物学报,2013;6(4):1131-48。gydF4y2Ba
- 59.gydF4y2Ba
姜玲,杨树林,谢丽芳,普春春,张晓青,杨文昌,孙德立,叶东。gydF4y2BaVANGUARD1gydF4y2Ba编码一种促进花粉管生长的果胶甲基酯酶gydF4y2Ba拟南芥gydF4y2Ba花柱和发射束。植物学报。2005;17(2):584-96。gydF4y2Ba
- 60.gydF4y2Ba
田广伟,陈明辉,Zaltsman A, Citovsky V.花粉特异性果胶甲基酯酶与花粉管生长的关系。中国生物医学工程学报,2006;29(1):391 - 391。gydF4y2Ba
- 61.gydF4y2Ba
刘国强,刘国强,刘国强,刘国强,刘国强,刘国强,刘国强,刘国强,刘国强,刘国强,刘国强,刘国强。果胶METHYLESTERASE48参与gydF4y2Ba拟南芥gydF4y2Ba花粉粒萌发。植物生理学报,2015;36(2):367 - 368。gydF4y2Ba
- 62.gydF4y2Ba
詹华,钟毅,杨志,夏华gydF4y2Ba拟南芥gydF4y2Ba肌醇多磷酸激酶AtIPK2α和AtIPK2β参与花粉发育、花粉管引导和胚胎发生。植物学报,2015;32(5):758 - 771。gydF4y2Ba
- 63.gydF4y2Ba
董旭,洪震,Sivaramakrishnan M, Mahfouz M, Verma DPS。胼胝质合成酶(Callose synthase, CalS5)是小配子体形成和花粉存活所必需的gydF4y2Ba拟南芥gydF4y2Ba.植物学报,2005;42(3):391 - 391。gydF4y2Ba
- 64.gydF4y2Ba
Lago C, Clerici E, Dreni L, Horlow C, Caporali E, Colombo L, Kater MM.gydF4y2Ba拟南芥gydF4y2BaTFIID因子AtTAF6控制花粉管生长。中国生物医学工程学报,2009;31(1):391 - 391。gydF4y2Ba
- 65.gydF4y2Ba
刘建军,刘建军,刘建军,刘建军,刘建军,刘建军,刘建军,刘建军。纤维素合酶样基因的功能分析gydF4y2BaCSLD1gydF4y2Ba,gydF4y2BaCSLD2gydF4y2Ba,gydF4y2BaCSLD4gydF4y2Ba在tip-growinggydF4y2Ba拟南芥gydF4y2Ba细胞。植物生理学报,2008;38(3):1238 - 1253。gydF4y2Ba
- 66.gydF4y2Ba
秦勇,ledon AR, Manziello A, Pandey R, Mount D, Denic S, Vasic B, Johnson MA, Palanivelu R.花粉管中柱头和花柱的插入引发了一个新的转录组,指向雌蕊生长的关键基因。生物医学工程学报,2009;5(8):e1000621。gydF4y2Ba
- 67.gydF4y2Ba
谢波,王旭,洪震。早熟花粉萌发gydF4y2Ba拟南芥gydF4y2Ba小孢子形成过程中胼胝质沉积改变的植物。足底。2010;231(4):809 - 23所示。gydF4y2Ba
- 68.gydF4y2Ba
赵丽宁,沈丽康,张文忠,张伟,王勇,吴文华。CagydF4y2Ba2+gydF4y2Ba−依赖性蛋白激酶11和24调节向内整流K+通道的活性gydF4y2Ba拟南芥gydF4y2Ba花粉管。植物学报,2013,25(2):649-61。gydF4y2Ba
- 69.gydF4y2Ba
王晓明,王晓明,王晓明,等。植物中月桂酸链上羟基化酶基因CYP703的克隆及其对孢粉素合成的影响。植物学报。2007;19(5):1473-87。gydF4y2Ba
- 70.gydF4y2Ba
Dobritsa AA, Geanconteri A, Shrestha J, Carlson A, Kooyers N, Coerper D, Urbanczyk-Wochniak E, Bench BJ, Sumner LW, Swanson R, Preuss DgydF4y2Ba拟南芥gydF4y2Ba鉴定与花粉外壁产生有关的基因。植物生理学报,2011;57(2):947-70。gydF4y2Ba
- 71.gydF4y2Ba
熊淑霞,卢建勇,娄勇,滕晓东,顾建军,张超,石庆生,杨祖祖,朱杰。转录因子MS188和AMS形成复合体激活表达gydF4y2BaCYP703A2gydF4y2Ba用于孢粉素的生物合成gydF4y2Ba拟南芥gydF4y2Ba.植物学报,2016;38(6):936 - 946。gydF4y2Ba
- 72.gydF4y2Ba
赵德志,王国锋,斯特尔B,马宏杰gydF4y2BaMICROSPOROCYTES1过剩gydF4y2Ba基因编码一种假定的富含亮氨酸的重复受体蛋白激酶,该蛋白激酶控制体细胞和生殖细胞的命运gydF4y2Ba拟南芥gydF4y2Ba花药。基因发育,2002;16(15):2021-31。gydF4y2Ba
- 73.gydF4y2Ba
Albrecht C, Russinova E, Hecht V, Baaijens E, de Vries S.gydF4y2Ba拟南芥gydF4y2Ba体细胞胚胎发生受体样激酶1和激酶2控制雄性孢子发生。植物学报,2005;17(12):3337-49。gydF4y2Ba
- 74.gydF4y2Ba
Mizuno S, Osakabe Y, Maruyama K, Ito T, Osakabe K, Sato T, Shinozaki K, Yamaguchi-Shinozaki K.受体样蛋白激酶2 (Receptor-like protein kinase 2, rpk2)是控制花药发育的新因子gydF4y2Ba拟南芥gydF4y2Ba.植物学报,2009;35(5):751 - 756。gydF4y2Ba
- 75.gydF4y2Ba
De Storme N, Geelen dgydF4y2Ba拟南芥gydF4y2Ba突变体gydF4y2Ba杰森gydF4y2Ba在减数分裂II中通过平行/融合纺锤体机制产生未减少的第一次分裂恢复雄性配子。植物生理学报,2011;33(3):1403 - 1504。gydF4y2Ba
致谢gydF4y2Ba
我们感谢Nitish Lahigude先生维护植物。感谢普纳IISER大学Sanjeev Galande教授实验室提供的计算资源。gydF4y2Ba
资金gydF4y2Ba
rsd承认从CSIR,新德里获得的研究奖学金。感谢印度政府DBT (No-BT/PR16399/NER/95/125/2015)和浦那IISER主任的财政支持。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
原始测序数据存储在NCBI Short Read Archive (SRA)数据库(gydF4y2Bahttp://www.ncbi.nlm.nih.gov/sra/gydF4y2Ba),登记号为SRP111347。De novo-assembledgydF4y2BaCoccinia茅gydF4y2Ba花芽转录组可在gydF4y2Bahttps://doi.org/10.6084/m9.figshare.5220874.v1gydF4y2Ba.注释报告用于重新组装gydF4y2Bac .茅gydF4y2Ba使用Trinotate生成的花芽转录组可在gydF4y2Bahttps://doi.org/10.6084/m9.figshare.5217652.v1gydF4y2Ba.gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
RSD, AKB和SS计划和设计研究,RSD进行实验和分析数据。RSD, AKB和SS撰写了手稿。AB、JB和RKS参与了关键讨论、数据解释和手稿编辑。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
本研究使用的引物列表。(PDF 328kb)gydF4y2Ba
附加文件2:gydF4y2Ba
De novo-assembledgydF4y2BaCoccinia茅gydF4y2Ba花芽转录组。可以在gydF4y2Bahttps://doi.org/10.6084/m9.figshare.5220874.v1gydF4y2Ba.(FASTA 4100 kb)gydF4y2Ba
附加文件3:图S1。gydF4y2Ba
ExN50的统计值gydF4y2Bac .茅gydF4y2Ba花从头转录组组装。(TIFF 1799 kb)gydF4y2Ba
附加文件4:表S2。gydF4y2Ba
顶级匹配Swiss-Prot数据库条目的百分比长度覆盖分布。(PDF 7kb)gydF4y2Ba
附加文件5:表S3。gydF4y2Ba
Coccinia茅gydF4y2Ba使用TransRate计算花芽转录组指标。的蛋白质编码初级转录本gydF4y2BaCucumis巨大成功gydF4y2Ba作为参考。(PDF 10kb)gydF4y2Ba
附加文件6:表S4。gydF4y2Ba
注释报告用于重新组装gydF4y2Bac .茅gydF4y2Ba利用Trinotate生成花芽转录组。可以在gydF4y2Bahttps://doi.org/10.6084/m9.figshare.5217652.v1gydF4y2Ba.(XLSX 5870kb)gydF4y2Ba
附加文件7:图S2。gydF4y2Ba
转录物丰度的两两比较。MA图显示平均对数折叠变化(logFC)与跨重复计数的平均对数。火山图显示与FDR相关的差异表达转录本(错误发现率)。DE在FDR <0.05处的特征以红色表示。功能与gydF4y2BaPgydF4y2Ba-最大为1e-3和至少为2^2倍变化的值是差分表示的。(TIFF 5988 kb)gydF4y2Ba
附加文件8:表S5。gydF4y2Ba
p值最多为1e-3且至少为2^2倍微分表达的转录本的表达矩阵。(xls7379kb)gydF4y2Ba
附加文件9:表S6。gydF4y2Ba
两两比较中差异表达转录本的基因本体(GO)富集分析。(XLSX 1509 kb)gydF4y2Ba
附加文件10:图S3。gydF4y2Ba
基于r的分层聚类提取的转录本聚类x轴:样本;y轴:中位对数gydF4y2Ba2gydF4y2Ba(FPKM)。灰线代表个人成绩单;蓝线表示每个簇的平均表达式值。(TIFF 5037kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Devani, r.s., Sinha, s.s, Banerjee, J。gydF4y2Baet al。gydF4y2Ba雌雄异株、雌雄同株和化学上雄性化的雌性花蕾的从头转录组组装gydF4y2BaCoccinia茅gydF4y2Ba揭示与性表达和性修饰相关的基因。gydF4y2BaBMC Plant BiolgydF4y2Ba17日,gydF4y2Ba241(2017)。https://doi.org/10.1186/s12870-017-1187-zgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-017-1187-zgydF4y2Ba
关键字gydF4y2Ba
- Coccinia茅gydF4y2Ba
- 雌雄异体的gydF4y2Ba
- GynomonoeciousgydF4y2Ba
- 从头转录组gydF4y2Ba
- 雄蕊逮捕gydF4y2Ba
- 硝酸银gydF4y2Ba
- 乙烯gydF4y2Ba
- 花粉生育gydF4y2Ba