摘要
背景
紫杉醇是一种有效的抗癌药物;然而,类星体的积累在不同的tax物种。类星体差异积累的机制还不太清楚。因此,对三个转录组进行比较分析tax物种,包括t .媒体,t . mairei和t . cuspidata执行。
结果
Kegg富集分析显示,在不同的比较中显着富集了二萜类生物合成和细胞色素P450途径。这些紫杉醇生物合成相关基因的差异表达可能是对紫杉醇及其衍生物的间隙差异积累的潜在解释。此外,几种MEP途径相关基因的序列,例如dx,DXR,MCT.,CMK,MDS,HDS,HDR,IPPI., 和GGPPS.,基于来自三个的独立转录om重新组装tax物种。这些MEP途径相关酶的系统发育分析也显示出高序列相似之处t .媒体和t . cuspidata.此外,48个与ja相关的转录因子(TF)基因,包括10个MYBS,5小块土地S,4说唱S,3vtc.s和其他26个tf进行了分析。这些与JA相关的TF基因的差异表达表明,这三个基因对外源JA的应用有不同的反应tax物种。
结论
我们的结果为三个紫杉醇生物合成相关基因的表达模式和序列相似性提供了深刻的见解tax物种。这些数据给了我们一个机会,揭示了紫杉木内容的变化的机制,并选择最高屈服tax物种。
背景
紫杉醇(通用名紫杉醇),对某些类型的癌症治疗非常重要,首次从太平洋紫杉的树皮中分离出来水松杂草并获得了美国食品和药物管理局的上市批准,用于治疗各种癌症[1].由于受到野生紫杉生长缓慢、破坏性采伐技术和复杂的净化程序等几个障碍的限制,紫杉醇供不应求[2].
部分揭示了紫杉醇生物合成的代谢途径。首先,利用质体2- c -甲基- d -赤藓醇磷酸(MEP)途径产生的C5异戊二烯基前体异戊烯基二磷酸(IPP)和二甲基烯丙基二磷酸(dimethylallyl diphosphate)的三个单元合成了二萜紫杉烷核心的前体香叶基香叶基二磷酸(GGPP) [3.].GGPP环化为taxa-4(5),11(12)-二烯是由taxadiene合酶进行的,该酶催化一个缓慢但不限速的步骤[4,5].然后,向紫杉醇的途径涉及许多中间酶促步骤,包括八个羟基,五酰基/芳酰转移反应,一种环氧化,一次氧化,两个COA酯化和一个N苯甲酰化(6].例如,包括2α-、5α-、7β-、9α-、10β-、13α-和14β-羟化酶在内的几种细胞色素p450酶参与了紫杉二烯的氧化反应[7].附加到塞凡蛋白III的C13侧链的组装被认为是紫杉醇生物合成途径的最后步骤[8].
RNA-SEQ经常用于评估不同的表达差异tax物种。第一个转录本tax属属来自培养的细胞t . cuspidata2010年,然后是机构特定的转录omt . mairei发表在同一个和明年[9,10].不同的深度排序tax物种表明茉莉酸甲酯(MeJA)在萜类生物合成途径调控中的作用,该途径为紫杉醇生物合成提供前体[11,12,13].之间的比较t .媒体和t . mairei转录om提供进入稻草类生物合成途径涉及的候选基因的差异表达的见解[14].转录组的概要t对在不同温度下发现不同TF家族,如NAC、WRKY、bZIP、MYB和ERF家族参与了中国紫杉对冷胁迫的响应[15].最近,转录组合组装和系统鉴定细胞色素P450和WRKY家族t对都是由于的团队表演的[16,17].在一本小说t将云南栽培品种,转录组分析说明了紫杉醇生物合成的具体调控机制[18].
基因大规模鉴定的最新技术进展揭示了参与植物代谢调控的几个复杂过程[19,20.].在自然界中,每个分类类的数量因品种和种而异[21,22,23].因此,研究了三种不同类型紫杉类代谢相关关键基因的表达模式和序列相似性的变化tax物种将为选择产量最高的物种和阐明类群含量的物种相关变异机制提供机会。
方法
植物材料及RNA提取
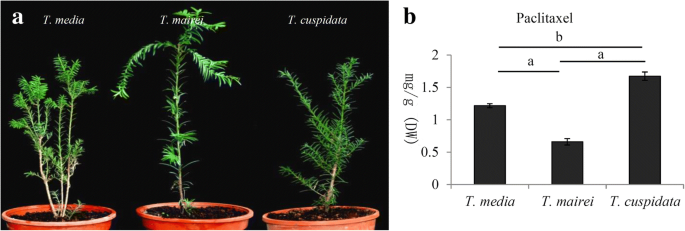
从三岁的栽培中收获了新鲜的枝条样品tax树木,包括t .媒体,t . mairei, 和t . cuspidata2015年3月,在杭州师范大学成长室,中国杭州(图)。1).将生长条件设定为25±1℃,光/暗循环为12/12小时,相对湿度为55-65%。我们的研究中使用了每种物种的五棵独立树。
对于RNA分离,我们使用了yu等人之前描述的方法。[14].详细地,根据其手册,使用RNEasy植物迷你套件(Qiagen,Hilden,德国)提取了总RNA。通过向混合物中加入DNA酶I来清洁DNA污染。使用1%琼脂糖凝胶电泳检查清洁RNA。使用RNA 6000纳米Labchip试剂盒(Agilent,Santa Clara,CA,USA)确认总RNA的质量,RNA完整性数> 7.0。
文库制备和转录组分析
每个RNA提取物(3个物种× 3个生物重复)的总RNA含量为10 μg。文库制备、de novo策略和转录组分析的方法与我们之前发表的工作相同[14].简而言之,RNA代表一个特定的mRNA被oligo (dT)附在磁珠。然后,将纯化的rna片段成小片段。利用样品制备试剂盒(Illumina, San Diego, USA)对这些小片段进行逆转录,创建cDNA文库。测序使用Illumina Hiseq 4000平台(LC-Bio,杭州,中国)按照其协议进行。
通过验证Q20、Q30和GC含量三个重要参数来评估所有读操作,使用FastQC在线工具(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)。对于de novo组件,使用软件三一对每种物种的转录组2.4.0 [24].在基因鉴定和表达分析中,将不同种的reads进行共组装,在基因序列分析中,将不同种的reads分别进行组装。原始序列数据已提交到NCBI Short Read Archive,登录号为GSE121523。
功能注释和富集分析
对于基因注释,我们使用Yu等人之前描述的方法[14].详细地,所有组装的未完成的unigenes都针对各种数据库,包括非冗余(NR)蛋白,基因本体(GO),Swissprot,Kyoto基因和基因组(Kegg)和EggnGog数据库,具有阈值E值< 0.00001。用内部perl脚本对DEGs进行GO和KEGG富集分析。
差异表达的Unigene(DEGS)分析
使用TPM方法计算每个UNIGENE的表达水平[25].筛选指标:ǀlog2(fold change) ǀ > 1,差异有统计学意义P< 0.05。对数变换后,转录本丰度值转化为z分数。根据他们的日志,使用MultiExperiment Viewer(版本4.9.0)绘制了热图2变换后z分数的值。
同源性分析和系统发育树建筑
采用默认参数ClustalW进行基因同源性分析。预测的紫杉醇生物合成途径关键基因的全长蛋白序列用于比对。利用GeneDoc软件对结果进行可视化,利用MEGA6.1软件采用NJ方法构建树。
紫杉醇含量分析
紫杉醇(≥99%;CAS编号33069-62-4)购自阿拉丁生化科技(中国上海)。取新鲜枝条,40℃干燥3 d,粉状。采用以前发表的方法制备粗提物和紫杉醇的测定[14].紫杉醇的定量采用至少三次重复±标准误差的方法。
统计分析
对于转录组分析,使用错误发现率来计算结果P价值观,和P值采用Benjamini和Hochberg方法进行调整。采用SPSS 19.0软件(SPSS Inc., Chicago, IL, USA)进行统计学分析,并采用方差分析比较两组间的差异。
结果
使用HPLC-MS / MS方法的紫杉醇内容的变化
更精确地确定三个紫杉醇内容的差异tax采用高效液相色谱-质谱联用技术。数据显示t . cuspidata包含最高水平的紫杉醇(1.67毫克)−1DW)和t . mairei紫杉醇含量最低(0.66 mg.g−1DW)(图。1b)。
转录组不同的tax物种
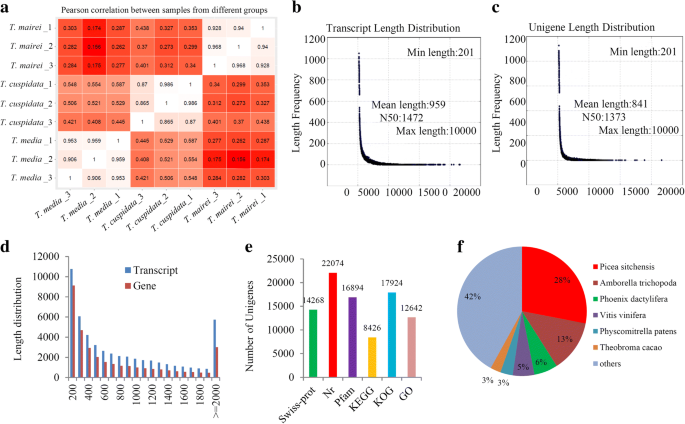
原始读取是合格的,适配器被删除,产生67.49 Gb的序列数据,其中19.84 Gb来自t .媒体, 21.90 Gbt . cuspidata, 25.75 Gb fromt . mairei(附加文件1).三次重复的成对皮尔逊相关系数×三tax物种表明测序数据的高重复性(图。2a).为了获得转录组变异的概述,进行主成分分析(PCA), PC1和PC2的解释值分别为18.4和36.2%(附加文件2).PCA清晰地将三个物种分为两组,表明它们之间非常相似t .媒体和t . cuspidata.
从这三个地方得到的所有读数tax结果共获得52261个转录本(N50: 1472),平均长度为959 bp(图5)。2b)、33,895个unigenes (N50: 1373),平均长度为841 bp(图5)。2c).转录本和unigenes的大小分布如图所示。2d.对于转录本,10.98%的reads长度为> 2000 bp,大部分(64.06%)的reads长度小于1000 bp。仅8.87%的unigenes长度为> 2000 bp,大部分在200 ~ 500 bp之间。在Swiss-Prot数据库中共注释了14268条unigenes,在Nr数据库中鉴定了22,074条unigenes,在Pfam数据库中与已知蛋白有显著相似性的unigenes有16,894条,在KEGG和KOG数据库中分别注释了8426条和17,924条unigenes(图2)。2e).注释的unigenes的物种分布如图所示。2F。
不同基因间差异基因的鉴定tax物种
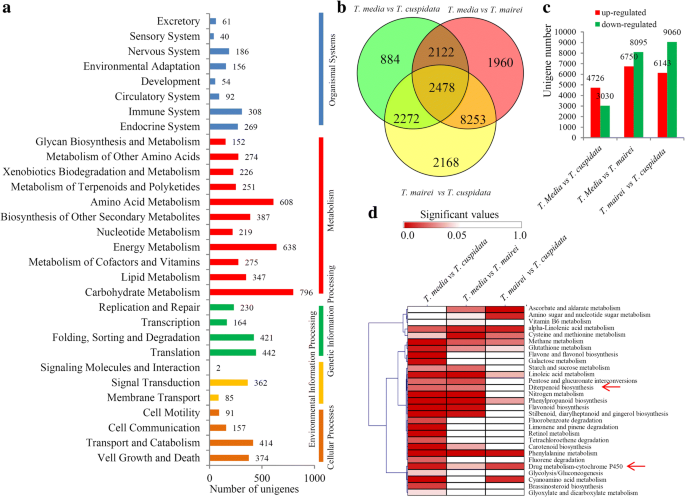
在我们的研究中,大量的unigenes被分为不同的KEGG代谢和信号通路(Additional file)3.).最丰富的KEGG途径是“氨基酸代谢”(608个unigenes)、“能量代谢”(638个unigenes)和“碳水化合物代谢”(796个unigenes)(图。3.一种)。
在每次比较中识别出的deg数用维恩图(图2)表示。3.b)详细地说,4726t .媒体高表达的unigenes和3030t . cuspidata在中发现了高度表达的unigenest .媒体vs。t . cuspidata比较。在t .媒体vs。t . mairei比较,6750个ungenes在t .媒体8095个ungenes在t . mairei.在t . maireivs。t . cuspidata相比之下,6143年t . mairei高度表达的unigenes和9060 t . cuspidata鉴定出高表达的ungenes(图。3.C)。
在这些通路中,有26条通路显著富集(P < 0.05) in thet .媒体vs。t . cuspidata比较。在t .媒体vs。t . mairei比较,18条通路显著富集,而在t . maireivs。t . cuspidata比较,仅富集11个途径(图。3.d)。
与紫杉醇生物合成途径相关的DEGs
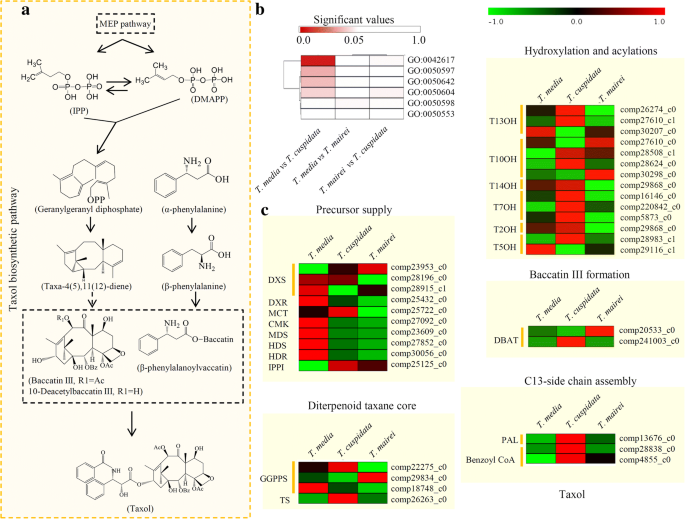
紫杉醇生物合成涉及到前体供应、二萜紫杉烷核心合成、羟基化、酰化、baccatin III形成和c13侧链组装等几个中间步骤(图13)。4) (6].一种transcriptomic analysis revealed six taxol biosynthesis-related GO terms, including ‘paclitaxel biosynthetic process’ (GO:0042617), ‘taxane 10-beta-hydroxylase activity’ (GO:0050597), ‘2-alpha-hydroxytaxane 2-O-benzoyltransferase activity’ (GO:0050642), ‘taxadiene 5-alpha-hydroxylase activity’ (GO:0050604), ‘taxane 13-alpha-hydroxylase activity’ (GO:0050598), and ‘taxadiene synthase activity’ (GO:0050553), and provided an opportunity to analyze the differential expression of taxol biosynthesis pathway-related genes among differenttax物种。具体来说,四个GO术语中的基因,包括GO:0042617 (P= 1.05e-9),执行:0050597 (P = 3.21E-4), GO:0050642 (P= 1.11E-3) and GO:0050604 (P= 8.36E-3)t .媒体vs。t . cuspidata比较(图。4b)。
与紫杉醇生物合成途径相关的unigenes的差异表达。一个紫杉醇生物合成途径综述。b紫杉醇生物合成相关氧化石墨烯六项的富集分析。重要的是P三个比较中每个GO项的值用热图显示。c紫杉醇生物合成途径相关基因表达分析。酶的简写为:DXS: 1-脱氧- d -木糖5-磷酸合酶;DXR: 1-脱氧- d -木糖5-磷酸还原异构酶;MCT: 2- c -甲基- d -赤藓醇4-磷酸胞苷转移酶;CMK: 4-(胞苷5-二磷酸)-2- c -甲基-d -赤藓醇激酶;MDS: 2- c -甲基- d -赤藓醇2,4-环二磷酸合成酶;HDS: 4-Hydroxy-3-methylbut-2-enyl-diphosphate合成酶;HDR: 4-羟基-3-甲基-2-烯基二磷酸还原酶;IPPI:异戊烯二磷酸异构酶;GGPPS:香叶酰香叶酰二磷酸合成酶; TS, taxadiene synthase; T13OH: taxoid 13-α-hydroxylase; T10OH: taxoid 10-β-hydroxylase; T14OH: Taxoid 14-β-hydroxylase; T7OH: taxoid-7β-hydroxylase; T2OH: taxoid-2α-hydroxylase; T5OH: taxadiene-5α-hydroxylase; DBAT: 10-deacetylbaccatin III-10-β-O-acetyltransferase; PAL: phenylalanine aminomutase; Benzoyl CoA: 2-debenzoyl-7,13-diacetylbaccatin III-2-O-benzoyl transferase. The bar indicated the “log2(expression folds)”
进一步研究了紫杉醇生物合成途径相关基因的表达模式。在MEP通路中,大多数基因在中表达量最高t .媒体.对于二萜类紫杉烷核心生物合成,编码关键酶,巨脂合酶的基因(Comp26263_C0),主要表达t . cuspidata.对于羟基化和酰化步骤,鉴定了一系列紫杉烷羟化酶编码基因,并且它们中的大多数高度表达t . cuspidata.在c13侧链组装中,鉴定了1个苯丙氨酸解氨酶编码基因(com13676_c0)和2个苯甲酰coa编码基因(comp28838_c0和comp4855_c0),主要表达于t . cuspidata(无花果。4C)。
MEP途径相关蛋白的系统发育分析
来自三个独立组装的转录组tax获得了12个MEP通路相关基因的全长序列。利用每个关键酶的三个预测肽序列构建系统发育树。大部分议员pathway-related酶,包括1-deoxy-D-xylulose 5-phosphate reductoisomerase (DXR) 1-deoxy-D-xylulose 5-phosphate合酶1 (DXS1) DXS2, 2-C-methyl-D-erythritol 2, 4-cyclodiphosphate合成酶(MDS), 4 -(胞嘧啶核苷5-diphospho) 2-C-methyl-D-erythritol激酶凯玛特为),gpp, geranylgeranyl二磷酸合酶1 (GGPPS1),和GGPPS2,来自t . cuspidata和来自t .媒体.4-羟基-3-甲基-2-烯基二磷酸还原酶(4-羟基-3-甲基-2-烯基二磷酸合成酶(4-羟基-3-甲基-2-烯基二磷酸合成酶(4-羟基-3-甲基-2-烯基二磷酸合成酶(4-羟基-3-甲基-2-烯基二磷酸合成酶(4-羟基-3-甲基-2-烯基二磷酸合成酶))和异戊烯基二磷酸异构酶(异戊烯基二磷酸异构酶(IPPI))三者之间的序列表现出高度相似性t .媒体和t . cuspidata(附加文件4).
转录组分析显示茉莉酸(JA)途径相关基因的差异
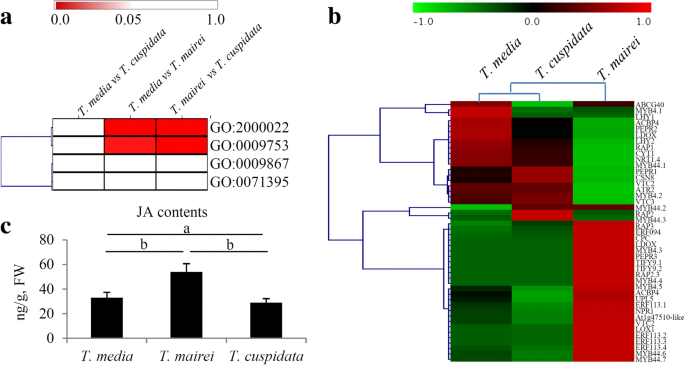
在转录组的基础上,鉴定了4个与JA代谢相关的氧化石墨烯转录因子,分别是“茉莉酸介导的信号通路调控”(GO:2000022)、“茉莉酸刺激的响应”(GO:0009753)、“茉莉酸介导的信号通路”(GO:0009867)和“茉莉酸刺激的细胞响应”(GO:0071395)。其中,GO的有效值为:2000022t . maireivs。t . cuspidata和t .媒体vs。t . mairei比较分别为0.044和0.034。对于GO:0009753,在t . maireivs。t . cuspidata和t .媒体vs。t . mairei分别为0.048和0.033(附加文件5).在这些术语中没有显著差异t .媒体vs。t . cuspidata比较。GO:2000022和GO:0009753的差异显著t .媒体vs。t . mairei和t . maireivs。t . cuspidata比较(图。5a).分析48个JA代谢及信号通路相关基因的表达模式(图2)。5b)。有趣的是,这些与...相关基因的表达模式t .媒体是相似的吗t . cuspidata(附加文件6).测定了三种植物的内源JA含量tax物种。观察到内源性JA含量的显着差异t .媒体vs。t . mairei和t . maireivs。t . cuspidata比较(图。5C)。
TFs家族的鉴定tax物种
据报道,许多TFS在紫杉醇生物合成中发挥重要作用。在我们的研究中,分析了属于17个主要TF系列的736个推定的TF编码基因进行了分析tax(附加文件7).大量转录因子包括MYB家族(174个基因)、ARF家族(90个基因)和WRKY家族(61个基因)。三种比较中差异表达的tf数见附加文件8.为了筛选紫杉醇生物合成的关键调控因子,将所有TF基因的表达水平显示在热图中(附加文件)9).
讨论
因为tax植物是紫杉醇的主要自然资源,综合植物化学分析tax物种已被执行[6,26].大量的化合物已在各种各样的tax物种 [27].然而,类群积累的水平可能在不同物种之间存在显著差异。以往的研究表明,紫杉醇的含量t . mairei,t .媒体, 和t . cuspidata针刺为0.163毫克−1,0.435毫克−1, 0.249毫克−1分别通过UFLC-ESI-MS和UFLC-DAD分析[28].在我们的研究中,t . mairei含有最低水平的紫杉醇,这与上一项工作的结果同意。但是,紫杉醇的内容t . cuspidata比那个高t .媒体.另一项研究表明,紫杉醇含量为0.1至0.4毫克.G−1在t . mairei一年的针头数目[29].Rikhari的集团表明,喜马拉雅紫花的树皮中的紫杉醇内容与树龄和性别有关[30.].紫杉醇的积累受自然环境和栽培条件的影响较大,因此紫杉醇的含量在不同的研究中存在差异。
在大肠杆菌中发现了大量的deg,其中富集了26个主要代谢途径t .媒体vs。t . cuspidata,t .媒体vs。t . mairei, 和t . maireivs。t . cuspidata比较(图。3.b, c).二萜紫杉烷骨架的形成是紫杉醇生物合成的重要步骤,发生在紫杉烷骨架环化之前[4].在我们的研究中,二萜类生物合成途径显着变化t .媒体vs。t . cuspidata和t .媒体vs。t . mairei比较。未观察到显著变化t . maireivs。t . cuspidata比较(图。3.d).这表明参与二萜生物合成的基因具有相似的表达模式t . mairei和t . cuspidata.另外,在所有三种比较中,含有一系列炸药氧基含量的药物代谢 - 细胞色素p450途径显着差异[7,31].上述两种重要代谢途径的差异表达可能提供了参与紫杉醇及其衍生物种间差异积累的一些基因。在紫杉醇生物合成途径中,α-和β-苯丙氨酸参与侧链组装[32,33].Kegg分析表明,在所有三种比较中,苯丙氨酸代谢途径被麻痹富集,表明侧链组装在紫杉醇的三种差异累积中的参与。此外,类黄酮和苯丙醇是分离的重要活性成分tax提醒提取物[23,34,35].在其中鉴定了两种富集的类黄酮代谢相关途径,包括类黄酮生物合成和黄酮和黄酮化合物生物合成途径t .媒体vst . cuspidata比较。我们的数据表明,黄酮类化合物的积累存在很大差异t .媒体和t . cuspidata.苯基丙素的生物合成途径在所有三种比较中都得到了丰富,这表明除了紫杉醇以外,不同的活性成分在不同的代谢过程中存在着深刻的差异tax物种。
之前的研究确定了一些与紫杉醇生物合成相关的基因,这些基因被分配到6个氧化石墨烯术语中[12,36].在t . baccata小植物,紫杉烷含量与表达水平相关tx,DBAT,BAPT, 和DBTNBT基因(37].在我们的研究中,紫杉醇生物合成相关基因的表达存在很大差异t .媒体和t . cuspidata(无花果。4b).研究了紫杉醇生物合成相关基因的表达模式,包括前体供应(10个)、二萜紫杉醇核心(4个)、羟基化和酰化(14个)、baccatin III形成(2个)和c13侧链组装(3个)。这些基因的动态表达水平可能为紫杉醇的种间差异积累提供了可能的解释。
紫杉醇生物合成途径中导致不同催化效率的关键酶的序列和结构特性与紫杉醇的生产密切相关[38,39].例如,10-deacetylbaccatin III-10-β-O-acetyltransferase (DBAT)催化适应度的提高,有助于baccatin III的大量积累[40].几个关键酶的序列根据每个独立的转录组重新组装tax物种。由于缺乏相应的基因组数据,大多数紫杉醇途径相关基因的组装序列不完善。幸运的是,大多数MEP通路基因的全长序列都是可用的。有趣的是,对于大多数MEP通路基因,例如DXR,dx,MDS,CMK,GPPS., 和GGPPS.,在两组之间观察到更大的序列相似性t . cuspidata和t .媒体.这一结果与三者间紫杉醇积累差异一致tax物种。
JA和MeJA在不同培养体系中被广泛应用于增加次生代谢产物的产生[41].外源MeJA还被用作一种有效的诱导子,以增加紫杉醇及其衍生物的产量tax细胞悬液文化(11,42].考虑到内源JA在t . mairei,内源性JAs水平可能达不到在紫杉醇生物合成中发挥作用的阈值。几种转录因子参与了ja介导的药用植物次生代谢的转录调控[43].在我们的研究中,我们鉴定了一些JA途径相关的基因,并对它们的表达水平进行了分析tax物种。在这些基因中,包括MYB、LHY和ERF等转录因子(图2)。5b)。这些JA相关TFS的差异表达表明三个不同的反应tax对外源MeJA应用的影响。
此外,增加的证据表明,涉及紫杉醇生物合成的调节的各种TF家族,如BHLH和WRKY [32].例如,TCMYC1,TCMYC2和TCMYC4涉及JA信号的转导和紫杉醇生物合成的调节[44,45].一个WRKY TF, TcWRKY1,在的转录激活中起作用DBAT在t对[46]。在我们的研究中,共鉴定出43个bHLH家族和61个WRKY家族转录因子。这些bHLH转录因子和大部分WRKY转录因子中有一半以上被鉴定为DEGst .媒体vs。t . cuspidata和t .媒体vs。t . mairei比较,提供紫杉醇生物合成的一些候选候选调节因素。
结论
紫杉醇生物合成途径相关基因的差异表达,包括前体供应-、二萜紫杉醇核-、羟基化和酰化-、baccatin III形成-和c13侧链组装相关基因的差异表达,可能为不同地区紫杉醇的种间差异积累提供了可能的解释tax物种。系统发育分析表明MEP通路基因的序列多样性可能是决定类群变异的另一个因素。我们的研究结果有助于更深入地理解三种类群的种间差异积累tax物种。
缩写
- 10-DAB:
-
10-deacetylbaccatin-III
- 方差分析:
-
方差分析
- CMK:
-
(4) -胞5-diphospho 2-c-methyl-d-erythritol激酶
- 度:
-
差异表达基因
- DXR:
-
1-Deoxy-D-xylulose 5-phosphate reductoisomerase
- DXS1:
-
1-脱氧- d -木糖5-磷酸合酶
- GGPP:
-
Geranylgeranyl二磷酸
- 走:
-
基因本体论
- 是:
-
茉莉酸;
- KEGG:
-
京都基因和基因组百科全书
- MDS:
-
2-C-methyl-D-erythritol 4-cyclodiphosphate合成酶
- Meja:
-
Methyl-jasmonate
- MEP:
-
2-C-methyl-D-erythritol磷酸
- UPLC-MS / MS:
-
超高效液相色谱耦合质谱法
参考
- 1.
Wani MC,Horwitz SB。自然作为一个非凡的化学家:紫杉醇发现和发展的个人故事。抗癌药物。2014; 25(5):482-7。
- 2.
Goodman J,Walsh V.紫杉醇的故事:自然和政治追求抗癌药物。纽约:剑桥大学出版社。2001; 107(2):577-8。
- 3.
Eisenreich W,Menhard B,Hylands PJ,Zenk MH,Bacher A.紫杉醇生物合成的研究:紫杉烷碳骨架不是普通酸的原点。Proc Natl Acad Sci U S A. 1996; 93(13):6431-6。
- 4.
Harrison JW, Scrowston RM, Lythgoe B, Harrison JW, Scrowston RM, Lythgoe B. Taxine。第四部分,出租车的构成。有机化学学报,1966:1933-45。
- 5.
Williams DC, Wildung MR, Jin AQ, Dalal D, Oliver JS, Coates RM,等。紫杉醇(Taxol)生物合成中紫杉醇二烯合酶的“伪成熟”形式的异体表达和表征,以及多步二萜环化反应的潜在中间体和抑制剂的评价。生物化学学报。2000;379(1):137-46。
- 6.
Croteau R,Ketchum Re,Long RM,Kaspera R,Wildung Mr。紫杉醇生物合成和分子遗传学。Phytochem Rev. 2006; 5(1):75-97。
- 7.
Kaspera R,Croteau R. cytochrome P450紫杉醇生物合成的氧气酶。Phytochem Rev. 2006; 5(2-3):433-44。
- 8.
Jiménez-Barbero J, Amat-Guerri F, Snyder JP。促进微管稳定的固体、溶液和微管蛋白结合的构象。抗癌药物。2002;2(1):91-122。
- 9.
郝大成,葛光国,肖鹏,张勇,杨磊。组织特异性的初步认识Taxu通过illumina第二代测序。《公共科学图书馆•综合》。2011;6 (6):e21220。
- 10.
Lee E-K, Jin Y-W, Park JH, Yoo YM, Hong SM, Amir R,等。培养的形成层分生组织细胞作为植物天然产物的来源。Nat生物技术。2010;28(11):1213 - 7。
- 11.
李圣,张P,张米,富琴,赵思,东益等。转录概况红豆杉细胞响应茉莉酸甲酯。BMC基因组学。2012; 13:295。
- 12.
孙刚,杨勇,谢芳,文剑锋,吴俊,孙刚,等。深度测序揭示转录组重编程水松×媒体用茉莉酸甲酯诱导细胞。《公共科学图书馆•综合》。2013;8 (4):e62865。
- 13.
茉莉酸甲酯抑制细胞生长并影响细胞周期进程tax细胞。植物学报2014;33(9):1479-92。
- 14.
于晨,郭华,张勇,宋勇,皮娥,于晨,等。两种红豆杉类群含量差异的潜在基因鉴定(Taxus Media和水松mairei).树杂志。2017;37(12):1659 - 71。
- 15.
胡建军,于晓东,马立军,等。紫杉的转录组反应(红豆杉)到冷压力。植物学报,2017;
- 16.
张敏,陈勇,聂林,金旭,廖伟,赵胜,等。参与紫杉醇生物合成调控的WRKY因子的转录组范围鉴定和筛选红豆杉.Sci众议员2018;8(1):5197。
- 17.
廖伟,赵胜,张敏,董凯,陈勇,付超,等。新型细胞色素p450的转录组组装及系统鉴定红豆杉.植物学报2017;8:1468。
- 18.
他CT,李ZL,周Q,沉C,黄yy,mubeen s等人。转录组分析揭示了新的紫杉醇合成的具体模式云南红豆杉品种。植物生理生化学报2018;122:10-8。
- 19.
Jin J,张H,张J,Liu P,Chen X,Li Z等。集成的转录组织和代谢组科分析,以表征冷应激反应烟草.BMC基因组学。2017; 18(1):496。
- 20。
徐强,朱军,赵胜,侯勇,李飞,太勇,等。转录组分析采用单分子直接RNA测序的方法,深入了解二级代谢途径中的基因山茶花Sinensis..植物科学学报2017;8:1205。
- 21.
Poupat C, Hook I, Gueritte F, Ahond A, Guenard D, Adeline MT,等。针叶中中性和碱性类群的含量tax物种。Planta Med。2000; 66(6):580-4。
- 22.
于超,罗旭,詹旭,郝军,张磊,YB LS,等。比较代谢组学揭示了两种濒危物种之间的代谢差异tax物种 (t . fuana和t将云南)在喜马拉雅山。BMC植物BIOL。2018; 18(1):197。
- 23.
Hao J,Guo H,Shi X,Wang Y,WAN Q,Song Y等。两种比较蛋白质组学分析tax物种 (水松×媒体和水松mairei)揭示了与紫杉醇和其他代谢物相关的代谢变化。植物生理学杂志。2017;114(24):6388。
- 24.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I,等。没有参考基因组的RNA-Seq数据的全长度转录组组装。生物科技Nat》。2011;29(7):644 - 52。
- 25.
基于RNA-Seq的哺乳动物转录组的定位和定量研究。Nat方法。2008;5(7):621。
- 26.
郑伟,朱伟,李昕,崔丽,等。反应和防御机制红豆杉利用比较蛋白质组学和代谢组学分析揭示了UV-A辐射下的叶片。植物生理学杂志。2016;57(9):1839-53。
- 27.
李春,霍春,张敏,石强。红豆杉的化学性质。红豆杉var. mairei。生物化学系统的生态系统。2008; 36(4):266-82。
- 28.
GE GB,Liang Sc,胡y,刘Xb,毛yx,张yy等。通过UFLC-ESI-MS和UFLC-DAD从各种毒品种类中快速定性和定量测定七种有价值的紫杉烷。Planta Med。2010; 76(15):1773-7。
- 29.
杨玲,郑志松,程飞,阮旭,姜达,潘春成,等。针叶代谢物的季节动态水松wallichianavar. mairei。分子。2016;21(10)。
- 30。
杨志强,李志强,李志强。喜马拉雅紫杉树皮中紫杉醇含量与树龄和性别的关系。植物化学,2002;60(6):627 - 31所示。
- 31。
Rasool S,Mohamed R.植物细胞色素P450S:命名和参与天然产物生物合成。原生质。2016; 253(5):1197-209。
- 32。
杨艳芳,张开凯,李丽英,李兴,魏颖,李宏伟,等。MYC转录因子的鉴定与鉴定taxsp。基因。2018; 675:1-8。
- 33.
Klettke KL, Sanjit S, Washington M, Walker KD。苯丙氨酸氨基变化酶催化的-苯乙烯-和-芳基- -丙氨酸产物。acta Chem . J . J . Chem . 2007; 29(11): 1688 - 1688。
- 34.
阮旭,詹利明,高XX,闫凌云,张辉,朱志勇,等。用聚苯乙烯和聚酰胺树脂从红豆杉残提取物中分离纯化黄酮类化合物。科学通报。2013;36(12):1925-34。
- 35.
金九苏k,yeon-ho h,Karchesy Jj,Young-Soo B.来自针刺的儿茶素的新苯基丙基丙酮衍生物水松cuspidata.acta photonica sinica, 2008;22(15): 1365-9。
- 36.
Nasiri J,Naghavi Mr,Alizadeh H,Moghadam Mr。基于季节的时间变化波动结果模式tx,DBAT,BAPT和DBTNBT基因与相关紫杉烷的产生Taxus Baccata..植物细胞批准。2016; 35(5):1103-19。
- 37.
Onrubia M, Moyano E, Bonfill M, Palazon J, Goossens A, Cusido RM。之间的关系tx,DBAT,BAPT和DBTNBT在开发过程中基因表达和紫杉烷生产Taxus Baccata.植株。植物科学。2011;181(3):282 - 7。
- 38.
Walker K,Croteau R. Taxol生物合成:苯甲酰 - CoA的分子克隆:紫杉烷2α-O-苯甲酰基转移酶cDNAtax和功能表达大肠杆菌.中国科学院院刊2000;97(25):13591-6。
- 39.
窦天宇,栾华伟,葛国宝,董明敏,邹海峰,何永强,等。一种新型纤维素类多酶复合物的功能和结构特性:水不溶性7-木糖-10-去乙酰紫杉醇的高效苷水解。Sci众议员2015;5:13768。
- 40.
Li B-J,Wang H,Gong T,Chen J-J,Chen T-J,Yang J-L等。改善紫杉醇生产的10-Deaetylbaccatin III-10-β-O-乙酰转移酶催化适用性。NAT Communce。2017; 8:15544。
- 41。
等。中国海洋大学学报(自然科学版)。茉莉酸甲酯介导的代谢和细胞周期进展的转录重编程的定位拟南芥细胞。Proc Natl Acad Sci U S A. 2008; 105(4):1380-5。
- 42。
茉莉酸甲酯诱导紫杉醇和baccatin III的过量生产tax细胞悬液的文化。生物科技Nat》。1996;14(9):1129 - 32。
- 43。
Sadia A,Jing-Jia H,Lou Z-Y.JA介导的药用植物中次生代谢的转录调控。SCI BULL。2015; 60(12):1062-72。
- 44。
张米,金X,陈义,魏米,廖开,赵某等。TCMYC2A,一种基本的螺旋环 - 螺旋转录因子,转换JA信号并调节紫杉醇生物合成红豆杉.植物科学学报2018;
- 45.
Lenka Sk,Nims Ne,Vongpaseuth K,Boshar Ra,Roberts SC,Walker El。紫杉醇生物合成基因的茉莉酮响应表达水松cuspidatabHLH转录因子TcJAMYC1、TcJAMYC2和TcJAMYC4对体外培养的细胞具有负调控作用。植物学报。2015;6:115。
确认
同时感谢中国杭州LC科技有限公司的技术支持。感谢刘开东(岭南师范大学生命科学与技术学院)阅读本手稿。
资金
我们的工作得到了中国浙江省自然科学基金的资助,根据批准号LY19C160001和LY19C200010,国家重点研发项目(2016年FFC0503100),国家自然科学基金(31501810)。资助机构在我们的研究中没有作用。
可用性数据和材料
当前研究中生成和分析的数据集可在NCBI Short Read Archive中找到,登录号为GSE121523。
作者信息
隶属关系
贡献
CS和MD对概念作出了实质性的贡献,参与起草手稿,并授予最终批准发布的版本。TZ,CY,XL和YB对获取数据分析进行了实质性贡献,涉及修改稿件,并授予最终批准发布的版本。LZ和CZ对数据的分析和解释作出了实质性贡献,涉及修改稿件,并获得最终批准待发布的版本。所有作者都已读取并批准了稿件,并确保了这种情况。
通讯作者
道德声明
伦理批准和同意参与
该项目使用植物材料,不使用转基因技术。当局负责tax资源均由长白山国家级自然保护区提供,经许可采集标本t . cuspidata和天目山国家级自然保护区,后者提供了采集样品的许可t . mairei,用于我们的科学研究。t .媒体是购自中国成都武旺农公司的栽培品种,武旺农公司允许我们将幼苗用于科学研究。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
附加文件1:
表S1。来自不同样本组的原始读取的详细信息。(XLSX 9 KB)
附加文件2:
图S1。三个转录组的主成分分析。(多克斯14 kb)
附加文件3:
表S2。unigenes的KEGG分类。(XLSX 580 kb)
额外的文件4:
图S2。与MEP途径相关的蛋白质的系统发育分析。(DocX 412 KB)
额外的文件5:
表S3。各种比较中每个与java相关的GO项的重要值。(XLSX 9 KB)
附加文件6:
表S4。JA相关基因的表达水平不同tax物种。(XLSX 17 kb)
额外的文件7:
表S5。三个转录因子的鉴定tax物种。(XLSX 205 kb)
附加文件8:
表S6。三个比较中的差异表达的TFS的数量。(XLSX 9 KB)
附加文件9:
图S3。三种比较中差异表达TF基因的热图。多克斯(283 kb)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
周涛,罗旭东,于超。等等。转录组分析提供了三个紫杉醇生物合成相关基因的表达模式和序列相似性tax物种。BMC植物杂志19,33(2019)。https://do.org/10.1186/s12870-019-164570-019-1645-x.
已收到:
接受:
发表:
关键词
- 表达式模式
- 紫杉醇
- Taxoid
- tax
- 转录组