摘要
背景
油菜素内酯(BRs)在植物营养生长和生殖发育中起着至关重要的作用。转录因子BZR1和BES1/BZR2被认为是中BR信号通路的下游调控因子拟南芥和米饭。大豆含有四种BzR1样蛋白(Gmbzls),据报道Gmbzl2.在BR信令规则中发挥守恒作用。然而,其他Gmbzls的角色尚未彻底研究,大豆中Gmbzls的目标仍不清楚。
结果
在本研究中,我们首先从四个GmBZL同源基因的表达模式、编码序列中的保守结构域和基因组复制时间等方面对大豆中GmBZL3进行了表征。结果表明,GmBZL3可能在大豆发育过程中起保守作用。过度的GmBZL3P219L.在Arabidopsis Br-Imsis突变体中bri1-5部分修复了包括br不敏感在内的表型缺陷,进一步证明GmBZL3在大豆和拟南芥同源基因之间是保守的。此外,通过ChIP-seq技术对GmBZL3靶基因的鉴定,发现BR在大豆中具有广泛的作用,调控多种途径,包括其他激素信号通路、疾病相关通路和免疫应答通路。进一步鉴定了br调控的GmBZL3靶基因,结果表明GmBZL3是调控br基因表达和大豆生长的主要转录因子。GmBZL3与AtBZR1/BES1靶点的比较表明GmBZL3在大豆BR信号网络中既可能起到保守作用,也可能起到特异作用。最后,对两个天然大豆品种进行了鉴定GmBZL3通过SNP分析,可以进一步了解基因在大豆发育过程中的作用。
结论
我们在这里说明,GmBZL3协调了一个全基因组的转录反应,这是br介导的大豆早期营养生长的基础,我们的结果支持BRs在大豆形态和基因表达水平发挥关键的调节作用。
背景
Brassinosteriods(BRS)在广泛的植物生长和开发过程中起重要和重要作用,包括细胞伸长,细胞分裂,植物建筑,光膀胱,根部发育,光合作用和衰老[1,2].BRs还在控制开花时间、雄性育性、果实成熟、种子发育、种子填充和种子休眠等方面发挥重要作用[3.,4].此外,BRS对于对各种非生物和生物应力的植物反应是必不可少的,例如盐,干旱,热,冷,氧化和重金属应力,病原体发作和除草剂/农药耐受性[5,6].近年来,遗传学、蛋白质组学和基因组学等技术对生物合成、信号转导和反应的分子机制进行了研究拟南芥.BR生物合成基因的表达受BR信号反馈的调节,以维持正常植物发育中细胞的平衡扩张[7,8,9].据报道,转录因子,BZR1和BZR2 / BES1直接染色和调节BR合成馈回环中下游靶基因的表达[10,11,12].当Br水平低时,BZR1由上游BR信号调节稳压器Bin2磷酸化,然后通过14-3-3蛋白保留在细胞质中或通过蛋白酶降解,这允许BR生物合成基因的表达,然后增加水平Br [13,14].当BR水平高时,去磷酸化的BZR1易位到细胞核,在细胞核中它可以结合到目标DNA区域,抑制下游BR生物合成和BR响应基因的表达[11,15].一些研究通过将BR反应基因与BZR1/BZR2靶基因联系起来,将BR信号与许多细胞过程联系起来[15,16].总之,BZR1和BZR2 / BES1是介导BR响应基因表达,协调BR信号和BR生物合成和生长反应的母转录因子。
大豆是一种高蛋白、高含油量的作物,为人类和动物提供许多产品,包括食物。研究结果表明,BRs在大豆生长发育过程中起重要作用。BRs在大豆根中主导根瘤的形成,促进大豆上胚轴伸长[17,18,19.].在孵育0.1μm至10μm的春匹吡吡啉的0.1μm至10μm后的3周内,大豆的总旋转,植物鲜重,根长度,芽长度,首先节间长度和横向根数减少[20.].干旱胁迫前叶面施用BRs可部分缓解干旱胁迫对大豆生长的不利影响[21.].gmcpd,催化BR合成的基因,参与开花调控的早期阶段[22.].拟南芥突变体的荚果大小和株高bri1-5可以通过过表达辅成GmBRI1,这表明GmBRI1可能作为BR受体介导BR信号[23.,24.].然而,将BR信号与各种形态和生理反应联系起来的基因调节网络在大豆中仍然很大程度上是未知的。
最近,关于Gmbzl2.(AtBZR1-like基因)在大豆中进行了研究。过表达GmBZL2P216L.拟南芥转基因植株可部分修复植株的缺陷bri1-5这表明GmBZL2参与了一个保守的BR信号调控通路大豆[25.].据报道,具有较大豆荚的大豆品种通常具有更高的GmbzR1(Gmbzl2.)POD中的表达水平[26.].这些结果表明,了解GmBZL2在大豆BR信号传导途径中的角色可以提供有价值的信息,以提高大豆生产率。然而,大豆包含四个GmBZL基因,和其他的功能GmBZL基因仍然不清楚。此外,基因组研究表明,BZR1和BES1 / BZR2直接调节数千种靶基因拟南芥,揭示植物生长调节监管网络[15,16].需要类似的GmbzL靶标的基因组研究来阐明大豆中BR的功能。
在该研究中,GmbZL3首先表征在大豆基因组中。职能GmBZL3通过过表达的Gmbzl3和Gmbzl3研究了BR信号传导P219L.在拟南芥bri1-5突变体。此外,我们的ChIP-seq分析证实GmBZL3不仅作为转录调节因子介导BR信号转导,而且作为中枢介导BR与其他途径的串音。最后,自然变化GmBZL3使用大豆全基因组重新命令数据探索编码序列,为未来提供了良好的基因功能分析资源。
结果
表征GmBZL3在大豆基因组中
这四个GmBZLs在g·马克斯基于系统发育树分析,在内部分为两个亚组,这表明它们可能来自大豆进化期间的特定复制事件[25.].大豆基因组在进化过程中经历了节段复制和串联复制事件,导致基因家族扩展,大豆的节段复制事件发生在5900万年前和1300万年前(mya) [27.].Ka/Ks是每个非同义位点的非同义替换数(Ka)与每个同义位点的同义替换数(Ks)之间的比率。在这里,计算Ka/Ks比值来评估GmBZLs的近似复制日期。我们发现GmBZL1/2和GmBZL3/4的基因组重复分别发生在大约11和16 mya。因此,GmBZL1/2和GmBZL3/4的复制可能是通过分段复制(Additional file .1).然而,重复的GmbzL基因在很强的阴性选择下,因为它们的Ka / Ks比率估计为<1(从0.05到0.15而变化)。
然后,我们分析了表达式轮廓GmBZL来自发布的RNA-SEQ数据集不同植物和生殖组织中的基因[28.].如附加文件所示2一个,GmBZL3转录本在荚果中大量积累,同时Gmbzl2.GmBZL1/4在茎尖分生组织中高表达。有几篇报道证实了这一点atbzr1.从事各种压力响应[5,6,29.].获得更多地洞察角色GmBZLs在非生物应激下,使用QRT-PCR进一步表征各种非生物胁迫条件(钠,冷,脱水和ABA)下的基因表达模式(附加文件2c)。结果表明GmBZL3在盐度和脱水胁迫下表达水平都增加,表明在非生物胁迫下通过转录调控发挥作用。
为了识别可能是功能关系的后果的相似区域,之间的多个氨基酸序列比对AtBZR1 / BZR2和GmBZLs.如图1所示。1,GmBZL3含有高度保守的序列,包括N-末端DNA结合结构域,推定的14-3-3个结合位点和十六个推定的Bin2磷酸化位点。此外,GmBZL3还含有害虫结构域(富含脯氨酸,谷氨酸,丝氨酸和苏氨酸的区域),其与拟南芥基因的高相似性份额。保守的氨基酸脯氨酸(图。1在GmBZL3的害虫区域中发现了影响蛋白质定位和磷酸化状态的红色和盒子的红色和盒子。上述所有观察结果表明,GmBZL3在大豆的BR信号通道中发挥着保守的作用。
交叉物种互补测试GmBZL3在拟南芥
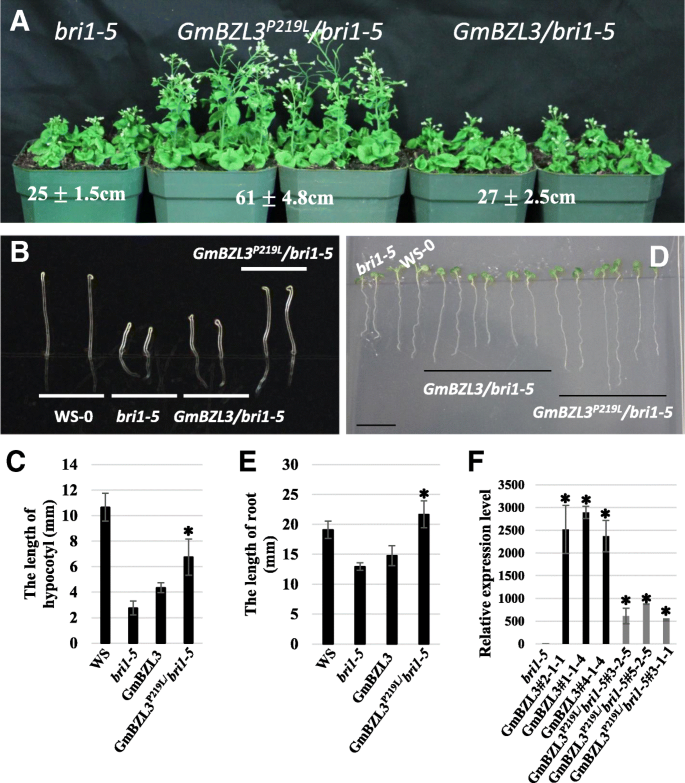
占主导地位BZR1-1D.突变增加BZR1蛋白积累,抑制br不敏感突变(bri1)表型,增强BR生物合成的反馈抑制拟南芥[10].BR和过表达的Gmbzl2诱导的Gmbzl2的核定位和磷酸化比P216L(含有保守的脯氨酸突变突变)拟南芥col0可以产生BZR1-1D.表型(25.].进行了种间互补试验,以检验GmBZL3基因是BR信号通路中功能保守的调节因子。转基因拟南芥植株被过度表达GmBZL3或GmBZL3P219L.(含有脯氨酸含量亮氨酸突变)bri1-5突变体。如图1中所示。2,形态表型无明显差异Gmbzl3 / Bri1-5转基因植物和bri1-5突变体(图。2a)。此外,GmBZL3/bri1-5植物表现出类似的表型bri1-5在幼苗阶段的暗或光条件下的突变体(图。2是)。然而GmBZL3P219L./bri1-5转基因植物显示出一个bzr1-1D -在正常条件下,成熟期株高提高(图1)。2一个)。GmBZL3P219L./ bri1-5与那些相比,幼苗几乎是黑暗条件下的下胚轴长度的两倍。bri1-5突变体苗(无花果。2b、c).在光照条件下,根的生长GmBZL3P219L./ bri1-5幼苗的时间长于bri1-5突变体(图。2d和e)。有趣的是,更高的RNA表达水平GmBZL3在Gmbzl3 /bri1-5与Gmbzl3相比P219L./bri1-5(图中被发现。2F).综上所述,这些结果表明GmBZL3在外源表达时可以调控BR信号通路拟南芥因此在功能上保守。
GmBZL3P219L.救援的bri1-5转基因植物中的不敏感表型。Gmbzl3 /bri1-5表示过表达的Gmbzl3bri1-5突变体。GmBZL3# 2-1-1、GmBZL3#1 -4和GmBZL3#4 -4是三个独立的线,其中GmBZL3在bri1-5背景。GmBZL3P219./bri1-5表示过表达的Gmbzl3.P219.在里面bri1-5突变体。GmBZL3P219./bri1-5#3-2-5,Gmbzl3P219./bri1-5# 5-2-5和GmBZL3P219L./bri1-5#3-1-1是过度扩张的三条独立线路P219L.在一个bri1-5背景。一个一个月大的植株高度bri1-5过表达GmBZL3的突变体被明显挽救P219..b-c在各种植物线中4天幼苗(在黑暗中生长)的幼杆植物长度的比较。d e不同株系7天幼苗(光照下生长)主根长度的比较f通过定量RT-PCR检测不同品系的转基因表达。比较值之间的显著差异显示(P< 0.05)。误差条表示S.D.(n≥30)
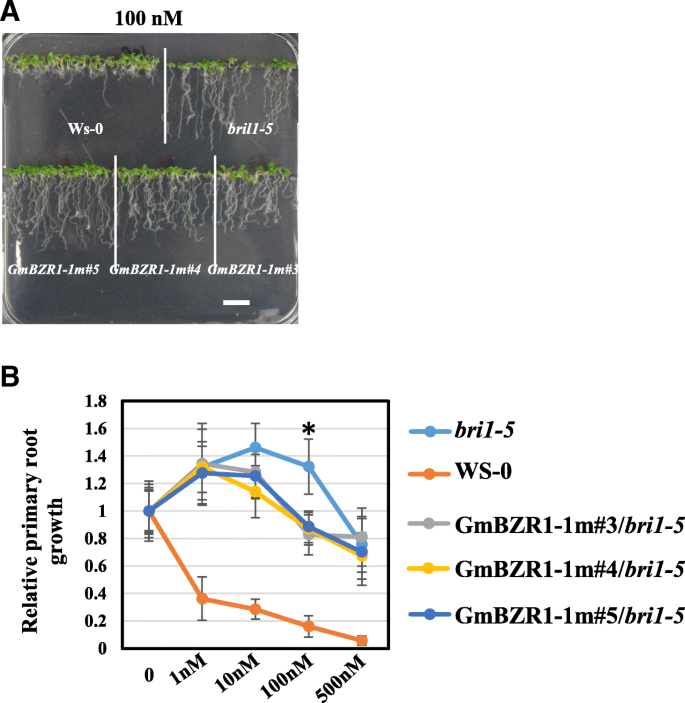
以前的研究表明,ATBZR1和GmBZL2可以部分拯救BR敏感性表型bri1-5突变体中拟南芥[10,25.].如图1所示。3.A,外源100nm Bl显着抑制野生型的根长。但是,根长度bri1-5较低浓度(1-100 nM)的BL,则有明显的增加。我们也发现了过度表达GmBZL3P219L.部分救出了bri1-5在10 nM和100 nM处均表现为不敏感表型。3.b)。不敏感的表型显着救出GmBZL3P219L./ bri1-5幼苗相比,bri1-5100 nM BL处理。这一结果表明,该基因的PEST基序中存在保守氨基酸突变(P219L)GmBZL3导致BR反应表型的改变。
芯片SEQ结果表明,GmBZL3规范了广泛的生物过程和细胞活动
利用抗GmBZL3抗体进行ChIP-seq实验,鉴定大豆中GmBZL3直接调控的基因。由于未使用免疫前血清作阴性对照,故采用重测序前DNA免疫沉淀的ChIP-qPCR方法进行分析。四个基因(DWF4,BR6ox2,CPD,BAS1),可以作为GmBZL3目标被选择。以蛋白磷酸酶2A (PROTEIN PHOSPHATASE 2A, PP2A)通过蛋白相互作用介导BZR1的去磷酸化和激活为阴性对照。如附加文件所示3.,与PP2A的DNA的免疫沉淀显着富集的DWF 4片段的量。在其他三个推定目标中发现了没有显着差异。
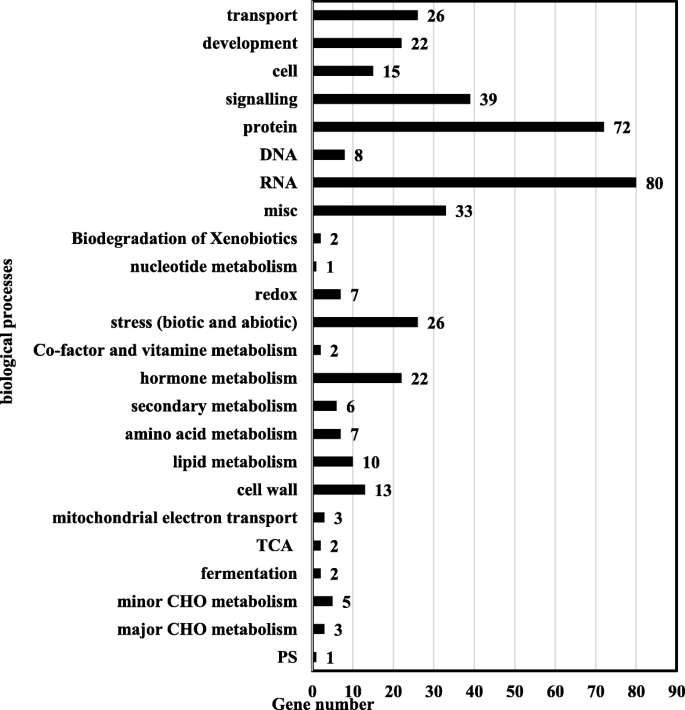
在两个独立的生物重复序列中鉴定出5185个结合峰。这些结合位点与所有20条大豆染色体上的2923个最近邻基因相连。其中729个高分基因被认为是高置信度gmbzl3结合靶基因(Additional file)4),并纳入后续研究。GO项分析显示,有407个基因参与了不同的生物过程(图1)。4)和322个基因未分配给任何已知的方法。在富集的生物过程中,RNA(转录的调节)和蛋白质组成了最大的亚组。与运输(26)相关的基因,发育(22)信号传导(39),杂项(33)和应力(26)代表了主要类别,表明GmBZL3在大豆发育中发挥多种作用。还发现了次级新陈代谢类别的少量基因,氨基酸代谢(7),脂质代谢(10)和碳水化合物代谢(8)。根据分子功能分布,共发现七种类别,在参与DNA结合,序列特异性DNA结合转录因子活性,蛋白质结合,运输活性等中的基因中高度且显着富集,(附加文件5,p< 0.05)。这些结果表明GmBZL3是一个主要的转录因子,负责基因表达和大豆生长。
GmBZL3直接调控基因,这些基因在其他激素的合成和反应中发挥作用
在生理水平和基因表达水平之间观察到BR和其他激素之间的串扰拟南芥[30.,31.,32.,33.,34.].然而,在大豆中激素之间的功能相互作用在很大程度上在很大程度上是未知的。在这项研究中,我们发现一些与生长素信号传导,响应和合成有关的基因,该基因由GmbZL3直接靶向,包括Saur样蛋白,GH3和YUCCA3(表1).乙烯代谢和乙烯反应途径调控的直接靶基因(Glyma.06G221800和Glyma.18G164100)。此外,GmBZL3靶向许多赤霉素合成降解相关基因和ga调控的家族基因(Glyma.13G039600和Glyma.13G069900)。几种茉莉酸(JA)途径相关基因,包括LOX2.,AOC4.和opr2.,在我们的芯片SEQ实验中识别出来。Jaz1是JA信令的团体和压缩机拟南芥[35.].在这里,我们发现Gmbzl3可以结合两个Jaz1基因的启动子区域,这可能表明BR和JA之间的负面关系。这些结果表明,在大豆和其他激素之间的串扰存在,并且该GmBZL3作为介导荷尔蒙串扰的中间因素。
Gmbzl3在BR和其他开发途径之间介导串扰
在拟南芥, BR与脱落酸、乙烯或水杨酸之间的激素相互作用参与应激相关的发育[29.].然而,油菜素丁酯参与大豆抗逆性的分子机制尚不清楚。有报道称BZR1通过诱导几种负调控早期免疫应答的WRKY转录因子的表达介导免疫信号与BRs之间的拮抗作用[36.].在这里,我们发现通过GmbZl3靶向几种相关基因和腕骨转录因子。BR通过在叶片中的膨胀和分裂上作用来控制植物生长[37.].ATBZR1蛋白在暗条件下积聚在拟南芥缺苗的生长区域中,表明BZR1在细胞扩张中发挥作用[10].拟南芥的研究BZR1-1D.突变体表明BZR1参与生长促进[10].在这里,我们发现GmBZL3直接调控4个expansin基因的表达(表1).发现了几个参与干旱和热胁迫反应的靶点,如热休克蛋白、热休克转录因子和ERD15(对脱水的早期响应15)。此外,GmBZL3调控衰老、脂肪酸生物合成和水果糖合成酶相关基因。这些结果不仅证实了类似的BR调控机制存在于拟南芥但也提示转录因子GmBZL3直接将BR信号转导与大豆发育联系起来。
GmbZL3目标的表达在大豆不同BR水平下紧密调节
ProPiconazole(PCZ),BR生物合成抑制剂,抑制BR新陈代谢并诱导BR缺陷拟南芥、玉米及大豆幼苗[38.(Song et al.,未发表)。BR反应基因的表达水平受BR浓度的精确调控[11,12,16].通过使用阶段V1(第一节:在Unifoliolate Node的Unifoliolate节点的完全发育的叶子)进行基因组基因表达分析,暴露于较高浓度的BR合成抑制剂的大豆幼苗,其中包含血管内酯。简而言之,用含有高浓度BR合成抑制剂的水(5μm丙酰唑10天,横幅MAXX-60,207-90-1,Syngenta,Greensboro,Nc)或高浓度抑制剂和低的施用v1阶段大豆植物浓度芸苔(BL)(5μmPCZ,10nm BL,10天,PCZ-B1)。用高浓度抑制剂10天处理(5μmPCz10天,施用高浓度BL或8小时,然后用1μmBL1H,PCZ-BL-1 H;5μmCCZ10天,然后1 μM BL for 8 h, Pcz-BL-8 h) (Song et al., unpublished). To characterize the genome-scale adjustment of GmBZL3 targets during soybean development, the overlap between GmBZL3 targets and BR-regulated genes was examined.
我们发现,在至少一个处理条件下,154个靶标的转录物丰度显着改变(图。5a).此外,在相同浓度的BR下,部分GmBZL3靶点的转录水平被诱导,而其他靶点的转录水平被抑制。部分基因在特定处理下有显著差异,而在其他处理下无明显变化。进一步选择GmBZL3的6个靶基因,利用qRT-PCR验证其在不同BR水平上的表达模式。如图1所示。5b, 5 μM Pcz和1 μM BL分别显著降低水苏糖合酶基因(Glyma.19G21770)和热休克蛋白(Glyma.03G171100) 8 h。在5 μM Pcz条件下,1 nM BL或1 nM BL联合处理均可使1个扩增蛋白基因(Glyma.01G050100)降低。1 μM BL作用1或8 h后,该基因的表达可以恢复。这些结果表明,大豆GmBZL3靶标的表达模式受不同BR水平的特异性控制,在大豆对不同BR水平的响应过程中,GmBZL3发挥着重要的调控作用。
GmBZL3靶基因对BR抑制剂联合或不联合表油菜素内酯反应的表达模式。一个在大豆威廉姆斯82下的不同GmbZl3靶表达模式的热图表示在以下条件下(PCZ:5μmCCZ10天。PCZ-BL:5μmPCZ,10nm BL,10天。PCZ-BL-1 H:5μmPCZ 10天,然后用1μmBL1小时。PCZ-BL-8 H:5μmPCZ10天,然后用1μmBL持续8小时)。在转换为颜色刻度(LOM2转化的比率)之前,表达数据值是中心为中心的并为每个基因标准化。底部的颜色栏显示了从最高表达水平(红色)到最低表达级别(绿色)的表达值的范围。0是中值表达水平(黑色)。b使用在对照中使用从WM82幼苗分离的总RNA进行六种GmBZL3靶基因的QRT-PCR分析。PCZ。PCZ-BL。PCZ-BL-1 H和PCZ-BL-8 H治疗。在与肌动蛋白(Glyma.18G290800)转录值标准化后显示相对基因表达水平(折叠变化,log2)。误差棒表示平均值的标准误差。Y轴表示不同样品中的相对基因表达水平。进行了三个独立的实验。显示了代表性结果。星号(*)表示平均值(p< 0.05)
GmbZL3和ATBZR1 / BES1目标的比较
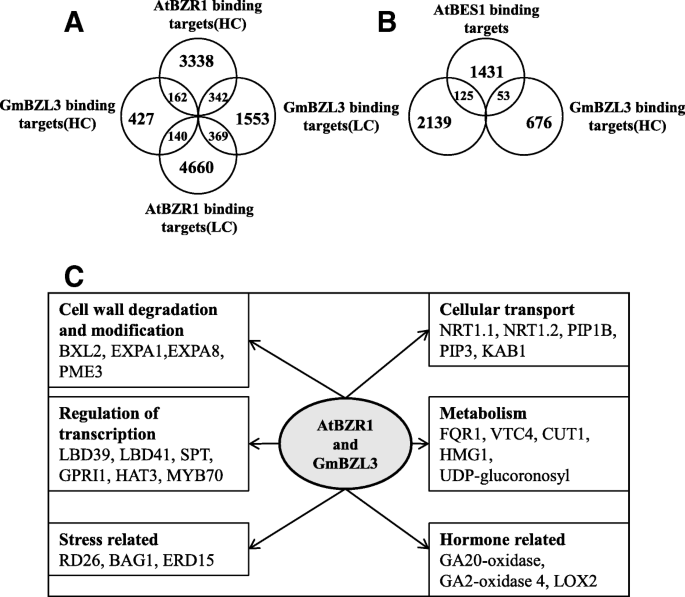
芯片芯片的研究已经确定BZR1和BZR2 / BES1直接调节成千上万的基因,揭示了芸苔类固醇转录网络拟南芥[15,16].揭示BR基因网络之间的进化变化拟南芥我们首先比较了3410个BZR1高置信靶点和729个GmBZL3高置信靶点同源物。我们的结果显示,729个GmBZL3靶标中有162个(22.2%)与BZR1靶标相同(图2)。6一种)。此外,729(19.2%)GmbZL3靶基因中的140个与BZR1低置信度重叠。因此,总共302(41.4%)GmbZL3高置信靶同源物与BZR1靶标匹配。然而,在GmBZL3靶同源物和BES1靶中发现只有53(7.27%)重叠基因(图。6b)。这些分析在一起证明了Gmbzl3可能在大豆BR信令网络中扮演保守以及类似于BZR1的作用的特定角色拟南芥.此外,GmbZL3和BES1之间的少量重叠目标可能意味着大豆之间存在不同的功能拟南芥.
GmBZL3与AtBZR1/BES1目标比较a - b维恩图显示GmBZL3靶基因与BZR1或BES1靶基因重叠。HC:高信任度。LC:低。cGmBZL3靶基因与BZR1靶基因在各种细胞、反应和代谢途径中具有代表性的重叠。NRT1.1(硝酸盐转运体1.1)。NRT1.2(硝酸盐转运体1.2)。PIP1B(质膜固有蛋白1;2)。PIP3(质膜固有蛋白3)、KAB1(钾通道β亚基)。FQR1 (flavordosin -like quinone reductase 1)、VTC4 (Inositol monphosphatase family protein)。3-羟基-3-甲基戊二酰辅酶a还原酶(HMG1)。LOX2 (Lipoxygenase 2)、BXL2 (Beta-xylosidase 2)、EXPA1 (Expansin A1)。EXPA8(棒曲霉素A8)。PME3(果胶甲基酯酶3)、LBD39(侧器官边界结构域蛋白39)。 LBD41 (lateral organ boundaries domain protein 41). SPT (SPATULA). GPRI1 (GOLDEN2-like 1). HAT3 (Homeobox-leucine zipper protein 3). AtMYB70 (Myb domain protein 70). RD26 (Responsive to dessication 26). BAG1 (BCL-2-associated athanogene 1). ERD15 (Early responsive to dehydration 15)
GmBZL3靶标同源物与BZR1靶标之间的这些重叠基因的分析显示了广泛的细胞运输、细胞壁相关酶、转录因子、代谢、应激和激素相关基因(图1)。6c).例如,EXPA1和EXPA8可能介导了细胞伸长和分化的BR反应,GmBZL3和BZR1都对其进行了靶向。赤霉素合成降解相关基因ga20氧化酶和ga2氧化酶均受GmBZL3和BZR1的调控。这些结果表明,大豆和大豆的BR反应网络中有几个发育过程是保守的拟南芥并揭示了BR与其他调节途径之间的串扰节点。
探索自然变化GmBZL3利用大豆全基因组重测序数据进行编码序列
来了解遗传变异GmBZL3利用全基因组重测序数据,在106个大豆基因型中鉴定了单核苷酸多态性[39.].在编码区中只观察到两个同义SNPGmBZL3与参考基因组序列(威廉姆斯82)进行比较(附加文件6).然而,在大豆品系PI594599和PI603154中发现了1个核酸缺失。这一核酸缺口引起氨基酸框架移位,并在这两个大豆基因型株系中引入过早终止密码子。具体来说,保守的PEST序列GmBZL3由于此删除,可以完全改变。这些鉴定的大豆线可以用作突变源,用于大豆BR信号通路中的GmbZL3基因的进一步函数表征。
讨论
在这里,我们在此说明了Gmbzl3核心基因组的转录反应,使BR介导的大豆早期营养增长造成了基础的转录反应,以及我们的结果支持,其中BRS在许多过程中起着至关重要的调节作用,这些过程范围从形态到基因表达水平。跨物种互补测试拟南芥证明GmBZL3在调节BR信号通路中起着保守而广泛的作用。
基因序列及结构特征GmBZL3
atbzr1.和AtBES1 / BZR2在拟南芥在整体氨基酸序列上有88%的相似性,在n端DNA结合域上有97%的相似性[10].此外,atbzr1.和AtBZR2 / BES1与类似的DNA序列结合,例如E-BOX(Canntg)和BrRE(CGTGT / CG)图案[11,12,16].这些高序列相似性的发现表明BZR1基因家族可能具有保守的生物学功能。在大豆、四GmBZR1矫形器显示出类似的序列域atbzr1.和AtBES1 / BZR2.有报道称PEST序列作为蛋白水解信号区,以蛋白质为靶点进行快速降解[40].鉴定了位于BZR蛋白序列中的害虫序列拟南芥、米及大豆[10,25.,41.].害虫结构域中的脯氨酸致亮氨酸突变导致BZR1的积累和改变的BR响应表型BZR1-1D.和bes1-D突变体(41.].BZR1-1D中的害虫序列突变增加其与PP2A磷酸酶的相互作用,并增强BZR1蛋白的磷酸化[42.],降低其与14-3-3蛋白的结合亲和力,同时增加其核聚集和DNA结合[13].BZR1-1D等位基因在转换成时逆转矮化表型bri1-5突变体,而野生型过表达BZR1WT或bri1-5由于BZR1活性受到磷酸化的严格控制,突变植株没有引起明显的表型变化[10].转基因生物功能验证证实了一个位于GmBZL3 PEST基序的保守突变的作用拟南芥植物(图。3.).c端结构域是BZR2/BES1与体内BIN2或BIM1相互作用所必需的[12,43.].在该研究中,在GmBZL3中鉴定了16个推定的Bin2磷酸化位点。缩短的胚囊,根和茎是拟南芥BR受体突变体最值得注意的形态特征。过度的GmBZL3P219L.可以拯救茎,幼杆基和根长度,但不能按预期拯救BR不敏感性。这些结果表明,GmBZL3是BR信号转导级联涉及的功能转录因子。
Gmbzl3目标响应BR信令
通过组合染色质 - 免疫沉淀微阵列(芯片芯片)和RNA-SEQ /微阵列结果来鉴定由ATBZR1和ATBZR2 / BES1调节的大量重叠靶基因[15,16].基因组研究进一步揭示了BES1 / BZR1家族调节涉及数千基因的转录网络。大约四分之一的Br响应基因由BZR1 / BZR2直接调节(约1000个基因)[15,16].在我们的研究中,通过ChIP-seq实验鉴定出了GmBZL3结合的2000多个靶基因,表明GmBZL3是BR通路的主要调控因子。此外,根据四组RNA-seq数据,许多GmBZL3靶点在不同BR水平下表达水平升高或降低。因此,可以想象GmBZL3在不同BR水平下具有双重调控功能。
GmBZL3和BZR1靶标的比较揭示了基因调控的有趣特征
据报道,BR涉及一系列植物物种中的干旱胁迫[44.,45.,46.].BR信号传播相关的受体和监管机构在干旱条件下发挥重要作用[47.,48.,49.].最近,研究发现NAC转录因子RD26 (Responsive to drought 26)通过协调RD26和BES1的转录活性,介导干旱相关和BR信号通路之间的串音[50.].编码RD26的两个大豆基因(Glyma.06G248900和Glyma.12G149100)通过GmBZL3在我们的结果中靶向,并且在PCZ和PCZ-BL处理下显着诱导(数据未显示)。以前的研究表明,ERD15是ABA响应基因的负调节因子拟南芥[51.].在这里,我们还发现ERD15由Gmbzl3和BZR1在大豆和BZR1靶向拟南芥,分别。GmBZL3和BZR1靶向大豆和大豆中的两个水通道蛋白(PIP1B和PIP3)拟南芥,分别。因此,我们的数据不仅支持GmBZL3在大豆干旱响应中发挥作用的结论,而且为进一步阐明其分子机制提供了候选基因。
BR突变体的去黄化表型表明BR在光形态发生中起着至关重要的作用,许多由BZR1调控的基因与HY5和PIL5(光信号通路关键转录因子)的靶标重叠[16,52.].然而,在GmBZL3靶标中发现了很少有关的基因。该结果表明GmBZL3可以在光信号通道中发挥间接和特定作用。
大豆全基因组测序揭示了优良的突变资源GmBZL3
由于大豆转化效率低,转基因方法难以验证基因功能[53.].因此,大豆基因经常被转化为其他植物,如拟南芥或烟草,用于功能评估。迄今为止,毛状根转化提供了一种有效的替代方案,以在相对较短的时间内获得大量大豆制转化体进行基因功能验证。虽然该系统对大豆根研究做出了重大贡献,但在非根性特征表征的情况下,它是值得怀疑的[54.,55.,56.].幸运的是,自然界中有一些突变,如无大豆突变或目标基因的隐性等位基因,这些都可以作为宝贵的遗传资源。第一个大豆的完整参考基因组Williams 82于2010年发布[27.].Hyten等人[57.]开发了一种SNP检测方法的初始版本,以识别大量的SNP,并构建了一个分辨率更高的遗传图谱。最近发表的GWAS研究产生了大量的基因组测序数据[39.,58.,59.].这些基因组资源将通过了解基于地图的克隆和反向遗传方法来提供一系列大豆改善机会。
在我们的研究中,两个突变系GmBZL3通过分析整个基因组重新排斥数据来鉴定。这些线条是优异的材料,用于进一步基因功能表征。此外,标记辅助的回复策略可用于发展GmBZL3适合基因功能验证的突变体。据报道,BC4 F1种子经过4轮回交后,有99.0%的亲本基因组重复[60.].未来,对所有BR信号相关因子的基因组测序数据进行分析,并对不同种质系的snp与性状之间的特定相关性进行研究,有助于进一步揭示BR的机制以及相互依赖途径之间的相互作用。
结论
BRS在大豆营养开发期间起着至关重要的调节作用。我们的研究表明,GmBZL3在大豆BR反应途径中发挥着保守的作用。我们的结果提供了大豆在大豆中的GmBZL3作用的基因组图,揭示了一种规范网络,其集成了血液荷尔蒙和多种调节途径,并揭示了BR信号通路和发育和生理过程中涉及的下游部件之间的许多分子链接。此外,这里鉴定的种质系的自然变化将为未来提供基因功能分析的良好突变资源。
方法
使用RNA-SEQ数据集进行表达分析分析
Libault等人生成的RNA-SEQ数据。[28.利用Williams 82基因型9个大豆组织(包括花、叶、根瘤、豆荚、根、根毛、种子、茎尖分生组织和茎)中4个同源GmBZLs基因的表达模式进行分析。使用dCHIP软件对表达数据进行分层聚类[61.].所示的RPKM值呈现了每个组织库中获得的归一化总读数。对于盐或ABA治疗,将大豆幼苗(V1阶段)根浸入含有200mM NaCl或100μmABA的溶液中,用水作为对照。对于冷处理,幼苗在4℃下保持16小时/ 8小时。为了脱水处理,将幼苗转移到滤纸上,并在室温下用60%湿度干燥。在8小时处理后,首先从三种植物进行三叶叶,以进行RNA分离。从三种生物重复收集组织样品,重复三个独立的实验。使用BR合成抑制剂治疗的四组RNA-SEQ数据分析GmBZL3靶标的表达模式(Song等人,未发表)。简而言之,将V1阶段的大豆幼苗用高浓度Br合成抑制剂(5μm丙酰唑10天处理,表示为Pcz或同时用高浓度抑制剂和低浓度油菜素内酯(5 μM Pcz + 10 nM BL)处理10 dPCZ-BL.).此外,在用高浓度抑制剂处理10天后(5μmCCZ10天,然后用1μmBL1H,表示为1μm,在短时间内施加高浓度的BL。Pcz-BL-1 h;用5 μM Pcz处理10 d后,用1 μM BL处理8 hPcz-BL-8 h).
Gmbzls的蛋白质序列比对和基因重复
使用Clustalw2构建多个序列比对(https://www.ebi.ac.uk/tools/msa/clustalo/).从植物基因组复制数据库(PGDD)中提取Ks和Ka值[62.],这些值用于计算复制事件的大致日期。然后根据eq. T = Ks/2λ估计重复事件的时间,其中大豆的平均同义替代率(λ)为6.1 × 10- 9[63.].
基因克隆,定向诱变和遗传转化
的全长开放读帧(ORF)GmBZL3从Williams 82基因中扩增出Glyma06g03700F: CACCATGACTTCGGACGGAGCAAC和Glyma06g03700R: AGCAGGCGTCTTCCCACTTCCAAGT。然后将PCR产物克隆到pENTR™D/TOPO载体(Thermo Fisher Scientific, Waltham, MA, USA)。用M13测序引物对阳性克隆进行全序列测序。使用二元载体pEarleyGate 101进行LR门户反应[64.].使用Phusion Site-Directed Mutagenesis Kit (Thermo Scientific)创建BZL3.P219L.含有Pro-219-Leu的突变基因[42.]突变位点,具有以下引物:14-3F:GaggatatcaaacgctGcccctgttaccc;14-3R:AAAGGAGGGAGAGAGAGAGGGAACGCAT。这GmBZL3-pEarleyGate 101和GmBZL3P219L.-pEarleyGate 101二元载体用于拟南芥转化。
植物材料、生长条件及处理
我们收到了拟南芥株系bri1-5来自志勇王(Carnegie Scients,斯坦福大学,Wang等,2002 [10])。GmBZL3和GmBZL3P219L.在拟南芥br不敏感突变体中过表达bri1-5.这农杆菌属- 采用介导的花卉浸渍转化方法产生转基因植物[65.].筛选T3纯合子转基因株系,进行以下表型分析。Ws-0,bri1-5,过表达的Gmbzl3 /BRIL1-5和过度表达GmBZL3P219L./BRIL1-5用2%蔗糖种植并在1/2固体MS培养基上种植和生长。对于在黑暗中生长的幼苗,将种子感冒2天,然后在黑暗中在22℃下生长4天。对于光生长的幼苗,在14/10H光/暗光周期和100μmol/ m下,在22℃下在22℃下生长冷处理的种子6天2/ s光强度。用于分析GmBZL3和GmBZL3P219L.利用拟南芥转基因植株、光照培养7 d幼苗进行RNA分离。为了评估BR的响应,将冷处理种子在22℃、14/10 h光/暗周期下在½固体MS培养基(不同BL浓度(0,1 nM、10 nM、100 nM和500 nM))上生长7天。
Gmbzl3抗体和基因组染色质免疫沉淀
从GmBZL3的推导的氨基酸序列的244-256的肽(FapsvsavpPispt)用于兔中的抗体产生。抗体由皮尔斯公司(Thermo Scientific,Huntsville,Al)生产。根据已发表的协议进行芯片测定[66.].简而言之,将8g大豆叶(V3阶段)接地并与1%交联(v/ v)在真空下甲醛5分钟,然后通过将甘氨酸加入到终浓度为0.25μm的终浓度下淬灭交联。将样品保持在真空下进行5分钟。将交联组织研磨成液氮中的粉末,5g组织粉末用于分离染色质复合物。随后,多克隆GmbZl3抗体被超声处理和免疫沉淀。通过使用FERMENSPCR纯化试剂盒提取DNA。将沉淀的DNA重悬于50μLTE中并在-20℃下储存,进行芯片SEQ分析。
芯片测序与分析
两个独立的生物重复用于芯片分析。从没有芯片处理的大豆叶中提取的DNA作为阴性对照。芯片测序图书馆建设和排序由密苏里大学使用Hi-SEQ 2000(Illumina,San Diego,CA)进行。数据分析如下进行:配对的端部读取与使用Bowtie的大豆基因组对齐[67.].映射结果保存为BAM文件[68.].通过峰值呼叫编程MAC鉴定了显着富集的芯片区域,并将结果保存为基因组上所识别的峰的坐标[69.].然后使用基因呼叫工具(BedTools)来表征峰值区域周围的基因[70].
定量实时PCR测定
用RNEasy植物迷你试剂盒(QIAGEN,CAT#:74904)从大豆叶或拟南芥幼苗中分离出总RNA。进行与RNase的DNase集合柱DNA酶消化以去除DNA污染(QIAGEN,VALENCIA,CA,CAT#:79254)。高容量cDNA逆转录试剂盒(Thermo,USA,Cat#4368814)用于cDNA合成。使用Sybr Green Master Mix(Thermo,USA,Cat#K0223进行QRT-PCR和芯片QPCR测定。比较CT方法用于量化特定基因的相对表达[71].选择cyclin基因(Glyma10g263500)作为内对照,使基因表达正常化。所有引物均采用Primer3 web界面设计(http://bioinfo.ut.ee/primer3-0.4.0/;[72])。每个反应进行三次生物重复和一次技术重复。利用引物GmBZL3-RTF(GGTCGTTTAATTGGAGGAGAAT)和(GmBZL3-RTR GATGAGGCCTATCATTTCCTG)确认转基因过表达,该引物跨越了YFP与转基因的连接区域,排除了拟南芥内源基因扩增的可能性。采用pEarly101-YFP-F (GTAAACGGCCACAAGTTCAG)和pEarly101-YFP-R(ACTTCAGGGTCAGCTTGC)在转基因拟南芥植株中进行基因表达水平分析。利用引物Gm10g263500-RTF (ACCACAATGACCAACTAGAGC)和Gm10g263500-RTR (CTTCCTCTTCCCACTTTCCTTC)选择cyclin基因作为内参。选择PP2A基因作为ChIP-qPCR内参。ChIP-qPCR检测引物列于附加文件7.
缩写
- ATMYB70:
-
Myb结构域蛋白70
- BAG1:
-
BCL-2相关的奥斯基诺1
- BC4:
-
背十字架
- bHLH:
-
基本螺旋循环螺旋
- BL:
-
芸苔
- bri1:
-
Br - 不敏感突变体
- br:
-
芸苔类固醇
- BXL2:
-
β-木糖苷酶2
- ChIP-chip:
-
染色质 - 免疫沉淀微阵列
- ChIP-seq:
-
染色质免疫沉淀反应测序
- CUT1:
-
粘性1
- ERD15:
-
早期响应脱水15
- EXPA1:
-
expansin A1
- EXPA8:
-
expansin A8
- FQR1:
-
样黄酮类醌还原酶1
- GH3:
-
格雷琴Hagen 3.
- GmBZLs:
-
BzR1样蛋白
- GPRI1:
-
GOLDEN2-like 1
- GWAS:
-
全基因组关联研究
- 哈特3:
-
同源亮氨酸拉链蛋白
- HMG1:
-
3-羟基-3-甲基戊芳基辛还原酶
- 是:
-
Jasmonate
- Jaz1:
-
茉莉齐域蛋白1
- kab1:
-
钾通道Beta亚基
- LBD39:
-
外侧器官边界结构域蛋白39
- LBD41:
-
横向器官界限域蛋白41
- LOX2:
-
脂氧合酶2
- mya:
-
几百万年前
- NRT1.1:
-
硝酸盐转运仪1.1
- NRT1.2:
-
1.2硝酸运输车
- OPR2:
-
12-苯二甲二烯酸还原酶2
- 子:
-
开放阅读框
- Pcz:
-
propiconazole.
- PGDD:
-
植物基因组复制数据库
- PIP1B:
-
血浆膜内在蛋白1; 2
- PIP3:
-
质膜内在蛋白3
- PME3:
-
果胶甲基酯酶3.
- QRT-PCR:
-
定量实时PCR
- RD26:
-
对干燥敏感的
- RD26:
-
对干燥有反应
- rpkm:
-
每公斤基地读数
- 阿富汗二月:
-
小auxin-up rna
- SNPS:
-
单核苷酸多态性
- SPT:
-
抹刀
- VTC4:
-
肌醇单磷酸酶家庭蛋白质
- yucca3:
-
吲哚-3-丙酮酸单氧基酶
参考
- 1.
李建军,李建军。油菜素内酯在植物中的作用。J Exp Bot. 1999; 50:332-40。
- 2。
Clouse SD。拟南芥突变体揭示了甾醇在植物发育中的多种作用。植物细胞。2002;14:1995 - 2000。
- 3.
ye q,zhu w,li l,张s,yin y,ma h等。通过调节拟南芥和花粉发育中涉及的关键基因的表达来控制芸苔类化合物。Proc Natl Acad Sci U S A. 2010; 107:6100-5。
- 4.
朱耶,SAE-SEAW J,Wang Zy。芸苔类固醇信号。发展。2013; 140:1615-20。
- 5。
Kagiale S,Divi UK,Krochko Je,Keller Wa,Krishna P. Brassinosteroid赋予拟南芥和芸苔Napus的耐受性。Planta。2007; 225:353-64。
- 6。
Divi UK,Krishna P. Brassinosteroids赋予胁迫耐受性。在:植物压力生物学:来自基因组学的系统生物学编辑:Hirt H. Weinheim:Wiley-VCH;2009.119-35。
- 7.
Mathur J,Molnárg,富士岛S,Takatsuto S,Sakurai A,Yokota T等人。编码类固化性细胞色素P450的拟南芥CPD基因的转录由芸苔类固醇负控制。工厂J. 1998; 14:593-602。
- 8.
Bancoşs,nomura t,sato t,molnárg,主教gj,koncz c等人。拟南芥细胞色素P450基因的转录水平调节芸苔类化合物生物合成。植物理性。2002; 130(1):504-13。
- 9.
西蒙斯总经理,里德·杰比。油菜素内酯在豌豆中不进行长途运输。内源性油菜素内酯水平调节的意义。植物杂志。2004;135(4):2196 - 206。
- 10.
王志勇,陈敏,王志勇,等。核定位BZR1介导油菜素内酯诱导的生长和反馈抑制油菜素内酯生物合成。发展细胞。2002;2:505-13。
- 11.
他JX,Gendron JM,Sun Y,Gampala SS,Gendron N,Sun CQ,等。BZR1是一种转录压缩机,具有双重作用的芸苔类固态性稳态和生长反应。科学。2005; 30:1634-8。
- 12.
Yin Y,Vafeados D,Tao Y,Yoshida S,Asami T,Chory J.一类新的转录因子介导Brassinosteroid-Crougle的基因表达拟南芥.细胞。2005; 120:249-59。
- 13。
何建新,唐伟,邓铮,白明明,等。14-3-3蛋白在油菜素内酯信号转导中的重要作用拟南芥.发展细胞。2007; 13:177-89。
- 14。
他JX,Gendron JM,Yang Y,Li J,Wang Zy。GSK3样激酶Bin2磷酸化和稳定的BZR1,芸苔类固醇信号通路的正调节器拟南芥.美国国家科学研究院2002;99:10185-90。
- 15.
yu x,li l,zola j,aluru m,ye h,foudree a等。铜雌激素转录网络通过GESI靶基因的全基因组鉴定揭示拟南芥.植物j . 2011; 65:634-46。
- 16。
孙勇,范学勇,曹冬梅,唐伟,何凯,朱建勇,等。油菜素内酯信号转导与转录网络的整合用于植物生长调控拟南芥.发展细胞。2010; 19:65-77。
- 17.
Terakado J,Fujihara S,Goto S,Kuratani R,Suzuki Y,Yoshida S等人。芸苔酚和铜唑烷施用铜碱基对大豆根结节形成的全身效应。土壤SCI植物NUTR。2005; 51:389-95。
- 18.
Zurek DM,Clouse SD。伸长大豆胶乳类固醇调节基因的分子克隆与表征(大豆l .)上胚轴。植物生理学。1994;104:161 - 70。
- 19.
Oh MH, Romanow W, Smith R, Zamski E, Sasse J, Clouse S.大豆BRU1编码一种功能性木葡聚糖内转糖基化酶,该酶在油菜素类固醇促进的伸长过程中内在上胚轴组织中高度表达。植物生理学报1998;39:124-30。
- 20.
猎人wj。根施加的血管糖苷和碳氧酮对大豆瘤瘤(大豆l .)幼苗。中国农业科学(英文版);2002;
- 21.
油菜素内酯缓解水分亏缺对大豆光合作用及抗氧化能力的影响大豆l .)。植物生长规律2008a; 56:257-64。
- 22.
王敏,徐旭,张旭,孙胜,吴超,侯伟,等。GmCPDs的功能分析及其在开花中的作用研究。《公共科学图书馆•综合》。2015;10 (3):e0118476。
- 23.
王敏,孙胜,吴超,韩涛,王强。油菜素内酯受体基因(GmBRI1)的分离与鉴定大豆.int j mol sci。2014; 15:3871-88。
- 24.
彭胜,陶鹏,徐飞,吴安,霍伟,王建军。大豆油菜素内酯受体基因Glyma04g39610的功能鉴定及进化分析。中华医学杂志。2016;17(6)。https://doi.org/10.3390/ijms17060897..
- 25.
张y,张yj,杨bj,yu xx,王d,zu sh等。GmBZL2(ATBZR1等基因)的功能表征揭示了保守的BR信号传导调节大豆.科学报告。2016;6:31134。
- 26.
Ariyoshi Y,Itoyama H,Nakagawa AC,Ario N,Kondo Y,Tomita Y等。通过细胞肥大在大豆肥胖对豆荚生长的调节(大豆L.)Merr。植物生长调节。2016; 80:391-5。
- 27.
Schmutz J,Cannon SB,Schlueter J,MA J,Mitros T,Nelson W等人。古代聚丙烯大豆的基因组序列。自然。2010; 463:178-83。
- 28。
李志强,李志强,李志强,等。作物模型的整合转录组图谱大豆.及其在植物中对比分析的用途。工厂J.2010; 63:86-99。
- 29。
Divi UK,Rahman T,Krishna P.粗碱基介导的拟南芥的胁迫耐受性显示出与脱离酸,乙烯和水杨酸途径的相互作用。BMC植物BIOL。2010; 10:151。
- 30.
GODA H,Shimada Y,Asami T,Fujioka S,Yoshida S.微阵列的芸苔类固定基因的微阵列分析拟南芥.植物杂志。2002;130:1319-34。
- 31.
Nemhauser JL,Mockler Tc,Chory J. Brassinosteroid和Auxin信号中的相互依赖性拟南芥.公共科学图书馆杂志。2004;2:E258。
- 32.
Vert G,Walcher Cl,Chory J,Nemhauser JL。养肝响应因子的植物素和芸苔类固醇途径的整合2. PROC NATL ACAD SCI U S A. 2008; 105:9829-34。
- 33.
张涛,王志勇。油菜素甾醇-乙烯相互作用的化学遗传分析。摩尔。2008;1:368 - 79。
- 34.
周XY,歌,薛HW。芸苔类固醇调节差异生长拟南芥通过养蛋白信号传导组分IAA19和ARF7的下胚轴。莫尔植物。2013; 6:887-904。
- 35.
Thines B,Katsir L,Melotto M,Niu Y,Mandaokar A,Liu G,等。Jaz阻遏蛋白是茉莉酸盐信号传导期间SCF(COI1)复合物的靶标。自然。2007; 448:661-5。
- 36。
Lozano-Durán R, Macho AP, Boutrot F, Segonzac C, somsich IE, Zipfel C.转录调节因子BZR1介导植物先天免疫和生长之间的权衡。eLife。2013; 2: e00983。
- 37。
Zhiponova MK, Vanhoutte I, Boudolf V, Betti C, Dhondt S, Coppens F, et al.;油菜素内酯的产生和信号转导不同程度地控制叶片中细胞的分裂和扩张。新植醇。2013;197(2):490 - 502。
- 38。
Hartwig T,Corvalan C,最佳NB,Budka Js,Zhu Jy,Choe S等人。丙酰唑是一种特异性和可接近的芸苔类化合物(BR)生物合成抑制剂拟南芥和玉米。Plos一个。2012; 7(5):E36625。
- 39。
Valliyodan B,秋D,Patil G,Zeng P,Huang J,Dai L等。大豆基因组多样性与特质景观。科学报告。2016; 6:23598。
- 40。
Rechsteiner M, Rogers SW。PEST序列及其蛋白水解调控。生物化学趋势1996;21:267-71。
- 41。
白美,张丽丽,甘帕拉,朱文文,宋文文,崇科,等。OsBZR1和14-3-3蛋白在水稻油菜素内酯信号转导中的功能。中国科学(d辑:地球科学)2007;104:13839-44。
- 42。
唐,元,王R,杨y,王c,oes-prieto ja,等。PP2A通过去磷酸化BZR1激活芸苔甾类响应响应基因表达和植物生长。NAT细胞BIOL。2011; 13:124-31。
- 43.
PEENG P,LI J. Brassinosteroid信号转导:融合和新颖性。J工厂增长调节。2003; 22:298-312。
- 44.
郝静,尹勇,费思忠。油菜素内酯信号网络对产量和耐受性的影响。2013; 32:1017-30。
- 45.
Sairam Rk。两种小麦品种灌溉和水分应激条件下植物代谢应用对植物代谢和籽粒产量的影响。植物生长调节。1994年; 14:173-81。
- 46.
Sahni S,Prasad Bd,Liu Q,Grbic V,Sharpe A,Singh Sp,等。芸苔类化芸苔类生物合成基因DWF4的过度表达同时增加种子产量和胁迫耐受性。SCI REP。2016; 6:28298。
- 47.
关键词:油菜素内酯受体(BdBRI1),抗旱性,矮化表型Broachypodium distachyon..植物科学。2015;234:163 - 73。
- 48.
桂军,郑松,刘超,沈俊,李军,李丽。OsREM4.1与OsSERK1相互作用协调水稻脱落酸与油菜素内酯信号转导的相互链接。发展细胞。2016;38:201-13。
- 49.
Nolan TM,Brennan B,Yang M,Chen J,Zhang M,Li Z等。DSK2介导的BES1介导的选择性自噬生长和生存。发展细胞。2017; 41:33-46。
- 50。
叶华,刘胜,唐斌,陈建军,谢振华,等。RD26介导干旱和油菜素内酯信号通路之间的串扰。自然沟通。2017;24(8):14573。
- 51.
5.李建军,李建军,李建军,李建军。脱水的早期反应。脱落酸反应的负调节因子拟南芥.植物杂志。2006;142:1559 - 73。
- 52.
Li J,Nagpal P,Vitart V,McMorris TC,Chory J.在轻依赖性发展中的芸苔类固醇的作用拟南芥.科学。1996;272:398 - 401。
- 53.
2 .黄豆遗传转化:基因功能研究和农艺改良作物生产的重要工具。Genet Mol Biol. 2012; 35:998-1010。
- 54.
Indrasumunar A, Searle I, Lin MH, Kereszt A, Men A, Carroll BJ, et al.;结瘤因子受体激酶1α控制大豆结瘤器官数量(大豆l .稳定)。植物j . 2011; 65:39-50。
- 55.
Kasai M,Kanazawa A. RNA沉默作为揭开大豆揭开基因功能和工程新特征的工具。品种sci。2012; 61:468-79。
- 56.
杨林,纪伟,朱玉明,高鹏,李勇,蔡辉,等。GsCBRLK是一种钙/钙调素结合受体样激酶,是植物耐盐和ABA胁迫的正调控因子。J Exp Bot. 2010; 61:2519-33。
- 57.
等。高通量SNP发现,通过深度重测序一个简化的代表性库,以锚定和定位支架在大豆全基因组序列。BMC基因组学。2010;三十八分。
- 58.
林慧敏,徐旭,刘旭,陈伟,杨光,王福林,等。通过对31个野生和栽培大豆基因组的重测序,确定了遗传多样性和选择模式。Nat麝猫。2010;42:1053-9。
- 59.
周志强,姜勇,王志强,苟志,吕军,李伟,等。对302份野生和栽培大豆材料进行测序,鉴定出与大豆驯化改良相关的基因。生物科技Nat》。2015;33:408-14。
- 60.
医院F.标记辅助繁殖。在:H.J. Newbury(ED)。植物分子育种,Vol。2003.牛津和博卡拉顿:Blackwell出版和CRC媒体;2003.30-59。
- 61.
李聪,王文辉。基于模型的寡核苷酸阵列分析:表达指数计算和离群值检测。美国国立科学研究院2001;98:31-6。
- 62。
李th,唐嘿,王x,帕特森啊。PGDD:植物中基因和基因组重复数据库。核酸RES。2013年。https://doi.org/10.1093/nar/gks1104.
- 63。
Lynch M, Conery JS。复制基因的进化命运和后果。科学。2000;290:1151-5。
- 64。
王志强,王志强,王志强,等。植物功能基因组学和蛋白质组学的门户兼容载体。植物j . 2006; 45:616-29。
- 65。
花的倾斜:一种简化的方法农杆菌属介导的变换拟南芥.植物j . 1998; 16:735-43。
- 66。
朱耶,孙y,王泽。使用染色质免疫沉淀,用微阵列(芯片芯片)或测序(芯片-SEQ),植物中植物中转录因子结合位点的基因组鉴定。方法Mol Biol。2012; 876:173-88。
- 67.
Langmead B, Salzberg S.快速间隙读取校准与领结2。Nat方法。2012;9:357-9。
- 68.
Li H, Handsaker B, Wysoker A, Fennell T, Ruan J, Homer N, et al. 1000基因组工程数据处理亚群。序列比对/映射(SAM)格式和sam工具。生物信息学。2009;25:2078-9。
- 69.
张Y,Liu T,Meyer Ca,Eekhoute J,Johnson DS,Bernstein是等等。基于模型的芯片SEQ(MAC)分析。基因组Biol。2008B; 9(9):R137。https://doi.org/10.1186/gb-2008-9-9-R137.
- 70。
胡晓燕,胡晓燕,胡晓燕,等。调节DNA中常见疾病相关变异的系统定位。科学。2012;337:6099。
- 71。
Livak KJ,Schmittgen TD。使用实时定量PCR和2的相对基因表达数据分析(-Delta Delta C(T))方法。方法。2001; 25:402-8。
- 72。
Rozen S, Skaletsky H. Primer3在万维网上为一般用户和生物学程序员。方法2000;132:365-86。
致谢
感谢薛宏伟博士对手稿的批判性阅读和完善。
资金
本研究由国家自然科学基金项目(31871540)、美国密苏里大豆销售委员会(MSMC)、美国大豆委员会(USB)资助。植物分子遗传学国家重点实验室开放研究项目。中科院。2018.
可用性数据和材料
关于本研究的所有数据已包含在目前的手稿或补充中的表格和/或图形中。作者很高兴在合理的要求时分享分析/原始数据和工厂材料。
作者信息
从属关系
贡献
本次研究由WC、LS、Z-YW、BV和HTN设计。WC和LS进行了实验和数据分析。BW进行了ChIP-seq实验和数据分析。Q-MY对手稿进行生物信息学分析并进行修订。M-YB, Z-MZ和HY参与了实验设计和结果分析。BV对大豆基因组序列分析有重要贡献。LS和HTN撰写了手稿草稿。所有作者都参与了撰写并批准了最终稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
大豆BZL基因对片段复制事件的日期估计。(XLSX 9 kb)
额外的文件2:
的表达模式GmBZLs在不同的组织和非生物胁迫条件下。(A) GmBZL基因在9个组织中的表达谱。RNA-seq测定的9个组织的相对表达数据来源于Libault等。用于构建大豆基因表达模式。热图中的颜色代表GmBZL基因的RPKM值。(B-C) GmBZL基因响应非生物胁迫的转录水平。用200 mM NaCl或100 μM ABA处理大豆V1期幼苗8 h。冷处理时,将幼苗置于4°C光照下保存。脱水处理时,将幼苗转移到滤纸上,在室温、60%的湿度下干燥。相对基因表达水平与肌动蛋白转录值正常化后显示。 Error bars represent the standard error of the mean. The star (*) indicates statistically significant differences among the means (p< 0.05)。(PPTX 88 KB)
额外的文件3:
与PP2A相比,DWF4在IP生物重复样品中显着富集,但在负芯片实验中没有显着差异的DWF4和PP2A之间的量。(PPTX 67 KB)
额外的文件4:
芯片数据揭示了大豆中GmbZL3转录因子可能调节的基因。(XLSX 38 KB)
额外的文件5:
GmBZL3目标中GO类别过多。GmBZL3靶标的功能分类显示,7组GO(分子功能)项显著富集(p值< 0.01)。(PPTX 40 kb)
附加文件6:
从106大豆重置数据集识别Nonsynonynous SNP和GmbZL3基因中的删除(Valliyodan等,2016)。突出显示的文本显示SNP和非同义词突变。(XLSX 13 KB)
附加文件7:
QRT-PCR和芯片QPCR中使用的引物列表。(XLSX 10 KB)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
宋,L.,陈,W.,王,B。et al。GmBZL3通过多通路的串扰,作为BR信号的主要调控因子大豆.BMC植物BIOL.19,86(2019)。https://doi.org/10.1186/s12870-019-1677-2
收到了:
接受:
发表:
关键字
- 大豆
- GmBZL3
- Brassinosteroid
- ChIP-seq
- 激素相声
- SNP.