抽象的
背景
衰老通过调节植物的不同性状来影响植物的品质和产量。一些成员S40基因家族,大麦HvS40和拟南芥AtS40-3,已经被证明在大麦和大麦的叶子衰老中发挥作用拟南芥.虽然我们之前报道了S40家族在大多数植物中存在,但到目前为止,已经证明了植物中S40成员的更多功能。本研究的目的是提供衰老相关信息S40水稻是一种主要作物,养活了世界上大约一半的人口。
结果
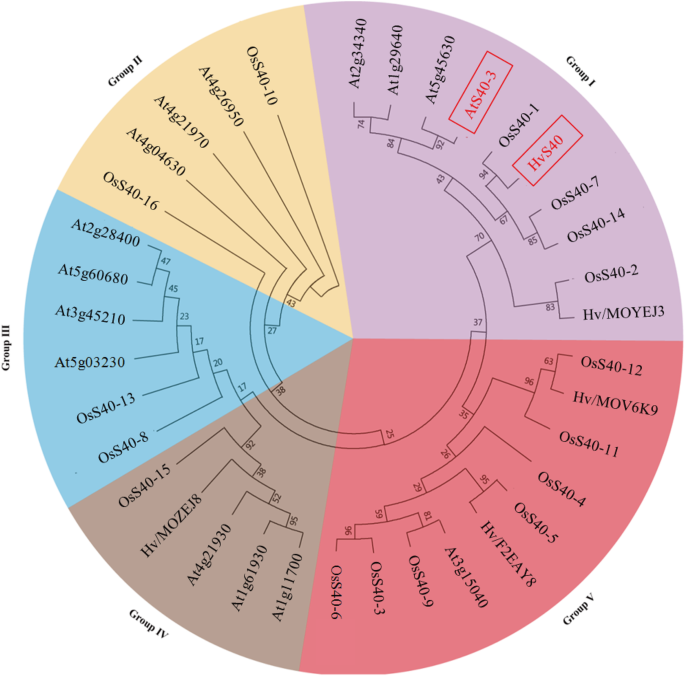
总共16个OsS40基因从基因组数据库中鉴定粳稻通过生物信息学分析。系统发育分析表明,16个OsS40蛋白被分为5个类群,其中4个属于类群I, HvS40和AtS40-3也属于类群I。S40水稻的基因具有高度的结构相似性,16个基因中有13个没有内含子,另外3个基因只有1或2个内含子。的表达模式OsS40分析了自然和胁迫诱导的叶片衰老过程中与衰老标记基因对应的基因。我们发现其中6个基因在黑暗、缺氮、激素处理和病原菌感染等不同情况下表现出差异但明显上调的转录谱。通过瞬时原生质体转化实验,鉴定出3个OsS40蛋白为核定位蛋白。
结论
综合所有的发现,我们得出结论OsS40-1,OsS40-2,oss40-12和oss40-14基因在水稻非生物衰老、生物衰老和发育衰老之间具有潜在的调控作用。我们的研究结果为水稻S40基因在水稻叶片衰老中的功能验证研究提供了有价值的基础。
背景
叶片衰老是植物开发最终阶段的一个组成部分,由微调复杂的监管网络控制[1].内部因素如植物年龄、激素和外部生物因素影响叶片衰老的调节[2].成千上万的基因显示了发病中的差异表达模式,在衰老的发展期间[3.,4].它揭示了许多植物在衰老过程中基因表达的广泛变化,如拟南芥[4,5)、小麦(6], 大麦 [7)、大米(8]和白杨[9].衰老是一个高度组织的过程,需要特定的基因表达[10,11衰老相关基因(SAGs),占植物基因组的10% [3.,12].大多数SAGs不仅在年龄依赖性衰老过程中表达,而且在胁迫诱导的衰老过程中也表达,如损伤、黑暗、干燥、激素处理和对病原菌感染的反应[2,13].这些sag被不同的转录因子(TFs)激活,其中NAC和WRKY是参与植物衰老的两个主要群体[3.].因此,大量sag的表达可能受到编码特定TF的特定基因的调控的影响[14].
尽管衰老对作物作物的产量有很大影响,但从小麦和大麦等作物中分离出的sagg很少[15],在应用微阵列技术研究小麦和大麦叶片衰老之前[16,17].在大麦,HvS40显示是衰老标记基因[18,19].的HvS40在大麦原发性叶子的自然衰老期间,基因进行上调,以及脱离叶子的黑暗诱导的衰老[18,19,20.,21].在一项转录组研究中,小麦的同源基因也在旗叶衰老过程中表达增强[16].同样在拟南芥,七个十一基因,AtS40-1,AtS40-2,AtS40-3,AtS40-4,AtS40-5,AtS40-6和AtS40-7与未衰老的叶片相比,衰老叶片的转录水平提高[22].表达水平AtS40-1,AtS40-2和AtS40-5基因在黑暗孵育2天后产生AtS40-3和AT-S40-4在黑暗孵化后一天显示表达增加[22].此外,HvS40茉莉酸甲酯(MeJA)、水杨酸(SA)侵染后叶片表达增强Pyrenophora Teres.[19].同样,三个基因的表达水平AtS40-2,AtS40-3和AtS40-4在治疗后显著增加拟南芥具有SA、脱落酸(ABA)或病原菌的植株假单胞菌桑雷克PV只使用1天[22].由于HVS40蛋白的核定位,它被认为是调节核中衰老相关基因的候选者[19].在洋葱表皮细胞转化后,AtS40-3-GUS [22[HVS40-GUS融合构建体在核中显示出类似的GUS活性分布[19].
的拟南芥本文分别插入突变体S40-3A与野生型相比表现出延迟衰老[22].表达水平WRKY53和SAG12,叶片衰老早期和晚期基因表达变化的标记物分别明显降低S40-3A突变体与裂缝中的所有衰老阶段相比[22].整体表达分析AtS40-3基因在野生型和突变型中都提出AtS40-3基因作为下游的激活物WRKY53和SAG12..同样,两种SAG标记的表达水平较低,SAG12.和SEN1.[23],在黑暗状态下S40-3A与野生类型相比,突变体表明AtS40-3在自然光和黑暗条件下积极调节衰老[22].尽管我们之前报道过S40科存在于大多数植物中[24],到目前为止,没有更多关于S40成员在大米方面的信息被展示。
在这项研究中,我们鉴定了水稻S40对16个基因组成的基因家族进行了系统发育、基因结构、染色体定位、保守基序确定、顺式作用元件和理化参数预测等分析。此外,我们还对其基因表达模式进行了综合分析OsS40(a)利用qRT-PCR检测自然和人工胁迫诱导衰老的基因与衰老标记基因的对应关系。在非生物、生物和发育性衰老中,包括两个表达谱重叠的基因在内的9个成员的亚细胞定位也得到了鉴定。这些发现可用于进一步的功能验证研究S40水稻叶片衰老的基因。
结果
稻米的鉴定与特性S40基因
S40属于DUF584家族,它包含DUF584域,序列:GRXLKGR(D/E)(L/M)XXXR(D/N/T)X(I/V)XXXXG(F/I)被所有属于DUF584组的成员共享。大麦HvS40基因编码DUF584组基因的一个成员拟南芥, 15种蛋白质属于这个家族,根据其氨基酸序列的相似性分为5类[22].识别S40与水稻基因一样,HvS40蛋白序列作为水稻基因组的查询序列进行了爆破。在水稻基因组中共发现16个相似的基因,并对这些基因进行了初步命名OsS40-1到oss40-16(表1).检索到的完整开放阅读框架(ORF)OsS40基因范围为393 bp (OsS40-2和OsS40-7)至780 bp (OsS40-10)(表1).
为了分析OsS40基因的结构多样性,我们对单个OsS40基因进行了外显子/内含子组织分析。的外显子和内含子的数目S40利用Gene Structure Display Server数据库(http://gsds.cbi.pku.edu.cn/).S40水稻基因在结构上具有高度的相似性,16个基因中有13个没有内含子,而另外3个基因只有1或2个内含子。此外,5个基因,包括OsS40-2,OsS40-3,OsS40-8,oss40-12和oss40-16,没有未翻译的地区(UTR)(附加文件1:图S1)。
深入了解组织S40水稻中的基因,染色体位置OsS40基因进行了分析。来自综合水稻科学数据库的染色体图谱工具(http://viewer.shigen.info/oryzavw/maptool/MapTool.do)用来定位OsS40染色体上的基因。它显示出16分中的9个OsS40基因分布在3条染色体(Chr1, Chr4和Chr5)上,而没有一个基因位于4条染色体(Chr2, Chr6, Chr8和Chr9)上。其他染色体包含一个或两个S40基因(附加文件2:图S2)。高密度OsS40基因簇被定位在某些染色体区域,例如,在Chr1和Chr7的近端区域和Chr4和Chr5的远端区域2:图S2)。这些数据可能提供有关大米扩张的有用信息S40基因家庭。
水稻的系统发育关系S40基因
目的探讨水稻S40蛋白与已有报道的水稻S40蛋白之间可能的进化关系拟南芥和大麦(22,24],序列比对,采用MEGA 6.0邻域连接(neighbor joining, NJ)方法,1000个bootstrap重复,构建了16个OsS40s、15个AtS40s和5个HvS40s的非根系统发育树。这表明水稻的S40家族蛋白,拟南芥和大麦可以分为5组(图。1).水稻16个DUF584蛋白中有4个属于I组,HvS40和AtS40也属于I组。进一步观察水稻的蛋白质,II组和III组各有2个,IV组只有1个蛋白质。相比之下,V组有7个水稻簇的S40蛋白,只有1个拟南芥蛋白质和两种大麦蛋白质(图。1).通过比较两种水稻S40蛋白的氨基酸序列,没有发现明显的相似性拟南芥从ⅰ组到HvS40蛋白的氨基酸序列。然而,所有比较的蛋白序列都具有保守的DUF584结构域序列(Additional file)2:图S3)。
序位分析进一步支持水稻S40成员的系统发育关系和分类。使用MEME软件对16个水稻S40蛋白、AtS40-3和HvS40的10个独立motif(标记为motif 1至10)进行敏化2:图S4)。正如预测的那样,DUF584结构域与motif 1相对应,而其他假定的motif由于在蛋白motif数据库SMART或Pfam中缺乏同源物而功能不明。基序1、2、3和4均存在于所有蛋白质中,而其他基序在不同蛋白质中有特定的分布。Motif 8或Motif 9在i组蛋白成员中具有分支特异性分布,OsS40-2和HvS40具有相似的分布模式。由于基序9的存在,AtS40-3在基序分布模式上是独特的,而与AtS40-3最相似的水稻S40蛋白是OsS40-16和OsS40-14(附加文件2:图S4),暗示这些S40成员之间的功能相似。
启动子中的顺式元素比较HvS40, AtS40-3和OsS40基因
发现独联体可能涉及启动的元素S40衰老过程中的基因转录,并探讨与发育性衰老相关的元件,启动子S40使用Plantcare数据库显示水稻基因(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),并与之相比较AtS40-3和HvS40[25].除了oss40-11的上游OsS40基因以及HvS40和AtS40-3基因显示存在W箱(C / T)TGAC(T / C),已知是腕表的结合位点的元素[26].此外,许多MYC (MYC TF识别位点[27)、MYB (MYB TF识别网站[27])和DOF(DOF蛋白质核心结合位点[28在所有水稻的促生剂中发现S40基因以及HvS40和AtS40-3(附加文件2表S1),提示S40基因的启动子可能被不同的tf靶向。丰富的CGCG盒(钙调素结合蛋白识别的基元,参与植物中的多种信号通路[29])和若干aba响应元件(ABRE)识别序列[30.]在一些米饭的启动子区域中鉴定出来S40未发现CGCG盒区AtS40-3基因启动子。此外,一些脱水响应元件/ c -repeat (DRE/CRT) [31]及低温响应元件(LTRE) [32]同步存在于8的启动子中OsS40基因以及HvS40而在AtS40-3启动子中只有一个LTRE出现(附加文件2:表S1)。这一信息暗示了水稻的转录本S40基因可能受到不同环境和发育状况的影响,正如在研究中所示HvS40[19,33,34].在马铃薯中,单链DNA结合因子StWHIRLY1被证明能与启动子中确定的诱导子响应元件(ELRE)结合PR10a[35,36].最近,已经证明了推动者区的两个精英元素HvS40基因可以与HvWHIRLY1相互作用[33].然而,在启动子序列中很少发现ELRE元件OsS40在启动子中只发现一个ELRE基因OsS40-7,oss40-13,oss40-15和oss40-16(附加文件2:表S1)。
表达谱的OsS40自然衰老过程中的候选基因
一般来说,在理想条件下生长的植物会经历自然衰老,这主要是由发育控制的。获得关于…的可能功能的线索OsS40水稻植物发育过程中不同组织中基因的表达变化综述OsS40从水稻种子、根、茎尖分生组织(SAM)、发育中的叶片和花序中获得候选材料。http://bar.utorto.ca/efprice/cgi-bin/EFPWeb.cgi.) [37].虽然有一些转录数据OsS40成员无法从数据库中获得剩余的大米S40基因在这些器官中表现出不同的表达模式1).OsS40-9在水稻发育过程中表现出高表达。相反,OsS40-3,OsS40-5和oss40-16在所有这些组织中转录本都很低或检测不到。结果表明OsS40-4,OsS40-6,oss40-13和OsS4-15在幼叶中低,但成熟的叶子高(表1),暗示他们参与稻叶的自然发展。
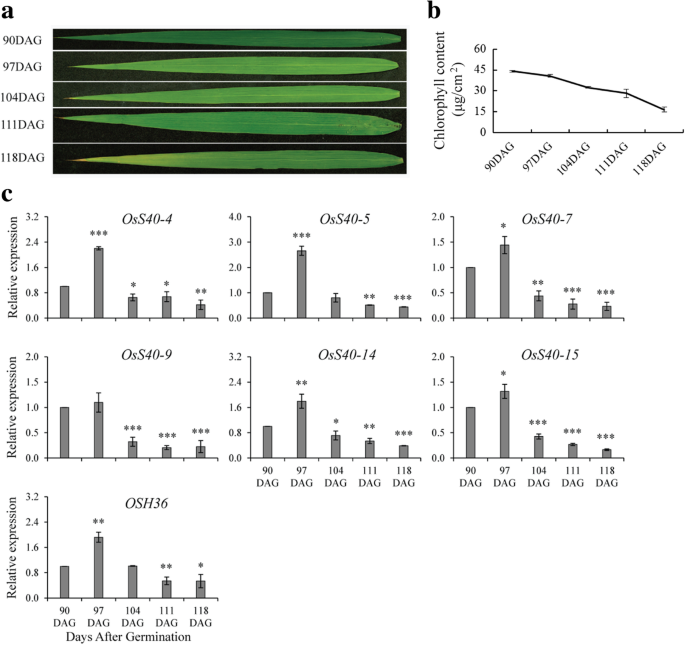
提出稻旗叶作为籽粒产量的决定因素,因为国旗叶不仅通过光合作用提供种子碳成分,而且在籽粒填充期期间将来自衰老叶的有用营养素运送到青少年[38,39].表征OsS40在旗叶的自然衰老期间的基因对于了解旗叶衰老和谷粒产量的机制将更有价值。为了收集衰老旗叶,水稻植物生长至成熟阶段(4个月)。敏锐地观察到它们的表型变化,因为泛黄是衰老的尖锐信号之一。在发芽(DAG)和同一天后第90天观察到淡黄色表型,将样品收集为衰老的发作。此外,在衰老的开始时,将样品收集四次,在衰老开始:90dag,97dag,104dag,111dag,118dag(图。2a, b).为了确定水稻旗叶发育后期不同阶段S40基因的转录谱,对所有16个成员设计引物进行RT-PCR。16个基因中的6个,OSS40-4,OSS40-5,OSS407,OSS40-9,OSS40-14和oss40-15半定量RT-PCR分析期间显示差异表达水平(附加文件2:图S5)。结果经qRT-PCR验证(图。2C)。在六种改变的表达基因中,三个属于v组,两个属于I族,一个是单族IV基因。基因表达倾向表明在早期衰老时表达水平增加,以降低晚期衰老叶片。其中一种衰老相关基因,OSH36[40,也表现出与阳性对照相同的表达模式。总的来说,我们的结果表明,这六个成员OsS40家族显示出在衰老的发作增强的表达,同时在衰老的后期表达表达模式下降。
表达谱的OsS40氮胁迫下的候选基因
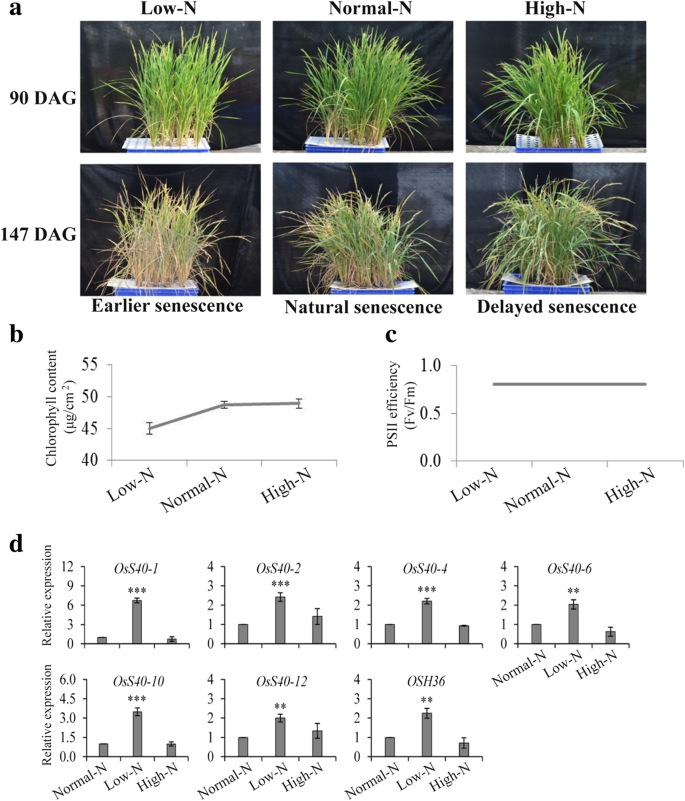
营养缺乏,特别是氮(N)的限制,已被证明能够加速植物的衰老。低氮供应下的叶片衰老早,过量氮供应下的叶片衰老延迟已被一些报道证实[41.,42.,43.].由于缺氮引起的旗叶早衰会导致产量下降[44.].因此,我们检测了它们的表达水平OsS40低氮或多氮条件下水稻旗叶衰老基因的研究。为研究氮素利用率的变化对水稻生长的影响,设计了水培系统,根系浸没在生长介质中。将水稻植株分别培养在三种不同类型的正常供氮(正常- n)培养基中作为对照,分别是正常供氮(低氮)的一半或正常供氮(高氮)的两倍。在缺氮培养基中生长的水稻植株衰老较早,而在过量施氮培养基中生长的水稻植株衰老较晚。3.a).所有类型植物的整个莲座的光系统II (Fv/Fm)的相对光化学效率相似,而低施氮植株的叶绿素含量比正常施氮植株降低(图2)。3.b, c)。
表达分析OsS40不同氮浓度下水稻植株的基因。一个以正常氮(normal - n)、低氮(low - n)或高氮浓度(high - n)条件下生长的13周龄(90DAG)和21周龄(147DAG)水稻植株为对照。在整个生长过程中,在育苗的生长介质中施用氮养分。B和C.通过叶绿素含量(μg/cm2)和整个莲座的光系统II的相对光化学效率(Fv/Fm)对植物进行了表征。误差棒表明了10个独立测量的叶绿素含量和5个独立测量的叶绿素光系统II效率的标准误差。d实时荧光定量PCR分析6种差异表达OsS40基因与衰老标记OSH36基因。每个样品的转录水平相对于水稻肌动蛋白表达,值为平均值±标准差使用学生t检验生成P价值。*P≤0.05,* *P≤0.01和***P ≤ 0.001
识别OsS40响应于改变的N供应而具有常见和明显表达模式的基因,从90dag收集来自生长在所有三种类型的培养基和基因表达中的90dag,首先通过半QRT-PCR分析基因表达。十六分之一OsS40基因在对照样本(Normal-N)中有可检测的表达,其中6个,OsS40-1, OsS40-2, OsS40-4, OsS40-6, OsS40-10和OsS40-12,更改N个供应时显示差异表达式(附加文件2:图S6)。通过QRT-PCR进一步分析这6个差异表达的基因,其证实了这六种基因的增强的转录物水平。然而,与对照(正常-N)相比,在低N的植物中,所有这六种基因的表达上调,而控制和高N电源之间的表达模式相似(图。3.C),建议这六个OsS40成员可能参与氮素限制引起的旗叶早期衰老,但不参与过量氮素引起的旗叶延迟衰老。六个上调基因中的两个,OsS40-1和OsS40-2,属于第一类HvS40在大麦[19),AtS40-3在拟南芥[22也适用。OSH36[40,作为阳性对照,也表现出类似的表达模式。
表达谱的OsS40暗疗反应的候选基因
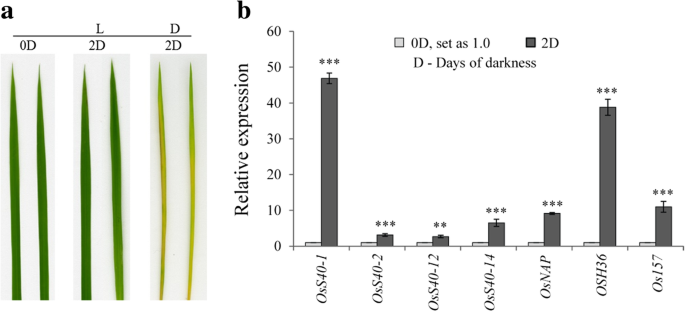
叶绿素降解和蛋白质分解代谢是衰老过程的一些典型症状。黑暗诱导的衰老经常被用作模型系统,以促进这些症状在植物中研究自然衰老[13,45.].大麦HvS40最初被鉴定为SAG,是由于其mRNA水平在黑暗诱导离体叶片衰老过程中升高[18].为了探究OsS40中哪些成员属于黑暗诱导的sag,我们检测了这些候选基因在黑暗处理后的表达。将漂浮在水中的离体水稻叶片在黑暗中孵育2天后,处理叶片出现明显的变黄表型,而对照叶片则没有(图2)。4A),表明加速衰老过程发生在暗培养后。通过半定量rt - pcr, 16个基因中的4个,OsS40-1,OsS40-2,oss40-12和oss40-14,暴露于黑暗2天的叶片表达水平升高2:图S7)。qRT-PCR分析进一步证实了这4个基因转录水平的提高,以及多个衰老标记基因的显著诱导,包括Osnap,OSH36和Os157在深色处理过的叶子中(图。4b).这一结果表明4个OsS40成员可能参与了暗诱导的叶片衰老。
表达谱的OsS40候选基因响应荷尔蒙
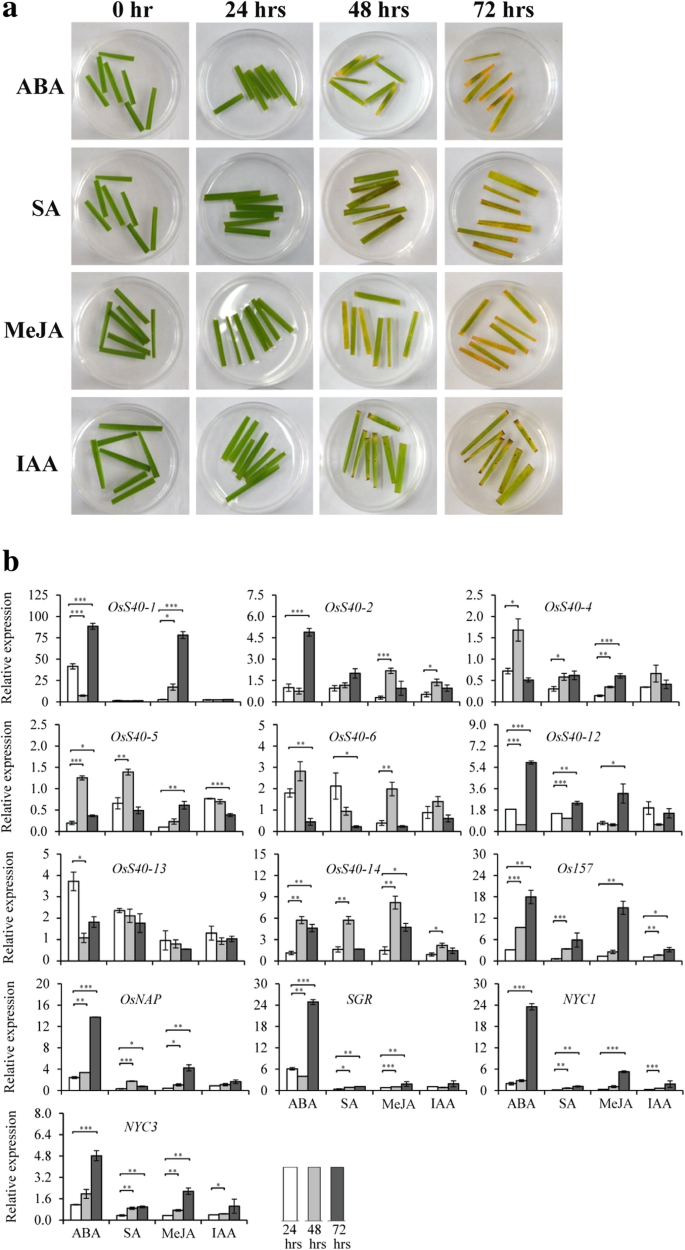
植物激素如JA、SA、ABA和乙烯已被描述为叶片衰老的诱导剂,而赤霉素、细胞分裂素和生长素则导致叶片衰老延迟[46.,47.].为了测试激素对稻叶衰老的影响,通过用尖锐的手术刀切割叶柄的近似中间,收获来自4周龄植物的成熟叶子以最小化伤口效果。然后将分离的叶片漂浮在不同浓度(50μm,100μm,200μm)的aba,sa,meja或Iaa的0,24,48和72h(hrs)中,以检查不同剂量的激素和何种剂量的效果指出了时间点。与水处理相比,在孵育48小时漂浮在4200μm激素溶液上时,在叶片上观察到清晰的促进变黄(图。5a和附加文件2:图S8),表明这些激素治疗后叶片衰老显着加速。确定不同激素对表达模式的影响OsS40200 μM浓度的激素处理24 h、48 h和72 h后采集样本,先用半定量rt - pcr分析基因表达情况。除了oss0-16,所有的OsS40其中8人在接受不同激素治疗后,转录水平发生了改变(附加文件)2图S9),通过qRT-PCR分析进一步确定。
16名成员中近一半的人,OsS40-1,OsS40-2,OsS40-4,OSS40-5,OSS40-6,OSS40-12和oss40-14, ABA处理48 h或72 h后,离体叶片表达模式增强oss40-13仅在ABA处理后24 h表达量最高,这可能是ABA引发的叶片黄变早开始(图2)。5b)。SA治疗后,mRNA水平OS40-4,OSS40-5,OSS40-12和oss40-14在48小时或72小时出现中度升高,而OsS40-6在24小时诱导高度诱导,也许是Sa-引发叶片衰老的发作(图。5b)。值得注意的是七OsS40对ABA处理反应强烈的基因在MeJA处理后也显著上调(图2)。5b),表明这7个成员可能在ABA-和meja介导的叶片衰老的共同分子机制中发挥冗余作用。作为对照,几个SAG标记的表达,如OsNAP[48.],岩石[49.],NYC1.[50.],NYC3.[51.),Os157[40ABA、SA或MeJA处理也极显著地诱导了。5b)。相比之下,只有少数基因,OsS40-2,OsS40-5和oss40-14表明OsS40的大部分基因在IAA诱导的叶片衰老过程中可能并不重要。IAA是一种生物活性的生长素,一些证据支持生长素在叶片衰老中的负作用[52.,53.,54.].然而,也有研究表明过表达生长素反应基因,SAUR36,在拟南芥表现出早期叶片衰老的表型[55.],生长素信号通路是衰老相关受体激酶(SARK)介导的叶片早期衰老所必需的[56.].因此,生长素也可能在叶片衰老过程中起促进作用。综合我们的结果(总结在表中2)提示部分OsS40基因可能在多个激素依赖的衰老通路的串扰中发挥关键作用。
表达谱的OsS40响应病原体感染的候选基因
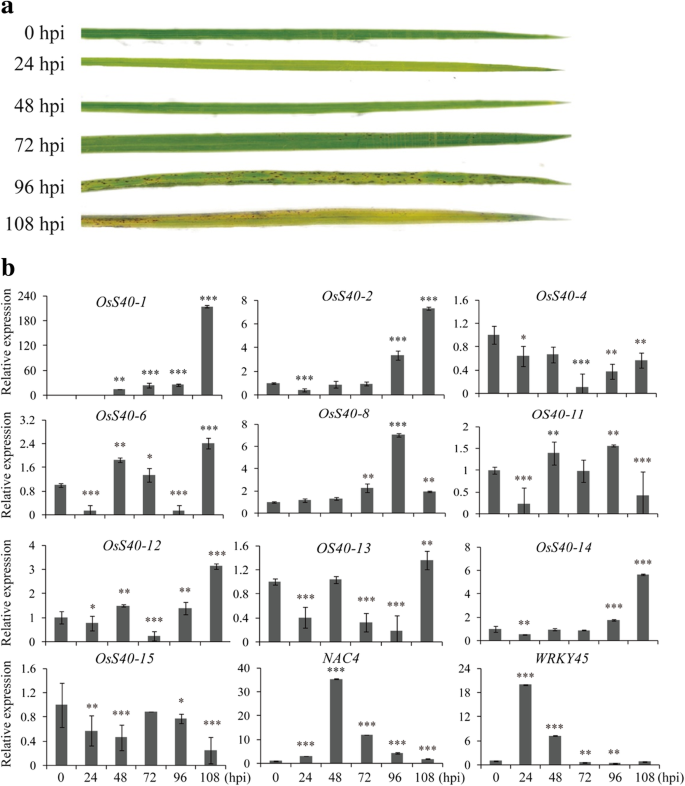
已经证明了许多植物激素,特别是SA和JA,以有助于植物中获得的系统性抗性[57.,58.].的几名成员OsS40基因家族在应答SA或MeJA时表达量增加,提示它们可能在植物与病原互作中发挥防御相关功能。探究的表达S40在水稻3 ~ 4叶期苗期喷施稻瘟病菌孢子接种水稻候选基因Magnaporthe oryzae应变Guy11。作为对照,在水稻幼苗上喷洒0.02%(w/v)吐温20解决方案。每隔24 h采集染病叶片,直至接种后108 h病害症状明显显现(图1)。6一种)。为了控制病原体,转录水平的两种无国防相关标记基因的作用,NAC4[59.),WRKY45[60.,在真菌感染期间也进行了测量。正如预期的那样,它们都在受感染的水稻叶片中表现出强烈的诱导作用。
半QRT-PCR分析显示,在用真菌病原体治疗植物后,16个基因中的10个出现了改变的基因表达(附加文件2图S10), qRT-PCR分析进一步证实。这五个基因,OsS40-1,OsS40-2,OsS40-6,oss40-12和oss40-14对SA或MeJA处理有反应的植物的mRNA水平也有升高M.oryzae.在真菌侵染水稻的后期,当侵染水稻的叶片发生坏死病变时,它们都是特异性的高表达。6a和b)。HvS40也有报道称,仅在感染部位有大量的mRNA积累Pyrenophora Teres.[19].据推测,这五个人OsS40基因和HvS40可能与坏死引起的细胞快速衰老和死亡有关。此外,感染后的转录水平升高也出现在OsS40-8和oss40-13,其表达不受上述所有处理的影响。然而, OsS40-4,oss40-11和oss40-15结果表明,受感染的水稻叶片中表达量下降(图。6B),暗示它们可能在病原体感染引发的衰老中发挥明显或负作用。
OsS40蛋白在水稻细胞中的亚细胞定位
利用Protparam程序(http://web.expasy.org/protparam/)(附加文件2:表S2)。等分症点(PI)的值从5.36(OSS40-16)变化为11.27(OSS40-11)。相应的分子量从14.14kDa(OSS40-7)变化至28.52kDa(OSS40-10)。分子量平均为19.67kDa。在这些蛋白质中,所有的结构都具有不稳定的结构,除了oss40-13不稳定性指数为27.77。OsS40-16为不稳定型,不稳定指数为89.11。水稻中所有的S40蛋白均为亲水性蛋白,疏水性评分(GRAVY)低于02:表S2)。
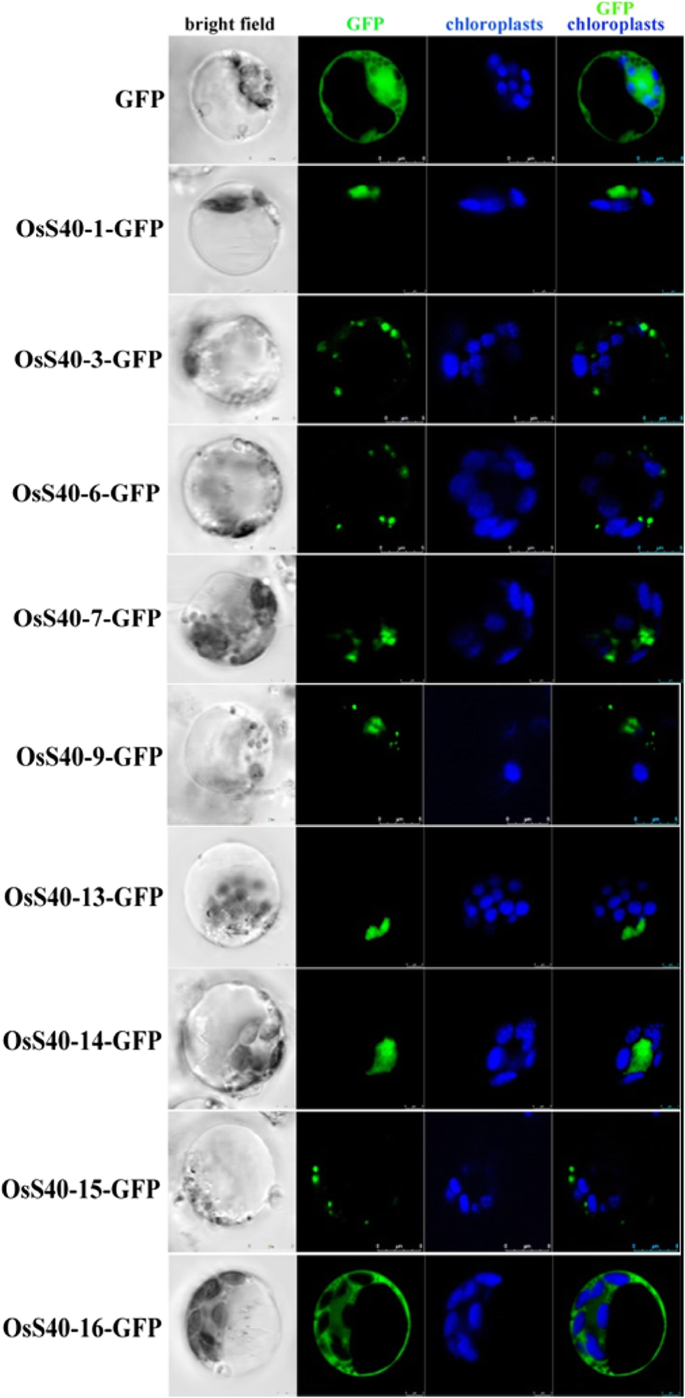
为了探讨水稻细胞中的OSS40成员的亚细胞定位,它们的编码区融合到GFP.并置于35S camv启动子的控制下。通过peg介导转化水稻原生质体。在原生质体中,表达的OsS40-1-GFP、OsS40-13-GFP和OsS40-14-GFP在细胞核中有效积累,而OsS40-16-GFP则分布在细胞质中。另一方面,OsS40-3-GFP、OsS40-6-GFP、OsS40-7-GFP、OsS40-9-GFP和OsS40-15-GFP的荧光在细胞质中出现多个斑点(图4)。7).免疫检测实验证实了这些OsS40成员在水稻细胞中的表达和稳定性(附加文件)2:图S11)。
讨论
一些研究表明S40基因与植物衰老或环境变化有关HvS40和拟南芥AtS40-3[19,22,34].全基因组调查和比对也显示S40基因家族存在于许多植物中[24].本研究根据HvS40蛋白序列分离出16个含有duf584的成员,并进一步分析了其在水稻衰老过程中的表达模式和在水稻细胞中的定位。这项筛选调查显示,16个成员中有6个对年龄依赖性或胁迫诱导的叶片衰老作出响应。其中2个候选基因OsS40-1和OsS40-14在水稻原生质体中瞬时表达,主要富集在细胞核中,这与HvS40和AtS40-3的亚细胞分布模式相似[19,22].
类比拟南芥S40家族,16个OSS40成员分为5组,它们的基因在八种米染色体上不均匀地穿插(图。1额外的文件2:图S2)。独特的特点OsS40大多数基因都没有内含子,除了OsS40-8和OsS40-10只有一个或两个内含子(附加文件2:图S1)。提出,在应力期间快速调节的基因包含较少的内含子,因为许多内含子可以用作负反馈时间延迟环或直接延长前mRNA的长度,导致转录伸长率[61.,62.,63.].中也观察到低内含子密度拟南芥S40基因,并在其他应激反应基因家族中报道,如晚期胚胎发生丰富(LEA)基因家族[64.]和海藻糖-6-磷酸合酶基因家族[65.].虽然水稻S40蛋白的氨基酸序列与HvS40和AtS40-3并不具有高度的相似性(附加文件2图S3), motif组成分析提示OsS40-2的功能可能与HvS40相似,而OsS40-14和OsS40-16可能与AtS40-3相似。虽然在每个OsS40蛋白中都能检测到DUF584结构域和3个保守motif,但motif的数量和分布都发生了变化(附加文件)2:图S4),导致其蛋白质序列结构紊乱,这可能有助于结构灵活性,从而使蛋白质能够与不同的DNA、RNA或蛋白质靶标结合,在植物衰老过程中具有多用途能力[66.].这些结果表明OsS40含有少量内含子的基因编码一系列具有DUF584基序的非结构蛋白,使OsS40蛋白在胁迫条件下作为灵活的相互作用者与其他分子相互作用。
此外,水稻启动子区还存在大量推测的TF结合位点,如w -box、MYBs、MYCs、Dofs等,以及胁迫响应元件ABRE、DRE等S40基因(附加文件2表S1),也提示它们可能受不同的转录因子调控,从而参与发育衰老或多种应激介导信号[67.,68.,69.,70].DNA结合蛋白HVWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWWW.HvS40非encest叶子的启动子[33].在拟南芥, AtWHIRLY1已被证实为的上游抑制因子AtWRKY53,编码叶片衰老的关键正调节剂[71.].因此,HvWHIRLY1可能作为负调控因子HvS40在衰老开始之前[33].这将是有趣的筛选水稻旋风目标推广OsS40由Chip-qPCR基因。
一般来说,基因的表达模式与其功能有一定的联系。调查稻米的参与情况S40旗叶自然衰老的基因,表达概况OsS40采用半定量RT-PCR检测旗叶衰老不同阶段的基因。其中6个在旗叶衰老开始或早期表达量增加,而在叶绿素含量低于20%的晚期叶片转录量下降,这与旗叶的表达动态相似OSH36,证实水稻衰老上调基因[40] (图。2).这些数据表明,一组OsS40基因可能以年龄依赖性的方式与旗叶自然衰老有关。从系统发育树来看,OsS40-1、OsS40-2、OsS40-7、OsS40-14与HvS40、AtS40-3属于同一类群(图4)。1), 但OsS40-1和OsS40-2在旗叶的自然衰老期间未诱导。对此的简单和可能的解释是它们的蛋白质中的低氨基酸相似度可能导致不同的活动OsS40-1和OsS40-2从其他成员在规定的实验条件下。值得注意的是,据报道HvS40和AtS40-3在大麦主要叶子的晚期衰老阶段累积到更高水平的转录物拟南芥莲座叶,分别[22,34,是六种表达水平中最高的OsS40基因只在水稻旗叶衰老开始时出现。一种可能是,考虑到旗叶在灌浆期发挥更重要的作用,衰老的旗叶和成熟的旗叶之间的组织依赖性基因表达趋势可能不一致[72.,73.].
考虑到自然衰老是内源衰老发育和环境变化共同作用的复杂退行过程,许多SAGs对诱导叶片衰老的外部胁迫也具有较高的响应能力[2,13,40,74.].HvS40由于其mRNA在不同衰老条件下的累积水平,看起来像是几个衰老相关途径共享的关键调控因子[19,33,34,而七ATS40在自然叶片衰老过程中诱导的基因显示了离散的转录谱,以响应不同的胁迫诱导衰老[22].在此之前,我们也知道了预测的表达模式的偏差OsS40在盐或干旱胁迫下的基因[24,假设S40成员可能在多个刺激促进衰老途径之间的串扰中发挥作用。为了进一步证实这一想法,对所有16个表达式进行了说明OsS40使用半和定量RT-PCR在不同的应力条件下测试基因。结果(在表中总结2揭示;揭示OsS40基因(OsS40-4,OsS40-5和oss40-14)涉及年龄依赖的旗叶衰老也在各种刺激治疗范围内调节从黑暗到M.oryzae感染。注意到oss40-14似乎是一个关键因素,涉及几乎所有测试应激介导的衰老过程,除了在氮缺乏的情况下。然而,半RT-PCR的数据反映了这一点oss40-14也可能在缺氮诱导的旗叶衰老过程中被激活2:图S6)。因此,OsS40-14在应对环境胁迫方面的生物学功能值得进一步研究。
类似于AtS40-6和AtS40-7[22,其他三个则与年龄有关OsS40基因(OsS40-7,OsS40-9和oss40-15)除了下调的情况下,没有显示对各种压力处理的增强响应oss40-15在M.oryzae- 养育米叶(表2),这表明它们可能与发育控制的衰老途径特别相关。在拟南芥,SAG12.被鉴定为自然衰老特异性标记,因为其转录物水平没有受到应激或激素控制的衰老显着影响[13,75.].预测该酶编码的半胱氨酸蛋白酶SAG12.可能对细胞有害,导致其在衰老过程中的晚期表达[13].最近,已经证明了JA诱导的叶片衰老,WRKY57中的阻遏物能够直接与启动子结合SAG12.干扰它的转录[76.].因此,我们假设OsS40-7,OsS40-9和oss40-15可能作用于衰老相关汇聚通路的下游。
此外,我们发现OsS40基因,如OsS40-1,OsS40-2,OsS40-6和oss40-12在旗叶衰老过程中,旗叶的活性较低或不受影响,但在外部胁迫或激素处理下显著引起(表1)2),这表明它们可能对胁迫诱导的叶片衰老具有特异性,尽管在不同的胁迫条件下它们的转录本具有有限的相似性。这些应激依赖的OsS40候选基因可能作为快速调节成分,促进极端环境变化引起的细胞死亡。这项研究没有提到拟南芥S40家族,仅使用叶片衰老相关的AtS40成员进行进一步分析。因此,我们的结果扩展了对衰老相关复杂调控网络中S40蛋白潜在功能的认识。这些OsS40候选基因在水稻发育和衰老的多个方面的重要性可能得到验证。但是,考虑到这些可能的功能冗余OsS40在叶片衰老的不同情况下,应该指出的是,这些敲击或敲除OsS40成员可能不会导致与衰老相关的明确表型,正如缺失研究所显示的那样拟南芥SAG12[77.].然而,最近发表的一项基于计算机的策略,通过系统分析SAG调控网络,可能有助于识别调控叶片衰老的关键S40基因[78.].
由于在蛋白质序列中包含了两个推定的核定位信号(NLS),发现HVS40-GUS主要在细胞核中积聚并部分地在细胞质中积聚[19].相反,大多数报道的ATS40蛋白显示在细胞质中分布,除了ATS40-3,其本地化类似于HVS40 [22].但是,值得注意的是,对大麦HVS40的亚细胞靶向的调查是值得注意的拟南芥AtS40蛋白是在洋葱表皮细胞上进行的,因此寄主特异性关联可能对原位定位模式产生影响。因此,在水稻原生质体中瞬时表达了c -末端融合到GFP的OsS40蛋白。结果表明,这些OsS40成员在水稻细胞中占据离散的亚细胞室。OsS40-1、OsS40-13和OsS40-14只在细胞核内靶向,而其他成员要么以斑点形式积累在细胞质中,要么分布在细胞质中(图4)。7),表明它们可能受到各种信号的调控,在水稻中可能执行不同或冗余的功能。此外,与HvS40和AtS40-3一样,基于网络的蛋白质功能家族预测软件SVMProt强调了OsS40-1和OsS40-14可能的dna结合特性[79.,80].通常,转录调控因子定位于细胞核中,并与DNA结合,开启或关闭一组靶基因,以snap为例[81.], OsY37 [82.],osnac2 [83.,84.,起到叶片衰老的正向调节作用。需要额外的实验来确定OsS40-1和OsS40-14的dna结合以及TF活性。
结论
在本研究中,共有16个S40对水稻基因组进行了基因鉴定,可分为5组。所有这些的表情简介OsS40旗叶自然衰老和各种促衰老胁迫处理的基因揭示了旗叶中包括OsS40-1、OsS40-2 OsS40-12和oss40-14,高度压力响应。关于系统发育关系,转录物数据和亚细胞分布,基因OsS40-1和oss40-14预计米饭预计将具有最高的功能性相似之处HvS40大麦或大麦的基因AtS40-3基因的拟南芥,因此它们的作用值得进一步研究。综上所述,本研究为进一步了解S40家族在植物衰老调控中的作用奠定了基础。
方法
OsS40蛋白的鉴定及系统发育分析
识别S40像大米的基因一样(栽培稻粳稻),将HvS40蛋白序列作为查询序列对水稻基因组数据库(http://plants.ensembl.org/Oryza_sativa/Tools/Blast?db=core).利用ClustalW对水稻、拟南芥和大麦中的S40蛋白进行多序列比对。利用mega6.0软件进行系统发育树构建,共1000个bootstrap重复。
染色体位置OsS40基因
标出…的位置S40像水稻中的基因转录物一样(OsS40)、来自水稻科学综合数据库的染色体图谱工具(http://viewer.shigen.info/应用oryzavw/maptool/Map Tool.do)可视化染色体分布。的染色体位置信息OsS40基因从水稻数据库(http://rice.plantbiology.msu.edu/).
基因结构和假定的顺式作用元件的特性
的外显子-内含子结构OsS40利用Gene Structure Display Server2.0 (http://gsds.cbi.pku.edu.cn/).水稻数据库中检索水稻中的CD和基因组序列(http://rice.plantbiology.msu.edu/).转录起始位点上游的1-kb(−1)OsS40提取转录本作为启动子,利用PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).
OsS40蛋白的保守基序及其化学特征
为了发现OsS40蛋白序列中的Motif,在线工具Multiple Expectation Maximization for Motif Elication (MEME) 4.11.2 (http://meme-suite.org/)用于鉴定全长OsS40蛋白的保守基序。优化参数为:基序分布,每个序列出现0或1次;最小的网站,6;最大宽度60;最大数量的主题,10。
为了了解所有16个S40蛋白的物理和化学特性,通过ProtParam计划计算或预测包括分子量,理论上Pi,氨基酸数,不稳定性指数,肉汁和脂族指数的6个指标(http://web.expasy.org/protparam/).
植物材料和治疗
水稻品种种子,o .马唐无性系种群。japonica.和栽培稻的履历。CO39,来自宗华王教授(福建农业和林业大学,中国)善良。发芽后,米幼苗(o .马唐无性系种群。粳稻)在人造气候室的生长室中生长,具有12-H光(28℃)/ 12-H-暗(25℃)光周期。在衰老开始之前收集样品直至不同时间点的晚期衰老,即90dag,97dag,104dag,111dag,118dag(发芽后DAG-天)。
为分析缺氮诱导水稻衰老的原因,将水稻植株置于含正常N (1 ml/L)、正常N (1/2 ml/L)和正常N (2 ml/L)的液体培养基中。以ABA、SA、MeJA和IAA (idole acetic acid, IAA)溶液(200uM)漂浮离体叶片,分析激素诱导的衰老。为了分析暗诱导衰老,将植株置于暗环境中2 d。
水稻侵染试验m . oryzaestrain Guy11被执行。3至4周龄的稻苗(栽培稻的履历。通过喷射真菌孢子接种的CO39,悬浮在5×10的浓度4Conidia / ml在0.02%(w/v) Tween20解决方案。接种后的植株在20-23℃、80%湿度的条件下保存24 h,然后在25℃、80%湿度的生长室内保存5 d。接种后24 h、48 h、72 h、96 h和108 h将染病叶片切除并进行RNA分析。作为模拟对照,只喷施0.02% (w/v) Tween20溶液。
叶绿素含量和叶绿素荧光的测量
叶绿素含量测定采用CCM-200 +叶绿素含量仪。叶绿素测定采用每株4片叶片。每片叶子至少放置10个点测量。计算了5个单株莲座叶的平均Fv/Fm。使用Pocket PEA叶绿素荧光仪进行叶绿素荧光测量。为了解释单个植物表面光合参数的变化,所提供的数据是在超过15分钟的3个点上单个莲座获得的平均值。所有的光合作用测量都是在5个单株的4个叶片上进行的。
半定量RT-PCR和定量RT-PCR的基因表达分析
用TRIzol试剂(Invitrogen, Carlsbad, CA, USA)提取总RNA。采用Transcript One-step gDNA Removal and cDNA Synthesis SuperMix对RNA进行反转录。相关基因的序列S40从水稻基因组数据库中提取基因家族,利用其编码DNA序列,利用Premier软件和NCBI在线工具设计基因特异性引物。用于半RT-PCR的特异性引物对列于附加文件1:表S1和qRT-PCR附加文件1S2:表。每一个扩增都确定了线性关系,产品在琼脂糖凝胶上用溴化乙锭染色可见。qRT-PCR总体积为20 μl,包括1× Platinium_SYBR_Green qRT-PCR SuperMix-UDG,每个基因特异性引物0.3 μM和10 μM的荧光素作为被动参比染料进行井因子校正。为了计算qRT-PCR的效率,使用了三种不同的cDNA稀释剂。为比较,将各处理成熟叶片的转录水平归一化至对照。每个数据点基于9个独立的测量,包括3个生物重复和3个技术重复(3 × 3)。
质粒的构建
构建表达载体,其编码序列如下OsS40根据制造商说明书,使用bp -克隆酶将基因克隆到进入载体pDONR201 (Invitrogen公司),随后通过LR反应(Gateway重组,Invitrogen公司)克隆到目的载体p2GWF7 (GFP c端融合- vib,比利时根特大学)。所有融合结构均由35S启动子驱动。所使用的特定引物对在附加文件中列出1表S3。
原生质体的分离、转化和共聚焦显微镜
水稻原生质体的制备是根据先前描述的方案进行的[85.略作修改。为了分离原生质体,将10-12日龄水稻幼苗的茎和鞘用新鲜刀片切成0.5 mm的条,并放入含有1.5%纤维素酶' Onozuka ' RS (Yakulta)、0.4% macerozyme R-10 (Yakulta)和0.2%果胶酶(Sigma)的酶溶液中培养。释放的原生质体经真空渗透和酶解后,经40 μm尼龙网过滤收集。存活原生质体通过蔗糖梯度离心收获,W5溶液洗涤一次,离心收获,2.5 × 10密度重悬6在peg介导转染前,在MMG溶液(0.4 M甘露醇,15 mM MgCl2和4 mM MES, pH 5.7)中/ml培养细胞。
对于转化,将10μg质粒DNA与100μL原生质体混合(约2.5×106加入细胞/ ml)和110μLPEG溶液。然后,将混合物在室温下温育5-10分钟。孵育后,用440μLW5溶液稀释混合物。通过轻轻反转管子,将溶液完全混合,并通过以400g以400g离心2分钟来沉淀原生质体。将转染的原生质盒样品重悬于200μlW1溶液中,并在室温下在暗度下培养10小时,允许质粒基因表达。
所有显微观察均使用徕卡TCS SP8共聚焦激光扫描显微镜。荧光的激发波长为488 nm,发射波长为505-535 nm。叶绿体自动荧光检测通道的激发波长和发射波长分别为633和650-710 nm。图像处理使用ImageJ (http://rsb.info.nih.gov/ij/).
通过免疫印迹检测GFP稠合蛋白质
对于每个样品,在转染后12小时收集200μl转化的原生质体,并在20μL蛋白质加载缓冲液中变性。使用标准协议进行SDS-PAGE和Western印迹分析[86.].使用小鼠(转基因)产生的抗gfp单克隆抗体,在5% BSA的TBS-T中稀释1/3000稀释,通过免疫印迹法检测gfp标记的OsS40蛋白的表达。
缩写
- 阿巴:
-
脱落酸
- 装备:
-
染色体
- GFP:
-
绿色荧光蛋白
- IAA:
-
伪脂醋酸
- 惩罚:
-
甲基jasmonate
- 护士:
-
氮
- 存在:
-
实时定量聚合酶链反应
- 山:
-
水杨酸
- 落下:
-
衰老相关基因
- 山姆:
-
技条顶端分生组织
- SDS-PAGE:
-
十二烷基硫酸钠聚丙烯酰胺凝胶电泳
- TFs:
-
转录因子
参考文献
- 1.
Buchanan-Wollaston v,Ainsworth C.甘蓝型叶片叶衰老:通过减毒杂交来克隆衰老相关基因。植物mol biol。1997年; 33(5):821-34。
- 2.
林波,金HJ,吉南h。叶片衰老。植物学报2007;58:115-36。
- 3.
李建军,李建军,李建军,等。WRKY54和WRKY70对拟南芥叶片衰老的负调控作用。中国生物医学工程学报。2012;63(7):2667-79。
- 4。
王志强,王志强,王志强,等。WRKY53转录因子在拟南芥叶片衰老过程中的作用。植物学报,2012,37(6):659 - 663。植物学报。2004;55(6):853-67。
- 5。
关键词:拟南芥,OsWRKY23基因,抗病能力,暗诱导衰老植物生长规律。2009;58(2):181-90。
- 6。
韩M,Kim C-Y,Lee J,Lee S-K,Jeon J-S。OSWRKY42抑制OSMT1D并在水稻中诱导反应性氧物种和叶片衰老。分子和细胞。2014; 37(7):532。
- 7。
Ricachenevsky FK, Sperotto RA, Menguer PK, Fett JP。通过对水稻幼苗铁过量诱导基因的鉴定,发现了一个响应铁、干旱和衰老的WRKY转录因子。acta photonica sinica; 2010;37(8): 3735-45。
- 8。
Robatzek S, somsich IE。AtWRKY6是拟南芥WRKY转录因子家族的一个新成员,它与衰老和防御相关过程都相关。植物j . 2001; 28(2): 123 - 33所示。
- 9。
Thomas H, Ougham H,保持绿色的特性。[J] .机器人。2014;65(14):3889-900。
- 10.
陈勇,邱凯,郭斌,丁颖。一种调控竹(Bambusa emeiensis ' Viridiflavus ')叶片衰老的转录因子BeNAC1的鉴定。杂志。2011;(4)142:361 - 71。
- 11.
陈旭,吴晓军,明峰奥雅萨苜蓿及其在分子育种中的应用。复旦大学(自然科学版)。2012; 51:507-14。
- 12.
张艳,曹勇,邵强,王丽,王华,李军,李华。ZmNAP基因对玉米抗衰老和产量性状的调控作用。河南农业科学,2012;41:19-24。
- 13.
Weaver LM, Gan S, Quirino B, Amasino RM。应激和激素处理下几个衰老相关基因表达模式的比较。植物学报。1998;37(3):455-69。
- 14。
德斯菲尔德A,阿夫尼R,费希尔m。小麦和大麦的衰老、养分恢复和产量。[J] .机器人。2014;65(14):3783-98 .]
- 15.
Gregersen PL, Holm PB。小麦旗叶衰老的转录组分析。植物生态学报;2007;5(1):192-206。
- 16。
小麦和大麦叶片衰老和养分恢复的研究。植物医学杂志。2008;10 (s1): 37-49。
- 17。
Parrott DL, McInnerney K, Feller U, Fischer AM。蒸煮大麦(Hordeum vulgare)叶片导致碳水化合物积累和加速叶片衰老,促进衰老相关基因的转录组分析。新植醇。2007;176(1):56 - 69。
- 18。
Becker W,Apel K.天然和人工诱导的叶片衰老之间基因表达的差异。Planta。1993年; 189(1):74-9。
- 19。
Krupinska K, Haussühl K, Schäfer A, van der Kooij TA, Leckband G, Lörz H, Falk J.一种新的细胞核靶向蛋白在大麦衰老和病原体感染过程中表达。植物杂志。2002;130(3):1172 - 80。
- 20.
大麦旗叶衰老过程中光合器官的功能和分子变化。植物学报。1996;19(3):337-44。
- 21.
关键词:大麦,暗诱导,衰老,基因表达,基因克隆足底。1997;203(3):332 - 40。
- 22.
关键词:拟南芥,AtS40,基因表达,自然发育abstract:acta botanica sinica(云南植物学报),2010;37(4):489 - 494。
- 23.
拟南芥(Arabidopsis thaliana)的一个衰老相关基因在自然和人工诱导的叶片衰老过程中受到显著调控。植物学报。1996;30(4):739-54。
- 24.
jehanzeb m,zheng x,miao y。S40基因家族在叶片衰老中的作用。int j mol sci。2017; 18(10):2152。
- 25.
Krupinska k,Dähnhardtd,费克尔 - kilbienski i,kucharewicz w,Scharrenberg c,röschm,降压f.鉴定Whirly1作为对应激和衰老相关基因Hvs40的启动子的因子。J工厂增长调节。2014; 33(1):91-105。
- 26.
eulgem t,rushton pj,Robatzek S,Somssish Ie。植物转录因子的腕骨超家族。趋势植物SCI。2000; 5(5):199-206。
- 27.
拟南芥AtMYC2 (bHLH)和AtMYB2 (MYB)在脱落酸信号转导中起转录激活作用。植物细胞。2003;15(1):63 - 78。
- 28.
Yanagisawa S, Schmidt RJ。Dof转录因子识别序列的多样性和相似性。植物j . 1999; 17(2): 209 - 14所示。
- 29.
杨志强,王志强,王志强,等。钙调素结合/CGCG盒dna结合蛋白家族在植物中表达的研究进展。生物化学杂志。2002;277(47):45049-58。
- 30.
BUSK PK,页面M.脱落酸诱导的转录的调节。植物mol biol。1998年; 37(3):425-35。
- 31.
铃木M,Ketterling Mg,McCarty Dr。ABA / VP1-和CBF / DREB1调节基因拟南芥顺式调控序列的定量统计分析。植物理性。2005; 139(1):437-47。
- 32.
蒋超,刘波,王志强,等。油菜BN115基因冷诱导的CCGAC顺式作用元件的筛选。植物学报。1996;30(3):679-84。
- 33.
Krupinska K,Dahnhardt D,Fischerkilbienski I,Kucharewicz W,Scharrenberg C,Trosch M,Cuck F. Whrly1的鉴定作为与应激和衰老相关基因HVS40的启动子结合的因子。J工厂增长调节。2014; 33(1):91-105。
- 34.
大麦衰老相关基因HvS40组蛋白修饰的研究进展[j]。植物学报。2015;89(1-2):127-41。
- 35.
PBF-2是一种新型的单链DNA结合因子,与马铃薯PR-10a基因的激活有关。植物细胞。2000;12(8):1477 - 89。
- 36.
DESVEAUX D,Subramaniam R,Despres C,Despres C,Sempet C,Fobert Pr,Dangl JL,Brisson N.在拟南芥中的水杨酸依赖性疾病性需要所需的。DEV细胞。2004; 6(2):229-40。
- 37.
Waese J, Fan J, Pasha A, Yu H, Fucile G, Shi R, Cumming M, Kelley LA, Sternberg MJ, Krishnakumar V, et al. ePlant:可视化和探索植物生物学假说生成的多层次数据。植物细胞。2017;29(8):1806 - 21所示。
- 38。
吉田。水稻作物科学基础。Intrice Resinstlos Ba Os, 1981。
- 39。
刘L,徐W,胡X,刘H,林Y. W-Box和G-Box元素在稻旗叶早期衰老中起重要作用。SCI批准。2016; 6:20881。
- 40.
李瑞华,王春华,黄立涛,陈世刚。水稻叶片衰老:衰老上调基因的克隆与特性研究。中国生物医学工程学报。2001;52(358):1117-21。
- 41.
王志强,王志强,王志强,等。氮胁迫对大豆叶片衰老和氮素再分配的影响。阿格龙j . 1978; 70(1): 43-7。
- 42.
SchildHauer J,Wiedemuth K,Humbeck K.氮气供应含量反转衰老过程,并影响编码血液谷氨酰胺合成酶和赖氨酸 - 酮酸还原酶/糖磷脱氢酶的基因的表达。植物BIOL。2008; 10(S1):76-84。
- 43.
陈志强,陈志强,陈志强,等。植物衰老与作物产量的关系。acta botanica sinica(云南植物学报). 2013;32(6):693 - 698。
- 44.
Masclaux-Daubresse C,Reisdorf-Cren M,Orsel M.植物开发和籽粒灌装的叶氮复合。植物BIOL(斯图特)。2008; 10(4):23-36。
- 45.
郭颖,甘树华。叶片衰老的信号、执行和调控。Curr Top Dev Biol. 2005; 71:83-112。
- 46.
Khan M, Rozhon W, Poppenberger B.激素在植物衰老中的作用-一个小型综述。老年医学。2014;60(1):49-55。
- 47.
陈志强,王志强,王志强,等。植物叶片发育和胁迫信号整合的激素调控。acta botanica sinica(云南植物学报). 2013;82(6):547-61。
- 48.
关键词:水稻,脱落酸,生物合成,衰老相关基因,OsNAP中国科学院院刊。2014;111(27):10013-8。
- 49.
Hörtensteiner S.保持绿色调节衰老过程中的叶绿素和叶绿素结合蛋白降解。植物科学进展。2009;14(3):155-62。
- 50.
Kusaba M, Ito H, Morita R, Iida S, Sato Y, Fujimoto M, Kawasaki S, Tanaka R, Hirochika H, Nishimura M.水稻NON-YELLOW COLORING1在叶片衰老过程中参与光收获复合物II和基粒降解。植物细胞。2007;19(4):1362 - 75。
- 51.
Morita R, Sato Y, Masuda Y, Nishimura M, Kusaba M.在水稻叶片衰老过程中,一种α/β水解酶折叠家族蛋白的非黄色着色3缺陷导致了一个保持绿色的表型。植物j . 2009; 59(6): 940 - 52。
- 52.
Kim JI, Murphy AS, Baek D, Lee SW, Yun DJ, Bressan RA, Narasimhan ML. YUCCA6过表达表明生长素在延缓拟南芥叶片衰老中的作用。中国生物医学工程学报。2011;62(11):3981-92。
- 53.
Ellis CM, Nagpal P, Young JC, Hagen G, Guilfoyle TJ, Reed JW。生长素反应因子1和生长素反应因子2调控拟南芥的衰老和花器官脱落。发展。2005;132(20):4563 - 74。
- 54.
Lim PO, Lee IC, Kim J, Kim HJ, Ryu JS, Woo HR, Nam HG.生长素响应因子2 (Auxin response factor 2, ARF2)在生长素介导的叶片寿命调控中起主要作用。中国生物医学工程学报。2010;61(5):1419-30。
- 55.
关键词:拟南芥,生长素向上RNA, SAUR36,叶片衰老植物杂志。2013;161(2):1002 - 9。
- 56.
徐F,孟T,李P,yu y,崔y,王y,龚q,王nn。一种大豆双特异性激酶,Gmsark及其拟南芥同源物,Atsark,通过促进素和乙烯的协同作用来调节叶片衰老。植物理性。2011; 157(4):2131-53。
- 57.
Robert-Seilaniantz A,Grant M,Jones JD。植物疾病和防御中的激素串扰:不仅仅是茉满面水杨酸盐拮抗作用。Annu Rev phytopathol。2011; 49:317-43。
- 58.
黄志强,王志强,王志强,等。植物激素途径与病原菌效应的关系。植物细胞,2014,26(6):2285 - 309。
- 59.
Kaneda T, Taga Y, Takai R, Iwano M, Matsui H, Takayama S, Isogai A, Che FS。转录因子OsNAC4是植物超敏细胞死亡的关键正调节因子。EMBO j . 2009; 28(7): 926 - 36。
- 60.
Shimono M, Sugano S, Nakayama A, Jiang C-J, Ono K, Toki S, Takatsuji H. Rice WRKY45在苯并噻唑诱导的稻瘟病抗性中起关键作用。植物细胞。2007;19(6):2064 - 76。
- 61.
Swinburne IA, Silver PA。发育过程中的内含子延迟和转录时机。Dev细胞。2008;14(3):324 - 30。
- 62.
Jeffares DC, Penkett CJ, Bahler J.快速调控基因内含子匮乏。趋势麝猫。2008;24(8):375 - 8。
- 63.
内含子的功能。麝猫。2012;55分钟。
- 64.
梁Y,Xiong Z,Zheng J,Xu D,Zhu Z,Xiang J,GaN J,Raboanatahiry N,Yin Y,Li M.全基因组鉴定,结构分析和新洞察晚期胚胎发生的丰富(LEA)基因家族形成在芸苔栗色的图案。SCI批准。2016; 6:24265。
- 65.
谢德伟,王新宁,付林林,孙军,郑伟,李志峰。冬小麦海藻糖-6-磷酸合酶基因家族的鉴定及冰冻胁迫下的表达分析J麝猫。2015;94(1):55 - 65。
- 66.
Patil A,Nakamura H.无序结构域和高表面电荷赋予轮毂,其能够与交互网络中的多种蛋白质相互作用。费用。2006; 580(8):2041-5。
- 67.
安巴瓦特,沙玛,亚达夫NR,亚达夫RC。MYB转录因子基因作为植物反应的调控因子:综述。植物学报。2013;19(3):307-21。
- 68.
Boter M,Ruiz-Rivero O,ABDEEN A,PRAT S.保守的Myc转录因子在番茄和拟南芥中的茉莉酸盐信号中发挥着关键作用。基因开发。2004; 18(13):1577-91。
- 69.
李志刚,李志刚,李志刚。拟南芥维管系统发育和功能的研究进展[j]。植物科学学报2013;4:164。
- 70.
Phukan UJ, Jeena GS, Shukla RK。WRKY转录因子:植物的分子调控与逆境响应。植物科学学报,2016;
- 71.
关键词:拟南芥,WRKY53, dna结合蛋白,转录因子,生长发育植物杂志。2013;163(2):746 - 56。
- 72.
王旭,蔡军,姜东,刘芳,戴涛,曹伟。花前高温驯化减轻小麦花后高温胁迫对旗叶的伤害。植物生理学杂志。2011;168(6):585-93。
- 73.
基于数值图像分析的硬粒小麦旗叶衰老及其与产量的关系作物学报,2000;185(4):275-80。
- 74.
刘丽,周勇,周刚,叶锐,赵磊,李旭,林勇。水稻旗叶早衰相关基因的鉴定。acta botanica sinica(云南植物学报),2008;37(1):1 - 4。
- 75.
卢三世,Amasino RM。衰老特异性表达SAG12启动子区域的鉴定。植物学报。1999;41(2):181-94。
- 76.
关键词:拟南芥,WRKY57,茉莉酸,生长素,叶片衰老植物细胞,2014,26(1):230 - 45。
- 77.
otegui ms,noh ys,martinez de,vila petroff mg,Staehelin la,amasino rm,uiiamet jj。具有强烈蛋白水解活性的衰老相关的液泡在拟南芥和大豆叶中产生。工厂J. 2005; 41(6):831-44。
- 78.
关键词:拟南芥,叶片衰老,基因网络,功能分析acta botanica yunnanica(云南植物研究). 2012;54(8):526-39。
- 79.
蔡长忠,韩丽英,季志林,陈旭,陈永忠。支持向量机:基于网络的支持向量机软件,用于根据蛋白质的主要序列对其进行功能分类。核酸学报2003;31(13):3692-7。
- 80.
李艳华,徐建勇,陶磊,李晓峰,李胜,曾旭,陈少英,张鹏,秦超,张超,等。SVM-Prot 2016:机器学习从序列预测蛋白质功能家族的web服务器,不考虑相似性。《公共科学图书馆•综合》。2016;11 (8):e0155290。
- 81.
关键词:水稻,NAC基因,叶片衰老调控,功能特性植物学报。2013;13(1):132。
- 82.
El Mannai Y, Akabane K, Hiratsu K, Satoh-Nagasawa N, Wabiko H. NAC转录因子基因OsY37 (ONAC011)促进水稻叶片衰老,加速抽穗期。中华医学杂志。2017;18(10):2165。
- 83.
毛超,丁伟,吴玉杰,何鑫,寿华,吴鹏。水稻na结构域蛋白的过表达促进茎部分枝。新植醇。2007;176(2):288 - 98。
- 84.
毛超,卢树华,吕波,张博,沈军,何杰,罗磊,席东,陈昕,明飞。A型水稻NAC转录因子通过ABA生物合成促进叶片衰老。植物杂志。2017;174(3):1747 - 63。
- 85.
张颖,苏军,段绍峰,戴军,刘杰,王鹏,李勇,刘波,冯德成。水稻绿色组织原生质体系统中基因瞬时表达及光/叶绿体相关过程的研究。工厂方法。2011;7(1):30。
- 86.
《分子克隆:实验室手册》,冷泉港出版社,纽约。在.: ISBN 0-87969-577-3;2001.
致谢
在此,我们要感谢郑华坤博士(福建农林大学)的技术支持m . oryzae感染测定。我们感谢审稿人和编辑的仔细阅读和耐心工作。
伦理认可和参与的同意
不适用。
资金
本课题由福建省自然科学基金(2018 J01694至X.Z.;国家自然科学基金项目(NSFC 31701862 - X.Z)、中国科学院植物分子遗传学国家重点实验室(上海)科研合作基金项目(xjq201717 - X.Z)。资助方在研究的设计、数据收集和分析、决定发表或手稿的准备方面没有作用。
数据和材料的可用性
本研究过程中产生或分析的所有数据均包含在本发表的文章及其补充信息文件中。
作者信息
从属关系
贡献
XZ, MJ和Habiba共同完成了所有的实验,分析了数据,修改了手稿。YZ和LL参与了样品采集和RNA提取等实验。从实验开始到手稿的撰写,YM负责整个项目的设计和监督。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
表S1。采用半定量rt - pcr进行表达分析OsS40基因。表S2。用于QRT-PCR的引物用于表达分析OsS40基因。表S3。用于全系统亚细胞定位测定的引物。(邮政编码244 KB)
额外的文件2:
表S1。启动子的顺便要求S40大米的基因,HvS40和ATS40-3。上游840 BP的推动者区域HvS40和1000 bp上游ATS40-3和米饭S40基因分析使用PLACE程序。W-box: WRKY转录因子的结合位点;ERE:诱导子响应元件;MYB:成髓细胞瘤;LREs:光调节元件;MYC: Myelocytomatosis;ABRE:脱落酸响应元件;Dof:单指dna结合;PRE:病原体反应要素;SURE:硫响应元素; DRE/CRT: Dehydration response elements/C-repeat; LTR: Low temperature response; ARF: Auxin response factor; DPBFCOREDCDC3: BZIP TFs binding core sequence; G-box plus G: TF OsIRO2-binding core sequence.表S2。水稻S40蛋白的特征。水稻S40蛋白质的特征,包括理论等离子点(PI),分子量(MW),氨基酸数,不稳定性指数,脂族指数和肉汁(水疗法的宏观)(http://web.expasy.org/protparam/).图S1。Exon-intron结构S40水稻基因组中的基因。黄色为CDS(外显子),蓝色为UTR(非翻译区),法线为内含子。图S2。的分布OsS40水稻染色体上的基因。利用染色体图谱工具对染色体上的基因进行定位。图S3。四种氨基酸的序列拟南芥,将I组的2个大米和1个大麦蛋白与大麦HvS40蛋白序列进行比较。黑色为保守的DUF584结构域序列,灰色为100%相同的残基。图S4。HvS40、AtS40-3和OsS40蛋白中的保守基序。一个利用MEME搜索工具确定蛋白质的Motif结构。灰线表示非保守序列。每个图案都由底部编号的彩色盒子表示。b通过MEME程序获得的Moti logo。每一堆的总高度代表了每个位置的保守程度,而每一堆字母的高度代表了氨基酸的相对频率。编号为1-10的主题被陈列在不同颜色的盒子里。图S5。半定量rt - pcr表达分析OsS40标记为90DAG、97DAG、104DAG、111DAG)和118DAG。DAG(发芽后天数)。图S6。半定量rt - pcr表达分析OsS40不同氮浓度的基因。标记为*的基因表明通过定量实时PCR进一步分析的差异表达基因。图S7。半定量rt - pcr表达分析OsS40黑暗诱导叶片衰老期间的基因。将叶片从4周龄幼苗中孵育在去离子水中,在黑暗中孵育2天(d)。作为对照,在光/暗状态(L)中同时与水一起温育脱离的叶子。标记为*的基因表示通过实时PCR进一步分析的四种差异表达基因。图S8。用不同浓度(50uM、100uM、200uM)的ABA、SA、MeJa和IAA处理4周龄水稻离体叶片。以水处理作为对照。结果表明,200 μM浓度处理48 h后叶片开始变黄。图S9。半定量rt - pcr表达分析OsS40ABA、SA、MeJA或IAA处理的响应基因。以水处理作为对照。其中8个基因在不同的治疗时间表达改变。标记为*的基因为8个差异表达基因,通过实时荧光定量PCR进一步分析。图S10。半定量rt - pcr表达分析OsS40基因对m . oryzae感染。作为对照,在水稻幼苗上喷洒0.02% (w/v仅吐温20解决方案(模拟)。接种后,将叶子收集在24hPI,48 HPI,72 HPI,96 HPI和108HPI中进行RNA提取。标记为*的基因表示通过定量实时PCR进一步分析的十种差异表达基因。HPI,小时后的小时。图S11。在水稻原生质体中瞬时表达的gfp标记的c端OsS40成员的免疫印迹分析。用箭头标出相应的gfp标记的OsS40蛋白的预期分子大小。用肌动蛋白和Ponceau S染色检测负载水平。(邮政编码14091 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
郑旭,杰哈泽布,哈比巴et al。水稻s40样蛋白的特性及其在响应环境信号和叶片衰老中的作用BMC植物BIOL.19,174(2019)。https://doi.org/10.1186/s12870-019-1767-1
收到了:
接受:
发表:
关键字
- S40蛋白家族
- 叶片衰老
- 大米
- 表达分析
- 环境线索