摘要
背景
研究表明了BBX.B-BOX基因在调控植物生长发育和胁迫反应的调控网络中发挥着重要作用。然而,全面的研究BBX.兰花的基因(兰科西)没有很好地研究。新释放的基因组序列Dendrobium Officinale.和蝴蝶兰属equestris是否允许对这些重要因素进行系统分析BBX.兰花的基因。
结果
在这里,我们确定了19(DoBBX01-19.)及16 (PEBBX01-16)BBX.基因D. Officinale.和p . equestris,并根据系统发育分析聚为5个分支(I-V)。13同源,两DoBBXsparalogous和两个PeBBXs对同源基因对进行了验证。该基因家族主要经历了纯化选择,但有五个区域在进化过程中经历了正向选择。值得注意的是,根、根尖、茎、叶、萼片、柱、唇和花蕾的表达模式表明它们可能参与了这些组织的形成。根据顺式调控元件分析BBX.基因,qRT-PCR实验D. Officinale.plb(原球茎状体),并显示这些BBX.基因在Agno下差异调节3.,Meja(茉莉甲酸甲酯),ABA(脱离酸)和SA(水杨酸)处理。
结论
我们的分析表明Dobbx.基因在植物的生长发育以及对不同环境胁迫条件的响应中发挥着重要的作用D. Officinale.,这提供了有助于选择适当的候选基因以进行进一步的功能表征BBX.植物中的基因。
背景
锌 - 手指蛋白在植物生长发育的调节中起重要作用,生物和非生物胁迫[1那2].其中,B盒锌指蛋白质亚家族含有一种或多种B盒结构域,其由保守的半胱氨酸(C)和组氨酸(H)组成,并通过与Zn-离子结合来稳定其独特的三级结构[3.那4.].B盒结构域可能涉及锌手指蛋白和其他蛋白质之间的相互作用[3.那5.].在真核生物中发现了1500多种含有B-BOX结构域的蛋白质。在动物细胞中,大多数B-BOX结构域与RING finger结构域和coil -coil结构域结合形成三价结构蛋白或RBCC。在RBCC复合物介导的蛋白泛素化降解途径中,B-BOX结构域可能参与底物识别过程[6.].B盒域可以分为两种类型,即[C3(C / H)H2](Box1(c-x2-x-x6-7-c-x2-x4-8-c-x2-3-c/ h-x3-4-h-x 5-10-h和[chc(d / c)c2h2](b-box2(c-x2-4-h-x7-10-c-x1-4-d / c4-7.-C-X.2-C-X.3.-6.-H-X.2-5.-H). Both of these two domains contain 7 or 8 conserved cysteines (C) and histidine (H) residues and together with two Zn-atoms to form a RING-like fold [7.那8.].
在拟南芥蒂利亚纳,khanna等。(2009)鉴定了32种含有N-末端B盒结构域的蛋白质,名为BBX1-32 [4.].与动物相比,B盒蛋白A. Thaliana.具有至少一个B-BOX结构域,通过天冬氨酸(Asp)残基与锌原子相互作用[7.那9.].虽然B盒结构域被认为参与蛋白质相互作用,但植物中B盒蛋白的功能尚不清楚。B盒蛋白STH3(耐盐性同源物03)和BBX22A. Thaliana.可以与光信号通路,HY5和COPI的两个关键调节器进行交互,以调节植物轻依赖性发育过程[7.那9.那10.那11.].此外,STH3,BBX22可以通过体外普遍的泛素化降解[7.那9.].编码双B盒域蛋白的八个基因A. Thaliana.进行了研究。证明了五的表达式BBX.基因是由昼夜节律控制的[4.].过度表达OsBBX25基因A. Thaliana.可以增强盐和耐旱性A. Thaliana.在转基因植物中的植物和KIN1,RD29A和COR15的表达在盐胁迫下上调。OsBBX25可能调节应激响应相关基因的表达作为转录调控的辅因子,然后参与植物对非生物胁迫的反应[12.那13.].
兰花占据了开花植物的10%,几乎是世界各地的[14.].D. Officinale.和p . equestris属附生兰花,其中D. Officinale.也是一个有价值的中草药植物。在几种植物中已经确定了B盒基因家族,例如Pyrus bretschneideri那o.苜蓿, 和A. Thaliana.[4.那12.那15.].此外,许多研究证实,B盒基因在植物生长和发育中发挥关键作用,以及对非生物和生物应激的反应。草稿D. Officinale.和p . equestris最近报道了基因组序列[16.那17.那18.].为了进一步了解兰花B-BOX基因家族,我们分别鉴定了所有19和16个基因家族BBX.成员Dendrobium Officinale.和蝴蝶兰属equestris分析了它们的系统发育关系、基因结构、顺式调控元件、组织表达模式以及AgNO下的表达谱3.,Meja(茉莉甲酸甲酯),ABA(脱离酸)和SA(水杨酸)处理。我们的研究将促进对特定基因的进一步功能研究BBX.家庭。
结果
这BBX.基因家族成员D. Officinale.和p . equestris
共鉴定了总共24和22个B盒(BBX)编码蛋白序列D. Officinale.和p . equestris分别使用BLASTP程序和HMMER软件。然而,一些未包含B盒域的序列(图。1),五个和六个序列D. Officinale.和p . equestris分别在本研究中排除。根据他们的脚手架位置,这些基因被命名DoBBX01-DoBBX19和PEBBX01-PeBBX16,分别。每个BBX的详细信息(基因名称、基因标识符、支架位置、分子量、理论等电点)见表1.如表所示1,BBX.基因在理论等电点和分子量方面存在较大差异。在D. Officinale.分子量为14648.51 Da (DoBBX14) ~ 61,659.92 Da (DoBBX05),平均分子量为34200.53 Da,理论等电点为4.74 (DoBBX15) ~ 8.4 (DoBBX02)。在p . equestris分子量最小的为7492.76 Da (PeBBX14),最大的为49942.19 Da (PeBBX06)。这些蛋白的理论等电点范围为4.35 (PeBBX11) ~ 8.61 (PeBBX05),平均为6.24。
蛋白质结构域和系统发育分析
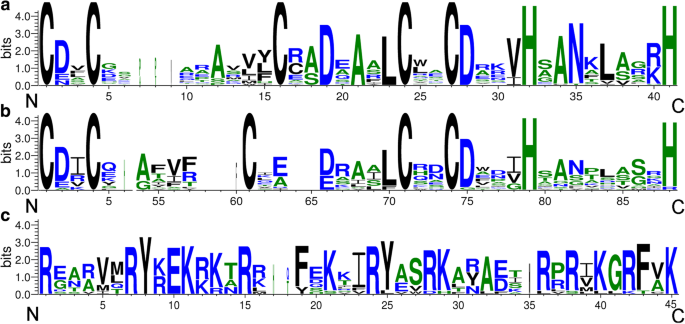
CCT域和B字幕域(包括B-Box1和B-Box2域)的域标志BBX.产生蛋白质并在图1中示出。1和图。2.在35个BBXs中,我们扫描到6个基因有两个保守的B-BOX结构域和一个CCT结构域。6个和6个蛋白分别只包含一个B-BOX结构域,或一个B-BOX +一个CCT结构域,而大多数BBX蛋白都有两个B-BOX结构域。在这三个结构域中,我们发现一些保守氨基酸残基相似,但并不完全相同。在B-BOX结构域中,Cys- x - x -Cys基序中有5个保守的Cys残基,其中4个是绝对保守的。此外,还有一些其他的保守氨基酸残基,如两个His, Asp, Ala和Asn,如图所示。1.在CCT结构域中,共有序列是R-XXXXX-R-y-X-E-K-XXX-R-XXX-K-XX-R-y-XX-R-K-XX-A-XX-R-X-r-X-k-r-r-F-X-k。
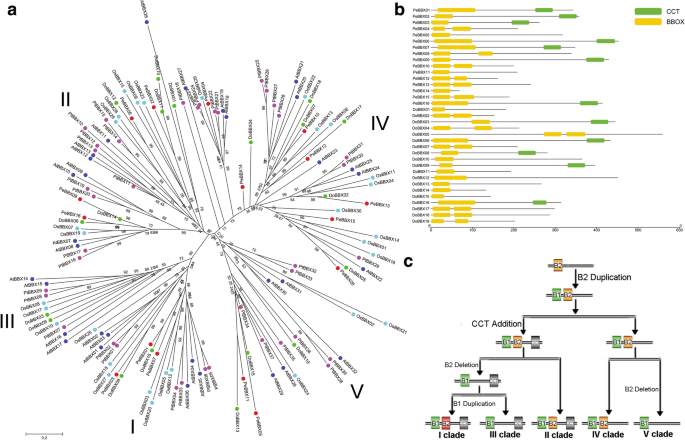
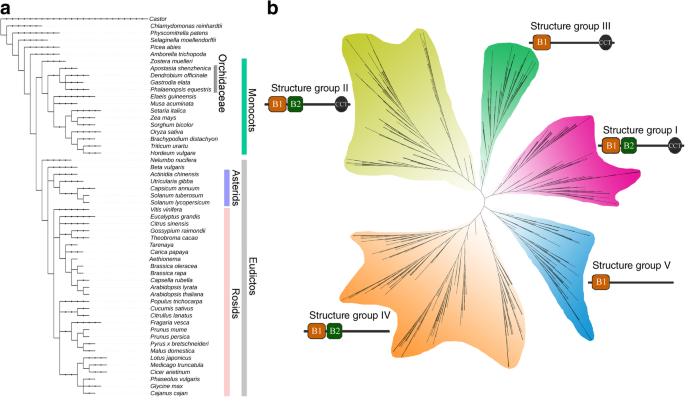
分析进化关系和分歧BBX.基因,系统发育树,包括BBX.基因Populus Trichocarpa,A. Thaliana那o.苜蓿那D. Officinale.和p . equestris,生成(图。2a).所有序列可聚为5个演化支,在系统发育树中按照前面的文章命名为演化支I-V [4.那15.].这BBX.疏水板I,Clade II和CLADE III中的基因包含额外的CCT结构域,其中CLADE III中的一个B盒结构域,以及在I和II中的两个B盒域。剩余的CLADE IV和CLADE V分别包含两个和一个B盒域,但不具有CCT结构域。进以进一步确定植物基因组中的B盒结构域的进化关系(图。3.),分析了54种植物基因组,覆盖了高血管,裸子植物,苔藓和绿藻,通过使用FastTree软件来产生最大可能性(ML)树[19.].基于系统发育分析(图。3.b),本研究提出了一种假设B盒结构域的进化关系(图。2c).植物基因组早期的BBX序列最初只包含一个B-BOX结构域,随后在进化过程中B-BOX结构域发生了重复事件,这与绿藻(即绿藻)的大部分结构域发生重复事件是一致的。衣藻reinhardtii)只有一个B盒域。值得注意的是,来自藻类的CRBBX1包含双B盒域表示,在绿色植物殖民地殖民地之前,第一个B盒复制事件发生了[20.].BBX月初变数寄存器域的删除事件序列属于进化枝第四上升到BBX序列用单一变数寄存器域,这是一个进化枝诉的特征后,添加了有条件现金转移支付领域在糖基生成BBX蛋白质双变数寄存器和有条件现金援助领域,这是早期BBX成员和属于进化枝。进化枝II中,一些BBX成员变数寄存器2域的删除事件导致BBX蛋白质只包含一个变数寄存器和有条件现金援助领域(即进化枝III)。重复事件早期BBX变数寄存器1域的蛋白质属于进化枝II可能是BBX前体分化枝的我,生成两个B-BOX域和一个CCT域的BBX序列。这些域序列的相似性和差异性支持了这一假设。2C和图3.b)。例如,与CLADE II和IV的序列相比,CLADE中的B盒2结构域具有很大的差异。CCT和B盒结构域的这些变化导致不同的片状的起源,其出现在植物基因组进化的早期阶段,并保留了B盒结构域的生物学功能。
进化模式和基因结构分析
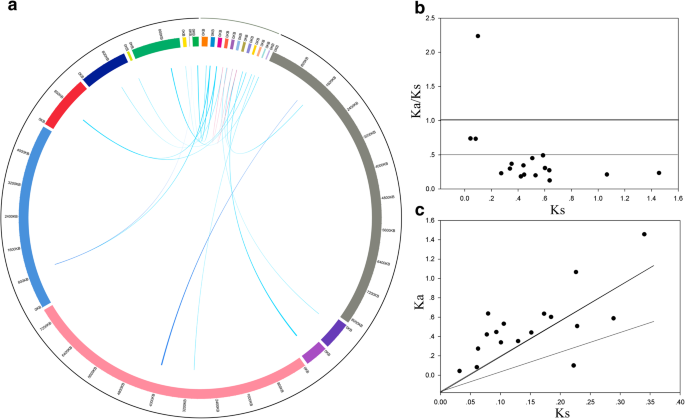
进一步了解进化模式BBX.基因,我们进行了对原始和逐渐的关系的分析D. Officinale.和p . equestris基因组。在目前的研究中,两个谬误(Do-Do)D. Officinale.,两个副病虫戈(PE-PE)p . equestris,和13个直系(Do-Pe)之间D. Officinale.和p . equestris通过使用orthomcl软件来识别(图。4.一种)。以前的研究表明,兰花共享一个基因组 - 范围的重复事件(Ks的值大约等于一个)[14.].随后,计算所有同源基因对的Ka、Ks和Ka/Ks(附加文件)1:表S1)。的k值PEBBX01-Pebbx07.和DoBBX07-DoBBX18分别为1.0658和1.4562,表明这些基因对来源于全基因组重复事件D. Officinale.和p . equestris.其他帕拉戈尔科克的KS值,包括Pebbx08-PeBBX14和DoBBX10-DoBBX11,分别为0.0433和0.0827,表明它们来源于古重复事件。根据Ka/Ks值分布(图。4.B和C)同源可以分为三类。九个同源基因对具有低于0.3的Ka / ks值,七个同源基因对具有0.3-1之间的Ka / ks值,剩余的一种基因对(DoBBX05-Pebbx08)的比值大于1。这些数据表明,大多数BBX.同源基因对在进化过程中经历了强烈的净化选择。为了进一步了解每个基因对的KA / KS值,我们在所有同源对中进行了滑动窗口分析(附加文件1:图S1)。基于该分析,大多数编码区具有Ka / ks值远远低于1,但是一个或多个不同的峰(即Ka / ks值大于1)。大多数BBX的域通常包含低于较低的Ka / ks值(即峰),这与在这些结构域中的功能约束一致。结合上述分析,这BBX.基因家族主要在进化期间接受净化选择D. Officinale.和p . equestris基因组。
多岛家族的演变可以由结构多样性驱动[21.].在本研究中,我们构建了外显子内组织地图,以调查结构多样性BBX.基因(额外的文件1:图S2和图S3)。35个成员BBX.基因家族含有可变的外显子,从1到7。此外,我们发现了两个BBX.基因含有七个外显子,两个基因含有五个外显子,六个基因含有四个外显子,七个基因含有三个外显子和十个基因含有两个外显子,而剩余的8个基因仅含有一个外显子。这种现象表明了BBX.基因家族在进化过程中经历了外显子的获得和丢失,这可能可以进一步解释密切相关的基因家族的功能差异BBX.同源基因。随后研究了外显子-内含子的结构BBX.进一步分析同源基因对。在17对基因中,15对基因的外显子数量发生了变化(附加文件)1:图S3),例如DoBBX02-PeBBX13那DoBBX10-DoBBX11和Pebbx08-PeBBX14.这些分歧可能是在进化期间单一内含子损耗或获得事件的结果。
Cis-acting元素分析
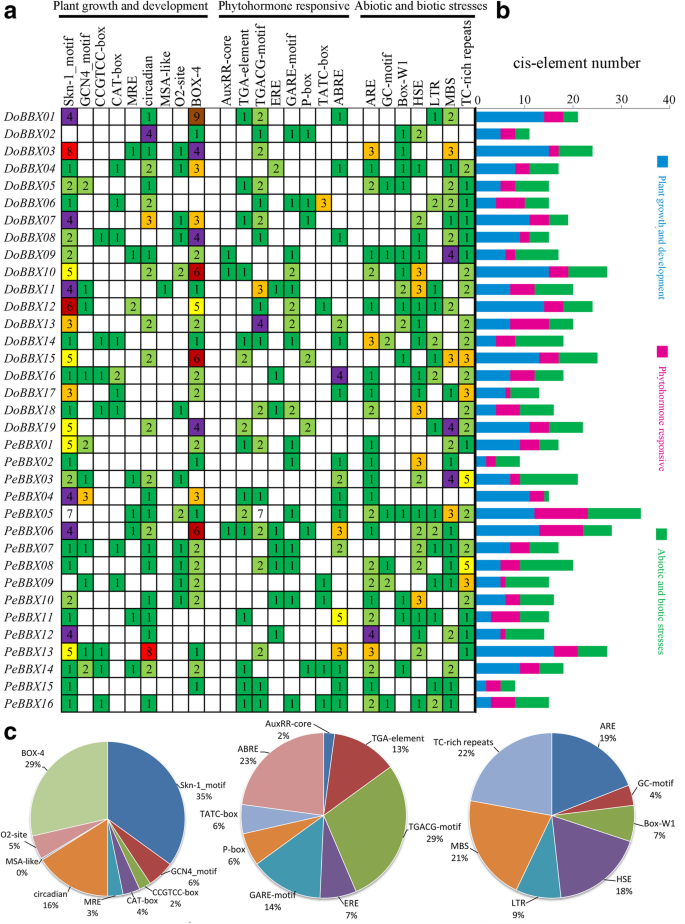
CIS-MOVICATION ELEAGE在控制植物生长和发育的监管网络中起重要作用,包括多刺激响应基因,并确定基因的组织特异性或应激响应表达表达谱与其启动子区域中的顺式元素密切相关。使用PlantCare数据库,我们确定了三个CIS元素,包括植物生长和发育,生物和非生物应激反应和启动子区域中的植物激素反应(图。5.)。在生长和开发类别中,CIS作用元件在启动子区域中广泛发现,包括SKN-1-MOTIF和GCN4_MOTIF,用于Endosperm表达,猫盒和CCGTCC盒,用于分类表达,Zein代谢调节的O2位点,MRE和BOX 4为轻响应性,以及其他独联体作用元素。在这些顺式作用元件中,鉴定了98个SKN-1-MOTIF,并且这些基序包括第一类的最大部分(图。5.)。在植物激素响应类别中,在十八次中鉴定了胃肠杆菌响应性元件的TGA元素和用于肺炎响应,Gare-MOTIF,P盒和TATC盒的TGA元素和Auxrrr核心BBX.基因最多。值得注意的是,最常见的主题是与MEJA响应性相关的TGACG-MOTIF CIS作用元件,占扫描激素响应基序的29%(图。5.)。其次是与ABA有关的ABRE CIS作用元素;它占23%并出现了32次。在最后一个类别中,各种相关的有关的元素,例如(厌氧诱导),Box-W1(真菌诱导),HSE(热应激),富含富含TC的重复(应力响应)和GC-MOTIF(缺氧)观测到的。我们的数据建议BBX.基因可能会对非生物胁迫作出反应,并且有可能改善非生物应激反应。
特定的器官特定表达谱分析D. Officinale BBX.基因
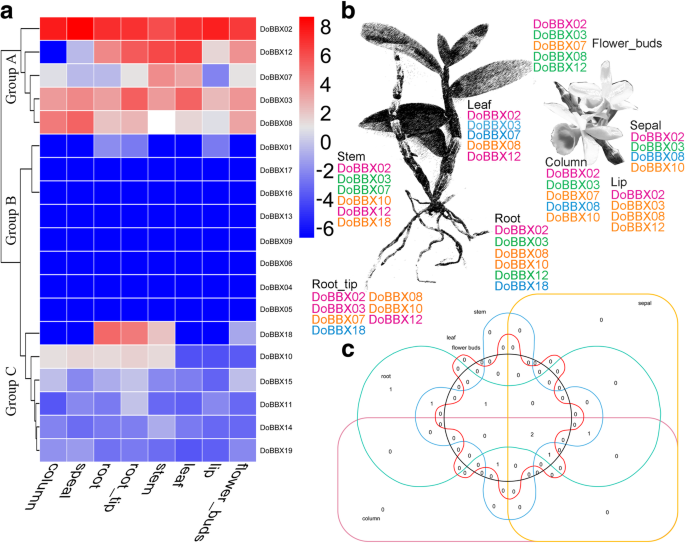
为进一步了解其动态基因表达BBX.基因家族成员D. Officinale.对8个组织(根、根尖、茎、叶、萼片、柱、唇和花蕾)的基因表达谱进行了全面分析。根据八种组织的表达模式,这些Dobbx.基因表现出明显的器官特异性表达,并进一步分为三组(图。6.a).在a组中,有五个基因(DoBBX02那−03那−07那−08年和−12)在所有八个器官中呈现适度的整体表达,这表明这些Dobbx.基因可能在这些组织的形成中起重要作用。在19个基因中,八bbx在这8个组织中基本不表达,属于B组。在C组中,其余6个基因在这些组织中有类似的低表达。值得注意的是,并不是所有的同源基因对都表现出类似的表达模式,例如DoBBX07在茎和/或叶中具有最高的转录性丰度,但其副病虫病的表达,DoBBX18,在叶片中最低,root和/或root_tips中最高。另外,还被识别出在花器官中高度表达的几种基因,包括DoBBX02那DoBBX07那DoBBX08和DoBBX12(图。6.B和C).这些最高的表达谱DoBBXs建议这些基因可能间接或直接参与生殖器官的发展和/或形成。这些结果也得到了证实AtBBXs(即拟南芥BBX.基因)。
表达式模式Dobbx.基因。一种器官特异性表达式模式Dobbx.八个组织中的基因:根,root_tips,茎,叶,液体,柱,唇和花_buds。蓝色和红色分别表现出较低和更高的成绩丰富。B.鉴定高度表达BBX.基因在D. Officinale..根据之前的研究[22.[黄色,绿色,蓝色,红色表示低(1-6.8 FPKM),中低(6.8-17.5 FPKM),中高(17.5-44.7 FPKM),分别为高(44.7-17,092件FPKM)表达式。C维恩图Dobbx.不同组织中的基因
表达的调节D. Officinale BBX.非生物胁迫的基因
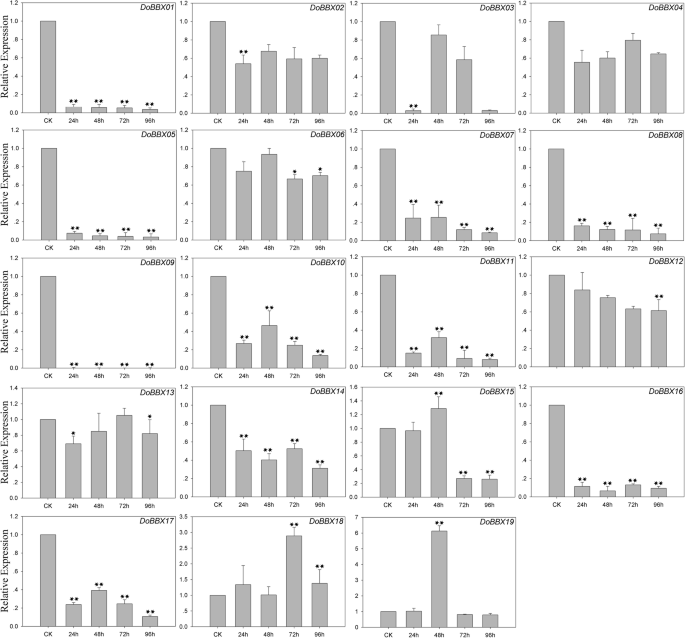
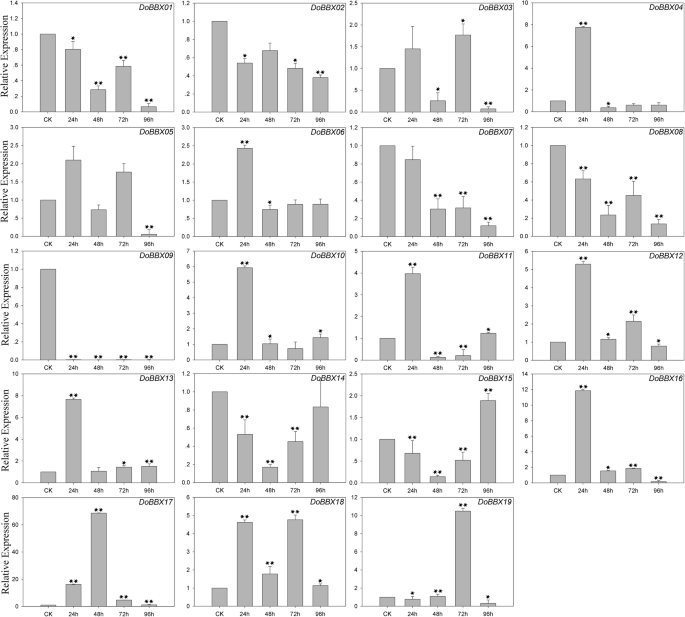
各种非生物和生物应力可能影响植物的健康和生长,最后影响一系列压力相关基因的调节[23.].因此,明确应激反应的调控途径,掌握应激反应的调控机制十分重要D. Officinale..更好地了解涉及的压力反应D. Officinale BBX.基因,QRT-PCR实验用于分析其在AgNO3,Meja(甲基己酸酯),ABA(脱离酸)和SA(水杨酸)处理下的表达。
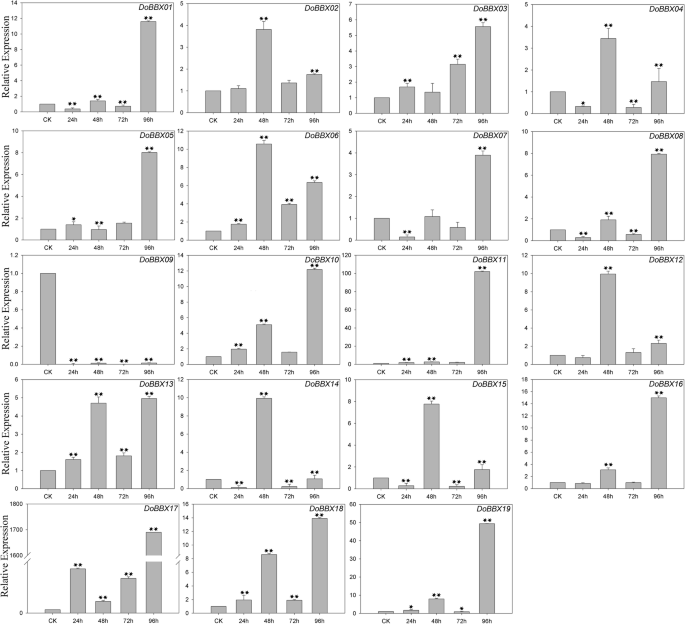
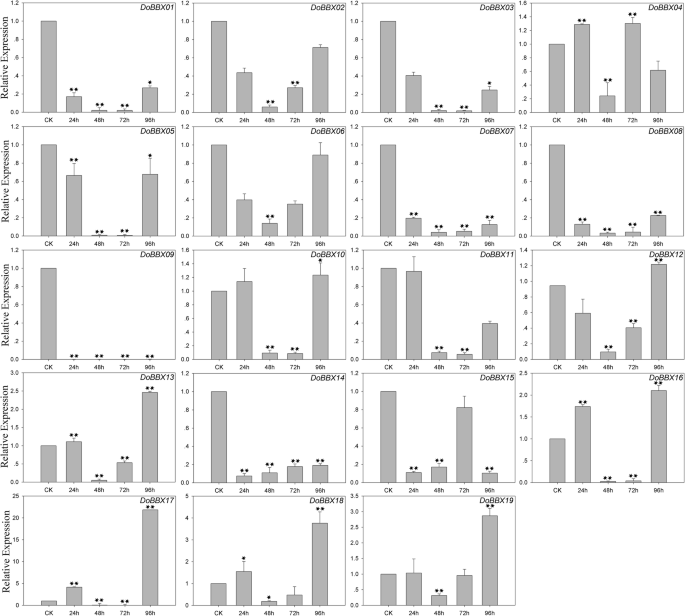
在ABA治疗中,八Dobbx.通过ABA治疗对基因上调至不同程度(图。7.)。例外是DoBBX09,这显然在所有时间点都显着迅速下调。在这些当中DoBBXs,我们发现最高表达水平DoBBX01那DoBBX03那DoBBX05那DoBBX07那DoBBX08那DoBBX10那DoBBX11那DoBBX13那DoBBX16那DoBBX17那DoBBX18和DoBBX19治疗后96小时发生:DoBBX17和DoBBX11大幅上调(分别上调1700倍和100倍以上)。七的表达Dobbx.基因(DoBBX02那DoBBX04那DoBBX06那DoBBX12那DoBBX14和DoBBX15)在48 h达到峰值;DoBBX06和DoBBX14以10倍折叠显示最大的上调。另外,我们发现寄生基因对含有类似的表达模式。例如,两者都是DoBBX07-DoBBX18和DoBBX10-DoBBX11在48小时后呈现了相同的趋势,在ABA治疗下97小时的最高水平。在SA治疗中,11Dobbx.基因向不同程度提高了表达水平的增加(图。8.)。十九中的四个Dobbx.基因在最后一次点(96小时)处显着上调,例如DoBBX17上调了20多倍。在AgNO3.治疗,15Dobbx.在所有时间点显然明显迅速,基因显着下调。剩下的四个Dobbx.基因在Agno下的48小时内具有最高的表达水平3.治疗(图。9.)。在Meja治疗中,表达水平DoBBX04那DoBBX06那DoBBX10那DoBBX11那DoBBX12那DoBBX13那DoBBX15和DoBBX17在24小时强烈上调,如DoBBX16被上调了10倍以上。这DoBBX03和DoBBX19在72小时(分别超过1.5倍和10倍)上调,而且DoBBX17在MeJA处理48 h显著上调(超过65倍)(图2)。10.)。其余Dobbx.基因在整个实验期内下调,包括DoBBX01那DoBBX02那DoBBX07那DoBBX08那DoBBX09, 和DoBBX14.
讨论
大多数转录因子是植物特异性,对植物生长和发展发挥重要作用[4.那12.那15.].作为一类转录因素,成员BBX.家族编码蛋白具有B-BOX结构域,其中一些蛋白还含有额外的CTT结构域。在本研究中,我们鉴定了19个和16个B-BOX基因D. Officinale.和p . equestris,比其他植物低得多,即64Malus Domestica.[24.),为25Pyrus bretschneideri[15.],29岁Solanum lycopersicum.[25.), 32A. Thaliana.[4.), 30o.苜蓿[12.].产生这种差异的原因可能是这些基因组中副同源基因的可变状态。例如,只有两个DoBBXsparalogous和两个PeBBXs在本研究中鉴定了旁骨基因对,但是18次osbbx.副寄生和12.SLBBX.发现了来自节段重复事件的副同源基因对o.苜蓿和美国lycopersicum, 分别 [12.那25.].根据系统发育分析,所有BBX.基因A. Thaliana.那杨树trichocarpa那o.苜蓿那D. Officinale.和p . equestris被聚集成五个片状,这与ml树一致BBX.来自54种植物基因组和之前公开的文章的基因(图。3.b)[4.].这BBX.基因成员D. Officinale.和p . equestris在CLADE I,II和IV有两个B盒域。与具有两种不同类型的B盒的动物BBX相反,DOBBX和PEBBX两种B盒子结构域的保守氨基酸序列相似,但它们不相同。如图1所示。2A,这BBX.基因D. Officinale.那p . equestris和o.苜蓿比D. Officinale.和P. Trichocarpa..其中,我们发现来自CLADE I,II和III的基因有两个B盒结构域加上CCT结构域,表明它们可能有助于控制开花的光/周期调节[2那26.].在CLADE VI和CLADE V Subfamily中,成员只有一个或两个B盒域,但缺少CCT域。以前的出版物文章建议C-X中的B盒域序列2-C-X.8.-C-X.7.-C-X.2-C-X.4.-H-X.8.-H在N-末端区域中,保守的C(半胱氨酸)和H(组氨酸)残留物参与BBX蛋白质[4.].在本研究中,我们发现来自Clades I,II和IV的BBX成员也包含保守的C(半胱氨酸)和H(组氨酸)残留物。可能的进化BBX.基因D. Officinale.和p . equestris也发生在其他植物中[20.],这是由撰写的结构分析支持BBX.我们研究中的基因。
基因复制,包括全基因组复制、串联复制、转位事件和节段复制,促进了基因组的扩展[27.].来自副基因的基因D. Officinale.和p . equestris不能清楚地分布在染色体上,因为染色体组装D. Officinale.和p . equestris基因组尚未完成[17.那18.].因此,我们无法验证当前研究中推定的重复事件类型。进一步了解两者中的演化模式D. Officinale.和p . equestris,计算Ka和Ks的值。特别地,我们计算了并行基因(Do-Do和Pe-Pe)和同源基因(Do-Pe)的Ka和Ks的频率分布,并估算了所有同源基因对的Ks值。我们预测两对同源基因(PEBBX01-Pebbx07.和DoBBX07-DoBBX18)是由全基因组复制事件共同进化而来的D. Officinale.和p . equestris[14.],因为它们的Ks值分别为1.0658和1.4562。通常,Ka / ks比大于1表示随加速的进化的阳性选择,ka / ks比等于1表示中性选择,而小于1表示稳定或阴性选择。显着的是,除了以外,所有同源基因对的Ka / ks比例小于1,DoBBX05-Pebbx08,暗示这些基因对在进化期间经历了明显净化的选择。我们还注意到了两个同源基因对(Pebbx08-PeBBX14和DoBBX10-DoBBX11)含有相对高的Ka / Ks值(> 0.5),表明这些基因对在进化过程中经过重复事件后经历了快速进化的多样化。
对不同组织中微阵列表达谱的整体分析将有助于研究组织特异性和动态表达BBX.基因在D. Officinale..因此,所有19的基因表达谱BBX.基因展出D. Officinale.通过使用已发布的RNA-SEQ数据。其中,几个BBX.基因(如DoBBX02那DoBBX03和DoBBX08)在八个组织中呈现出高度表达水平,表明这些基因在过程中的重要性D. Officinale.增长与发展。以前的研究表明BBX.基因在开花的调节中发挥关键作用[2那26.那28.那29.], 如A. Thaliana BBX1那O. Sativa BBX1.和β寻常的COL1.在我们的研究中,发现了一些与开花相关的顺式作用元素Dobbx.启动子区域,如胚乳表达所需的skn -1基序和gcn4_基序,以及昼夜节律控制元件所需的昼夜节律。相应的Dobbx.基因(如DoBBX03和DoBBX12)在花器官中也有高表达,表明这些基因可能在生殖器官的形成中起重要作用。
在植物中,许多与应激相关的基因可以产生应激反应,这些应激反应是由各种信号通路调控和/或介导的[30.].数字的数量BBX.已经验证了基因家族以发挥非生物应激反应的阳性作用,并受环境信号调节[12.那24.].在我们的研究中,在两者的启动子区域中鉴定了各种经常发生的顺式作用元素DoBBXs和PeBBXs,例如MB,是,LTR,HSF,IRE和ABRE。我们还指出了这些BBX.基因中至少含有一种非生物胁迫顺式元件,表明它们可能参与了生物和非生物胁迫的响应。为了深入了解中西医结合的应激反应机制D. Officinale BBX.基因,我们在不同治疗中进行了QRT-PCR,例如Agno3.PLBS中的Meja(茉莉甲酸),ABA(脱落酸)和SA(水杨酸)(水杨酸)。然后,我们观察到了Dobbx.基因在这些处理下表现出显着的差异表达模式。一些Dobbx.基因受这些治疗强烈调节,表明这些基因可能在反应中的反应中发挥关键作用d . officinale。例如,DoBBX17在ABA和ABA的高度表达(超过1700倍的CK水平)DoBBX19在Agno下高度表达3.和meja治疗。在这些当中Dobbx.基因中,部分成员具有CCT结构域,其余成员缺乏CCT结构域。在目前的研究中,我们发现Dobbx.无论它们是否包含CCT结构域,基因反应非生物应激。这些结果表明,具有B盒或CCT结构域的基因编码蛋白可以响应应力而起作用。在我们的研究中,我们发现了Dobbx.基因对不同的非生物胁迫敏感,例如Agno3.,meja,aba和sa强调。这些结果提供了植物BBX成员可以参与反应非生物应激反应的证据。
结论
在我们的研究中,综合分析BBX.基因是在D. Officinale.和p . equestris,其中包括系统发育,外显子结构,顺式作用元件,微阵列分析和QRT-PCR分析19Dobbx.四种胁迫处理下的基因:AgNO3.、MeJA(茉莉酸甲酯)、ABA(脱落酸)和SA(水杨酸)。我们的实验结果强调了生长发育阶段的作用,以及对非生物胁迫的反应。
方法
鉴定BBX.基因在D. Officinale.和p . equestris基因组
在我们的研究中,两种不同的策略用于注释并识别编码BBX的基因D. Officinale.和p . equestris基因组。在第一个策略中,我们首先从TAIR数据库下载已知的BBX序列。随后,我们使用这些序列来搜索潜在的BBXD. Officinale.和p . equestris基因组数据库由BLASTP程序与E处的E值截止设置在1E-5。在第二次策略中,我们首先从PFAM数据库下载BBX域(PFAM00643)的HMM(隐马尔可夫模型)配置文件[31.].然后这个HMM配置文件被用来识别所有的BBXsD. Officinale.和p . equestris利用HMMER 3.0软件进行基因组测序,E值截断值为1e-3。最后,将所有推测的BBX基因提交InterProScan进一步验证B-BOX结构域的存在[32.],[包含了33.]及SMART数据库[34.], 分别。扩展的在线工具用于估计所有的分子量和等电点(PI)BBX.基因(35.].
系统发育分析和序列表征
我们的系统发育分析中共有54种植物基因组,包括绿藻(衣藻reinhardtii),苔藓(Physcomitrella patens.)、梅花(Selaginella Moellendorffii.),裸子植物的单一基因组(Picea amies),早期分歧的Angiosperm(Amborella trichopoda.),13单古典,Beta寻常魅力(非ROSID非Asterid)和30个ROSID(附加文件1:表S3和图3。3.a).所有BBX蛋白用MUSCLE进行多序列比对(https://www.ebi.ac.uk/tools/msa/muscle/),使用默认参数。随后MEGA 5.2软件通过bootstrap分析(1000次)生成Neighbor Joining (NJ)树[36.].最大似然树由FastTree软件使用JTT模型生成[19.那37.].个人的GFF3文件BBX.基因是从先前公布的制品中获得的,然后用GSDS网站产生它们的基因结构(http://gsds.cbi.pku.edu.cn/)[38.].使用在线MEME程序生成BBX和CCT域的主题徽标(http://meme.nbcr.net/meme/cgi-bin/meme.cgi.)[39.].
直方图和谬误图的识别
使用OrthoMCL软件识别直方图和副直方图,E值截止值设为1e-5 [40].根据之前的论文[41.那42.],我们使用DNASP5.0软件来计算KS(同义替代率),KA(非同义替代率)和同源基因对的KA / KS。
CIS作用元素分析BBX.基因在D. Officinale.和p . equestris
为了确定顺式作用元件,我们首先利用TBtools软件获得启动子序列(即起始密码子(ATG)上游1500 bp基因组DNA序列)。然后将这些启动子序列提交到PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)确定不同顺式作用元素的存在[43.].
RNA-seq表达分析
深入了解Dobbx.不同组织中的基因表达模式D. Officinale.从NCBI的SRA数据库中下载了从八种不同组织(根,root_tips,茎,叶,液,柱,唇,唇,嘴唇)读取的原始RNA-SEQ读取。通过使用Hisat2软件,将成对的清洁读数映射到D. Officinale.具有默认参数的参考基因组[44.那45.].然后使用StringTie软件来估计不同表达的基因[44.].R脚本用于展示的热图Dobbx.8种不同组织(根,根尖,茎,叶,萼片,柱,唇和花蕾)的基因。
植物材料和应力处理
组织培养的幼苗D. Officinale.灭菌后,在安徽农业大学组织培养室的Murashige and Skoog (MS)培养基上(Murashige and Skoog),在25℃恒定光周期(16 h光照/8 h暗)条件下种植约1个月。然后转移到添加30 g L的MS培养基上- 1蔗糖(阿拉丁),0.1 mg l- 1naa(阿拉丁)和1.0 mg l- 16-BA (biosharp)。在1/2 MS(添加0.1 mg/L α-萘乙酸(NAA)、0.1 g/L水解乳白蛋白和30 g/L蔗糖(pH为5.8)的液体培养基上诱导原球茎样体(PLBs)。将PLBs切成0.5× 0.5 cm的菌种,在装有40 mL MS培养基的三角形烧瓶中接种7 g。在MS培养基中,通过0.22 μM微孔过滤,加入100 μM MeJA(茉莉酸甲酯:阿拉丁)、100 μM SA(水杨酸:阿拉丁)、100 μM ABA(脱落酸:阿拉丁)和100 μM AgNO3(阿拉丁)。46.].在治疗后,在24小时,48小时,72小时和96小时中取样PLBS。对于每种诱导处理,收集每个样品(PLBS)并立即储存在-80℃以进行RNA分离。另外,未处理的PLBS(24小时)用作对照组。
定量实时PCR分析
使用Plant Total RNA Isolation Kit (Sangon Biotech,中国)提取PLBs的总RNA,使用按照制造商的方案在液氮中均质的300mg组织,然后使用一步RT-qPCR Kit (BBI Life Science,中国)将其反转录到第一个DNA链中。根据制造商的介绍,采用2X TaqMan Fast qPCR Master Mix (BBI Life Science,中国)和CFX96 Touch™Real-Time PCR检测系统(Bio-Rad,美国)进行qRT-PCR。在25 μl的反应体系中,每个反应包含0.75 μl SYBR Abstart One Step RT-PCR Mix, 10 μl 2.5X SYBR One Step RT-PCR buffer, 2 μl cDNA样本,每个引物(10 μM) 1 μl。热循环为:98℃2 min, 98℃10 s, 60℃10 s, 68℃30 s共40个循环。tubliun基因被用作内部对照[47.]和基因特异性引物(附加文件1:每个表S2)Dobbx.使用信标设计器7软件设计基因。对每个实验进行三种生物重复。
数据和材料的可用性
表达数据D. Officinale.在本研究中使用的是在NCBI SRA数据库中提供,具有Prjna348403的登录号。
缩写
- 阿坝:
-
脱盐酸
- K a:
-
不幸的是
- ks:
-
同义的
- Meja:
-
茉莉酸甲酯
- NJ:
-
邻居加入
- PLBS:
-
Protocorm-like身体
- 存在:
-
实时聚合酶链反应
- SA:
-
水杨酸
参考
- 1。
Takatsuji H.植物中的锌指转录因子。细胞mol寿命。1998年; 54(6):582-96。
- 2。
PUTERILL J,ROBSON F,LEE K,SIMON R,偶曲面G.拟南芥的致突基因促进开花并编码蛋白质显示与锌指转录因子的相似性。细胞。1995年; 80(6):847。
- 3.
klug a,schwabe jw。蛋白质主题5.锌手指。FASEB J. 1995; 9(8):597-604。
- 4.
khanna r,wu sh。Arabidopsis B盒锌手指家庭。植物细胞。2009; 21(11):3416。
- 5。
两个B还是不是两个B?快速扩展的B-box蛋白家族综述;2001.
- 6。
Tao H,Simmons BN,Singireddy S,Jakkidi M,Short Km,Cox Tc,Massiah Ma。MID1串联B盒的结构揭示了激发分子间环异二聚体的相互作用。生物化学。2008; 47(8):2450-7。
- 7。
Datta S,Johansson H,Hettiarachchi C,Holm M.STH2有2个B有2 B:探讨B盒在拟南芥中含有蛋白质的作用。植物信号表现。2008; 3(8):547-8。
- 8。
马萨诸塞玛丽亚,亚马逊,短克,西蒙斯BN,Singireddy S,Yi Z,Cox Tc。MID1 B-BOX2 CHC(D / C)C2H2锌结合结构域的溶液结构:洞察进化保守的环折叠。J Mol Biol。2007; 369(1):1-10。
- 9.
Datta S,Johansson H,Hettiarachchi C,Irigoyen ML,Desai M,Rubio V,Holm M.LZF1 /盐耐受同源物,涉及光依赖性发育和基因表达的拟南芥B盒蛋白,经历COP1介导的泛素化。植物细胞。2008; 20(9):2324。
- 10。
张C-SJ,Maloof Jn,Wu S-H。COP1介导的BBX22 / LZF1的降解优化了拟南芥的幼苗发育。植物理性。2011; 156(1):228-39。
- 11.
Crocco CD, Locascio A, Escudero CM, Alabadí D, Blázquez MA, Botto JF。在拟南芥中,转录调节因子BBX24通过降低DELLA活性来促进遮荫。Nat Commun。2015;6:6202。
- 12.
水稻B-box锌指基因家族的鉴定、表达谱和日变化分析。《公共科学图书馆•综合》。2012;7 (10):e48242。
- 13。
刘y,xing l,李杰,戴S.米饭B盒锌指蛋白OSBBX25参与了非生物反应。Chin Bull Bot。2012; 47(4):366-78。
- 14。
张G-Q,刘k-W,李Z,罗哈斯R,HSIAO Y-Y,NIU S-C,王J-Y,林Y-C,XU Q,Chen L-J。血管基因组和兰花的演变。自然。2017; 549(7672):379。
- 15.
Cao Y,Han Y,Meng D,Li D,Jiao C,Jin Q,Lin Y,Cai Y. B盒基因:基因组鉴定,进化及其对花粉生长的梨(Pyrus Bretschneideri Rehd。)。BMC植物BIOL。2017; 17(1):156。
- 16。
张G-Q,徐Q,Bian C,Tsai W-C,Yeh C-M,Liu K-W,Yoshida K,Zhang L-S,Chang S-B,陈F. Dendrobium catenatum Lindl。基因组序列为多糖合成酶,花卉发育和自适应演化提供了见解。SCI REP。2016; 6:19029。
- 17。
闫朗,王X,刘虎,田义,莲俊,杨河,郝S,王X,杨氏,李问。石斛officinale的基因组照亮了重要的中式兰花草本植物的生物学。莫尔植物。2015; 8(6):922-34。
- 18。
蔡俊,刘旭,Vanneste K, prost S,蔡文昌,刘克文,陈立军,何颖,徐强,卞灿。蝴蝶兰属植物的基因组序列分析。Nat麝猫。2015;47(1):65。
- 19.
价格Mn,Dehal PS,Arkin AP。FastTree:使用配置文件而不是距离矩阵计算大的最小进化树。mol Biol Evol。2009; 26(7):1641-50。
- 20。
Crocco CD,Botto JF。BBX蛋白在绿色植物中:洞察他们的演化,结构,特征和功能多样化。基因。2013; 531(1):44-52。
- 21。
Cao Yp,Han Y,Jin Q,Lin Y,Cai Y.中国梨(Pyrus Bretschneideri Rehd),杨树(人口众多),葡萄(葡萄葡萄),拟南芥和水稻(Oryza sativa)的GRF基因对比基因组分析。前植物SCI。2016; 7:1750。
- 22。
Josephs EB,Josephs Eb,Platts Ae,Hazzouri公里,Haudry A,Blanchette M,Wright Si。Capsella Grandiflora编码和保守的非分量区域广泛阳性和阴性选择的证据。Plos Genet。2014; 10(9):E1004622。
- 23。
Grallath S,Weimar T,Meyer A,Gumy C,Suter-Grotemeyer M,Neuhaus J-M,Rentsch D. Atprot家族。具有相似的底物特异性的溶质转运蛋白,但差异表达模式。植物理性。2005; 137(1):117-26。
- 24。
刘X,李河,戴y,陈X,王X.苹果(Malus domestica borkh.)基因组(Malus domestica borkh。)的基因组鉴定及对表达分析[J]。Mol Gen Genomics。2018; 293(2):303-15。
- 25。
关键词:番茄,B-BOX,基因家族,系统发育,基因表达植物学报2016;7:1552。
- 26。
Cockram J,Thiel T,Steuernagel B,Stein N,Tudien S,Bailey PC,O'Sullivan DM。基因组动力学解释了在淘雾中开花时间CCT结构域基因家族的演变。Plos一个。2012; 7(9):E45307。
- 27。
Moore Rc,Purugganan MD。重复基因进化的早期阶段。Proc Natl Acad Sci U S A. 2003; 100(26):15682-7。
- 28。
Yano M,Katayose Y,Ashikari M,Yamanouchi U,Monna L,Fuse T,Baba T,Yamamoto K,Umehara Y,Nagamura Y.HD1是大米的主要光周期敏感性定量性状性状,与拟南芥开花时间密切相关基因致力。植物细胞。2000; 12(12):2473-83。
- 29。
Suárez-LópezP,Wheatley K,Robson F,Onouchi H,Valverde F,Conceand G.Consans在昼夜节奏和拟南芥中的开花控制之间调解。自然。2001; 410(6832):1116。
- 30.
Walther D,Brunnemann R,Selbig J.转录响应多样性的监管代码及其与A的基因组结构性质的关系。蒂利亚纳。Plos Genet。2007; 3(2):E11。
- 31。
Mistry J, Finn RD, Eddy SR, Bateman A, Punta M.同源性搜索的挑战:HMMER3和线圈-线圈区域的收敛进化。核酸学报2013;41(12):e121。
- 32。
ZDOBNOV EM,APWEILER R.Igner occan - Interpro中签名识别方法的集成平台。生物信息学。2001; 17(9):847-8。
- 33。
Finn RD, Bateman A, Clements J, Coggill P, Eberhardt RY, Eddy SR, Heger A, Hetherington K, Holm L, Mistry J. Pfam:蛋白质家族数据库。核酸Res. 2013;42(D1): D222-30。
- 34。
LeetUnic I,Deerks T,Bork P. Smart 7:蛋白域注释资源最近的更新。核酸RES。2012; 40(D1):D302-5。
- 35。
Gasteiger E,Hoogland C,Gattiker A,Duvaud SE,Wilkins Mr,Appel Rd,Bairoch A.蛋白质识别和分析工具在扩展服务器上。蛋白质组学protoc手册。2005; 112(112):571-607。
- 36。
Tamura K,Peterson D,Peterson N,SteCher G,Nei M,Kumar S. Mega5:使用最大可能性,进化距离和最大判定方法的分子进化遗传学分析。mol Biol Evol。2011; 28(10):2731-9。
- 37。
Cao Y,Han Y,Meng D,Abdullah M,Yu J,Li D,Jin Q,Lin Y,Cai Y.Rosaceae基因组中Gdsl型酯酶/脂肪酶的膨胀和进化模式。Funct综合基因组学。2018; 18(6):673-84。
- 38。
胡斌,金军,郭亚,张浩,罗军,高光。GSDS 2.0:一种改进的基因特征可视化服务器。生物信息学,2014,31(8):1296。
- 39。
Bailey TL, Johnson J, Grant CE, Noble WS。MEME套件。核酸学报2015;43(W1): W39-49。
- 40。
Li L,Stoeckert CJ,Roos DS。Orthomcl:鉴定真核基因组的正交组。Genome Res。2003; 13(9):2178-89。
- 41。
Librado P, Rozas J. DnaSP v5: DNA多态性数据综合分析软件。生物信息学。2009;25(11):1451 - 2。
- 42。
Cao Y,Han Y,Li D,Lin Y,Cai Y. Myb转录因子在中国梨(Pyrus Bretschneideri Rehd。):水果开发期间的基因组鉴定,分类和表达剖析。前植物SCI。2016; 7:577。
- 43。
Lescot M, Déhais P, Thijs G, Marchal K, Moreau Y, Van de Peer Y, Rouzé P, Rombauts S. PlantCARE,植物顺式作用调控元件的数据库和启动子序列硅分析工具的门户。核酸学报2002;30(1):325-7。
- 44。
Pertea M,Kim D,Pertea Gm,韭菜JT,Salzberg SL。RNA-SEQ实验与Hisat,Stringtie和Ballgown的转录级表达分析。NAT PROTOC。2016; 11(9):1650。
- 45。
曹颖,韩莹,李丹,林颖,蔡勇。4-香豆酸:辅酶a连接酶(4CL)相关基因的系统分析及在梨果实发育中的表达谱分析。基因。2016;7(10):89。
- 46。
王Y,哈姆斯F,Duggelin M,EGLI T.通过微孔膜过滤器对细菌通道的尺寸,形状和灵活性的影响。环境科技。2008; 42(17):6749-54。
- 47。
风扇H,Wu Q,王X,Wu L,Cai,林Y.在石斛中的1-脱氧-D-木糖-5-磷酸盐合成酶和1-脱氧-D-木糖-5-磷酸盐氧化酯酶的分子克隆及表达officinale。植物细胞组织器官邪教。2016; 125(2):381-5。
致谢
我们要感谢范洪洪、林毅和穆罕默德·阿卜杜拉对这份手稿的认真阅读和有益的评论。我们感谢审稿人和编辑对这份手稿的认真阅读和有帮助的评论。
资金
本研究由国家自然科学基金项目(no . 31640068)资助。资助机构没有参与研究的设计、数据的收集、分析和解释以及手稿的编写。
作者信息
隶属关系
贡献
YPC预计该研究,效仿主要生物信息学分析,绘制了稿件。YPC和DDM执行软件,并帮助处理数字和表格。yhy参加了实验并制定了手稿。TZC和YC处理实验数据并加入修改稿件。QJ和Cyj参加了软件并绘制了稿件。YPC和YPC构思并引导了实验,涉及其项目和协调,并帮助制定了稿件。所有作者都阅读并接受了最终手稿。
相应的作者
伦理宣言
伦理批准和同意参与
实验不涉及濒危或受保护的物种。这些地点/活动不需要具体许可,因为D. Officinale.本研究中使用的是从安徽农业大学的组织培养室获得。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
附加文件1:
图S1.ka / ks的滑动窗口分析(pe-do)和副酰基(pe-pe,do-do)基因对。窗口大小为150bp,步长为9bp。图S2.基因结构分析bbx同时D. Officinale.和p . equestris.外显子和内含子分别用绿色矩形和细线表示。图S3.同源基因(Pe-Pe, Do-Do和Pe-Do)的外显子-内含子结构比较外显子和内含子分别用绿色矩形和细线表示。表S1.19Dobbx.基因引物序列。表S2.ka,ks和ka / ks值的正非(pe-do)和副骨(pe-pe,do-do)基因对。表S3.本分析中使用的植物基因组。(docx 391 kb)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
曹勇,孟,D,韩勇。等等。的比较分析B盒各种治疗下的基因及其表达模式分析Dendrobium Officinale..BMC植物BIOL.19,245(2019)。https://doi.org/10.1186/s12870-019-1851-6
已收到:
公认:
发表:
关键词
- BBX.
- D. Officinale.
- 非生物压力
- QRT-PCR.
- 进化