抽象的
背景
的WOX(WUSCHEL相关同源盒)基因家族编码一类绿色植物特有的转录因子,通过决定细胞命运参与调节植物组织和器官的发育。虽然重要性WOX基因为人们所熟知,但对其在棉花中的功能研究较少。
结果
本研究共发现32个WOX基因陆地棉.系统发育分析表明,棉的WOX蛋白可分为三个分布:古代,中级和洪水。WUS思工中的WOX蛋白的数量大于其他两种枝条中蛋白质的总和。我们的分析显示20ghwox基因分布在16条染色体上,重复事件可能是导致棉花染色体扩增的原因之一ghwox家庭。所有ghwox基因有内含子,每个GhWOX蛋白包含多个基序。RNA-seq数据和实时PCR显示GhWOX13型基因亚家族在棉纤维中特异性表达。我们还识别推定的GA,NAA和BR响应元件在启动子区域中GhWOX13型基因和GhWOX13型GA、NAA和BR显著诱导转录。
结论
我们的数据为今后研究棉花的功能作用提供了有用的资料WOX基因和显示GhWOX13型基因可能影响棉花纤维的发育。我们的研究结果也为其他物种中WOX蛋白基因的鉴定和表征提供了一种方法。
背景
的乌塞尔-相关的Homeobox.(WOX)编码最大的转录因子(TFS)之一的基因家族是植物的独特性,并且属于同源域(HD)超家族的亚克片,其可以形成保守的DNA结合家庭结构域[1].虽然WOX基因在植物发育过程中的时空表达WOX不同植物的基因组基因并不一致。有15 11和21WOX基因家族成员拟南芥,高粱,玉米,[2,3.,4].来自多种高等植物种类的WOX蛋白的系统发育分析拟南芥高粱、玉米和水稻表明它们聚集成三个分支,即WUS分支、中间分支和古分支。然而,低等植物(绿藻和苔藓)只含有古老类型的WOX蛋白[5].在拟南芥,15个WOX蛋白可分为三个系统发育分支,AtWOX1–7和AtWUS属于WUS分支,AtWOX8、AtWOX9、AtWOX11和AtWOX12属于中间分支,AtWOX10、AtWOX13和AtWOX14属于古老分支[6,7].
已显示WOX蛋白在众多发育过程中起作用,例如器官形成,胚型,干细胞维持[8,9,10].AtWOX1型在子叶和新生叶的起始维管原基中高表达,过表达AtWOX1型造成叶片小,植株矮小,肥力低[11,12]. 异位过度表达TaSF (STENTOFOLIA),正射影像AtWOX1型结果,导致具有较宽叶片的转基因植物,加速开花和增加叶绿素含量[13].WOX3.在招募创始细胞期间具有高度保守的功能,以形成植物和花卉器官的侧面拟南芥和玉米。失去功能AtWOX3公司突变体表现出侧托叶和萼片的退化[14].AtWOX4型是生长素依赖的原形成层分化和/或维持所必需的,这表明WOX影响植物侧生生长的生长素依赖性调控基因家族[15,16].大米WOX4.负责分生组织的维护和减量oswox4.表达导致叶片原基严重畸形[17].AtWOX5型,由蟾蜍诱导诱导的,是调节IAA稳态以维持根顶部分页(RAM)中干细胞的负面因素[18].在杨树,WOX5a型主要表达在不定根尖和侧根尖。过度表达ptowx5a.导致AR数增加,AR长和叶片数减少[19]. 另外,过度表达WOX11.和WOX12.杨树中的Ar数显着增加,异位根减少[20.].AtWOX11的同源物,操作系统WOX11,与H3K27ME3脱甲基酶JMJ705相互作用,促进拍摄发育过程中下游基因的表达[21].此外,OsWOX11型也参与侧根起始、根毛形成和对非生物胁迫的反应[22,23].
棉花是世界上重要的经济作物,可用于纺织。棉纤维是单一种皮表皮细胞。纤维的质量和产量主要取决于三个生物过程;纤维起始、纤维伸长和次生细胞壁沉积[24,25,26].许多研究专注于棉花中的纤维细胞生长。到目前为止,已经完成了三种棉花种类的基因组序列,包括同种异体四倍体G. Hirsutum.(Aadd,2n = 52)和两个二倍体祖细胞G植物园(AA;2n = 26)和G雷蒙迪(DD, 2n = 26) [27,28,29,30.,31]. 这些基因组序列使我们能够识别WOX在棉花的基因组范围内基因。
WOX蛋白的作用在拟南芥然而,WOX蛋白在棉花中的功能,特别是在纤维发育中的作用,目前还不清楚。在这项研究中,我们鉴定了32种棉花WOX发现它们聚在已知的古代、WUS和中间系统发育支系中。染色体分布分析显示20ghwox基因分布在16个棉染色体上。基因表达模式分析表明GhWOX13型基因在棉纤维中特异性地高水平表达。另外,我们发现所有的GhWOX13型这些基因的启动子区域具有公认的GA、NAA和BR响应元件,可被这些激素诱导。研究结果为进一步研究棉花的功能作用提供了参考WOX基因,并证明GhWOX13型基因产物可能影响棉纤维的发育。本研究也为其他植物中WOX蛋白的鉴定和鉴定提供了一种方法。
结果
鉴定WOX基因家族蛋白Gossypium
识别WOX家庭成员Gossypium用15个AtWOX蛋白序列作为棉花基因组数据库的blast搜索,E值截断值为0.001。利用InterPro蛋白质序列分析和分类工具对候选GhWOX蛋白进行人工检测,以确定候选蛋白含有保守的DNA结合同源结构域。结果,我们确定了32、18和19WOX蛋白质编码基因G. Hirsutum,G植物园,和G雷蒙迪,分别为(表1).我们发现的数量WOX四倍体中鉴定的基因G. Hirsutum低于二倍体前体的总数目,表明多倍体形成后有一定的损失。相比之下,拟南芥,多个WOX基因,如WOX3,WOX4.,WOX13.和本人,在Gossypium. 相反地,WOX7.和WOX8.在三个棉花里失踪了,而在拟南芥,建议WOX7.和WOX8.基因可能已经丢失了Gossypium在他们脱离了人类共同的祖先之后Gossypium和拟南芥.
来自WOX蛋白的系统发育关系G. Hirsutum,G植物园,G雷蒙迪,和A. Thaliana.
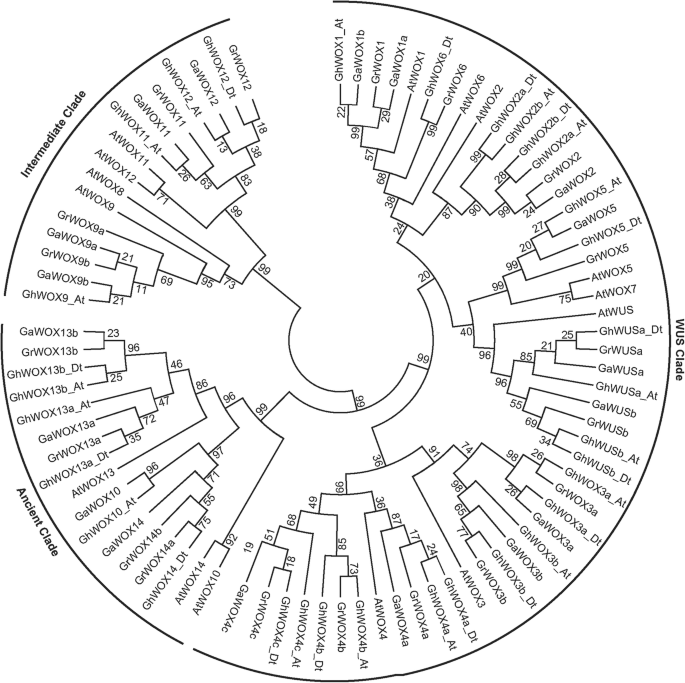
以评估进化和系统发育的关系WOX物种间的基因家族,共有89个WOX蛋白质序列,包括32个GhWOXs、18个GaWOXs、19个GrWOXs和15个AtWOXs序列,被用于构建一个基于对齐的无根系统发育树,使用MEGA 6.0中实现的邻居连接(NJ)方法,有1000个引导复制(图。1).根据Wox家族的系统发育关系,GHWOX家族蛋白也分为三个分支:WUS思工,古代思工和中间思工,涵盖最大的思工,含有23个GHWox蛋白。古代思工有六个GHWOX蛋白。剩下的成员属于中级思工。
染色体位置ghwox基因
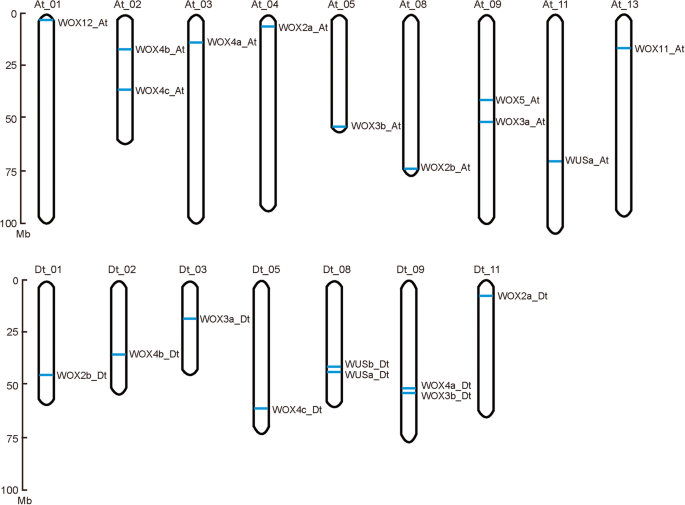
我们调查了32例的染色体位置ghwox基于基因的注释G. Hirsutum基因组。染色体的基因组定位ghwox基因显示20ghwox基因地图到16条染色体,而12ghwox基因映射到未分配给染色体的支架序列(图。2). 棉花染色体在02,09,08和09有两条ghwox每个基因,而所有其他染色体只有一个。但是,没有ghwox在AT_06,AT_07,AT_10,AT_12,DT_04,DT_06,DT_07,DT_12和DT_13上发现基因。我们分析了复制事件ghwox映射到染色体的基因,并确定了三种类型的基因重复:串联重复,分散复制和分段复制(附加文件2:表S2)。除了GhWOX12\U在和GhWUS1b\u日期它分别来自分散和串联重复,另一个映射ghwox这些基因都是由片段复制产生的。这一结果表明,片段复制是基因扩增的主要原因ghwox基因G. Hirsutum.
ghwox基因结构和结构域分析
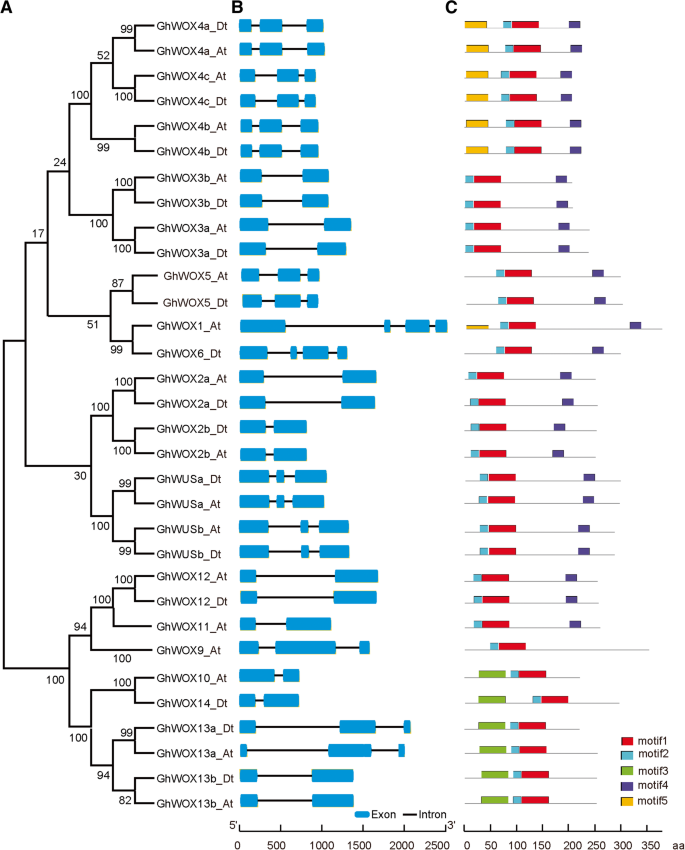
为了更好地理解和探索多样性WOX基因G. Hirsutum分析了该基因的保守基序和外显子/内含子结构ghwox基因。基因结构ghwox将cDNA序列与相应的基因组DNA序列进行比对得到。利用预测的GhWOX蛋白序列获得无根系统发育树(图。3.a) 是的。外显子/内含子结构分析表明ghwox每个基因含有两个内含子,其他基因含有不少于一个内含子,表明ghwox基因结构保守(图。3.b) 是的。我们还使用Interprob蛋白序列分析服务器分析了GHWOX蛋白的保守基序,并确定了五个不同的保守基序。基序的组成图案往往与系统发育树一致。在所有GHWOX蛋白亚壳中存在图案1和2,除了GHWOX9,GHWOX10,GHWOX13和GHWOX14之外,MOTIF 4存在于24个GHWox蛋白中。主题3存在于GHWOX10中,GHWOX13和GHWOX14,并且仅在GHWOX1和GHWOX4亚家族的所有成员中发现基序5(图。3.C)。来自古代思工的GHWOX蛋白包含三个相同的主题,这可能表明该思路中的蛋白质具有相同的功能,并且功能是多余的。此外,发现一种新的基序,其特异于GHWOX1_AT蛋白,尽管它与GHWOX6A共用了三个相同的主题。两种蛋白质在系统发育树中非常接近,表明它们可以具有共用功能。然而,新的基序可以为GHWox1_AT蛋白提供一种新功能。
系统发育关系,基因结构和结构域组成ghwox蛋白质。一个基于GhWOX蛋白氨基酸序列的多重比对,采用邻居连接(NJ)方法构建了MEGA-6.0系统发育树,共有1000个自举重复。b外显子/内含子结构ghwox基因。外显子和内含子分别由蓝色盒子和黑线表示。c示意图显示了由InterPro注释的GhWOX蛋白中的保守结构域(http://www.ebi.ac.uk/Interpro / scan.html)。不同的颜色盒代表不同的保守蛋白质图案
基因表达模式ghwox各种组织中的基因
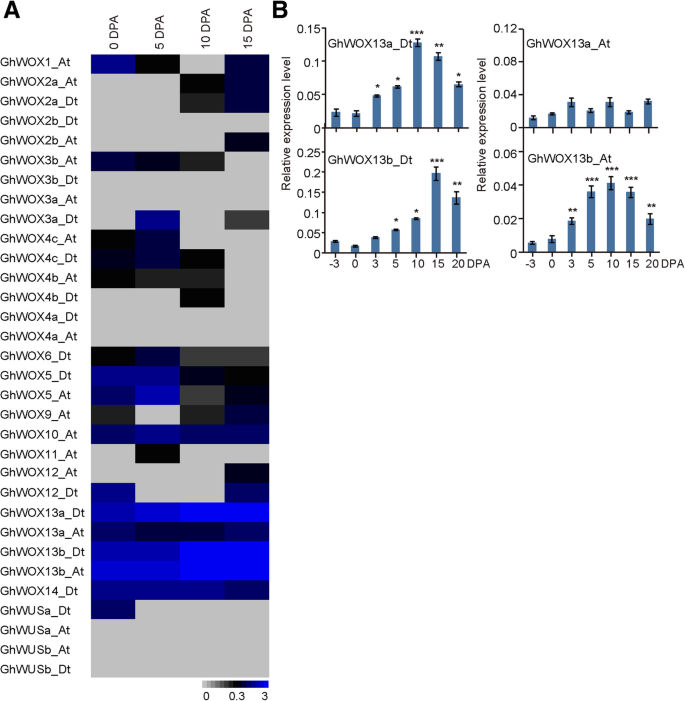
研究32个基因的组织特异性表达谱ghwox利用RNA-seq数据分析了这些基因在幼根、幼茎、幼叶、花和0 dpa胚珠等不同器官中的相对表达水平。如图所示。4,数据表明了表达的ghwox不同器官和组织的基因不同;ghwox2.,ghwox4.,GHWOX5.,GHWOX9.,GhWOX11号,和GhWOX13b_Dt在幼根中高度表达,ghwox4.,GHWOX5.,GhWOX11号,和GhWOX13b_At在幼嫩的茎中高度表达,并且GhWOX9_At, GhWUSa_At,和GhWUSb在幼叶中高表达,暗示ghwox基因在棉花生长发育中起着不同的作用。这些结果与以往关于个体功能的报告一致WOX基因,这表明了WOX基因功能在不同的物种中是保守的。有趣的是,所有的ghwox基因在胚珠中的表达水平几乎相同。
我们进一步调查了表达概况ghwox基因发现,除了纤维开发阶段,它们都没有显示出显着的变化GhWOX13a\ U日期,ghwox13b_at.,和GhWOX13b\U D公司,在10dpa和15dpa高度表达(图。5一种)。此外,我们使用定量实时PCR(QRT-PCR)实验验证了RNA-SEQ数据。因此,GhWOX13型与RNA-seq数据一致。的成绩单GhWOX13a\ U日期和ghwox13b_at.在10dpa时达到峰值。5b) 是的。这些结果表明GhWOX13型基因可能在棉纤维发育中起重要作用。
GhWOX13型基因表达受GA、BR和生长素的刺激
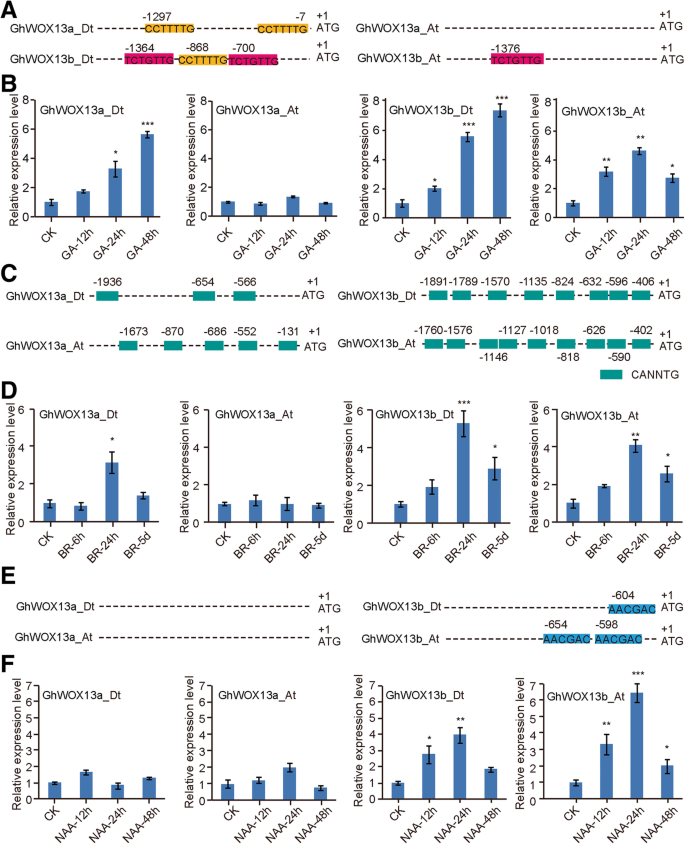
为了确定控制基因表达的调控元件WOX在棉花基因中,我们分析了ghwox基因。我们发现ghwox基因启动子包含至少一个假定的ga响应元件(即GARE基序、P-box和TATC-box)ghwox1_at.,ghwox3a_at.,ghwox3b_at.,GhWOX3b_Dt,ghwox4b_dt.,GhWOX4c_At, GhWOX12_Dt,GhWOX13a\ U日期,和ghwox14_dt.(附加文件1:图S1)。接下来,我们分析了假定的br -响应元素,发现所有ghwox基因在其启动子地区有推定的BR响应元素(附加文件1:图S2)。我们还寻找了可能与生长素有关的基因独联体的启动子区域中的-元素ghwox基因,发现GhWOX3a_Dt,ghwox4b_dt.,ghwox4c_at.,GhWOX5_Dt,GhWOX9_At,ghwox13b_at.和GhWOX3b_Dt在上游推动者区域中包含一个推定的助长响应元素(AUXRE)(附加文件1:图S3)。自从此以来GhWOX13型基因在棉纤维中特异性表达,我们分析了其启动子区GhWOX13型基因和确定的假定GA, NAA和BR反应独联体-启动子中的元素(图。6a,c和e)。为了确定是否GhWOX13型GA, NAA, BR诱导的基因,mRNA水平ghwox13a_at.,GhWOX13a\ U日期,ghwox13b_at.,和ghwox13b_dt.三种植物激素处理后进行qRT-PCR检测。结果表明,在大肠杆菌中GhWOX13a\ U日期和ghwox13b_dt.用ga待治疗48小时后进行上调,ghwox13b_at.用Ga持续24小时治疗后mRNA水平显着增加,但转录ghwox13a_at.对GA处理的反应没有变化(图。6b) 是的。GhWOX13a\ U日期,ghwox13b_at.和ghwox13b_dt.上调,表达峰在BR治疗后24小时,而转录ghwox13a_at.对BR无反应(图。6d) 是的。表达ghwox13b_at.和ghwox13b_dt.NAA诱导表达,NAA诱导表达ghwox13a_at.,GhWOX13a\ U日期未显示任何效果(图。6F)。这些结果表明了GhWOX13型基因可能在植物激素介导的棉纤维伸长过程中发挥重要作用。
GhWOX13型亚家族基因转录由甘草酸(GA),芸苔类固醇(BR)和养肝治疗诱导。一个四种基因启动子区生长素反应元件的鉴定GhWOX13型基因家庭成员。bGA诱导三种基因的转录GhWOX13型在他们的推动者地区中具有辅助的基因。启动子ghwox13b.不包含AuxRE(c)基因启动子区E-box元件的鉴定GhWOX13a_At / 13 a_dt / 13 b_at / 13 b_dt.d四种基因的转录hWOX13BR处理6小时、24小时和5天后的家族基因。e基因启动子区生长素反应TGA元件的鉴定GhWOX13b_At / 13 b_dt基因。f四种基因的转录GhWOX13型用NAA治疗12,24和48小时后进行家族基因。ghwox13b_at.和ghwox13b_dt.在启动子区域中有假定的TGA元件。基因表达数据通过每个样本3个重复的qRT-PCR检测获得,每个重复使用独立的材料。各基因在CK胚珠中的相对表达量归一化,取1.0。采用单因素方差分析结合Tukey检验确定统计学意义。*,P < 0.05; **,P< 0.01;***,P < 0.001
讨论
棉是全球栽培中最重要的经济作物之一,它是纤维和油的重要来源。全基因组测序G植物园,G雷蒙迪,和G. Hirsutum近年来,基因组研究已经完成,并通过基因组分析与高通量转录组测序相结合,发现了一些与纤维发育和叶片形成相关的基因。然而,功能WOX棉花的基因,特别是与纤维发育有关,主要是未知的。在这项研究中,我们确定了32,18和19WOX基因G. Hirsutum,G植物园,和G雷蒙迪分别是。虽然WOX基因G. Hirsutum比其他两个物种的At和Dt基因组中的基因数量要高得多G. Hirsutum比数字小吗G植物园或G雷蒙迪.在棉质特定的多倍化事件期间,基因拷贝数在很大程度上减少了[32,33,34]. 我们的结果与异源四倍体棉花的基因丢失率高于两个祖先的二倍体棉花的结果一致。以前的研究表明WOX基因家族可分为三个主要的林分;在绿藻和土地植物的所有谱系中存在的古代思工,而中间和洪水植物仅在蕨类植物和种子植物中发现[35]. 在这项研究中,我们确定了32个WOX代表异源四倍体棉花三个主要分支的基因G. Hirsutum.杨等人。确定WOX基因家族成员陆地棉和我们还发现WOX基因可以自然地分为三个分支[36],这与我们的发现一致。四个中的四个ghwoxs属中支,6属古支。WUS分支中的基因数目远高于中间或古代分支,这与以前的报道一致[37].在A. Thaliana.,有15种阿特魏蛋白,包括中间思工中的四个,古代的三个,八个在吴思。
基因结构分析预测15ghwox基因包含一个内含子,15ghwox基因包含两个内含子ghwox基因(ghwox1_at.和GhWOX6年)包含三个内含子。ghwox1_at.和GhWOX6年有几乎相同的基因结构WOX1/6型子群,尽管内含子的相位和长度不同。同样地拟南芥基因AtWOX1型和atwo.X6属于一个系统进化支系,与3个内含子具有相似的基因结构。蛋白质序列基序分析显示,所有GhWOX亚家族均包含基序1和基序2。Motif 3仅存在于GhWOX10、GhWOX13和GhWOX14中,这些蛋白属于古老的分支(图1)。1),表明基序3在最古老的WOX蛋白中是保守的。这些结果表明,蛋白质在不同亚家族中的特殊功能可能是由于特定序列基序的存在。内含子和基序的模式与系统发育分支密切相关,有力地支持了基因间的密切进化关系ghwox在每个亚属中的基因。
已显示WOX蛋白在众多发育过程中起作用,例如器官形成,胚型,干细胞维持[38,39].我们的数据显示了很多ghwox基因具有与同源基因不同的表达模式拟南芥.例如,相反WOX2.中的表达式拟南芥我们找到了胚胎GhWOX2a_At/2_日期/2 b_At /2 b_日期,在幼根中特异性表达,并表现出与WOX2.在里面Populus tomentosa,主要在根中表达[40].我们还指出,重复的基因显示出不同的表达水平;GhWOX13a\ U日期和ghwox13b_dt.主要表现在花上,而ghwox13b_at.在幼茎中高水平表达。这些结果表明一些WOX基因可能在进化期间获得不同的功能。
GhWOX13a\ U日期,ghwox13b_at.,和ghwox13b_dt.在棉纤维中高表达,在纤维伸长过程中表达逐渐增加。我们分析了GhWOX13型基因和鉴定的推定GA,NAA和BR反应独联体-发起人要素;我们还发现GhWOX13型在用Ga,Br或Naa处理后,基因进行上调。AtWOX13型在花序、花蕾、新生侧根和根尖中均有高表达[41.,42.].的沃克斯13突变体显示出略较宽的水果,横向根数减少拟南芥. 我们的数据表明GhWOX13型可能与植物激素介导棉花纤维伸长有关。
综上所述,我们的工作不仅全面确定了WOXS.在里面G. Hirsutum,还发现了GhWOX13型在棉纤维发育过程中表达了转录物,可以通过Ga,Naa和Br显着诱导。我们的研究提供了进一步揭示精确作用的线索WOX棉花纤维发育的基因。
结论
陆地棉包含32个WOX蛋白,可分为三个分支:古代、中间和WUS分支。WUS分支中WOX蛋白的数量多于其余两个分支。发现了多个内含子和基序ghwox基因。GhWOX13型基因在棉纤维细胞中特异、高表达,GA、NAA和BR可诱导其转录。我们的结果也提供了一种方法来识别和表征WOX其他物种的基因。
方法
数据库和序列
基因组序列拟南芥是从TAIR数据库下载的(http://www.arabidopsis.org/).基因组序列G植物园(A2,CRI更新的装配v1.0),Gossypium raimondii就(D5,JGI组装v2.0),和G. Hirsutum(AD1, NAU assembly v1.1)从CottonFGD数据库(https://cottonfgd.org/).我们使用了ga(G植物园),gr(Gossypium raimondii就),生长激素(G. Hirsutum),和(A. Thaliana.)作为命名的前缀WOX这项研究的基因。
启动子分析,多序列比对,系统发育分析
从起始密码子之前的2000个核苷酸的序列从基因组序列中提取ghwox基因,和独联体-PlantCARE在线计划预测了作用调控因子(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/). 人类的基因IDWOX上述三个物种的基因见附加文件2S1:表。完整的氨基酸序列预测WOX四种植物物种的基因使用CLUSTALW对齐。由Mega 6.0软件构建邻近(NJ)系统,具有成对删除选项,泊松校正模型和均匀速率。使用1000重复进行引导测试,用于评估系统发育树的统计可靠性[43.].
基因结构,蛋白质基序分析,和基因组定位
基因结构显示服务器(GSDS,http://gsds.cbi.pku.edu.cn/)用来绘制基因的外显子-内含子结构ghwox基于如上所述获得的全长基因组序列和相应编码序列的基因[44.].InterPro,蛋白质序列分析与分类(http://www.ebi.ac.uk/Interpro/scan.html.)用于识别GHWOX蛋白中的保守结构域[45.].染色体位置信息ghwox从基因组注释中获得基因,并以自上而下的方式显示在各自染色体上的相对位置。
植物材料与激素治疗
陆地棉(徐州142)种子采自中国农业科学院棉花研究所(中国安阳)。棉花植株生长在气候控制的温室中,光照时间为16小时/8小时,温度为30°C。新鲜的棉籽纤维在开花后不同的时间点(DPA)从铃中收获,然后立即在液氮中冷冻,如之前报道的那样[46.].
植物激素处理采用前面描述的方法[46.]. 简言之,在开花后1dpa(天)采集自花授粉的棉花花。取苞片、萼片和花瓣,用10%次氯酸消毒子房15min,再用无菌蒸馏水冲洗7次。在无菌条件下,仔细地将胚珠从卵巢中分离出来,并立即漂浮在液体培养基(0.272)上 克/升KH2阿宝4, 6.183 毫克/升小时3.薄3., 0.242 mg/L Na2Moo.4·2小时2O, 0.441 g/L钙离子2·2小时2o,0.83 mg / l ki,0.024 mg / l cocl2·6小时2O, 0.493 g/L MgSO4h·72O、 16.902美元 毫克/升硫酸锰4·H2O、 8.627美元 毫克/升硫酸锌4h·72O、 0.025毫米 毫克/升硫酸铜4·5小时2O、 5.055美元 毫克/升硝酸钾3., 8.341 毫克/升硫酸亚铁4h·72O、 11.167美元 毫克/升钠2EDTA, 0.492 mg/L烟酸,0.822 mg/L吡酮·HCl, 1.349 mg/L硫胺素·HCl, 0.180 g/L肌醇,18.016 g/L d -葡萄糖,3.603 g/L d -果糖),分别含1 μM GA(赤霉素酸),5 μM BR(油菜素内酯),或5 μM NAA(1-萘乙酸)。46.].然后在没有搅拌的情况下在暗度下在30℃下培养胚珠。对于GA和NAA处理,将孵育12小时,24小时和48小时,与纤维一起收集,因为难以彼此分离。对于BR处理,将6小时,24小时和5d胚珠与纤维一起进行。在收集后立即将样品在液态氮中冷冻并在实验中使用前储存在-80℃。对于每种处理,收集了三种单独的样品,对三种生物重复进行分析。GA,BR和NAA购自Sigma-Aldrich。
RNA提取及qRT-PCR分析
根据制造商的说明,使用E.Z.N.A.植物RNA试剂盒(OMEGA)提取总RNA。组织被破坏和均质化。最后一步的柱流通与膜结合液混合,然后加载到HiBind RNA微型柱中。最后,用RWC缓冲液和RNA洗涤缓冲液洗涤RNA,去除蛋白质、多糖和盐类。总RNA经dna酶处理去除gDNA污染。然后使用PrimeScript RT试剂盒按照制造商的方案(中国大连TaKaRa)合成第一链cDNA。
qRT-PCR检测采用Bio-Rad Real - Time PCR检测系统(Bio-Rad CFX96 Touch) [47.].SYBR Green qRT-PCR反应包含10 μl SYBR®Premix Ex Taq™II (Takara), 0.5 μl 10 μM引物,2ng cDNA模板。用ddH调节终浓度至20 μl2O.PCR循环条件为95℃,30秒,其次为95℃的40个循环,5 s和60℃。使用2计算相对基因表达−ΔΔCt方法[47.].试验设3个生物重复,每个生物重复设3个技术重复。用于qRT-PCR分析的引物见附加文件2:表S3。棉花泛素基因Ghubq7.用作每个QRT-PCR实验中基因表达的正常化内部控制。
数据和材料的可用性
所有支持我们研究结果的数据和材料都包含在手稿的方法部分。详情见所附补充资料。
缩写
- BR:
-
芸苔类固醇
- DPA:
-
花后天数
- GA:
-
吉布林素
- 乙酰天冬氨酸:
-
萘酸甲酸
- WOX:
-
WUSCHEL相关同源盒
参考
- 1.
朴so,郑忠,欧阳志明,欧阳志明。的相当少的种子2基因编码拟南芥调节胚珠发育的同源结构域蛋白质。发展。2005;132(4):841–9.
- 2.
Shimizu R、Ji JB、Kelsey E、Ohtsu K、Schnable PS、Scanlon MJ。分生组织的组织特异性与进化WOX3.功能。植物生理学。2009;149(2):841–50.
- 3.
的微分表达式WOX基因介导顶端基底轴线形成拟南芥胚胎。Dev细胞。2008;14(6):867 - 76。
- 4.
Suer S,Agusti J,Sanchez P,Schwarz M,Greb T.Wox4赋予患有悬浮蛋白的响应性拟南芥.植物细胞。2011;23(9):3247 - 59。
- 5。
Hirakawa Y,Kondo Y,Fukuda H.TDIF肽信号传导通过该方法调节血管干细胞增殖WOX4.同源框基因拟南芥.植物细胞。2010; 22(8):2618-29。
- 6。
一种控制干细胞生态位的信号模块拟南芥根业务。Curr Biol。2009; 19(11):909-14。
- 7。
研究结果表明,保守因子调控的信号转导是调控信号转导的关键拟南芥芽和根干细胞组织者。大自然。2007;446(7137):811 - 4。
- 8。
李国强,李国强,李国强。WOX4促进原形成层发育。植物杂志。2010;152(3):1346 - 56。
- 9。
哈克尔A、格罗斯哈特R、盖格斯B、萨卡尔A、布朗格H、赫尔曼M、劳克斯T。基因表达动力学WOX在早期胚胎形成过程中,基因决定了细胞的命运拟南芥. 发展。2004;131(3):657–68.
- 10.
Costanzo E, Trehin C, Vandenbussche M.的角色WOX花发育的基因。安博特伦敦。2014;114(7):1545–53.
- 11.
张勇,吴R,秦G,陈Z,顾H,曲LJZDB。过度表达WOX1导致分生组织发育和多胺稳态的缺陷拟南芥.植物生物学杂志。2011;53(6):493-506。
- 12.
Vandenbussche M、Horstman A、Zethof J、Koes R、Rijpkema AS、Gerats T。矮牵牛和拟南芥侧翼发育和器官融合中WOX转录因子的差异招募。植物细胞。2009;21(8):2269–83.
- 13.
刘米,雷路,苗F,力量C,张x,邓j,tadege m,carver bf,yan l。的Stenofolia.基因来自苜蓿改变转基因小麦的叶宽,开花时间和叶绿素含量。植物Biotechnol J. 2018; 16(1):186-96。
- 14.
中田M、松本N、筑基R、立基E、劳克斯T、冈田K。中间领域的角色WUSCHEL相关同源盒叶片早期发育的基因拟南芥. 植物细胞。2012;24(2):519–35.
- 15.
林H,NIU L,MCHALE NA,OHME-TAKAGI M,Mysore Ks,TASEGE M.威毒蛋白的进化抑制活性介于植物中培养叶片外泌叶和花器官发展。Proc Natl Acad Sci U S A. 2013; 110(1):366-71。
- 16。
Ji J, Shimizu R, Sinha N, Scanlon MJ。分析WOX4.转基因为基因的进化提供了进一步的证据WOX基因家族调控不同干细胞功能。植物信号行为研究。2010;5(7):916-20。
- 17。
Yasui Y、Ohmori Y、Takebayashi Y、Sakakibara H、Hirano HY。wuschel-相关的homeobox4.在水稻早期叶发育中起关键调节作用。公共科学图书馆Genet。2018;14(4):e1007365。
- 18。
Lopez Moya F、Escudero N、Zavala Gonzalez EA、Esteve Bruna D、Blázquez MA、AlabadíD、Lopez Llorca LV。生长素生物合成的诱导与调控WOX5.抑制介导根发育的变化拟南芥暴露在壳聚糖。SCI批准。2017; 7(1):16813。
- 19。
李军,张军,贾辉,刘波,孙平,胡军,王磊,陆敏婷wuschel相关的homeobox 5a(ptowx5a.)参与了植物不定根的发育杨树.树生理。2018; 38(1):139-53。
- 20.
徐敏,谢伟,黄敏WUSCHEL相关同源盒基因,Pewox11a.和Pewox11b.,参与不定根的形成杨树.physiol植物。2015; 155(4):446-56。
- 21.
程,谭F,陆Y,刘X,李T,周元W,赵Y, DX。WOX11招募组蛋白H3K27me3去甲基化酶促进水稻茎叶发育过程中的基因表达。核酸研究。2018;46(5):2356-69。
- 22.
关键词:水稻,同源基因,生殖器官发育,激素信号转导,非生物胁迫基因。2014;549(2):266 - 74。
- 23.
程S、周德祥、赵Y。乌塞尔相关的同源框基因WOX11.通过控制根毛形成和根系发育提高水稻抗旱性。电厂信号行为。2016;11(2):e1130198。
- 24.
阮YL,LLEWELLYN DJ,FURBANK RT。通过血浆和蔗糖和k的协调表达对单细胞棉纤维伸长的控制。蔗糖和k的协调表达+转运蛋白和棒曲霉素。植物细胞。2001;13(1):47-60。
- 25。
Kim HJ,Triplett Ba。植物和体外棉纤维生长。植物细胞伸长和细胞壁生物发生模型。植物理性。2001; 127(4):1361-6。
- 26。
秦玉明,朱义祥。棉花纤维如何拉长:一个线性细胞生长模式的故事。植物生物学杂志。2011;14(1):106-11。
- 27。
李芳芳,范国刚,王凯博,孙fm,袁亚林,宋国良,李强,马征镒,吕荣荣,邹春生,等。栽培棉花基因组序列Gossypium Arboreum..Nat麝猫。2014;46(6):567 - 72。
- 28。
王克斌,王志伟,李福光,叶伟,王金勇,宋高丽,岳兹,丛力,尚HH,朱素丽,等。一个二倍体棉花的基因组草案Gossypium raimondii就. 纳特·吉内特。2012;44(10):1098–103.
- 29。
李福国,范国勇,吕CR,肖国华,邹CS,柯海瑞,马志,尚海华,马新发,吴金英,等.栽培陆地棉基因组序列分析(陆地棉TM-1)提供了对基因组进化的见解。纳特生物技术公司。2015;33(5):524–U242。
- 30
张TZ,胡y,江口,方l,关xy,陈杰,张jb,萨斯岛,scheffler,btelly dm,等。分子素棉花的测序(陆地棉L. ACC。TM-1)提供了一种用于纤维改进的资源。NAT BIOTECHNOL。2015; 33(5):531-7。
- 31
杜×,黄庚,何S,杨子忠,孙庚,马×,李恩,张×,孙杰,刘梅,等。基于更新的a基因组对243份二倍体棉花种质进行重测序,确定了关键农艺性状的遗传基础。纳特·吉内特。2018;50(6):796–802.
- 32
Chen Zj,Scheffler,Dennis E,Triplett Ba,Zhang Tz,Guo Wz,Chen Xy,Stelly DM,Rabinowicz PD,Town CD,等。朝向棉花(Gossypium)基因组。植物理性。2007; 145(4):1303-10。
- 33
Wendel的摩根富林明。新世界四倍体棉花含有旧世界的细胞质。国家自然科学基金资助项目:国家自然科学基金资助项目;
- 34.
王XY,郭H,王JP,雷提,刘T,王志勇,李义新,李思,李JP,唐HB等。棉花基因组的比较基因组去卷积显示了一个十倍体祖先和广泛的染色体分离。新植物醇。2016;209(3):1252–63.
- 35.
关键词:茎和根干细胞,离散增殖,细胞增殖本人/WOX5.功能是被子植物的进化创新。分子生物学。2009;26(8):1745–55.
- 36.
杨Z,龚Q,秦W,杨Z,程Y,陆L,葛X,张C,吴Z,李F。全基因组分析WOX旱地棉中的基因及其在不同应力下的表达模式。BMC植物BIOL。2017; 17(1):113。
- 37.
德沃Y、托法诺·尼奥奇C、克莱塞G、塔劳V、莫林H、劳夫P、莫罗H、克雷斯M、莱查尼A。最保守的基因WOX植物的枝系影响根和花的发育拟南芥.BMC进化生物学。2008;8:291。
- 38.
纳德曼的发明本人类似干细胞的植物促进功能早于细囊蕨类植物。中国生物医学工程学报,2012;
- 39。
Nardmann J,WERR W.在Angiosperms中拍摄干细胞Niche:表达模式本人水稻和玉米中的直系同源基因意味着在单双子叶植物和双子叶植物的进化过程中发生了重大变化。分子生物学。2006;23(12):2492–504.
- 40.
刘b,王l,张俊,李俊,郑h,陈俊,鲁米。乌塞尔同源盒相关基因Populus tomentosa:多样化的表达模式和不定根形成中的功能相似性。BMC基因组学。2014; 15:296。
- 41.
Sakakibara K,Reisewitz P,Aoyama T,Friedrich T,ando S,Sato Y,Tamada Y,Nishiyama T,Hiwatashi Y,Kurata T,等。WOX13.在苔藓中,叶片和原生质体细胞重编程为干细胞需要类似基因Physcomitrella patens.. 发展。2014;141(8):1660–70.
- 42.
孙XD,向恩,王光德,杨世华,李X,杨永青,杨玉萍。分离和功能分析SpWOX13从大针紫竹. 《植物分子生物学报告》,2015年;33(5):1441–50.
- 43.
Tamura K,SteCher G,Peterson D,Filipski A,Kumar S. Mega6:分子进化遗传学分析6.0版。mol Biol Evol。2013; 30(12):2725-9。
- 44.
胡乙、金杰、郭艾、张赫、罗杰、高庚。gsds2.0:一个升级的基因特征可视化服务器。生物信息学。2015;31(8):1296–7.
- 45.
InterProScan:蛋白质结构域标识符(protein domain identifier)。核酸研究2005;33(Web服务器):W116-20。
- 46.
史永华,朱思文,毛学忠,冯建新,秦玉明,张玲,程杰,魏立平,王志勇,朱应祥。转录组分析、分子生物学和生理学研究揭示了乙烯在棉纤维细胞伸长中的主要作用。植物细胞。2006;18:651 - 64。
- 47.
Livak KJ,Schmittgen TD。应用实时定量PCR和2−ΔCT方法。方法。2001;25(4):402–8.
致谢
不适用。
资金
国家自然科学基金资助项目(No. 31600223);香港学者资助项目(No. XJ2017017);中央高校基本科研业务费专项资金资助项目(No. XJ2017017);棉花生物学国家重点实验室开放基金(批准号:GK201803041; GK201901004);国家大学生创新创业训练计划(批准号:CB2018A03);陕西省自然科学基础研究计划(批准号:2018JZ3006、20119jm -491)、陕西省青年英才计划(批准号:20190205)、陕西省博士后研究计划(批准号:2018BSHYDZZ76)、勤工助学创新基金项目(批准号:2018BSHYDZZ76)。KY2018YB003)。资助机构为研究项目提供资金支持,但不参与研究设计、数据收集、分析或手稿编写。
作者信息
从属关系
贡献
gx和j.y设计了这项研究。P.H.和y.z进行了这项研究。H.L., Y.Y.和C.W.分析了数据。gx和P.H.写了这篇论文。所有作者已阅读并批准最终稿件。
相应的作者
道德声明
道德认可和参与同意
不适用。
出版许可
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商说明
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
权利和权限
开放获取本文在知识共享归属4.0国际许可条款下发布(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
他,p。,张,y。,刘,h。et al。综合分析WOX基因揭示了这一点WOX13.参与植物激素介导的棉花纤维发育。BMC植物BIOL.19,312 (2019). https://doi.org/10.1186/s12870-019-1892-x
收到:
接受:
出版:
关键字
- 陆地棉
- WOX基因
- 表达分析
- 响应调节器