抽象的
背景
SPL (SQUAMOSA promoter binding protein-like)是一类植物特异性转录因子,在芽、花序分枝、胚胎发育、信号转导、叶片起始、阶段转变、花果发育等诸多生长发育过程中发挥重要作用。在苦荞这一重要的食药作物中,SPL基因家族已经在许多物种中被鉴定和表征,但尚未得到充分的研究。
结果
在这项研究中,24Fagopyrum tataricum SPL(FTSPL.)根据染色体分布鉴定并重命名的基因FTSPL.基因。根据SBP结构域和基因结构的氨基酸序列,SPL通过系统发育树分析将基因分成八组(I组至组VII)。在鞑靼荞麦中检测到总共10个图案SPL基因。的表达模式23 SPL.采用实时荧光定量聚合酶链反应(qRT-PCR)对不同组织和果实在不同发育阶段(青果期、变色期和初成熟期)中的基因进行了测定。
结论
苦荞基因组包含24 SPL.基因,大多数基因在不同的组织中表达。QRT-PCR显示FTSPLS.在苦荞生长发育中起重要作用,初步鉴定了可能调控花和果实发育的基因。本研究为深入了解苦荞麦SBP-box基因家族奠定了基础,为进一步研究苦荞麦SBP-box基因的功能特性奠定了基础FTSPL.苦荞作物的基因与改良。
背景
鞑靼荞麦起源于中国西南,目前在中国西南部和喜马拉雅地区以及日本,加拿大等国家的种植。作为一种广泛栽培的药物和食用作物,急性荞麦含有丰富的完整蛋白质,具有良好的必需氨基酸组成,具有丰富的有益可溶性纤维和植物化学[1,2,3.,4].鞑靼荞麦水果富含芦丁,据报道,预防肝损害[5].鞑靼荞麦果的发展和成熟是其增长和发展的重要阶段。转录因子(TFS)在调节植物的生长和发展方面发挥着不可或缺的作用。目前,在鞑靼荞麦中鉴定了蟾蜍素响应因子基因家族,以及潜在的作用Fagopyrum tataricum Arf2.(FTARF2.)关于鞑靼荞麦的果实大小已经研究过[6,7].因为Squamosa启动子结合蛋白(SBP) -SPL)基因调控花序分枝和籽粒发育,探索其潜在功能具有重要意义FTSPL.理解季后荞麦生长和发展的基因。
SBP-box是一个重要的转录因子家族,调控植物的生长发育。首次从该菌的cDNA文库中分离得到金鱼草majus以其识别和结合SQUAMOSA启动子(SQ-UA)的能力而命名[8,9].SPL是一类类似于SBP-box的转录因子的总称。的SPL基因编码含有约76个氨基酸残基的高度保守的SBP结构域,包括两种串联锌手指(Cys-Cys-His-Cys和Cys-Cys-Cys-his),并在C-拥有核定位信号(NLS)终点[10,11].研究表明,SPL TFs广泛存在于植物和发挥重要作用在植物生长发育的许多方面,包括调节花形成和后期开发、控制转换植物从营养生长到生殖生长,调节叶片形态发生,应对环境信号(12,13,14,15].
随着植物基因组数据的发布,SPL基因家族的全基因组鉴定和分析已经在许多植物中进行,如拟南芥(答:芥)[16,17],Solanum lycopersicum(S. lycopersicum.)[18],大豆(g·马克斯)[19],葡萄(诉酿酒用葡萄)[20.],马吕斯有明显Borkh (M. Domestica.)[21],里纳斯市政府L (R. Communis.l)[22],玉米L (z梅斯)[23],甜椒L (c .建立)[24),而丹参[25].在答:芥, 16答:芥SPL(atspl.根据SBP结构域的氨基酸序列将基因分成8组:AtSPL7(我组),AtSPL1/12/14/16(II集团),AtSPL8(iii集团),AtSPL6(IV组),ATSPL2 / 10/11(v组),AtSPL3/4/5(第六组),AtSPL13(VII集团),和AtSPL9/15(第七组)。这些函数SPL基因答:芥它们在叶、花和芽的发育中起着重要的作用[15,26,27].目前,许多SPL在其他植物中已经分离和鉴定了SPL基因,但尚未对苦荞麦SPL蛋白进行研究,这些蛋白的功能也不清楚。
在本研究中,我们综合分析了24例的基因结构、基序组成、染色体位置和基因重复SPL在最近完成的苦荞基因基因组序列的基础上,比较了苦荞与小麦的进化关系答:芥,甜菜属(B. vulgaris.),番茄红素,葡萄树,葡萄树,和奥雅萨苜蓿(o .漂白亚麻纤维卷).与其他植物SPL家族鉴定结果进行比较,不仅分析了FtSPL基因家族的分组、基因结构、染色体定位、串联和片段复制,还分析了FtSPL家族的进化关系FTSPL.多种物种的基因,包括多种物种系统发育树,基序组合物和它们之间的共线性分析。此外,我们研究了空间表达SPL苦荞果实发育过程中不同组织的基因及其表达模式。通过全局表达分析,具体的角色SPL确定了在季后荞麦的不同生物过程中的基因家族。本研究全面分析了鞑靼荞麦的SPL基因家族,不仅为筛查重要信息提供有价值的信息SPL同时也为其他植物SPL家族的挖掘提供了方法。
结果
识别的FTSPL.苦荞基因
在本研究中,我们提取了SPL通过两种BLASTp方法从苦荞麦基因组中分离得到24个基因SPL去除冗余序列后鞑靼荞麦的基因。我们更名为SPL基于苦荞染色体位置的基因(附加文件2表S1)。的位置信息SPL基因,我们看到了这一切SPL基因位于细胞核(附加文件2表S1)。Tarrary荞麦的预测SPL蛋白在长度和分子量(MV)中大大变化。鞑靼荞麦SPL基因编码蛋白质,范围为100(FTPY000637300.01)至1004(FTPY0000377600.01)氨基酸(AA)的长度和11.7(FTPY0006337300.01)至110.77(FTPY0000377600.01)KDA在MV中。蛋白质的等电点(PIS)范围为5.69(FTPY0000377600.01)至9.75(FTPY0001287900.01)(附加文件2表S1)。
多序列比对、系统发育分析和分类FTSPL.基因
与SPL全长蛋白序列进行多序列比对,SBP结构域在特定位置基本保守,如CQQC序列(235-238氨基酸)、SCR序列(253-256氨基酸)和RRR序列(264-267氨基酸)。几乎所有的序列都包含两个锌指状结构,Zn-1, Zn-2和一个高度保守的核定位信号(NLS)1图S1)。
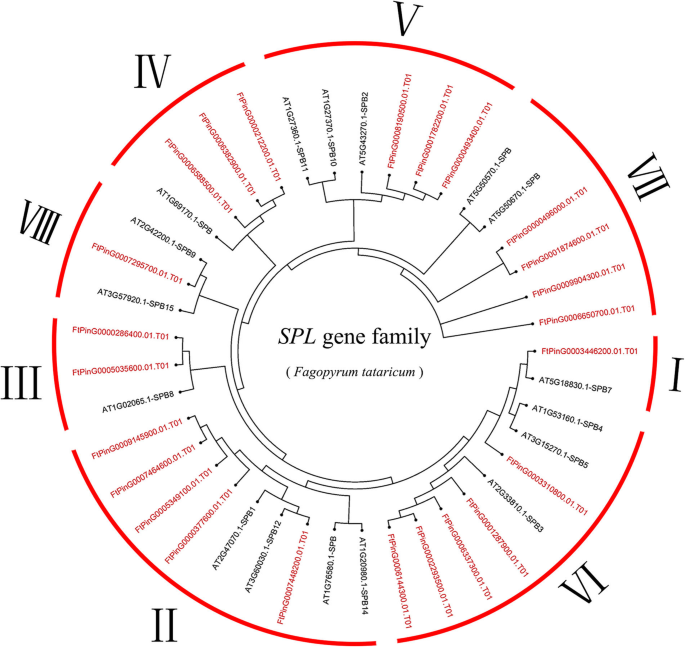
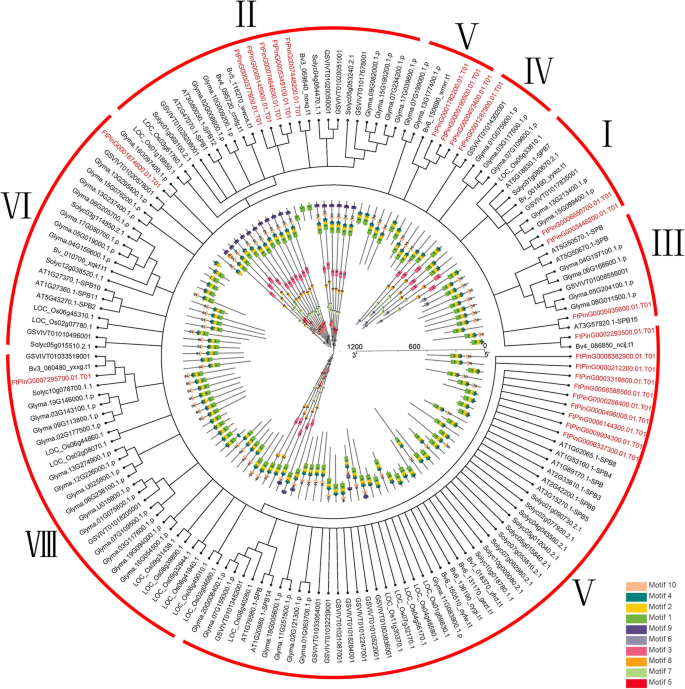
调查该系统的系统发育关系SPL鞑靼荞麦的基因,24个季后荞麦SPL基因和17答:芥SPL基因用于使用Mega 6.0软件构建邻接(N-J)系统发育树。从系统发育树上,我们看到了FTSPL.基因被分成八组七世(我)。只有一个成员在组我和组七苦荞麦,五名成员从鞑靼荞麦在第六组II和组,三个成员来自集团IV和V苦荞麦的两名成员从鞑靼荞麦在第三组,第七组有4个成员来自苦荞(图。1).
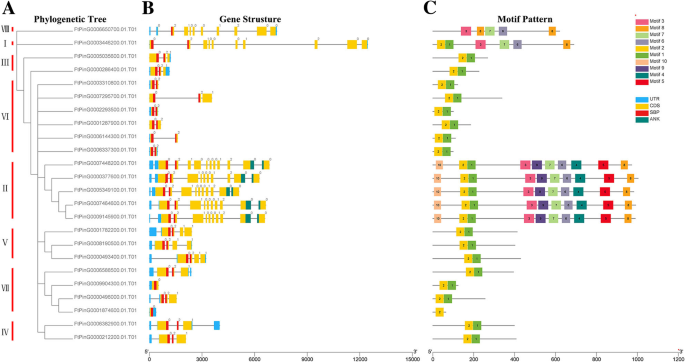
基因结构和基序组成FTSPL.基因家族
根据预测的全长FtSPL蛋白序列构建系统发育树,分析苦荞麦的结构多样性SPL这些蛋白质也被大致分为8个亚组(图2)。2).遗传结构的多样性可能是促进多烯家族的演变的机制。我们比较了外显子和内含子的数量和位置SPL鞑靼荞麦基因序列进一步探索了结构多样性FTSPL.基因。从图中2b,我们看到在第二组基因中含有最多的外显子,其中FtPinG0007448200.01含有11个外显子,而其他基因含有10个外显子。的FTSPL.VI组的所有基因都有两个外显子,是这些亚组中外显子数量最少的。一般来说,在同一亚群内的外显子数量是相似的,尽管外显子的位置不同。
进一步的分析表明,仅在所有FTSPL蛋白的N-末端和仅在第II组成员的C末端的保守ANK结构域中存在保守的SBP结构域(FTPY0007448200.01 / 377600.01 / 5349100.01 / 7464600.01 / 9145900.01)(图.2b).我们使用MEME软件检测整个序列的motif组成,包括所有FtSPL蛋白中的保守结构域,以探索每个蛋白中motif的多样性(图)。2c).在苦荞中共检测到10种不同的motifFTSPL.并命名为motif 1到motif 10。表S3列出了这10个motif的长度和序列。每个FtSPL蛋白的保守基序数为1 ~ 10。除FtPinG0006850700.01和FtPinG0001874600.01外,所有FtSPL蛋白均含有motif 1和motif 2,而II组的所有蛋白均含有motif。12个FtSPL蛋白只含有motif 1和motif 2, FtPinG0001874600.01只含有motif 2。总之,在系统发生树中,同一亚群的成员具有相似的基因结构和基序组成,并趋于聚集。
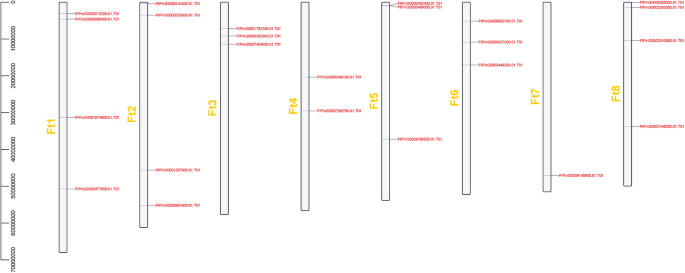
染色体分布,基因复制和同步分析FTSPL.基因
染色体映射FTSPL.使用最新的Tartary荞麦基因组数据库进行基因。共24个SPL在八个季后荞麦连杆基团(LGS)中,基因不均匀分布(图。3.).只有一个基因(FtPinG0009145900.01)在LG 7中。LG1,LG2和LG8中有四种基因,即最大的基因。
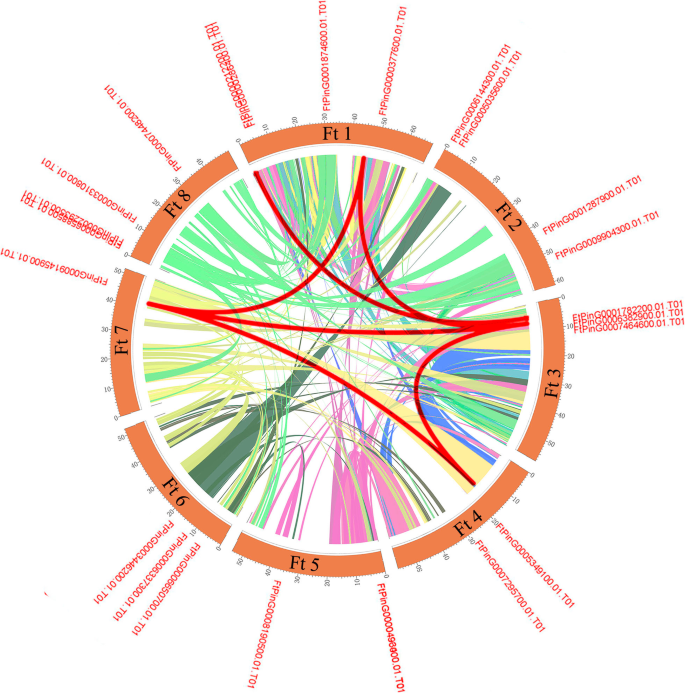
基因复制事件在新功能和基因扩张中发挥不可或缺的作用。因此,我们分析了重复事件SPL苦荞基因组中的基因。苦荞麦中没有串联重复事件SPL基因,但有6对节段重复(图。4).苦荞不同染色体上有许多同源基因,这支持了SPL基因家族的高度保守。综上所述,基于以上结果,有一些FTSPL.基因可能是由节段复制产生的,这些复制事件是基因复制的主要驱动力FTSPLS.进化。
进化分析FTSPL.基因和SPL几种不同种类的基因
的数量SPL在鞑靼荞麦中确定的基因与此相似丹参,苹果,玉米和大白菜米饭,但这五种的基因组大小非常不同(季后荞麦,516 MB;丹参, 641 Mb;苹果、742 Mb;玉米、2300 Mb;白菜米,485mb)。[21,23,25,28].这一结果表明,SPL家族基因的数量在不同物种的长期进化过程中相对稳定。
推断出进化关系SPL基因,对六分离植物进行系统发育树分析(答:芥,g·马克斯,B.vulgaris,S. lycopersicum.,诉酿酒用葡萄,和鞑靼荞麦)和单圈植物奥雅萨苜蓿.从图中5,我们看到SPL蛋白被系统发育树分为8个类群,其中第VI类群成员最多。在所有植物的SPL蛋白序列中共检测到10个保守motif(附加文件)3.表S2)。除了FtPinG0009145900.01,FTPing0007464600.01和ftping0005349100.01仅包含基序1,其他基因均包含基序1、2和4。在大多数样品中均发现了所有的保守基序SPL来自II组的其他植物的基因,而几个FTSPL.基因只包含基序1。总的来说,SPL同一组植物的基因有相似的基序组成(图。5).
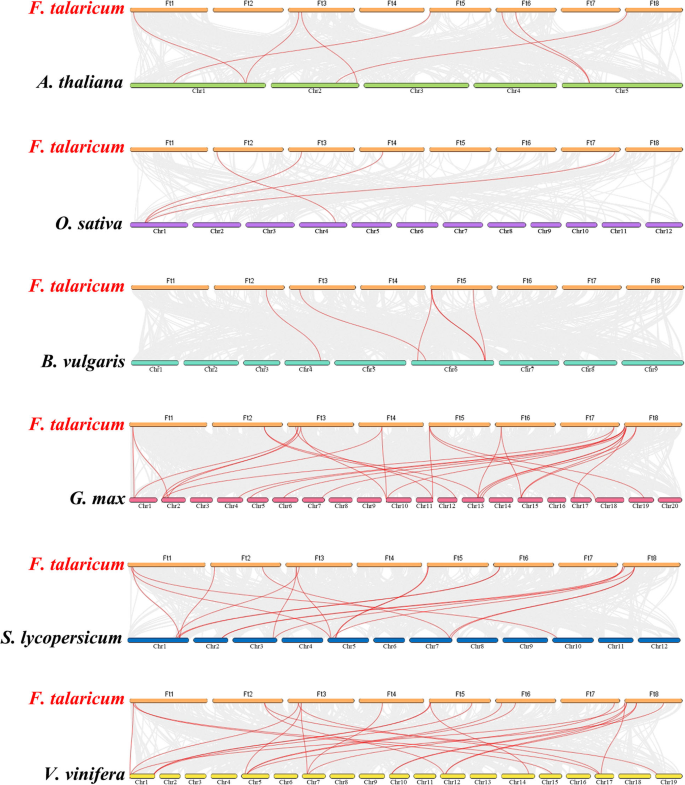
我们进行了共线分析SPL六种双子叶植物的基因(答:芥,B. vulgaris.,葡萄属植物和苦荞)和单子叶植物o .漂白亚麻纤维卷推测进化的起源SPL基因。的SPL季后荞麦基因对参考植物中的基因同源,并且观察到最高水平的同步守恒g·马克斯(除LG3,LG8,LG9,LG14,LG16和LG20)外,(分布在所有LG中都分布的28对原始基因对),诉酿酒用葡萄(24对同源基因分布在LG1、LG5、LG7、LG10、LG12、LG14、LG15、LG17、LG19)S. lycopersicum.(18对同源基因分布在LG1、LG2、LG3、LG5、LG7和LG10上)6).在共时分析中SPL鞑靼荞麦基因和大豆,ftping0006588500.01被发现与至少三个同位基因对有关,这表明ftping0006588500.01可能在SPL家族进化中扮演重要角色(附加文件4表S3)。总的来说,这些结果表明苦荞SPL基因家族具有高度的保守性SPL基因更接近g·马克斯基因比答:芥基因。的SPL基因可能是从不同植物的共同祖先进化而来的。
表达模式FTSPL.不同植物组织中的基因
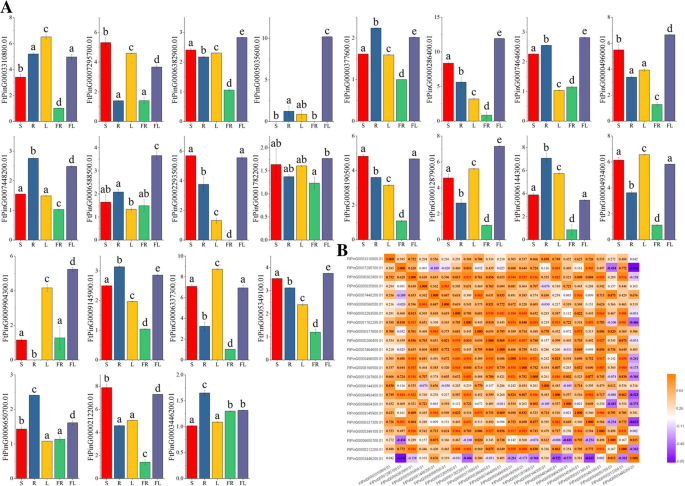
为进一步研究其生理功能SPL基因,我们测量了每个基因的表达模式SPL通过QRT-PCR测定的季耳荞麦的不同组织(根,茎,叶,花和水果)的基因。从实验结果来看,我们看到每个基因的表达模式在不同的组织中大大变化。其中,83.3%的基因(20基因)在所有组织中表达,10个基因(FTPing0000286400.01/5035600.01/1287900.01/496000.01/9904300.01/5349100.01/6588500.01/6382900.01/7464600.01/1782200.01)在花中表达量最高,其中3个基因(FtPinG0006337300.01/3310800.01/0493400.01叶(图。7).FTPing0005035600.01在茎和果实中没有表达,FtPinG0002293500.01并没有在水果中表现出来FtPinG0009904300.01没有在根中表达。此外,在所有测试组织中,10个基因具有相对高的表达水平,包括ftping0003310800.1.,ftping0000286400.1.,FtPinG0000496000.1,ftping0008190500.1.,FtPinG0001287900.1,FTPing0006144300.1.,FtPinG0000493400.1,FtPinG0006337300.1,FTPing0005349100.1., 和FtPinG0000212200.1.在所有的FTSPL.的基因,ftping0000286400.1.和FtPinG0006337300.1在大多数组织中表达水平最高,与ftping0000286400.1.在花、茎和根中比在其他组织中表达更多FtPinG0006337300.1在叶、茎和花中表达量高于其他组织。ftping0001874600.01未在所有组织中表达(图中未显示)。7),而表达水平ftping0001782200.01和FtPinG0003446200.01在所有组织中都很低。ftping0001782200.01主要在鲜花和茎中表达,FtPinG0003446200.01主要表现在根、花和果实中。
此外,我们分析了各种组织中不同基因的表达模式之间的相关性。从相关性分析中,我们看到大多数基因的表达模式呈正相关;例如,FtPinG0006382900.01,在花中表达最多,且与多个基因呈显著正相关(FtPinG0000212200.1/5349100.01/0493400.01/1287900.01/8190500.01/0496000.01./1782200.01) (图。7).
差异表达FTSPL.鞑靼荞麦果实开发期间的基因
鞑靼荞麦水果是一个重要的功能性食品。它在其蛋白质中具有平衡的氨基酸组成,具有高生物值[4].苦荞麦果实中粗纤维和维生素B含量也高于其他水果,苦荞麦中芦丁的含量也很高[29].Tarrary Buckwheat果实的生长和发育可能受到一些基因的调节,从而影响果实中营养物质的内容物。因此,我们可以系统地研究表达FTSPL.不同阶段的基因在水果发育(绿色果汁阶段,变色阶段和初始成熟期),发现一些可能调节果实生长和发育的基因。
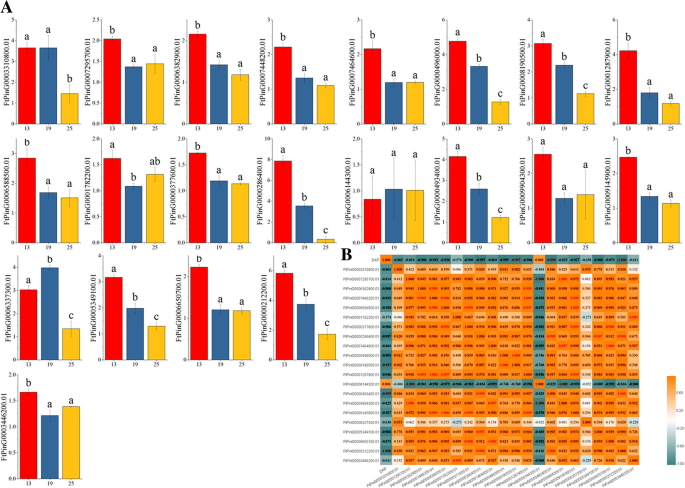
的表达模式FTSPL.不同发育阶段(青果期、变色期和初成熟期)的基因存在差异。在果实发育的各个阶段有21个基因表达。随着果实的发育,大多数基因的表达水平(ftping000638290.0.1、FtPinG0007448200.1、FtPinG0000496000.1、FtPinG0008190500.1、ftping000128790.0.1、FtPinG0006588500.1、ftping000037760.1、ftping000028640.1、ftping000049340.1、ftping000914590.1、FtPinG0005349100.1、和FtPinG0000212200.1)逐渐下降;三个基因的表达水平(FtPinG0003310800.1, FtPinG0006144300.1和FtPinG0006337300.1)在变色期最高,4个基因的表达量(FtPinG0007295700.1、FtPinG0001782200.1 FtPinG0009904300.1和FTPing0003446200.1.)在变色期的表达水平最低,另外两个基因(FtPinG0007464600.1和FtPinG0006650700.1)变色阶段后保持稳定(图。8).同时,我们研究了FTSPL.苦荞果实发育的基因表达模式及各基因在这一过程中的相关性。从结果来看,我们发现有三个基因(FtPinG0000212200.01 / FtPinG0008190500.01 / FtPinG0000493400.01)与水果发育显着呈负相关。大部分的FTSPL.基因表现出正相关。FtPinG0006382900.01显著正相关FtPinG0001287900.01和FtPinG0007448200.01, 尽管FtPinG0007295700.01显著正相关FtPinG0009904300.01,显著负相关FtPinG0006144300.01(无花果。8).
讨论
演变的SPL苦荞基因
SPL蛋白在植物发育的调节中起重要作用,例如水果成熟[14,30.],开花[31]和器官大小[32].的SPL基因家族已被隔离并从许多植物中识别,例如S. lycopersicum.(15名成员),答:芥(17人)诉酿酒用葡萄(18个成员)o .漂白亚麻纤维卷(19个成员)18,20.,33,34].探讨二者之间的同源性SPL基因答:芥而水稻,系统进化树显示SPL基因被分为9个亚组SPL矮牵牛花和答:芥被分为八个小组[33,35].24FTSPLS.在这项研究中确定的基因也被分为八个亚群答:芥;每组至少含有一种苦荞SPL基因和答:芥SPL基因(图。1).内含子的数量FTSPL.基因范围为0至10,并且每个亚组内的内含子和基序组合物的数量类似,其进一步支持系统发育树的分组(图。2).的FTSPL.基因在天耳其荞麦的8染色体上不均匀分布(图。3.).当同源的时候SPL对苦荞麦基因组中的基因进行分析,发现没有串联重复基因对,但发现了6对分段重复(图2)。4).在荞麦的不同染色体上存在这些同源基因的存在促进了促进的进化FTSPL.基因,允许数量SPL季节荞麦的基因大于其他双子叶植物(S. lycopersicum.,答:芥,诉酿酒用葡萄和o .漂白亚麻纤维卷).
为进一步研究其进化关系FTSPL.基因,我们构建了由六种分枝叶植物(Tartary Buckwheat,答:芥,G.Max,B.Vulgaris,S.Lycopersicum和诉酿酒用葡萄)和单子叶植物o .漂白亚麻纤维卷(无花果。5).我们从系统发育树中得到的信息是SPL来自不同植物的基因也被分为八组,其中苦荞属SPL基因分散在这八个组中。的FTSPL.与I组和VII组的基因聚类SPL基因G. Max,和SPL其他类群的基因被聚在一起SPL基因葡萄树,普通树和答:芥.同步分析也表明了FTSPLS.具有最多数量的同源基因对G. Max,V.Vinifera和其他双子叶植物。在分析术语的基序组合物时SPL结果表明,虽然各亚群的基序组成不同,但同一亚群内的基序组成相似,几乎所有植物的第二亚群成员都包含10个基序。这些结果表明SPL苦荞麦的基因与双子叶植物的基因关系密切,可能来自共同祖先。
表达模式和功能预测FTSPL.基因
目前,关于这方面的功能数据很少SPL苦荞基因。通常,基因的功能取决于其表达的存在,在很大程度上,基因的表达模式与基因的功能有关[35].转录因子通常在控制组织特异性基因的表达方面发挥关键作用[36,37,38].在本研究中,每一个的表达模式FTSPL.qRT-PCR检测,各基因在不同组织中的表达水平不同(图2)。7).大部分的FTSPL.基因在花中显着表达,类似于高表达水平SPL来自花序和花蕾的其他物种的基因[18,34].同一组中的一些基因表现出相似的表达谱;例如,VI组中的许多基因在花中表达量最高(FtPinG0006382900.01/ftping0006588500.01/FTPing0000286400.01/FtPinG0000496000.01/FtPinG0009904300.01),虽然群体中的基因(ftping0006650700.01/FTPing0003446200。
01.)及第二组(FtPinG0000377600.01/FtPinG0007448200.01/FtPinG0009145900)在根中高度表达(图。7).此外,FtPinG0006382900.01VI组与基因呈显著正相关(ftping0005349100.01/FtPinG0000496000.01),在同一组的花中高度表达。在答:芥的转录水平SPL15.基因在开发过程中增加,优先在幼花中出现。而且,SPL15呈正常调节从幼年相到成人阶段的转化答:芥并对叶片产生负面调节答:芥[39].FTPing0005035600.01来自III组是一种同源基因A. Thaliana SPL15(atspl15),从图中可以看出它。5那FTPing0005035600.01和atspl15也有类似的主题,FTPing0005035600.01包含图案1,2,4和和atspl15包含主题1,2,4和10。与此同时,FTPing0005035600.01仅在鲜花,根和叶中表达,在花中具有非常高的表达,在叶子中表达得非常低(图。5,无花果。7).同源基因可能具有相似的功能,所以在未来的研究中,我们可以验证是否FTPing0005035600.01具有与之相同的功能atspl15通过进一步的实验。AtSPL3主要表达于花序和过度表达AtSPL3不仅促进开花,而且在长时间的日照和连续光照下导致花和花序发育异常[15,40].有许多AtSPL3苦荞麦VI组同源基因(FtPinG0009904300.01 / FtPinG0000496000.01,等。)它们在鲜花中高度表达。在未来的研究中,我们可以验证这些基因是否(FtPinG0009904300.01 / FtPinG0000496000.01,等。)具有相同的功能AtSPL3通过更深入的实验。
苦荞具有很高的营养价值,其果实中富含芦丁,芦丁具有抗氧化活性[4,29].Tartary Buckwheat的增长和发展将受到许多转录因子的调节[38,41,42,43,44].通过转录因子的急性荞麦生长和发展的调节将直接影响季后荞麦的营养含量[45,46].苦荞作为苦荞的主要食用部分,果实的生长发育过程尤为重要。因此,表达式配置文件FTSPL.苦荞果实不同发育阶段(青果期、变色期和初成熟期)的基因可以为筛选调控果实生长发育的潜在基因奠定基础。通过qRT-PCR检测,21FTSPL.在果实发育阶段,基因以不同的模式表达。8),表示FTSPL.基因在果实生长发育中可能发挥不同的作用。SPL基因在植物水果的发展和成熟中发挥着重要作用,例如AtSPL10,这会影响果荚的长度,而在水稻中,OsSPL16可控制晶粒尺寸、形状和质量[14,47].在进化分析中FTSPL.基因,发现FTPing0007295700.01和OsSPL16(LOC_OS08g41940.1)属于第VII组,它们具有相同的母题组成(母题1、2、4、10)(图。5).前人研究表明,绿果期是苦荞麦果实大小确定的时间,表达水平FTPing0007295700.01青果期最高。8).因此,在未来的研究中,我们可以验证是否FTPing0007295700.01也可以调节水果尺寸OsSPL16通过进一步更深入的实验[48].LESPL-CNR.(Solyc02g077920.2.1)是控制番茄果实成熟的关键基因。启动子区表观遗传变异LESPL-CNR.影响类胡萝卜素的生物合成和细胞壁结构,从而抑制果实的正常成熟[30.,49].LESPL-CNR.和苦荞麦SPL基因在VI组中聚集,其中FtPinG00063829.00.01、FtPinG0000212200.01、FtPinG0006588500.01和FtPinG0000286400.01有相同的主题构成LESPL-CNR.,这些FTSPL.基因在花中也高度表达。5,无花果。7).在这些实验结果的基础上,给出了它们的具体功能FTSPL.可以通过未来进一步的实验验证基因。
结论
这些结果是第一次全基因组分析SPL苦荞的基因家族。
我们综合分析了24个假定FTSPL.基因,包括其基因结构、保守基序、基因复制、进化关系和时空表达模式,这些可能与基因的生物学功能有关.系统发育树将人类分为两类FTSPL.基因分为八组,每个基因具有类似的基序组合物和基因结构。这些表达模式FTSPL.不同组织中的基因表明这些FTSPL.基因可能调控苦荞的生长发育。本文的研究为今后进一步阐述其潜在功能奠定了基础FTSPL.苦荞生长发育的基因研究。
方法
植物材料
本研究中使用的Tarrary荞麦面(西樵)是从西昌大学王安野教授的要求。这些材料被种植在四川省农业大学生命科学学院的实验领域(拉特。29°97'n,102°97'e,Alt。580米),四川雅安,中国。单独收集包括花朵,包括鲜花的样品,从三(授粉,DAP,DAP,DAP)不同发育果阶段以及茎,根和叶片,叶片,根和叶片的成熟荞麦片迅速进入液氮并储存- 80°C以进一步使用。
识别的SPL苦荞基因
苦荞基因组从苦荞基因组计划(TBGP;http://www.mbkbase.org/Pinku1/).最多的SPL通过两个BLASTP方法从季耳荞麦基因组中筛选基因,以及对应于SBP域的隐马尔可夫模型(HMM)分布(PF03110)从PFAM蛋白家庭数据库下载(http://pfam.xfam.org/).详细的方法如下:我们下载了中所有SPL蛋白的氨基酸序列答:芥来自Tair库,范围从131AA到1035AA。我们确定了所有类似的SPL苦荞基因基因组利用SPL基因序列答:芥作为目标。之后,我们分析了保守的领域FTSPL.去掉不含SBP保守结构域的基因,最终从苦荞基因组中筛选出24个含有SBP保守结构域的基因。的pi, mv和亚细胞定位FTSPL.基因分析在ExPASy网站(https://web.expasy.org/compute_pi/).
系统发育分析和内含子-外显子结构测定
SPL蛋白序列(答:芥,B. vulgaris.,g·马克斯,S. lycopersicum.,诉酿酒用葡萄和o .漂白亚麻纤维卷)的N-J系统发育树从UniProt数据库下载(https:/)www.uniprot.org).多个氨基酸序列的鉴定SPL使用Clustalx1.81程序对齐基因。Phylo到期的树木比较Tartary荞麦和多种物种(答:芥,B. vulgaris.,g·马克斯,S. lycopersicum.,诉酿酒用葡萄和o .漂白亚麻纤维卷)由NJ方法构建,具体参数是泊松模型和1000个引导复制。Phylo到期的树木比较Tartary Buckwheat和答:芥通过N-J方法和上述参数也与Mega 7.0构造。从鞑靼荞麦和答:芥在构建系统发育树前,利用Clustalx1.81程序进行序列比对。此外,网上基因结构展示服务(http://gsds.cbi.pku.edu.cn)用于通过比较CDNA来预测内含子结构FTSPL.具有相应基因组DNA序列的基因通过MEME在线程序(http:/)测定FtSPL蛋白中的保守基序meme.nbcr.net/meme/intro.html.),参数设定为6至200的最佳模式宽度,最大数量为10。
染色体分布和基因重复FTSPL.基因
映射方法FTSPL.根据Liu et al.的研究,对苦荞染色体的基因进行了研究[50].的分析FTSPL.使用多个共线扫描工具包进行基因复制事件(MCSCanx)。之间的同步关系FTSPL.基因和SPL来自所选植物的基因是通过使用双相曲培尔特软件来确定的(https://github.com/CJ-Chen/TBtools).
表达分析FtAP2 /小块土地real-time PCR检测基因
QRT-PCR引物设计有引物3软件(http://frodo.wi.mit.edu/)(附加文件5表S4)。引物的设计标准如下:PCR产物长度范围为100至200,GC含量为50-60%,选择62℃至67℃的引物熔化温度。使用Tarrary Buckwheat组蛋白H3基因作为内部参考基因,SybR预混物ExTaq II(Takara)用于进行QRT-PCR [50].每个实验至少重复三次,并通过2分析数据−(∆∆Ct)方法(51].
统计分析
通过使用Origin Pro 2018B(OriginLab Corporation,Massachusetts,USA)统计程序分析的所有数据进行分析,并通过最低差异测定(LSD),在0.05和0.01的显着差异测试(LSD)进行比较。
数据和材料的可用性
苦荞麦基因组序列用于鉴定AP2 /小块土地本研究的基因定位于苦荞基因组计划(TBGP;http://www.mbkbase.org/Pinku1/).实验所用苦荞麦材料由西昌大学王安虎教授提供。支持本文结论的数据集包括在本文及其附加文件中。
缩写
- 答:芥:
-
拟南芥
- 阿巴:
-
脱盐酸
- B. vulgaris.:
-
甜菜属
- c .建立:
-
甜椒l
- cd:
-
编码序列
- DAP:
-
授粉后的几天
- 英国《金融时报》:
-
Fagopyrum tataricum
- FTSPL:
-
Fagopyrum tataricumSPL
- g·马克斯:
-
大豆
- 嗯:
-
隐马尔可夫模型
- 格林:
-
连锁群
- 迷幻药:
-
最不重要的差异
- M. Domestica.:
-
马吕斯有明显Borkh.
- MVs:
-
分子量
- NLS:
-
本地化信号
- o .漂白亚麻纤维卷:
-
奥雅萨苜蓿
- PIS:
-
等电点
- 存在:
-
定量实时聚合酶链反应
- R. Communis.李:
-
里纳斯市政府l
- S. lycopersicum.:
-
Solanum lycopersicum
- S. Miltiorrhiza:
-
丹参
- SQ-UA:
-
SQUAMOSA
- TBGP:
-
苦荞基因组计划
- TFs:
-
转录因子
- 诉酿酒用葡萄:
-
葡萄
- z梅斯:
-
玉米l
参考
- 1.
金荞麦属(蓼科)二新种,云南金荞麦属(金荞麦属)。中国科学(d辑:地球科学)2002;
- 2.
Anton B,谢尔盖N,Dmitry A,Gurevich AA,Mikhail D,Kulikov As,Lesin VM,Nikolenko Si,Son P,Prjibelski广告。黑桃:一种新的基因组装配算法及其在单细胞排序的应用。j计算biol。2012; 19(5):455-77。
- 3.
荞麦(Fagopyrum esculentum Moench)的化学成分和蛋白质品质。植物营养学报。1980;30(3-4):175-9。
- 4.
普通荞麦和苦荞麦麸皮的组成及工艺特性。食品化学。2003;80(1):15。
- 5.
关键词:苦荞麦;芦丁;槲皮素;食品功能。2013;4(5):794 - 802。
- 6.
张文楠,张文文,张旭东,黄庆芳,李铁宁。施用多效唑对半干旱区玉米根系形态和生理特性的影响。Sci众议员2018;8(1):4818 - 33所示。
- 7。
刘M,MA Z,Zheng T,Wang J,Huang L,Sun W,Zhang Y,Jin W,Zhan J,Cai Y等。蟾蜍素和脱落酸平衡和FTARF2在Tarrary荞麦果的最终尺寸测定中的潜在作用。int j mol sci。2018; 19(9):2755-74。
- 8。
Huijser P,Klein J,Lönnig,我们,Meijer H,Saedler H,Sommer H.Bracteomania,花序异常,是由疯子箱基因Squamosa在Antirrhinummus的功能丧失引起的。Embo J. 1992; 11(4):1239-49。
- 9。
Klein J,Saedler HP。新的DNA结合蛋白质包括Antrirhinum jajus花卉营商标识基因Squamosa的推定转录调节剂。Mol Gen Genet MGG。1996年; 250(1):7-16。
- 10。
Birkenbihl R,Jach G,Saedler H,Huijser P.植物特异性SBP结构域的功能解剖:DNA结合和核定位域重叠。J Mol Biol。2005; 352(3):585-96。
- 11.
Kazuhiko Y,Takanori K,Makoto I,Masaru T,Tomoko Y,Takashi Y,Masaaki A,Eiko S,Takayoshi M,Emi N.一种新的ZinC结合图案,通过拟南芥DNA结合域的溶液结构揭示了拟南芥SBP-Family转录因子。J Mol Biol。2004; 337(1):49-63。
- 12.
贾伟W,本杰明C,Detlef W.Mir156调节的SPL转录因子在拟南芥中定义内源性开花途径。细胞。2009; 138(4):738-49。
- 13.
王勇,胡宗立,杨应祥,陈晓强,陈桂平。水稻SBP-box基因家族的生物信息学分析。中国生物信息学杂志。2011;9(1):82-71。
- 14.
Masahito S,Tomotsugu K,Nobutaka M,Masaru Ot。拟南芥SBP-Box基因SPL10,SPL11和SPL2对生殖阶段芽成熟的形态变化。植物和细胞生理学。2009; 50(12):2133-45。
- 15.
Gandikota M,Birkenbihl Rp,Höhmanns,Cardon GH,Saedler H,Huijser P.拟南芥SBP Box基因SPL3的3'UTR中的miRNA156 / 157识别元素可防止在幼苗中的翻译抑制早期开花。工厂J.2010; 49(4):683-93。
- 16.
徐敏,胡涛,赵建军,杨磊。拟南芥mir156调控的SQUAMOSA启动子结合蛋白样蛋白(SPL)基因的发育功能。公共科学图书馆麝猫。2016;12 (8):e1006263 - 92。
- 17.
Cardon G,HöhmannS,Klein J,Nettesheim K,Saedler H,Huijser P. Arabidopsis SBP-Box基因的分子表征。基因。1999; 237(1):91-104。
- 18。
关键词:番茄,转录因子,SBP-box,基因组,系统发育,差异表达足底。2012;235(6):1171 - 84。
- 19。
关键词:大豆,SPL家族,基因组,系统发育,表达谱发展基因与进化。2017;227(2):1-19。
- 20.
洪明H,6月L,Min G,歌手SD,Hao W,临沂M,Zhangjun F,西平W.基因组组织,系统发育比较和SBP-Box家族基因葡萄的鉴别表达。Plos一个。2013; 8(3):E59358-73。
- 21.
李杰,侯H,李X,Xiang J,Yin X,Gao H,Zheng Y,Bassett Cl,王X.基因组识别与苹果SBP-Box家族基因的鉴定与分析(Malus×Diewsa Borkh。)。植物理性生物化学。2013; 70:100-14。
- 22.
张SD,Ling LZ。蓖麻籽中SBP箱基因家族的基因组鉴定及进化分析。Plos一个。2014; 9(1):E86688-94。
- 23.
毛海涛,于丽娟,李志军,严艳,韩锐,刘辉,马明。玉米SPL家族转录因子的全基因组分析及其对非生物胁迫的响应。植物基因。2016;6 (C): 1 - 12。
- 24.
张海霞,金建华,何玉梅,卢斌,李德伟,柴卫国,可汗阿,龚振华。辣椒疫霉SBP-box家族基因的全基因组鉴定与分析。植物学报,2016;7(151):504-18。
- 25.
张林苏,张德刚,李彩丽,刘凤娟。丹参SPL基因家族的全基因组分析和分子分析。acta botanica yunnanica(云南植物研究). 2014;56(1):38-50。
- 26.
Takeshi U,Gorou H,Satoshi Y,Hirokazu T.拟南芥的越来越小的细胞突变体识别对偏异毛囊控制中的Squamosa启动子结合蛋白质样基因的新作用。发展。2009; 136(6):955-64。
- 27。
6 .吴国华,吴国华。拟南芥miR156及其靶基因SPL3对拟南芥幼苗发育的调控。发展。2006;133(18):3539 - 47。
- 28。
华伟T,小明S,Wei-ke D,Yan W,Xi-Lin H.大白菜SBP-Box基因家族的基因组宽分析(Brassica Rapa Subsp.Pekinensis)。基因组/国家研究委员会加拿大= GE?NOME / CONSEIL National De Recherches Canada。2015; 58(11):463-77。
- 29。
苦荞麦(Fagopyrum tataricum Gaertn.)作为膳食中芦丁和槲皮苷的来源。农业与食品化学。2003;51(22):6452-5。
- 30.
Kenneth M,Mahmut Tr,Mervin P,Yiguo H,Thompson Aj,King GJ,Giovannoni JJ,Seymour GB。在编码SBP箱转录因子的基因中的天然存在的表观遗传突变抑制了番茄果实成熟。NAT Genet。2006; 38(8):948-52。
- 31.
Cardon GH,H?Hmann S,。,Nettesheim K,。,Saedler H,。,Huijser P,。拟南芥SBP-Box基因SPL3的功能分析:参与花卉过渡的新基因。工厂J 2010,12(2):367-377。
- 32。
6 .吴刚,王金文,王金文,魏格尔。miR156和miR172对拟南芥发育时间的调控作用。细胞。2009;138(4):750 - 9。
- 33。
杨志强,王旭,顾胜,胡志强,徐华,徐超。拟南芥和水稻SBP-box基因家族的比较研究。基因。2008;407(1):1 - 11。
- 34。
Kabin X,康庆W,Lizhong X.基因组组织,差异表达和Squamosa启动子结合转录因子和MicroRNA156在水稻中的相互作用。植物理性。2006; 142(1):280-93。
- 35。
周Q,张某,陈F,刘B,吴L,李F,张继,宝M,刘G.蚕豆SBP-Box基因家族的基因组综合征与表征。BMC基因组学。2018; 19(2):193-211。
- 36.
Ingraham Ha,Chen R,Mangalam Hj,Elsholtz HP,Flynn Se,Lin Cr,Simmons DM,Swanson L,Rosenfeld Mg。含有同种域的组织特异性转录因子规定了垂体表型。细胞。1988; 55(3):519-29。
- 37.
F J N,C M S,M J T.通过新型螺旋螺旋 - 螺旋转录因子进行胰岛素基因的组织特异性调节。基因开发。1995; 9(8):1009-19。
- 38.
CLEVENTEDE,Overdier DG,TAO W,。,Qian X,。,PANI L,。,LAI e,。,Costa RH:鉴定肝细胞核因子3 /叉头DNA结合结构域的九种组织特异性转录因子家庭。1993,90(9):3948-3952 Proc Natl Acad SCI U S。
- 39.
Schwarz S,Grande Av,Bujdoso N,Saedler H,Huijser P. MicroRNA调节的SBP-Box基因SPL9和SPL15对照拟南芥中的测量成熟。植物mol biol。2008; 67(1-2):183-95。
- 40.
subosa Y, Sato H, Tachimori Y, Hokamura N, Hosokawa M, Kinoshita Y, Daiko H, Udagawa H, Ueno M, Seto Y.拟南芥SBP-box基因SPL3的功能分析:一个参与花的转变的新基因。植物j . 2010; 12(2): 367 - 77。
- 41.
高飞,周军,邓瑞英,赵洪霞,李春林,陈辉,Suzuki T, Park SU,吴强。转基因拟南芥中苦荞麦r2r2 - myb转录因子基因FtMYB9的过表达增强对干旱和盐胁迫的耐受性。植物生理学报。2017;32(4):491 - 497。
- 42.
姚PF,李克,赵XR,李米,赵劲宫,郭jy,蔡y,陈h,吴q.急性荞麦基因,ftbhlh3,增强转基因拟南芥中的干旱/氧化应激耐受性。前植物SCI。2017; 8:625-42。
- 43.
罗晓霞,赵辉,姚鹏,李强,黄勇,李超,陈辉,吴庆安。R2R3-MYB转录因子FtMYB15在苦荞麦花青素和原花青素合成中的作用。植物生长规律。2017;37(1):1 - 9。
- 44.
高飞,赵海霞,姚海平,李春林,陈辉,王阿,Park SU,吴强。苦荞麦(Fagopyrum tataricum)逆境相关R2R3 - MYB基因的鉴定、分离和表达分析。植物学报2016;35(6):1385-96。
- 45.
白永春,李春林,张建文,李淑娟,罗小平,姚海平,陈辉,赵红霞,朴苏,吴强。两种苦荞R2R3-MYB转录因子的特性及其对原花青素合成的调控。杂志。2014;152(3):431 - 40。
- 46.
赵海霞,吴晓芳,白永春,李春林,陈辉,邵瑞君,吴强。苦荞麦萌发过程中类黄酮合成途径关键酶和MYB转录因子的基因表达分析。农业生物技术学报。2012;20(2):121-8。
- 47.
王胜,吴科,袁强,刘旭,刘智,林旭,曾锐,朱华,董刚,钱强。OsSPL16对水稻籽粒大小、形状和品质的控制。Nat麝猫。2012;44(8):950 - 4。
- 48.
刘敏,马智,郑涛,孙伟,张勇,金伟,詹杰,蔡勇,唐勇,吴强。苦荞生理变化与种子发育相关性的研究。.BMC基因组学。2018;19(1):648 - 68。
- 49.
陈无,孔杰,赖特,曼宁k,吴c,王y,qin c,李b,yu z,张x。调整Lespl-cnr表达式由slymir157影响番茄果实成熟。SCI REP。2015; 5:7852-8。
- 50.
刘米,马Z,王A,郑T,黄l,太阳,张y,金w,zhan j,cai y等。天竺葵抗果实(Fagopyrum Tataricum)中的基因组响应因子基因家族。int j mol sci。2018; 19(11):3526-44。
- 51.
Livak KJ, Schmittgen TD。使用实时定量PCR和2 - ΔΔ C - T方法分析相对基因表达数据。方法——酶学方法的伴侣。2001;25(4):402-8。
致谢
我们感谢实验室所有同仁提供的有益讨论和技术援助。我们非常感谢编辑和审稿人对稿件的批判性评价,并为其改进提供建设性意见。
资金
国家自然科学基金项目(no . 31500289);国家重点研发计划项目(no . 2018YFD1000706)。资金被用于研究的设计、数据的收集、分析和解释、手稿的撰写以及开放获取支付。
作者信息
从属关系
贡献
m.y.l策划设计研究,分析数据。w - j。s写了手稿。W.-J.S Z.-T.M。,L.H Q.W, Z.-Z.T, T.-L.B, C.-L.L.进行了实验。H.C.监督了这项研究。m - y - l和w - j . s平分。所有作者阅读并批准了最终的手稿。
通讯作者
道德声明
伦理批准和同意参与
实验所用苦荞麦材料由西昌大学王安虎教授提供。这些植物材料在世界各地广泛使用,采集植物样品不需要许可证。植物材料按照中国四川农业大学生命科学学院的制度指导方针进行维护。本文不包含任何与人类或动物的研究,也不涉及任何濒危或保护物种。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
刘敏,孙伟,马泽。et al。全基因组鉴定SPL鞑靼荞麦的基因家庭(Fagopyrum tataricum)果实开发阶段期间的表达分析。BMC植物杂志19,299(2019)。https://doi.org/10.1186/s12870-019-1916-6
已收到:
接受:
发表:
关键字
- 苦荞麦
- FTSPL.
- 基因组
- 水果开发
- 表达模式