摘要
背景
核和细胞素基因组之间的互核组基因转移(IGT)是植物演化期间的常见现象。Gossypium是一个有用的模型来评估IGT对二倍体和多倍体物种的基因组结果。在这里,我们探索了四个棉花物种的核,线粒体和质体基因组间的IGT,包括两个异源多倍体及其模型二倍体祖(基因组捐赠者,G. Arboreum.:一个2和g . raimondii就: D5.).
结果
二倍体和同种异体中的棉花存在广泛的IGT事件(Gossypium),核基因组是转移DNA的主要接受者,其次是线粒体基因组。核基因组整合的外来序列比线粒体基因组的总长度多100倍。在细胞核中,叶绿体DNA (cpDNA)的整合长度是线粒体DNA (mtDNA)的1.87倍(二倍体)到近4倍(异源多倍体)。在线粒体中,核DNA (nuDNA)的长度通常是cpDNA的3倍。Gossypium线粒体基因组整合了3个核反转座子和8个叶绿体tRNA基因,并在二倍体和异源多倍体形成之前整合了叶绿体DNA。线粒体叶绿体- trna基因在远亲属的插入位点两侧存在2-6 bp的保守微同源性,4种棉花线粒体叶绿体- trna基因在远亲属的插入位点两侧存在10 bp的保守微同源性。对于细胞器DNA序列,有来源热点,如atp6-trnw.线粒体中的代苯基和叶绿体中的反相的重复区域。细胞核中的细胞细胞DNA很少表达,并且在低水平下。令人惊讶的是,随着大多数人的祖先插入祖先插入的生存时,存在不对称numts(核线粒体插入)腐烂或丢失而最多nupts(核质体插入)被保留。
结论
本研究对两种栽培的异源多倍体及其祖先二倍体棉花的细胞核和细胞器基因组间的细胞内转移进行了特征和比较。在异源多倍体棉花中发现了IGTs命运的惊人不对称性numts优先丢失的相对于nupts。我们的研究结果将基因组间基因转移与异源四倍体联系起来,并为细胞内基因组进化提供了新的见解。
背景
原核α-变形菌和蓝藻菌被认为是现代真核线粒体的前身[1]和叶绿体[2那3.就像内共生理论所描述的那样。从内共生体到细胞器的转化伴随着大量的DNA在细胞内基因组间的转移,或基因组间基因转移(IGT)。虽然IGT的速度自真核生物形成以来已经大大放缓,但它仍然是植物核和细胞器基因组进化的共同特征[4.].在植物细胞中的三种类型的基因组中,存在六种可能的基因转移方向。IGT最突出的方向来自细胞细胞基因组进入核基因组[2那4.那5.那6.那7.那8.那9.那10那11那12那13那14那15那16那17那18那19那20.那21那22那23那24那25],然后从核和质体基因组进入线粒体基因组[2那26那27那28那29那30.那31那32那33那34那35那36那37那38].胞间转移到高度紧密质体基因组的情况似乎相当罕见[39那40那41那42那43]。
最近的研究表明,植物线粒体基因组经常整合来自其他两个细胞室的DNA。随着植物线粒体基因组测序数量的增加[27那29那39那42那44那45那46那47那48那49那50那51那52那53那54那55那56那57那58那59那60那61],从叶绿体中整合的程度[28那30.那32那62那63和核基因组[33那60那62]变得更加明显。通常,植物线粒体基因组在0.56%之间(Marchantia polymorpha) - 10.85% (Phoenix Dactylifera)质体衍生序列[9.那10那34].核序列整合往往更丰富,也更难以识别,因为这些通常包括逆转录转座子和其他重复片段[28那31那33那55].
来自线粒体和可塑基因组的核组成部分被称为numts[19),nupts[4.],这些统称为norgnas [14或核细胞器dna。环境压力已被证明会增加植物细胞器DNA进入细胞核的数量[8.],插入通常发生在开放染色质区域[12].虽然Norgdnas通常被认为是不活跃的,但在植物物种中有一些证据表明Norgdna转录,包括稻米[11]和棉花[64].
虽然IGT与基因组进化的广泛问题有关,但由于其可能与植物生育的关系,IGT承担了额外的重要性[65那66那67那68].重复的IGT转移可以在线粒体基因组内产生同源区域,为胞内重组提供热点。有丝分裂基因组重组是一种常见现象,可能产生新的嵌合序列[69那70那71那72].这些新的嵌合序列可能与相邻功能基因共转录[73那74那75],进而影响或干扰线粒体电子传递链通路[76那77].此外,被称为细胞质雄性不育的现象受到核室和线粒体室以及它们之间的相互作用的影响[65].因此,提高我们对IGT的理解可能有助于了解利用植物育性差异的育种策略,例如在雄性不育方面发展杂种。
属Gossypium约有50个品种[78那79那80,其中有四种已经被驯化,目前正在培育它们的种子毛状体或棉纤维。这些驯化的物种中有两个属于7个现存的异源多倍体物种(AD基因组)的分支,这些异源多倍体物种形成于大约1-2百万年前(Mya),当时是一个a基因组二倍体(类似现代)G. Arboreum.,一个2或g . herbaceum一种1用D-基因组物种杂交(类似于现代化的g . raimondii就D5.)随后在染色体数字翻番[79那81].高质量的核基因组集合最近已成为二倍体可用g . raimondii就[64那82),G. Arboreum.[83,以及异源多倍体g .分子[84那85那86),g .取得[86那87那88].在二倍体和异源多倍体棉花物种中也存在多个细胞器基因组序列[60那61那63那65那89那90那91那92那93].这些基因组数据为发现和描述IGT事件提供了基础Gossypium.
在这里,我们分析了四种棉质种类内的核和细胞细胞基因组的细胞内转移,包括两种培养的海域(Ad Genome)和他们的祖传二倍体(A,D)基因组供体的模型,以探讨IgT在棉花中的患病率(Gossypium).我们表征并比较了六种可能类IGT事件的频率,以及细胞间序列的源和尺寸。我们在Allopolyploid棉花的IgTs命运中报告了一个醒目的不对称,numts优先丢失的相对于nupts。最后,我们探讨了norgnas的表达。
结果
基因组间基因转移概况Gossypium
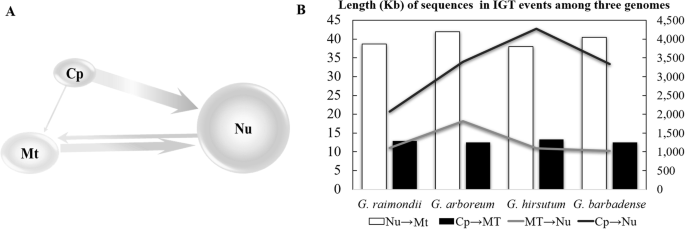
我们筛选了四个棉花品种、两个多倍体及其模型二倍体祖的核、线粒体和叶绿体基因组1),用于IGT事件的证据。如预期的那样,大多数检测到的IgTS涉及四种可能的IGT事件中的四种可能的IGT事件:核 - 对线粒体,叶绿体 - 对线粒体,线粒体 - 核和叶绿体 - 核(图。1a).我们没有在四种棉花的叶绿体中检测到核或线粒体插入。
在四个被调查的棉花品种中,细胞核整合片段的长度通常是线粒体整合片段的100倍。核整合体的大小从1028 kb到4276 kb不等,而线粒体整合体的大小从13 kb到42 kb不等。1b,表1).线粒体的核插入长度通常是叶绿体插入长度的3倍(40 kb vs 13 kb;桌子1)和叶绿体插入细胞核(nupts)是线粒体插入量的2至4倍(numts).除了G. Arboreum.那numt种间长度大致相等(图。1b),而uhereasnupt长度变化大约两倍(从2072 kbg . raimondii就到4276 kbg .分子;桌子1).有趣的是,比率nupt来numt对于二倍体棉花种类和近似的两倍(平均3.58)为1.87,用于两种同种异体一体化棉花种类(表1).
线粒体整合对核重复是可变的,对叶绿体tRNA基因是保守的
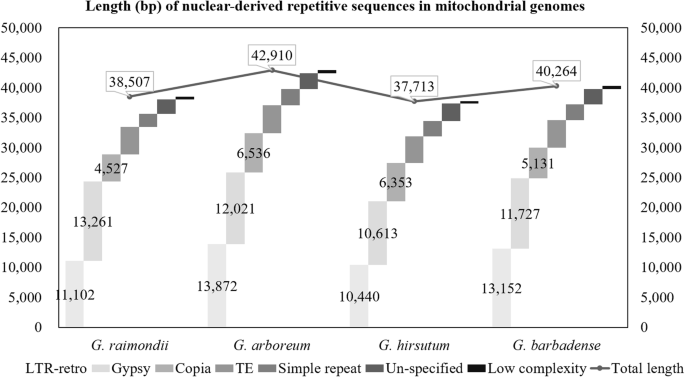
重复序列对各种种子植物的毒蛛常见,包括单子叶植物奥雅萨苜蓿[55]和eudicots拟南芥[33],Cucumis梅洛[31],Cucumis sativus[28),Gossypium物种(60那91].长终端重复(LTR)回收(LTR-复古)通常包括植物核重复的最大组成部分[94那95,它们通常对核和线粒体基因组的大小有主要影响[96那97那98那99].在这里,我们鉴定了所有四种棉质物种的线粒体基因组中的核衍生重复。核衍生的重复的总长度(对于所有重复等级)的总长度范围为37.7 kBg .分子线粒体基因组超过42.9 kbG. Arboreum.(无花果。2),表明同源重复序列占棉花线粒体基因组的5.64 - 6.24%。这些重复的实验被分成7类:Copia那吉普赛、低复杂性、未分类的长末端重复逆转录转座子(LTR-retro)、简单重复、可转座子(TE)和未分类的(图4)2).这里,Copia和吉普赛表示将一般LTR-retro(第1类)转座因子进一步划分为它们的两个主要类[One hundred.].每一类(基于元素丰度)的排序几乎相同的每个物种,未分类的LTR-retro和吉普赛在所有四种物种中贡献最大序列的元素(图。2);然而,每个纲的总序列长度在不同种之间存在一定的差异,导致上述总核衍生重复长度的差异约为5 kb。无论是重复序列总量还是每个重复类的序列长度都没有显示出倍性偏倚的证据。
除了包含核重复,植物有丝分裂基因组中类似叶绿体的tRNA基因的存在已经被描述[27那34那65].在我们之前的研究中,我们鉴定了8个叶绿体衍生的tRNA基因(TRND.那trnh.那TNM.那Trnn.那TRNP.那TRNS.那trnv.和trnw.)在所有四种棉花的有丝染色体组中[65].这些基因在棉花系统发育过程中分散的物种中存在,可能表明它们的转移发生在一个共同的祖先中,并被保存了下来。为了评估这一提示历史,我们使用两个叶绿体来源的tRNA基因(trnh.和TRND.)作为例子。对于这两个基因,我们发现在四种棉质物种中共用了在插入的上游和下游的10bp(图。3.).当我们将植物物种的数量扩大到包括不同的被子植物时,我们发现了这两个基因插入位点两侧共享的2-6 bp微同源性(图。3.).
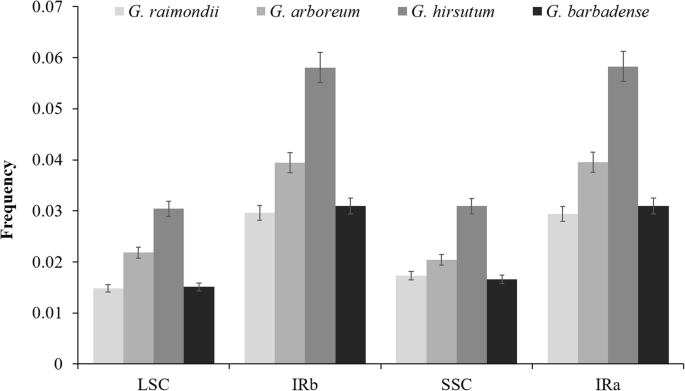
此外,我们评估了核和叶绿体衍生序列对26种土壤植物的总体色素基因组大小的贡献。虽然核和叶绿体序列都有助于促滤菌膨胀,但促毒性或促丝瘤中的核样序列的总长度与促丝孔尺寸变化更强烈地相关(R.2 = 0.77) than is the length of chloroplast sequences (R.2= 0.36)(附加文件2a,b)。这部分是由于插入促滤膜中的重复序列总量的变化;但是,这种相关性很弱(R.2 = 0.13) (Additional file2c),总重复长度和总核/叶绿体长度之间的相关性是相关性(R.2= 0.23和0.0048;额外的文件2D, E)。
线粒体dna的核插入(numts)和叶绿体dna (nupts)
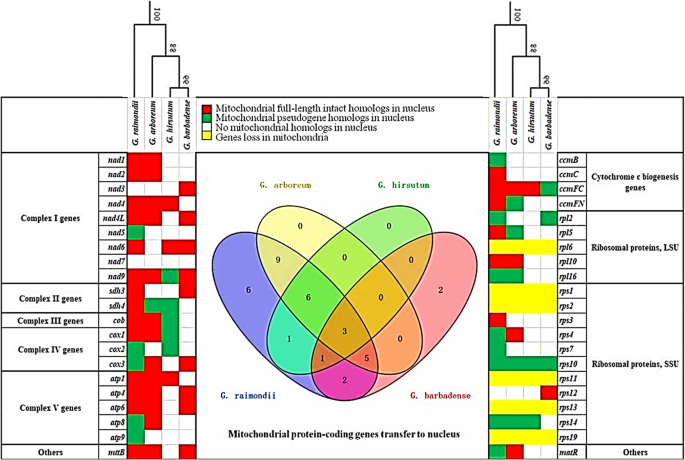
我们评估了4种棉花的线粒体和细胞核中42个常见线粒体蛋白编码基因的存在-缺失模式,为核-线粒体共同进化提供了线索。正如预期的那样,大多数线粒体基因仍然存在于有丝分裂基因组中。只有六个核糖体亚单位基因(rpl6.那RPS1.那RPS2.那rps11那rps13和rps19)在所有四种棉花品种中均缺失(图。4.,黄色细胞),这可能在其进化历史中的某些时候表示共享损失。对于编码复合物II的线粒体基因(琥珀酸脱氢酶,SDH.基因)和核糖体亚基(rpl和石头剪刀基因)Gossypium保留更多的基因(例如,sdh3和sdh4那rpl10和rps10)在线粒体基因组中。所有剩余的线粒体基因(除nad7)经历了全长度或部分长度转移到细胞核,至少在一个棉花品种,(图。4.,白色细胞)。
线粒体基因在四种棉质物种中转移和损失。左侧的第一栏和右侧的设置是线粒体蛋白质编码基因,其功能类别,以及在核和/或线粒体中的存在/不存在。第一行列出了植物物种的名称,其与树指定的关系。彩色盒子表示存在:(1)核中的线粒体全长完整同源物(红色);(2)细胞核中的线粒体假蛋白(绿色);(3)在核(白色)中没有线粒体同源物;(4)在线粒体(黄色)中完全没有该基因。中心:线粒体蛋白质编码基因的VENN图转移到核基因组中(对应于左侧的红色和绿色细胞)G. Arboreum.(黄色),g . raimondii就(蓝色的),g .分子(绿色)那和g .取得分别(红色)。圆之间的重叠显示了共性numts在这些物种
在Gossypium,数目numts在二倍体中有两到三倍,在四倍体中发现(33 inGossypium raimondii就和23日G. Arboreum.,与11相比陆地棉和13 in.g .取得;无花果。4.).许多二倍体numts(23)在两个二倍体之间共享,g . raimondii就(D.5.),G. Arboreum.(一种2),这表明这些numts在底部的A和D片状发散之前被纳入核基因组Gossypium。随后,世系导致g . raimondii就又获得了10个numts(nad5那atp9那ccmB那ccmC那rps3.那rps7.那nad6那COX2.那sdh3和rpl2.).相反,两个四倍体(g .分子和g .取得)遭受了巨大的差异numtallotetraploidization后衰变。只有三个共享的二倍体numts(nad9那ccmFC,和rps10)和一个D5.-具体的numt(nad6)两者都存在g .分子和g .取得.陆地棉包含另外6个共享的二倍体numt基因(nad4那sdh4那结实的矮那COX1.那atp1和rps14)和一个D5.-具体的numt基因(COX2.).另一方面,g .取得包含五个不同的二倍体常见numts(nad4L那COX3.那atp4那atp6和mttB),两个不同的d5.-具体的numts(sdh3和rpl2.),两个AD2-具体的numts(nad3和rps12).
有趣的是,最重要的是numts插入后保持完整(全长)(图。4.,红细胞),少量降解到截短的伪原(图。4.、绿色细胞)。在一些情况下(例如,COX2.那rpl2.那rpl16那rps10和rps14),有证据表明二倍体和多倍体中的假生素。其余10个伪原(nad9那sdh4那结实的矮那COX1.那COX3.那atp8那CCMFC那rpl5.那rps4,和matR)在二倍体中完整,但在多倍体中截短。另外,四numt伪原(nad5那atp9那ccmB,和rps7.)仅发生在g . raimondii就(无花果。4.、绿色细胞)。
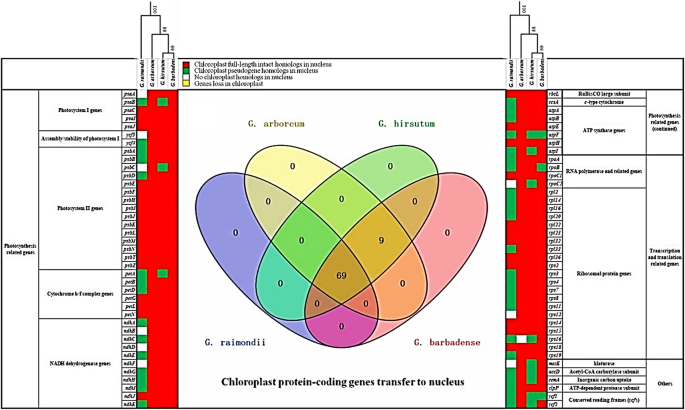
我们评估了所有78个叶绿体基因的核插入(nupts)在四种棉质物种中。78个叶绿体基因中没有一个损失塑体(图。5.几乎所有的78个基因都在四种棉花中至少一种的细胞核中经历了转移。只有6个nupts(psaA那ycf3那psbC那NDHB.那n那NDHF.那rpoC2那rps12和matK) 在g . raimondii就(D.5.)和一个nupt(rps16) 在G. Arboreum.(一种2)缺失(图。5.,白色细胞)。
与较大的丰富相比numts在g . raimondii就那nupts经历了普遍的衰退g . raimondii就相对于其他棉花品种(图。5.).几乎所有的78nupts出现在G. Arboreum.那g .分子,g .取得(除了rps16 nupt损失G. Arboreum.)作为全部或部分nupts;69nupts是四种棉花共有的(图。5.).一般来说,G. Arboreum.(一种2)保留最多的nupts(78分中有77个),而相当大nupt从中降解(39)或移除(9)g . raimondii就基因组。就像在g . arboreum nupts在g .取得通常保留为完整(75/78),而在其他多倍体物种中,g .,有一个适度的降解(12/78降级;图。5.).一个nupt(rps16),而在G. Arboreum.假基因在吗g . raimondii就和g .分子,只有在g .取得.这表明这一点rps16 nupt是在进化的某个时候转移到细胞核的g . raimondii就在偏离G. Arboreum.谱系,随后被保留在多倍体中Gossypium直到它经历了血统的衰退,导致g .分子.在g .取得,这三个nupts(在78分中)经历了降解(即,atpF那rpoB,和ycf1)所有经验丰富的IGT在二倍体物种的共同祖先(g . raimondii就和G. Arboreum.),并且经历过差异劣化g . raimondii就和两个异源多倍体(除了完整的rpoB在g .分子).劣化nupts更突出g .分子,其中15%nupts退化(12/78;psaB那psbC那善待动物组织那atpF那atpI那rpoC2那rps16那matK那accD那accma.那ycf1和ycf2).几乎所有这些(九个)也是伪原的g . raimondii就,而叶绿体psbC那rpoC2和matK在核中不存在。全面的,g . raimondii就经历了最退化的nupts,超过一半(78分中的39个)衰减,并且不存在九(即,psaA那ycf3那psbC那NDHB.那n那NDHF.那rpoC2那rps12和matK).
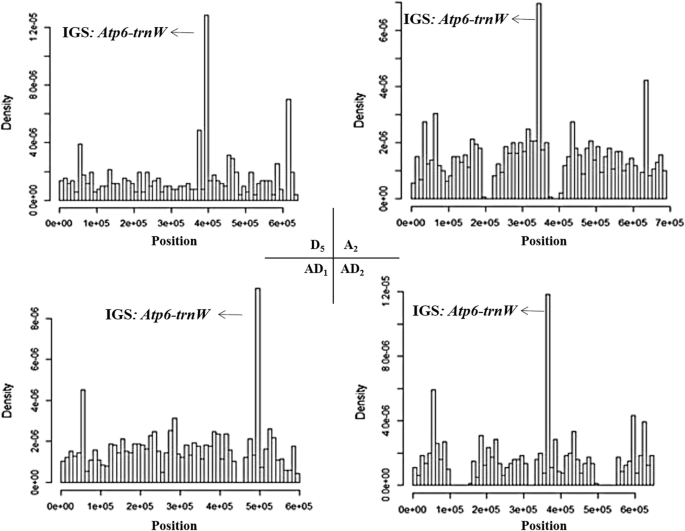
有趣的是,并非叶绿体和线粒体基因组的所有区域以等频率转移。线粒体源材料的热点位于atp6-trnw.基因间区域(图。6.),叶绿体基因组中存在3个热点区,即大单拷贝区(LSC)、反向重复区(IR)和小单拷贝区(SSC),它们的转移速率相对为1:2:1(图2)。7.).
与大多数被子植物相同,棉花中的norgdna大部分是小到中等大小(100 bp - 5 kb)3.和4.),它们的分布模式因物种而异(附加文件3.).在CHR01上发现了两个先前注意的完全线粒体基因组转移g . raimondii就和ChrA03g .分子[64那93,类似于在其他植物中发现的大规模norgnasnumt在CHR2的答:芥[61那101)和nupt插入脚手架的美国二色的(附加文件3.).反向匹配的数量(供体和受体基因组中沿基因组坐标的序列间隔方向为反向,一个基因组的起始到结束位置由小到大,而另一个基因组由大到小)不少于正匹配(供体和受体基因组的位置都是由小到大,或由大到小)。在大多数被研究的物种中,同一染色体上存在两种配对。的nupts六条染色体(CHR01,CHR03,CHR05,CHR06,CHR08和CHR09)都是反向匹配(蓝点或片段),另一个七染色体阳性匹配(红色点或片段)g . raimondii就.第三,一些物种中的Norgnas经常转移到某些染色体中,但这种核热点的整合因素不同于物种,如numts在CHR2的A. Thaliana,Chr01的G. Raimondii,和ChrA03g .分子.第四,norgnas的转移在系统进化上是零星的,因为通常很少norg密切相关物种之间的相似性。
我们研究了进入细胞核的IGT和基因组大小之间的关系,并将其与重复内容对基因组大小变化的影响进行了比较。而核重复大小与基因组大小相关性最强(R.2 = 0.9813; Additional file5.C和表2),与核基因组大小相当相关的NORGDNA长度(R.2 = 0.5917 andR.2 = 0.4675 fornumts和nupts分别;额外的文件5.A和B)。此外,核重复序列长度和norgnas长度也中度相关(R.2= 0.6321numts和R.2 = 0.4511 fornupts;额外的文件5.d和e)。
细胞核中细胞内基因的低表达水平(Norgdnas)
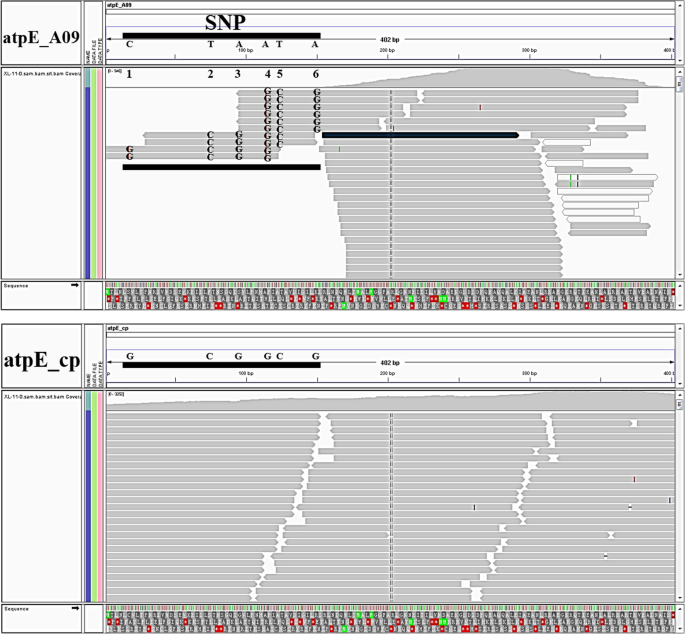
为了评估在棉花中norgs是否表达,我们分析了两份棉花的叶片RNA-seq数据g .,即,X11和X42。我们发现细胞细胞基因的相对表达通常远高于其完整的核对应(表3.),虽然一个norgDNA (nupt atpe_cp)的RPKM值相对较高。为了进一步探索这一点,我们评估了将细胞器基因与norgDNA区分的序列变异的数量和模式,以及由此产生的表达差异。只有6个SNPs能区分402个核苷酸atpE_A09和atpE_cp(~ 1.5%的序列差异),表明这是一个相对较新的或高度保守的norgDNA。当我们删除了所有不能准确分配的读取atpE_A09或atpE_CP,我们发现,没有读取的读取到区别核和细胞内副本的区域atpE(无花果。8.).当我们对一个额外的叶绿体基因(petG核拷贝和叶绿体拷贝之间的分化率高到足以区分两个拷贝(约6.1%的分化率,是核拷贝和叶绿体拷贝之间分化率的4倍)atpE_A09),相对较少的读被模糊地映射和分配给核源(附加文件6.).虽然这表明我们的RNA-SEQ分析适合捕获细胞内和NORG基因之间的表达差异,但我们还通过QRT-PCR验证了这些解释(附加文件7.) 使用atpE和petG作为样权。
norgnas在二倍体和异源多倍体进化过程中发生变化
对于IGT进入细胞核,异源多倍体影响显著,线粒体-核IGT和叶绿体-核IGT表现不同。为numts在异源多倍体物种中,相对于其二倍体祖先的转移较少numts更常见的是部分和/或衰变副本(图。9.一种)。相反,几乎所有人nupts在异源多倍体物种中保留(图。9.b).为了评估这一模式是否在其他多倍体系统中重复,从而表明这可能是与基因组加倍相关的普遍现象,我们分析了异源多倍体的IGT芸苔栗鸟(AACC)相对于其模型二倍体祖细胞,B. Oleracea.(CC)。B. Rapa.(AA)。不像Gossypium,异源多倍体芸苔属植物两者的积分率相似numts和nupts(附加文件8.).
讨论
不同比例的IGT发生在细胞内基因组之间Gossypium
在我们的研究中,我们描述了四种细胞内基因组间IGT的速率和方向(核↔叶绿体、核↔线粒体、叶绿体↔线粒体)Gossypium物种。我们检测到本发明的毒蛛中大多数线粒体基因,这表明大多数基因(即,蛋白质编码,rRNA和TRNA基因)Gossypium线粒体基因组很多保守[29那102那103那104].例如,的线粒体基因组Gossypium保留编码复合物II的一些基因(琥珀酸脱氢酶,SDH.基因)和核糖体亚基(rpl和石头剪刀基因),这些基因在其他被子植物中已经大量丢失[9.那17),例如,sdh3和sdh4那rpl10和rps10.同时,我们在四种棉花质体中任一种质体中都发现了叶绿体基因,这证实了叶绿体基因的普遍保存[105],在大多数植物种类中[9.].虽然所有三种细胞内基因组参与IGT,但是未检测到的IGT的唯一方向是核或线粒体转移到叶绿体中。这与大多数其他植物的观察结果一致[9.,但有两个明显的例外,即:胡萝卜胡萝卜[39),Asclepias Syriaca[40的细胞内转移到叶绿体已有报道。总之,这些观察表明质体基因组缺乏整合外源序列的活跃机制。
总的来说,我们发现整合到细胞核中的序列远远多于整合到线粒体中的序列,这一现象可能是由于序列整合到每个基因组中的机制、线粒体基因组大小的限制,或者两者兼之。几乎所有的线粒体和叶绿体基因都经历了向细胞核的转移Gossypium,这是在大多数其他被子植物中可见的模式[9.,其转移速率是线粒体基因组的100倍。
全多倍体化对IGT的非添加性效应Gossypium
通过多倍体加倍的基因组有许多后果[106].多倍体可以改变基因组的大小、内容和复杂性[107],从而影响遗传变异、应激适应、生物复杂性、物种形成、生物多样性[108[进化的新奇[109].多倍性的无数基因组结果已经被记录[110那111那112];然而,特别是异源多倍体的细胞-核效应(它是由分化种杂交产生的)尚未得到充分的探索[113而关于多倍性对IGT的影响则知之甚少。在这里,我们评估了两个异源多倍体物种的IGT转移,g .分子和g .,取得从大约1-2百万年前的单一多倍化事件中出现,涉及这里测序的两个二倍体棉花的祖先[81].我们发现了一个二倍体祖先物种(这里,g . raimondii就)更多的体验nupt截断和/或损失比其他二倍体祖先物种(这里,G. Arboreum.),产生的多倍体几乎保留了所有的nupts在二倍体中发现的,类似于在G. Arboreum..这些模式与来自21种土地植物的调查中的一般观察一致[9.].相反,线粒体到核IGT在异源多倍体物种中大量丢失。也就是说,只有少数人衰变了numts在异源多倍体物种中被保留的比在任何一个二倍体祖先中保留的都要少,而那些被保留的通常是更老的numts在二倍体物种之间共享。
保留的总长度numts和nupts对任何一个多倍体物种都没有接近加性,g .分子(广告1)或g .取得(广告2),可能的例外nupts在g .分子它们的总长度是典型二倍体亲本的80%,g . raimondii就(D.5.),G. Arboreum.(一种2).这可能反映了在多倍体或真正多倍体祖分化后,在模式二倍体亲本中的插入,或者它可能代表多倍体在形成后和随时间的差异衰变。有趣的是,比率nupt来numt两次在两种异源四倍体棉花,棉花在二倍体物种,显示可能相对的转变nupt和numt合并和/或保留nupt)在多倍体棉花中。这可能部分地解释了从核基因组的背景重复序列中唯一识别线粒体衍生重复序列所面临的挑战,特别是当这些重复序列随着时间的推移而退化时。我们的初步结果(上面)表明相似的norgDNA整合率Gossypium和芸苔属植物,但需要更多的数据来了解倍性的影响nupt和numt集成和劣化动态。虽然这一提示在所有来自IGT的AllopolyPloid系统之间的差异,但它是为广义而更广泛的适用结论而过早的。显然,该领域需要进一步研究Norgnas的进化意义,它们在不同的生物系统中发展的模式和过程,以及倍增性对整合和降解的影响。
细胞内基因组中IGT的图案
在这里,我们发现线粒体atp6-trnw.代表叶绿体区域和叶绿体反转的重复区域代表IGT源材料的热点,即,这些区域经常转移到其他细胞内基因组中。在线粒体基因组中,这些(和其他)转移通常与10bp微型药物相关,这是在远处相关的属(As 2-6bp微博学)的现象中观察到的现象。
检测到numts在各种完整性状态下被发现,由于转移期间的长度或随后的腐烂。在这里,我们发现大多数numts插入后保持全长,表明该机制负责numt代可能优先作用于全长基因;然而,少数基因确实以部分序列的形式转移到细胞核中,说明部分基因并没有被排除在转移之外。使用系统发育学方法,我们也检测到基因转移完整,但随后衰变,例如。nad9和atp8.因为年轻numts更容易识别和检测变得更困难numt衰减,对年轻,更完整和/或保守的Numts的检测有自然偏见,腐烂numts / nupts慢慢地变得越来越难检测,因为它们失去了与来源的序列相似性。然而,在这里,我们描述几个numts / nupts在该属的最基底辐射下存活下来的,大约5-10 MYA。进一步了解这些不常见的保留的潜在原因需要额外的功能研究。
IGT对基因组扩张的贡献
基因组大小变化的根本原因对核基因组来说是一个古老的问题,而对线粒体基因组来说则是一个相对较新的问题。对于后者,我们发现核和叶绿体序列都与有丝分裂基因组的扩展相关,这与植物线粒体与核和叶绿体DNA的污染是植物有丝分裂基因组扩展的核心观点一致[114].由于大多数植物基因组都是由大量重复序列组成的,因此,核衍生重复序列应该代表最频繁的转移;然而,重复序列特征(如数量、总量)与有丝分裂基因组大小之间的相关性较弱。因此,虽然核重复衍生的转移确实有助于有丝基因组的大小增加,但它们不能完全解释核-线粒体转移和有丝基因组扩大之间的相关性。
关于核基因组大小变异,人们普遍认为,物种间的大部分大小变异都是由重复内容引起的;然而,基因组规模扩大的其他来源的贡献还没有很好地描述。本研究发现,核重复对物种间基因组大小差异的贡献最大(超过一半)(分别为55.60、68.50、67.20和69.11%)g . raimondii就那G. Arboreum.那g .分子和g .取得,分别),贡献numts和nupts对基因组大小的影响并非无关紧要2).的存在numts和nupts与核基因组大小呈正相关,与nupts对基因组大小的影响更大(即0.27,0.20,0.20和0.13%g . raimondii就那G. Arboreum.那g .分子和g .取得分别比numt做(即0.15,0.11,0.05和0.04%g . raimondii就那G. Arboreum.那g .分子和g .取得分别表2).我们还发现了核重复和norgnas之间的正相关,这可能反映了norgnas更有能力成功整合到更大的无基因区域的基因组中。
细胞器对核转移的后果在很大程度上是未知的
细胞器有向细胞核功能转移的历史,其中一些细胞器在远亲谱系中保守,另一些细胞器是谱系特异性的。除了非功能性转移外,非功能性转移可能代表从基因片段到细胞器基因组大区域的大小和内容不等的序列[4.那14那18那19那46那101那115那116].虽然许多细胞器衍生的序列是无活性和/或无功能的,但一些转移到细胞核的序列可能有功能[11那16那17那117],功能性和非功能性转移都可能对细胞内代谢和基因组进化产生影响[14那17那18那114那117那118].我们分析了作为功能代理的细胞器基因及其norgnas的表达,发现这些细胞器来源的基因通常以远低于细胞器来源的基因的水平表达,这表明功能潜力有限。因此,虽然norgDNA的表达确实出现,但它可能反映的是转录的泄露而不是功能。然而,表达的和潜在功能的norgnas确实发生在植物中(尽管缺乏核启动子)[11,对普遍存在的无功能假设提出了警告。此外,正如我们所注意到的,norgDNA表达的特性需要认识到细胞器来源的reads与核组成部分的高相似性。
异源多倍体化过程中norgnas的进化不对称性Gossypium
在多倍体演变期间,许多人numts存在于二倍体中的几乎全部消失了nupts在二倍体中仍然保留在目前的多倍体中。鉴于基因组的组装质量差异代表了存在对特定基因的不存在的可能替代解释,我们将我们的结果与最近释放甚至更高质量的基因组组件进行了新的分析g .分子和g .取得[86].这种分析大多重申了我们的结果,但有一些差异。在g .分子,另外还有三个numts(sdh3那rpl5.和rps7.)一个丢了numt(nad4),其中一个完好无损nupt(matK,先前的推论并不完整),而其中一个推论则不完整nupt(rps12,前一篇推理完好无损)。在g .取得,有六个新的numts(sdh4那结实的矮那COX1.那rpl5.那rps7.和rps14)输了四场numts(nad3那nad4L那rps12和mttB),还有四个新腐烂的nupts(ycf2、ycf3 ycf4和rps12),使用早期发布的程序集是完整的。这些结果强调了装配质量对推理的潜在影响numt增益和损失,但也证实我们对多倍体中的微分损失和增益的一般性结论有效。此外,我们还检测到一些先前发表的大片段转移,例如CHR01中的完全线粒体基因组转移g . raimondii就和ChrA03g .分子[64那93),numt在CHR2的答:芥[61那101]以及额外的新检测的转移,进一步验证了我们方法的可靠性和鲁棒性.因此,我们得出结论numt和nupt这里所报道的动态性是一种真实的生物现象。
结论
本研究得出结论,在三种细胞内基因组中,大多数IgT都来自细胞器进入两种栽培的所有多利多倍数和其祖先二倍体棉种类的核基因组;然而,核转回横向和叶绿体TRNA基因以足以与促丝杆菌尺寸增加相关的速率集成到线粒体基因组中。我们检测到IGT的源极(例如,atp6-trnW这需要在不同的植物中进一步研究,以确定这些观察的模式和普遍性。我们还发现,在异源多倍体之后,在核基因组中IGT保留有一个显著的不对称,大多数numts迷失,但最nupts保留.虽然很容易将这些片段的丢失归因于亲代来源,但由于父系来源的norgnas可能会产生干扰,因此是有害的,我们没有看到亲代来源的丢失存在偏见。由于这是基因组间基因转移与异源四倍体之间关系的首次报道,需要来自额外多倍体系统的数据来了解多倍体中IGT的进化动力学。
方法
植物材料和基因组数据
我们用了两种陆地棉(g .分子),Xinluzao 11(X11)和Xinluzhong 42(X42)表达分析。我们自己的实验室提供了X11和X42的种子。X11(原名:玉昭202)由河南农业研究所,河南农业科学院,中国河南省河南省,1994年介绍。经过多年的育种审判,它被农作物批准委员会批准中国新疆新疆自治区,1999年,并被评为新禄兆11. X42由新疆农业科学院的现金作物研究所培养,并受新疆新疆自治区作物品种批准委员会,中国新疆自治区作物综合委员会批准,在2009年。
两倍二倍体的叶绿体,线粒体和核基因组序列(g . raimondii就和G. Arboreum.),以及两个异源四倍体(g .分子和g .取得)从NCBI数据库下载(在附加文件中列出的登录号1).
基因组间转移基因的鉴定
对于研究中的每个物种,我们使用BLAST(附加文件中的命令代码1)对叶绿体或线粒体基因和核染色体序列进行了成对比较9.) [118].我们设置E.值为1 e−5高匹配的100bp最小长度(95%)。我们还确定了叶绿体DNA的线粒体插入(mtpts)使用本地BLASTN(版本2.2.23),最小匹配长度为50 bp (identity > 95%, coverage > 90%)。我们将这些转移归类为全长基因。假基因没有全长或现有突变导致过早终止密码子。
线粒体基因组中核转座元件和重复序列的检测
我们使用RepeatMasker(附加文件中的命令代码2)从核源中检测到核转座元素9.) (http://www.repeatmasker.org)有一个习惯Gossypium-丰富的重复数据库为研究的四个棉花品种。我们使用双尾T.- 评估不同类型的重要层次。通过重复匹配算法(在附加文件中的命令代码3中识别线粒体基因组中的重复9.)在MUMmer中[116].具体参数包括:-f(仅使用前向链),−n(最小匹配长度;默认为20)和-t(仅输出串联重复)。
Microhomologies分析
分析工作如前所述[13那119].如果旁边有相同的核苷酸mtpt融合点的不同陆地物种,我们确定为微同源。
IGT Hotspot分析Gossypium
我们对四种线粒体或叶绿体基因组和核染色体进行了点矩阵比较Gossypium利用MUMmer的核程序。我们为精确匹配设置了100 bp的最小大小,为每两次匹配之间设置了500 bp的最小间隔[116].我们计算了所有的中间位置Gossypium细胞器插入到核染色体以表列转移热点。然后,我们用R(附加文件中的命令代码4)绘制频率分布图9.) (https://www.r-project.org/).
norgnas的表达分析
采用改良十六烷基三甲基溴化铵(CTAB)和十二烷基硫酸钠(SDS)法提取陆地棉X11和X42叶片总RNA,并在上海汉羽生物技术有限公司Illumina HiSeq2500上进行测序。根据制造商的建议,使用Illumina TruSeq RNA样品制备试剂盒(Illumina,美国)生成测序库,并添加4个索引代码来诊断每个序列的样品来源(核或细胞器)。在实验确定了浓度和纯度后,poly-(T)寡聚附着磁珠用于细胞核mRNA的富集。利用Illumina PCR Primer Cocktail进行10个周期的PCR扩增,以200 ~ 300 bp为优先扩增片段,形成cDNA文库。最后,库被对端测序在一个通道中,平均长度为125 nt,有4 Gb的干净读取/样本。采用FastQC检测RNA序列数据质量。读取使用领结2(附加文件中的命令代码5)映射到norgnas同源7.) [120,然后samtools idxstats [121)(附加文件中的命令代码69.)用于计算每个基因的表达读数。RPKM值用于估计相对表达。使用BWA 0.7.10-R789将表达的配对结束读数映射到各自的共识序列上[122];然后使用SAMtools视图将结果转换为BAM文件[121];使用综合基因组学观察来视化结构变异(SV)和诱导物[123].X42和X11的总RNA在一次使用两对引物,即寡核苷酸底漆和随机6mers,以捕获核表达(NE)和细胞细胞表达(OE)的逆转录。由寡核苷酸底漆产生的cDNA代表核表达,而随机6mers产生的cDNA代表核和细胞内基因(NOE)的组合。OE等于NOE minus ne。两种cDNA用作QRT-PCR的模板。通过应用的生物系统7500实时PCR系统使用Sybr Premix ExTaq TM(TLI RNASEH Plus)RR420A试剂盒(Takara)进行QRT-PCR实验。该程序包括三个阶段:第1阶段,95°C,30 s,1个循环;第2阶段:95°C,5 s,60°C,35秒,40个循环;第3阶段:95°C,15 s,60℃,1分钟,95°C,35秒,1个循环。使用棉花家政基因UBQ7作为内参,我们分析了两个细胞器基因及其核拷贝的相对表达量-△△Ct方法。每个样本重复三次。
可用性数据和材料
在当前研究期间使用和/或分析的数据集在NCBI存储库中可用。g . raimondii就核基因组,登录号:PRJNA171262, DOI:https://www.ncbi.nlm.nih.gov/bioproject/PRJNA171262;g . raimondii就线粒体基因组,登录号:KR736345, DOI:https://www.ncbi.nlm.nih.gov/nuccore/KR736345.1/;g . raimondii就叶绿体基因组,登录号:HQ325744, DOI:https://www.ncbi.nlm.nih.gov/nuccore/HQ325744.1//;G. Arboreum.核基因组,登录号:PRJNA335838, DOI:https://www.ncbi.nlm.nih.gov/bioproject/PRJNA335838;G. Arboreum.线粒体基因组,登录号:KR736342, DOI:https://www.ncbi.nlm.nih.gov/nuccore/KR736342.1/;G. Arboreum.叶绿体基因组,登录号:HQ325740,DOI:https://www.ncbi.nlm.nih.gov/nuccore/hq325740.1/;g .分子核基因组,登录号:PRJNA248163,DOI:https://www.ncbi.nlm.nih.gov/bioproject/PRJNA248163;g .分子线粒体基因组,登录号:JX944505,DOI:https://www.ncbi.nlm.nih.gov/nuccore/jx944505.1//;g .分子叶绿体基因组,登录号:DQ345959,DOI:https://www.ncbi.nlm.nih.gov/nuccore/DQ345959.1/;g .取得核基因组,登录号:PRJNA219156,DOI:https://www.ncbi.nlm.nih.gov/bioproject/PRJNA219156;g .取得线粒体基因组,登录号:KP898249, DOI:https://www.ncbi.nlm.nih.gov/nuccore/KP898249.1/;g .取得叶绿体基因组,登录号:AP009123, DOI:https://www.ncbi.nlm.nih.gov/nuccore/AP009123.1/;支持本文结论的其他数据集包含在文章及其附加文件中。
缩写
- 显著(协会):
-
芸苔栗鸟
- B. Oleracea.(CC):
-
芸苔属植物oleracea
- B. Rapa.(AA):
-
Brassica Rapa.
- cpDNA:
-
叶绿体DNA
- G. Arboreum.,(一种2):
-
Gossypium Arboreum.
- g .取得(广告2):
-
取得
- g . herbaceum(一种1):
-
草本棉
- g .分子(广告1):
-
陆地棉
- g . raimondii就(D.5.):
-
Gossypium raimondii就
- IGT:
-
Intergenomic基因转移
- LTR-RETRO:
-
长末端重复逆转录转座子
- mtDNA:
-
线粒体DNA
- norgDNAs:
-
核细胞仪DNA.
- NUDNA:
-
核DNA
- numts:
-
核线粒体插入
- nupts:
-
核塑料插入
- te:
-
可转换元素
参考文献
- 1.
灰色mw。线粒体蛋白质组的马赛克本质:对线粒体的起源和演化的影响。Proc Natl Acad Sci U S A. 2015; 112(33):10133-8。
- 2.
Martin W, Stoebe B, Goremykin V, Hansmann S, Hasegawa M, Kowallik KV。基因转移到细胞核与叶绿体的进化。大自然。1998;393(6681):162 - 5。
- 3.
Rodriguez-Ezpeleta N, Brinkmann H, Burey SC, Roure B, Burger G, Loffelhardt W, et al.;初级光合真核生物的单系:绿色植物,红藻类和青苔植物。咕咕叫医学杂志2005;15(14):1325 - 30。
- 4.
黄春英,黄志强,王志强。内共生基因转移:细胞器基因组构建真核染色体。[j] .自然科学进展,2004;5(2):123-35。
- 5.
李志强,李志强,李志强,等。DNA从细胞器到细胞核的转移:内共生的特殊遗传学。植物学报2009;60:115-38。
- 6.
基因组进化的见证:内共生和水平基因转移的实验重建。acta photonica sinica, 2017;51(1):1 - 22。
- 7.
线粒体DNA和质体DNA在细胞核中的插入分析(nupts和numts):大小、相对年龄和染色体定位。遗传。2013;111(4):314 - 20。
- 8.
Wang D, Lloyd AH, Timmis JN。环境胁迫增加了植物细胞质细胞器DNA进入细胞核的能力。中国科学院院刊2012;109(7):2444-8。
- 9.
Zhao N,Wang Y,Hua J.线粒体在植物中骨髓组织转移中的作用:源和水池。int j mol sci。2018; 19(2):E547。
- 10.
在质体基因组还原过程中大量的细胞内基因转移列当科.新植物。2016; 210(2):680-93。
- 11.
王D,Qu ZP,Adelson DL,Zhu JK,Timmis JN。模型植物系统中核细胞素DNA的转录。基因组Biol Evol。2014; 6(6):1327-34。
- 12.
王D,Timmis JN。细胞质细胞器DNA优先插入开放的染色质中。基因组Biol Evol。2013; 5(6):1060-4。
- 13.
Hazkani-Covo E, Covo S。Numt-介导的双链断裂修复缓解灵长类基因组进化中的缺失。公共科学图书馆麝猫。2008;4 (10):e1000237。
- 14.
细胞器DNA核插入的起源、进化和遗传效应。趋势麝猫。2005;21(12):655 - 63。
- 15.
berthorsson U, Adams KL, Thomason B, Palmer JD。开花植物中广泛的线粒体基因水平转移。自然。2003;424(6945):197 - 201。
- 16.
亚当斯kl,palmer jd。线粒体基因含量的演变:基因丧失和转移到细胞核。mol phylocyet evol。2003; 29(3):380-95。
- 17.
Adams KL, Qiu Y-L, Stoutemyer M, Palmer JD。间断进化的线粒体基因含量:在被子植物进化过程中,线粒体基因丢失和转移到细胞核的高和可变率。中国科学(d辑:地球科学)2002;99(15):9905-12。
- 18.
Blanchard JL, Schmidt GW。植物细胞器DNA向细胞核的普遍迁移。中国科学(d辑:地球科学)1995;41(4):397-406。
- 19.
Lopez JV,Yuhki N,Masuda R,Modi W,Obrien SJ。Numt,最近的线粒体DNA转移和串联扩增到国内猫的核基因组。J Mol Evol。1994年; 39(2):174-90。
- 20.
王志强,王志强,王志强,等。动态演化的天竺葵通过多次水平和细胞内基因转移的线粒体基因组。新植醇。2015;208:570 - 83。
- 21.
黄春英,马毅夫,金炯敏。直接测定叶绿体DNA进入细胞核的速率。大自然。2003;422:72-6。
- 22.
e,e,leister d。numts.在真核生物基因组序列中。生物化学学报2004;21:1081-4。
- 23。
Sheppard AE, Timmis JN。核基因组中质体DNA的不稳定性。公共科学图书馆麝猫。2009;5 (1):e1000323。
- 24。
史密斯博士,Crosby K,Lee RW。核塑性DNA丰度和塑性数之间的相关性支持有限的转移窗假设。基因组Biol Evol。2011; 3:365-71。
- 25。
从叶绿体基因组到细胞核的高频基因转移。中国科学院院刊2003;100(15):8828-33。
- 26。
史密斯博士。将有限的转移窗假设扩展到细胞间DNA迁移。基因组Biol Evol。2011; 3:743-8。
- 27.
Sloan DB,Alverson AJ,Storchova H,Palmer JD,Taylor Dr。高原植物结构动态线粒体基因组中的广泛翻译基因丧失硅宾latifolia.BMC Evol Biol. 2010; 10:1-15。
- 28.
Alverson AJ,米DW,Dickinson S,Barry K,Palmer JD。黄瓜细菌大小瘤细菌线粒体基因组的起源和重组。植物细胞。2011; 23(7):2499-513。
- 29.
米DW,Alverson AJ,Richardson AO,Young GJ,Sanchez-Puerta MV,Munzinger J等人。通过高管植物的线粒体融合水平转移全基因组Amborella.科学。2013; 342(6165):1468-73。
- 30.
王栋,卢梭-格丁,金提米斯。质体序列与某些植物线粒体基因有关。中国生物医学工程学报。2012;29(7):1707-11。
- 31.
Rodriguez-Moreno L,Gonzalez VM,Benjak A,Marti Mc,Puigdomenech P,Aranda Ma,等。甜瓜叶绿体和线粒体基因组序列的测定表明,植物中最大报道的线粒体基因组含有核来源的大量DNA。BMC基因组学。2011; 12:424。
- 32.
王D,吴yw,shih acc,吴cs,王yn,chaw sm。将叶绿体基因组DNA转移到线粒体基因组中发生至少300μA。mol Biol Evol。2007; 24(9):2040-8。
- 33.
刘志强,张晓东,张志强,等。Copia-, gypsy-和line-like逆转录转座子片段的线粒体基因组拟南芥.遗传学。1996年; 142(2):579-85。
- 34.
Dietrich A, Small I, Cosset A, Weil JH, Marechal-Drouard L.编辑和导入:为植物线粒体提供一套完整的功能转移rna的策略。Biochimie。1996;78(6):518 - 29。
- 35.
甘迪尼CL,桑切斯-普雷塔MV。植物线粒体中的外源质体序列通常通过线粒体到线粒体的水平转移获得。Sci众议员2017;7:43402。
- 36.
王志强,王志强,王志强,等。中华绒螯蟹线粒体基因组的质粒、核和逆转录酶序列分析月见草属:遗传信息是通过RNA在细胞器之间传递的吗?EMBO j . 1987; 6(10): 2857 - 63。
- 37.
王小春,陈辉,杨东,刘晨(mtpts)。线粒体DNA Part A. 2017; 29:635-42。
- 38.
Veronico P, Gallerani R, Ceci LR。高等植物线粒体trna基因的编写与分类。核酸学报1996;24(12):2199-203。
- 39.
Goremykin VV,Salamini F,Velasco r,Viola R. Mitochondrial DNA葡萄以及猖獗的水平基因转移问题。生物医学进展。2009;26(1):99-110。
- 40.
Straub SCK,Cronn RC,Edwards C,Fishbein M,Candon A.从线粒体到体液组织的DNA水平转移及其随后在乳草中的演变(夹竹桃科).基因组Biol Evol。2013; 5(10):1872-85。
- 41.
Iorizzo M,Grezbelus D,Senalik D,Szklarczyk M,Spooner D,Simon P.抵抗流量:线粒体DNA转移到塑性基因组中的第一个证据。暴徒群体elem。2012; 2(6):261-6。
- 42.
Iorizzo M, Senalik D, Szklarczyk M, Grzebelus D, Spooner D, Simon P.利用全基因组DNA的下一代测序,从新组装胡萝卜线粒体基因组,提供了DNA转移到被子植物质体基因组的第一个证据。植物学报。2012;12(1):1 - 17。
- 43.
线粒体到质体的DNA转移:确实有。新植醇。2014;202(3):736 - 8。
- 44.
常胜,杨涛,杜涛,黄勇,陈建军,闫建军,等。线粒体基因组测序有助于揭示线粒体基因组形成的进化机制芸苔属植物.BMC基因组学。2011;12:497。
- 45.
油菜线粒体基因组全核苷酸序列及rna编辑内容(芸苔栗鸟:油菜籽和油菜线粒体基因组的比较分析拟南芥.核酸RES。2003; 31(20):5907-16。
- 46.
Marienfeld J,Posseld M,Brandt P,Brennicke A.线粒体的基因组重组atp6基因拟南芥在蛋白质加工区域产生两种不同的前序。DNA研究杂志1996;3(5):287 - 90。
- 47。
陈亚平,刘旭东,刘志伟,等。蓖麻细胞器基因组测序及全球遗传多样性分析。《公共科学图书馆•综合》。2011;6 (7):e21743。
- 48。
张S,王y,卢j,gai j,li j,chu p等。大豆的线粒体基因组揭示了细胞内和系统发育水平的复杂基因组结构和基因演化。Plos一个。2013; 8(2):E56502。
- 49。
Alverson AJ,卓S,米DW,Sloan DB,Palmer JD。豆类的线粒体基因组Vigna Radiata.跨短线粒体重复的重组分析。Plos一个。2011; 6(1):E16404。
- 50。
Sugiyama Y, Watase Y, Nagase M, Makita N, Yagura S, Hirai A, et al.烟草线粒体基因组的全核苷酸序列和多部结构:高等植物线粒体基因组的比较分析。中国生物医学工程学报。2005;27(6):603-15。
- 51。
Terasawa K, Odahara M, Kabeya Y, Kikugawa T, Sekine Y, Fujiwara M, et al.;苔藓的线粒体基因组Physcomitrella patens.落下土地植物中线粒体演变的新光。mol Biol Evol。2006; 24(3):699-709。
- 52.
小田,大和K,大田E,中村Y, Takemura M, Nozato N,等。从苔类全序列推导出基因组织Marchantia polymorpha线粒体DNA:一种原始形式的植物线粒体基因组。J Mol Biol。1992年; 223(1):1-7。
- 53.
周淑敏,春杰施安,王丹,吴永伟,刘淑敏,周天逸。裸子植物的线粒体基因组铁树taitungensis含有新颖的短散射元素,BPU序列和丰富的RNA编辑位点。mol Biol Evol。2008; 25(3):603-15。
- 54.
方y,wu h,张t,杨m,yin y,pan l等。枣棕榈的完整序列和转录组分析(Phoenix DactyliferaL.)线粒体基因组。Plos一个。2012; 7(5):E37164。
- 55.
Notsu Yn,Masood Sm,Nishikawa Tn,Kubo NK,Akiduki Ga,Nakazono Mn,等。米的完整序列(奥雅萨苜蓿1)线粒体基因组:开花植物进化过程中DNA序列的频繁获取和丢失。中国生物医学工程学报。2002;26(4):434-45。
- 56.
田X,郑j,胡s,yu J.水稻线粒体基因组及其变化。植物理性。2006; 140(2):401-10。
- 57.
Ogihara Y,Yamazaki Y,Murai K,Kanno A,Terachi T,Shiina T,等。小麦线粒体基因组完全核苷酸测序揭示的谷物线粒体基因组的结构动态。核酸RES。2005; 33(19):6235-50。
- 58.
基于重排事件的玉米线粒体基因组进化。BMC基因组学。2010;11(1):233。
- 59.
关键词:棉花,线粒体基因组,雄性不育,候选基因引用本文:BMC基因组学。2018;19(1):775。
- 60.
唐美美,陈志伟,Grover CE,王玉梅,李世生,刘国珍,等。快速进化分化海岛棉和G分子线粒体基因组。BMC基因组学。2015;16:770。
- 61.
陈志伟,聂海生,Grover CE,王玉梅,李鹏,王美美,等。整个核苷酸序列Gossypium raimondii就和G. Arboreum.线粒体基因组显示一个基因组物种是异源四倍体物种的细胞质供体。植物医学杂志。2017;19(3):484 - 93。
- 62.
玉米线粒体和叶绿体基因组有一个共同的12k碱基dna序列。自然。1982;299(5885):698 - 702。
- 63.
刘GZ,Cao DD,Li SS,Su Ag,Geng Jn,Grever Ce,等。完全线粒体基因组陆地棉高等植物线粒体基因组的进化分析。《公共科学图书馆•综合》。2013;8 (8):e69476。
- 64.
郭洪波,王志强,王志强,等。重复多倍化Gossypium基因组与可纺棉纤维的进化。大自然。2012;492(7429):423 - 7。
- 65.
陈泽,赵不,李斯,格罗弗Ce,Nie HS,Wendel JF等。植物线粒体基因组进化和细胞质雄性不育。CRIT Rev Plant Sci。2017; 36(1):55-69。
- 66.
植物线粒体逆行调控。线粒体。2007;7(3):177 - 94。
- 67.
田志刚,田志刚,田志刚,等。甜菜细胞质雄性不育恢复的翻译后机制(甜菜属).植物j . 2015; 83(2): 290 - 9。
- 68.
刘志强,杨志强,王旭东,安华,刘建军,等。线粒体靶向的ppr蛋白得以恢复pol减少细胞质雄性不育orf224油菜的转录水平。摩尔。2016;9(7):1082 - 4。
- 69.
陈志强,陈志强,陈志强,等。线粒体基因组序列、结构和基因含量的种内变异Silene Vulgaris.,一种被子植物,具有普遍的细胞质雄性不育性。新植醇。2012;196(4):1228 - 39。
- 70.
陈林,刘永刚。作物雄性不育与育性恢复。植物学报。2014;65:579-606。
- 71。
水稻细胞质雄性不育基因的起源。细胞研究》2017;27(1):3 - 4。
- 72。
Tang H,Zheng X,Li C,谢X,Chen Y,Chen L等。植物线粒体基因组新细胞质雄性不育基因的多步形成,演化和功能化。细胞res。2017; 27(1):130-46。
- 73。
Okazaki M, Kazama T, Murata H, Motomura K, Toriyama K.通过全线粒体基因组测序和转录分析,发现来自于rt102型细胞质男性不育相关候选基因oryza rufipogon..植物生理学报。2013;54(9):1560-8。
- 74。
Gallagher LJ,Betz SK,Chase CD。线粒体RNA编辑截断与玉米中的雄性不育相关的嵌合开放阅读框架。Curr Genet。2002; 42(3):179-84。
- 75。
Wise RP, Fliss AE, Pring DR, Gengenbach BG。URF13-T.T型细胞质玉米线粒体编码13 kd多肽。植物mol biol。1987; 9(2):121-6。
- 76.
线粒体在细胞质雄性不育研究中的作用。19 Pt B: 198-205。
- 77.
Wesolowski W,Szklarczyk M,Szalonek M,Slexinska J.细胞质雄性无菌和雄性肥料甜菜中线粒体蛋白质组的分析。J蛋白质组。2015; 119:61-74。
- 78.
格罗弗CE, Gallagher JP, Jareczek JJ, Page JT, Udall JA, Gore MA等。异源多倍体系统发育的再评价Gossypium1 .中国科学院地理科学与资源研究所,2015;
- 79.
文德尔,格罗弗。棉花属的分类与进化,Gossypium.棉花。2015;57:25-44。
- 80。
黄志刚,王志刚,王志刚,等。环礁棉属的一种新种。Gossypium stephensii(Malvaceae)。SYST BOT。2017; 42:115-23。
- 81。
Wendel JF。新世界四倍体棉花含有旧世界细胞质。Proc Natl Acad Sci U S A. 1989; 86(11):4132-6。
- 82。
王凯,王志,李飞,叶伟,王军,宋国光,等。二倍体棉花的基因组草图Gossypium raimondii就.NAT Genet。2012; 44(10):1098-103。
- 83.
李方锋,范国贵,王克朋,孙富明,袁玉良,宋国良,等。栽培棉花的基因组序列Gossypium Arboreum..Nat麝猫。2014;46(6):567 - 72。
- 84.
李方锋,范国英,卢春荣,肖光华,邹春生,Kohel RJ,等。栽培陆地棉基因组序列(陆地棉Tm-1)提供了基因组进化的见解。生物科技Nat》。2015;33(5):524 - 30。
- 85.
张TZ,胡y,江口,方l,关西,陈杰,等。分子素棉花的测序(陆地棉l。Acc。Tm-1)为纤维改良提供资源。生物科技Nat》。2015;33(5):531 - 7。
- 86.
王敏,屠龙,袁东,朱东,沈超,李军,等。两种栽培异源四倍体棉花的参考基因组序列陆地棉和海岛棉.51 Nat麝猫。2019;(2):224 - 9。
- 87.
刘旭,赵斌,郑海军,胡勇,卢刚,杨春强,等。海岛棉基因组序列提供了深入了解超长短纤维和特殊代谢物的进化。Sci众议员2015;5:14139。
- 88.
袁丹杰,唐振华,王明杰,高文辉,涂丽丽,金旭,等。海岛棉(海岛棉)提供对各种可纺纱纤维的全多聚纤维化和开发的见解。SCI REP。2015; 5:17662。
- 89.
Lee SB, Kaittanis C, Jansen RK, Hostetler JB, Tallon LJ, Town CD, et al.;完整的叶绿体基因组序列陆地棉:与其他被子植物的组织和系统发育关系。BMC基因组学。2006;7:61。
- 90。
徐Q,熊GJ,Li Pb,He F,Huang Y,Wang Kb等人。12的完全核苷酸序列分析Gossypium叶绿体基因组:同种异体四倍体的起源和演化。Plos一个。2012; 7(8):E37128。
- 91。
陈志伟,冯轲,Grover CE,李斌,刘峰,王玉明,等。二倍体棉花品种间叶绿体DNA结构变异、系统发育和年龄差异。《公共科学图书馆•综合》。2016;11 (6):e0157183。
- 92。
陈志伟,Grover CE,李鹏,王玉梅,聂海生,赵艳萍,等。棉花属分化过程中质体基因组的分子进化。分子系统学进展。2017;112(增刊C): 268-76。
- 93.
陈泽,聂王,王烨,裴HL,Li SS,张LD等。二倍体和同种异体中的快速进化分歧Gossypium线粒体基因组。BMC基因组学。2017;18:876。
- 94.
Feschotte C,Jiang N,Wessler SR。植物转产元件:遗传学符合基因组学的地方。NAT Rev Genet。2002; 3(5):329-41。
- 95。
Cossu RM, Casola C, Giacomello S, Vidalis A, Scofield DG, Zuccolo A.在大型植物基因组中,LTR逆转录转座子表现出低水平的不平等重组和高水平的元件内基因转化。基因组生物学进展。2017;9(12):3449-62。
- 96。
SanMiguel P, Gaut BS, Tikhonov A, Nakajima Y, Bennetzen JL。玉米基因间反转座子的古生物学。Nat麝猫。1998;20(1):43-5。
- 97。
水稻反转录转座子(奥雅萨苜蓿最近的爆发性扩增伴随着DNA的快速丢失。BMC基因组学。2007;8:218。
- 98。
王浩,刘建生。LTR逆转录转座子景观Medicago Truncatula.:比水稻更快速地去除。BMC基因组学。2008; 9(1):382。
- 99。
霍金斯JS,Proulx SR,RAPP RA,Wendel JF。快速DNA损失作为通过植物中转回扩增的基因组扩增的逆损。Proc Natl Acad SCI U S A. 2009; 106(42):17811-6。
- 100。
邱F,UNGERER MC。不同的基因组丰富和转录活动吉普赛和Copia长终端重复转回三种野生向日葵物种。BMC植物BIOL。2018; 18(1):6。
- 101。
等。复杂的mtDNA构成一个大约620 kb的插入拟南芥染色体2:大单位重复导致的潜在测序错误的暗示。中国科学院院刊2001;98(9):5099-103。
- 102.
Kurland CG, Andersson SGE。线粒体蛋白质组的起源与进化。微生物学与生物工程学报2000;64(4):786-820。
- 103.
拥有最大线粒体基因组的代价:植物线粒体基因组的进化机制。J Bot, 2010, 2010。https://doi.org/10.1155/2010/620137.
- 104.
Skippington E,Barkman TJ,米DW,Palmer JD。寄生植物的小型化促发催化剂毒蕈氏菌霉素是极其多样化和动态的,却失去了一切河畔基因。acta Natl academy Sci U S A. 2015;112(27): E3515-E24。
- 105.
黄杰,陈瑞华,李晓刚。四种已知叶绿体全基因组的比较分析Ziziphus物种。基因。2017;8(12):340。
- 106.
丁MQ,陈ZJ。对多倍体植物与作物的演化与驯化的表观遗传观点。CurrOp植物BIOL。2018; 42:37-48。
- 107.
翻倍的基因组,加倍的乐趣:被子植物的基因组复制。摩尔。2018;11(3):357 - 8。
- 108.
李志强,李文杰,李志强。多倍性的进化意义。Nat Rev Genet. 2017;18:411。
- 109.
soltis ps,soltis de。古代WGD活动作为Agenperms的关键创新的驱动因素。CurrOp植物BIOL。2016; 30:159-65。
- 110。
张文德,李士德,胡光华。加倍的长与短:多倍体、表观遗传学和基因组分离的时间动态。Curr Opin Genet Dev. 2018; 49:1-7。
- 111。
Li Z, Tiley GP, Galuska SR, Reardon CR, Kidder TI, Rundell RJ,等。六足动物进化过程中基因和基因组的多次大规模复制。中国科学(d辑:地球科学)2018;
- 112.
亲本基因组多倍体后基因的优先保留说明了杂交引起的基因组冲突的性质和范围。公共科学图书馆麝猫。2018;14 (3):e1007267。
- 113.
Sehrish T, Symonds VV, Soltis DE, Soltis PS, Tate JA。在异源多倍体形成时,细胞核协调不是立即的tragopogon miscellus.(菊科)异源多倍体。《公共科学图书馆•综合》。2015;10 (12):e0144339。
- 114.
线粒体基因组马吕斯有明显种子植物线粒体基因组扩张的输入驱动假说。植物j . 2012; 71(4): 615 - 26所示。
- 115。
Kudla J, Albertazzi F, Blazević D, Hermann M, Bock R.线粒体的丢失COX2.单子叶植物家族中的内含子1及其利用线粒体内含子序列构建核内含子的研究。中国生物医学工程学报。2002;27(2):223-30。
- 116。
Delcher Al,Phillippy A,Carlton J,Salzberg SL。大规模基因组对齐和比较的快速算法。核酸RES。2002; 30(11):2478-83。
- 117。
王hc,帕尔默。表达的线粒体普遍存活rps14在三次功能性转移到细胞核之后,草类及其近亲的伪基因已经存在了八千万年。BMC Evol Biol. 2006;6:55。
- 118。
altschul sf,gish w,miller w,myers ew,lipman dj。基本的局部比对搜索工具。J Mol Biol。1990年; 215(3):403-10。
- 119。
朱玉玲,图比奥。频繁的体细胞转移线粒体DNA进入人类癌症细胞的核基因组。基因组研究》2015;25(6):814 - 24。
- 120.
Langmead B,Salzberg SL。与Bowtie 2. NAT方法的快速喷射读取对齐。2012; 9(4):357-9。
- 121.
李洪波,李洪波,李洪波,等。序列对齐/映射格式和samtools。生物信息学。2009;25(16):2078 - 9。
- 122。
李H,Durbin R.快速准确的长读与挖洞轮转变换。生物信息学。2010; 26(5):589-95。
- 123。
引用本文:王志强,王志强,王志强,等。结合基因组学查看器。生物科技Nat》。2011;29(1):24-6。
确认
不适用。
资金
本研究由国家自然科学基金(31671741)和国家作物育种重点研发计划(2016YFD0101305)资助。资助机构在研究的设计、数据的收集、分析和解释以及手稿的撰写中没有发挥作用。各基金支持实验费用、论文改版费等。
作者信息
从属关系
贡献
NZ分析了数据,解释了结果,并准备了稿件。ZC参加了数据收集,原始分析和讨论。JFW和CEG参加了讨论,数据分析和手稿修订。JH构思了实验设计,提供了研究平台,并修改了稿件。所有作者均认批准了最终手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
额外的文件1。
四种棉花的核、线粒体和叶绿体基因组的登录号。
额外的文件2。
26种土壤植物线粒体基因组,线粒体基因组的线粒体基因组,线粒体基因组大小的核和叶绿体序列长度的相关性。(a)转移到线粒体和线粒体基因组大小的核序列的长度之间的相关性。(b)转移到线粒体和线粒体基因组大小的叶绿体序列之间的长度之间的相关性。(c)线粒体基因组中重复尺寸与线粒体基因组之间的相关性。(d)转移到线粒体基因组的核序列长度与线粒体基因组重复尺寸之间的相关性。(e)转移到线粒体基因组的叶绿体序列长度与线粒体基因组重复尺寸的相关性。每个点代表一个物种的二维值(X, Y)。返回点表示四种棉质,灰色点意味着其他物种。斜线表示点的分布趋势的线性回归函数。R.2为回归系数。
额外的文件3。
对包括四种棉花在内的14种植物的叶绿体dna(上)和线粒体dna(下)的核插入进行了点矩阵分析。对结果进行过滤,以便只选择那些引用和查询之间具有一对一映射的对齐。红线和蓝线分别表示正匹配和反向匹配。基于最大似然法,采用GTR + G + I模型绘制了系统发育的最上层分支。有关线粒体dna插入四种棉花的四个核基因组的数字引用自我们实验室以前的一篇论文[61].
附加文件4。
细胞核细胞器DNA的鉴定Gossypium.答:g . raimondii就.B:G. Arboreum..C:g .分子(一种T.).D:g .分子(D.T.).圆圈周围的红色条带表示核染色体。橙色和绿色线分别代表有丝分裂基因组和叶绿体基因组中超过5kb的插入。而灰色线代表来自两个基因组的100 bp到5 kb之间的插入。MT:线粒体基因组。CP:叶绿体基因组。
额外的文件5。
26种陆生植物线粒体和叶绿体序列向核基因组转移的长度、核基因组大小和核基因组重复大小的相关性(A)向核转移的线粒体序列长度与核基因组大小的相关性。(B)向核转移的叶绿体序列长度与核基因组大小的相关性。(C)核基因组重复大小与核基因组大小之间的相关性。(D)转移到核基因组的线粒体序列长度与核基因组重复大小的相关性。(E)转移到核基因组的叶绿体序列长度与核基因组重复大小的相关性。每个点代表一个物种的二维值(X, Y)。黑点表示四种棉种,灰点表示其他种。斜线表示点的分布趋势的线性回归函数。R.2为回归系数。
附加文件6。
RNA-seq表达叶绿体基因的配对端序列petG_cp及其核同源性petG_D12在g .分子品种(Xinluzao 11)。上面的两个图像显示了通过整合基因组观察器(IGV)屏幕截图的RNA-SEQ表达对结束读数的可变性和覆盖范围。每个图像都包含三个主面板。上面板表示序列坐标。中间板被细分为两条轨道,其中上轨迹描绘读取密度,下轨迹显示清洁读取的映射。底部的面板表示线性DNA序列。snps in.petG_D12和相应的正常核苷酸petG_cp以粗体突出显示。表达的解读petG_D12与petG_cp和少量的读被映射到散度区域。
附加文件7。
叶绿体基因的相对表达水平atpE_cp / petG_cp和他们的核副本atpE_A09 / petG_D12在两个g .分子品种。×:Xinluzao 42;X11: Xinluzao 11。用2的方法计算相对表达式值-△△Ct.Arunachal Pradesh,P.< 0.01。看到方法有关详细信息。
额外的文件8。
显示全多倍化过程中Norgdnas变化的假设进化模型芸苔属植物物种。(A)异源多倍体中线粒体到核IGT事件的图式图芸苔属植物.CC:B. oleracea。AA:B. Rapa..协会:显著.灰色矩形条带代表两个二倍体物种分化前转移的基因块。蓝色和紫色基因条带分别代表仅在二倍体CC和异源四倍体AACC中转移的基因块。绿色的基因是假基因。(B)异源多倍体过程中叶绿体向核IGT事件的图式图芸苔属植物.同一灰盒中的基因属于一个功能分类。绿色中的基因表示伪原。蓝色,紫色和红色盒子的基因分别仅在CC,AA和AACC中转移。
附加文件9。
本研究中使用的命令及其代码。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
赵,N.,Grover,C.,Chen,Z.et al。二倍体和异源多倍体基因组间的基因转移Gossypium.BMC植物杂志19,492(2019)。https://doi.org/10.1186/s12870-019-2041-2
收到了:
公认:
发表:
关键字
- Intergenomic基因转移
- Allopolyploidization
- Gossypium
- 线粒体基因组
- 叶绿体基因组
- Numt
- n