摘要
背景
在软水果中,发育和成熟过程中许多基因的差异表达改变了它们的感官特性。在草莓果实中,虽然一些参与成熟过程代谢调节的基因已被功能鉴定,但一些被研究最多的基因对应于转录因子。草莓红花托的高通量转录组学分析(Fragaria x ananassa)使我们能够识别一个编码非典型HLH的成熟相关基因(FaPRE1)与多效唑抗性(PRE)基因序列同源性高.PRE基因是非典型的bHLH蛋白,其特征是缺乏dna结合域,其功能与调节细胞伸长过程有关。
结果
FaPRE1序列分析表明,该基因属于非典型bHLHs亚家族,还包括ILI-1从大米,SlPRE2来自番茄和AtPRE1从拟南芥通过bHLH转录因子的异二聚化阻塞,bHLH转录因子作为阻遏因子参与转录调控过程。FaPRE1表达了一个成熟相关基因的转录模型,该基因具有花托特异性表达,被生长素抑制,被ABA激活。但赤霉素对其表达无明显影响3.).另一方面,短暂的沉默FaPRE1花托中农渗的转录在诱导花托生长发育相关基因转录的同时,下调了一组与成熟过程相关的基因。
结论
总之,这项工作首次提供了支持非典型HLH的重要新功能的实验数据FaPRE1草莓果实成熟的时候。我们假设FaPRE1拮抗调节与花托生长和成熟相关基因的转录。由此可见,FaPRE1抑制了花托成熟过程中促花托生长基因的表达,而激活了与花托成熟过程相关的基因的表达。
背景
在软质果实的发育和成熟过程中,许多与感官特性有关的代谢途径存在差异表达。在草莓果实中,ABA/生长素比例的增加触发了许多与成熟相关的基因的转录,这些基因涉及不同的感官特性,如香气、颜色、味道和软化[1,2,3.,4,5,6,7,8,9,10].然而,除了一些转录因子(TFs)外,迄今为止,参与这些代谢途径调控的基因的功能表征非常稀缺。因此,一些转录因子所起的作用已被描述。FaMYB10,一个与次级代谢相关的R2R3 MYB TF,被描述为结构类黄酮/苯丙烷代谢途径基因的成熟相关的主调控基因[9];和苯类化合物的释放(FaEOBII),是类黄酮/苯丙烷挥发性相关基因的正向调节因子肉桂醇脱氢酶(FaCAD1)及丁香酚合成酶2(FaEGS2),可控制成熟草莓花托中丁香酚(一种挥发性苯丙类化合物)的产生[8].最近,一种dof型TF (FaDOF2)也被鉴定为成熟草莓花托中丁香酚生物合成的正调控因子。FaEOBII和FaDOF2似乎都协同作用于激活FaEGS2基因转录[11].在这种情况下,ERF-MYB TF复合物通过醌还原酶转录调控调控呋喃醇的生物合成[12].另外一种R2R3 MYB TF FcMYB1也被鉴定出其功能作用。该TF是花青素/原花青素生物合成分支点的调节因子[13].同时,FaGAMYB被描述为从营养生长到成熟过程过渡的调节剂[14].此外,还证实了c型MADS-box TF表达的瞬时下调(SHATTERPROOF-like基因;FaSHP)使到达粉色成熟阶段所需的时间稍短一些[7].此外,在这些瞬时修饰的果实中,几种成熟相关基因的转录以及几种代谢产物的含量都发生了改变[7].本文认为稻草人样8 (FaSCL8)可能通过对黄酮类/花青素生物合成相关基因的影响,调控其转录调控FaMYB10基因表达[15].此外,FaMYB44.2被提议与之互动FaMYB10在蔗糖的积累中,这会对成熟过程产生影响[16].另一方面,四种tf (FaMYB9/FaMYB11、FabHLH3和FaTTG1)已被描述为参与草莓未成熟果实原花青素(PAs)生物合成的基因的阳性激活因子[17].通过对突变的白色草莓和天然的红色草莓进行比较,发现了一些可能参与花青素生物合成的TF [18].
我们小组以前进行的高通量转录组学分析[19]使我们能够识别一种编码非典型HLH的成熟相关基因(FaPRE1)属于基本的螺旋-环-螺旋/螺旋-环-螺旋(bHLH/HLH) tf家族。FaPRE1根据其表达特征选择:a)与成熟相关;b) receptacle-specific;c)生长素负调控,d) ABA诱导[19].根据它们的dna结合能力,这些蛋白质被分为两类;dna结合的bHLH (bHLH)和非dna结合的bHLH (HLH)蛋白,也称为非典型HLH [20.,21,22,23,24].bHLH tf包含两个明显分化的结构域,一个位于蛋白质的氨基端,包含13-17个碱性氨基酸的基本结构域,以及一个位于羧基端的HLH区域,包括两个富含疏水氨基酸的两亲性α-螺旋,由一个可变长度的环连接。基本结构域赋予转录因子与DNA结合的能力[24,25,26而HLH motif的存在赋予了与其他bHLH蛋白建立同源或异二聚体相互作用的能力,这对于DNA识别和DNA结合特异性至关重要[22,24].相反,HLH蛋白在碱基区特别分化,通常缺乏形成适当DNA结合域的关键序列,因此不具有DNA结合能力[25].HLH蛋白可与其他bHLH蛋白二聚[24,27,28,29],从而通过形成异源二聚体作为bHLH蛋白作用的负调控因子。这种相互作用将避免bHLH蛋白与其他bHLH蛋白相互作用,并以这种方式与相应的bHLH蛋白相互作用独联体DNA上的序列[24,29,30.,31,32,33,34].
多项研究表明,非典型HLH蛋白在激素信号和细胞伸长中起着重要的调节作用[20.,35,36,37,38]、光信号[39]、维管束和果实发育[30.,34]或粒度[40,41].在这个意义上,功能分析发现AtPRE1 (拟南芥耐多效唑(PACLOBUTRAZOL RESISTANCE 1),一种非典型HLH蛋白,在对赤霉素反应的基因中起激活作用,可能在DELLA蛋白下游[20.].AtPRE1也调节器官伸长以响应BRs [31,32].因此,AtPRE1与IBH1相互作用(ILI1结合bHLH 1),这是另一种负调控ACE1(细胞延伸激活因子1)的非典型HLH。当AtPRE1与IBH1相互作用时,它阻止其与ACE1结合,并恢复ACE的转录能力以诱导细胞延伸[31,32].因此,这种通常用于这些转录调节因子发挥功能的三拮抗bHLH系统似乎在决定植物细胞的最终大小方面很重要[31,32].
此外,在番茄中精准医疗例如基因SlStyle2.1控制花柱的伸长和长度,也与栽培品种自花授粉花的进化有关[42].在所有这些情况下,三拮抗bHLH蛋白的平衡可能对决定植物细胞的大小和细胞伸长的调节都很重要,这些调节作用于多个外部和内源性信号的下游[31,32,43].
bHLH/HLH调控因子在水果成熟过程中的作用尚不清楚。在水果中,仅在番茄中有非典型HLH (SlPRE2),似乎参与未成熟果实的发育,但不参与果实成熟的各个阶段[33,34].该转录因子主要在果实发育中表达,由于果皮变薄,其转录的沉默减少了果实的大小[34].此外,SlPRE2转录为GA3.-在未成熟的绿色水果中诱导。作者认为SlPRE2可能通过调节细胞膨胀来调节果实大小[34].
然而,bHLH/HLH在果实成熟过程中所起的具体作用尚不清楚。在本文中,我们介绍了一种非典型HLH蛋白(FaPRE1)在草莓花托成熟过程中的功能特征。该基因的转录模式是花托特异性的,在成熟阶段明显可诱导。此外,FaPRE1转录被花托内ABA (ABA)的浓度正调控,而不受GA含量的影响3..暂时的沉默FaPRE1花托中农渗的转录在诱导花托生长相关基因转录的同时,下调了一组与成熟过程相关的基因。所有这些结果都表明FaPRE1在花托成熟过程中起着新的重要的关键功能作用,不同程度地协调与花托生长相关的基因和与花托成熟相关的基因的拮抗转录。
结果
FaPRE基因编码非典型HLH蛋白
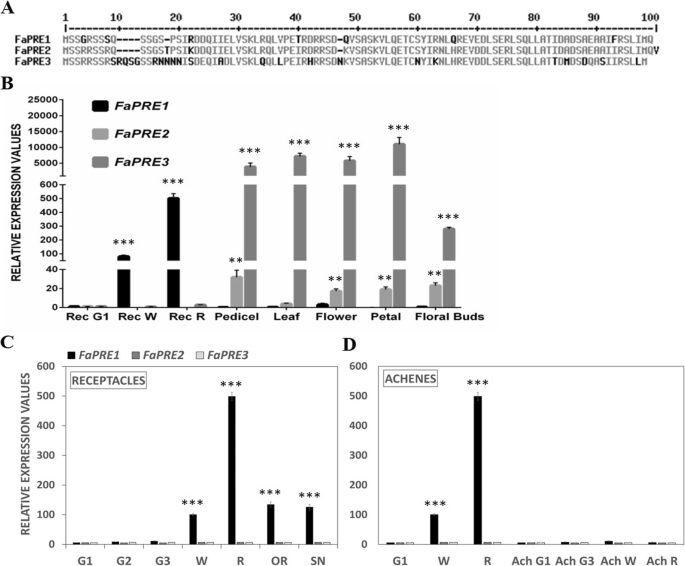
可采Fragaria vesca (v2.0.a2)生物信息学分析[44),Fragaria x ananassa基因组(v1.0-a1) [45使我们能够确定三种精准医疗基因(FaPRE我们命名的草莓基因组FaPRE1(gene30478),FaPRE2(gene28320),FaPRE3(gene03986).推导出的蛋白的比较FaPRE这些基因中90%的氨基酸序列是相同的(图;1a).系统发育分析显示FaPRE1、FaPRE2和FaPRE3蛋白可归为32个植物bHLH/HLH亚家族中的非典型HLH亚群16 [22](其他文件1,2).
一个FaPRE1, FaPRE2和FaPRE3蛋白预测氨基酸序列的比对。b-dqRT-PCR分析FaPRE基因在不同组织中的表达草莓属xananassa“Camarosa”植物。b分析FaPRE部分发育中花托与营养组织比较的基因表达。分析FaPRE花托内的基因表达(c)和瘦果(d)在不同的发展阶段。Rec G1和G1,小绿果;G2,中等大小的绿色水果;G3,完整大小的绿色果实(G1和G3:发育阶段);娱乐W和W,白色舞台;Rec R和R,成熟期;或,过熟阶段;SN,衰老阶段。结果采用3'UTR特异性引物,基于Ct值进行定量。相对表达值计算相对于花托G1期CT值,它被赋予了一个等于单位的任意值。数值为5个独立实验的平均值±标准差。与参考样本相关的统计学意义由学生的决定t以及:* *p< 0.01, ***p< 0.001
此外,利用InterProScan软件对FaPREs氨基酸推断序列的分析显示,与其他类似的PRE-like蛋白一样,FaPREs在蛋白质的氨基末端缺乏基本区域,这是bHLH转录因子的特征,负责其特定的DNA结合能力。非典型HLHs与bHLHs转录因子相互作用,并以这种方式通过阻断其与转录因子的结合来干扰其调控活性独联体-调控序列位于基因启动子上,调节。在这个意义上,假定的螺旋-环-螺旋(HLH)结构域的存在,这对于与其他HLH转录因子的相互作用是重要的,在三个FaPREs推导的蛋白质中被观察到(附加文件)3.B).值得注意的是,该HLH结构域在A. thaliana所有PRE家族成员中高度保守[20.],在水稻和葡萄等其他植物中也有3.C) (23,46].使用Plant-mPLoc程序(http://www.csbio.sjtu.edu.cn/cgi-bin/PlantmPLoc.cgi),以确定FaPREs的生物信息学预测,预测了这些蛋白质的核亚细胞定位(附加文件3.D),正如以前在其他植物物种中所描述的那样[47,48].
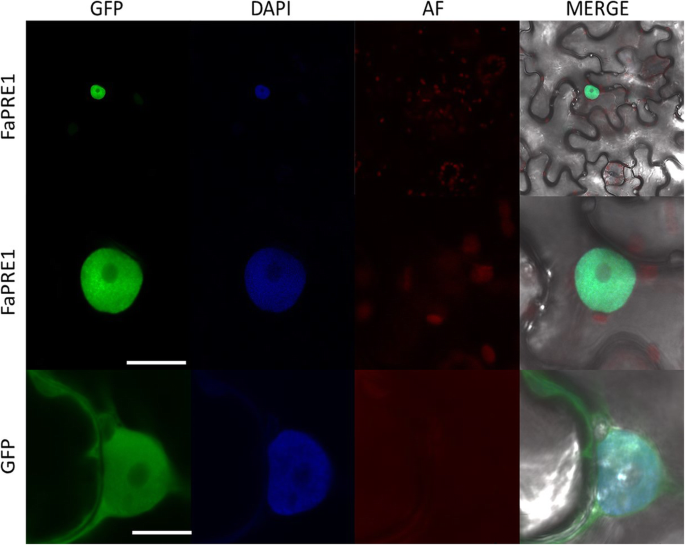
FaPRE1蛋白位于细胞核
为了证实与FaPRE1蛋白亚细胞位置相关的生物信息学预测,我们在体内进行了异体研究n benthamiana.为此,在CaMV35S启动子的控制下,FaPRE1和GFP蛋白之间的n端翻译融合蛋白构建被驱动。农业浸润叶片的共聚焦成像分析表明,融合蛋白与核标记物DAPI共定位(图2)。2).
的时空表达FaPRE基因表明FaPRE1是与成熟相关的基因吗
通过qRT-PCR研究确定三者的空间表达FaPRE基因。我们的分析表明FaPRE2而且FaPRE3转录局限于花托中转录稀少或可忽略的营养组织。然而,FaPRE1几乎只在成熟的花托中表达(图;1b).为此,对FaPRE1在不同生长成熟阶段的草莓花托中进行了表达。数据表明,的数量FaPRE1转录物在花托发育和成熟阶段稳步增加,在完全成熟阶段(R)达到最高转录水平。随后,在过熟阶段(OR)观察到转录物略有下降,在衰老阶段(SN)更明显,仅检测到低转录水平(图2)。1c).相反,瘦果中对应于不同发育和成熟阶段的转录水平与花托中观察到的值相比可以忽略不计(图2)。1d).此外,FaPRE1在营养组织中表达不显著。所有这些数据综合起来表明FaPRE1在草莓花托成熟过程中FaPRE2而且FaPRE3会在植物的营养组织中发挥它们的功能。
激素调节FaPRE基因转录
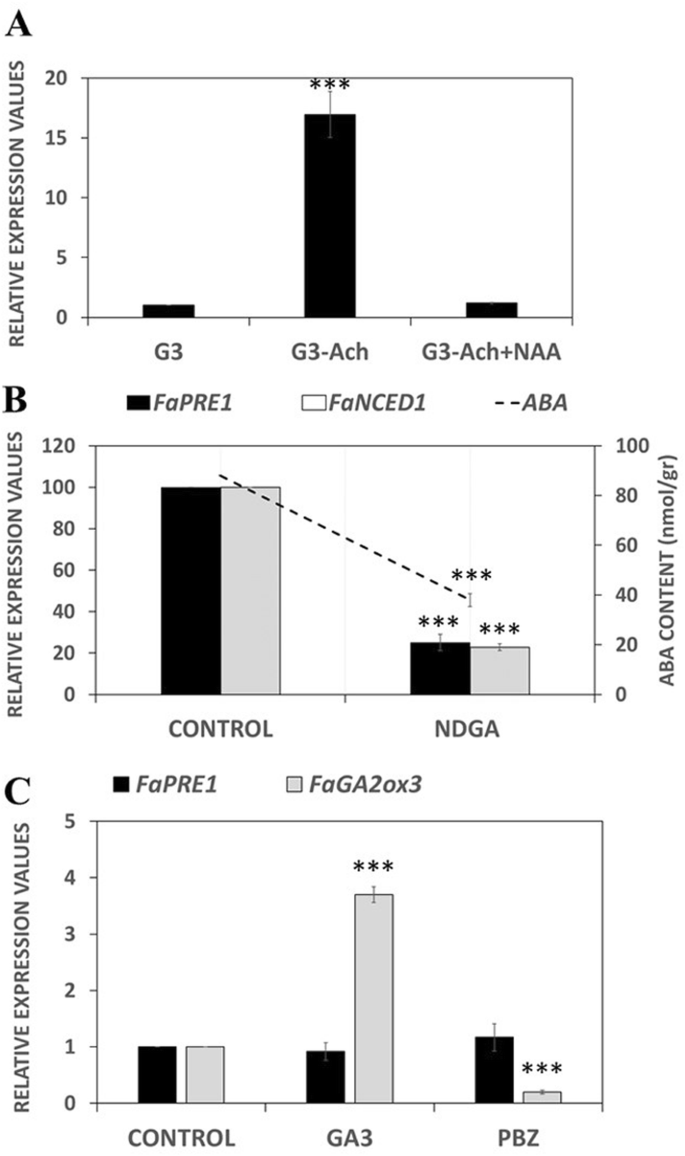
考虑到FaPRE1是一个成熟相关基因,研究了其受生长素和ABA的调控。此前有报道称,未成熟g3期果实表面瘦果的去除会降低花托中生长素的内部浓度,从而诱导许多成熟相关基因的转录[9,19].类似地,FaPRE1与对照容器(G3)相比,去瘦果容器(G3)的转录增加(图3)。3.a).正如预期的那样,外用人工合成的生长素IAA可以消除这种诱导(图。3.a).两个结果都表明FaPRE1在未成熟花托中,基因转录受到生长素内部含量的负调控。另一方面,又支持了前人数据的转录FaPRE1在花托中,ABA的产生是通过NDGA处理果实抑制FaNCED1酶活性或通过暂时沉默FaNCED1酶活性而减少的FaNCED1转录(无花果。3.b) (9].这种不同的激素表达模式表明,就像许多与成熟相关的基因一样,FaPRE1基因转录受ABA/生长素的比例直接或间接调控[19].
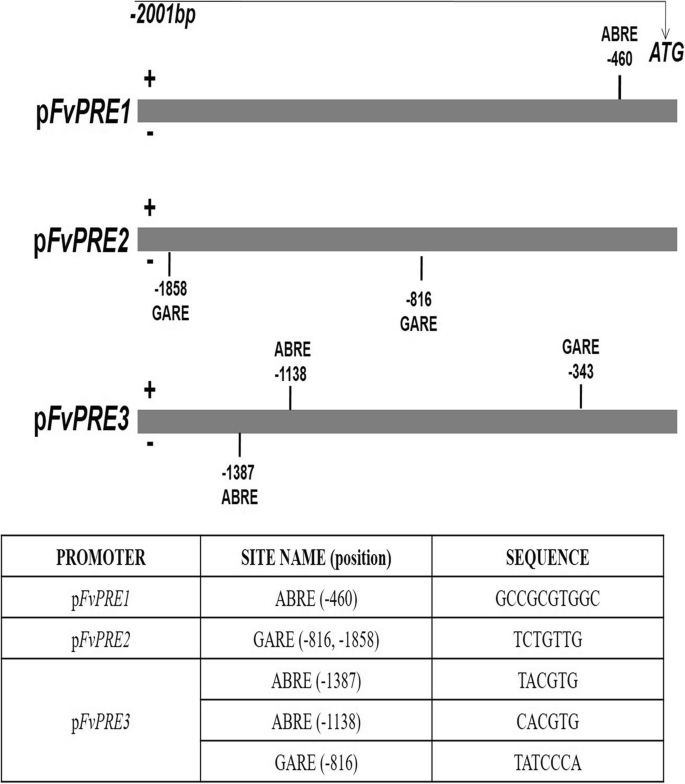
A. thaliana,先前已经证明,赤霉素(GA)通过增加细胞的生长来调节细胞的伸长AtPRE1转录(20.].另一方面,SlPRE2也显示了GAs在番茄果实发育过程中细胞增大的重要作用[34].在草莓果实花托中,虽然内源GA含量已在花托发育和成熟过程中测定[49,50], GAs与果实成熟的关系尚未建立。以确定是否FaPRE1在GA的控制下,草莓果实被注射了赤霉素(GA)3.)或多效唑(PBZ),一种阻止赤霉素生物合成的化合物。有趣的是,在这两种情况下,没有检测到显著的变化FaPRE1处理过的果实与未处理对照果实之间的转录GA2ox3一个与草莓果实GA降解相关的控制基因,分别被GAs和PBZ处理抑制(图2)。3.c).此外,与对照组相比,处理后的果实未观察到表型变化(数据未显示)。这些结果否定了赤霉素对植物生长的影响FaPRE1成熟水果的基因转录。这一事实被生物信息学分析pFaPRE1启动子显示GARE缺失独联体-该启动子中的调控序列(赤霉素反应的DNA识别位点)(图。4).
与此相反,GA处理的草莓离体植株3.显示了导致植株伸长的形态变化,而PBZ处理的植株表现出矮化的表型(附加文件)4).分析FaPRE处理后植株叶片、花梗和根的基因转录水平均高于未处理的植株FaPRE2在所有分析的GA组织中都增加了其转录3.植物在FaPRE3转录与对照相比没有变化(附加文件4罪犯)。此外,FaPRE2而且FaPRE3在PBZ存在的情况下,所有组织的转录都显著降低(附加文件4罪犯)。这表明FaPRE2而且FaPRE3在GA的监管下3.可能在营养组织中赤霉素信号传导中起积极作用,但在果实中不起作用。此外,两个基因的启动子分析均呈现gare -motif。在p中FaPRE2启动子区存在两个gare -motif,而在pFaPRE3只有一个人存在(图。4).这些数据不仅支持这一观点FaPRE2而且FaPRE3转录受赤霉素调控,但每个基因对这种激素的反应的转录水平与其启动子序列中确定的gare -motif的数量有关。此外,这些结果支持了转录FaPRE1不依赖于GA3.的水平。
转基因容器的高通量转录分析FaPRE1转录被抑制了
考虑到FaPRE1是转录共调节因子,以确定假定的功能作用FaPRE1在成熟过程中,我们通过RNAi-暂时沉默其在成熟果实中的转录FaPRE1agroinfiltration方法。RNAi -FaPRE1与对照花托相比,沉默花托没有表现出任何表型变化(数据未显示)。使用定制的寡聚微阵列平台[19],转基因花托之间的转录组比较,其中FaPRE1转录被沉默,与对照容器进行对比(附加文件5,6),所得数据经qRT-PCR验证(附加文件7).转录组结果及其与红色花托转录组的比较[19],结果表明,基因中有227个基因转录下调FaPRE1沉默的成熟花托,其中160个(70%)也是成熟相关基因(附加文件)8,9).相比之下,RNAi-中有276个基因的转录上调FaPRE1其中211个(76%)花托在未成熟的草莓花托中过表达(附加文件)8,10).
在RNAi中转录下调的成熟相关基因中-FaPRE1成熟花托中,我们发现转录因子为FaMyb10(gene31413),FaEOBII(gene28435) [8,9](其他文件9,10).在成熟过程中对黄酮类/苯丙类途径起调节作用的两种转录因子在转基因花托中均显著下调FaPRE1转录沉默(表1).在草莓成熟过程中,其他基因也表现出了同样的行为,比如gene21638(FaPG1,polygalacturonase-1[51])和gene31030(FaRGlyaseI,rhamnogalacturonate lyase-1[52]),合成与成熟过程中细胞壁分解有关的水解酶;gene28407(FaQR,醌氧化还原酶[53]),gene07931(FaAAT2,醇酰基转移酶2[6])和gene34009(FaAAT1,醇酰基转移酶-1[54]),会合成与酯类生物合成有关的酶,这些酯类生物合成有助于水果的最终香气;而且gene14611(FaF3H,黄烷酮3-hydroxylase[55]),gene20700(FaCAD1,肉桂醇脱氢酶-1[56])和gene25260(FaEGS2,丁香酚合成酶-2[57]),与草莓成熟果实中苯丙类化合物的生物合成有关(表1).所有这些结果似乎都表明FaPRE1基因可能在草莓成熟过程中起调控作用。
另一方面,FaPRE1沉默诱导未成熟的绿色花托、发育和生长期转录水平较高的基因表达,而在成熟阶段转录水平不高。这些基因大多与代谢和细胞壁重塑有关,这两个过程对果实的生长发育至关重要。因此,FaPRE1沉默明显诱导转录gene01986而且gene02631编码aXyloglucan endotransglucosylase /水解酶和一个Xyloglucan糖基转移酶分别(表2).这些基因可能与细胞壁生长过程中木葡聚糖片段的羟基化和重连接有关[58].同样的,gene23429(果胶裂解酶12),gene04435(Expansin-A1)的含量也有所上升FaPRE1rnai插座。请而且棒曲霉素与细胞伸长和细胞壁延长有关[58)(表2).此外,转录gene20426而且gene26607在相同的容器中也被诱导。这两个基因都编码β -葡萄糖苷酶,这种酶可能参与纤维素降解[58)(表2).否则,转录gene09384, gene11861而且gene24005,编码生长素外排载体,一个生长素反应蛋白IAA27,以及吲哚-3-乙酸-酰胺合成酶GH3.1分别在中过表达FaPRE1 -RNAi容器(表2).这三个基因与对生长素的反应有关,生长素是一种调节草莓花托生长发育的激素[59].
讨论
在这篇文章中,我们介绍的功能特征FaPRE1这种基因属于草莓FaPRE家庭(FaPRE1,FaPRE2而且FaPRE3),它们是假定的同源的AtPRE基因拟南芥。
FaPRE1由于缺乏DNA结合域,该基因被归为非典型bHLHs亚家族的成员。在这个亚科中还包括ILI-1水稻基因[32],SlPRE2源自tomato [33],以及拟南芥前家庭(22](其他文件1,2,11).AtPRE1 [20.], atbs1 [39]、PGL1及APG [40,60],以及IBH1 [31]通过bHLH转录因子的异二聚体阻塞,作为阻遏物参与转录调节过程。正如生物信息学分析所预期的那样,FaPRE1的核定位(图。2,附加文件3.D)支持它们与转录调节过程的关系。根据我们的实验数据,FaPRE1可以在草莓果实成熟过程中发挥类似的作用。
FaPRE1水果成熟
FaPRE1提出了一个成熟相关基因的表达模型,其在未成熟花托和营养组织中的转录值可以忽略不计,但在成熟阶段的转录值较高。在草莓中,这是一种常见的转录模式,绝大多数与成熟相关的基因都有这种转录模式[19].这种表达模式的特点是:a)与成熟相关;b) receptacle-specific;c)生长素负调控,d) ABA诱导。FaPRE1遵循这些标准以来的量FaPRE1转录随着花托的成熟而增加(图;1c),优先在成熟的红色花托中表达(图。1c)。否则,FaPRE1转录也被生长素负调控,但被ABA正调控(图。3.a - b)。的时空和激素转录谱FaPRE1符合上述准则,并符合[59],他认为ABA/生长素的比例决定了草莓花托从发育期到成熟期的过渡。因此,生长素会在未成熟的瘦果中产生,并释放到花托中,促进其生长,但防止过早成熟。随后,生长素的产生将被抑制,随后,花托内ABA的内源性生物合成将被刺激,增加ABA/生长素的比例,从而促进成熟过程[59].这一建议最近得到了实验证明[2,5,9].在编码转录因子的其他成熟相关基因中也发现了类似的转录模式,如FaMYB10[9],FaEOBII[8]或FaDOF2[11].此外,据报道精准医疗样基因受GAs的正向调控[20.,43].这不是FaPRE1基因自GA治疗花托以来3.没有导致其表达的增加,不像GA2ox3控制基因,丢弃任何参与该激素的调节FaPRE在成熟草莓果实中转录1。3.c).这一假设通过在p区缺乏对GAs (GARE-motifs)响应的调控序列而得到加强FvPRE1启动子(无花果。4).然而,这些母题出现在pFvPRE2和pFvPRE3启动子,两个在营养组织中有特定表达的基因。所有这些表达式数据都表明FaPRE1起着不同的生理作用FaPRE2而且FaPRE3,主要研究果实成熟的过程。
在软质水果中,除番茄外,所起的功能作用较少精准医疗水果成熟过程中的类基因还没有被研究过。最近,一段关系精准医疗类非典型HLH基因(SlPRE2),而番茄果实的生长已被证实[33,34].因此,在番茄未成熟的果实中,SlPRE2似乎具有抑制叶绿素积累和叶绿体发育的作用。此外,它还抑制了水果成熟过程中参与类胡萝卜素生物合成的基因的转录[33].然而,SlPRE2呈现与观察到的不同的表达模式FaPRE1.因此,虽然SlPRE2在根、幼叶、成熟叶、衰老叶、花和萼片等果实和营养组织中均有表达FaPRE1转录仅限于成熟的花托。在番茄营养组织中,转录水平最高的部位是伸长过程较为活跃的幼叶和花。这不是…的情况FaPRE1,其转录主要局限于花托成熟的最后阶段,在这一阶段细胞伸长的过程并不显著。除此之外,SlPRE2在小番茄未成熟果实中强烈表达,但其转录水平随着生长而下降,尽管在随后的成熟过程中其转录水平略有上升[33,34].相反,FaPRE1转录在花托成熟过程中不断提高。表达数据表明FaPRE1发挥了不同于FaPRE1的生理功能SlPRE2在番茄果实中。否则,SlPRE2超表达(35 s -SlPRE2),导致番茄果实中叶绿素含量和类胡萝卜素含量分别下降,成熟果实中叶绿素含量和类胡萝卜素含量分别下降。与此同时,果实中与叶绿素代谢和光信号相关的基因如GLK2、HY5、rbc和Cab7转录水平下调。此外,与类胡萝卜素生物合成有关的基因,如植物素合成酶(PSY1)、植物素去饱和酶(PDS)和胡萝卜素去饱和酶(ZDS)的转录在35S-显著下调SlPRE2番茄红素含量降低的转基因成熟果实[33].这些发现表明SlPRE2通过抑制这些叶绿素和类胡萝卜素生物合成基因的表达来调节叶绿素和类胡萝卜素含量。除此之外,SlPRE2可能通过GA途径决定果实大小3.-依赖于调节果皮细胞扩张[34].但是,在草莓成熟过程中,有调控作用FaPRE1功能似乎与…截然不同SlPRE2.当然,两者之间进行了比较分析FaPRE1-RNAi和对照容器的转录组已经表明FaPRE1发挥双重功能,调节两组基因的转录,其表达模式是拮抗的。其中一组包括那些与成熟相关的基因,主要在果实成熟过程中表达在花托中,而另一组包含那些表达谱与花托营养生长更相关的基因(附加文件)9,10).
这些基因的转录可能受到FaPRE1在成熟的花托中,我们发现基因参与了与水果感官特性相关的几个代谢过程。例如,参与黄酮类/苯丙类代谢基因转录调控的基因,编码两个R2R3 MYB转录因子为FaMYB10而且FaEOBII[8,9].我们之前已经证明,FaMYB10调控黄酮/苯丙类途径中大多数早期调控生物合成基因(EBGs)和晚期调控生物合成基因(LBGs)的转录,包括黄酮醇-3-hidroxylase (FaF3H),查尔酮合成酶(FaCHS)二hidro黄酮醇还原酶(DFR),肉桂酰辅酶a还原酶(FaCCR),肉桂醇脱氢酶(FaCAD1),丁香酚synthase-2(FaEGS2) [9].此外,FaMYB10调节FaEOBII表达,进而调节编码FaEGS2的基因的转录,FaEGS2是一种参与苯丙醇挥发性丁香酚生物合成的酶[8,57].所有这些基因的转录也在FaPRE1-RNAi容器(表3.).这些结果表明FaPRE1可能通过调控苯丙素通路发挥重要的调节作用FaMYB10bHLH的功能是在未成熟的花托中抑制该FT的基因表达。
此外,细胞壁相关基因的表达为FaPG1而且FaRGlyaseI[51,52],之前已被证明参与细胞壁分解,在RNAi-中也被下调FaPRE1插座(表1).
其他基因也表现出同样的行为,这些基因在草莓成熟过程中的功能已被描述,并与香气产生有关。例如,在RNAi-中转录下调的基因之一FaPRE1草莓花托与成熟有关FaQR编码醌氧化还原酶的基因.我们已经证明了这种酶对呋喃醇(4-羟基-2,5-二甲基-3(2H)-呋喃酮;HDMF)生物合成,草莓果实香气最重要的成分之一[61].此外,编码两种酶的基因的转录参与了促成成熟水果最终香气的关键酯的生物合成,如FaAAT1 (醇酰基转移酶-1)及FaAAT2 (醇酰基转移酶2) [6,54],在RNAi-中也下调FaPRE1草莓插座。所有这些基因都有一个共同的表达谱,即花托成熟相关基因1).总的来说,所有这些结果似乎都表明FaPRE1基因在草莓成熟过程中起调控作用。
如上所述,PREs是一种HLH蛋白,它缺乏DNA结合所需的基本结构域,但与DNA结合因子bHLH二聚化以抑制其DNA结合能力[20.,33,62,63].在这个意义上,我们假设FaPRE1可能通过形成非活性的FaPRE1 HLH: bHLHa异二聚体复合体来发挥其转录调控特性,该复合体将提取可用的bHLHa数量以形成同源或异二聚体转录活性复合体。我们认为这种异二聚应该会抑制假定的异二聚体(bHLHa:bHLHb)转录激活物的形成。该复合物可上调未成熟花托中特异性表达的非成熟相关基因的转录。这些基因与生长发育阶段有关,在成熟的花托中必须被沉默。相反,在成熟花托中,FaPRE1会抑制另一个bHLH异二聚体负调控复合物的形成,该复合物决定了成熟相关基因的下调,但在未成熟的未成熟花托中。该阻遏物将由两个DNA结合的基本螺旋-环-螺旋(bHLHa:bHLHc)的异二聚体构成。因此,成熟花托中抑制复合体的形成将通过隔离其中一个单体伙伴(bHLHa)而被抑制。这样可以避免成熟相关基因的抑制,从而促进其表达。
相互作用的相似但不相同的机制FaPRE类基因和bHLHs对不同信号的反应,包括光、温度、BRs和GAs,已被描述[31,32,43].例如,3精准医疗基因(PRE1, PRE3/ATBS1, PRE6/KIDARI)正向调节器官伸长以响应GAs, BRs和光信号[20.,35,39]通过与其他负向调节细胞伸长的bHLH转录因子的相互作用,如AtIBH1, AIFs和HFR1 [35,39,64].在拟南芥,三拮抗bHLH系统级联响应多种激素和环境信号通路负向调节细胞伸长[43].在该系统中,同源二聚体HBI1:HBI1直接结合到两个EXPANSIN基因的启动子上,激活其转录。否则,IBH1与HBI1的相互作用通过异二聚体抑制激活剂同型二聚体的产生,这反过来决定了两种EXPANSIN基因的抑制。此外,PRE1通过在PRE1:IBH1异源二聚体形成过程中隔离其抑制剂IBH1,激活HBI1的DNA结合能力[43].此外,这种三拮抗系统已在bHLH细胞延伸激活因子1(ACE1)和两种非典型HLH蛋白AtIBH1和PRE1之间的相互作用中得到证明拟南芥[31]以及ACE1和ATBS1相互作用因子(AIF2, AIF3和AIF4)或PRE1对BRs和光的响应[32].同样,通过类似的调控系统,ARF/BZR/PIF相互作用刺激下胚轴伸长拟南芥[38].
显然,在草莓中,FaPRE1不起到类似的作用SlPRE2并且不能被认为是同源基因。然而,它的功能显然与水果的成熟过程有关。事实上,基因是由FaPRE1有什么不同SlPRE2.
结论
总之,这项工作首次在草莓成熟果实中提供了支持非典型HLH重要新功能的实验数据FaPRE1在水果成熟的时候。FaPRE1拮抗协调与花托生长和成熟相关基因的转录。因此,在成熟花托中,FaPRE1抑制了花托生长促进基因的转录,同时激活了与花托成熟过程相关的基因的转录。
方法
植物材料
Fragaria × ananassa杜赫。(简历。Camarosa)植物是在Huelva(西班牙西南部)的田间条件下种植的。草莓果实和瘦果在不同发育成熟阶段收获:小绿果(G1, 2-3 g)、中等绿果(G2, 3-5 g)、大绿果(G3, 4-7 g)、白色果(W, 5-8 g)、熟透红果(R, 10-20 g)、过熟果(OR, 10-20 g)和衰老果(SN, 10-20 g)。还收集了花、花蕾、花瓣和花梗、膨大叶等营养组织。烟草benthamiana草莓(F. × ananassa杜赫。简历。Elsanta)在25°C, 10,000 lx和80%湿度的植物室中进行渗透。所有分析的组织立即在液氮中冷冻,然后在−80°C保存。草莓植株是在“Viveros California S.L.”(西班牙Huelva)获得的烟草benthamiana种子是Muñoz-Alamillo博士的礼物。
激素治疗
为了消除果实中的生长素,按照[9].简单地说,用含有吲哚-3-乙酸(IAA) 1mm, 1% (w/v)二甲基亚砜(DMSO)的羊毛脂膏覆盖一组去酸G3水果。另一组去酸果实(对照组)涂上同样的膏体,但不涂IAA。样品采集和分析按照[9].
对于赤霉素酸(GA3.)处理,草莓果实在G2期注射多效唑(PBZ) 100 μM和GA3.100μM。PBZ是一种三唑,可减缓植物生长,阻断赤霉素的合成[65].对照组的水果被注入水。每个处理共浸泡30个果实。实验24 h后收获果实。同时,在离体草莓植株中(F. × ananassa杜赫。简历。Chandler),在添加2.2 mM激动素的N30K培养基中微繁殖[66],用赤霉素处理。在添加GA的MS培养基中培养2组6个独立无性系3.(100 μM)和PBZ (100 μM),并在收获前在生长室中保存11天。未处理的植物作为对照。采集后的所有样品和组织立即在液氮中冷冻,然后在−80°C保存。
为了阻断ABA的生物合成,20个草莓果实(F。xananassa简历。以100 μM的正二氢愈创木酸(NDGA)注射于G3期。NDGA是9-的理想抑制剂独联体-环氧类胡萝卜素双加氧酶活性[67]并且先前已证明它可降低成熟果实花托的内源性ABA浓度[9].果实注射1-2 ml NDGA溶液或水(对照果实),处理8d后收获,液氮冷冻,−80°C保存待用。用这些样品测定ABA含量和相对表达量FaPREs而且FaNCED1基因。
脱落酸含量的定量
以氘化脱落酸(dABA)为内标。草莓样品中ABA的制备和ABA的提取均按照[9].为了测定ABA的含量,采用HPLC-MS系统(VARIAN 1200 L三重四极杆)和色谱柱(150 × 2.1 mm id . Phenomenex C183 μm颗粒)(加利福尼亚州,美国)。用于分析的条件和程序与[9].
生物信息学资源
国家生物技术信息中心资源(NCBI)http://www.ncbi.nlm.nih.gov)和欧洲生物信息学研究所服务器(EBI) (http://www.ebi.ac.uk/)用于硅片研究FaPRE基因序列与数据库。采用EBI ClustalW2程序或MegAlign程序(来自Lasergene DNASTAR软件包)和FigTree程序(http://tree.bio.ed.ac.uk/software/figtree/).域和功能位点的预测是使用InterProScan数据库(版本4.8)(www.ebi.ac.uk /工具/ pfa / iprscan /),并用Plant-mPLoc计算机程序(http://www.csbio.sjtu.edu.cn/cgi-bin/PlantmPLoc.cgi).BlastN还用于定位基因的位置f . vesca而且F。xananassa基因组的数据库(https://rosaceae.org).可用f . vesca(v 2.0.a2)基因组[44来确定FaPRE启动子序列。启动子分析FaPRE基因在PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/).
草莓果实RNAi构建及农渗转染研究
626-pb片段(RNAi-fragment)FaPRE1PCR扩增cDNA,克隆至PCR®8/GW/TOPO®载体(Invitrogen)。随后,通过LR重组将rnai片段转移到pFRN二元载体上(由Marten Denekamp提供)。RNAi结构(pFRN-FaPRE1)在转化草莓果实前进行测序和酶切分析。RNAi -FaPRE1Construct被转化为根癌土壤杆菌应变AGL1。利用rnai -构建体获得了转基因草莓果实FaPRE1因农业渗透而沉默的表情[68].根据[指示],用注射器将RNAi-construct注入草莓植株附着的整个果实的基底中。68].对15 ~ 25株草莓接种30 ~ 40个果实进行了接种分析。
亚细胞定位分析
用于定位研究的结构来源于二元载体pK7WGF2,它允许所选蛋白质与GFP的n端融合[69].草莓的282 bp CDSFaPRE1基因从F。xananassa使用特定引物的cDNA(附加文件12)并克隆到pDONR™221中。然后将pcr产物转移到pK7WGF2目的载体上,得到35个年代-绿色荧光蛋白-FaPRE1融合结构。生成的构造通过之前的测序进行测试n benthamiana叶子agroinfiltration。所使用的程序n benthamiana以前曾描述过农业渗透[8,10].n benthamiana用无性系浸种植物,表达FaPRE1-GFP和GFP。样品在农业浸润后2天在徕卡TCS SP8点扫描共聚焦显微镜上成像,使用预先设置的绿色荧光蛋白,Ex:488 nm, Em:500-550 nm。核染色时,在Ex:405 nm, Em: 448-525 nm成像前10分钟用40 μg/ml DAPI溶液染色。
RNA隔离
从三个不同发育阶段的草莓果实和植物营养组织中分离总RNA(每个池10个果实),根据[70].当使用草莓果实时,总是在从样品中提取RNA之前去除瘦果。在任何情况下,提取的RNA总是与DNase I (RNase free) (Invitrogen)一起孵育,以按照制造商的说明消除基因组DNA污染。使用Agilent 2100生物分析仪(Agilent Technologies, Deutschland)检查RNA质量和完整性。仅使用RIN值≥8的样本进行后续转录组分析。
微阵列生成和分析
产生的转录组变化FaPRE1使用定制的寡核苷酸微阵列平台(60 mer长度;FraGenomics 35 k),包含34.616个与草莓基因组计划中发表的序列相对应的单基因(http://www.strawberry.org).我们比较了注入空pFRN载体的对照红色容器与注入RNAi的红色容器的转录组-FaPRE1构造。同样的微阵列平台也用于草莓成熟果实过程的转录组分析,比较来自绿色(G1)花托和红色(R)花托的转录组[19].相应的数据存入GEO数据库(www.ncbi.nlm.nih.gov /地理/)使用GSE125995作消声数据,GSE126220作成熟数据[19].差异表达基因的选择标准为对数2折叠变化>±2和p两种分析均≤0.05。微阵列特性、杂交及处理条件如[8].
芯片数据验证及实时定量PCR表达分析
本文研究的基因在不同生理条件下的表达分析和微阵列验证,采用iCycler系统(BioRad)进行实时定量PCR (qRT-PCR),如前所述[9,71].设计3'UTR区域特异性引物,分析该基因的表达PRE -比如基因(FaPRE1,FaPRE2而且FaPRE3)在草莓基因组中被发现。此外,为了验证微阵列分析得到的表达数据,对在分析的实验情况下表现出差异表达的几个基因设计了特定的引物。额外的文件12描述用于所有定量扩增的引物序列。样本中基因表达量相对于对照基因的相对增减量根据Pedersen和[72].中间26 s-18s由于该基因具有组成性表达,因此选择该基因作为对照基因。
数据统计分析
统计显著性检验与学生t-使用SPSS软件进行测试。
数据和材料的可用性
在本研究期间生成和分析的数据集可在GEO资料库(www.ncbi.nlm.nih.gov /地理/)(沉默数据为GSE125995,成熟数据为GSE126220)。该数据自2019年10月18日起公开。
缩写
- 2,4 - d:
-
2,现在也是酸
- 阿坝:
-
脱落酸
- bHLH:
-
基本helix-loop-helix
- cd:
-
编码DNA序列
- 背景:
-
氘化脱落酸
- DAPI:
-
4 ' 6-diamino-2-phenylindole盐酸盐
- G1:
-
Green1阶段
- G2:
-
Green2阶段
- G3:
-
Green3阶段
- 遗传算法3.:
-
赤霉酸
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 通过:
-
Helix-loop-helix
- nc:
-
9 -独联体-epoxycarotenoid加双氧酶
- NDGA:
-
去甲二氢愈创木酸
- 或者:
-
过熟的阶段
- PBZ:
-
摘要
- PRE1:
-
多效唑耐药
- 存在:
-
实时定量PCR
- 接待员:
-
成熟的阶段
- RNAi:
-
RNA干扰
- SN:
-
衰老期(草莓果实发育的七个主观阶段)
- W:
-
白色的阶段
参考文献
Koyama K, Sadamatsu K, Goto-Yamamoto N.脱落酸对赤霞珠葡萄果实皮成熟和基因表达的促进作用。基因工程学报。2010;10:367-81。https://doi.org/10.1007/s10142-009-0145-8.
柴玉梅,贾海峰,李春林,董庆华,沈云云。FaPYR1参与草莓果实的成熟。中国科学(d辑),2011;
陈琳,刘勇,刘宏,康林,耿杰,盖勇,等。参与蓝莓类黄酮转运的MATE基因鉴定及表达分析。PLoS One. 2015;10:e0118578。https://doi.org/10.1371/journal.pone.0118578.
陈杰,刘东,姜勇,赵敏,单伟,匡杰,等。草莓FaASR基因与果实成熟关系的分子特征。科学通报。2011;6:e24649。https://doi.org/10.1371/journal.pone.0024649.
贾海峰,柴永明,李长林,陆东,罗建军,秦玲,等。脱落酸在草莓果实成熟过程中起着重要的调控作用。植物学报。2011;157:188-99。https://doi.org/10.1104/pp.111.177311.
Cumplido-Laso G, Medina-Puche L, Moyano E, Hoffmann T, Sinz Q, Ring L,等。果实成熟相关基因FaAAT2编码一种酰基转移酶,参与草莓香气生物发生。中国科学(d辑),2012;https://doi.org/10.1093/jxb/ers120.
一种抗shatter防样基因控制非更年期草莓的成熟,生长素和脱落酸拮抗其表达。中国科学(d辑),2013;https://doi.org/10.1093/jxb/ert214.
李志强,李志强,李志强,杨晓娟,López-Vidriero I,李志强,等。R2R3-MYB转录因子调节成熟草莓果实托中丁香酚的产生。中国生物医学工程学报,2015;https://doi.org/10.1104/pp.114.252908.
Medina-Puche L, cumpldo - laso G, Amil-Ruiz F, Hoffmann T, Ring L, Rodríguez-Franco A,等。MYB10在甜果成熟过程中对黄酮类/苯丙类代谢的调控中起主要作用。中国科学(d辑),2014;
马丽娜-伊达尔戈,马丽娜-普彻,马丽娟,马丽娟,等。FaNIP1基因是草莓果实成熟相关和花托特异性水通道蛋白。植物科学进展(英文版);
杨晓东,杨晓东,杨晓东,Cañete-Gómez C,杨晓东,López-Vidriero I,杨晓东,等。果实特异性转录因子FaDOF2调节成熟果实花托中丁香酚的产生。中国科学(d辑),2017;https://doi.org/10.1093/jxb/erx257.
张勇,尹旭,肖勇,张震,李松,刘旭,等。乙烯反应因子- myb转录复合物通过激活醌氧化还原酶在草莓中的表达来调控呋喃醇的生物合成。植物学报。2018:00598.2018。https://doi.org/10.1104/pp.18.00598.
Salvatierra A, Pimentel P, Moya-León MA, Herrera R.通过短暂抑制FcMYB1基因促进樱桃果实花青素积累。植物化学。2013;90:25-36。https://doi.org/10.1016/j.phytochem.2013.02.016.
Vallarino JG, Osorio S, Bombarely A, Casañal A, Cruz-Rus E, Sánchez-Sevilla JF,等。FaGAMYB在草莓花托从发育到成熟过渡过程中的中心作用。新植物学报。2015;208:482-96。
俞华伟,张志强,张志强,张志强。利用转录组相关网络分析鉴定成熟草莓果实类黄酮通路候选基因。中国科学(d辑),2015;https://doi.org/10.1093/jxb/erv205.
魏磊,毛伟,贾敏,邢松,阿里苏,赵颖,等。FaMYB44.2是一种转录抑制因子,通过与FaMYB10的相互作用负向调控草莓花托中蔗糖的积累。中国机械工程学报。2018;49:4805 - 20。https://doi.org/10.1093/jxb/ery249.
Schaart JG, Dubos C, Romero De La Fuente I, van Houwelingen AMML, De Vos RCH, Jonker HH,等。草莓果实原花青素合成调控复合物MYB-bHLH-WD40的鉴定与鉴定新植物,2013;197:454-67。https://doi.org/10.1111/nph.12017.
碱基/螺旋-环-螺旋转录因子的鉴定揭示了从草莓白肉突变体中参与花青素生物合成的候选基因。科学通报2018;8:2721。https://doi.org/10.1038/s41598-018-21136-z.
梅迪纳-普彻,R, Molina-Hidalgo FJ, cumpldo - laso G, García-Caparrós N, Moyano-Cañete E,等。脱落酸和生长素在草莓果实发育和成熟过程中所起作用的广泛转录组研究。中国生物工程学报。2016;16:671-92。https://doi.org/10.1007/s10142-016-0510-3.
李硕,李硕,杨金勇,金永明,朴世勇,金世勇,等。PRE1及其同源基因的过表达在拟南芥中激活赤霉素依赖反应。植物细胞物理学报。2006;47:591-600。https://doi.org/10.1093/pcp/pcj026.
rog - villanova I, boun - torrent J, Galstyan A, Carretero-Paulet L, Portolés S, Rodríguez-Concepción M,等。避荫和生长素反应的相互作用:两种新的非典型bHLH蛋白的作用。Embo j . 2007; 26:4756-67。https://doi.org/10.1038/sj.emboj.7601890.
卡雷特罗-保莱特L,加尔斯特安A,罗伊-维拉诺瓦I,马丁内斯-加西亚JF,比尔巴奥-卡斯特罗JR,罗伯逊DL。拟南芥、杨树、水稻、苔藓和藻类中bHLH转录因子家族的全基因组分类和进化分析。植物科学进展。2010;https://doi.org/10.1104/pp.110.153593.
张超,冯锐,马锐,沈震,蔡震,宋震,等。桃基本螺旋-环-螺旋超家族成员全基因组分析。PLoS One, 2018;13:e0195974。https://doi.org/10.1371/journal.pone.0195974.
魏凯,陈华。水稻、玉米和小麦bHLH基因家族的比较功能基因组学分析。BMC植物生物学,2018;18:309。https://doi.org/10.1186/s12870-018-1529-5.
masari ME, Murre C.螺旋-环-螺旋蛋白:真核生物中的转录调控因子。分子生物学杂志2000;20:429-40。https://doi.org/10.1128/MCB.20.2.429-440.2000.
tolido - ortiz G, Huq E, Quail PH.拟南芥基本/螺旋-环-螺旋转录因子家族。《植物科学》2003;15:1749-70。https://doi.org/10.1105/tpc.013839.
赫罗尔德,M, Beuger V, Frohme C, Beul D, Hillukkala T,等。Myc通过与mis -1相关对哺乳动物紫外线反应的负调控。化学学报。2002;10:509-21http://www.ncbi.nlm.nih.gov/pubmed/12408820.
Hernandez JM, Feller A, Morohashi K, Frame K, Grotewold E.玉米R的基本螺旋环螺旋结构域通过招募emsy相关因子连接转录调控和组蛋白修饰。自然科学进展,2007;26(3):344 - 344。https://doi.org/10.1073/pnas.0705629104.
申凯,李i,金e,朴s,苏美生,李s。拟南芥多效唑抗性基因家族对花器官生长的调控作用。中国药理学杂志2019;20:869。https://doi.org/10.3390/ijms20040869.
Castelain M, Le Hir R, Bellini C.非dna结合bHLH转录因子PRE3/bHLH135/ATBS1/TMO7参与拟南芥光信号通路调控。《植物科学》2012;145:450-60https://doi.org/10.1111/j.1399-3054.2012.01600.x.
Ikeda M, Fujiwara S, Mitsuda N, Ohme-Takagi M.一种三拮抗基本螺旋-环-螺旋系统调节拟南芥细胞伸长。《植物科学》2012;24:483 - 97。https://doi.org/10.1105/tpc.112.105023.
Ikeda M, Mitsuda N, Ohme-Takagi M. ATBS1相互作用因子在三拮抗bHLH系统中负向调控拟南芥细胞伸长。植物学报。2013;8:e23448。https://doi.org/10.4161/psb.23448.
朱震,陈刚,郭旭,尹伟,于旭,胡健,等。SlPRE2是一种非典型bHLH转录因子,其过表达影响番茄植株形态和果实色素积累。科学代表2017;7:5786。https://doi.org/10.1038/s41598-017-04092-y.
朱震,梁辉,陈刚,李峰,王勇,廖超,等。bHLH转录因子SlPRE2调控番茄果实发育并调节植物对赤霉素的反应。植物细胞代表2019。https://doi.org/10.1007/s00299-019-02425-x.
Hyun Y, Lee I. KIDARI编码非dna结合bHLH蛋白,抑制拟南芥光信号转导。植物分子生物学杂志,2006;https://doi.org/10.1007/s11103-006-0010-2.
金勇,宋建辉,朴秀秀,郑永生,金世辉。油菜素类固醇诱导的转录抑制和去磷酸化依赖的蛋白质降解负向调控bin2相互作用的AIF2 (BR信号负调控因子)bHLH转录因子。植物细胞物理学报,2017;58:227-39。https://doi.org/10.1093/pcp/pcw223.
卢荣,张娟,刘东,魏玉林,王勇,李晓波。棉花(Gossypium hirsutum)纤维发育过程中油菜素类固醇(BR)信号通路相关bHLH/HLH基因的鉴定。BMC植物生物学2018;18:304。https://doi.org/10.1186/s12870-018-1523-y.
吴娥,朱建勇,白明英,Arenhart RA,孙勇,王志勇。在拟南芥下胚轴中,细胞伸长是通过相互作用的转录因子的中央回路调节的。Elife。2014;3。https://doi.org/10.7554/eLife.03031.
王红,朱勇,李娟,李娟。拟南芥油菜素内酯信号通路的非典型碱基螺旋-环-螺旋蛋白调控。植物学报。2009;21:3781-91。https://doi.org/10.1105/tpc.109.072504.
Heang D, Sassa H.,谷长2正调控因子编码的非典型bHLH蛋白通过与典型bHLH蛋白APG相互作用参与控制水稻粒长和重量。中国农业科学(英文版)2012;https://doi.org/10.1270/jsbbs.62.133.
张松,安光,李海燕。水稻叶片角度和晶粒大小受OsBUL1转录激活复合物的影响。植物物理学报。2017;173:688-702。https://doi.org/10.1104/pp.16.01653.
陈凯勇,丛b, Wing R, Vrebalov J, Tanksley SD。转录因子调节的改变导致栽培番茄的自交配。科学(80-)。2007; 318:643-5。https://doi.org/10.1126/science.1148428.
白明宇,范敏,吴娥,王志勇。在拟南芥中,三重螺旋-环-螺旋/基本螺旋-环-螺旋级联控制多种激素和环境信号通路下游的细胞伸长。《植物科学》2012;https://doi.org/10.1105/tpc.112.105163.
李勇,魏伟,冯杰,罗华,皮明,刘震,等。利用广泛的Illumina-和smrt -基RNA-seq数据集对野生草莓Fragaria vesca的基因组重新注释。DNA决议2017。https://doi.org/10.1093/dnares/dsx038.
张志刚,张志刚,张志刚,张志刚,等。八倍体草莓基因组的起源和进化。Nat Genet, 2019; 51:541-7。https://doi.org/10.1038/s41588-019-0356-4.
王敏,杨东,马峰,朱敏,石志,苗霞。OsHLH61-OsbHLH96通过调控病原相关基因影响水稻对褐飞虱的防御。水稻(N Y). 2019;12(9)。https://doi.org/10.1186/s12284-019-0267-0.
崔娟,尤超,朱恩,黄强,马红,常峰。DYT1与下游bHLH因子相互作用的反馈调控促进了DYT1核定位和花药发育。植物细胞,2016;28:1078-93。https://doi.org/10.1105/tpc.15.00986.
徐震,刘旭,何霞,徐林,黄勇,邵辉,等。大豆碱性螺旋-环-螺旋转录因子ORG3-like通过增加铁和减少镉从根到芽的吸收和运输来增强镉耐受性。中国植物科学,2017;8:1098。
Csukasi F, Osorio S, Gutierrez JR, Kitamura J, Giavalisco P, Nakajima M,等。草莓花托发育过程中赤霉素的生物合成及信号转导。新植物,2011;191:376-90。
Symons GM, Chua Y-J, Ross JJ, Quittenden LJ, Davies NW, Reid JB。草莓非更年期成熟过程中激素的变化。中国科学(d辑),2012;https://doi.org/10.1093/jxb/ers147.
Quesada MA, Blanco-Portales R, Pose S, Garcia-Gago JA, Jimenez-Bermudez S, Munoz-Serrano A,等。FaPG1基因的反义下调揭示了聚半乳糖醛酸酶在草莓果实软化中的意想不到的核心作用。植物科学学报。2009;30(2):344 - 344。https://doi.org/10.1104/pp.109.138297.
Molina-Hidalgo FJ, Franco AR, Villatoro C, Medina-Puche L, Mercado JA, Hidalgo MA,等。草莓(Fragaria×ananassa)果实特异性鼠李糖半乳糖酸裂解酶1 (FaRGLyase1)基因编码一种参与细胞壁中片层降解的酶。中国科学(d辑),2013;
付旭,程松,张勇,杜波,冯超,周勇,等。采后草莓(Fragaria × ananassa Duch.)香气化合物4种生物合成途径在光温交互作用下的差异响应食品化学,2017;221:356-64。https://doi.org/10.1016/j.foodchem.2016.10.082.
张晓东,张晓东,张晓明,等。利用DNA微阵列鉴定草莓风味生物发生的SAAT基因。《植物科学》2000;12:647。https://doi.org/10.2307/3870992.
Almeida JRM, D 'Amico E, Preuss A, Carbone F, de Vos CHR, Deiml B,等。草莓果实发育过程中参与类黄酮和原花青素生物合成的主要酶和基因的特征(Fragaria ×ananassa)。生物化学学报。2007;465:61-71。https://doi.org/10.1016/j.abb.2007.04.040.
Blanco-Portales R, Medina-Escobar N, López-Ráez JA, González-Reyes JA, Villalba JM, Moyano E,等。草莓肉桂醇脱氢酶基因的克隆、表达及免疫定位模式。钱德勒)。中国科学(d辑),2002;https://doi.org/10.1093/jxb/erf029.
阿尔瓜雷斯I, Osorio S, Hoffmann T, Rambla JL, Medina-Escobar N, Granell A,等。草莓果实瘦果和花托中合成丁香酚的酶具有独特的催化动力学。中国生物医学工程学报,2013;https://doi.org/10.1104/pp.113.224352.
巴恩斯WJ,安德森CT。释放、回收、重建:细胞壁重塑、自降解和植物发育过程中用于新细胞壁生物合成的糖回收。植物学报。2018;11:31-46。https://doi.org/10.1016/j.molp.2017.08.011.
草莓果实的生长和成熟。在:园艺评论。牛津:约翰·威利父子公司;1995.p . 267 - 97。https://doi.org/10.1002/9780470650585.ch8.
Heang D, Sassa H. HLH/bHLH蛋白的拮抗作用与水稻粒长和粒重有关。公共科学图书馆,2012;7:e31325。https://doi.org/10.1371/journal.pone.0031325.
Raab T, López-Ráez JA, Klein D, Caballero JL, Moyano E, Schwab W,等。FaQR是草莓风味化合物4-羟基-2,5-二甲基-3(2H)-呋喃酮生物合成所必需的,编码烯酮氧化还原酶。植物细胞。2006;18:1023-37。https://doi.org/10.1105/tpc.105.039784.
玛拉CD,黄T,爱尔兰VF。拟南芥花同源蛋白APETALA3和PISTILLATA负向调控BANQUO基因和光信号。《植物科学》2010;22:690-702。https://doi.org/10.1105/tpc.109.065946.
郑凯,王勇,王松。拟南芥非dna结合bHLH转录因子多效唑抗性参与ABA和盐应答的调控。植物物理生物化学PPB。2019; 139:239-45。https://doi.org/10.1016/j.plaphy.2019.03.026.
张丽英,白明英,吴娟,朱金勇,王辉,张震,等。拮抗HLH/bHLH转录因子介导油菜素类固醇对水稻和拟南芥细胞伸长和植株发育的调控。植物学报。2009;21:3767-80。https://doi.org/10.1105/tpc.109.070441.
赤霉素与离体番茄根系生长的关系:gib-1突变型与野生型的比较及对ga3和2s, 3s多效唑的响应。中国科学(d辑),2001;https://doi.org/10.1093/jxb/41.6.715.
Barceló M, El-Mansouri I, Mercado JA, Quesada MA, Pliego-Alfaro F.草莓品种chandler的再生和转化。植物组织科学。1998;54:29-36。https://doi.org/10.1023/A:1006031527413.
克里曼RA,贝尔E,鲻鱼JE。脂氧合酶样酶在脱落酸生物合成中的作用。植物物理学报。1992;99:1258-60。https://doi.org/10.1104/pp.99.3.1258.
Hoffmann T, Kalinowski G, Schwab W. rnai诱导草莓果实(Fragaria x ananassa)基因表达的沉默:一种快速的基因功能分析方法。植物J. 2006; 48:818-26。https://doi.org/10.1111/j.1365-313X.2006.02913.x.
杨晓明,杨晓明,杨晓明,等。农杆菌介导植物转化的研究进展。植物科学进展,2002;7:193-5http://www.ncbi.nlm.nih.gov/pubmed/11992820.
刘志强,李志强,李志强,等。一种从香蕉果实中分离高质量rna的方法。植物摩尔生物学报告,2000;18:109-15。
Benítez-Burraco A, Blanco-Portales R, Redondo-Nevado J, Bellido ML, Moyano E, Caballero JL,等。两种成熟草莓的克隆及性状研究。钱德勒)果胶裂解酶基因。中国科学(d辑),2003;
杨晓明,李志强,李志强,等。基于iCycler iQ检测系统的多重相关基因实时RT-PCR表达分析。BioRadiations。107:10-1 2001;http://www.bio-rad.com/LifeScience/pdf/Bulletin_2696.pdf.
Shulaev, Sargent DJ, Crowhurst RN, Mockler TC, Folkerts O, Delcher AL,等。林地草莓(Fragaria vesca)基因组。Nat Genet. 2011; 43:109-16。https://doi.org/10.1038/ng.740.
郝勇,吴娥,崔庚,梁忠,王志勇。HLH和bHLH因子之间的相互作用调节植物的光调节发育。植物学报。2012;5:688-97。https://doi.org/10.1093/mp/sss011.
Agius F, González-Lamothe R, Caballero JL, Muñoz-Blanco J, Botella MA, Valpuesta V.工程通过过表达d -半乳糖醛酸还原酶提高植物维生素C水平。生物技术。2003;21:177-81。https://doi.org/10.1038/nbt777.
马楠,薛娟,李勇,刘旭,戴峰,贾伟,等。Rh-PIP2;1是一个玫瑰水通道蛋白基因,参与乙烯调控花瓣的扩张。植物学报。2008;48:894 - 907。https://doi.org/10.1104/pp.108.120154.
Salentijn EMJ, Aharoni A, Schaart JG, Boone MJ, Krens FA。草莓结实度不同品种的差异基因表达分析。化学工程学报。2003;18:571 - 582。https://doi.org/10.1034/j.1399-3054.2003.00138.x.
Lin-Wang K, Bolitho K, Grafton K, Kortstee A, Karunairetnam S, McGhie TK,等。R2R3 MYB转录因子与调控蔷薇科花青素生物合成途径相关。植物学报。2010;10:50。https://doi.org/10.1186/1471-2229-10-50.
确认
作者感谢Josefa博士Muñoz-Alamillo(植物学、生态学和植物生理学,科尔多瓦大学,西班牙)烟草benthamiana种子和Marten Denekamp博士的pFRN二元载体(分子细胞生物学系,乌得勒支大学,荷兰)。
资金
这项工作得到了西班牙科学部长Innovación (AGL2014-55784-C2-2-R)、西班牙科学部长Educación - Ciencia (AGL2017-86531-C2-2-R)在FPU计划框架内(博士奖学金到MP)的支持,以及西班牙政府Ramon y Cajal计划(BP)内的MINECO (RYC-2014-15111)的支持。资助者在研究设计、数据分析和解释以及手稿写作中没有任何作用,只是提供资金支持。
作者信息
从属关系
贡献
LM-P和FJM-H进行了一些实验并做了一些图形。FJM-R还进行了一些实验,制作了一些图形、表格和补充材料;JAM参与大棚植物的维护;JLC、EM和AR-F有助于微阵列数据的分析和解释;RB-P进行多次实验,制作数字,共同进行工作,合作撰写和修改手稿;JM-B进行了工作,构思了这项研究,并就所获得的结果进行了讨论。所有作者均已阅读并批准稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用
发表同意书
不适用
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
184个bHLH/HLH转录因子的系统发育树。FaPREs分类单元以黑色和灰色书写,分支包含属于16亚群的序列。该树是使用IQTREE网络软件(http://iqtree.cibiv.univie.ac.at/)采用近邻连接法,自举重复1000次。
附加文件2。
本研究分析了182个植物bHLH/HLH序列的亚科分类及其附加信息。
附加文件3。
A.表中包含属于16亚组的非典型HLH序列的附加信息。B. InterProScan数据库预测域的截图(版本5)(http://www.ebi.ac.uk/Tools/pfa/iprscan5).C. bHLH蛋白的序列比对。相同的氨基酸用黑色表示。两个螺旋用黑色箭头表示,循环用灰色线表示。数字表示氨基酸的位置。D. Plant-mPLoc计算机程序预测细胞内蛋白质定位位点结果的截图(http://www.csbio.sjtu.edu.cn/cgi-bin/PlantmPLoc.cgi).
附加文件4。
的表型分析F. × ananassa“钱德勒”体外培养的植物生长在补充激素的N30K培养基中。(A)对照植物(control)和施用赤霉素酸(GA)处理植物的概况3.)和多效唑(PBZ)。qRT-PCR分析FaPRE1,FaPRE2而且FaPRE3在离体草莓叶片(B)、花梗(C)和根(D)中的表达(F. × ananassa“钱德勒”)用GA治疗3.和PBZ。给出了三个独立实验的平均值±标准差。对照,植物在N30K培养基中;遗传算法3.在N30K培养基中添加GA3.100μM;PBZ,在添加多效唑100 μM的N30K培养基中培养。参照样本(对照)的统计显著性由学生的数据决定t以及:*p< 0.05。
附加文件5。
qRT-PCR分析FaPRE1,FaPRE2而且FaPRE3RNAi-在草莓转基因花托中的表达FaPRE1构造。对照:空pFRN载体浸种花托;池1、池2和池3:花托用FaPRE1-pFRN构造。
附加文件6
转基因花托的转录组比较的总微阵列数据FaPRE1-RNAi构建和非转基因对照容器。中所报道的基因ID和相应的注释草莓属vesca基因组数据库(https://www.rosaceae.org/) [73].
附加文件7
所选基因的表达数据FaPRE1通过QRT-PCR和微阵列分析获得的-沉默容器。
附加文件8
显示草莓中下调(A)和上调(B)基因数量的维恩图FaPRE1-RNAi在草莓红花托中表达上调。
附加文件9
草莓中所有基因均下调FaPRE1-RNAi花托(折叠改变RNAi)和草莓红花托(折叠成熟)上调。中所报道的基因ID和相应的注释草莓属vesca基因组数据库(https://www.rosaceae.org/) [73].
附加文件10
草莓中所有基因均上调FaPRE1-RNAi花托(折叠改变RNAi)和下调草莓红花托(折叠成熟)。中所报道的基因ID和相应的注释草莓属vesca基因组数据库(https://www.rosaceae.org/) [73].
附加文件11
一些具有功能特征的非典型HLH转录因子的系统发育树。每对分支的长度表示序列对之间的距离,而树底部的单位表示替换事件的数量。FaPRE1 (KM655802;Fragaria x ananassa);FaPRE2 (XM_004296502;F. x安纳萨);FaPRE3 (XM_004297270;F. x安纳萨);SlStyle2.1 (NM_001247361;茄属植物lycopersicum) [42];SlPRE2 (XP_004233358.1;美国lycopersicum) [34];AtPRE1 (At5g39860;拟南芥) [20.];BNQ3 (NP_190355.2;答:芥) [62];KIDARI (NP_849712;答:芥) [35];ATBS1 (NP_177590;答:芥) [32];AtPRE3 (At1g74500;答:芥) [30.];PGL2 (Os02g0747900;栽培稻) [40];AIF2 (At3g06590;答:芥) [36];AIF3 (At3g17100;答:芥) [36];AIF4 (At1g09250;答:芥) [36];PAR1 (At2g42870;答:芥) [74];PAR2 (At3g58850;答:芥) [74].使用MegAlign (MegAlign 5.00;DNASTAR)。
附加文件12。
本研究中使用的引物序列。弗兰克-威廉姆斯:向前;房车:反向。:上;低:低。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
梅迪纳-普彻,L., Martínez-Rivas, F.J.,莫利纳-伊达尔戈,F.J.et al。一个非典型的HLH转录调控因子在草莓成熟花托中起着新的重要作用。BMC植物生物学19日,586(2019)。https://doi.org/10.1186/s12870-019-2092-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-019-2092-4
关键字
- 典型的通过
- 水果成熟
- PRE1
- 草莓