摘要
背景
NAC(NAM / ATAF / CUC)是已知在木材形成中发挥重大作用的最大植物特异性转录因子(TF)家族之一。作为母体基因调节剂,几种NAC基因可以在木质植物的木材形成期间激活二次壁生物合成。
结果
在本研究中,我们首先在双单倍体的叶、茎和根中筛选了110个差异表达的NAC基因Populus Simonii×p。纳里加通过RNA-SEQ。然后我们鉴定了核靶向基因,NAC15基因,这是110个NAC家族成员中在茎中高度表达的基因之一。再次,我们进行了NAC基因的表达模式分析NAC15基因,观察NAC15通过RT-QPCR,基因在XYLEM中最高度表达。而且,我们转移了NAC15将基因导入烟草,获得12个过表达的转基因株系NAC15基因(TLS)。与含有空载体(CLS)的对照管线相比,在TL中观察到半纤维素,纤维素和木质素的相对较高含量。与CLS相比,它还显示在TLS的秆中染色较深染色。此外,少量木质素和纤维素相关基因的相对表达水平在TL中显着高于CLS中的。
结论
总体结果表明:NAC15该基因在杨树木质部高度表达,可能是在转基因烟草木材形成中发挥重要作用的潜在候选基因。
背景
作为最广泛和环保的天然材料之一,木材通常用于建筑,造纸,运输,化工,军事,航空航天等行业,以及生产各种木制品,如农业工具,家具,手工艺品和乐器。木质生物量也可作为生物能源的可持续和碳中性资源使用[1].对木材的需求总是增加,因为它是工业和能源的成本效益和可再生资源的增加[2].在木材形成过程中,具有次生细胞壁的细胞主要有纤维和管状细胞两种。这两种细胞的形成经历了细胞扩张、次生壁沉积、木质化和程序性细胞死亡(PCD) [3.].了解木材形成过程有助于木材性质和生产,在树生物学和生物技术方面具有显着意义。
作为一个模型树,杨树通常用于了解木本植物中发生的独特过程,包括木材形成[4.那5.].木材形成的分子和遗传机制杨树已通过发育遗传学、基因组学和生物化学方法进行研究[6.].调节木材形成的表达序列标签(EST),激素和基因的鉴定是受欢迎的杨树[7.那8.那9.]例如,从两种杨树中鉴定出的5692个EST中有4%参与了各种细胞壁形成过程,如木质素和纤维素合成[7.].特定的组织特异性转录分析显示,木质素和纤维素生物合成相关基因,转录因子(TFS)和Xyloyesis的其他潜在调节因子受到杨树的严格发育阶段特异性转录调节10.].特别地,诸如养肝响应因子(ARF),III类同源域 - 亮氨酸拉链(HD-ZIPIII),Kanadi(KAN),MYB和NAC等几种TF可能会管理杨树木材形成中的转录调节复杂网络[9.那11.].
NAC家族是已知在木材形成中发挥重要作用的最大的植物特异性TF家族之一[12.].几种NAC基因可以在用作母基因调节剂的木形成过程中激活二次壁生物合成,例如血管相关的NAC结构域基因(盾)和次级壁相关NAC结构域基因(SND)[13.那14.].转录分析表明有七个盾在发育中的维管组织中优先表达的基因拟南芥[15.].他们,VND6和VND7是木质血管分化的关键调节因子。它们调节综合血管形成血管形成的广泛基因的表达[16.那17.].两个NAC域tf,SND1和NST1.(NAC二次生壁增厚促进因子1)在调控二次生壁合成方面具有冗余作用拟南芥[18.].除了NAC基因来自拟南芥,许多与木材相关的NAC域(WND.)基因杨树被识别为木材形成的主调节因素。例如,来自两个NAC基因的过表达Populus Trichocarpa.那PtrWND2B和PtrWND6B,铅粘附纤维素,Xylan和木质素的异位沉积拟南芥通过诱导次级壁相关的TFS和次壁生物合成基因的表达[14.].一个次级壁相关NAC基因的嵌合抑制子杨树(PTSND2.)严重影响转基因木材的形成P. Davidiana×p . bolleana通过下调一些与木材相关的基因[19.].
NAC转录稳压剂在木材形成方面精确地协调了次要壁相关基因的表达,需要细微和空间调节[14.那20.].有289个推定的NAC基因Populus Trichocarpa.其中大多数显示出不同的时间和空间表达式模式[21.那22.].在本研究中,首先,我们在叶片,茎和根部的叶片,茎和根部筛选差异表达的NAC基因Populus Simonii×p。纳里加通过RNA-SEQ。然后我们进行了表情模式分析NAC15RT-qPCR检测不同组织中基因的表达。第三,我们确认了亚细胞定位NAC15通过粒子轰炸基因。此外,我们通过农杆菌介导的方法将基因转化为烟草,并进行了转基因烟草含量过表达的生理学,组织学和分子分析NAC15基因。研究表明了NAC15杨树基因在转基因烟草木材形成中起重要作用。
结果
NAC家族的转录体分析Populus Simonii×p。纳里加
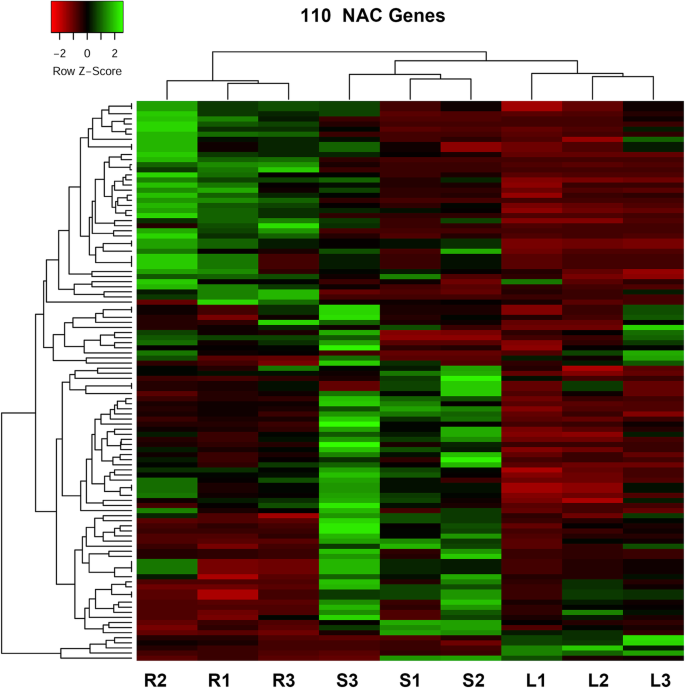
每个样本中每个基因的mRNA丰度被描述为片段每千碱基每百万reads (FPKM)。根、茎、叶中289个NAC成员的FPKM信息Populus Simonii×p。纳里加从RNA-SEQ数据检索(附加文件3.: Excel S1)。RNA-Seq检测到231个NAC基因。根据至少一个组织中FPKM≥4,筛选出231个基因中的126个,计数NAC基因的表达。在126个基因中,叶与茎、根与茎、叶与根的比较对中差异表达基因分别为115、123、118个。多达110个NAC基因在三种组织中有差异表达。110个基因的热图显示,叶片和茎中的表达模式可以聚类在一起,说明基因在两个组织中的表达模式相似(图2)。1).
差异表达的110个NAC基因在三种组织中的热线映射杨树simonii×P.nigra。热线图是由热传达的(http://www.heatmapper.ca/expression/).红色和绿色分别表示低表达和高表达。R1-3、S1-3、L1-3分别表示根、茎、叶的3个生物重复
NAC15的系统发育分析
1257 bp的编码序列NAC15基因来自小叶杨(Potri.001G448400.1)包含一个编码418个氨基酸的ORF。氨基酸序列分析结果表明,杨树NAC15与杨树NAC15的序列相似性分别为86、77、75、77、72、66、66、66、65、65%Salix purpurea.(SapurV1A.0131) s0060.3),里纳斯市政府(30,068.m002591),Manihot Esculenta(manes.02g001600.1),可可树(thecc1eg015621t1),Gossypium raimondii.(Gorai.004G129200.1),碧桃(Prupe.5G131900.1),Malus Domestica.(MDP0000762302),维斯卡草莓(mRNA01881.1-V1.0-杂交),桉树茅(Eucgr.E01053.1),vitis Vinifera(GSVIVT01019670001)分别。多个氨基酸对准表明,上述蛋白质共用了160个氨基酸的高度保守结构域,即NAC结构域,其可以分成A-E子结构域(图。2一种)。具有前10个相同的蛋白质序列的系统发育树表明,来自杨树的NaC15与来自柳树,木薯和蓖麻油植物的蛋白质具有相对高的同源性,同时与野生草莓,桃树和苹果树的同源性相对较低(无花果。2b)。
NAC15蛋白的定位
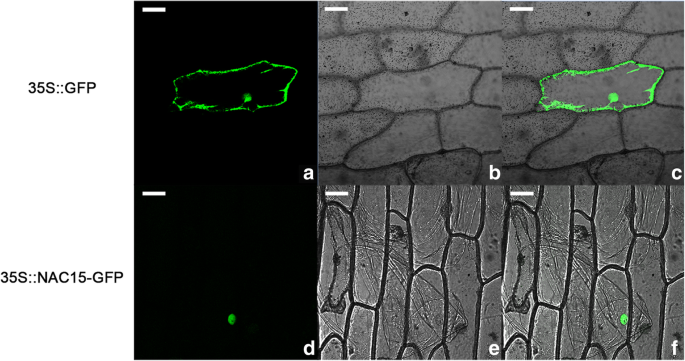
如图所示。3.,在细胞核中检测到NAC15- gfp(绿色荧光蛋白)融合的荧光信号,而在细胞中完全表达对照,表明NAC15蛋白定位于细胞核。将转染nac15 - gfp的洋葱细胞用DAPI染色并在免疫荧光显微镜下观察。DAPI和GFP联合荧光信号在细胞核中一致(附文件)4.:图S1),其精确证明了NAC15的核定位。
表达模式分析NAC15基因
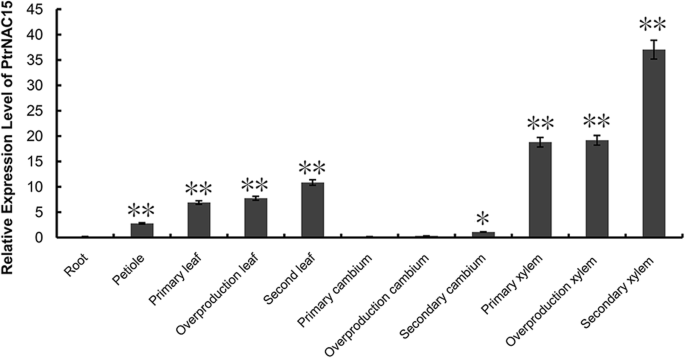
NAC15基因在叶、茎和根中有差异表达,其mRNA丰度在茎中最高,其次是叶和根。相对表达水平NAC15通过RT-QPCR量化不同发育阶段的不同组织中的基因。结果表明表达式模式NAC15基因在不同组织中差异很大,从木质部和叶片到形成层和根的表达量迅速下降,表达量最高的是次生木质部,最低的是根系,这与RNA-Seq结果的趋势一致,最高表达量约为最低表达量的173倍(图。4.).相对表达水平NAC15在发展阶段也显着不同。例如,次级Xylems比杨树的初级和粗颧骨中更高(图。4.).综上所述NAC15基因具有时空特异性,其表达模式可能在木材形成过程中木相关基因的时空调控中起关键作用。
长度烟草过度表达的产生NAC15基因
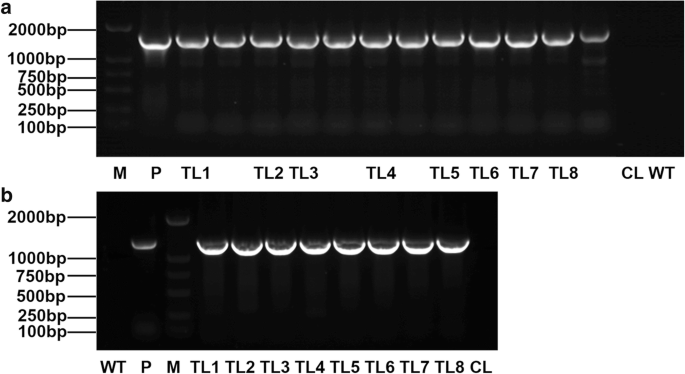
共获得18个转基因烟草株系,包括12个TLs和6个CLs。转基因烟草经PCR和RT-PCR鉴定。如图所示。5.,预期的带在TLS中扩增,但不在CLS和野生型(WT)植物中,这证明了成功的整合NAC15基因在烟草。
利用RT-qPCR分析木质素和纤维素相关基因的表达
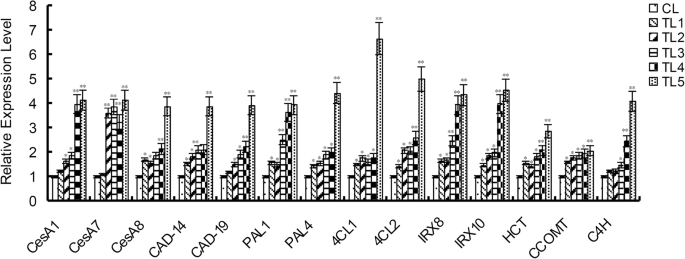
少量木质素和纤维素相关的基因,如塞萨(纤维素合成酶),C4H.(肉桂肉4-羟化酶),计算机辅助设计(肉桂醇脱氢酶),朋友社会学ammonia-lyase),CL.(香豆酸:辅酶A连接酶),克斯(咖啡酰辅酶a o -甲基转移酶)等(附加文件1:植物中的次壁生物合成需要表S1)[23.那24.].拍摄塞萨举个例子,PtoCesA3在原发性细胞壁形成期间高度表达,被证明与生长和木质性质相关Populus tomentosa[25.].PAL1和PAL2被鉴定为与组织特异性木质素合成具有关系[26.].RT-qPCR检测木质素和纤维素相关基因在转基因植株中的相对表达量。结果显示了相对表达水平塞萨那计算机辅助设计那朋友4.CL., 和C4H.在TL中,显着高于CLS中的TL(图。6.).
转基因烟草过表达的组织学分析NAC15基因
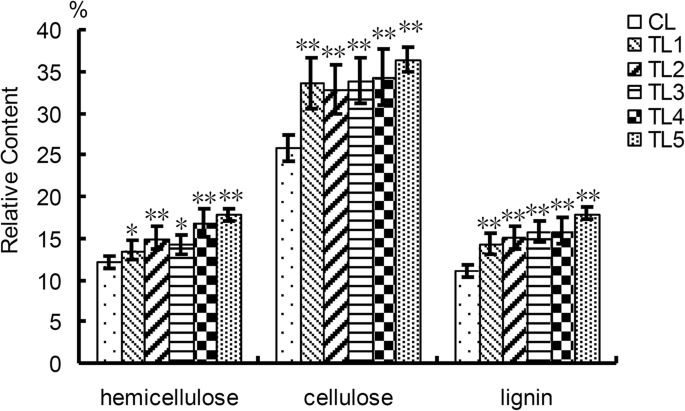
植物二次细胞壁中有三种类型的聚合物(半纤维素,纤维素和木质素)[23.那27.].纤维素是植物中最丰富的多糖,其微纤维可以形成主要承载网络。半纤维素主要由Xylans,葡聚糖和曼纳人组成。木质素影响植物的机械强度,机械强度,刚性和环保[23.那27.].测定了半纤维素、纤维素和木质素的相对含量,比较了TLs和CLs的木材性能。结果表明,TLs中半纤维素、纤维素和木质素的相对含量分别是CLs的1.09-1.38、1.29-1.40和1.31-1.58倍。7.).
盐酸间苯三酚染色
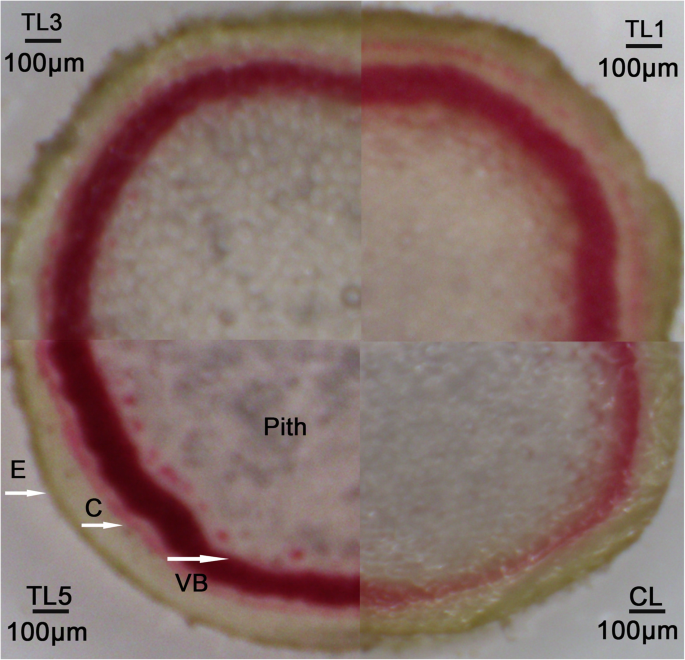
间苯三酚- hcl染色法常用来表征植物木质化[28.].因此,进行甘油酸-HCl-HCl染色以比较研究中TLS和CLS之间的木质性质。结果表明,与CLS相比,血管束中的血管束染色较暗染色(图。8.).它显示了基于TL1,TL3和TL5中的染色的三种水平的茎木质,其符合木质素相关基因的基因素和相对表达水平的相对含量。
讨论
NAC基因是重要的植物特异性TFS,其调节多种生物学过程,如植物发育过程,代谢过程,非生物应激和防御反应[22.那29.].NAC基因在木材形成中的功能来自于聚光灯下。NAC基因优选地在显影木材和区分气囊元素中表达[11.那15.].特别是,盾/望远镜/SNDNAC结构域蛋白的亚颗粒参与二次电池壁形成的转录控制作为主交换机[11.那12.那30.](附加文件5.:图S2)。盾蛋白质控制涉及二次壁形成和PCD的基因的表达望远镜基因在次生壁形成的转录调控中起着关键作用[11.那16.那31.](附加文件5.:图S2)。盾和望远镜基因及其下游基因(包括其他NAC结构域蛋白、MYB蛋白和同源框蛋白)形成了一个转录网络,在木材形成过程中调节次生壁的形成[9.那30.那31.](附加文件5.:图S2)。
在木质植物的木材形成中的NAC基因上,已经对NAC基因进行了相当大的努力。提出了存在的相互交叉调节盾和SND多基因TF家族维持木质部分化的稳态Populus Trichocarpa.[32.].显著地,与木材相关的NAC主开关由杨树(PTRWNDS.)在发育中的木材和纤维素、木聚糖和木质素生物合成的关键调节剂中优先表达[14.](附加文件5.:图S2)。过表达PTRWNDS.导致转基因杨树木材组分异位沉积[1那20.].此外,占主导地位的镇压PTRWNDS.在转基因杨树中引起二级壁增厚的急剧减少[13.那20.].PTRWNDS.可以调节一套下游木相关的TFS和木生物合成基因,以激活整个次壁生物合成程序Populus Trichocarpa.[14.那20.](附加文件5.:图S2)。在研究中,我们鉴定了一种核靶向基因Populus Simonii×p。纳里加那NAC15基因。它是基于RNA-SEQ的茎中高表达的NAC之一。和表达模式分析表明NAC15该基因在木质部表达最高。TLs中半纤维素、纤维素和木质素的相对含量高于CLs。与CLs相比,间苯三酚染色显示TLs韧皮部和木质部的染色更深。一些木质素和纤维素相关基因的相对表达水平显著降低TLs高于CLs。所有结果表明NAC15基因作为一个成员PTRWNDS.对转基因烟草木材形成有重要作用。
众所周知,许多具有高度蛋白质序列相似性的基因可以聚集成同一亚群,并且通常具有相似的功能拟南芥从杨树中分离到16个调控木质部导管和纤维细胞分化的NAC结构域同源物Populus Trichocarpa..其中12人被确认为PTRWND基因(1].NAC15基因被归入亚组(v)SND1基因来自拟南芥,已被证明是调节纤维次级壁合成的关键转录开关[33.那34.].该亚组还包含其他木相关基因,例如NST1.基因和第2号基因,调控次生壁增厚拟南芥[35.].此外,NAC15与?有高度的同源性WND1A基因,在纤维发育过程中调控细胞壁增厚杨树物种 [14.那36.].所有上面也表明了NAC15在植物中,基因与木材的形成有关。
结论
在289个NAC家庭成员中小叶杨,分别在叶和茎、根和茎、叶和根之间的对照对中,共有115、123、118个基因差异表达。多达110个NAC基因在这三种组织中差异表达。其中,NAC15基因在茎中高表达。该基因被证实是针对细胞核的。TLs的半纤维素、纤维素和木质素含量均高于CLs。间苯三酚染色也表明,与CLs相比,TLs的维管束木质素化增加。一些木质素和纤维素相关基因的相对表达量,如塞萨那计算机辅助设计那朋友4.CL., 和C4H.等因子在TLs中显著高于CLs。所有的结果表明NAC15杨树基因在转基因烟草木材形成中起重要作用。
方法
植物材料和文化
Populus Simonii×p。纳里加是我国东北、西北、西南地区广泛种植的一种特殊杂交杨树。野生型的生长枝条Populus Simonii×p。纳里加以东北林业大学实验林1个无系为材料,在室温下进行水培培养,光照/暗循环16/8 h,相对湿度70%,培养2个月。嫩枝上的新根、茎和叶被冷冻在液氮中进行rna测序。采集根、叶柄、叶、木质部和形成层进行表达模式分析。每个组织准备三个生物复制。
野生型的种子尼科尼亚塔哈瓦姆源自东北林业大学树遗传学和育种的国家重点实验室。准备灭菌的烟草外植物那用70% (v/v)乙醇灭菌30 s,然后用1% NaClO溶液(0.05% TWEEN20)灭菌10 min,再用无菌水冲洗5次。将种子置于1/ 2ms (pH 5.8-6.0)固体培养基上,24±2℃,光照/暗循环16/8 h,萌发。将萌发的种子转移到含1/ 2ms固体培养基的组织培养瓶中。用一个月大的无病苗进行基因转化[37.].
RNA-Seq分析NAC表达
总共有九个样本,包括叶、茎和根,分别有三个生物复制品,与干冰一起运到GENEWIZ公司(www.genewiz.com)对于具有Illumina Hi-SEQ平台的RNA分离,mRNA纯化和RNA-SEQ。使用Trimmomatic v0.30清洁原始序列[38.].清洁的读数与Populus Trichocarpa.参考基因组使用STAR 2.4.2a [39.].将每个样品中的每个基因的mRNA丰富定量为FPKM。
289名NAC家族成员的FPKM信息来自RNA-Seq数据(附加文件3:Excel S1)。在至少一种组织中具有FPKM≥4的NAC被施用在三个组织中计数差异表达的NAC基因。不同组织中的折叠变化(Fc)由日志标准化2FPKM比率(40那41.].三组织中差异表达的NAC基因的分层聚类是通过热传播者进行的(http://www.heatmapper.ca/expression/).
RT-qPCR分析
使用植物RNA输出试剂盒(CAT#:71203,中国北京天津)提取总RNA,并使用PrimeScript将其反转录为cDNA™ 带有gDNA橡皮擦的RT试剂盒(中国大连塔卡拉RR047A)。使用SYBR预混料Ex-Taq,通过ABI7500快速实时PCR检测系统进行RT-qPCR实验™II(DRR081A,TaKaRa,大连,中国)。基因的相对表达水平由2计算-△△Ct三个生物复制的方法[42.].杨树的底漆对NAC15基因(NAC15-1),参考基因和木质素和纤维素相关基因(附加档案2:表S2)基于Populus Trichocarpa.v3.1在phytozome12中(https:///phytozome.jgi.doe.gov/pz/portal.html.).
NAC15蛋白的系统发育分析
NACS的氨基酸序列来自Populus Trichocarpa.和其他物种源自PlantTFDB (http://planttfdb.cbi.pku.edu.cn/).通过Clustal W进行保守NAC结构域的多次对准[43.].采用MEGA 6程序Neighbor-Joining法构建NAC蛋白系统发育树[44.].
NAC15的亚细胞定位
编码区NAC15没有停止密码子的基因被克隆到具有特异性引物的PBI121载体中(NAC15-2,附加文件2:表S2),并在CAMV35S启动子的控制下用GFP表达。组合载体35s :: NaC15-GFP和35s :: GFP作为对照通过粒子轰击转移到洋葱表皮细胞中。通过荧光显微镜系统(LSM 700,Zeiss,Germany)检测GFP和DAPI的荧光信号。
转基因烟草过表达的产生NAC15基因
1515bp的转录本序列NAC15在CaMV35S启动子的控制下,利用特异性引物(NAC15-3,附加文件)克隆到pBI121载体中2:表S2)。将重组载体和空载体分别电穿孔转化至农杆菌EHA105。通过PCR和测序证实了EHA105菌株的转化。
烟草转化如下:1)将疾病自由植物的叶子在一个月内切成1cm×1cm的圆盘,浸泡在正变化的EHA105液体培养基(OD 0.3-0.5)中浸泡10分钟;2)将留下盘用灭菌的滤纸干燥,并在1/2 ms固体培养基上以在黑暗中为共同培养两天;3)将留下盘转移到预培养培养基上(含有0.5mg / L 6-Ba,0.05mg / L Naa和100mg / L Kan的1/2 ms固体培养基),直至愈伤组织出现;4)在射击介质上转移健康的愈伤组织(含有0.1mg / L 6-Ba,0.05mg / L Naa和100mg / L kan的1/2 ms固体培养基)直至射击成长;5)将芽转移到生根培养基中(含有0.2mg / L IBA和100mg / L KAN的1/2 ms)直至产生;6)通过PCR和RT-PCR确认转基因烟草幼苗[45.].PCR和RT-PCR的特异性引物对(NAC15-4)在附加文件中列出2:表S2。
二次壁成分的测定
用三种生物重复测量烟草植物中木质素,半纤维素和纤维素的相对含量。Sukjun等人提到了描述的样品制剂,确定程序和计算公式。[46.].
组织学分析
组织学染色在烟草中在生长期,具有三个生物重复。该程序如下:1)固定在FAA溶液中的茎(70%乙醇:冰醋酸:甲醛; 90:5:5,v / v)并将其嵌入冷冻切片介质(OCT; Thermo Scientific,沃尔瑟姆,马);2)将嵌入的茎切成切片并将切片放在载玻片上;3)用甘油氟醇溶液染色2分钟;4)将载玻片浸泡在50%(v / v)HCl中;5)将盖玻片放在载玻片上,用镜片纸擦拭幻灯片;6)用光学光显微镜检查载玻片[47.].
统计分析
本研究所有数据均为3次生物重复的平均值和标准误差。学生t检验用于鉴别TLs和CLs之间的显著差异。统计学意义控制在P. < 0.05.
数据和材料的可用性
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。
缩写
- C4H.:
-
肉桂醛4-羟化酶
- 计算机辅助设计:
-
肉桂醇脱氢酶
- 克斯:
-
咖啡酰基CoA O-甲基转移酶
- 塞萨:
-
纤维素合成酶
- 肤色线:
-
包含空向量的控制线
- CL.:
-
香豆酸:辅酶A连接酶
- ests:
-
表达序列标签
- FPKM:
-
每千克零件百万读的片段读
- 绿色荧光蛋白:
-
绿色荧光蛋白
- 望远镜:
-
NAC二壁增厚
- 朋友:
-
phe氨-Lyase
- PCD:
-
编程细胞死亡
- PTRWNDS.:
-
木材相关的NAC主开关从杨树
- SND:
-
次要壁相关NAC域
- TF:
-
转录因子
- TL:
-
转基因系过表达NAC15创
- 盾:
-
血管相关的NAC域
- WND.:
-
木材相关的NAC域
- WT:
-
野生型
参考文献
- 1。
大谷,西库保,徐斌,Yamaguchi M, Mitsuda N, Goué N, Shi F, Ohme-Takagi M, Demura T. NAC结构域蛋白家族对杨树木材形成的调控作用。植物j . 2011; 67:499 - 512。
- 2。
韩国宏,高俊华,杨树华。木质纤维素原料的优化及其在生物燃料生产和加工中的应用。生物燃料Bioprod Biorefin. 2007; 1:35 5 - 46。
- 3.
Plomion C,Leprovost G,Stokes A.树木的木材形成。植物理性。2001; 127(4):1513-23。
- 4.
泰勒G.杨树:林业拟南芥。我们需要一个模型树吗?Ann Bot。2002; 90(6):681-9。
- 5。
Jansson S,Douglas CJ。杨树:植物生物学模型系统。Annu Rev植物Biol。2007; 58(1):435-58。
- 6。
Mansfield SD Helariutta Y Nieminen K的Groover。木材形成杨树.在:遗传和基因组学杨树.纽约:斯普林克;2010. p。201-24。
- 7。
Sterky F,Regan S,Karlsson J,等。杨树木材形成组织中的基因发现:5692表达序列标签的分析。自然科学学报,1998;95(22):13330–5。
- 8。
在树木形成层活动、木质部发生和血管模式的调控中,激素信号的参与。植物学报2013;32(6):885-98。
- 9。
Ye Zh,钟R.树木形成的分子控制。J Exp Bot。2015; 66(14):4119-31。
- 10。
王志强,王志强,王志强,等。木材形成的转录路线图。中国科学院院刊。2001;98(25):14732-7。
- 11.
Demura T,Fukuda H.在木材形成中的转录调节。趋势植物SCI。2007; 12(2):64-70。
- 12.
王洪志,赵强,陈芳,王美美,Dixon RA。一个次级细胞壁主开关的NAC结构域功能和转录控制。植物j . 2011; 68:1104-14。
- 13。
Grant EH, Fujino T, Beers EP, Brunner AM。NAC结构域转录因子参与调控血管细胞分化的特性拟南芥和杨树.足底。2010;232:337-52。
- 14。
钟荣强,李昌华,叶志华。杨木相关NAC结构域转录因子的功能表征。植物杂志。2010;152:1044-55。
- 15.
等。原木质部和后生木质部导管形成的转录开关。基因Dev。2005;19:1855-60。
- 16。
Yamaguchi M,Gouén,igarashih,Ohtani M,Nakano Y,Mortimer JC等。血管相关的NAC结构域6(VND6),VND7在诱导系统的控制下,有效地诱导向木质部导管分子转分化。植物杂志。2010;153:906-14。
- 17。
管束相关NAC-domain 7直接调控木质部导管形成的一系列基因的表达。植物j . 2011; 66:12。
- 18。
钟锐,理查森艺,叶振华。两个NAC结构域转录因子,SND1和NST1.,在调节纤维二次壁合成方面有冗余作用拟南芥.Planta。2007; 225:1603-11。
- 19。
王HH,唐RJ,Liu H等。嵌合压缩机PTSND2.严重影响转基因的木材形成杨树.树生理。2013; 33(8):878-86。
- 20。
钟雷克,麦卡锡,李,,叶zh。杨树木材形成过程中调节次壁生物合成的转录程序的解剖。植物理性。2011; 157:1452-68。
- 21。
金娟,田芳,杨大成,杨志强,孔亮,罗建军,高光。植物转录因子与调控相互作用的中心枢纽研究进展。核酸Res. 2017;45: D1040-5。
- 22。
胡河,齐克,孔子,孔子D,高Q,周G. NAC结构域转录因子基因家族综合分析Populus Trichocarpa..BMC植物BIOL。2010; 10(1):145。
- 23。
王志强,王志强,王志强,等。一个拟南芥基因调节网络用于二次细胞壁合成。自然。2014; 517:571-5。
- 24。
Boerjan W,Ralph J,Baucher M. Lignin生物合成。Annu Rev植物Biol。2003; 54:519-46。
- 25。
徐海波,田建新,杜琦珍,龚瑞荣,潘伟,张迪强。纤维素合酶基因的单核苷酸多态性(PtoCesA3)与生长和木材特性有关Populus tomentosa.Planta。2014; 240:1269-86。
- 26。
Olsen Km,Lea US,Slimestad R,Verheul M,Lillo C.四分之一的差异表达拟南芥PAL基因;PAL1和PAL2在非生物环境触发的类黄酮合成方面具有功能专门化。植物生理学报。2008;65:1491 - 1492。
- 27。
杨H,闫岚,陈H,李德,郑粉。半纤维素,纤维素和木质素热解的特征。燃料。2007; 86:1781-8。
- 28。
郭h,王y,王l,胡p,王y,jia y等。MYB转录因子基因的表达BplMYB46影响非生物胁迫耐受性和次级电池壁沉积Betula Platyphylla..植物生物技术学报2017;15:107-21。
- 29。
陈志强,陈志强,陈志强,等。NAC转录因子的dna结合特异性和分子功能。植物科学。2005;169:785 - 97。
- 30
Yamaguchi M,Demura T. NAC域蛋白控制次级壁形成的转录调节。植物生物科技。2010; 27(3):237-42。
- 31。
张建军,聂明宁,张建军,等。木材的形成及其控制。植物学报。2014;17:56-63。
- 32。
林YC,Chen H,Li Q等。互惠交叉调节盾和SND多尾TF家庭用于木材形成Populus Trichocarpa.《自然科学学报》2017;114(45):E9722-9。
- 33。
姚WJ,赵k,cheng z,李xy,周br,jiang tb。盐胁迫下杨树的转录体分析及杨树转录因子的过表达NAC57基因在转基因中赋予耐盐性拟南芥.前植物SCI。2018; 9:1121。
- 34。
钟克,魔法,叶zh。SND1,NAC结构域转录因子是纤维中二壁合成的关键调节因子拟南芥.植物细胞。2006; 18:3158-70。
- 35。
Mitsuda N,Seki M,Shinozaki K,Ohme-Takagi M. NAC转录因子NST1.和第2号的拟南芥调节次壁加厚,并且需要脱裂。植物细胞。2005; 17:2993-3006。
- 36。
赵颖,孙军,徐鹏,张瑞丽,李丽。内含子介导的NAC转录因子1B选择性剪接对植物纤维发育过程中细胞壁增厚的调控杨树物种。植物理性。2014; 164:765-76。
- 37。
姚文杰,王磊,周斌,王思杰,李若赫,蒋特伯。杨树转录因子的过度表达ERF76.,基因赋予转基因烟草耐盐性。植物生理学报。2016;198:23。
- 38。
Bolger Am,Lohse M,Usadel B. Trimmomatic:用于Illumina序列数据的灵活修剪器。生物信息学。2014; 30:2114-20。
- 39。
Dobin A,Davis Ca,Schlesinger F,Drenkow J,Zaleski C,JHA S等人。星:超快通用RNA-SEQ对齐器。生物信息学。2013; 29:15-21。
- 40
姚WJ,张XM,赵克,周法网,李华,江TB。多种非生物胁迫下ERF基因家族的表达模式小叶杨.前沿。植物科学。2017;8:181。
- 41
姚文杰,周蓓蓓,张晓明,赵凯,程志华,姜涛。在多种非生物胁迫下转录因子基因的转录组分析Populus simonii×p.nigra.基因。2019; 707:189-97。
- 42
Livak KJ,Schmittgen TD。使用实时定量PCR和2的相对基因表达数据分析 -ΔδCT,方法。方法。2001; 25:402-8。
- 43。
马拉金,黑盾G,布朗NP,陈娜R,麦格蒂根PA,麦克威廉H,等。Clustal W和Clustal X版本2.0。生物信息学。2007;23:2947–8。
- 44。
Tamura K,SteCher G,Peterson D,Filipski A,Kumar S. Mega6:分子进化遗传学分析6.0版。mol Biol Evol。2013; 2013年:2725-9。
- 45。
姚WJ,王SJ,周谢,江TB。转基因杨皮尺过表达内源转录因子ERF76.基因提高了盐度耐受性。树生理。2016; 36:896-908。
- 46。
王志强,王志强,王志强,等。木质纤维素和半纤维素在生物燃料中的应用研究进展。生物质生物能源。2015;83:322-7。
- 47。
木质素的Liljegren S.甘黄油染色。冷泉harb protoc。2010; 5(1):PDB.PROT4954。
致谢
不适用。
资金
这项工作得到了中央大学基础研究经费(2572018BW04)、江苏省自然科学基金(BK2090748)和111项目(B16010)的资助,资助机构没有参与研究设计、数据收集、分析或编写手稿。
作者信息
隶属关系
贡献
TJ和BZ设计了这项研究。WY进行实验,分析数据,撰写手稿。DZ进行实验。JW对手稿进行了修改。RL提供了新的分析工具。所有作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
补充资料
出版商说明
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:
表S1。烟草中木质素和纤维素相关基因的列表。
附加文件2:表S2。
List of primer对。
附加文件3:Excel S1。
差异表达NAC基因在根,茎和叶片中的FPKM信息Populus Simonii×p。nigra。(XLS 53 KB)
附加文件4:图S1。
NAC15的核定位与DAPI染色。一个,DAPI的黑暗场;B,GFP的暗场;C,明亮的场;D,DAPI和GFP的覆盖层。秤杆=20μm。
附加文件5:图S2。
NAC家族转录因子及其下游基因在木材形成中的工作模型。
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
姚伟,张丹,周斌。et al。杨树的过度表达NAC15基因增强转基因烟草中的木材形成。BMC植物BIOL.20,12(2020)。https://doi.org/10.1186/s12870-019-2191-2
已收到:
公认:
发表:
关键字
- Populus Simonii×p。纳里加
- 南汽
- 转录因子
- 木质素
- 木材形成